单核细胞增生李斯特氏菌(Listeria monocytogenes)简称单增李斯特菌,是一种兼性厌氧的革兰氏阳性杆菌,在自然界中广泛存在,对低温、高浓度NaCl和低pH值有一定的耐受能力。该菌主要被发现于肉制品、乳制品和海产品中[1],可造成脑膜炎、败血症等疾病[2],主要易感染孕妇、婴幼儿、老年人等人群[3]。副溶血性弧菌(Vibrio parahaemolyticus)是一种常见的嗜盐性致病菌,主要存在于海洋和河口等含盐环境中,常污染鱼、虾、蟹、贝类等海产品,为革兰氏阴性兼性厌氧菌[4]。该菌具有弧状、杆状、丝状等多种形态,具有荚膜和鞭毛,最适生长温度为37 ℃,最适生长pH值为7.4~8.0,最适盐度为2~4 g/100 mL NaCl[5]。研究表明,沿海地区由食源性致病菌引起的食物中毒多与副溶血性弧菌有关,人感染该菌后通常会出现胃肠炎等疾病[6]。
生物被膜是细菌生长过程中为了对抗外界刺激而形成自我保护的防御结构,主要由胞外多糖、蛋白质、胞外DNA等组成[7-8]。它能够较强地黏附在物体的表面,一般的消毒剂、抗菌剂很难将其清除,具有很强的耐药性[9],可能导致生物被膜在食品加工表面或内部持续残留,从而造成微生物污染。混合生物被膜与单菌生物被膜相比,其中存在的相互作用及其形成机制更为复杂。近年来,研究发现混合生物被膜比单种生物被膜对抗菌剂、抗生素等有着更强抗性及耐药性[10-11],对食品造成更加严重的污染及危害。单增李斯特菌对不利条件的耐受能力较高,而副溶血性弧菌的生物被膜形成能力较强,两者普遍以生物被膜的形式存在于海产品、食品接触表面、食品加工设备中,使得交叉感染的风险以及宿主感染几率增加,对食品的污染范围增大,对食品安全和人体健康造成威胁[12]。迄今为止,单增李斯特菌与其他常见的食源性致病菌形成的混合生物被膜的研究已较为深入,包括金黄色葡萄球菌、大肠杆菌、假单胞菌属等[13-15],而单增李斯特菌和副溶血性弧菌混合生物被膜的形成及菌体相互作用和菌体空间分布等研究较少,有待于深入研究。
副溶血性弧菌是嗜盐菌,本研究探讨不同NaCl浓度下单增李斯特菌与副溶血性弧菌共存并形成混合生物被膜的情况,分析两菌之间的相互作用、生物被膜的形成量、代谢活性和细胞组成,为更好地认识与防控单增李斯特菌和副溶血性弧菌混合生物被膜提供数据参考。
1 材料与方法
1.1 材料与仪器
单增李斯特菌ATCC 19115、副溶血性弧菌ATCC 17802,广东微生物研究所微生物菌种保藏中心,于-80 ℃超低温冰箱中保藏。葡萄糖、NaCl、冰乙酸、KH2PO4、NaH2PO4,广州市化学试剂厂;胰蛋白胨、大豆蛋白胨、牛肉膏、酵母粉、TCBS(thiosulfate citrate bile salts sucrose)培养基、脑心浸液(brian heart infusion,BHI)培养基、PALCAM单增李斯特菌选择性培养基及配套试剂、琼脂糖,广东环凯生物技术有限公司;2,3-双(2-甲氧基-4-硝基-5-磺苯基)-2H-四唑-5-甲酰胺内盐[2,3-Bis(2-methoxy-4-nitro-5-sulfophenyl)-2H-tetrazolium-5-carboxanilide inner salt, XTT钠盐],深圳市益百顺科技有限公司;甲萘醌,上海迈瑞尔化学技术有限公司;结晶紫,上海麦克林生化科技有限公司;Honeycomb2 Sterilized蜂窝模板/生长板,北京百隆兴达生物科技有限公司;Biosharp白鲨细胞爬片,北京兰杰柯科技有限公司。
TSB培养基(g/L):15.0 胰蛋白胨,5.0 大豆蛋白胨,5.0 NaCl,pH调为7.2,121 ℃高温灭菌20 min。
YA28X-4TA1011高压蒸汽灭菌锅,宁波久兴医疗器械有限公司;SW-CJ-1B超净工作台,苏州净化设备有限公司;THZ-100恒温培养摇床,上海一恒科学仪器有限公司;SP-02生化培养箱,广州市绿向生物科技有限公司;SpectraMax i3x连续波长多功能微孔板检测平台,美国Molecular Devices公司;PHS-3E型pH计,上海仪电科学仪器股份有限公司;BioscreenC全自动生长曲线仪,芬兰Oy Growthcurves Ab有限责任公司。
1.2 实验方法
1.2.1 菌株活化
将单增李斯特菌ATCC 19115和副溶血性弧菌ATCC 17802菌株从-80 ℃的超低温冰箱中取出于4 ℃冰箱中解冻。单增李斯特菌ATCC 19115接种于 BHI液体培养基中在适宜条件下培养24 h。副溶血性弧菌ATCC 17802接种于含3 g/100 mL NaCl的TSB培养基中并在适宜条件下培养12 h,菌株经2代活化后使用。
1.2.2 不同NaCl浓度下单独及共培养体系中菌体的生长
用全自动生长曲线仪进行测定。将1.2.1节中的两种菌的菌液在4 ℃、8 000 r/min下离心5 min后,分别收集菌体用含NaCl不同浓度(0.5、1、1.5、2、3、5 g/100 mL)的TSB培养基将菌浓度调至107 CFU/mL,然后将两菌单独或以1∶1的比例转移到96孔培养板中,在37 ℃培养60 h,每隔4 h测量OD600nm值,测量前振荡5 s。测量完成后绘制生长曲线。
1.2.3 探究单增李斯特菌和副溶血性弧菌混合生物被膜的形成
1.2.3.1 生物被膜生物量的测定
按1.2.2节中的方法制备单种和混合菌液,置于96孔板中,于37 ℃下静置孵育6、12、24、36、48、60、72、96 h,以形成生物被膜,阴性对照为TSB培养基。用结晶紫染色法测定生物被膜OD595nm值[12]。
1.2.3.2 混合及单种生物被膜形成时被膜细胞组成分析
在含有圆形细胞爬片的24孔板中制备生物被膜,37 ℃静置培养24、36、48和60 h,用珠涡流法对附着在细胞爬片表面的细菌进行计数,具体操作为将细胞爬片用PBS轻轻冲洗后,置于含无菌生理盐水的离心管中,加入直径为3~4 mm的无菌玻璃珠,涡旋振荡3 min后可从细胞爬片上分离细胞。涡旋后,悬浮液经10倍梯度稀释后,采用微量点样法,取10 μL稀释的菌液点在TCBS选择培养基和PALCAM选择培养基上,37 ℃培养24 h,分别对副溶血性弧菌和单增李斯特菌进行计数。
1.2.3.3 混合及单种生物被膜形成时浮游细胞组成分析
取1.2.3.2节中的培养液1 mL,以10倍进行梯度稀释,采用微量点样法,取10 μL稀释后的菌液点在TCBS选择培养基和PALCAM选择培养基上,37 ℃孵育24 h后,分别对浮游的副溶血性弧菌和单增李斯特菌进行计数。
1.2.3.4 混合及单种生物被膜代谢活性分析
按1.2.3.1节中的方法制备单种和混合生物被膜,参照韩翔鹏等[16]的XTT法测定生物被膜的代谢活性。
1.2.4 不同NaCl浓度下副溶血性弧菌对单增李斯特菌生物被膜形成的抑制作用
采用transwell小室进行区隔实验[17]。向带有transwell小室的24孔细胞培养板下层加入1 mL培养基及50 μL单增李斯特菌菌液。然后放入transwell小室,向小室加入50 μL副溶血性弧菌菌液,对照组加入50 μL TSB培养基。置于37 ℃中培养24 h,培养结束后取出transwell 小室,采用结晶紫染色方法对细胞培养板中单增李斯特菌生物被膜形成能力进行测定。
1.3 数据处理与统计分析
每组实验进行3次重复并取其平均值,采用Graphpad prism 9.5软件作图,利用 SPSS 25.0软件进行显著性差异分析,P<0.05表示具有显著性差异。
2 结果与分析
2.1 不同NaCl浓度下混合及单种培养体系中菌体的生长
由图1-a可知,当单增李斯特菌与副溶血性弧菌在含2 g/100 mL NaCl和3 g/100 mL NaCl的TSB培养基中混合培养时,进入稳定期最快,且在含3 g/100 mL NaCl的TSB培养基中,菌体密度达到了最高。图1-b和图1-c显示,对于副溶血性弧菌而言,3 g/100 mL NaCl的TSB培养基仍是其最适生长培养基,菌体密度最高,且与在BHI培养基中最为接近,而在2 g/100 mL NaCl的TSB培养基中的生长趋势与在3 g/100 mL NaCl的TSB中相似。单增李斯特菌和副溶血性弧菌在3 g/100 mL NaCl下生长较好,其对较高的盐浓度有较好的适应性。
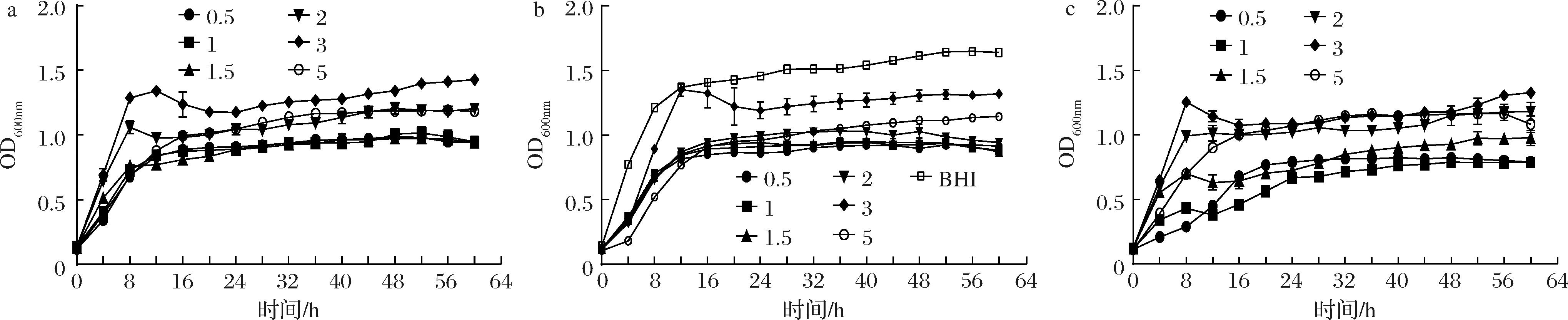
a-混合培养体系;b-单增李斯特菌培养体系;c-副溶血性弧菌培养体系
图1 不同NaCl浓度下混合及单种培养体系的菌体生长曲线
Fig.1 Growth curves of bacteria at different NaCl concentrations in mixed and single culture systems
注:0.5、1、1.5、2、3、5 分别表示NaCl的质量浓度为0.5、1、1.5、2、3、5 g/100 mL(下同)。
2.2 不同NaCl浓度下混合及单种生物被膜形成能力
从图2-a可知,在含2 g/100 mL NaCl和3 g/100 mL NaCl的TSB培养基中混合生物被膜形成能力最强,并在24~36 h达到最大值。图2-b中,单增李斯特菌在含2 g/100 mL NaCl和3 g/100 mL NaCl的TSB培养基中有较强生物被膜形成能力,并且在48 h达到最大值,在其他NaCl浓度下,达到最大值所需时间较长。图2-c可知,副溶血性弧菌在含2 g/100 mL NaCl和3 g/100 mL NaCl的TSB培养基中生物被膜形成能力较强,除了在5 g/100 mL NaCl的TSB培养基中,各NaCl浓度下形成的生物被膜生物量均在48 h达到最大值,而在5 g/100 mL NaCl的TSB培养基中,能够快速形成生物被膜,但其菌体很快恢复了浮游态。总体而言,混合培养体系的生物被膜形成能力强于单增李斯特菌,与副溶血性弧菌相当,且混合生物被膜达到成熟的时间也较短,表明在混合培养体系中生物被膜形成能力增强,可能两菌存在一定的协同相互作用[18]。
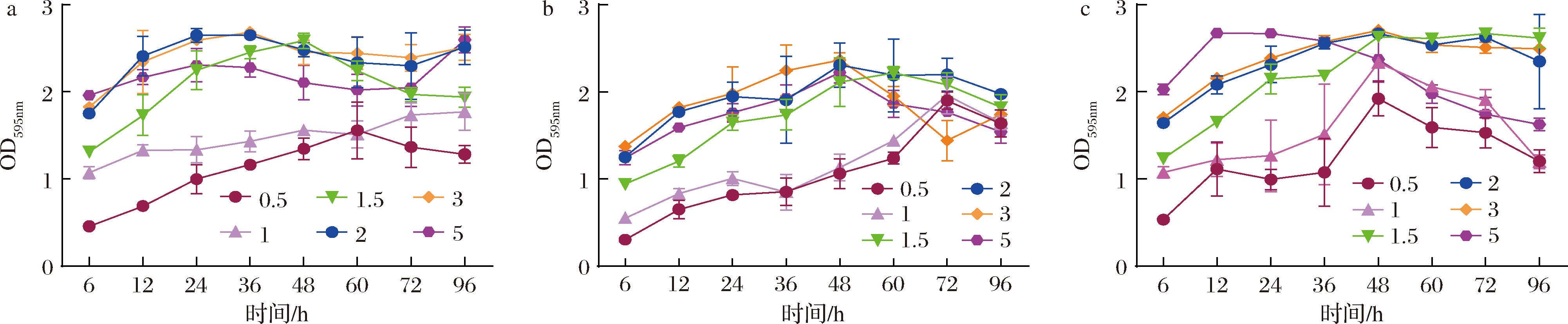
a-混合生物被膜;b-单增李斯特菌生物被膜;c-副溶血性弧菌生物被膜
图2 不同NaCl浓度下混合及单种生物被膜的生物量
Fig.2 Biomass of mixed and single biofilms formed at different NaCl concentrations
2.3 不同NaCl浓度下混合及单种生物被膜中被膜细胞数的变化
由图3可知,在单增李斯特菌和副溶血性弧菌共培养体系中,单增李斯特菌的被膜细胞数在绝大部分阶段均比单独培养低,而副溶血性弧菌除了在0.5 g/100 mL NaCl浓度下,在混合培养的绝大部分阶段其被膜细胞数均比单独培养高。可能是在0.5 g/100 mL NaCl浓度下,更有利于单增李斯特菌生物被膜形成,对副溶血性弧菌生物被膜的形成有抑制作用;而在其他NaCl浓度下,因为副溶血性弧菌的存在,单增李斯特菌生物被膜形成受到一定程度的抑制。各NaCl浓度下形成的混合生物被膜均在培养36 h时有最大被膜菌体量,而1.5 g/100 mL和2 g/100 mL NaCl的TSB培养基中生物被膜菌体量高于其他NaCl浓度。在1 g/100 mL、1.5 g/100 mL和2 g/100 mL NaCl的TSB培养基中孵育24~48 h的混合生物被膜中副溶血性弧菌细胞数有明显升高的趋势,其中培养36 h时,副溶血性弧菌在混合生物被膜中的细胞数高于单菌生物被膜中的细胞数。但是在培养60 h时,出现了副溶血性弧菌数量显著下降的情况。这可能是在混合体系中单增李斯特菌的存在对副溶血性弧菌生物被膜的形成具有促进作用,并在1 g/100 mL、1.5 g/100 mL、2 g/100 mL NaCl时其促进作用最强。总体而言,在 0.5 g/100 mL NaCl的TSB条件下培养形成的混合生物被膜以单增李斯特菌为主;但在含有1~5 g/100 mL NaCl的混合培养体系中,副溶血性弧菌占优势,并对单增李斯特菌生物被膜的形成具有一定的抑制作用,这与陈萍[19]的研究结果一致;但单增李斯特菌的存在促进副溶血性弧菌生物被膜形成,整体上混合生物被膜形成量增多。
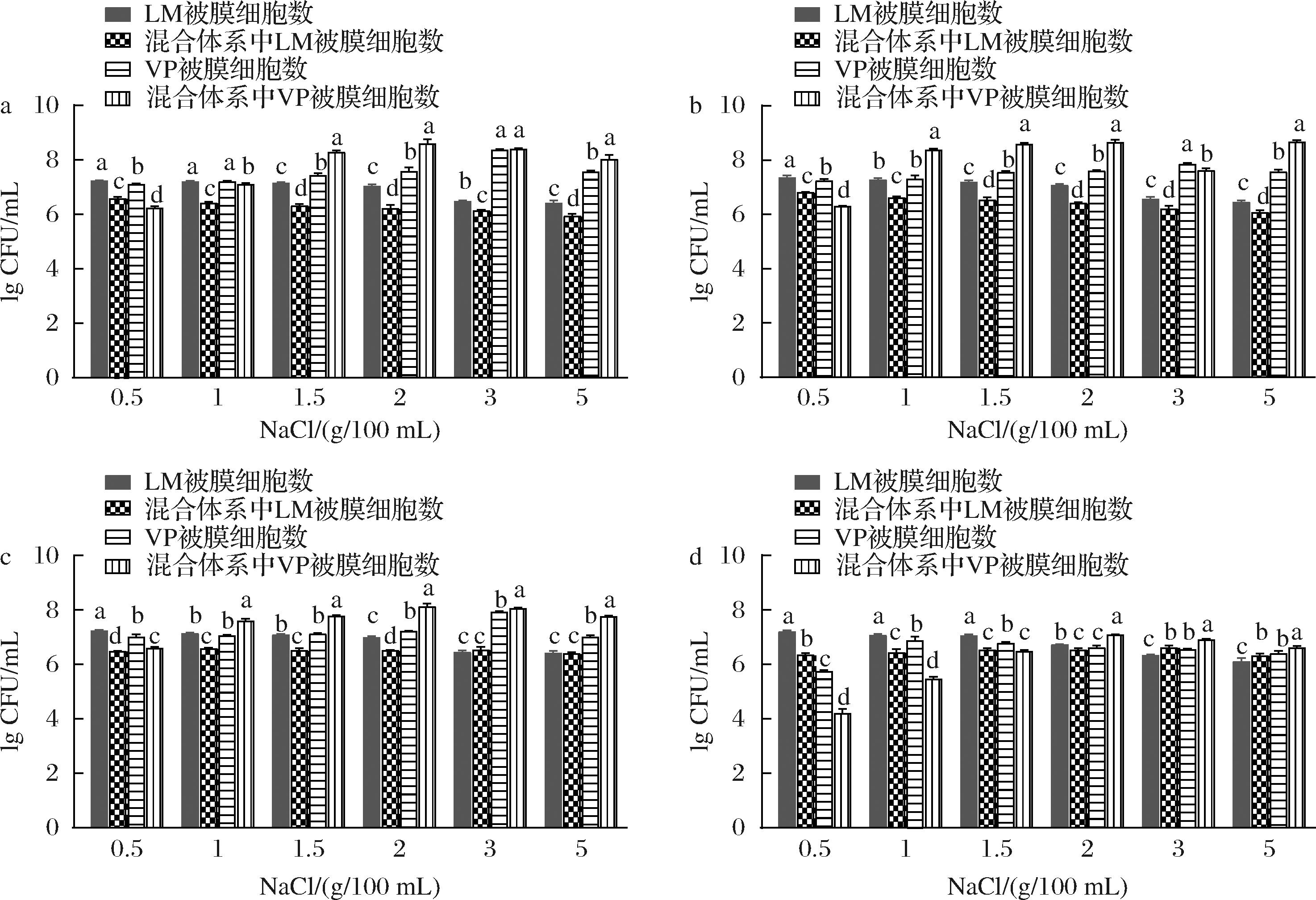
a-培养24 h;b-培养36 h;c-培养48 h;d-培养60 h
图3 不同NaCl浓度下混合及单种生物被膜中被膜细胞数的变化
Fig.3 Changes in the number of biofilm cells in mixed and single biofilms cultured at different NaCl concentrations
注:不同小写字母表示组内有显著性差异(P<0.05),LM为单增李斯特菌,VP为副溶血性弧菌,(下同)。
2.4 不同NaCl浓度下混合及单种生物被膜形成时浮游细胞数的变化
由图4可得,单增李斯特菌的浮游细胞生长情况与图3中被膜细胞一致,其数量由于副溶血性弧菌的存在而受到抑制。在各NaCl浓度的培养体系中,单增李斯特菌菌数均少于副溶血性弧菌。在1~5 g/100 mL NaCl浓度下,培养24至48 h,混合培养体系中副溶血性弧菌浮游菌数均高于单菌生物被膜时的浮游菌数,说明在该浓度范围下,单增李斯特菌对副溶血性弧菌生长繁殖以及生物被膜形成具有促进作用。
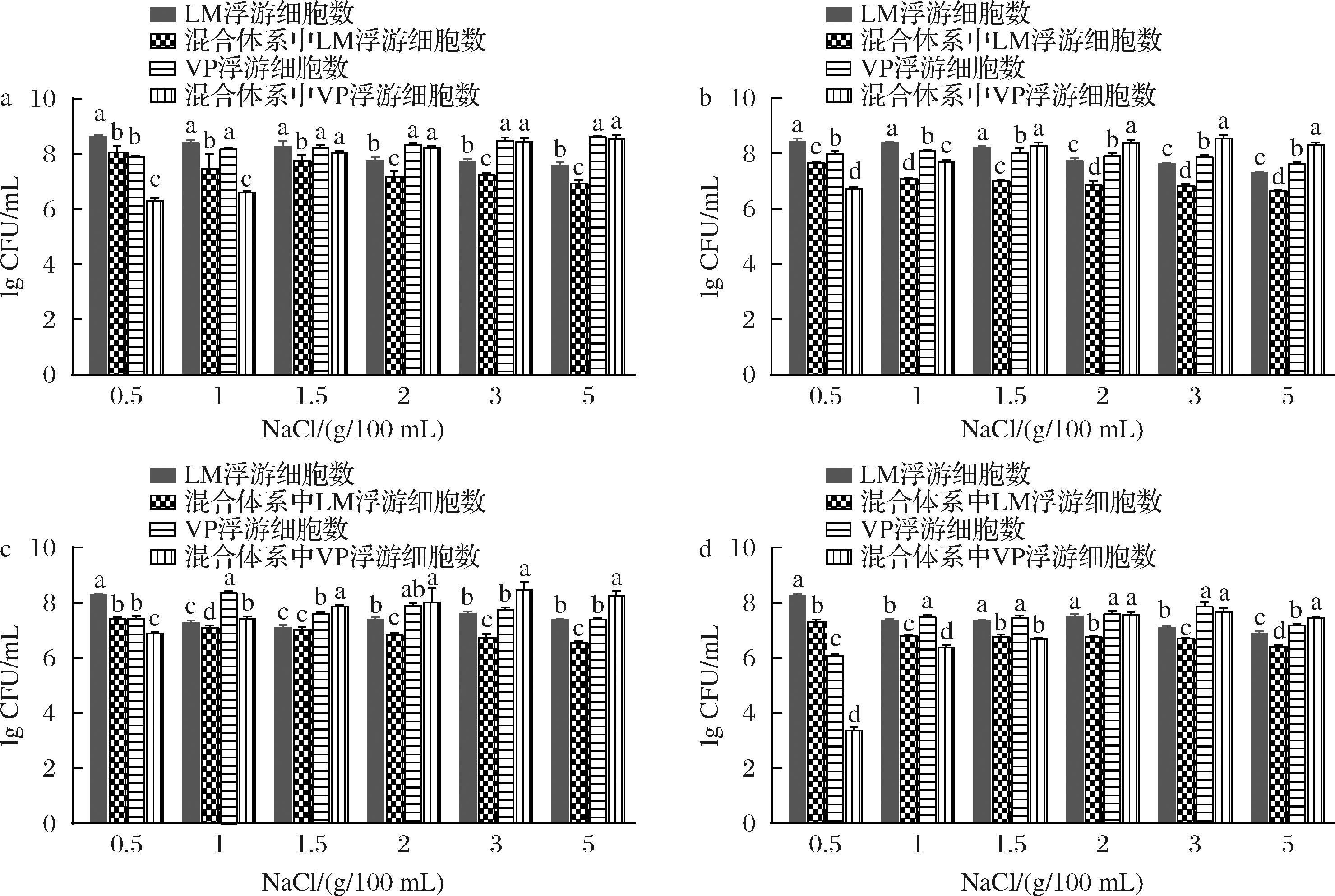
a-培养24 h;b-培养36 h;c-培养48 h;d-培养60 h
图4 不同NaCl浓度下混合及单种生物被膜中浮游细胞数的变化
Fig.4 Changes in the number of free cells in mixed and single biofilms cultured at different NaCl concentrations

a-培养12 h;b-培养24 h;c-培养36 h;d-培养48 h
图5 不同NaCl浓度下混合及单种生物被膜代谢活性的变化
Fig.5 Changes in metabolic activities of mixed and single biofilms formed at different NaCl concentrations
2.5 不同NaCl 浓度下混合及单种生物被膜活性分析
由图5可得,在5 g/100 mL NaCl浓度下,单种和混合生物被膜的代谢活性都低于其他NaCl浓度,这可能是因为XTT还原法检测的代谢活性不能反映复杂体系中单个细胞的代谢强度[20],且培养基中NaCl浓度过高抑制了菌体的生长繁殖,使菌体数量低于其他浓度,以致无法检测到较高的代谢活性。在其他NaCl浓度条件下单增李斯特菌的单菌生物被膜代谢活性均略高于混合生物被膜,而副溶血性弧菌除了在NaCl浓度为3 g/100 mL时,在其他NaCl浓度条件下单菌生物被膜的代谢活性均低于混合生物被膜,进一步表明了单增李斯特菌对副溶血性弧菌生长代谢具有促进作用,而副溶血性弧菌能抑制单增李斯特菌的生长繁殖。在36 h时,各盐度下混合生物被膜的代谢活性最高,且1.5 g/100 mL NaCl浓度时生物被膜代谢活性最高。
2.6 不同NaCl浓度下副溶血性弧菌对单增李斯特菌生物被膜形成的抑制作用
由图6可知,在与副溶血性弧菌区隔培养时,单增李斯特菌的生物被膜形成能力明显降低,但这种抑制作用随着盐度的升高而逐渐减弱,且NaCl浓度为1.5 g/100 mL时,单增李斯特菌受到的抑制作用最强,这说明单增李斯特菌与副溶血性弧菌共培养时,不仅存在营养、空间等物理竞争,也可能存在种间分子信号的交流,副溶血性弧菌的存在抑制了单增李斯特菌生物被膜形成。过高的盐浓度会抑制细菌的生长、繁殖和代谢,使混合菌的数量减少,代谢变慢,从而可能降低分子信号的交流[21]。
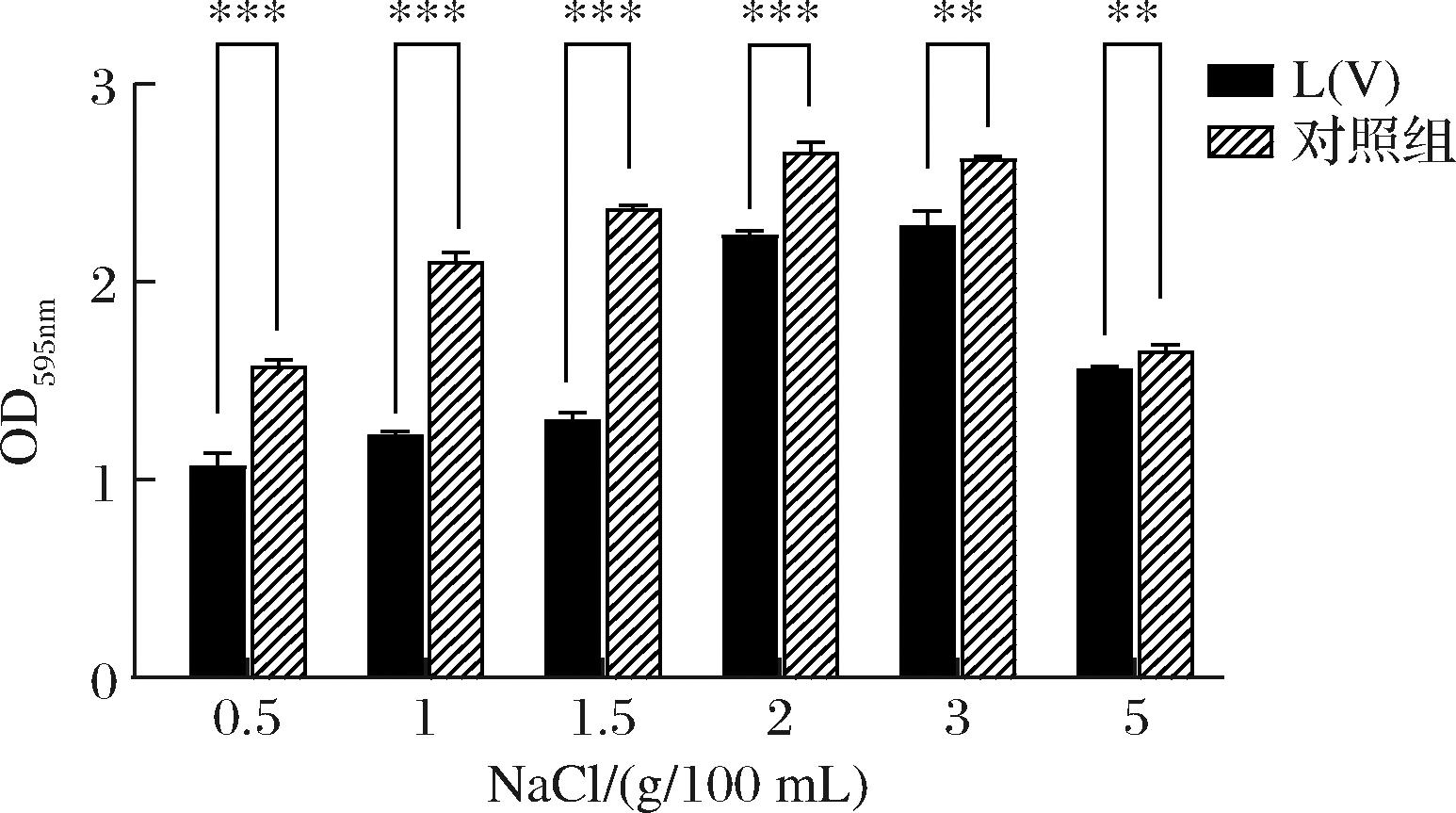
图6 区隔培养24 h后副溶血性弧菌对单增李斯特菌生物被膜形成的抑制作用
Fig.6 Inhibition of Vibrio parahaemolyticus on biofilm formation of Listeria monocytogenes after 24 h interval culture
注:L(V):与副溶血性弧菌区隔培养时单增李斯特菌生物被膜;Control:单独培养时单增李斯特菌生物被膜; ***P<0.001,**P<0.01。
3 讨论与结论
生物被膜的形成增强了细菌对环境胁迫因素的抵抗力,从而导致食品加工设备受损、食品更容易腐败变质等食品安全隐患,尤其是在混合生物被膜中[22]。尽管混合物种生物被膜是食品工业中的主要污染源,但对生物被膜的了解大都是对单种生物被膜的研究[23],在未来需要针对混合生物被膜进行进一步研究。混合生物被膜相比于单种生物被膜,微生物生长环境更加复杂,不同微生物群落之间存在着复杂的相互作用,使其更能够抵抗外界环境的刺激。单增李斯特菌作为重要的食源性致病菌,其与伴生细菌所形成的混合生物被膜存在于食品加工的不同环节,在这种混合生长体系中,细菌之间的相互作用,可能是竞争性的,也可能是协同性的,从而影响混合生物被膜的结构和功能等特性[24]。充分了解混合生物被膜形成规律及相互作用,将有利于更好地开发防控生物被膜污染的新方式。
本文对不同NaCl浓度下单增李斯特菌和副溶血性弧菌混合生物被膜进行研究,初步探究混合生物被膜中两菌的相互作用,结果表明两株菌在混合培养时比单独培养时生物被膜形成能力更强,达到成熟期的时间更短;并且混合体系中占据主导地位的菌株在不同NaCl浓度下有所不同;在NaCl 1.5 g/100 mL时,混合生物被膜有较高的生物量,副溶血性弧菌对单增李斯特菌生物被膜形成的抑制作用最强,同时单增李斯特菌对副溶血性弧菌生物被膜形成的促进作用也最强,混合生物被膜具有较高的代谢活性。
本文初探了不同NaCl浓度下单增李斯特菌和副溶血性弧菌混合生物被膜的形成规律,为了解单增李斯特菌和副溶血性弧菌混合生物被膜的形成提供了参考资料,也为后续控制混合生物被膜提供了理论依据。但混合生物被膜形成机制尚需进一步研究,后续可从基因水平等方面对混合生物被膜开展更深层次的研究。
[1] 梁馨文, 刘振杰, 张菊梅, 等.高效噬菌体防控食品源单增李斯特菌的研究进展[J].现代食品科技, 2024, 40(1):304-311.
LIANG X W, LIU Z J, ZHANG J M, et al.Research advances in the efficient prevention and control of foodborne Listeria monocytogenes by bacteriophages[J].Modern Food Science &Technology, 2024, 40(1):304-311.
[2] 王伶, 唐宇宏, 赵清, 等. 三文鱼燃气烤制过程单增李斯特菌失活数值模拟[J]. 中国食品学报, 2024, 24(4):211-222.
WANG L, TANG Y H, ZHAO Q, et al. Numerical simulation of lethality of Listeria monocytogenes during gas grilling of salmon[J]. Journal of Chinese Institute of Food Science and Technology, 2024, 24(4):211-222.
[3] MOHAN V, CRUZ C D, VAN VLIET A H M, et al.Genomic diversity of Listeria monocytogenes isolates from seafood, horticulture and factory environments in New Zealand[J].International Journal of Food Microbiology, 2021, 347:109166.
[4] 张俊鹏, 刘文婷, 石甜, 等.一株副溶血弧菌噬菌体生物学特性、全基因组特征及其在食品中的应用[J].食品工业科技, 2024, 45(1):137-144.
ZHANG J P, LIU W T, SHI T, et al.Biological characteristics, genome-wide characteristics of A bacteriophage of Vibrio parahaemolyticus and its application in food[J].Science and Technology of Food Industry, 2024, 45(1):137-144.
[5] 高璐, 欧阳敏, 张辉, 等.胁迫生长条件下副溶血性弧菌的生物特性分析[J].食品科学, 2018, 39(6):177-182.
GAO L, OUYANG M, ZHANG H, et al.Biological characteristics of Vibrio parahaemolyticus during growth in adverse environment[J].Food Science, 2018, 39(6):177-182.
[6] YANG C, ZHANG X, FAN H, et al.Genetic diversity, virulence factors and farm-to-table spread pattern of Vibrio parahaemolyticus food-associated isolates[J].Food Microbiology, 2019, 84:103270.
[7] 程传松, 闫晓彤, 李长城, 等.食品接触表面食源性致病菌生物膜形成及控制研究进展[J].包装工程, 2021, 42(13):1-8.
CHENG C S, YAN X T, LI C C, et al.Research progress in biofilm formation and control of foodborne pathogens on food contact surfaces[J].Packaging Engineering, 2021, 42(13):1-8.
[8] 胡丽丽, 董庆利, 夏阳, 等.单增李斯特菌生物膜形成及其调控机制研究进展[J].食品与发酵工业, 2021, 47(8):276-282.
HU L L, DONG Q L, XIA Y, et al.Advances on the formation and regulation mechanism of Listeria monocytogenes biofilm[J].Food and Fermentation Industries, 2021, 47(8):276-282.
[9] 马悦, 吴梦洁, 李卓思, 等.食品接触表面生物被膜形成机制及防控方法研究进展[J].食品科学, 2023, 44(7):276-285.
MA Y, WU M J, LI Z S, et al.Formation mechanism and control strategies of biofilm on food contact surfaces[J].Food Science, 2023, 44(7):276-285.
[10] ZHANG H F, PANG X Y, SECK H L, et al.Low-energy X-ray inactivation of Listeria monocytogenes in mono-/co-culture biofilms with Pseudomonas fluorescens on food contact surfaces[J].Food Microbiology, 2021, 100:103841.
[11] 王思亓, 梁晓云, 张晨, 等.葡萄柚籽提取物及其纳米乳对大肠杆菌和金黄色葡萄球菌生物菌膜的抑制作用[J].食品科学, 2023, 44(3):22-30.
WANG S Q, LIANG X Y, ZHANG C, et al.Inhibitory effects of grapefruit seed extract and its nanoemulsion on biofilm formation of Escherichia coli and Staphylococcus aureus[J].Food Science, 2023, 44(3):22-30.
[12] CHEN P, WANG J J, HONG B, et al.Characterization of mixed-species biofilm formed by Vibrio parahaemolyticus and Listeria monocytogenes[J].Frontiers in Microbiology, 2019, 10:2543.
[13] OXARAN V, DITTMANN K K, LEE S H I, et al.Behavior of foodborne pathogens Listeria monocytogenes and Staphylococcus aureus in mixed-species biofilms exposed to biocides[J].Applied and Environmental Microbiology, 2018, 84(24):e02038-18.
[14] PUGA C H, ORGAZ B, SANJOSE C.Listeria monocytogenes impact on mature or old Pseudomonas fluorescens biofilms during growth at 4 and 20 ℃[J].Frontiers in Microbiology, 2016, 7:134.
[15] QUAN Y R, KIM H Y, SHIN I S.Bactericidal activity of strong acidic hypochlorous water against Escherichia coli O157∶H7 and Listeria monocytogenes in biofilms attached to stainless steel[J].Food Science and Biotechnology, 2017, 26(3):841-846.
[16] 韩翔鹏, 何美珊, 吴金松, 等.薰衣草精油对不同温度下形成的副溶血弧菌成熟生物被膜的清除作用[J].食品与发酵工业, 2022, 48(14):68-74.
HAN X P, HE M S, WU J S, et al.The elimination effects of lavender essential oil on Vibrio parahaemolyticus biofilms formed under different temperatures[J].Food and Fermentation Industries,2022,48(14):68-74.
[17] STANDAR K, KREIKEMEYER B, REDANZ S, et al.Setup of an in vitro test system for basic studies on biofilm behavior of mixed-species cultures with dental and periodontal pathogens[J].PLoS One, 2010, 5(10):e13135.
[18] 檀利军, 王敬敬, 彭知云, 等.食品工业中混合菌生物被膜的形成、相互作用与新型控制策略[J].食品科学, 2022, 43(19):285-294.
TAN L J, WANG J J, PENG Z Y, et al.Formation, interaction and novel control strategies of mixed-species biofilm in the food industry[J].Food Science, 2022, 43(19):285-294.
[19] 陈萍. 副溶血性弧菌-单增李斯特菌共培养下混合生物被膜形成及种间关系的研究[D].上海:上海海洋大学, 2021.
CHEN P.Mixed biofilm formation and the interspecies relationship between Vibrio parahaemolyticus and Listeria monocytogenes[D].Shanghai:Shanghai Ocean University, 2021.
[20] WANG S G, YU H T, WICKLIFFE J K.Limitation of the MTT and XTT assays for measuring cell viability due to superoxide formation induced by nano-scale TiO2[J].Toxicology in Vitro, 2011, 25(8):2147-2151.
[21] 朱耀磊, 郑玉茹, 张昕昕, 等.盐度对腐败嗜水气单胞菌YCR17腐败特性的影响[J].食品工业, 2023, 44(7):137-140.
ZHU Y L, ZHENG Y R, ZHANG X X, et al.Effect of salinities on spoilage characteristics of Aeromonas hydrophila YCR17 isolated from spoiled yellow river carp[J].Food Industry, 2023, 44(7):137-140.
[22] RAO Y F, SHANG W L, YANG Y, et al.Fighting mixed-species microbial biofilms with cold atmospheric plasma[J].Frontiers in Microbiology, 2020, 11:1000.
[23] GALIÉ S, GARC A-GUTIÉRREZ C, MIGUÉLEZ E M, et al.Biofilms in the food industry:Health aspects and control methods[J].Frontiers in Microbiology, 2018, 9:898.
A-GUTIÉRREZ C, MIGUÉLEZ E M, et al.Biofilms in the food industry:Health aspects and control methods[J].Frontiers in Microbiology, 2018, 9:898.
[24] YAO S J, HAO L Y, ZHOU R Q, et al.Multispecies biofilms in fermentation:Biofilm formation, microbial interactions, and communication[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(4):3346-3375.