正畸是改善牙齿排列和咬合关系的牙科治疗方法[1],但正畸过程中可能伴随着正畸诱导性骨吸收的发生[2]。这种过度的骨吸收不仅影响治疗效果[3],还影响到患者口腔健康和功能[4]。中间普雷沃氏菌(Prevotella intermedia)作为一种常见的口腔有害菌,已被证实能够加剧正畸患者的牙槽骨过度骨吸收[5-7]。P.intermedia能够通过产生的脂多糖诱导免疫细胞分泌炎症介质及金属蛋白酶进而损伤牙周组织,同时还能通过促进牙菌斑的形成,增加其他有害细菌的积聚,从而加剧牙槽骨的破坏。在正畸治疗中,牙齿移动伴随着牙槽骨的重建过程,而P.intermedia会使这一过程失衡,过量的炎症介质及金属蛋白酶会诱导OPG/RANKL/RANK骨代谢通路失衡,导致骨吸收过度,影响正畸效果,并可能增加治疗后的复发风险。目前,控制P.intermedia的方法主要包括机械性洁治和使用抗菌药物,如漱口水和局部抗生素。然而,这些方法可能存在不足,例如,机械性洁治可能无法彻底清除细菌,而长期使用抗生素可能导致耐药性的发展。此外,针对正畸诱导性骨吸收,临床上主要是通过减轻牙周膜受力[8]和延长治疗周期来控制[9],上述方法不仅延长了治疗时间,还可能增加患牙周病的风险[10]。目前的研究发现淫羊藿苷[11]、大豆苷元[12]等植化提取物可以显著提高OPG/RANKL/RANK通路中OPG和RANKL的比例水平,可以缓解正畸牙槽骨骨吸收。因此,抑制P.intermedia的生长和在口腔的黏附,同时针对性调控患者骨代谢平衡以预防骨吸收的发生,对于正畸患者具有重要意义。
植物乳植杆菌CCFM8724是本实验室于健康人粪便中分离出来的1株益生菌,研究发现其在体外能抑制致龋菌混合生物膜,动物实验中亦能显著降低大鼠口腔龋齿评分[13],该菌抑制生物膜生成的有效成分为环肽类物质[14],临床试验结果亦显示其可显著降低龋齿儿童口腔中的致龋菌含量,并改善口腔菌群的组成[15]。为拓展植物乳植杆菌CCFM8724的益生功能范围,本研究首先通过结晶紫法评估植物乳植杆菌CCFM8724抑制P.intermedia生物膜形成的效果,随后通过动物模型进一步探究该菌株在体内抑制P.intermedia定植及调控OPG和RANKL比例水平的能力,并通过病理组织学及牙槽骨微观结构验证植物乳植杆菌CCFM8724缓解正畸诱导性骨吸收的应用效果。研究结果将进一步挖掘植物乳植杆菌CCFM8724在口腔健康领域的应用潜力,特别是在正畸治疗中牙槽骨保护的潜在价值。
1 材料与方法
1.1 材料与仪器
1.1.1 实验菌株及材料
植物乳植杆菌CCFM8724及中间普雷沃氏菌ATCC25611,保藏于江南大学食品生物技术菌种保藏中心;苏木素-伊红(H&E)高清恒染试剂盒、TRAP染液套装、返蓝液、分化液、苏木素染液,Service bio公司;大鼠白介素-1β(interleukin-1 beta,IL-1β)、白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)、基质金属蛋白酶-8(matrix metalloproteinase-8,MMP-8)、髓过氧化物酶(myeloperoxidase,MPO)ELISA试剂盒,南京森贝伽生物科技有限公司。
1.1.2 仪器与设备
SCIENTZ-48高通量组织破碎仪,新芝生物科技股份有限公司;Quantum GX Micro-CT活体成像系统,美国Perkinelmer公司;Pannoramic DESK数字切片扫描仪,3DHISTCH公司。
1.2 植物乳植杆菌CCFM8724对P.intermedia生物膜抑制率的测定
参照WAKABAYSSHI等[16]的方法,将植物乳植杆菌CCFM8724在MRS培养基中37 ℃培养24 h,离心取上清液,并通过0.22 μm的滤膜过滤。P.intermedia使用BHI培养基于37 ℃厌氧培养24 h,离心收集菌泥,用无菌PBS溶液重悬至1×109 CFU/mL。
在96孔板中每孔先加入120 μL浓度为1×109 CFU/mL的P.intermedia菌悬液,随后加入80 μL过滤除菌后的植物乳植杆菌CCFM8724发酵上清液,37 ℃下厌氧培养48 h。使用空白MRS培养基作为对照。培养结束后,每孔用PBS洗涤2次,随后加入100 μL体积分数为99%的甲醇固定15 min,除去甲醇并在室温下风干10 min。待生物膜干燥后,向每孔添加100 μL的体积分数为0.1%结晶紫溶液染色40 min,再次用PBS溶液洗涤。加入100 μL的体积分数95%乙醇溶液使染色物质溶解,并在振荡器上振荡30 min,测定OD600值以评估生物膜的形成[16]。
1.3 动物实验方法
18只7周龄SPF级WISTAR雄性大鼠购于北京维通利华实验动物技术有限公司,饲养于室温(23±2) ℃、湿度(50±10)%、12 h明暗交替的循环环境。本实验已获无锡血吸虫病防治研究所动物伦理委员会批准,伦理编号为IACUC-JIPD-2023-141。
1.3.1 菌株制备
植物乳植杆菌CCFM8724活化3代后,将其发酵液于4 ℃,7 000 r/min离心20 min,收集菌泥,用无菌PBS溶液清洗2次后,再次离心收集菌泥。随后使用100 g/L的脱脂牛奶溶液重悬菌泥并冻干。实验前检测冻干菌粉的活菌数,并用无菌PBS溶液复溶至菌悬液浓度为1×109 CFU/mL。
P.intermedia在BHI血琼脂固体培养基上划线培养3代,挑取单菌落接种至BHI液体培养基中,在37 ℃厌氧培养48 h,计数后用无菌PBS溶液调整菌悬液浓度为1×109 CFU/mL。
1.3.2 动物实验设计
实验开始前,将18只大鼠随机分为3组(n=6只/组),包括空白组、模型组(正畸模型+P.intermedia菌)、植物乳植杆菌CCFM8724组(正畸模型+P.intermedia菌+植物乳植杆菌CCFM8724)。
所有大鼠适应1周后开始实验,实验周期共14 d。实验开始时,除空白组外,植物乳植杆菌其余组大鼠均参照WANG等[17]的方法,采用镍钛弹簧在大鼠右侧上颌第一磨牙与上颌中切牙之间施加50 g牵引力,建立大鼠正畸模型。2组大鼠在第0~6天和第8~14天每天使用无菌注射器(无针头)对大鼠模型口腔内受力的第一磨牙区域进行灌洗1×109 CFU/mL的P.intermedia菌悬液1 mL。此外,植物乳植杆菌CCFM8724组大鼠在灌洗P.intermedia菌后6 h再额外灌洗1×109 CFU/mL的植物乳植杆菌CCFM8724菌悬液1 mL。所有大鼠在第0天、第7天及第14天使用无菌拭子沾取大鼠唾液,保存于含有1 mL体积分数为30%甘油的2 mL离心管中,分析P.intermedia菌的定植情况。同时记录大鼠体重、第一磨牙距中切牙距离(orthodontic tooth movement,OTM)、牙龈指数及探诊深度。所有大鼠在第14天处死,取血清、牙龈组织和牙槽骨组织,进行进一步分析。
1.3.3 大鼠唾液P.intermedia数量的测定
在第0天、第7天和第14天取样,取10 μL保存于甘油溶液的唾液样本均匀涂布于BHI血琼脂平板上。37 ℃厌氧培养48 h后观察并计数平板上的菌落,其中P.intermedia菌落呈蓝灰色。
1.3.4 血清细胞因子及牙龈组织测定
在第14天,大鼠处死前,取大鼠腹主动脉血液10 mL,静置30 min后离心取上清液,即为血液样本。处死大鼠后,剥离第一磨牙舌侧及颊侧牙龈组织。称取20 mg牙龈组织与180 μL PBS缓冲液混合,置于1.5 mL离心管中,加入3颗研磨锆珠,并在高通量组织研磨机中研磨。随后将组织匀浆以10 000 r/min在4 ℃离心15 min,收集上清液,并保存于-20 ℃。
随后根据试剂盒说明书测定血清中RANKL、OPG和牙龈组织中IL-1β、TNF-α、IL- 6、MMP-8、MPO的水平。
1.3.5 大鼠上颌骨组织Micro-CT扫描
大鼠处死时,剥离大鼠右侧上颌骨组织,将其置于40 g/L多聚甲醛溶液中固定48 h。参照YE等[18]的方法,将固定好的大鼠上颌骨用PBS溶液清洗并晾干。采用高分辨率Micro-CT影像系统对上颌骨样本进行扫描。具体参数为:电压100 kV,电流88 μA,视野范围18 μm,成像旋转360°,采集时间4 min。测定并计算造模处骨体积(bone volume,BV)与牙槽骨总体积(tissue volume,TV)的比值(BV/TV)。
1.3.6 大鼠上颌骨病理组织分析
将固定好的大鼠上颌骨组织用EDTA脱钙1周,随后使用乙醇脱水,石蜡包埋。沿第一磨牙长轴方向矢状面切厚度为2 μm的组织切片。
对于HE染色,将组织切片参照YU等[19]的方法,使用苏木精和伊红染色,用Case Viewer软件在20倍下观察切片。对于TRAP染色,将组织切片参照KANG等[20]的方法,使用TRAP染色液将切片染色,使用Case Viewer软件在20倍放大镜下观察切片,选取3个部分计算破骨细胞的数量并取平均值。
1.3.7 数据统计分析
所有数据通过SPSS 26.0进行统计分析。正态分布的数据使用“平均值±标准差”表示,并通过单因素方差分析(ANOVA)、t检验分析差异性。非正态数据采用非参数检验。数据可视化通过Graphpad 9.0等工具完成。显著性水平设定为P<0.05。
2 结果与分析
2.1 植物乳植杆菌CCFM8724上清液对P.intermedia生物膜形成的影响
基于过往研究中植物乳植杆菌CCFM8724拥有的多菌生物膜清除能力,继续探究了其抑制P.intermedia生物膜形成的能力。如表1所示,经植物乳植杆菌CCFM8724发酵上清液液干预后,P.intermedia的生物膜减少了54%,说明其显著抑制了P.intermedia的生长。在过往研究中,一般使用抗生素控制口腔中的致病菌定植量。但抗生素的使用也存在一些局限性和副作用。长期使用抗生素可能导致耐药性的增加,破坏口腔内的正常菌群平衡,引起口腔黏膜的不良反应,以及可能对患者的整体健康产生不利影响。
表1 植物乳植杆菌CCFM8724菌对P.intermedia生物膜的抑制率
Table 1 Inhibition rate of P.intermedia biofilm by Lactiplantibacillus plantarum CCFM8724
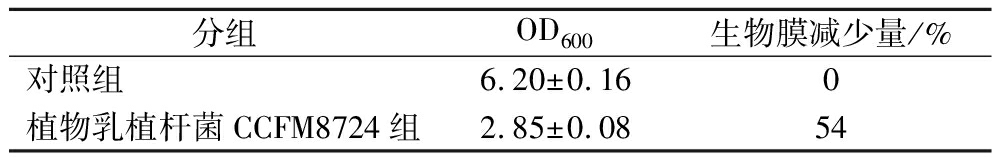
分组OD600生物膜减少量/%对照组6.20±0.160植物乳植杆菌CCFM8724组2.85±0.0854
因此,本研究中植物乳植杆菌CCFM8724提供了一种潜在的、副作用较小的替代方案。植物乳植杆菌CCFM8724可以通过竞争性抑制P.intermedia、产生抗菌物质、增强机体免疫反应等机制,维护口腔微生态的平衡。
2.2 植物乳植杆菌CCFM8724对正畸大鼠体重及OTM的影响
OTM距离是显示正畸模型大鼠牙齿移动的直观指标。如图1所示,模型组大鼠经正畸模型及P.intermedia口腔灌洗后体重及OTM距离下降,而经植物乳植杆菌CCFM8724干预后大鼠体重及OTM与模型组相比有一定的恢复,但没有统计学差异(P>0.05)。VIECILLI等[21]的结果表明正畸模型大鼠相较无处理组大鼠牙齿移动更快,骨吸收反应更加活跃。与该研究结果相同,本研究模型大鼠上颌第一磨牙距上颌中切牙更近,移动距离更大,而植物乳植杆菌CCFM8724可以缓解正畸模型及P.intermedia口腔灌洗诱导的大鼠体重损失,并减缓大鼠牙齿移动进程,降低骨吸收的速率。
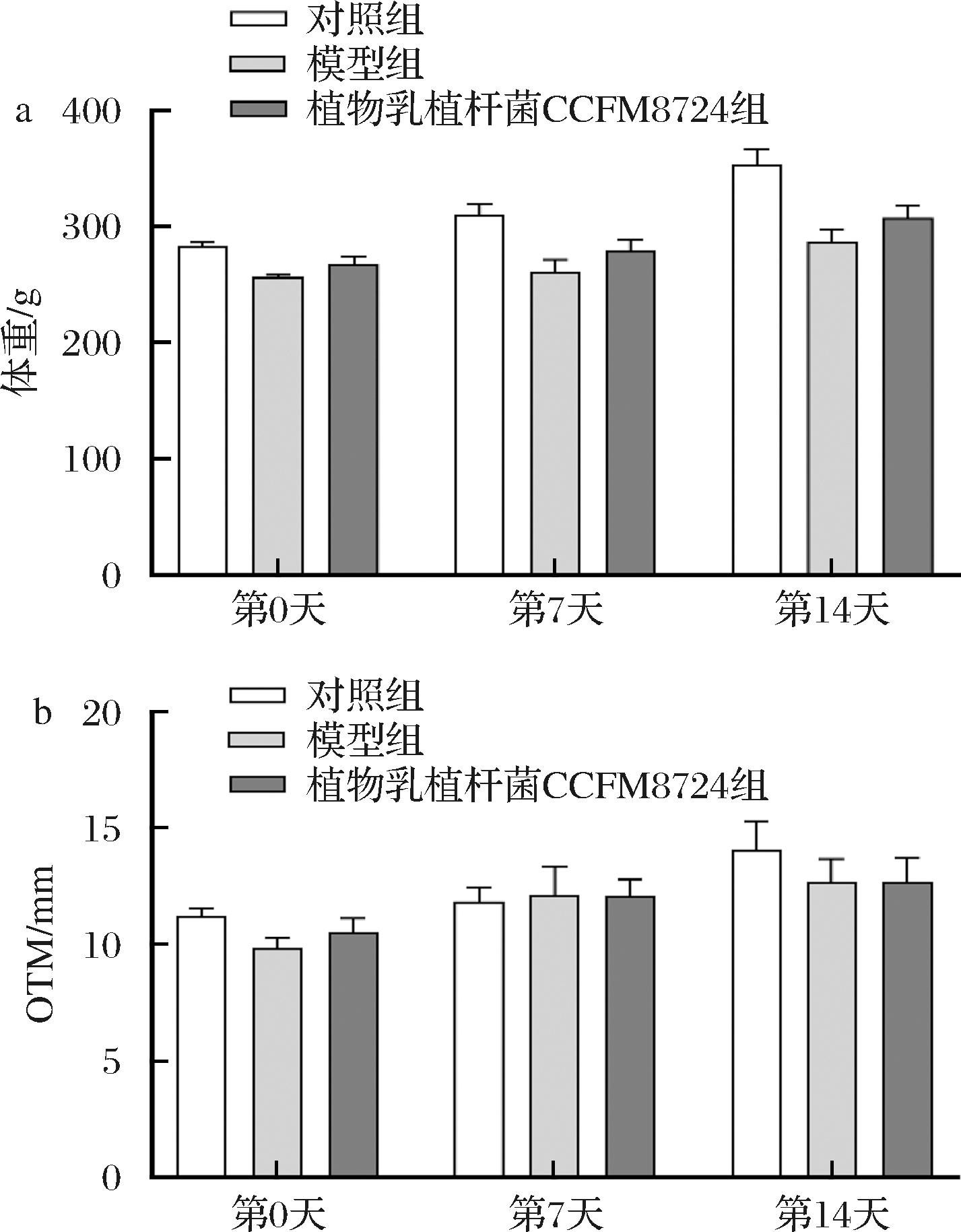
a-大鼠第0、7、14天体重;b-大鼠第0、7、14天OTM
图1 植物乳植杆菌CCFM8724干预后的大鼠体重及OTM的变化
Fig.1 Changes in body weight and OTM in rats post-intervention with L.plantarum CCFM8724
2.3 植物乳植杆菌CCFM8724对正畸大鼠牙周组织的影响
大鼠牙龈指数的变化可以反映出大鼠牙龈炎症程度的变化。牙龈指数降低意味着牙龈红肿、出血等症状的改善。大鼠探诊深度的变化通常与牙周组织的改善相关,较浅的探诊深度暗示着牙周组织的健康并有较低的牙周病风险。如图2所示,模型组的牙龈指数、探诊深度高于植物乳植杆菌CCFM8724组,后者显示出更低的牙龈炎症及出血倾向,牙周组织损伤也得到一定缓解。LI ARES等[22]的研究表明,使用益生菌能够显著减少种植体周围炎患者的探诊深度和临床附着水平损失,表明益生菌对于改善牙周健康具有潜在的益处。而本研究在调控探诊深度外突出了牙龈指数在干预前后的变化,牙龈指数的下降补充说明了植物乳植杆菌CCFM8724对抑制正畸诱导的牙龈炎症反应具有潜在效果。
ARES等[22]的研究表明,使用益生菌能够显著减少种植体周围炎患者的探诊深度和临床附着水平损失,表明益生菌对于改善牙周健康具有潜在的益处。而本研究在调控探诊深度外突出了牙龈指数在干预前后的变化,牙龈指数的下降补充说明了植物乳植杆菌CCFM8724对抑制正畸诱导的牙龈炎症反应具有潜在效果。
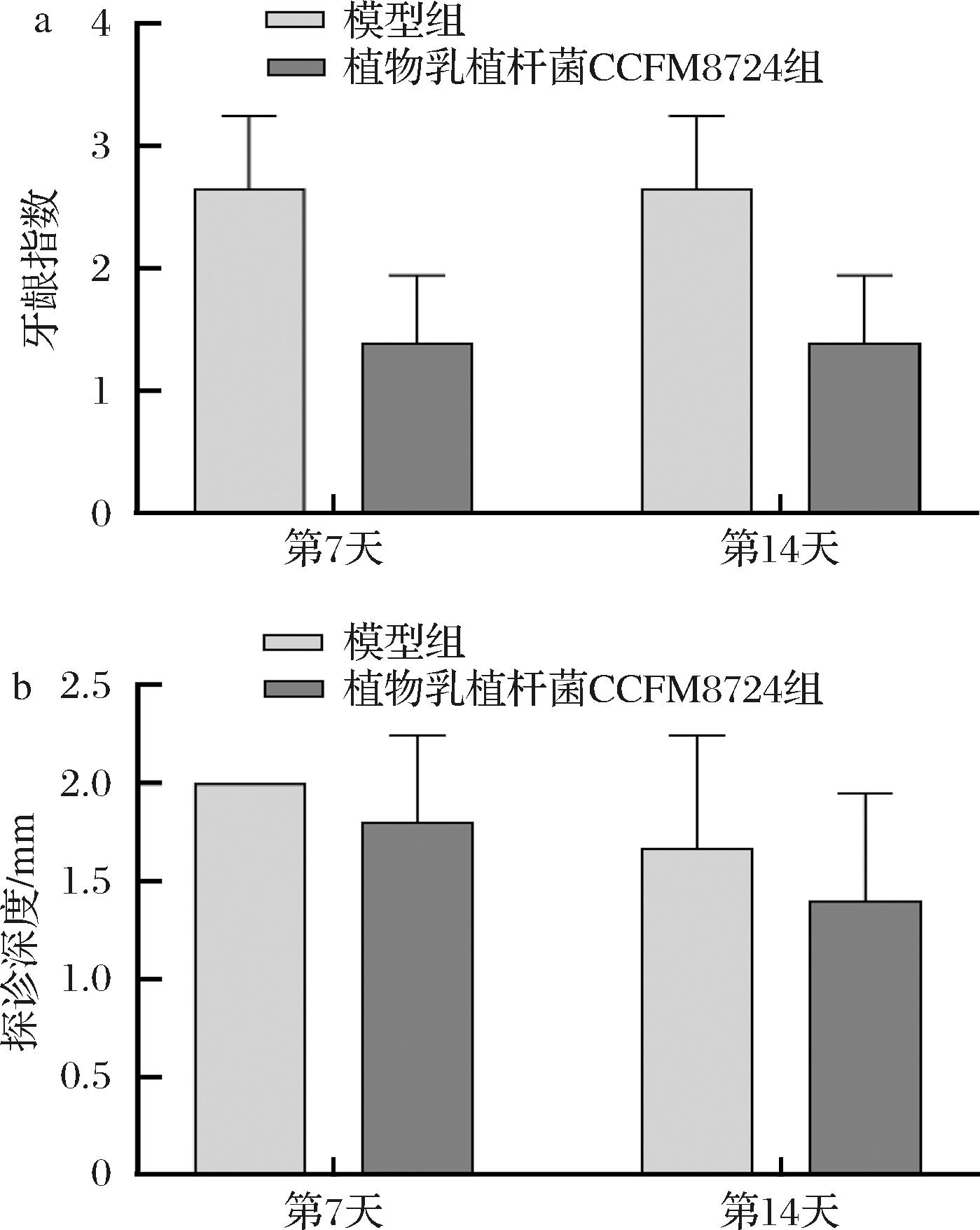
a-大鼠牙龈指数;b-大鼠牙周探诊深度
图2 植物乳植杆菌CCFM8724干预后大鼠牙龈指数及探诊深度指数的变化
Fig.2 Changes in gingival index and probing depth index in rats following L.plantarum CCFM8724 intervention
2.4 植物乳植杆菌CCFM8724对正畸大鼠口腔P.intermedia定植的影响
研究收集了第7天和第14天各组大鼠的唾液。通过测定唾液中P.intermedia的活菌数,反映植物乳植杆菌CCFM8724大鼠口腔P.intermedia定植的抑制能力。如图3所示,在第7天时,模型组相较第1天的唾液中P.intermedia的定植量显著提升(P<0.000 1)。其中在第7天及第14天时,模型组P.intermedia定植量显著低于植物乳植杆菌CCFM8724组(P<0.000 1)。在第14天时P.intermedia组定植量为6.63 lg CFU/mL,而植物乳植杆菌CCFM8724组仅为3.7 lg CFU/mL。VIVEKANANDA等[23]的双盲随机对照试验发现,罗伊氏乳酪杆菌17938能显著降低牙周炎患者的P.intermedia数量,从而缓解了患者牙龈出血及附着丧失。而在本研究中,通过口腔灌洗P.intermedia,模型组大鼠口腔P.intermedia已经在口腔获得稳定的生态位,丰度相对基线期显著提高。而植物乳植杆菌CCFM8724可以显著降低P.intermedia在口腔中的黏附能力,抑制P.intermedia在正畸模型大鼠口腔中的定植。该结果与过往研究均表明,通过抑制P.intermedia可以实现对正畸骨吸收的控制。
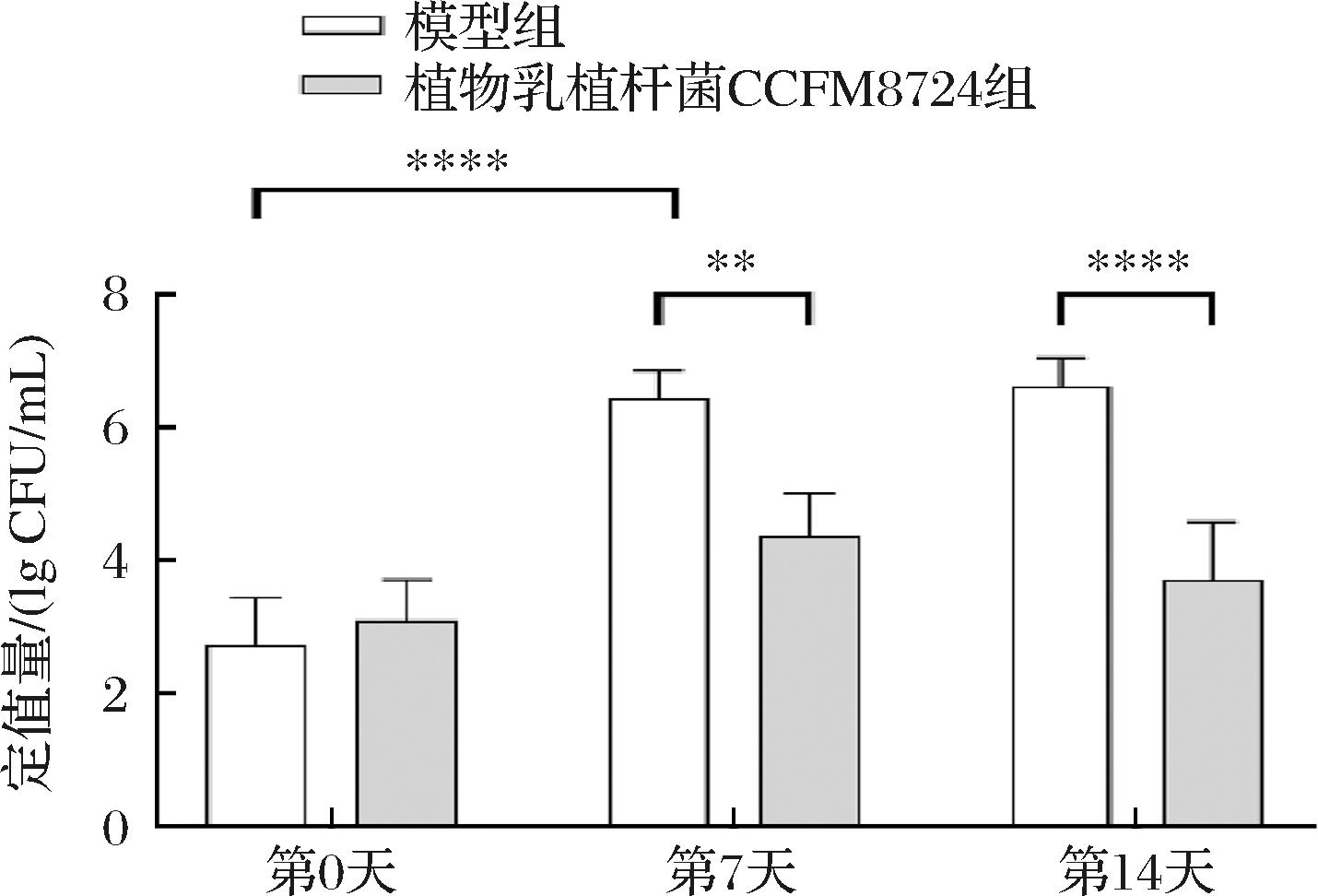
图3 植物乳植杆菌CCFM8724干预后P.intermedia在大鼠口腔中的定植情况
Fig.3 Colonization of P.intermedia in the oral cavity of rats following L.plantarum CCFM8724 intervention
注:*表示干预前后对比差异有显著性,其中*代表P<0.05,****代表P<0.000 1(图4同)。
2.5 植物乳植杆菌CCFM8724对正畸大鼠骨组织的影响
Micro-CT技术能够在不破坏样本的情况下清晰地了解牙槽骨的内部显微结构。利用Micro-CT技术观察各组大鼠牙槽骨微观结构,可以确定大鼠牙槽骨骨结构在正畸模型及植物乳植杆菌CCFM8724的干预下的变化情况。如图4-a所示,对照组骨微观结构显示其牙周组织未见损伤,牙根未见明显暴露。模型组的牙周组织出现明显退缩,并伴随着牙周袋的形成,第一磨牙与第二磨牙间隙超过2 mm,牙根尖也暴露于牙龈组织外。而经植物乳植杆菌CCFM8724干预后,大鼠牙周组织形态相较模型组更加完整,与对照组相似。
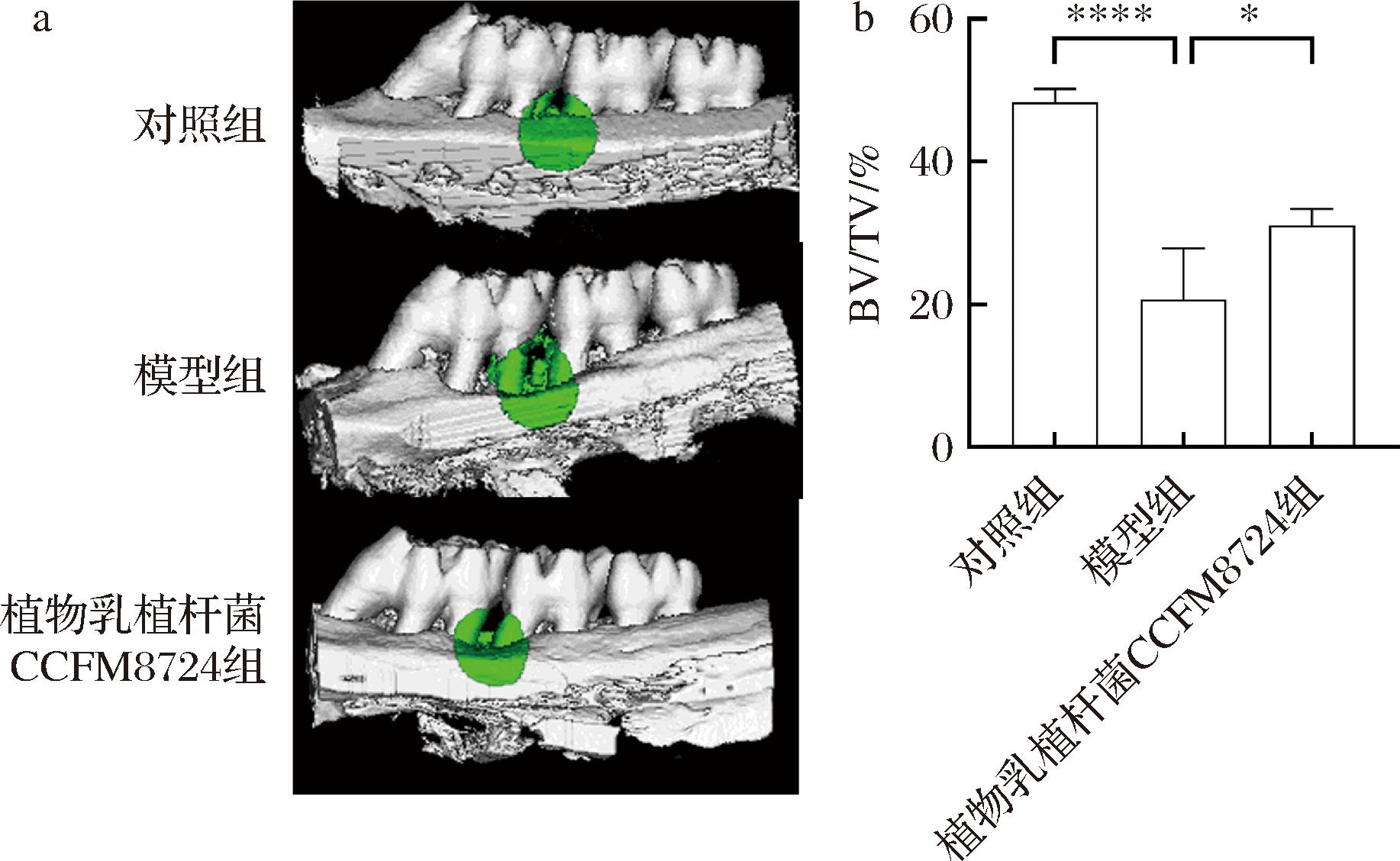
a-大鼠牙槽骨微观结构;b-大鼠牙槽骨骨吸收水平
图4 大鼠上颌骨微观结构及BV/TV值
Fig.4 Microarchitecture of the rat maxilla and BV/TV ratio
牙槽骨BV/TV值可以有效说明牙槽骨骨吸收的状态,若BV/TV值高,则说明牙槽骨骨吸收较少。如图4-b所示,模型组BV/TV值(20.39%)相较于对照组(48.34%)显著下降(P<0.000 1)。植物乳植杆菌CCFM8724组BV/TV值(31.09%)则相较于模型组BV/TV值(20.39%)显著提高(P<0.05)。以上结果表明,正畸模型及P.intermedia诱导大鼠牙槽骨发生了骨吸收。而植物乳植杆菌CCFM8724对正畸模型大鼠骨吸收具有显著的缓解效果。
2.6 植物乳植杆菌CCFM8724对正畸大鼠牙槽骨骨组织的影响
HE染色可以反映组织炎症的急性程度,也可观察到组织形态的变化。如图5所示,在比例尺50 μm的视野下,对照组大鼠的上颌骨切片经过HE染色后,显示出完整的牙周组织结构。牙龈紧密贴合在牙齿表面,无牙周袋形成,且未见炎症细胞聚集。模型组大鼠的上颌骨切片显示牙周组织完整性受损。牙龈与牙面之间出现缝隙,形成牙周袋。观察到大量炎症细胞在根尖区域聚集,第一磨牙与第二磨牙间的间隙增大,牙周根尖组织厚薄不均。而经植物乳植杆菌CCFM8724干预后,大鼠牙槽骨炎症浸润减少,牙根尖处炎症细胞未明显聚集在牙周根尖处。植物乳植杆菌CCFM8724的大鼠牙龈组织损伤也得到了缓解。以上结果表明,植物乳植杆菌CCFM8724具有一定的牙龈炎症调控能力,进而也缓解了正畸诱导的牙根骨吸收。
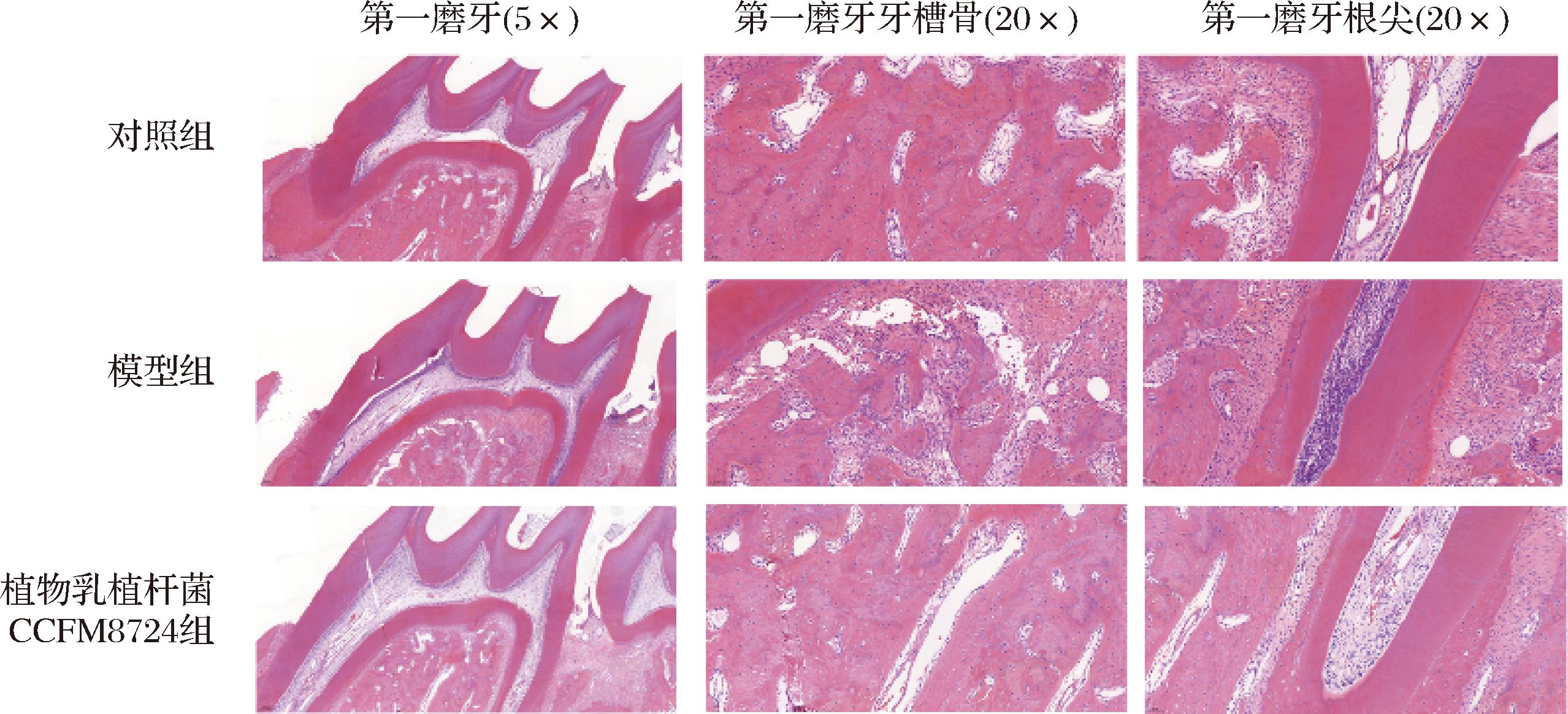
图5 大鼠上颌骨病理组织HE染色
Fig.5 HE staining of pathological tissue in the maxilla of rats
2.7 植物乳植杆菌CCFM8724对正畸大鼠牙槽骨破骨细胞表达的影响
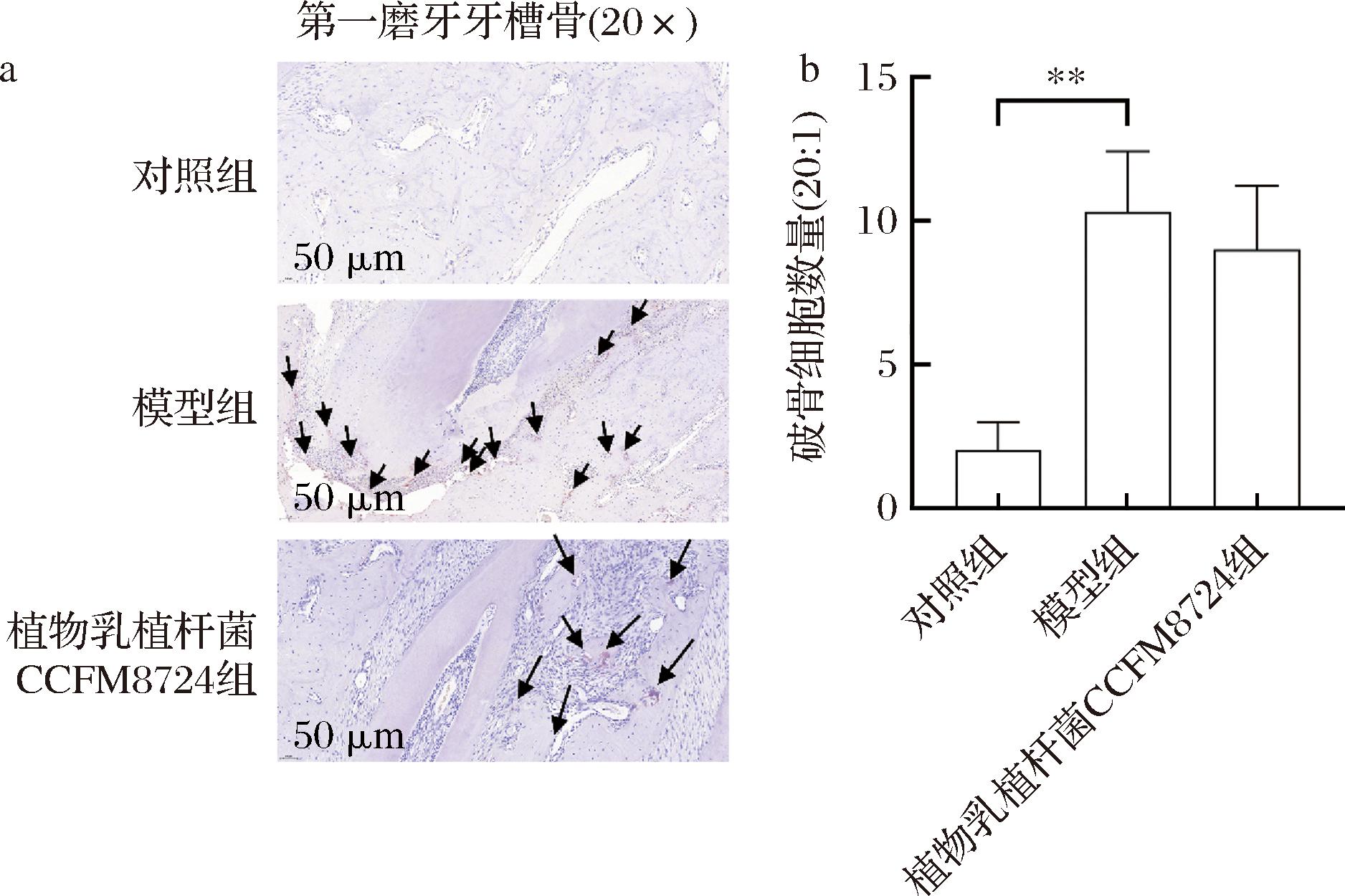
TRAP染色可以用于破骨细胞的定位及定量分析。TRAP染色可以特异性地标记破骨细胞,而破骨细胞是骨稳态中相当重要的一环,它负责旧骨的吸收,与新合成的牙槽骨形成稳定的动态平衡。如图6所示,在比例尺50 μm的视野下模型组的破骨细胞数量(10.33±2.08)相较于对照组(2.00±1.00)显著增加(P<0.01),并主要分布在牙槽骨根尖分叉处。在此处相较于对照组发生了大量的骨基质吸收的过程。植物乳植杆菌CCFM8724灌洗大鼠口腔2周后,牙槽骨破骨细胞单位面积数量相较模型组呈下降趋势。阿司匹林在过往的研究结果表明其可抑制破骨细胞的分化,并通过活化T细胞核因子κB(NF-κB)/核因子胞浆1(NFATc1)信号调节通路调节树突状细胞向破骨细胞分化[24]。根据本研究的结果,植物乳植杆菌CCFM8724同样对破骨细胞的活性具有一定的抑制能力,但在NF-κB、NFATc1等信号通路的调控作用机制尚未详细说明,后续也需要在这一方面进行一定的深入探究。
a-牙龈组织IL-1β水平;b-牙龈组织IL-6水平
图6 大鼠上颌骨病理组织TRAP染色及破骨细胞数量
Fig.6 Histopathological tissue staining with TRAP and osteoclast count in the maxilla of rats
注:其中箭头处为破骨细胞;*表示干预前后对比差异有显著性,其中**代表P<0.01(图8同)。
2.8 植物乳植杆菌CCFM8724对正畸大鼠牙龈组织炎症因子表达的影响
牙龈组织炎症因子的水平反应了局部的炎症程度。而炎症因子IL-1β、IL-6、TNF-α可以通过多条通路促进RANKL及OPG的表达,进而加剧牙槽骨的骨吸收。研究测定了植物乳植杆菌CCFM8724干预后正畸大鼠牙龈组织炎症因子表达水平。如图7所示,对照组与P.intermedia组牙周组织中IL-1β、IL-6、TNF-α、MMP-8存在显著差异(P<0.05),表明正畸治疗及P.intermedia的干预加剧了局部组织的损伤,提高了牙龈组织的炎症水平。而在植物乳植杆菌CCFM8724干预后,TNF-α和IL-6的表达相较于模型组显著下降(P<0.05),牙周组织IL-1β、MMP-8也有一定下调。早期研究已证实,牙周炎症中的炎症因子会加剧骨吸收的发生。在ZHOU等[25]的研究中血红铆钉菇的摄入可以通过激活Wnt/β-catenin信号传导降低TNF-α、IL-1β和IL-6等牙周炎因子的水平,促进牙周骨的形成。一项动物实验结果[26]也表明,植物乳植杆菌A41发酵的奶制品可增加卵巢切除大鼠的骨量和骨矿物质密度,并使血清中的骨生物标志物正常化,同时下调卵巢切除术刺激的骨凋亡相关基因和大鼠血清、骨骼、回肠和结肠中炎症标志物的水平。本研究中植物乳植杆菌CCFM8724与上述最新研究一致,可以通过减少大鼠牙龈组织炎症因子的产生缓解骨吸收,但后续需要补充植物乳植杆菌CCFM8724干预对大鼠其他的骨生物标志物的影响。
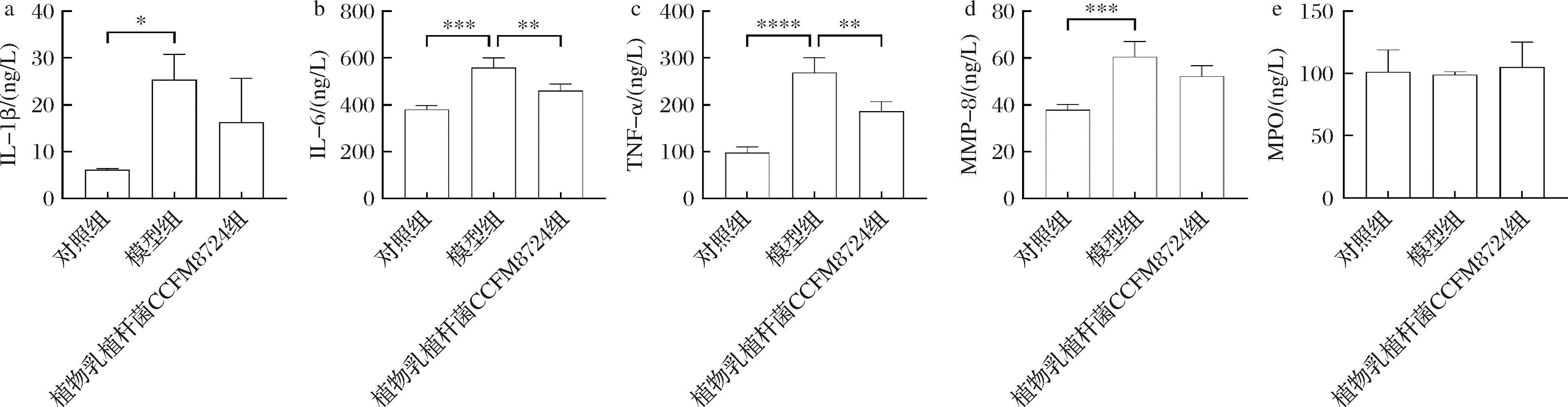
a-牙龈组织IL-1β水平;b-牙龈组织IL-6水平;c-牙龈组织TNF-α水平;d-牙龈组织MMP-8水平;e-牙龈组织MPO水平
图7 正畸模型大鼠牙周组织炎症因子表达
Fig.7 Expression of periodontal inflammatory cytokines in orthodontic model rats
注:*表示干预前后对比差异有显著性,其中*代表P<0.05,**代表P<0.01,***代表P<0.001,****代表P<0.000 1。
2.9 植物乳植杆菌CCFM8724对正畸大鼠牙槽骨OPG/RANKL表达的影响
OPG作为一种重要的骨吸收抑制因子,可以竞争性结合RANKL,防止破骨细胞的分化,并抑制破骨细胞活性。OPG的上调可能缓解骨骼改建过程中的骨吸收的发生。RANKL则作为加速骨吸收的关键配体与破骨细胞表面RANK受体结合,促进牙槽骨的骨吸收。研究通过测定血清中OPG及RANKL的表达水平以探讨植物乳植杆菌CCFM8724在正畸过程中对骨吸收的调控机制。如图8-a所示,植物乳植杆菌CCFM8724组OPG表达(1 091.13 ng/L)与P.intermedia组(845.87 ng/L)相比显著增加(P<0.01)。而RANKL在干预后出现下降趋势。WANG等[11]的研究通过对牙槽骨组织切片进行了OPG和RANKL免疫组化分析,发现淫羊藿苷可以通过调节OPG/RANKL比例,调控破骨细胞分化,对快速扩弓诱导的大鼠牙根吸收产生修复效果。此外,乳杆菌属中的多种菌株已被证实在骨吸收方面具有不同的应用潜力。罗伊氏黏液乳杆菌被发现能够通过增加OPG/RANKL比值来抑制小鼠的破骨细胞形成,并降低小鼠血清中酒石酸盐抗性碱性磷酸酶水平[27]。以上研究均与本研究相呼应,植物乳植杆菌CCFM8724也可以通过提高OPG/RANKL含量的相对比例,进而缓解正畸模型大鼠牙槽骨骨吸收。
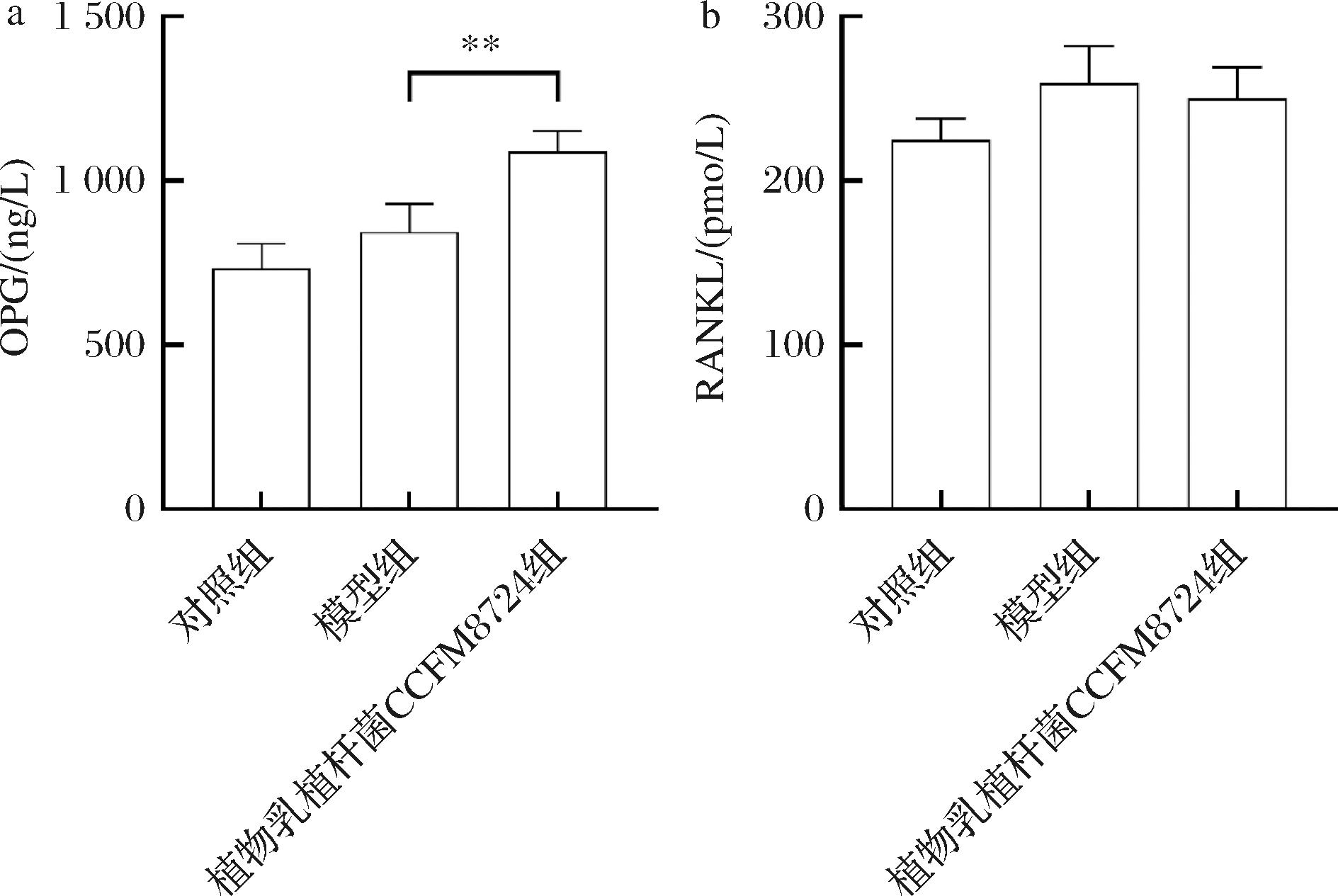
a-OPG水平;b-RANKL水平
图8 不同分组的大鼠血清OPG、RANKL表达
Fig.8 Expression of OPG,RANKL in the serum of rats from different groups
3 结论
植物乳植杆菌CCFM8724在体外具有抑制P.intermedia生物膜形成的潜力。在正畸大鼠模型中,植物乳植杆菌CCFM8724可以显著下调大鼠牙龈组织的炎症水平,降低P.intermedia在大鼠口腔中的定植量,并提高OPG/RANKL/RANK通路中OPG和RANKL的比例水平。综上所述,植物乳植杆菌CCFM8724的致病菌抑制、炎症及骨代谢调控能力为正畸治疗中牙槽骨吸收控制提供了新的策略。
[1] WEILAND F.External root resorptions and orthodontic forces:Correlations and clinical consequences[J].Progress in Orthodontics, 2006, 7(2):156-163.
[2] ALGHAMDI B, JEON H H, NI J, et al.Osteoimmunology in periodontitis and orthodontic tooth movement[J].Current Osteoporosis Reports, 2023, 21(2):128-146.
[3] YAMAGUCHI M, FUKASAWA S.Is inflammation a friend or foe for orthodontic treatment?Inflammation in orthodontically induced inflammatory root resorption and accelerating tooth movement[J].International Journal of Molecular Sciences, 2021, 22(5):23-25.
[4] GKANTIDIS N, CHRISTOU P, TOPOUZELIS N.The orthodontic-periodontic interrelationship in integrated treatment challenges:A systematic review[J].Journal of Oral Rehabilitation, 2010, 37(5):377-390.
[5] CHAVES E S, JEFFCOAT M K, RYERSON C C, et al.Persistent bacterial colonization of Porphyromonas gingivalis, Prevotella intermedia, and Actinobacillus actinomycetemcomitans in periodontitis and its association with alveolar bone loss after 6 months of therapy[J].Journal of Clinical Periodontology, 2000, 27(12):897-903.
[6] YOSHIDA-MINAMI I, SUZUKI A, KAWABATA K, et al.Alveolar bone loss in rats infected with a strain of Prevotella intermedia and Fusobacterium nucleatum isolated from a child with prepubertal periodontitis[J].Journal of Periodontology, 1997, 68(1):12-17.
[7] PAN S, LIU Y, ZHANG L, et al.Profiling of subgingival plaque biofilm microbiota in adolescents after completion of orthodontic therapy[J].PLoS One, 2017, 12(2):e0171550.
[8] FELLER L, KHAMMISSA R G, SCHECHTER I, et al.Biological events in periodontal ligament and alveolar bone associated with application of orthodontic forces[J].The Scientific World Journal, 2015(4):876-909.
[9] KITAURA H, KIMURA K, ISHIDA M, et al.Effect of cytokines on osteoclast formation and bone resorption during mechanical force loading of the periodontal membrane[J].The Scientific World Journal, 2014, 2014(1):617032.
[10] XU Q, YUAN X, ZHANG X, et al.Mechanoadaptive responses in the periodontium are coordinated by wnt[J].Journal of Dental Research, 2019, 98(6):689-697.
[11] WANG F, LIU Z F, LIN S S, et al.Icariin enhances the healing of rapid palatal expansion induced root resorption in rats[J].Phytomedicine, 2012, 19(11):1035-1041.
[12] SUN J, SUN W J, LI Z Y, et al.Daidzein increases OPG/RANKL ratio and suppresses IL-6 in MG-63 osteoblast cells[J].International Immunopharmacology, 2016, 40:32-40.
[13] ZHANG Q X, QIN S J, HUANG Y, et al.Inhibitory and preventive effects of Lactobacillus plantarum FB-T9 on dental caries in rats[J].Journal of Oral Microbiology, 2020, 12(1):170-183.
[14] ZHANG Q X, LI J X, LU W W, et al.Multi-omics reveals the inhibition of Lactiplantibacillus plantarum CCFM8724 in Streptococcus mutans-Candida albicans mixed-species biofilms[J].Microorganisms, 2021, 9(11):1283-1294.
[15] LI J X, ZHANG Q X, ZHAO J X, et al.Streptococcus mutans and Candida albicans biofilm inhibitors produced by Lactiplantibacillus plantarum CCFM8724[J].Current Microbiology, 2022, 79(5):143-146.
[16] WAKABAYASHI H, YAMAUCHI K, KOBAYASHI T, et al.Inhibitory effects of lactoferrin on growth and biofilm formation of Porphyromonas gingivalis and Prevotella intermedia[J].Antimicrobial Agents and Chemotherapy, 2009, 53(8):3308-3316.
[17] WANG W, QIAO S C, WU X B, et al.Circ_0008542 in osteoblast exosomes promotes osteoclast-induced bone resorption through m6A methylation[J].Cell Death &Disease, 2021, 12(7):628-633.
[18] YE Y H, XU X Y, MAO B Y, et al.Evaluation of heat-inactivated Limosilactobacillus fermentum CCFM1139 and its supernatant for the relief of experimental periodontitis in rats[J].Food &Function, 2023, 14(6):2847-2856.
[19] YU F L, GENG D Z, KUANG Z P, et al.Sequentially releasing self-healing hydrogel fabricated with TGFβ3-microspheres and bFGF to facilitate rat alveolar bone defect repair[J].Asian Journal of Pharmaceutical Sciences, 2022, 17(3):425-434.
[20] KANG M S, MOON J H, PARK S C, et al.Spirulina maxima reduces inflammation and alveolar bone loss in Porphyromonas gingivalis-induced periodontitis[J].Phytomedicine, 2021, 81:153420.
[21] VIECILLI R F, KAR-KURI M H, VARRIALE J, et al.Effects of initial stresses and time on orthodontic external root resorption[J].Journal of Dental Research, 2013, 92(4):346-351.
[22] LI ARES A, SANZ-S
ARES A, SANZ-S NCHEZ I, DOPICO J, et al.Efficacy of adjunctive measures in the non-surgical treatment of peri-implantitis:A systematic review[J].Journal of Clinical Periodontology, 2023, 50:224-243.
NCHEZ I, DOPICO J, et al.Efficacy of adjunctive measures in the non-surgical treatment of peri-implantitis:A systematic review[J].Journal of Clinical Periodontology, 2023, 50:224-243.
[23] VIVEKANANDA M R, VANDANA K L, BHAT K G.Effect of the probiotic Lactobacilli reuteri (Prodentis) in the management of periodontal disease:A preliminary randomized clinical trial[J].Journal of Oral Microbiology, 2010, 2(1):23-27.
[24] WU L L, LUO Z H, LIU Y T, et al.Aspirin inhibits RANKL-induced osteoclast differentiation in dendritic cells by suppressing NF-κB and NFATc1 activation[J].Stem Cell Research &Therapy, 2019, 10(1):375-382.
[25] ZHOU Y, ZHU Y F, JIN X H, et al.Chroogomphus rutilus regulates bone metabolism to prevent periodontal bone loss during orthodontic tooth movement in osteoporotic rats[J].Nutrients, 2023, 15(23):3411-3418.
[26] LEE C S, KIM J Y, KIM B K, et al.Lactobacillus-fermented milk products attenuate bone loss in an experimental rat model of ovariectomy-induced post-menopausal primary osteoporosis[J].Journal of Applied Microbiology, 2021, 130(6):2041-2062.
[27] SCHEPPER J D, COLLINS F L, RIOS-ARCE N D, et al.Probiotic Lactobacillus reuteri prevents postantibiotic bone loss by reducing intestinal dysbiosis and preventing barrier disruption[J].Journal of Bone and Mineral Research, 2019, 34(4):681-698.