镇江香醋(Zhenjiang aromatic vinegar,VAR)是我国四大名醋之一,距今已有1 400余年的历史,是以糯米为主要原料,历经糖化、酒精发酵、醋酸发酵、淋醋、煎煮等工艺制作而成,虽然发酵过程是开放的,但由于利用套醪分层接种工艺等,除醋酸菌外,还有乳酸菌、芽孢杆菌和酵母菌等形成了复杂的酿造微生态系统,菌群发酵演替具有批次稳定性,使得产品品质稳定,在陈酿阶段,由于美拉德等反应其有机酸、氨基酸、川芎嗪等风味物质和功能组分均会提高及不断积累[1-3]。
除作为酸性调味品外,VAR还具有一定保健和药用价值,具有降低总胆固醇及血压、抗菌、助消化、保肝等功效[4]。近年来研究通过高糖诱导胰岛素抵抗细胞模型、酒精诱导慢性肝损伤及高脂诱导慢性非酒精性肝损伤小鼠模型等,证实VAR具有抗氧化、降糖及肝脏保护活性,且可以调节肠道菌群[5-7]。
人类肠道定殖的庞大而复杂的微生物群落对机体健康至关重要。饮食是个体肠道内物种和功能的主要驱动因素,可以调节机体肠道微生物组,进而影响宿主健康[8]。世界著名肠道菌群研究专家Jeffrey Gordon提出可将肠道菌群、食品科学和营养学相结合进行研究,靶向肠道微生物组以增强、引入或消除特定功能,或分类群的饮食有助于肠屏障健康[9]。2021年发表于Cell的随机对照临床研究表明相对于富含膳食纤维饮食,富含发酵食品的饮食方式更能普遍增强正常个体肠道菌群的多样性并降低系统炎性标志物水平[10]。
VAR对正常机体及肠道菌群的影响尚未可知,在本研究中,利用正常无特定病原体(specific pathogen free,SPF)级近交系C57BL/6J小鼠,探讨VAR对机体肠道菌群及其代谢物的影响,以期为VAR功能性食品的开发奠定理论基础。
1 材料与方法
1.1 材料、试剂与供试动物
镇江酿造醋液(陈酿5年),由江苏恒顺醋业有限公司提供;总胆红素(total bilirubin,TB)、总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、乳酸脱氢酶(lactate dehydrogenase,LDH)、丙氨酸转氨酶(alanine transaminase,ALT)、天冬氨酸转氨酶(aspartate transaminase,AST)、高密度脂蛋白(high-density lipoprotein,HDL)和低密度脂蛋白(low-density lipoprotein,LDL)血清ELISA检测试剂盒,上海酶联生物有限公司。
6周龄SPF级C57BL/6J雄性小鼠,购自南京集萃药康实验动物技术有限公司。实验动物饲养在江南大学实验动物SPF级屏障中。饲养期间,环境室温控制在23~25 ℃,相对湿度控制在40%~60%,照明制度为标准的12 h光-暗周期循环。小鼠普通维持饲料由上海斯莱克有限公司提供。
1.2 仪器与设备
酶标仪,美谷分子仪器有限公司;MGI-2000基因测序仪,华大智造有限公司;超纯水制备系统,美国Millipore公司;SCIENTZ-48高通量组织研磨器,宁波新芝有限公司;X500R超高效液相色谱-电喷雾离子源-飞行时间质谱系统,美国AB SCIEX公司。
1.3 实验方法
1.3.1 动物实验
所有实验操作均经由江南大学实验动物福利伦理委员会批准(JN.No20211115 m0881228[449])。实验动物在进行自由饮食7 d后,分为2组,每组5只。实验组(VAR)每天灌胃恒顺醋液(1.25 mL/kg体重),对照组(control,CTL)灌胃同等体积的无菌水。连续灌胃4周,夜间禁食后对每只小鼠进行异氟烷麻醉并处死。小鼠眼球取血,静置30 min后4 ℃、2 500×g离心15 min,小心收集上层血清,无菌操作取出盲肠内容物放入到液氮中速冻,随后转移到-80 ℃保存。
1.3.2 血清学指标检测
将离心后的小鼠血清样本使用ELISA试剂盒进行各项指标检测。
1.3.3 小鼠肠道菌群16S rRNA基因测序与分析
提取小鼠粪便DNA后,以其为模版对细菌的V3~V4片段进行聚合酶链式反应扩增。正向引物341F(5′-ACTCCTACGGGAGGCAGCAG-3′),反向引物(5′-GGACTACHVGGGTWTCTAAT-3′)。纯化建库后,使用Agilent 2100 Bioanalyzer 对文库的片段范围及浓度进行检测。检测合格的文库根据插入片段大小,利用Illumina HiSeq平台进行测序。利用Qiime2-2020.2对扩增子测序结果进行分析。利用Silva_V138_2019.12.16细菌数据库对样品的有效序列进行聚类,按照97%的序列相似度将这些序列聚类成为操作分类单元(operational taxonomic units,OTU),得到每个cluster的序列及其代表序列,用于统计每个OTU序列和丰度进行多样性、差异物种及PICRUSt2(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)功能注释分析。
1.3.4 广泛代谢组学
称取50 mg粪便样本置于2 mL的QSP管中,加入400 μL预冷甲醇(含内标),涡旋振荡2 min;加入2粒钢珠,在低温条件下以50 Hz频率研磨4 min,将钢珠取出,或使用球磨机进行液氮冷冻研磨;涡旋振荡2 min,低温静置10 min;4 ℃、14 000×g离心15 min;吸取上清液200 μL于新的EP管中冻干。用20%(体积分数)甲醇/水溶液(100 μL)复溶,振荡离心取上清液,进行正、负离子模式分析[11]。
所有样品均在AB SCEIX X500R超高效液相色谱-电喷雾离子源-飞行时间质谱系统中运行,电喷雾电离为正模式。正离子模式下色谱柱:BEH C18柱(1.7 μm,2.1 mm×100 mm)、流动相A相:水(含0.1%甲酸,体积分数,下同)、流动相B相:乙腈;负离子模式下色谱柱:HSS T3柱(1.8 μm,2.1 mm×100 mm)、流动相A相:水(含0.1%甲酸)流动相B相:乙腈。使用Analyst Software 1.6.2进行仪器控制和数据集成,基于正交偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA)模型,获取R2X、Q2参数验评估型预测能力;对模型进行置换检验(Permutation,n=200),以检查模型过拟合(Over-fitting)程度,获取R2和Q2的截距信息;再使用单因素方差分析(one-way analysis of variance,ANOVA)分析代谢产物的P值,计算各处理组质谱相应值和对照组质谱响应值的倍数变化(fold change,FC),并以P<0.05,且FC>1作为差异代谢的初步筛选阈值;标志物的变量投影重要值(variable importance projection value,VIP)参数也一并计算。代谢组学数据使用Metabo Analyst进行分析和绘图[12](https://www.metaboanalyst.ca/faces/home.xhtml)。
1.4 数据统计分析
实验数据均以平均值±标准差表示,两组间差异用非配对t检验方法进行统计学分析,以P<0.05作为差异显著性的标准,采用GraphPad Prism 9.0软件绘图。
2 结果与分析
2.1 镇江香醋对正常小鼠体重及血清生化指标的影响
2.1.1 正常小鼠的体重指标变化趋势
利用体重比来显示正常小鼠灌胃VAR后体重指标变化(图1),与对照组相比,VAR组小鼠体重缓慢增长,连续4周灌胃处理后,其体重显著增加,推测可能原因是VAR中的有机酸和酶类物质可以促进胃液的分泌,增加胃肠蠕动,有助于消化和吸收食物中的营养物质,从而促进了正常小鼠的生长发育。
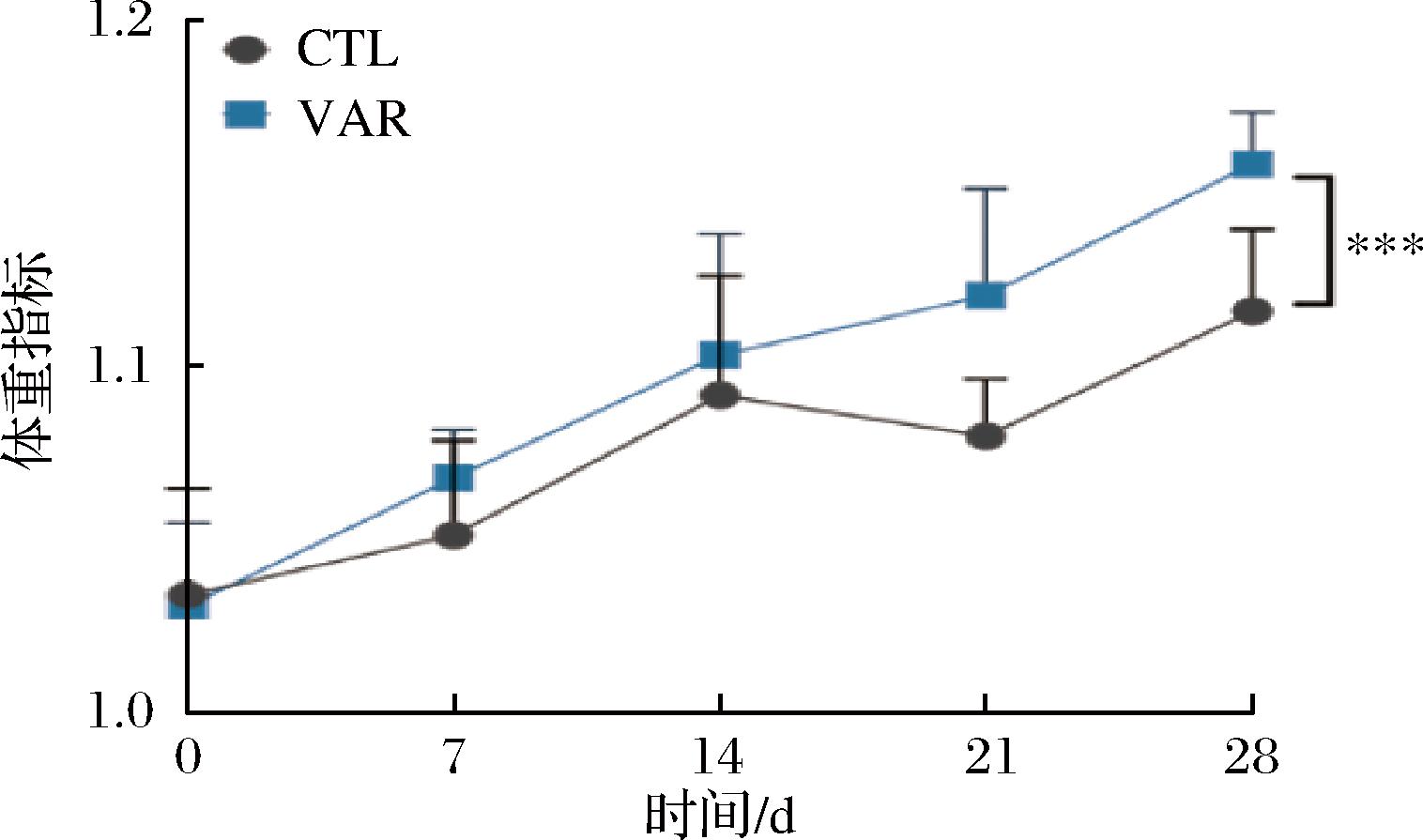
图1 体重指标变化
Fig.1 Change of body weight index
注:***表示P<0.001(下同)。
通过使用ELISA血清酶联试剂盒对分离得到的小鼠血清样本进行检测,由图2所示,TB、TC、AST、TG、LDH、ALT、LDL在对照组与VAR组小鼠血清中没有显著性差异,但单独来看,作为血清蛋白之一的高密度脂蛋白明显升高,同时它也是一种抗动脉粥样硬化的血浆脂蛋白,是冠心病的保护因子[13],表明VAR组小鼠在食用VAR后影响了体内的能量循环代谢以及血液循环系统。
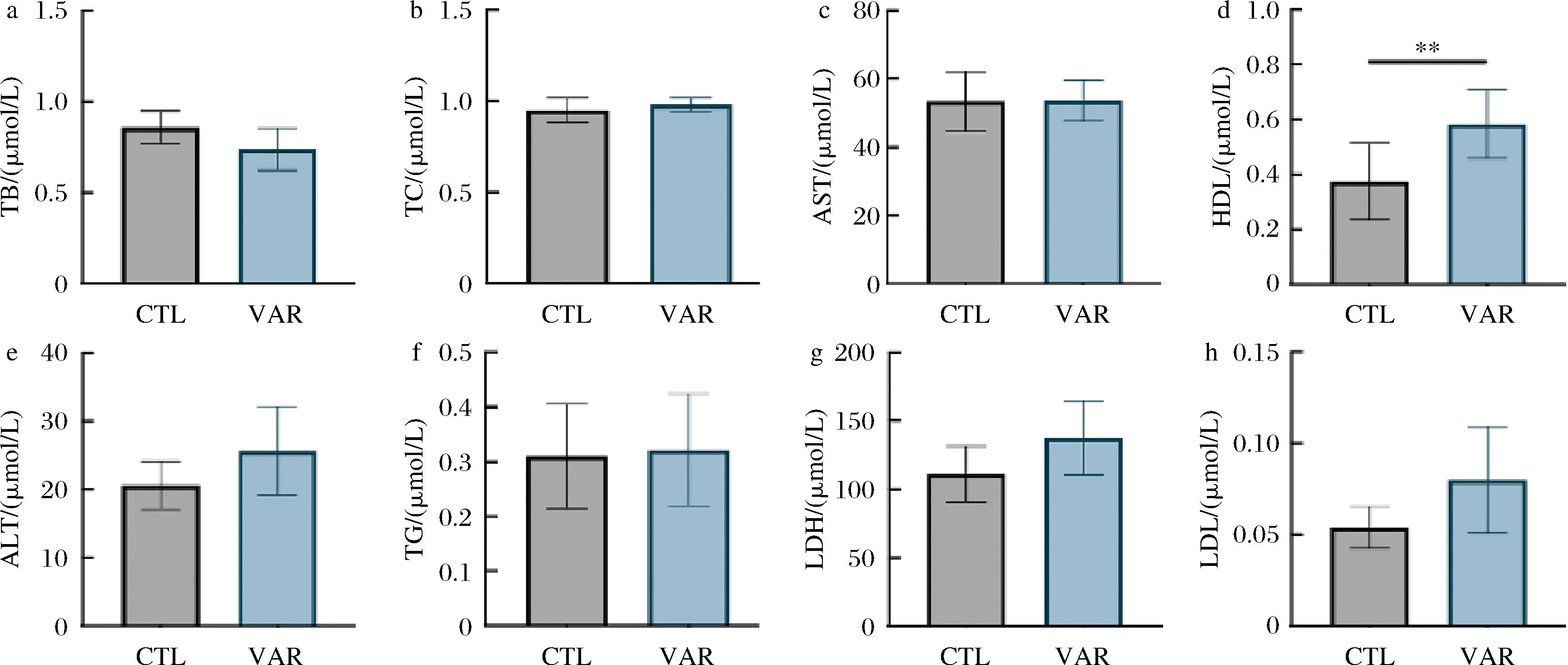
a-血胆红素浓度;b-总胆固醇浓度;c-天冬氨酸转氨酶浓度;d-高密度脂蛋白浓度;e-丙氨酸转氨酶浓度;f-甘油三酯浓度;g-乳酸脱氢酶浓度;h-低密度脂蛋白浓度
图2 血清学指标
Fig.2 Serological indicators
注:**表示P<0.01(下同)。
2.2 镇江香醋对正常小鼠体重、血清生化指标及肠道菌群结构及功能的影响
2.2.1 小鼠肠道微生物α-多样性及β-多样性
如图3-a所示,使用肠道菌群的多样性(Shannon指数、Simpson指数)和丰富度(ACE指数、Chao1指数)表征α-多样性,明显看出Shannon和Simpson指数有显著差异VAR组较对照组肠道微生物多样性增加,即通过加权物种均匀度反映的群落复杂程度发生改变;ACE指数、Chao1指数显著升高,即物种操作分类单元OTU总量增加,物种丰富度更大,可能是因为VAR发挥了其营养功能,促进了体内有益循环和能量代谢,促进了肠道菌群的生长[14]。

a-Shannon指数;b-Simpson指数;c-ACE指数;d-chao1指数;e-PCoA图
图3 小鼠肠道微生物α-多样性及β-多样性
Fig.3 α-diversity &β-diversity of mice gut microbiota
基于unweighted_unifrac距离,β-多样性用主坐标分析(principal coordinate analysis,PCoA)表示,PCoA是β-多样性中使用频率较高的一种数据降维和分析技术,如图3-e对照组和VAR组在空间上互不交融,但组内形成聚集状态,说明在小鼠食用VAR后,体内肠道菌群发生了显著改变,且由于同笼效应导致组内差异较小。
2.2.2 镇江香醋对小鼠肠道菌群门、属水平的影响
在门水平上,如图4-a展示了相对丰度排名前13的分组柱状图,在每个门类单独比较分析后,如图4-b所示,脱硫菌门(Desulfobacterota)、放线菌门(Actinobacteriota)在VAR组显著降低,疣微菌门(Verrucomicrobiota)、厚壁菌门(Firmicutes)在VAR组显著增加。在属水平上,如图4-c展示了相对丰度排名前17的分组柱状图,发现脱硫弧菌属(Desulfovibrio)、阿克曼菌属(Akkermansia)、乳杆菌属(Lactobacillus)、毛螺菌属(Lachnospiraceae_NK4A136)、Clostridia_UCG-014属、Muribaculaceae属有较大变化,在每个菌属单独比较分析后,如图4-d所示,脱硫弧菌属(Desulfovibrio,DSV)在 VAR组显著降低,DSV是一种硫酸盐还原菌,普遍存在于环境中,是人类胃肠道内的常驻共生菌,但DSV也是机会性病原体,可能在各种肠道和肠外疾病中过度生长[15]。而双歧杆菌属(Bifidobacterium)在VAR组显著降低的原因推测为VAR对小鼠肠道环境所造成的影响。阿克曼菌属(Akkermansia)在VAR组显著增加,宏基因组研究表明阿克曼菌的丰度与人的体重呈负相关。对粪便中肠道微生物群的分析表明,肥胖和超重儿童与瘦弱儿童相比,阿克曼菌浓度降低。利用微生物组多变量关联与线性模型的显著多变量线性关联显示,阿克曼菌的丰度与空腹血糖水平和体重指数呈负相关,表明这些细菌可以控制肥胖和糖尿病[16]。同样,实验肥胖模型,如喂食高脂饲料或高糖饮食的小鼠和遗传性肥胖小鼠显示,阿克曼菌属的丰度与肥胖、体重、肝脏和脂肪组织炎症、血糖血清、胰岛素和甘油三酯水平呈负相关[17]。

a-门水平丰度柱状图;b-门水平单菌丰度图;c-属水平丰度柱状图;d-属水平单菌丰度图
图4 小鼠肠道微生物的物种组成
Fig.4 Species composition of gut microbiota in mice

a-LEfSe聚类分析;b-LDA评分
图5 LEfSe及LDA图
Fig.5 LEfSe and LDA charts
2.2.3 小鼠肠道微生物的LEfSe分析和LDA图
为了进一步确认关键生物学标志物,进行了LEfSe分析和LDA评分展示,结果如下图5所示,对照组的标志差异微生物为双歧杆菌科(Bifidobacteriaceae)、放线菌门(Actinobacteria),VAR组的标志差异微生物为毛螺菌科(Lachnospiraceae)、拟杆菌目(Bacteroidales)、Muribaculaceae、颤螺旋菌科(Oscillospiraceae)、瘤胃球菌科(Ruminococcaceae)。在VAR组中被发现具有显著增加的是毛螺菌属(Lachnospiraceae_NK4A136)在相关文献中被报道在合成短链脂肪酸、产生次生代谢产物、形成孢子等方面具有巨大的潜力,具有广阔的研究和应用前景。此外,毛螺菌属(Lachnospiraceae_NK4A136)的丰度与动脉粥样硬化性心血管疾病和炎症性肠病等疾病呈负相关,表明其具有潜在的保护作用[18]。
2.2.4 镇江香醋对小鼠肠道菌群门、属水平的影响
为了进一步揭示VAR通过改变肠道微生物组成对正常小鼠产生的影响,使用PICRUST2(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States 2)软件预测菌群的功能。结果如下图6所示,结果表明VAR促进了泛醌和其他萜类化合物的生物合成、柠檬酸循环、酪氨酸和谷胱甘肽代谢,从而抑制了细胞凋亡、香叶醇降解、多糖、丙烷、哌啶和吡啶生物碱的生物合成。
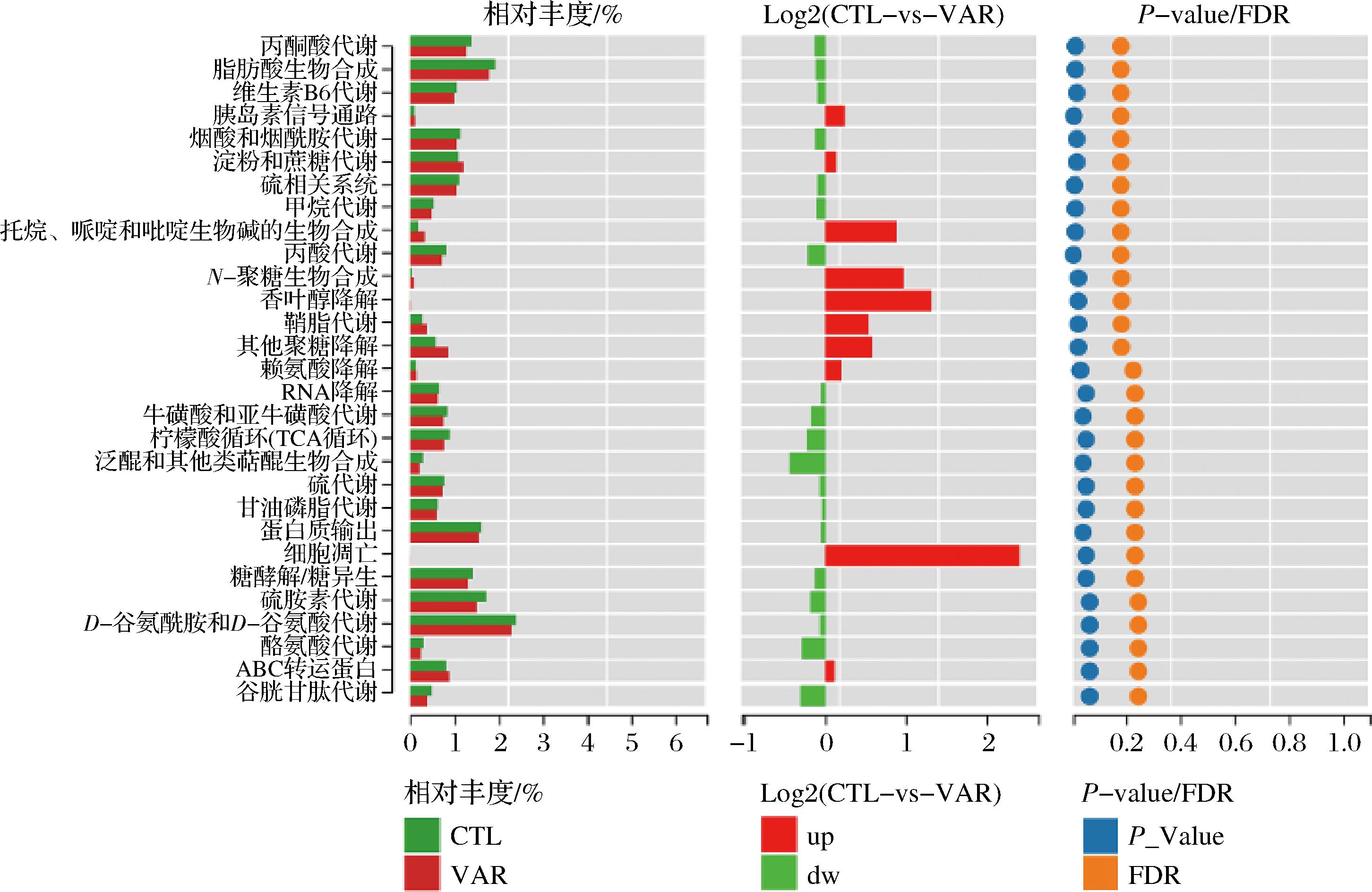
图6 基于小鼠肠道微生物的功能预测分析
Fig.6 Functional prediction analysis based on mice gut microbiota
2.2.5 镇江香醋对正常小鼠肠道菌群代谢的影响
对小鼠盲肠内容物进行广泛代谢组学分析,如图7所示,基于OPLS-DA分析,两组间明显分离,与对照组相比VAR组小鼠体内代谢物质发生改变,又由火山图可以看出VAR组小鼠盲肠代谢物中抗坏血酸类和肾上腺素类物质含量提高3.14倍、异亮氨酸含量提高2.78倍、尿胆素含量提高4.34倍,而葡萄糖基磷酸含量显著降低。
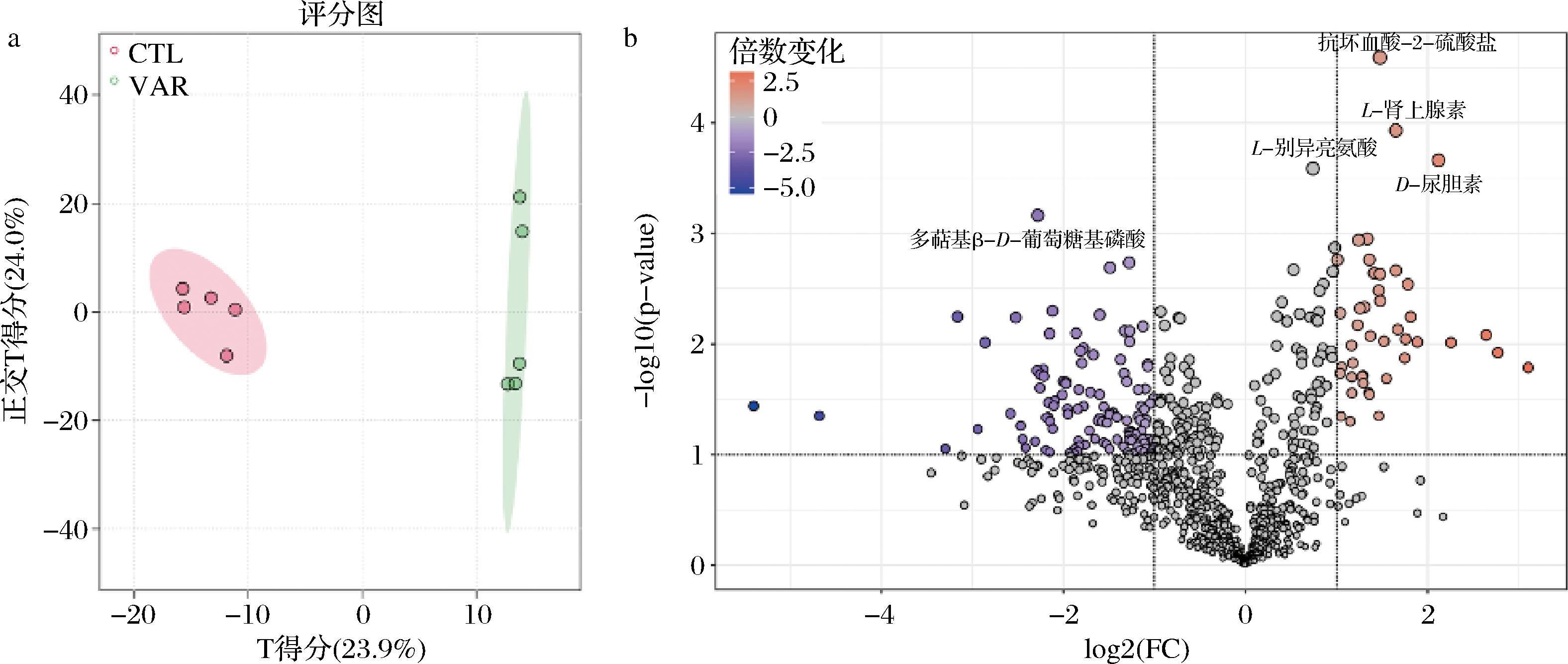
a-OPLS-DA图;b-火山图
图7 代谢物OPLS-DA及火山图
Fig.7 Metabolite OPLS-DA and volcanic map
2.2.6 KEGG通路富集分析
通过对差异代谢物进行代谢组-KEGG富集分析,利用代谢通路气泡图来展示VAR组小鼠显著富集的代谢通路,如图8所示甘油磷脂代谢、色氨酸代谢、柠檬酸循环、嘌呤代谢和嘧啶代谢(P<0.05)是显著富集的代谢通路,甘油磷脂是机体含量最多的一类磷脂,它除了构成生物膜外,还是胆汁和膜表面活性物质等的成分之一,并参与细胞膜对蛋白质的识别和信号转导[19]。色氨酸是人体必需氨基酸,也是正常细胞稳态所必需的,其代谢物可充当神经递质和信号分子[20],在一些文献报道中被发现色氨酸及其代谢物支持中枢和肠神经系统的发育,且色氨酸代谢物的失调在许多神经和精神疾病的发病机制中起着核心作用[21]。柠檬酸循环是机体最重要的几个循环途径之一[22]。嘌呤和嘧啶代谢是机体内非常复杂的生物化学过程,它们直接影响着细胞内信号传导、DNA和RNA的合成,与多种疾病的发生发展密切相关,对于维持机体健康具有重要意义。
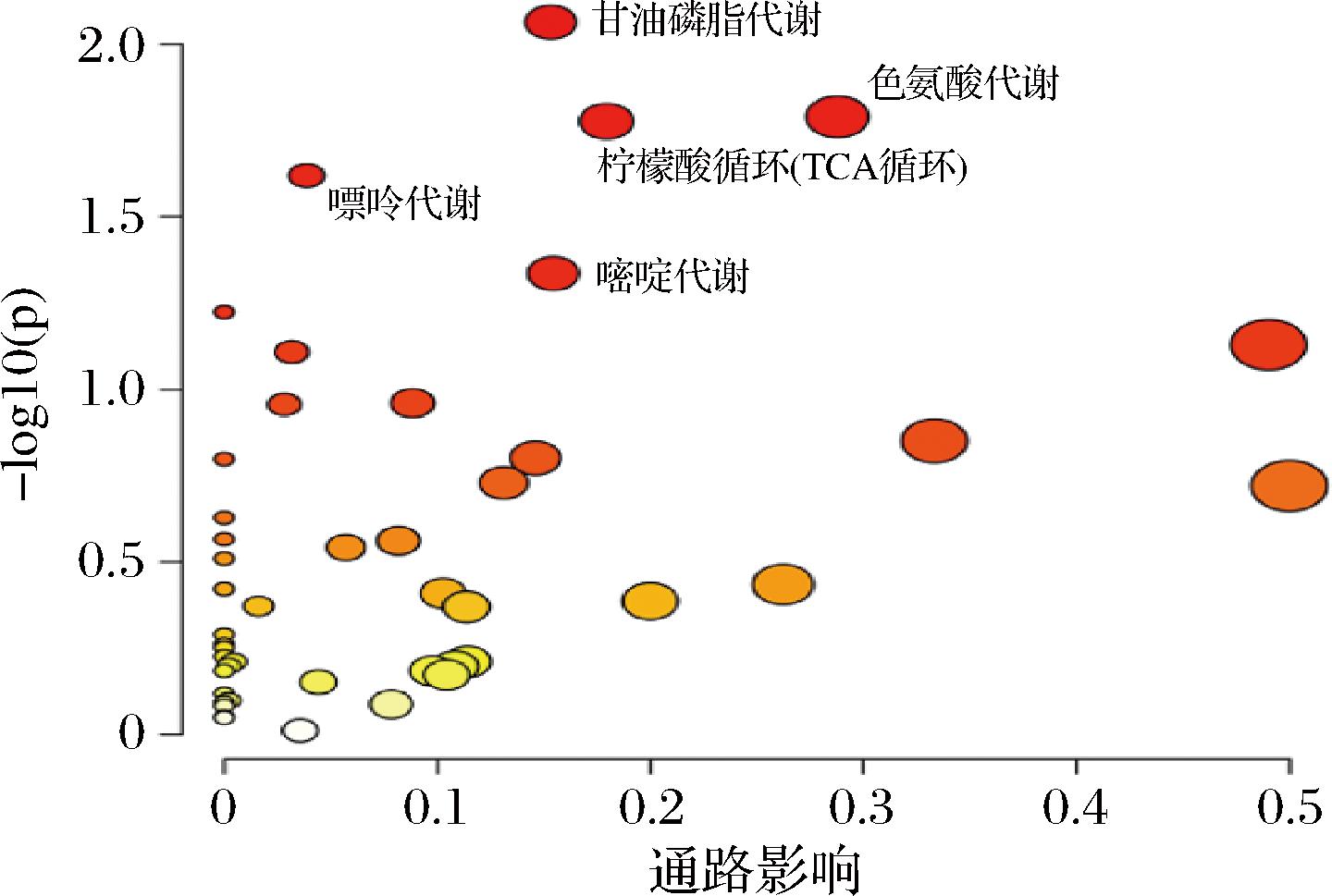
图8 KEGG通路富集分析
Fig.8 Enrichment analysis of metabolite KEGG pathway
3 结论与讨论
实验结果表明,与对照组相比,经过4周VAR灌胃处理后,VAR组小鼠体重指标明显增加,结合广泛代谢组学分析结果推测可能是食用VAR后促进机体内的物质循环与能量流动。在检测小鼠血清学指标后发现VAR组小鼠高密度脂蛋白显著升高,又经过16S rRNA基因测序分析,发现VAR组小鼠体内OTU数目总量增加,肠道菌群多样性更为丰富,其物种组成与对照组相比在属水平上Desulfovibrio显著降低, Akkermansia和Lachnospiraceae_NK4A136显著增高,后两者被广泛认同为肠道有益菌群。进一步通过LEfSe分析和LDA可知VAR组Lachnospiraceae、Bacteroidales、Oscillospiraceae显著增加,Lachnospiraceae是维持肠道内稳态的重要微生物,Oscillospirace能够产生丁酸盐等短链脂肪酸,而丁酸盐是筛选“下一代益生菌”的重要参考指标,该菌也被列为下一代益生菌的候选者[23]。在功能预测方面,VAR促进了柠檬酸循环、酪氨酸和谷胱甘肽代谢,柠檬酸循环是体内糖类、脂类、氨基酸代谢联系的枢纽,酪氨酸和谷胱甘肽对于维持人体正常生命活动具有重要作用[24]。为了探究肠道菌群对于小鼠体内代谢物质的影响,通过广泛代谢组学分析结果发现,与对照组相比VAR组小鼠体内代谢物质发生显著变化,代谢物质富集在甘油磷脂代谢、色氨酸代谢、柠檬酸循环、嘌呤和嘧啶代谢通路上,它们对于维持人体正常能量循环与生命健康具有重要意义[25]。本研究利用16S rRNA基因测序结合代谢组学技术手段,研究表明VAR可调节正常小鼠肠道菌群,促进了有益菌及其代谢物质的产生,为VAR发挥健康益处及相关功能性食品的研发提供了科学依据。
[1] LU Z M, WANG Z M, ZHANG X J, et al.Microbial ecology of cereal vinegar fermentation:Insights for driving the ecosystem function[J].Current Opinion in Biotechnology, 2018, 49:88-93.
[2] DUAN W H, XIA T, ZHANG B, et al.Changes of physicochemical, bioactive compounds and antioxidant capacity during the brewing process of Zhenjiang aromatic vinegar[J].Molecules, 2019, 24(21):3935.
[3] 任晓荣, 王宏霞, 孙晓琪, 等.不同陈酿年份镇江香醋品质指标和功能成分的比较[J].中国酿造, 2023, 42(5):85-90.
REN X R, WANG H X, SUN X Q, et al.Comparison of quality indexes and functional components of Zhenjiang aromatic vinegar with different aging years[J].China Brewing, 2023, 42(5):85-90.
[4] 沈志远. 镇江香醋的营养保健和药用功能研究[J].食品科学, 2005, 26(8):483-485.
SHEN Z Y.Research on Zhenjiang vinegar’s health and medical value[J].Food Science, 2005, 26(8):483-485.
[5] XIA T, DUAN W H, ZHANG Z J, et al.Polyphenol-rich extract of Zhenjiang aromatic vinegar ameliorates high glucose-induced insulin resistance by regulating JNK-IRS-1 and PI3K/Akt signaling pathways[J].Food Chemistry, 2021, 335:127513.
[6] XIA T, DUAN W H, ZHANG Z J, et al.Polyphenol-rich vinegar extract regulates intestinal microbiota and immunity and prevents alcohol-induced inflammation in mice[J].Food Research International, 2021, 140:110064.
[7] 朱淑云, 杨靖, 邵锋, 等.镇江香醋对非酒精性脂肪肝病小鼠的保护作用及机制[J].中国食品学报, 2020, 20(10):16-22.
ZHU S Y, YANG J, SHAO F, et al.Protective effect and mechanism of Zhenjiang aromatic vinegar on nonalcoholic fatty liver disease in mice[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(10):16-22.
[8] PERLER B K, FRIEDMAN E S, WU G D.The role of the gut microbiota in the relationship between diet and human health[J].Annual Review of Physiology, 2023, 85:449-468.
[9] BARRATT M J, LEBRILLA C, SHAPIRO H Y, et al.The gut microbiota, food science, and human nutrition:A timely marriage[J].Cell Host &Microbe, 2017, 22(2):134-141.
[10] WASTYK H C, FRAGIADAKIS G K, PERELMAN D, et al.Gut-microbiota-targeted diets modulate human immune status[J].Cell, 2021, 184(16):4137-4153.e14.
[11] ZHENG F J, ZHAO X J, ZENG Z D, et al.Development of a plasma pseudotargeted metabolomics method based on ultra-high-performance liquid chromatography-mass spectrometry[J].Nature Protocols, 2020, 15(8):2519-2537.
[12] XIA J G, WISHART D S.Web-based inference of biological patterns, functions and pathways from metabolomic data using MetaboAnalyst[J].Nature Protocols, 2011, 6(6):743-760.
[13] VON ECKARDSTEIN A, NORDESTGAARD B G, REMALEY A T, et al.High-density lipoprotein revisited:Biological functions and clinical relevance[J].European Heart Journal, 2023, 44(16):1394-1407.
[14] CHEN G L, ZHENG F J, LIN B, et al.Vinegar:A potential source of healthy and functional food with special reference to sugarcane vinegar[J].Frontiers in Nutrition, 2023, 10:1145862.
[15] SINGH S B, CARROLL-PORTILLO A, LIN H C.Desulfovibrio in the gut:The enemy within?[J].Microorganisms, 2023, 11(7):1772.
[16] RODRIGUES V F, ELIAS-OLIVEIRA J, PEREIRA  S, et al.Akkermansia muciniphila and gut immune system:A good friendship that attenuates inflammatory bowel disease, obesity, and diabetes[J].Frontiers in Immunology, 2022, 13:934695.
S, et al.Akkermansia muciniphila and gut immune system:A good friendship that attenuates inflammatory bowel disease, obesity, and diabetes[J].Frontiers in Immunology, 2022, 13:934695.
[17] ZHAO Q X, YU J D, HAO Y, et al.Akkermansia muciniphila plays critical roles in host health[J].Critical Reviews in Microbiology, 2023, 49(1):82-100.
[18] LIN X Q, HU T Y, WU Z N, et al.Isolation of potentially novel species expands the genomic and functional diversity of Lachnospiraceae[J].iMeta, 2024, 3(2):e174.
[19] PETRENKO V, SINTUREL F, RIEZMAN H, et al.Lipid metabolism around the body clocks[J].Progress in Lipid Research, 2023, 91:101235.
[20] XUE C, LI G L, ZHENG Q X, et al.Tryptophan metabolism in health and disease[J].Cell Metabolism, 2023, 35(8):1304-1326.
[21] ROTH W, ZADEH K, VEKARIYA R, et al.Tryptophan metabolism and gut-brain homeostasis[J].International Journal of Molecular Sciences, 2021, 22(6):2973.
[22] MART NEZ-REYES I, CHANDEL N S.Mitochondrial TCA cycle metabolites control physiology and disease[J].Nature Communications, 2020, 11(1):102.
NEZ-REYES I, CHANDEL N S.Mitochondrial TCA cycle metabolites control physiology and disease[J].Nature Communications, 2020, 11(1):102.
[23] VILLASE OR-ARANGUREN M, ROSÉS C, RIEZU-BOJ J I, et al.Association of the gut microbiota with the host’s health through an analysis of biochemical markers, dietary estimation, and microbial composition[J].Nutrients, 2022, 14(23):4966.
OR-ARANGUREN M, ROSÉS C, RIEZU-BOJ J I, et al.Association of the gut microbiota with the host’s health through an analysis of biochemical markers, dietary estimation, and microbial composition[J].Nutrients, 2022, 14(23):4966.
[24] MINICH D M, BROWN B I.A review of dietary (Phyto)nutrients for glutathione support[J].Nutrients, 2019, 11(9):2073.
[25] NASSOGNE M C, MARIE S, DEWULF J P.Neurological presentations of inborn errors of purine and pyrimidine metabolism[J].European Journal of Paediatric Neurology, 2024, 48:69-77.