5-羟基戊酸(5-hydroxyvaleric acid,5-HV)是一种重要的五碳平台化学品,一端含有羟基,另一端含有羧基,具有双官能团结构。近年来,5-HV成为制药行业中受到重视的药物合成中间体,在多种药物的合成过程中可以作为碳骨架或增加药物的生物相容性[1]。含有5-HV单体的聚羟基烷酸具有优异的材料性能和生物降解性[2]。将5-HV的羟基氧化为羧基可得到1,5-戊二酸,用于生产聚合物如聚酯、聚酰胺等,对降低聚合物弹性十分有用;将其羧基还原为羟基可得到1,5-戊二醇,用于聚酯合成或增塑剂[3]。
化学法合成5-HV,需要以石油资源为原料,合成过程大多需要高温、高压等苛刻的条件和昂贵的催化剂,需要加氢,有副产物,收率低,很难进行规模化生产。SUN等[4]报道了2-呋喃甲酸在负载型铂催化剂上氢解合成5-HV。也可通过戊二酸氢化生成1,5-戊二醇,在反应中形成5-HV中间体[5]。目前,生物法合成5-HV的研究较少,大多是在代谢工程改造微生物生产其他产品时,作为中间体被发现,如5-HV是5-氨基戊酸经氨基戊酸梭菌(Clostridium aminovalericum)降解为多元酸和氨时的代谢中间体[6]。
代谢工程改造微生物生产化学品往往需要添加IPTG作为诱导剂,该化合物具有一定的毒性,可对大肠杆菌宿主造成损害[7],IPTG由于潜在的毒性,只作为实验室用于少量蛋白表达时的诱导剂,不被各国药典提倡使用[8],在医疗材料等方面的应用上可能存在隐患。同时IPTG的价格较为昂贵,在大规模发酵中导致生产成本的增加[9]。大肠杆菌的醛还原酶YqhD是生物法生产5-HV的关键限速酶[10],它是一种NADPH依赖的醛还原酶,是大肠杆菌中主要的醛还原酶[11],具有广泛的底物谱,如3-羟基丙醛、丙醛、异丁醛、丙烯醛和丙二醛[12]。yqhC基因是其转录激活子,yqhC与yqhD基因的启动子区域结合,参与相关醛的还原[13]。yqhD通过yqhD-dkgA操纵子表达,该操纵子由转录调控因子yqhC诱导[14]。研究表明yqhC对yqhD具有调节作用,yqhC有益突变可以使得yqhD表达量增加[15]。在生物法生产酸性化学品时,为了维持中性的pH使得微生物生长不受影响,发酵过程中需要流加大量碱液,给后续的纯化带来不利影响,并产生大量高盐废水[16]。而维持发酵液低pH环境还有助于抑制杂菌污染[17]。耐酸工业生产菌株可以有效地降低发酵生产成本,减少生产过程和污染物排放量,具有重要产业意义,合成耐酸菌株是许多生物技术应用的理想表型[18]。大肠杆菌23%的基因表达直接或间接受RpoS调控[19],耐酸性主要也由因子RpoS控制。有研究发现,非编码小RNA(sRNAs)、DsrA、RprA和ArcZ(翻译RpoS激活剂)同时过表达,在活性细胞生长过程中增加了高达8 500倍的耐酸性(基于低pH生存实验)[20]。同时,DsrA可在伴侣蛋白Hfq的辅助下,激活RpoS翻译,从而提高下游酸压力相关基因的表达,从而增强菌株的酸耐受性[21]。DsrA等sRNAs可作用于RpoS的mRNA,进而激活抗酸相关基因的转录,以提高大肠杆菌的酸耐受性。有研究表明同时过表达DsrA和sRNA伴侣Hfq作为RpoS激活剂,能显著提高细胞在适度酸性pH下的生长耐酸能力,以及在极端酸休克下的细胞存活率[22]。
本实验室前期通过对5-HV生物合成途径的关键酶进行挖掘和优化、过表达底物输送蛋白以及引入hok/sok系统等代谢工程策略,构建的工程菌可以生产35.6 g/L的5-HV[10]。本研究将进一步构建无需IPTG诱导的5-HV合成菌株,并过表达转录激活子yqhC基因提高菌株产5-HV的能力。在此基础上,将Hfq-DsrA抗酸元件引入底盘细胞,期望能够在低pH环境下无诱导、高效合成5-HV。
1 材料与方法
1.1 菌株和引物
本研究中采用Escherichia coli BL21用于DNA片段扩增、质粒构建和质粒保存,E.coli W3110用于代谢工程改造生产5-HV。本研究使用的菌株及质粒如表1所示。
表1 本研究中使用的菌株及质粒
Table 1 Strains and plasmids used in this study

菌株描述来源E.coli BL21wild typeTaKaRaE.coli W3110wild type上海保藏生物技术中心pSTVpSTV28-Plac-davBA-gabT-lysP-yqhD-gabP-hoksok本实验室pCDFpCDF-Trc-yajo-hoksok本实验室5HV0E.coli W3110 harboring pSTV and pCDF本实验室5HV1E.coli W3110 harboring pSTV and pCDF-ΔLacIΔLacO本研究5HV2E.coli W3110 harboring pSTV-yqhc and pCDF-ΔLacIΔLacO本研究5HV3E.coli W3110 harboring pSTV-yqhc and pCDF-ΔLacIΔLacO-dsra-hfq本研究
本实验中均使用高保真DNA聚合酶扩增DNA片段,购自上海捷瑞生物工程有限公司。本研究中所有引物均由上海生工生物工程股份有限公司合成,部分引物如表2所示。PCR采用Proflex PCR系统(Thermo Fisher Scientific, Waltham, MA, USA)。
表2 本研究中所用引物
Table 2 Primers used in this study

引物名称引物序列(5′-3′)pCDF-DI-FGGAGAGCGTCGAGATCCCGGCGCAACGCAATTAATGTAAGTTAGCTCACTCATTAGGCpCDF-DI-RTACATTAATTGCGTTGCGCCGGGATCTCGACGCTCTCCCTTATGCGACTCCTGCATTAGpCDF-DO-FGCTCGTATAATGTGTGGAAAGCTTCGCCCTTGAAGGAGACGACGATGCAGTACGTAAAGpCDF-DO-RCTCCTTCAAGGGCGAAGCTTTCCACACATTATACGAGCCGGATGATTAATTGTCAACAGyqhc-gene-FAACGATAAGAAATAAGGTATTGCTGTACCGGGAACGTATTTAATTCCCCTGCATCGCCCyqhc-gene-RACTTGCTCCCTTTGCTGGGCCAATATGAGGGCAGAGAACGATCTGCCTGATGTTTTTCpSTV-yqhc-line-FTTCTCTGCCCTCATATTGGCCCAGCAAAGGGAGCAAGTAATGAACAACTTTAATCTGCpSTV-yqhc-line-RTACGTTCCCGGTACAGCAATACCTTATTTCTTATCGTTCTGCGGGAACTTCATTTCGCdsra-gene-FGGTCACCGGCTTCAAGTAGCATAGTCGCGCAGTACTCCTCTTACCAGGATGATTCTCdsra-gene-RATTATGCGGCCGCAAGCTTCATACATGGCGTGAATTGGCGGATGCCTTCGAACTGGpCDF-dsra-line-FCCAATTCACGCCATGTATGAAGCTTGCGGCCGCATAATGCTTAAGTCGAACAGAAAGpCDF-dsra-line-RGGAGTACTGCGCGACTATGCTACTTGAAGCCGGTGACCGCGTGGGGAACGTAAGGGGCChfq-gene-FCCAATTCACGCCATGTATGGGATCCCACTGTTAGTGGGCGGTACGATGTTGTATTTChfq-gene-RATTATGCGGCCGCAAGCTTCGTGTAAAAAAACAGCCCGAAACCTTATTCGGTTTCTTCGpCDF-dsra-hfq-line-FCGGGCTGTTTTTTTACACGAAGCTTGCGGCCGCATAATGCTTAAGTCGAACAGAAAGpCDF-dsra-hfq-line-RCCCACTAACAGTGGGATCCCATACATGGCGTGAATTGGCGGATGCCTTCGAACTGG
1.2 培养基
种子培养基(g/L):KH2PO4 4,MgSO4·7H2O 0.5,(NH4)2SO4 4.5,酵母粉5,蛋白胨8,蔗糖3,121 ℃ 灭菌20 min,使用时根据需要加入适量相应的抗生素。
摇瓶发酵培养基(g/L):MgSO4·7H2O 1.6,FeSO4·7H2O 0.032,MnSO4·H2O 0.032,(NH4)2SO4 11,KCl 0.5,玉米浆0.8,CaCO3 7,葡萄糖40,121 ℃灭菌20 min,使用时根据需要加入适量相应的抗生素。
发酵罐培养基:向6 000 mL蒸馏水中加入9.6 g MgSO4·7H2O、0.192 g FeSO4·7H2O、0.192 g MnSO4·H2O、66 g (NH4)2SO4、3 g KCl、200 g葡萄糖、156 g玉米浆,溶解后加入10 L发酵罐中,121 ℃灭菌20 min备用。
1.3 仪器与设备
FUS-10 L生物反应器,国强生物工程设备有限公司;UV1900紫外分光光度计、GC2010 Pro气相色谱仪,岛津企业管理(中国)有限公司。
1.4 培养方法
1.4.1 摇瓶发酵培养
将E.coli W3110的单个新鲜菌落接种于含有种子培养基的500 mL摇瓶中,摇瓶装液量50 mL,摇瓶种子的培养温度37 ℃,旋转式摇床转速为170 r/min,培养8 h。将种子液按照2%接种量接种至含有发酵培养基的500 mL摇瓶中,发酵摇瓶装液量50 mL,初始发酵温度37 ℃,18 h后改为30 ℃,旋转式摇床转速为200 r/min。对于需要诱导的菌株,当培养物的菌浓度(OD600值)达到0.6~0.8时,加入终浓度为0.5 mmol/L的IPTG,摇瓶培养3 d,每24 h取样检测菌体生长情况和产物浓度。
1.4.2 发酵罐培养
采用10 L生物反应器进行主发酵。将单个新鲜菌落接种于含有50 mL种子培养基的500 mL摇瓶中,37 ℃、170 r/min培养10 h,然后将50 mL培养液接种至含有6 L发酵罐培养基的10 L生物反应器中。发酵过程中,通风量控制在0.4 vvm,罐压控制在0.05~0.08 MPa。通过加入30%(质量分数)的NaOH水溶液,将pH维持在初始6.7。发酵过程中搅拌速度为400 r/min,随着溶解氧的减少,提高搅拌速度,使其保持在20%~40%,温度设为37 ℃。18 h后温度调整至30 ℃,发酵过程中维持发酵液的pH为6.0。发酵过程中流加50%的葡萄糖溶液,使得发酵液中的葡萄糖(质量分数)为1%~1.5%。
1.5 分析方法
采用紫外分光光度计测量600 nm(OD600值)的吸光度来监测细菌生长。采用DNS比色法测定培养液中葡萄糖的浓度,具体为将一定量的发酵液稀释,与3,5-二硝基水杨酸在沸水浴中反应,在520 nm处测定吸光度,测定葡萄糖的浓度[23]。采用比色法测定培养液中赖氨酸盐酸盐的浓度,具体为将一定量的发酵液稀释,与茚三酮在沸水浴中反应,在475 nm处测定吸光度,测定赖氨酸盐酸盐的浓度[24]。发酵液中5-HV的含量使用气相色谱法测定,具体为取适量发酵液离心得上清液。进样口温度280 ℃,N2流速2.6 mL/min。自动进样,进样量0.5 μL,进样比30∶1,FID探测器温度设定为300 ℃,空气流量400 mL/min,N2流速25 mL/min,H2流速30 mL/min。柱温程序设置如下:初始温度50 ℃,保持5 min,然后升至210 ℃,保持5 min,色谱柱型为Wondacap-5(30 m×0.25 mm×0.25 μm)。
2 结果与分析
2.1 构建无需IPTG诱导的5-HV生产菌株及其发酵温度优化
2.1.1 构建无需IPTG诱导的5-HV生产菌株
当不添加诱导剂时,LacI基因编码阻遏蛋白,与启动子上的操纵基因LacO结合,阻碍转录[25]。本实验室保藏的5-HV生产菌株5HV0含有质粒pSTV28-Plac-davBA-gabT-lysP-yqhD-gabP-hoksok和pCDF-Trc-yajo-hoksok,其中pSTV质粒为非诱导型,pCDF质粒为诱导型质粒。利用反向PCR技术扩增出不含LacI和LacO基因的线性化pCDF质粒,通过同源重组重新连接,并转化至E.coli W3110中,构建菌株5HV1。由于大肠杆菌最适生长温度为37 ℃,而IPTG诱导的适宜温度为30 ℃,本研究分别考察5HV1菌株在30 ℃ 和37 ℃发酵产5-HV的情况,对照菌株5HV0在初始37 ℃生长,添加IPTG后,将摇瓶培养温度调整为30 ℃。
如图1-a所示,删除LacI和LacO基因后的菌株仍然能够生产5-HV,但产量有所降低,从对照的(8.48±0.13) g/L降低至(5.99±0.19) g/L。当发酵过程温度始终保持37 ℃时, 5-HV的滴度达到(6.42±0.28) g/L,高于发酵过程温度始终保持30 ℃ 的5-HV滴度。由图1-b可知,5HV1(37 ℃)在发酵前期菌体生长阶段OD600值略高于5HV0菌株,这可能是由于5HV0添加了诱导剂,使得菌体生长受到影响,此结果与文献一致[7],而5HV1(30 ℃)的初期菌体浓度较低,说明培养温度为30 ℃不利于5HV1的生长。
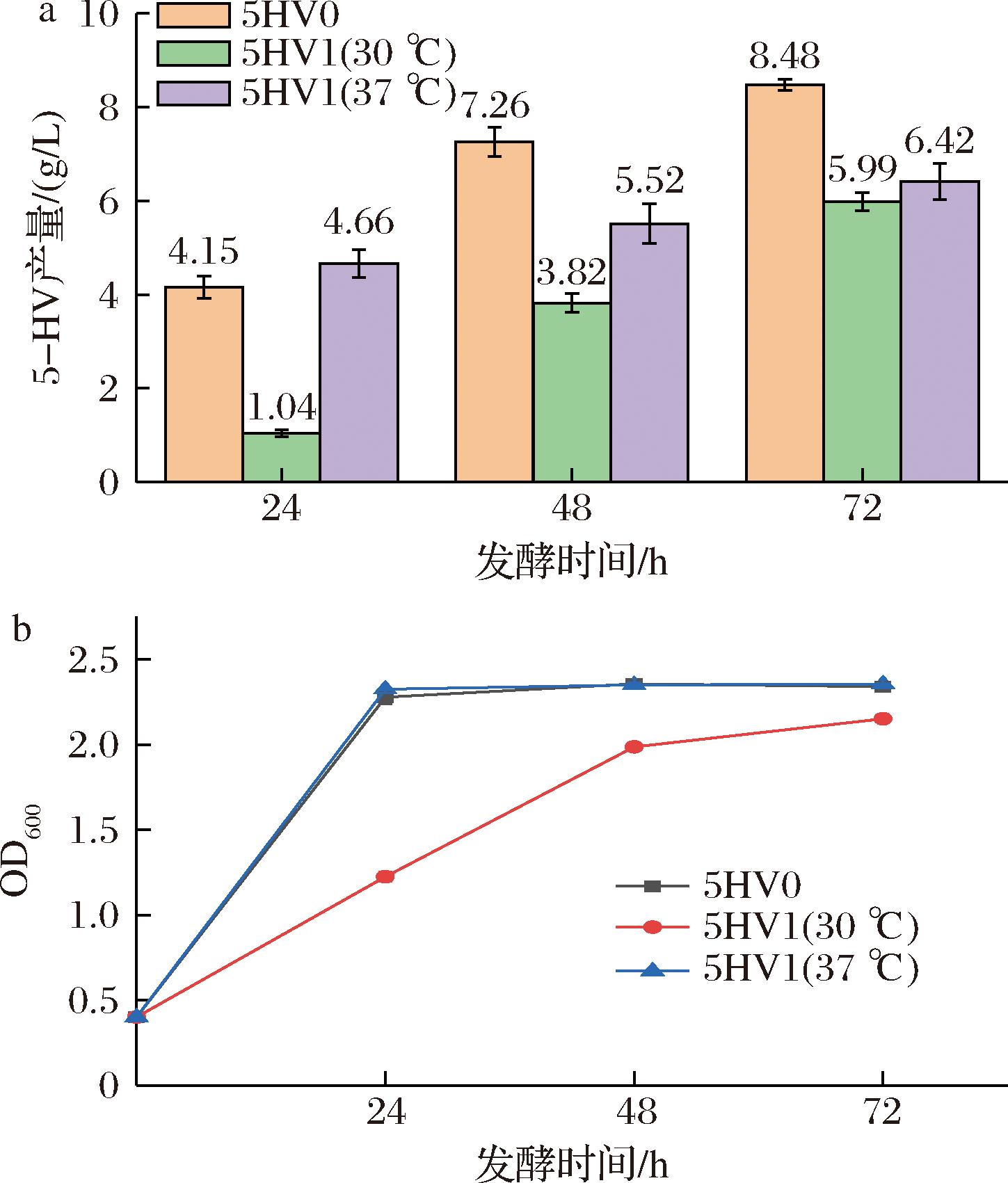
a-发酵温度对5-HV合成的影响;b-发酵温度对菌株生长的影响
图1 不同重组菌的5-HV摇瓶发酵结果对比
Fig.1 Comparison of 5-HV shake flask fermentation by different recombinant bacteria
2.1.2 摇瓶发酵温度优化
有研究表明,发酵的初始阶段保持较高的温度可以促进大肠杆菌的快速生长和早期产物积累,而在发酵后期降低温度可以减少副产物的形成并延长细胞活力,从而提高最终产量[26]。据此为5HV1设计了2种不同的温度方案:a)发酵初期温度为37 ℃,生长8 h后将温度调至30 ℃;b)发酵初期温度为37 ℃,生长18 h后将温度调至30 ℃。以5HV0作对照组比较产量和菌体量。5HV0为需要诱导的菌株,接种后生长3~4 h,当OD600值为0.6~0.8时,添加IPTG,并将发酵温度从37 ℃调节至30 ℃。
如图2-a所示,5-HV产量最高的温度控制方案为方案b,5-HV产量达(9.70±0.27) g/L,方案a的5-HV产量为(9.04±0.39) g/L。如图2-b所示,发酵温度为37 ℃下培养8 h和18 h时,菌体都生长良好。考虑到不同发酵温度下菌株的5-HV生产能力,选择发酵温度37 ℃下生长18 h后,再调节至30 ℃继续发酵的方案。
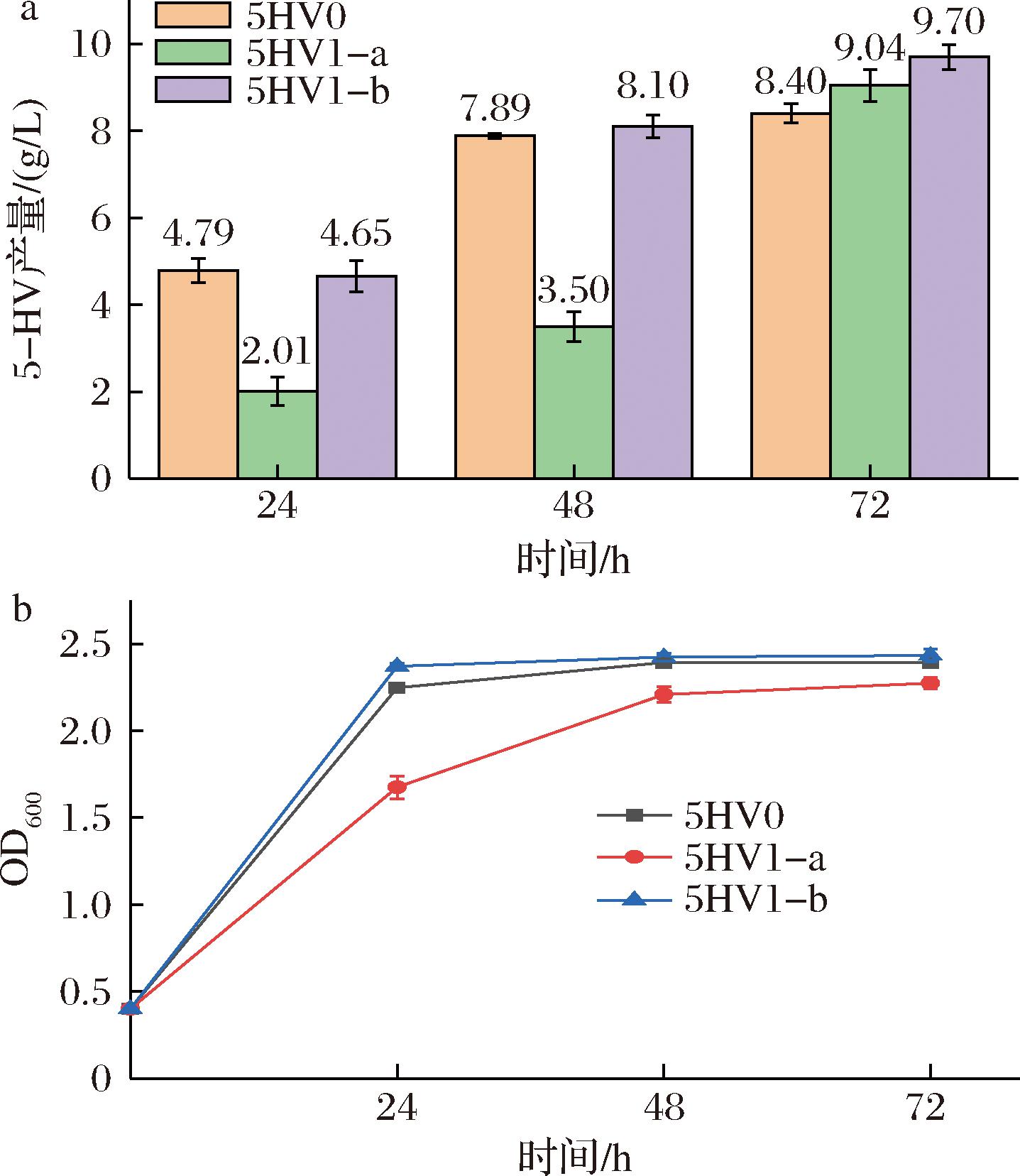
a-发酵温度对5HV1合成5-HV的影响;b-发酵温度对5HV1生长的影响
图2 重组菌5HV1的摇瓶发酵温度优化
Fig.2 Optimization of shake flask fermentation temperature of the recombinant bacterium 5HV1
2.2 过表达醛还原酶YqhD转录激活子yqhC对5-HV产量的影响
醛还原酶是5-HV的关键酶,其活性和表达量影响5-HV的合成效率,本研究通过引入对应的转录激活子进一步提高产量。在大肠杆菌基因组中,yqhC基因与yqhD基因相邻。通过查找E.coli W3110中对应的yqhC基因的序列(KEGG JW5849),通过PCR扩增该基因序列及后续间隔序列,目的是连接到质粒中时维持其与yqhD天然的原始间隔序列。将扩增的序列通过同源重组技术连接至pSTV质粒中,该质粒还连接了davB、davA、gabT、lysP、yqhD、gabP、hoksok基因,插入yqhC基因的位置为yqhD之前,lysP之后,经测序验证质粒中yqhC、yqhD及二者之间的间隔序列与E.coli W3110基因组一致。将改造后的质粒转化至5HV1中,构建重组菌株5HV2。
以菌株5HV2进行5-HV摇瓶发酵实验,对照组为5HV1菌株。发酵过程中的温度方案为2.1.2节中的方案b,发酵过程中不添加诱导剂。如图3所示,菌株5HV2的5-HV产量提升至(12.11±0.21) g/L。转录激活子yqhC基因能够激活醛还原酶的yqhD基因的表达,显著提升5-HV的产量。
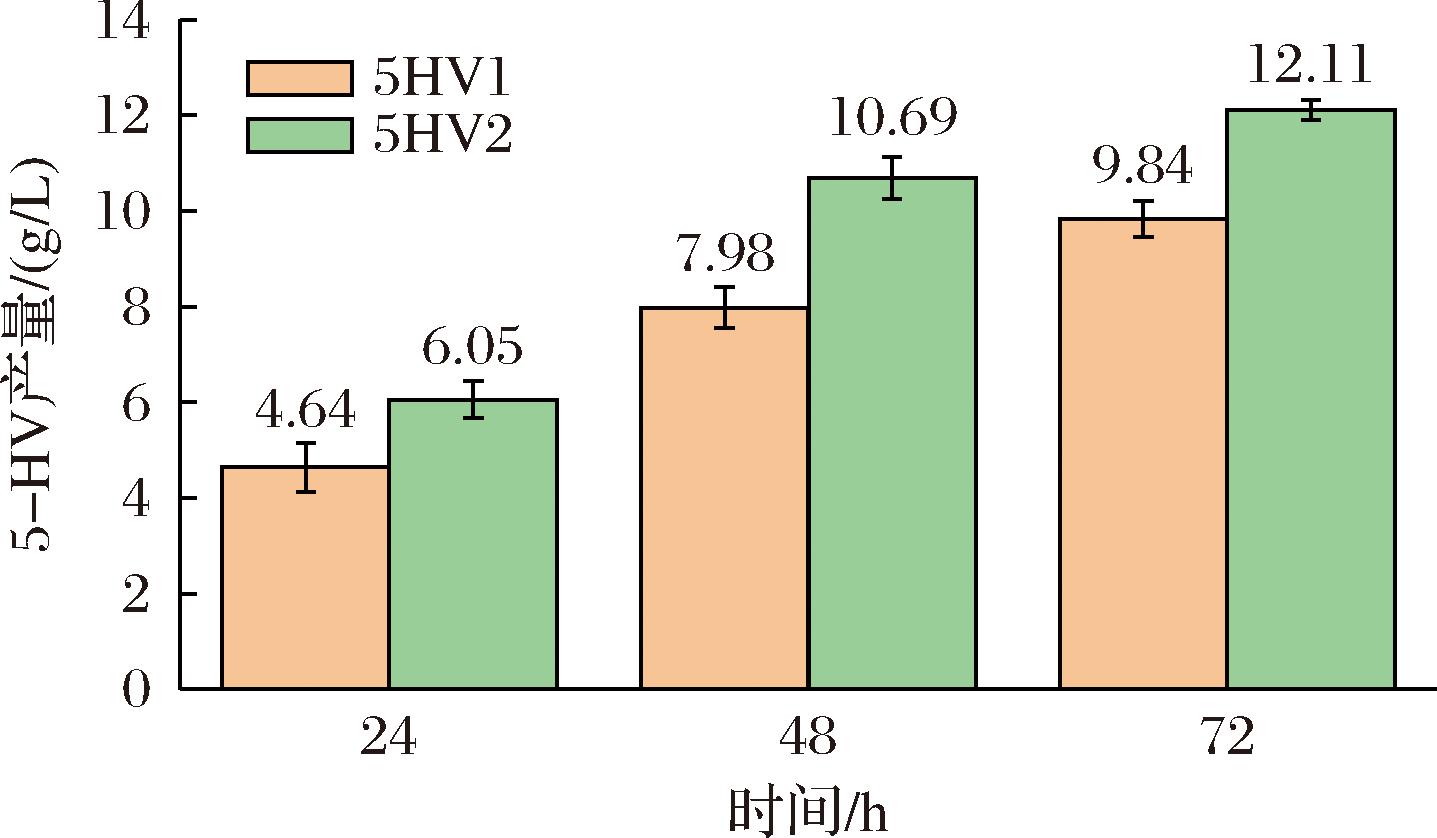
图3 转录激活子yqhC对5-HV合成的影响
Fig.3 Effect of the transcriptional activator yqhCon 5-HV synthesis
2.3 引入抗酸元件,低pH发酵生产5-HV
本研究从E.coli W3110中基因组扩增dsrA基因(KEGG JWR0036)和hfq基因(KEGG JW4130),通过同源重组连接至2.1.1节中构建的pCDF-ΔLacIΔLacO质粒上,插入基因的位置为hoksok基因之后,插入的顺序为dsrA基因在前,hfq基因在后。将重组质粒转化至5HV2菌株中,得到重组菌5HV3,并进行摇瓶发酵,对照组为5HV2菌株,发酵温度方案为2.1.2节中最优的方案b,发酵过程中不添加诱导剂,考察5HV3产5-HV的能力。摇瓶结果如图4所示,最终5-HV的滴度达到(12.24±0.51) g/L,与5HV2产量无明显差异,这表明此抗酸元件对5-HV的产量无不利影响。
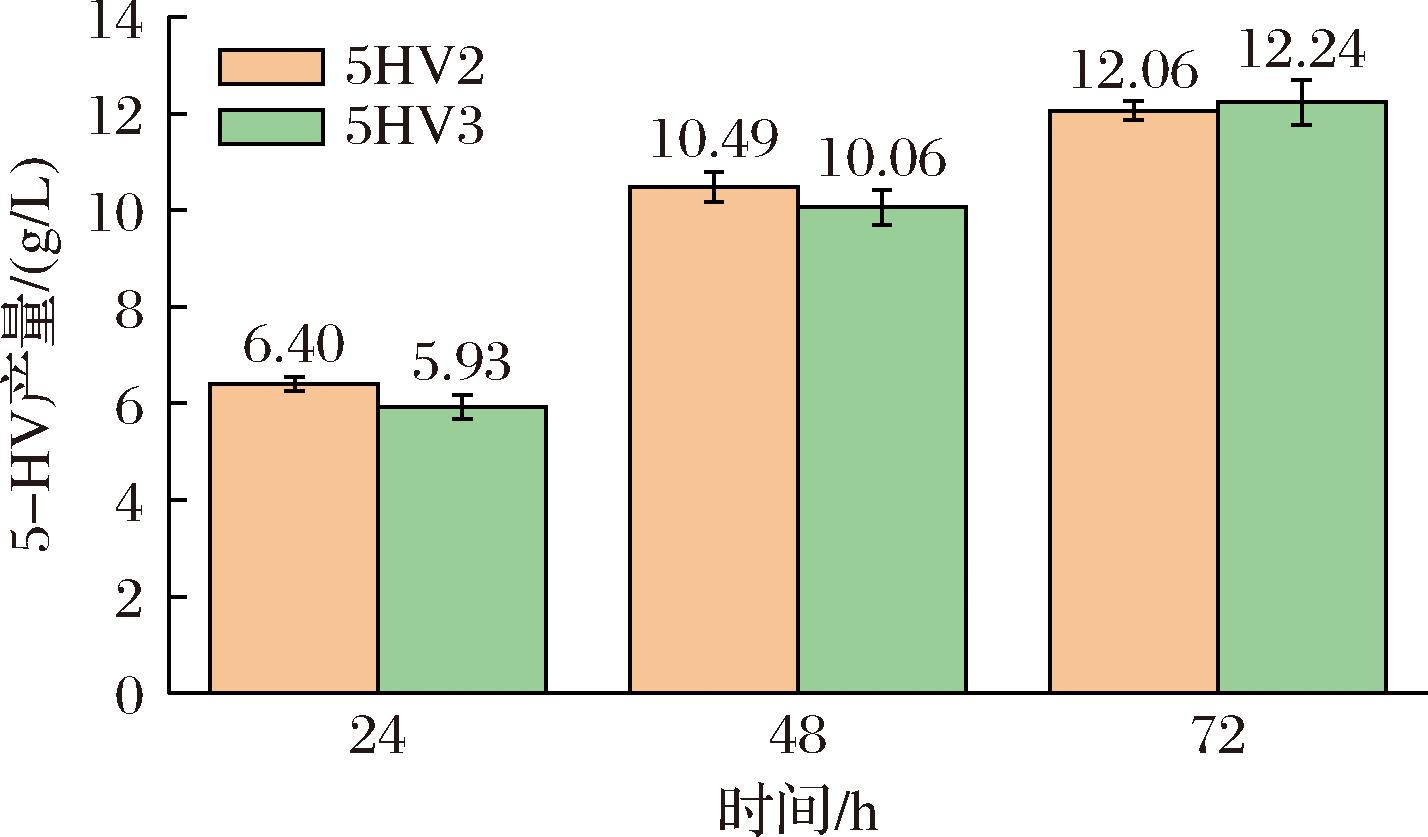
图4 抗酸元件对5-HV合成的影响
Fig.4 Effect of antacid components on 5-HV synthesis
为了进一步考察5HV3在酸性环境下生产5-HV的能力,本研究在10 L发酵罐水平上,将发酵起始pH值调节为6.7,当发酵18 h时,暂停流加碱液,待pH随着菌体生长和产酸逐渐降低至6.0后,继续自动流加碱液控制pH为6.0。发酵温度前18 h控制为37 ℃,18 h后控制温度为30 ℃,直至发酵结束。发酵过程中每3 h取样检测1次。对照组使用5HV2菌株,在10 L发酵罐水平上,通过自动流加碱液全程控制发酵液的pH值为6.7,其他发酵参数的控制与实验组相同。发酵过程中菌体浓度(OD600值)、葡萄糖、中间物赖氨酸(Lys)和产物的浓度如图5-a、图5-b所示:2个菌株在发酵过程中的菌体生长情况相似,25 h左右,OD600值最高均达到12~13左右;随着发酵的进行,中间体Lys浓度逐渐升高,发酵进行到70 h,菌株5HV3的5-HV的产量达到47.5 g/L,糖酸转化率达到42%,对照组5HV2菌株的5-HV产量为46.6 g/L,糖酸转化率为40%。如图5-c所示,使用5HV3菌株,当发酵进行到18 h左右,由于发酵液中的葡萄糖含量低,溶氧开始反弹,使得发酵液pH反弹到7.6左右,随着葡萄糖的流加,pH逐渐降低,通过流加30%的碱液将发酵液的pH值控制在6.0,至发酵结束共补加了120 g碱液,对照组整个发酵过程补充了220 g碱液(图5-d)。与5HV2菌株相比,5HV3菌株节约碱液45%。
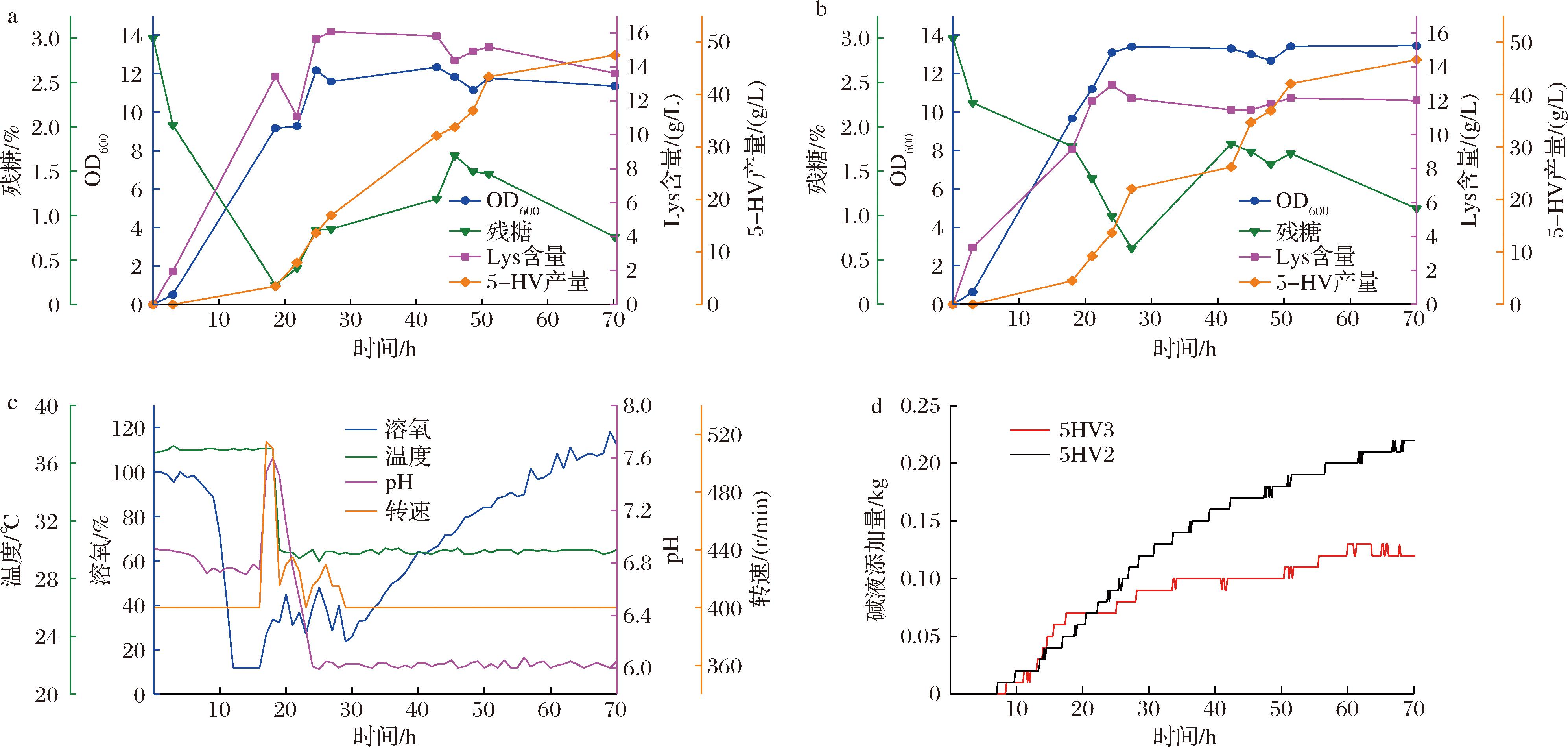
a-5HV3菌株在10 L发酵过程中葡萄糖、中间体Lys和产物的浓度变化;b-5HV2菌株在10 L发酵过程中葡萄糖、中间体Lys和产物的浓度变化;c-5HV3菌株在10 L发酵罐的发酵实时参数;d-使用5HV3菌株和5HV2菌株的发酵过程碱液添加量对比
图5 重组菌5HV3在酸性环境下的5-HV的发酵曲线
Fig.5 Time profile of 5-HV fermentation by the recombinant bacterium 5HV3 under acidic condition
3 结论与讨论
5-HV作为一种重要的化合物,受石油原料及化学工艺限制,难以通过化学法大规模生产。生物法生产化学品往往需要添加诱导剂、酸碱中和剂,成本高,纯化过程复杂,并带来诱导剂残留安全性、工业高盐废水排放等环境问题,本研究通过删除乳糖操纵子的LacI和LacO等相关元件,构建了无需IPTG诱导的5-HV菌株。在摇瓶水平上,优化了无需诱导的工程菌株发酵产5-HV的发酵温度,5-HV的滴度达到(9.70±0.27) g/L。本研究通过引入醛还原酶的转录激活子yqhC,使得5-HV的产量进一步提高到(12.11±0.21) g/L。为减少发酵过程中碱液的用量,本研究在菌株中引入抗酸元件Hfq-DsrA,并在10 L发酵罐上,考察其在低pH环境下产5-HV的能力。最终,发酵进行70 h,5-HV的产量达到47.5 g/L,节约碱液45%。本研究较好地解决了生物法生产化学品需要添加诱导剂和酸碱中和剂所涉及的成本、环境安全性等问题,为生物法5-HV的规模化生产奠定了良好的基础。
[1] L PEZ N I, PETTINARI M J, NIKEL P I, et al.Polyhydroxyalkanoates:Much more than biodegradable plastics[J].Advances in Applied Microbiology, 2015, 93:73-106.
PEZ N I, PETTINARI M J, NIKEL P I, et al.Polyhydroxyalkanoates:Much more than biodegradable plastics[J].Advances in Applied Microbiology, 2015, 93:73-106.
[2] LI Z B, YANG J, LOH X J.Polyhydroxyalkanoates:Opening doors for a sustainable future[J].NPG Asia Materials, 2016, 8(4):e265.
[3] 孙乾辉, 郑路凡, 杜泽学, 等.一种制备5-羟基戊酸的方法:中国, CN112441911B[P].2019-08-28.SUN Q H, ZHENG L F, DU Z X, et al.A method for preparing 5-hydroxyvaleric acid:China, CN112441911B[P].2019-08-28.
[4] SUN Q H, WANG S, LIU H C.Selective hydrogenolysis of α-C-O bond in biomass-derived 2-furancarboxylic acid to 5-hydroxyvaleric acid on supported Pt catalysts at near-ambient temperature[J].ACS Catalysis, 2019, 9(12):11413-11425.
[5] TAKEDA Y, TAMURA M, NAKAGAWA Y, et al.Hydrogenation of dicarboxylic acids to diols over Re-Pd catalysts[J].Catalysis Science &Technology, 2016, 6(14):5668-5683.
[6] BARKER H A, D’ARI L, KAHN J.Enzymatic reactions in the degradation of 5-aminovalerate by Clostridium aminovalericum[J].Journal of Biological Chemistry, 1987, 262(19):8994-9003.
[7] DVORAK P, CHRAST L, NIKEL P I, et al.Exacerbation of substrate toxicity by IPTG in Escherichia coli BL21(DE3) carrying a synthetic metabolic pathway[J].Microbial Cell Factories, 2015, 14:201.
[8] 唐梅, 蔡松, 杨东成, 等.不依赖IPTG诱导产木糖醇大肠杆菌工程菌的构建[J].中国酿造, 2021, 40(9):173-179.TANG M, CAI S, YANG D C, et al.Construction of IPTG-inducing independent engineered Escherichia coli for xylitol production[J].China Brewing, 2021, 40(9):173-179.
[9] 高润香, 蔡侠, 姚宏伟.一种强化羟脯氨酸合成的质粒及其构建和应用:中国, CN111378678B[P].2023-08-18.GAO R X, CAI X, YAO H W.A plasmid for enhancing hydroxyproline synthesis and its construction and application:China, CN111378678B[P].2023-08-18.
[10] CHEN C, WANG T T, YE P, et al.Metabolic engineering of Escherichia coli for the efficient production of 5-hydroxyvaleric acid[J].Process Biochemistry, 2023, 130:625-633.
[11] JARBOE L R.YqhD:A broad-substrate range aldehyde reductase with various applications in production of biorenewable fuels and chemicals[J].Applied Microbiology and Biotechnology, 2011, 89(2):249-257.
[12] VERMA R, ELLIS J M, MITCHELL-KOCH K R.Dynamic preference for NADP/H cofactor binding/release in E.coli YqhD oxidoreductase[J].Molecules, 2021, 26(2):270.
[13] LEE C H, KIM I, LEE J, et al.Transcriptional activation of the aldehyde reductase YqhD by YqhC and its implication in glyoxal metabolism of Escherichia coli K-12[J].Journal of Bacteriology, 2010, 192(16):4205-4214.
[14] FRAZ O C R, MATON V, FRANÇOIS J M, et al.Development of a metabolite sensor for high-throughput detection of aldehydes in Escherichia coli[J].Frontiers in Bioengineering and Biotechnology, 2018, 6:118.
O C R, MATON V, FRANÇOIS J M, et al.Development of a metabolite sensor for high-throughput detection of aldehydes in Escherichia coli[J].Frontiers in Bioengineering and Biotechnology, 2018, 6:118.
[15] MERCHEL PIOVESAN PEREIRA B, ADIL SALIM M, RAI N, et al.Tolerance to glutaraldehyde in Escherichia coli mediated by overexpression of the aldehyde reductase YqhD by YqhC[J].Frontiers in Microbiology, 2021, 12:680553.
[16] 林章凛, 林敏.微生物和植物抗逆元器件的合成生物学研究[J].生物产业技术, 2013(4):7-11.LIN Z L, LIN M.Studies on synthetic biology of microbial and plant stress-resistant components[J].Biotechnology &Business, 2013(4):7-11.
[17] 郝小明, 陈博, 安泰.工业微生物酸胁迫的耐受机制及改造途径[J].生物工程学报, 2015, 31(8):1151-1161.HAO X M, CHEN B, AN T.Pathway modification of industrial microorganisms to improve acid-stress tolerance[J].Chinese Journal of Biotechnology, 2015, 31(8):1151-1161.
[18] GAO X X, YANG X F, LI J H, et al.Engineered global regulator H-NS improves the acid tolerance of E.coli[J].Microbial Cell Factories, 2018, 17(1):118.
[19] WONG G T, BONOCORA R P, SCHEP A N, et al.Genome-wide transcriptional response to varying RpoS levels in Escherichia coli K-12[J].Journal of Bacteriology, 2017, 199(7):e00755-16.
[20] GAIDA S M, AL-HINAI M A, INDURTHI D C, et al.Synthetic tolerance:Three noncoding small RNAs, DsrA, ArcZ and RprA, acting supra-additively against acid stress[J].Nucleic Acids Research, 2013, 41(18):8726-8737.
[21] 李嘉慧. DsrA-Hfq抗酸模块的进化及其提高大肠杆菌酸耐受性的研究[D].广州:华南理工大学, 2020.LI J H.Evolution of DsrA-Hfq acid-resistant module and its improvement of acid tolerance of Escherichia coli[D].Guangzhou:South China University of Technology, 2020.
[22] LIN Z L, LI J H, YAN X F, et al.Engineering of the small noncoding RNA (sRNA) DsrA together with the sRNA chaperone hfq enhances the acid tolerance of Escherichia coli[J].Applied and Environmental Microbiology, 2021, 87(10):e02923-20.
[23] 赵凯, 许鹏举, 谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学, 2008(8):534-536.ZHAO K, XU P J, GU G Y.Study on determination of reducing sugar content using 3, 5-dinitrosalicylic acid method[J].Food Science, 2008(8):534-536.
[24] 全红丽. 茚三酮分光光度法分析赖氨酸硫酸盐中L-赖氨酸含量的研究[D].北京:北京化工大学, 2015.QUAN H L.Ninhydrin spectrophotometry determination of lysine content of lysine-sulfate research[D].Beijing:Beijing University of Chemical Technology, 2015.
[25] 罗晓婷, 许春鹃, 谢富华.生物化学与分子生物学[M].北京:化学工业出版社, 2019.LUO X T, XU C J, XIE F H.Biochemistry and Molecular Biology[M].Beijing:Chemical Industry Press, 2019.
[26] WU Z J, CHEN T P, SUN W J, et al.Optimizing Escherichia coli strains and fermentation processes for enhanced L-lysine production:A review[J].Frontiers in Microbiology, 2024, 15:1485624.