米糠是稻谷加工过程中附加值较高的副产物,年产量约为1 600万t,占稻谷总质量的8%[1]。其营养丰富,含有稻谷中约64%的营养成分,包括蛋白质、脂肪、碳水化合物、膳食纤维等常量物质,以及γ-氨基丁酸(γ-aminobutyric acid,GABA)、谷维素、生育酚、花青素葡萄糖苷、没食子酸和角鲨烯等多种生物活性成分,可作为原料开发米糠油、米糠蛋白和植酸等高价值产品[2-3]。然而,米糠脂类含量高、易发生氧化酸败,导致其在加工与贮运过程中稳定性差,风味与营养成分易受破坏;同时,其所含植酸、胰蛋白酶抑制剂等抗营养因子及水溶性差和口感粗糙等问题,制约了其高值化利用[4]。当前,米糠资源正朝着多元化和高附加值方向发展,广泛应用于食品、保健品及化妆品中。日本通过稳定化处理提取米糠油,并开发了米糠蛋白和膳食纤维功能食品;美国则更注重提取其功能活性成分,用于营养补充剂与天然防腐剂;印度、泰国等主产国虽仍以饲料或肥料用途为主,但近年来也开始探索其在生物燃料和生物质能源领域的转化应用;此外,多个国家正在推动其在可降解包装材料等新兴领域的应用[5-11]。然而,高技术门槛与较低的产业化水平,仍制约着米糠资源价值的充分释放与产业链的延伸升级。
GABA是一种天然存在的非蛋白质氨基酸,广泛分布于动物、植物及微生物体内。作为中枢神经系统中的重要神经递质,GABA不仅可调节神经活动、改善睡眠、缓解焦虑与增强记忆,还具有降血压、延缓衰老、增强免疫力以及辅助控制血糖等多种代谢功能[12-14]。米糠作为功能性食品原料,其GABA天然含量约为30~50 mg/100 g,显著高于白米[15]。通过特定温湿条件下的发芽处理或微生物发酵等生物转化技术,可有效激活其内源性谷氨酸脱羧酶活性,将谷氨酸高效转化为GABA,从而有效提高其含量。相比其他方法,微生物发酵因其绿色、高效、可控性强,成为米糠GABA富集的有效手段。乳酸菌、霉菌、酵母及芽孢杆菌等多种微生物均可用于GABA的生产[16]。LAI等[17]采用短乳杆菌发酵脱脂米糠提取物,使GABA含量达6.11 mg/mL;KIM等[18]采用植物乳植杆菌KCTC 3103在改性米糠培养基中开展两步液体发酵,使GABA产量最高达0.67 g/L。前期研究发现,发酵粘液乳杆菌和解淀粉芽孢杆菌均能有效促进脱脂米糠中GABA的富集。解淀粉芽孢杆菌不仅具备合成GABA的潜力,其分泌高活性的α-淀粉酶和蛋白酶,可有效降解米糠中的淀粉及蛋白质[19-21]。
目前,GABA的常规生产多采用单一菌株或复合菌株进行液态发酵,而对复合菌株在固态发酵体系中的协同机制研究相对较少。相比单一菌株,双菌复合发酵可通过优势互补实现底物高效降解与代谢产物的协同富集,具有更高的资源转化效率和功能提升潜力。尤其是以米糠为主要底物的复合固态发酵模式,其相关研究仍较为有限。本研究首次构建并优化了发酵粘液乳杆菌与解淀粉芽孢杆菌组成的复合菌株固态发酵体系,基于双菌代谢互补机制,提升谷氨酸供给及脱羧效率,以实现GABA的高效富集,并系统评估其对米糠降血糖与抗氧化活性的协同增强作用。
1 材料与方法
1.1 材料与试剂
脱脂米糠,河南四维生物技术有限公司,具体成分见表1。
表1 脱脂米糠成分 单位:%
Table 1 Composition of defatted rice bran
成分粗蛋白粗脂肪灰分水分总碳水化合物含量14.34±0.141.30±0.009.85±0.076.48±0.2468.03±0.50
发酵粘液乳杆菌(Limosilactobacillus fermentum ASAG,CCTCC编号M20242832)与解淀粉芽孢杆菌(Bacillus amyloliquefaciens ASAG,CCTCC编号M20242831),中国典型培养物保藏中心。
酵母提取物、胰蛋白胨、脱脂奶粉,英国Oxoid公司;MRS肉汤,北京奥博星生物技术有限责任公司;GABA标准品(≥98%)、玉米浆干粉、NaClO、山梨醇,北京索莱宝科技有限公司;α-淀粉酶、血管紧张素转换酶,上海麦克林生化科技股份有限公司;α-葡萄糖苷酶,上海源叶生物科技有限公司;其余试剂均为分析纯。
1.2 仪器与设备
ISF1-X恒温恒湿摇床,瑞士阿道夫科耐公司;DRP-9162恒温培养箱,上海森信实验仪器有限公司;Synergy HIMF酶标仪,美国伯腾仪器有限公司;5424高速冷冻离心机,德国Eppendorf有限公司;热场发射扫描电子显微镜,日本电子株式会社;LGJ-12真空冷冻干燥机,北京松源华兴科技发展有限公司;Nicolet iN10-i Z10傅里叶变换显微红外光谱仪,赛默飞世尔科技(中国)有限公司。
1.3 实验方法
1.3.1 菌株活化与种子液的制备
将冻存于-80 ℃冰箱的发酵粘液乳杆菌和解淀粉芽孢杆菌分别划线接种于固体MRS培养基(MRS粉末67.3 g/L,琼脂粉20.0 g/L)和固体LB培养基(胰蛋白胨10.0 g/L,NaCl 10.0 g/L,酵母提取物5.0 g/L,琼脂粉20.0 g/L)上,分别于37 ℃和30 ℃条件下培养至菌落形成。随后,挑取单个菌落分别接种于对应的MRS或LB液体培养基中进行预培养:发酵粘液乳杆菌于37 ℃静置培养,解淀粉芽孢杆菌于30 ℃、200 r/min 培养12 h后以相同条件传代活化2次。将活化后的菌液以5%(体积分数)的接种量接入50 mL相应液体培养基中,于相同培养条件下培养10 h,所得菌液浓度约为1010 CFU/mL,用于后续固态发酵接种。
1.3.2 发酵米糠的制备
称取50.0 g脱脂米糠于罐头瓶中,115 ℃灭菌25 min。按固液比1∶0.5(g∶mL)向灭菌后的米糠中加入25 mL菌液,搅拌均匀,30 ℃发酵7 d,得发酵脱脂米糠。
1.3.3 发酵条件优化的单因素试验设计
将种子液接入脱脂米糠中恒温发酵,以发酵前后脱脂米糠中GABA产量为指标,考察菌株配比、发酵时间及不同添加成分对脱脂米糠的影响,单因素试验设计如下:
1)分别将浓度约为1010 CFU/mL的发酵粘液乳杆菌与解淀粉芽孢杆菌以不同体积比(1∶0、1∶9、3∶7、5∶5、7∶3、9∶1、0∶1,下同)接入脱脂米糠,于30 ℃下发酵7 d,测定各处理条件下发酵产物中GABA含量;
2)在优化菌株配比条件下,于30 ℃恒温发酵,设定发酵时间为1、3、5、7、9、11 d,分别取样测定各阶段脱脂米糠中GABA产量;
3)在最佳菌株配比条件下,分别添加1%(质量分数)胰蛋白胨、酵母提取物、玉米浆干粉、脱脂奶粉、NH4Cl和(NH4)2SO4,比较其对GABA产量的影响;进一步以胰蛋白胨为氮源,考察其不同添加量0.5%、1%、1.5%、2%、2.5%(质量分数,下同)对GABA产量的影响。
4)在最佳氮源条件下,分别向发酵体系中添加1%(质量分数,下同)的L-谷氨酸、L-谷氨酸钠、磷酸吡哆醛、CaCO3和CaCl2,比较各添加物对GABA产量的影响;以L-谷氨酸钠为变量,设置添加量为0.5%、1%、1.5%、2%、2.5%(质量分数,下同),优化其添加水平。
1.3.4 发酵条件优化的响应面试验设计
根据单因素试验的筛选结果,采用Box-Behnken设计,以GABA产量(Y)为响应值,选择乳酸菌菌液占比(A)、胰蛋白胨添加量(B)、谷氨酸钠添加量(C)为自变量,优化米糠的发酵条件,因素与水平见表2。
表2 Box-Behnken设计因素水平表
Table 2 Box-Behnken design of factors and levels
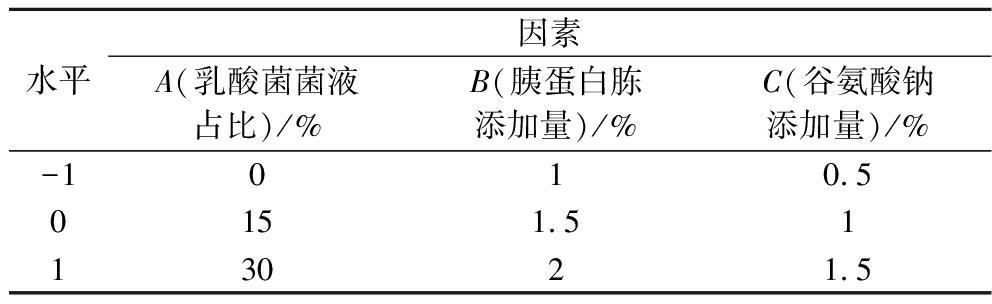
水平因素A(乳酸菌菌液占比)/%B(胰蛋白胨添加量)/%C(谷氨酸钠添加量)/%-1010.50151.5113021.5
1.3.5 微观结构观察
将少量冷冻干燥后的米糠样品用导电固体胶均匀分散固定后进行喷金处理,表面朝上置于电镜载物台,分别放大1 000倍和5 000倍对样品进行微观结构观察。
1.3.6 检测方法
待测样品制备:称取米糠样品2 g,加入6 mL去离子水,涡旋均匀,超声波提取30 min,4 000 r/min离心15 min,保留上清液待测。
GABA含量:取样品待测液1 mL,依次加入0.2 mol/L的硼酸缓冲液(pH 9)1 mL,6%(质量分数)的苯酚溶液2 mL,5.25%(质量分数)的NaClO溶液1 mL,充分振荡后在沸水浴中反应10 min,随即在冰浴中冷却20 min,待出现蓝绿色后加入60%(体积分数)乙醇2 mL,在630 nm处测定吸光度[22]。根据GABA标准曲线计算GABA含量。
α-淀粉酶活性抑制率:将200 μL待测溶液与200 μL淀粉酶溶液(2 U/mL)混合,37 ℃反应10 min。向混合液中加入200 μL、1%(质量分数)的淀粉溶液反应15 min并与1.2 mL 3,5-二硝基水杨酸混合,沸水浴5 min,快速冷却后于540 nm处测定吸光度。α-淀粉酶活性抑制率按公式(1)计算[23]:
α-淀粉酶活性抑制率![]()
(1)
式中:A1,待测溶液吸光度;A2,PBS代替淀粉酶吸光度;A0,PBS代替样液吸光度。
α-葡萄糖苷酶活性抑制率:将0.5 mL待测溶液与0.5 mL葡萄糖苷酶溶液(2 U/mL)混合,37 ℃反应10 min。向混合液中加入0.5 mL、1 mmol/L 对硝基苯基-β-D-吡喃葡萄糖苷。反应15 min后与2 mL 1 mol/L 的Na2CO3溶液混合,沸水浴5 min,快速冷却后于405 nm处测定吸光度。α-葡萄糖苷酶活性抑制率按公式(2)计算[23]:
α-葡萄糖苷酶活性抑制率![]()
(2)
式中:A1,待测溶液吸光度;A2,PBS代替葡萄糖苷酶吸光度;A0,PBS代替样液吸光度。
DPPH自由基清除率:取1 mL样液,加入0.02 mmol/L 的DPPH-乙醇溶液1 mL,充分混匀,室温下避光反应30 min,4 000 r/min离心10 min,取上清液在517 nm处测定其吸光度。DPPH自由基清除率按公式(3)计算[23]:
DPPH自由基清除率![]()
(3)
式中:A1,待测溶液吸光度;A2,无水乙醇代替DPPH-乙醇溶液吸光度;A0,PBS代替样液吸光度。
超氧阴离子(·O2-)自由基清除率:在离心管中加入2 mL 150 mmol/L的Tris-HCl(pH 8.20)缓冲液,再分别加入0.6 mL样液,混合均匀后于25 ℃恒温预热10 min;之后加入0.4 mL 1.2 mmol/L的邻苯三酚溶液(25 ℃预热),充分混匀后将所有离心管置于25 ℃恒温水浴20 min;最后加入1 mL 10 mmol/L HCI终止反应。在3 500 r/min条件下离心10 min,取上清液在325 nm处测定其吸光度。·O2-自由基清除率按公式(4)计算[24]:
·O2-自由基清除率![]()
(4)
式中:A1,待测溶液吸光度;A2,PBS代替邻苯三酚吸光度;A0,PBS代替样液吸光度。
1.4 数据分析
所有实验均进行3次独立重复,并以“平均值±标准差”表示结果数据。差异显著性分析采用单因素方差分析(one-way ANOVA),并结合Duncan多重比较检验法评估不同处理组间的显著性差异。统计分析使用SPSS 22软件完成。
2 结果与分析
2.1 发酵条件优化
2.1.1 菌株配比对米糠发酵中GABA产量的影响
脱脂米糠原料中GABA含量为(0.37±0.01) g/L,接种不同比例菌株发酵后,GABA产量发生变化(图1-a)。与单一菌株发酵相比,混合接种均显著提升GABA产量(P<0.05),其中发酵粘液乳杆菌与解淀粉芽孢杆菌按1∶9体积比接种时产量最高,达(1.46±0.03) g/L;而5∶5体积比接种时产量最低,仅为(1.22±0.03) g/L。当解淀粉芽孢杆菌占主导时,其分泌的水解酶可持续降解底物,释放谷氨酸,为GABA合成提供底物;同时,适量乳杆菌产酸或许有助于维持谷氨酸脱羧酶的最适pH区间,协同促进GABA积累。等比例接种时菌群竞争增强,可能引起体系波动,抑制产酶效率。若发酵粘液乳杆菌占主导,虽酸性环境可能抑制芽孢杆菌活性,但其本身具备GABA合成能力,产量仍高于等比例接种。

a-菌株配比;b-发酵时间;c-氮源;d-胰蛋白胨添加量;e-其他成分;f-谷氨酸钠添加量
图1 复合菌株脱脂米糠发酵单因素优化
Fig.1 Single-factor optimization of defatted rice bran fermentation by compound strains
注:图c、图e中CK为不添加外源成分的脱脂米糠;不同小写字母表示差异显著(P<0.05)(下同)。
2.1.2 发酵时间对发酵米糠中GABA产量的影响
GABA产量随发酵时间延长呈先升高后降低趋势,于5 d达到峰值(1.42±0.01) g/L(图1-b)。前期微生物活跃生长,发酵粘液乳杆菌产酸致pH下降,激活谷氨酸脱羧酶,促进GABA合成[25]。发酵时间超过5 d后,底物中营养物质逐渐耗尽,谷氨酸等前体释放减少,部分GABA被进一步代谢,导致产量下降。发酵9 d后,微生物进入衰亡期,代谢减缓,GABA含量趋于稳定。
2.1.3 氮源对发酵米糠中GABA产量的影响
氮源不仅是微生物合成核酸与蛋白质的基本原料,也在GABA等含氮代谢产物的合成中发挥调控作用。图1-c显示,4种有机氮源中,胰蛋白胨促进GABA合成效果最佳,产量达(2.12±0.17) g/L,较空白组提升44.81%。胰蛋白胨富含谷氨酸和短肽,为GABA合成提供底物。相比之下,无机氮源作用较弱,其中NH4Cl可快速供氮,促进生长但效果有限,(NH4)2SO4中![]() 可能对菌体不利,抑制产物积累[26]。综合判断,胰蛋白胨为最适氮源。在优化添加量时,GABA产量随胰蛋白胨含量增加而上升,1.5%时达到峰值(3.11±0.07) g/L(图1-d)。超过1.5%后产量趋于稳定,推测为酶活性饱和限制了底物转化,最终确定1.5%为最优添加水平。
可能对菌体不利,抑制产物积累[26]。综合判断,胰蛋白胨为最适氮源。在优化添加量时,GABA产量随胰蛋白胨含量增加而上升,1.5%时达到峰值(3.11±0.07) g/L(图1-d)。超过1.5%后产量趋于稳定,推测为酶活性饱和限制了底物转化,最终确定1.5%为最优添加水平。
2.1.4 其他成分对米糠发酵中GABA产量的影响
除主要因子外,本研究还考察了辅助成分对GABA产量的影响(图1-e)。Ca2+被认为可通过上调GABA代谢通路中关键酶基因的表达以提高其合成量[27]。然而本研究中添加CaCl2与CaCO3均未显著提升GABA产量(P>0.05)。谷氨酸及其钠盐为GABA合成的直接前体,其中谷氨酸钠因具有缓冲作用,可延缓发酵体系酸化进程、延长谷氨酸脱羧酶表达期,其添加后GABA产量最高达(4.36±0.04) g/L。磷酸吡哆醛虽为谷氨酸脱羧反应所需辅酶,但在本研究中未显著提升GABA产量(P>0.05),推测为体系酶活性已饱和[28]。进一步优化谷氨酸钠添加量发现,随添加量升高,GABA产量呈先升后降趋势;1%时产量最高,为(4.31±0.15) g/L,优于其他添加量(图1-f)。适量添加有助于提高底物脱羧效率,但过量则可能因渗透障碍或毒性抑制菌体生长,从而降低产物积累,因此确定1%为最优添加水平[29]。
2.1.5 响应面优化
在单因素试验基础上,以GABA产量为响应值,采用Box-Behnken法建立二次回归模型:
Y=4.39+0.026 7A+0.201 3B-0.083 9C-0.093 3AB+0.128 6AC-0.197 5BC-0.179 7A2-0.653 3B2-0.209 0C2(表4)
表4 响应面设计与试验结果
Table 4 Response surface design and results
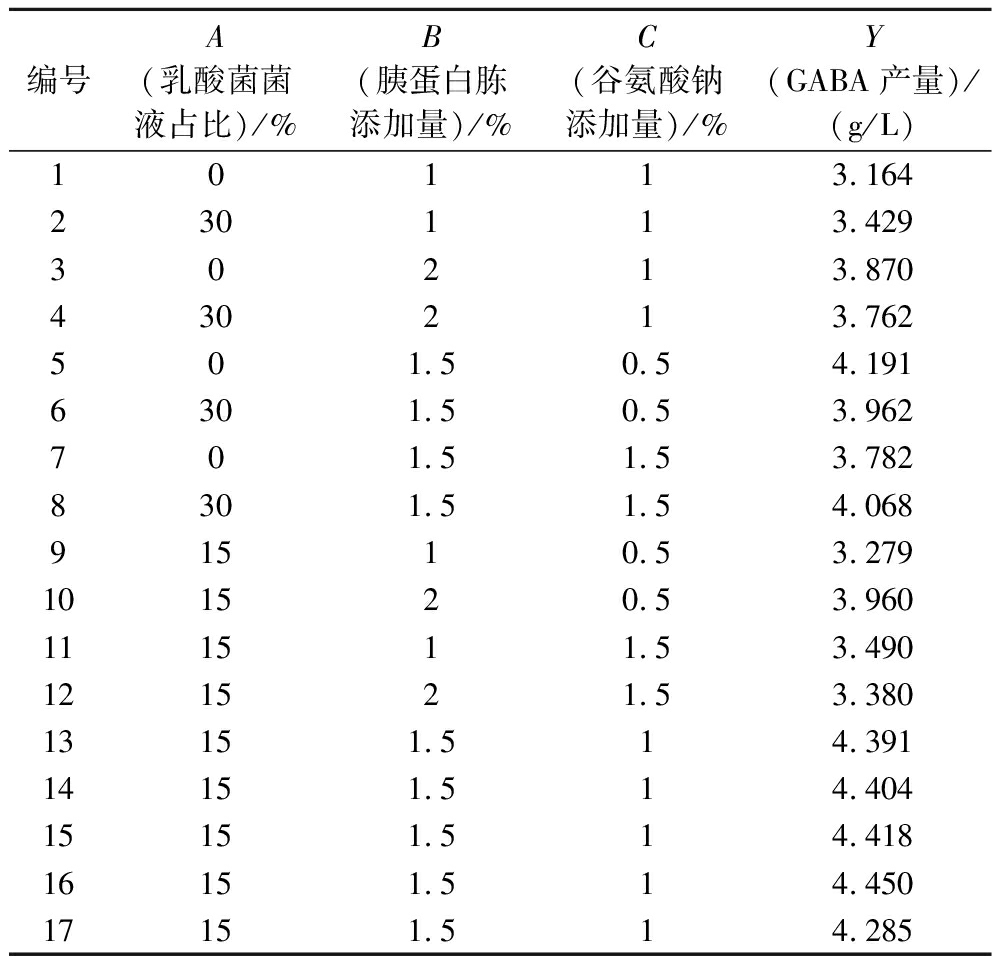
编号A(乳酸菌菌液占比)/%B(胰蛋白胨添加量)/%C(谷氨酸钠添加量)/%Y(GABA产量)/(g/L)10113.164230113.42930213.870430213.762501.50.54.1916301.50.53.962701.51.53.7828301.51.54.06891510.53.279101520.53.960111511.53.490121521.53.38013151.514.39114151.514.40415151.514.41816151.514.45017151.514.285
方差分析表明模型显著(P<0.000 1),失拟项不显著(P=0.201 3),拟合度良好(R2=0.984 9,Adj R2=0.965 4),具较强预测能力(Adeq Precision=19.22)(表5)。各因素对GABA产量的影响顺序为:胰蛋白胨添加量(B)>谷氨酸钠添加量(C)>乳酸菌菌液占比(A),其中B对响应值影响极显著(P<0.01),C显著(P<0.05)。
表5 回归模型方差分析
Table 5 Analysis of variance (ANOVA) for the regression model
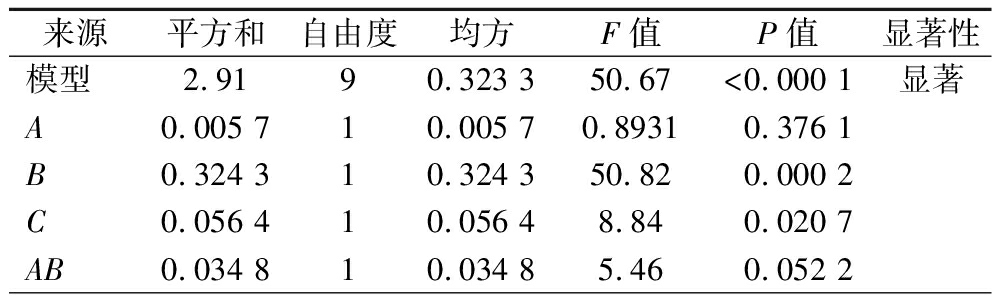
来源平方和自由度均方F值P值显著性模型2.9190.323 350.67<0.000 1显著A0.005 710.005 70.89310.376 1B0.324 310.324 350.820.000 2C0.056 410.056 48.840.020 7AB0.034 810.034 85.460.052 2
续表5
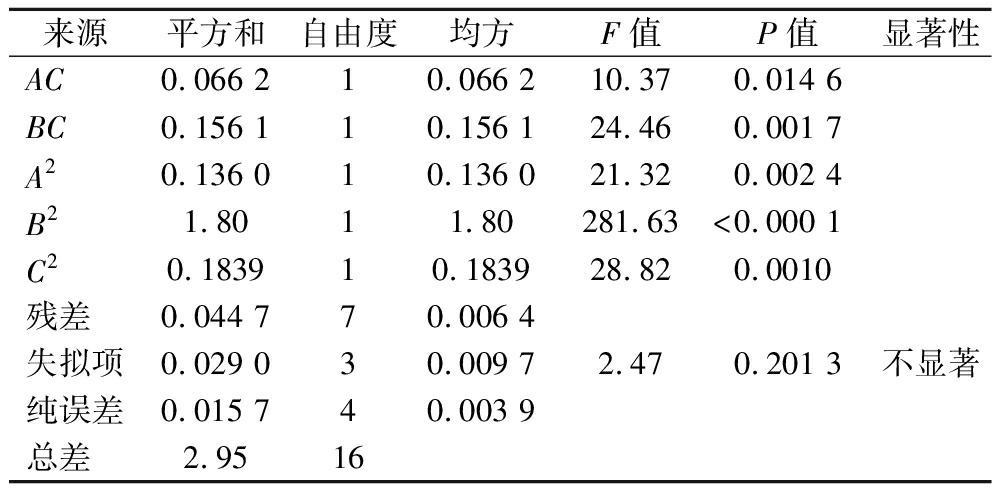
来源平方和自由度均方F值P值显著性AC0.066 210.066 210.370.014 6BC0.156 110.156 124.460.001 7A20.136 010.136 021.320.002 4B21.8011.80281.63<0.000 1C20.183910.183928.820.0010残差0.044 770.006 4失拟项0.029 030.009 72.470.201 3不显著纯误差0.015 740.003 9总差2.9516
通过响应面图分析了乳酸菌菌液占比(A)、胰蛋白胨添加量(B)及谷氨酸钠添加量(C)对GABA产量的影响(图2)。在A与B交互作用下,A在0%~30%内变化对GABA产量影响较小,而B在1%~2%内变化则导致GABA产量明显波动。固定A,仅考察C时,GABA产量随C呈先升后降趋势,但整体变化幅度较小,等高线图近似圆形,表明两者交互作用不明显。B与C交互作用显示,B增加使GABA产量先升后降,而C的影响相对较弱,表明B对产量的调控作用最强。基于回归模型预测,最优发酵条件为A 13.524%、B 1.605%、C 0.834%,预测GABA产量为4.423 g/L。为简化操作,实际条件调整为A 13.5%、B 1.6%、C 0.8%,验证实验中GABA产量为(4.34±0.03) g/L,与预测值接近,说明模型可靠。

a-响应面图;b-等高线图
图2 乳酸菌菌液占比、胰蛋白胨添加量和谷氨酸钠添加量对GABA产量影响的响应面图及等高线图
Fig.2 Response surface and contour plots of GABA yield as affected by Lactobacillus inoculum ratio, peptone addition, and monosodium glutamate addition

a-未发酵米糠;b-发酵粘液乳杆菌发酵米糠;c-解淀粉芽孢杆菌发酵米糠;d-复合菌株发酵米糠
图3 米糠扫描电镜图
Fig.3 Scanning electron micrographs of rice bran
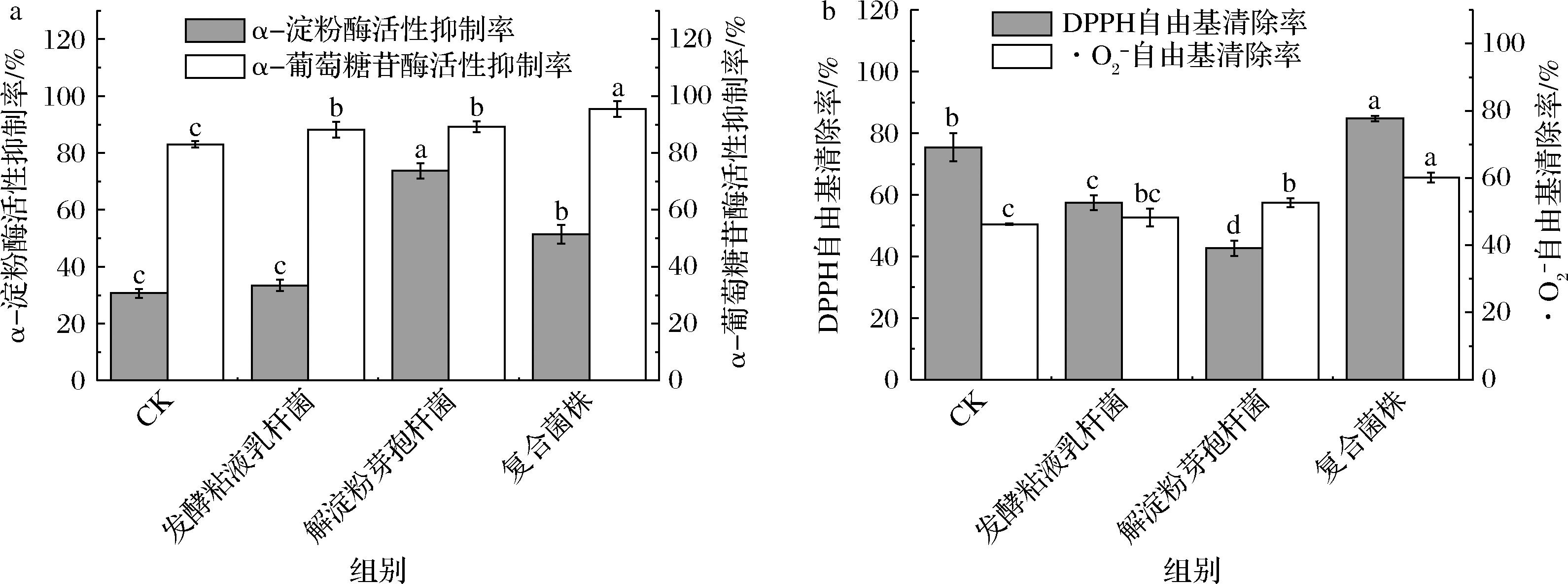
a-降血糖功能;b-抗氧化功能
图4 不同发酵处理对米糠降血糖与抗氧化功能的影响
Fig.4 Effects of different fermentation treatments on the hypoglycemic and antioxidant activities of rice bran
注:CK为对照组,以等体积无菌水替代接种菌液。
2.2 复合发酵对米糠微观结构的影响
如图3-a所示,未经发酵的米糠表面光滑致密,孔隙较少。发酵粘液乳杆菌处理后,表面变粗糙,出现少量孔隙,结构略为松散(图3-b)。解淀粉芽孢杆菌发酵则因其分泌多种水解酶,显著破坏淀粉与纤维结构,形成凹陷或蜂窝状孔洞(图3-c)。复合菌株发酵效果最显著,米糠表面呈现出疏松多孔的网络状形态,有助于提高比表面积和成分释放效率(图3-d),为后续开发利用奠定物理基础。
2.3 复合发酵对米糠降血糖活性的影响
通过抑制α-淀粉酶和α-葡萄糖苷酶的活性以调节血糖水平,是糖尿病治疗中的重要策略。α-淀粉酶抑制作用可减少淀粉的初步水解,降低葡萄糖释放速度;而抑制α-葡萄糖苷酶则能延缓寡糖的终端分解,减缓膳食碳水化合物的吸收过程,从而有效控制餐后血糖波动[30-31]。如图4-a所示,解淀粉芽孢杆菌发酵米糠和复合菌株发酵米糠对α-淀粉酶活性抑制率分别达到(73.75±2.71)%和(51.41±3.26)%,显著高于未发酵米糠。α-葡萄糖苷酶活性抑制率也显著提升,尤以复合菌株发酵米糠表现最佳,抑制率达(95.46±2.72)%,较未发酵米糠提高15.02%。这种抑制作用可能是由于发酵过程中生成的多酚、阿魏酸、GABA等物质所致[32-33]。上述结果表明,复合菌株发酵可显著增强米糠的降血糖潜力。
2.4 复合发酵对米糠抗氧化活性的影响
DPPH自由基和·O2-自由基的清除率是评价样品抗氧化活性的常用指标[33]。组合发酵显著增强了米糠的抗氧化能力(图4-b)。其中,组合发酵米糠的DPPH自由基清除率达(84.76±0.90)%,显著高于未发酵米糠;在·O2-自由基清除方面,解淀粉芽孢杆菌发酵米糠和组合发酵米糠的清除率分别为(57.47±1.37)%和(65.62±1.59)%,均显著优于未发酵米糠。结果表明,组合菌株发酵有助于提升米糠的体外抗氧化性能。
3 结论
本研究通过系统优化米糠固态发酵工艺,实现了GABA的高效富集,最优条件下产量达4.34 g/L。发酵改善了米糠的微观结构,同时增强其降血糖与抗氧化活性。该工艺突破了以米糠为唯一碳源开展固态发酵制备功能因子的关键技术瓶颈,在无需外加主要底物的条件下实现了GABA的高效累积,显著拓展了米糠在功能食品原料领域的高值化应用潜力。
[1] 刘芳, 韩伟, 郭超, 等.米糠蛋白提取、改性及在食品加工中的应用[J].食品与发酵工业, 2025, 51(1):363-372.LIU F, HAN W, GUO C, et al.Research progress on extraction, modification and application of rice bran protein in food[J].Food and Fermentation Industries, 2025, 51(1):363-372.
[2] DA ROCHA LEMOS MENDES G, SOUTO RODRIGUES P, DE LAS MERCEDES SALAS-MELLADO M, et al.Defatted rice bran as a potential raw material to improve the nutritional and functional quality of cakes[J].Plant Foods for Human Nutrition, 2021, 76(1):46-52.
[3] ANTUNES L L, BACK A L, KOSSAR M L B C, et al.Prebiotic potential of carbohydrates from defatted rice bran-effect of physical extraction methods[J].Food Chemistry, 2023, 404:134539.
[4] RANJAN A, SAHU N P, DEO A D, et al.Solid state fermentation of de-oiled rice bran:Effect on in vitro protein digestibility, fatty acid profile and anti-nutritional factors[J].Food Research International, 2019, 119:1-5.
[5] ENDO Y, NAKAGAWA K.Differences in the compositions of vitamin E tocochromanol (tocopherol and tocotrienol) in rice bran oils produced in Japan and other countries[J].Journal of Oleo Science, 2021, 70(4):503-507.
[6] OKADA T, SUGISHITA T, MURAKAMI T, et al.Effect of the defatted rice germ enriched with GABA for sleeplessness, depression, autonomic disorder by oral administration[J].Nippon Shokuhin Kagaku Kogaku Kaishi, 2000, 47(8):596-603.
[7] MANLAPIG J J D, MATSUI H.Production and utilization of fermented rice bran as animal feed[J].Animal Science Journal, 2025, 96(1):e70037.
[8] GANJIZADEH ZAVAREH S, JAVANMARD DAKHELI M, TAJEDDIN B.Optimization of biodegradable paper cup packaging coated with whey protein isolate and rice bran wax as potential popcorn package[J].Food Science &Nutrition, 2021, 9(12):6762-6775.
[9] SOHAIL M, RAKHA A, BUTT M S, et al.Rice bran nutraceutics:A comprehensive review[J].Critical Reviews in Food Science and Nutrition, 2017, 57(17):3771-3780.
[10] SOOKWONG P, MAHATHEERANONT S.Some strategies for utilization of rice bran functional lipids and phytochemicals[J].Journal of Oleo Science, 2018, 67(6):669-678.
[11] TAN B L, NORHAIZAN M E, CHAN L C.Rice bran:From waste to nutritious food ingredients[J].Nutrients, 2023, 15(11):2503.
[12] BOUCHÉ N, LACOMBE B, FROMM H.GABA signaling:A conserved and ubiquitous mechanism[J].Trends in Cell Biology, 2003, 13(12):607-610.
[13] LAI Q D, DOAN N T T, NGUYEN H D, et al.Influence of enzyme treatment of rice bran on gamma-aminobutyric acid synthesis by Lactobacillus[J].International Journal of Food Science &Technology, 2021, 56(9):4722-4729.
[14] 李海峰, 李冰冰, 石硕硕, 等.γ-氨基丁酸在食品中的应用研究进展[J].河南工业大学学报(自然科学版), 2023, 44(1):117-125.LI H F, LI B B, SHI S S, et al.Research progress on the application of γ-aminobutyric acid in food[J].Journal of Henan University of Technology (Natural Science Edition), 2023, 44(1):117-125.
[15] SALEH A S M, WANG P, WANG N, et al.Brown rice versus white rice:Nutritional quality, potential health benefits, development of food products, and preservation technologies[J].Comprehensive Reviews in Food Science and Food Safety, 2019, 18(4):1070-1096.
[16] WANG Y H, LIANG H X, HU Z Y, et al.Evaluation of flavor properties in rice bran by solid-state fermentation with yeast[J].Food Chemistry:X, 2025, 28:102516.
[17] LAI Q D, DOAN N T T, NGUYEN H D.Influences of adding media additives on synthesis of gamma-aminobutyric acid in fermentation of defatted rice bran extract with lactic acid bacteria[J].International Journal of Food Science and Technology, 2022, 57(11):7412-7422.
[18] KIM N Y, KIM S K, RA C H.Evaluation of gamma-aminobutyric acid (GABA) production by Lactobacillus plantarum using two-step fermentation[J].Bioprocess and Biosystems Engineering, 2021, 44(10):2099-2108.
[19] ZAYABAATAR E, HUANG C M, PHAM M T, et al.Bacillus amyloliquefaciens increases the GABA in rice seed for upregulation of type I collagen in the skin[J].Current Microbiology, 2023, 80(4):128.
[20] ABD-ELHALIM B T, GAMAL R F, EL-SAYED S M, et al.Optimizing alpha-amylase from Bacillus amyloliquefaciens on bread waste for effective industrial wastewater treatment and textile desizing through response surface methodology[J].Scientific Reports, 2023, 13:19216.
[21] HUANG X Y, LI H J, HAN T, et al.Isolation and identification of protease-producing Bacillus amyloliquefaciens LX-6 and its application in the solid fermentation of soybean meal[J].Frontiers in Bioengineering and Biotechnology, 2023, 11:1226988.
[22] 赵宏飞, 宋伟, 裴家伟, 等.食品中三种γ-氨基丁酸检测方法比较[J].中国乳品工业, 2008, 36(11):51-55.ZHAO H F, SONG W, PEI J W, et al.Comparisons of three methods available for the analysis of γ-aminobutyric acid from food environments[J].China Dairy Industry, 2008, 36(11):51-55.
[23] 黄越, 黄传书, 杨碧文, 等.不同品种桑椹发酵酒的体外抗氧化、降血糖及降血脂活性研究[J].食品与发酵工业, 2024, 50(22):150-158.HUANG Y, HUANG C S, YANG B W, et al.Study on in vitro antioxidant, hypoglycemic, and hypolipidemic activities of mulberry fermented wine brewed with different varieties[J].Food and Fermentation Industries, 2024, 50(22):150-158.
[24] 杨旭洲, 陈佩瑶, 张富新.抗氧化乳酸菌的筛选及其益生特性评价[J].食品与发酵工业, 2023, 49(10):17-23.YANG X Z, CHEN P Y, ZHANG F X.Screening of antioxidant lactic acid bacteria and evaluation of their probiotic properties[J].Food and Fermentation Industries, 2023, 49(10):17-23.
[25] VILLEGAS J M, BROWN L, SAVOY DE GIORI G, et al.Optimization of batch culture conditions for GABA production by Lactobacillus brevis CRL 1942, isolated from quinoa sourdough[J].LWT-Food Science and Technology, 2016, 67:22-26.
[26] WANG Q, LIU X H, FU J H, et al.Substrate sustained release-based high efficacy biosynthesis of GABA by Lactobacillus brevis NCL912[J].Microbial Cell Factories, 2018, 17(1):80.
[27] HAN S K, LIU H, HAN Y, et al.Effects of calcium treatment on malate metabolism and γ-aminobutyric acid (GABA) pathway in postharvest apple fruit[J].Food Chemistry, 2021, 334:127479.
[28] 江迪, 张紫晋, 杨婷, 等.青稞麦麸γ-氨基丁酸的制备条件优化[J].中国食品学报, 2023, 23(7):259-266.JIANG D, ZHANG Z J, YANG T, et al.Optimization of γ-aminobutyric acid preparing conditions using highland barley bran[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(7):259-266.
[29] 刘辉, 季海峰, 王四新, 等.响应面-主成分分析法优化副干酪乳杆菌发酵培养基[J].中国饲料, 2023(13):36-42.LIU H, JI H F, WANG S X, et al.Optimization of fermentation medium of Lactobacillus paracasei by response surface methodology and principal component analysis[J].China Feed, 2023(13):36-42.
[30] 杜昭换, 但玉兰, 徐彩红, 等.发芽糙米酚类物质降血糖活性研究[J].中国粮油学报, 2025, 40(2):33-40.DU Z H, DAN Y L, XU C H, et al.Investigation of hypoglycemic activity of phenols derived from germinated brown rice[J].Journal of the Chinese Cereals and Oils Association, 2025, 40(2):33-40.
[31] DU X P, WANG X, YAN X, et al.Hypoglycaemic effect of all-trans astaxanthin through inhibiting α-glucosidase[J].Journal of Functional Foods, 2020, 74:104168.
[32] SUN Y, CAO Q W, HUANG Y Y, et al.Mechanistic study on the inhibition of α-amylase and α-glucosidase using the extract of ultrasound-treated coffee leaves[J].Journal of the Science of Food and Agriculture, 2024, 104(1):63-74.
[33] JEONG E Y, CHO K S, LEE H S.α-amylase and α-glucosidase inhibitors isolated from Triticum aestivum L.sprouts[J].Journal of the Korean Society for Applied Biological Chemistry, 2012, 55(1):47-51.
[34] NWACHUKWU I D, SARTESHNIZI R A, UDENIGWE C C, et al.A concise review of current in vitro chemical and cell-based antioxidant assay methods[J].Molecules, 2021, 26(16):4865.