被孢霉(Mortierella)属隶属于接合菌门的被孢霉科[1]。具有丰富的物种多样性。截至目前,全世界已报道110个种,其中,中国已报道的Mortierella共计44个种和变种[2]。该属真菌广泛分布于自然界中,常见于森林土壤中,此外植物根际、枯枝落叶、动物残体、腐烂蘑菇中也常分离到,而有关干旱区Mortierella属菌株分离筛选相关研究鲜有报道。Mortierella属真菌功能多样,具有降解农业废弃物和有机污染物修复土壤,溶磷、产铁载体促进土壤营养元素转化的潜力,在土壤碳磷循环中起了重要的作用[3]。其次,Mortierella属真菌可以分泌植物激素和脂肪酸类物质促进植物生长[4]。此外,Mortierella属菌还能特异性抑制某些病原菌如尖孢镰刀菌等病原真菌从而防治对应的土传病害[5]。
同时,Mortierella作为油脂生产的重要菌株,可以用来生产功能性油脂和多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)[6],如花生四烯酸(arachidonic acid,ARA)、二十碳五烯酸(eicosapentaenoic acid,EPA)等,可广泛用于食品、生物医药等领域。目前工业化生产脂肪酸的菌株有高山被孢霉(Mortierella alpina)[7]、拉曼被孢霉(Mortierella ramanniana)[8]以及深黄被孢霉(Mortierella isabellina)[9]。研究发现,不同种类的Mortierella其产油能力和油脂组成往往不同,同时通过诱变和发酵优化能提升菌株发酵能力。随着合成生物学的发展,通过强化油脂代谢途径,加大基因元件改造,能显著提高菌株油脂产量。因此挖掘新型Mortierella,不仅有利于丰富物种多样性,同时也为Mortierella油脂生产提供了菌种资源和基因元件。
本研究对托克逊干旱区域土壤样品采集,开展了Mortierella分离鉴定,并对所获得菌株生长特性和产油性能进行测定,不仅丰富了干旱区Mortierella分布的认知,也为相关菌株的开发利用奠定了基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
供试土壤样品采自新疆吐鲁番市托克逊县(北纬42°42′39″,东经86°52′48″),该区域为典型干旱无人区,地表主要以沙石为主,无任何植被覆盖。样品采集选取典型样方按“蛇形法”布设5个样点后采集表土层(0~20 cm)土样,剔除石头,将土样充分混匀并用四分法留取2 kg带回实验室,4 ℃保存备用。
1.1.2 试剂及培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、马铃薯葡萄糖水(potato dextrose water,PDW),青岛高科技工业园海博生物技术有限公司;真菌基因组DNA提取试剂盒、引物、Taq酶等试剂,生工生物工程(上海)股份有限公司。
麦芽提取物琼脂(malt extract agar,MEA)培养基(g/L):麦芽提取物18、鱼粉蛋白胨4、葡萄糖20、琼脂20。
产油液体(oil-producing water,OW)培养基(g/L):葡萄糖50、酵母浸粉10、KH2PO4 3、Na2SO4 1、CaCl2 0.38、MgCl2·6H2O 0.5,pH值调至7.0~7.4。
淀粉酶筛选培养基(g/L):淀粉10、牛肉浸粉3、蛋白胨10、NaCl 5、琼脂20,pH值调至7.0~7.4。
纤维素酶筛选培养基(g/L):羧甲基纤维素钠10、Na2CO3 2、MgSO4 0.5、K2HPO4 10、FeSO4 0.01、KCl 0.5、琼脂20,pH值调至7.0~7.4。
脂肪酶筛选培养基:添加体积分数为1%的三丁酸甘油酯和0.5 g/L罗丹明B的PDA培养基,pH值调至7.0~7.4[10]。
蛋白酶筛选培养基(g/L):蛋白胨8、酵母浸粉6、脱脂奶粉24、琼脂20,pH值调至7.0~7.4。
上述培养基均在121 ℃灭菌20 min。
1.2 仪器与设备
SPX-250BF生化培养箱,上海福玛实验设备有限公司;BSD-250振荡培养箱,上海博讯实业有限公司医疗设备厂;ECLIPSE CI-L荧光显微镜,尼康仪器(上海)有限公司;SMZ25体式显微镜,日本NIKON 公司;Scan 1200自动菌落计数器,法国Interscience公司;DHG-9070电热恒温鼓风干燥箱,上海鸿都电子科技有限公司;7890A气相色谱仪,美国Agilent公司。
1.3 实验方法
1.3.1 菌株分离与纯化
采用梯度稀释分离法对真菌进行筛选。取土壤5 g,加入无菌水45 mL,放置于摇床中30 ℃、150 r/min振荡培养30 min,使土样与水充分混合,分散菌体,得到50 mL土壤悬浮液,通过梯度稀释将土壤悬浮液稀释为10-1、10-2和10-3倍数的土壤稀释液。分别取稀释液100 μL涂布到PDA平板上,共3个稀释梯度,每个梯度3个重复。30 ℃培养7 d左右,挑取不同菌落进行纯化,直至出现单菌落。
1.3.2 菌种鉴定
形态学描述:将纯化好的单菌落接种于PDA和MEA培养基,30 ℃培养7~9 d,观察菌落的生长状态,如菌落直径、菌落颜色、菌落质地和反面颜色等,并进行显微形态观察,记录菌种的显微形态。结合《真菌鉴定手册》和《中国真菌志》等进行分类鉴定。
分子生物学鉴定:采用真菌基因组DNA提取试剂盒进行菌株基因组DNA的提取。以引物ITS1/4扩增ITS序列。PCR反应体系为:2× PCR Bestaq MasterMix 25 μL,正反向引物(10 μmol/L)各1 μL,DNA模板(20 ng/μL)2 μL,ddH2O补足50 μL。PCR反应条件:95 ℃预变性5 min;94 ℃变性45 s;50 ℃退火30 s,72 ℃延伸45 s,循环30次;循环结束后72 ℃ 1 min。将PCR扩增的产物在10 g/L琼脂糖凝胶上电泳分离,检测出明显条带后送至成都罗宁生物科技有限公司测序。所得序列经人工矫正和拼接后,上传至NCBI数据库进行同源性比对,用MEGA 11软件构建系统发育树,确定分离菌株分类地位。
1.3.3 菌株抗逆特性
耐盐特性:将菌株分别转接到含50、60、70、80 g/L NaCl的PDA培养基上,30 ℃倒置培养3 d,每个处理3个重复,观察生长情况,以确定菌株耐盐程度。
耐碱特性:将菌株分别转接到起始pH分别为4.0、5.0、6.0、13.0的PDW液体培养基上,30 ℃培养3 d,每个处理3个重复,观察生长情况,以确定菌株耐pH程度。
菌株生长温度测定:将分离纯化好的菌株平板分别放入4、10、20、28、35、40、45 ℃培养箱中培养6 d,观察生长情况。每个处理3个重复。
1.3.4 菌株产酶特性
产淀粉酶特性:将分离纯化好的菌株转接入淀粉酶筛选培养基,30 ℃培养6 d,用碘液染色5 min,观察透明圈。
产纤维素酶特性:将分离纯化好的菌株转接入纤维素酶筛选培养基,30 ℃培养6 d,10 g/L刚果红染色20 min,1 mol/L NaCl溶液脱色15~20 min,观察菌落周围的透明圈。
产脂肪酶特性:将分离纯化好的菌株转接入脂肪酶筛选培养基,30 ℃培养6 d,观察是否出现透明圈。
产蛋白酶特性:将分离纯化好的菌株转接入蛋白酶筛选培养基,30 ℃培养6 d,观察透明圈情况。
1.3.5 菌株产油性能评估
发酵液的制备:用移液枪向长满菌丝的活化后的Mortierella平板加入25 mL无菌水,无菌接种环刮去平板的孢子制成孢子悬液,将孢子悬液菌丝混匀后按5%的接种量转接到含有200 mL发酵培养基的1 L三角瓶中,于30 ℃、150 r/min振荡培养7 d,获得发酵液。
生物量的测定:菌体收集、干燥:发酵液用4层纱布抽滤,先后取100 mL蒸馏水洗涤,3次至流出液无色,收集菌体于60 ℃烘干至恒重,并计算单位发酵生物量(菌体干质量/发酵液体积)。
总油脂量的测定:采用酸热法对微生物油脂进行提取。称1.0 g干菌体,加10 mL 4 mol/L HCl溶液,将试管放入75 ℃水浴处理45 min。取出试管,加入10 mL乙醇,混匀。自然冷却后加入25 mL无水乙醚提取液,充分振摇1 min,8 000 r/min离心5 min,弃上清液并于100 ℃干燥1 h至恒重,冷却后称重,得到油脂含量和发酵产量。油脂含量和发酵产量计算公式分别如式(1)、公式(2)所示:
油脂含量/%=(带油脂接受瓶质量-接受瓶净质量)/干菌体质量×100
(1)
发酵产量/(g/L)=生物量×油脂含量
(2)
脂肪酸组成测定:参照GB 5009.168—2016《食品安全国家标准 食品中脂肪酸的测定》,采用气相色谱法分析Mortierella油脂中脂肪酸组成。
脂肪酸甲酯化:取50 μL样品加入2 mL 20 g/L NaOH-甲醇溶液,85 ℃水浴30 min,加入 3 mL 质量分数14%三氟化硼甲醇溶液,于85 ℃水浴30 min。水浴完成后,冷却至室温,加入3 mL正己烷,振荡萃取2 min之后,静置1 h,等待分层。取上层清液过0.45 μm滤膜后进行气相色谱分析。
气相色谱条件:HP-88色谱柱(100 m×0.25 mm×0.20 μm);火焰离子检测器;升温程序:100 ℃保持15 min,以20 ℃/min的速率升温至190 ℃,保持6 min,再以1 ℃/min的速率升温至220 ℃,保持7 min;进样口温度260 ℃;载气N2,流速10 mL/min;分流进样,分流比20∶1;检测器温度250 ℃。
脂肪酸定性定量方法:通过37种脂肪酸甲酯标准品保留时间对脂肪酸成分进行定性,归一化法进行定量分析。
1.4 数据处理
采用Excel 2010软件对数据进行初步整理;采用SPSS 26统计软件对数据进行单因素方差分析(ANOVA);采用Origin 2021软件进行图形绘制。
2 结果与分析
2.1 菌株分离鉴定结果
通过梯度稀释法对采集样品真菌进行分离筛选,共分离得到3株潜在的Mortierella菌株。对其进行形态学观察发现菌株呈现明显的不同(图1)。其中菌株10-1-F1在MEA培养基上生长较快,菌落呈白色,菌丝有隔,气味典型,中等强烈,在PDA培养基上菌落呈轮状,白色,气生菌丝中等发达,培养9 d菌落直径达6.3~6.8 cm,孢囊梗从气生菌丝长出,孢子囊为球形。菌株3-2在MEA培养基上呈碎裂片状,菌落白色,气生菌丝丰富,菌丝有不规则排列的隔膜;气味比较强;在PDA培养基上菌落呈花瓣状,具有少量气生菌丝;培养9 d菌落直径达7.4~7.6 cm。菌株2-1-4菌落在MEA培养基上呈放射状,菌落白色;在PDA培养基上呈白色环状;气生菌丝丰富,棉絮状,较粗壮,有隔膜,培养9 d菌落直径达6.8~7.2 cm。
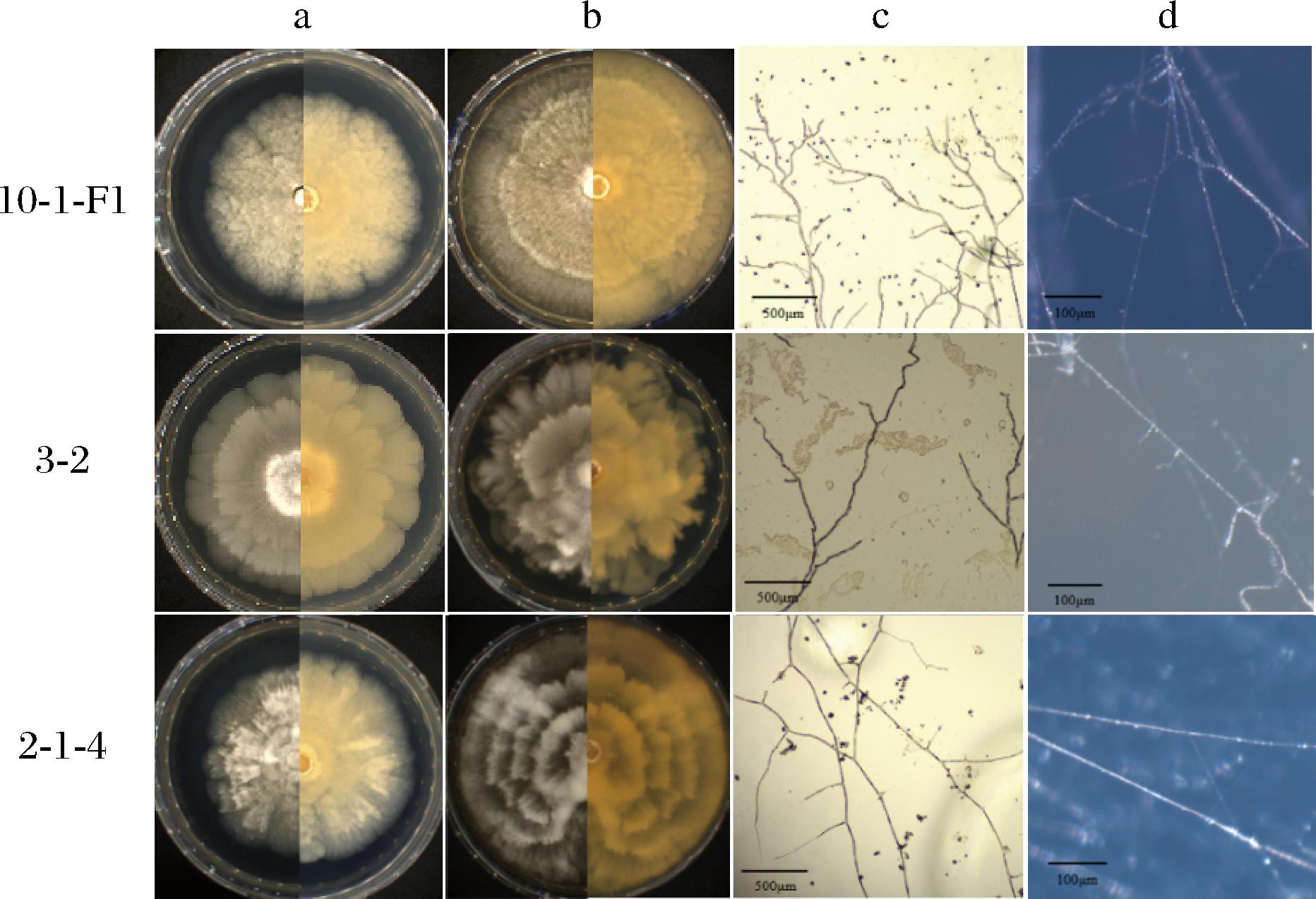
a-PDA菌落形态;b-MEA菌落形态;c-荧光显微镜菌丝形态;d-体式显微镜菌丝形态
图1 Mortierella新种菌落形态和显微结构
Fig.1 Colony morphology and microstructure of new species of Mortierella
2.2 菌株分子生物学鉴定
ITS基因序列经NCBI数据库比对显示3株菌均属于Mortierella属,其中菌株2-1-4和10-1-F1与最为邻近的模式菌株Mortierella antarctica同源性为94.69%,菌株3-2与Mortierella globalpina的同源性为95.87%。进一步利用MEGA 11构建系统发育树,如图2所示,菌株2-1-4和10-1-F1与Mortierella antarctica聚为一支,置信度为87%,菌株3-2与Mortierella globalpina表现出较近的亲缘关系。3株菌相似度均<99%,初步确定为Mortierella属的潜在新种。

图2 基于ITS基因序列的邻接法构建的系统发育树
Fig.2 Phylogenetic tree constructed by neighbor-joining method based on ITS gene sequence
2.3 菌株特性
2.3.1 菌株抗逆特性
对3株Mortierella抗逆特性进行分析,发现菌株具有较强的耐盐、耐碱和低温生长特性,结果如表1所示。3株菌生长温度范围在4~35 ℃,均可在50 g/L 的NaCl溶液和pH 13.0的环境下正常生长,但菌株不能在pH 4.0条件下生长。
表1 Mortierella的抗逆特性
Table 1 Resistance properties of Mortierella strains

菌株NaCl/(g/L)pH温度/℃50604.05.013.04354010-1-F1+--++++-3-2+--++++-2-1-4+--++++-
注:+为阳性反应;-为阴性反应(下同)。
2.3.2 菌株产酶特性
将菌株分别接种于淀粉酶、蛋白酶、纤维素酶以及脂肪酶培养基上,观察菌株在相应培养基上的透明圈和变色情况,结果如表2所示。3株新种Mortierella均具有产淀粉酶和脂肪酶能力,但是都不具有产蛋白酶、纤维素酶能力。
表2 Mortierella的产酶特性
Table 2 Enzyme-producing activity of Mortierella strains
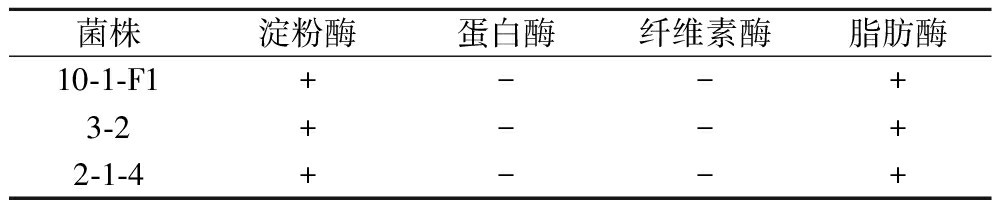
菌株淀粉酶蛋白酶纤维素酶脂肪酶10-1-F1+--+3-2+--+2-1-4+--+
2.4 不同培养基对生物量和总油脂产量影响
与PDW培养基相比,菌株在OW培养基发酵培养其生物量、油脂含量和发酵产量均显著提高(图3)。在OW培养基上,3株Mortierella得到的生物量范围在10.56~12.64 g/L;油脂含量在8.93%~12.56%;而总的发酵产量在1.09~1.33 g/L。2-1-4的胞内油脂含量最高,可达12.56%,发酵油脂产量也最高,为1.33 g/L。
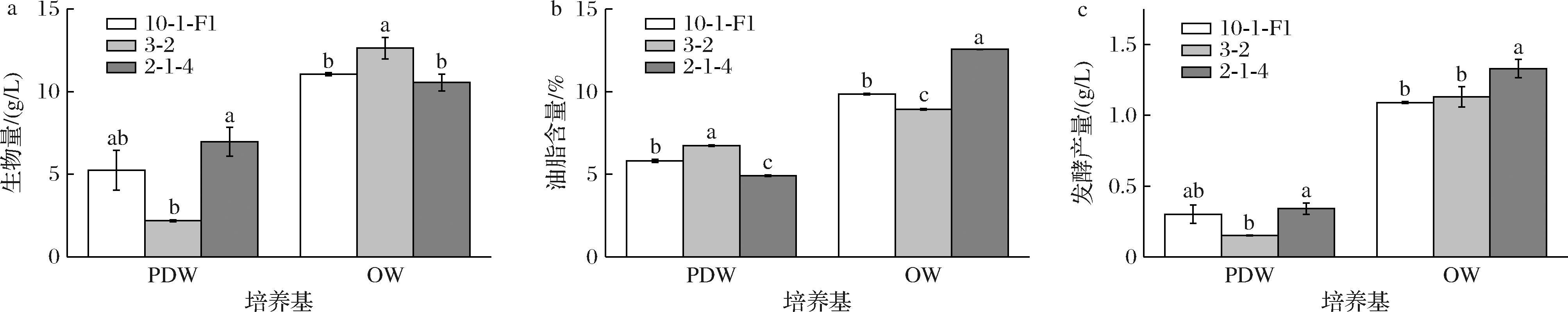
a-生物量;b-油脂含量;c-发酵产量
图3 不同培养基对Mortierella生物量、油脂含量和发酵产量的影响
Fig.3 Effects of different media on biomass, lipid content and fermentation yield of Mortierella
注:不同小写字母代表组间具有显著性差异(P<0.05)(下同)。
2.5 不同培养基对脂肪酸组成及产量影响
采用气相色谱对各菌株脂肪酸进行测定,结果发现采用OW培养基各菌株饱和脂肪酸、PUFAs和单不饱和脂肪酸产量显著高于PDW培养基(图4)。其中在这3类脂肪酸中菌株2-1-4的产量均高于其他菌株,分别达到0.55、0.31、0.47 g/L。进一步对各菌株主要脂肪酸含量进行分析(图5),油酸、软脂酸、硬脂酸和ARA是主要脂肪酸,其含量均占7.5%以上。不同菌株主要脂肪酸含量存在显著差异,各菌株油酸含量最高。达到29%以上,其中2-1-4油酸含量显著高于其他菌株,达到32.58%;菌株10-1-F1软脂酸含量显著高于其他菌株,达到24.17%;而菌株3-2 ARA的含量最高,达到17.67%。
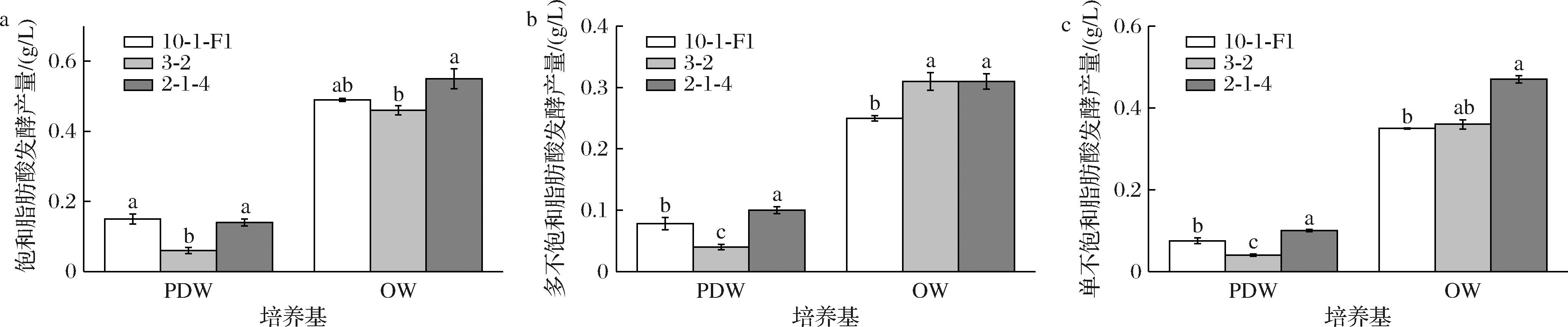
a-饱和脂肪酸;b-PUFAs;c-单不饱和脂肪酸
图4 不同培养基发酵Mortierella脂肪酸产量分析
Fig.4 Fatty acid production analysis of Mortierella fermentation in different media
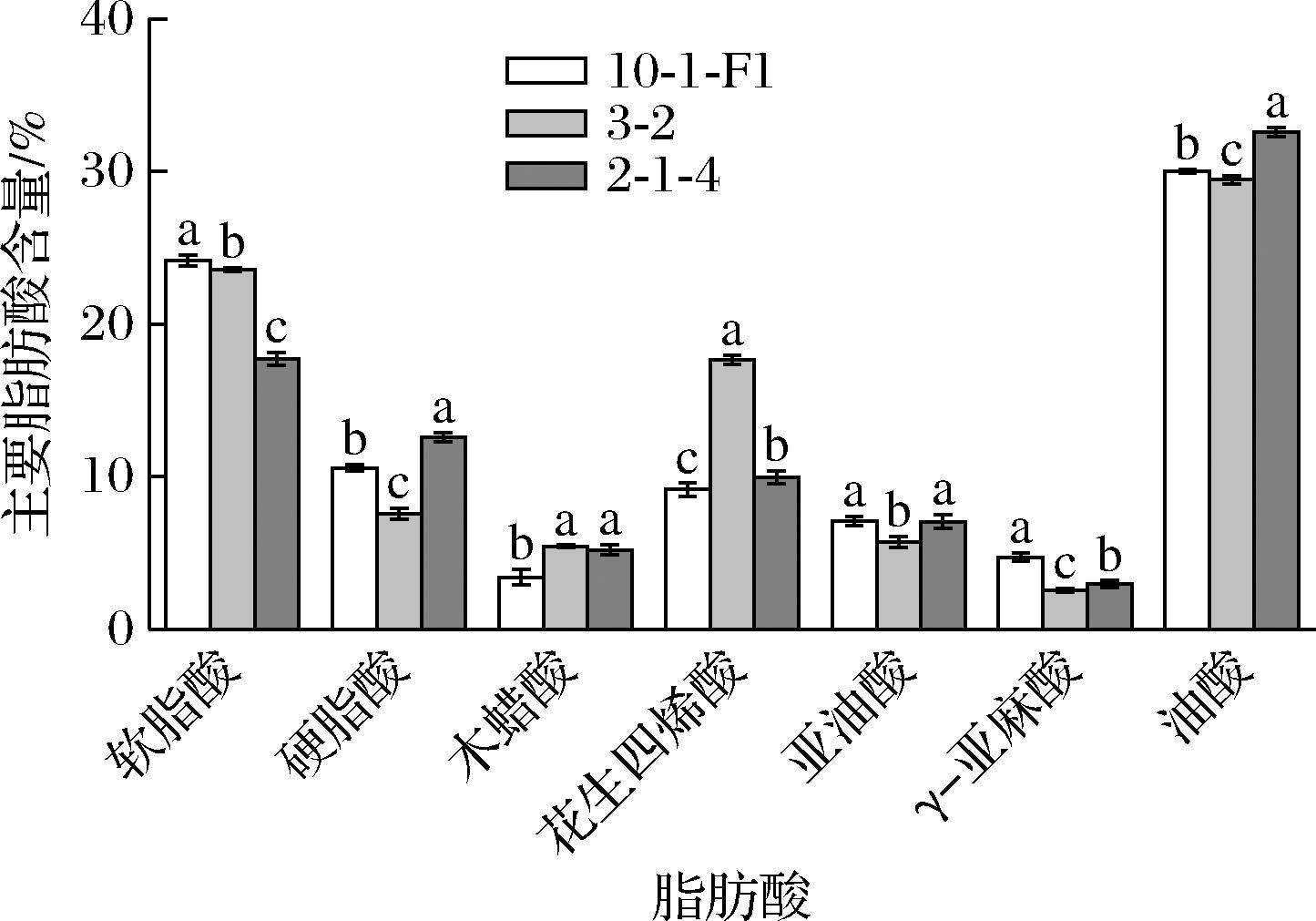
图5 产油培养基发酵Mortierella主要脂肪酸组成分析
Fig.5 Analysis of main fatty acid composition ofMortierella fermentation in OW medium
3 讨论
Mortierella种类多样分布广泛,我国学者对Mortierella的研究始于上世纪40年代,目前中国已报道的Mortierella共计44个种和变种。OU[11]在四川采集的土壤中分离获得2个种,其中1个为新种命名为Mortierella fimbriata Ou,是中国Mortierella属物种的最早记录。此后,我国陆续报道多个Mortierella新种。1992年,CHEN[12]报道了25种Mortierella,包括4个新种,14个我国新记录种,3个变种。近年来,李政宏等[13]从西藏采集的土壤、动物粪便等样品中分离得到Mortierella属9个种。刘泽[2]从我国大小兴安岭、西藏以及其他地区不同基质(土壤、粪便、植物残体等)中分离获得Mortierella属菌株的疑似新种8个。目前国内外有关干旱区盐碱环境分离Mortierella的报道较少,尤其在新疆区域未见Mortierella分布研究。本研究从托克逊干旱区土壤样品中分离得到3株Mortierella,经ITS基因序列分析比对,结果显示属于Mortierella属的2个种,其中菌株2-1-4和10-1-F1与Mortierella antarctica同源性为94.69%,菌株3-2与Mortierella globalpina的同源性为95.87%,同源性均低于99%,初步确定为Mortierella属的潜在新种。
研究发现,不同Mortierella属菌株因各自油脂合成能力差异,其油脂产量和组成往往不同。程晗等[14]筛选到1株长孢被孢霉(Mortierella elongata),其油脂质量分数和产量分别为30.15%和4.67 g/L。许本波等[15]发现Mortierella isabellina,其油脂含量为59.5%,油脂产量为5.37 g/L,占总油脂的56.6%。贾路遥等[16]对Mortierella alpina进行发酵优化,其生物量和油脂产量分别达到26.05 g/L和9.37 g/L,ARA为主要脂肪酸,占总油脂的39.93%。本研究发现,分离获得的3株Mortierella具有较好的产油能力,使用OW培养基能显著提高油脂含量。其中菌株2-1-4的发酵培养后油脂含量最高可达到12.56%;发酵产量可达到1.33 g/L。3株菌主要脂肪酸包括油酸、软脂酸、硬脂酸和ARA,不同菌株主要脂肪酸含量存在显著差异,其中2-1-4油酸含量最高,达到32.58%;菌株10-1-F1 软脂酸含量显著高于其他菌株,达到24.17%;而菌株3-2的ARA含量最高,达到17.67%。
另外,通过菌株诱变能显著提高菌株油脂产量,并改变其脂肪酸组分[17]。许本波等[15]通过微波诱变和紫外诱变,其突变株A35-4的油脂和PUFAs产量,分别提高了98.69%和125.7%;宋遥遥[18]诱变获得深黄Mortierella突变株SLZH-20,其生物量和油脂含量分别提高34.60%和24.30%。张鑫等[19]利用紫外-LiCl联合ARTP诱变,获得Mortierella alpina突变株Z6-A23,其油脂中ARA含量提高了75.40%,产量达3.62 g/L。一般而言,在发酵过程中高碳低氮(C/N >40)环境可诱导微生物从生长阶段转向油脂积累阶段,通过发酵条件优化和调控也可以提升菌株产油能力和改变油脂组成。宋遥遥[18]通过响应面法优化了突变株SLZH-20的发酵条件,其菌体生物量和油脂产量分别达到了26.12、14.63 g/L;VADIVELAN等[20]发现通过两阶段温度调控Mortierella alpina CFR-GV15发酵,可激活细胞内去饱和酶系统,显著改变了脂肪酸组成谱系。此外,溶氧量对需氧菌的油脂合成至关重要,高溶氧可促进TCA循环提供更多乙酰辅酶A;pH值可影响细胞膜通透性和酶活性,酸性环境(pH 5~6)有利于真菌积累油脂;在真菌发酵过程,菌球大小直接关系着溶氧、营养物质的传递和细胞微环境,控制其菌球大小对发酵产量也至关重要。本研究所分离的Mortierella原始菌株油脂产量和不饱和脂肪酸含量均不高,尤其是ARA含量,最高仅达到17.67%,远低于相关生产菌株,后续还将通过进一步诱变和发酵条件优化以提升其发酵能力。
4 结论
本实验从托克逊干旱区获得Mortierella属菌株3株;经形态观察和分子鉴定,初步确定为Mortierella属潜在新种。3株菌均表现出较宽的生长温度范围和耐盐、耐pH特性,均可产生淀粉酶和脂肪酶。3株菌的产油能力存在显著差异,采用OW培养基能显著提高菌株产油能力,其中菌株2-1-4最高油脂产量可达1.33 g/L。
[1] AMANO N.Chemotaxonomic significance of fatty acid composition in the genus Mortierella (Zygomycetes, Mortierellaceae)[J].Mycotaxon, 1992, 45:257-265.
[2] 刘泽. 中国被孢霉属及近缘属的分类与分子系统发育研究[D].北京:北京林业大学, 2020.LIU Z.Studies on the taxonomy and molecular phylogeny of Mortierella and allied genera in China [D].Beijing:Beijing Forestry University, 2020.
[3] 宁琪, 陈林, 李芳, 等.被孢霉对土壤养分有效性和秸秆降解的影响[J].土壤学报, 2022,59(1):206-217.NING Q, CHEN L, LI F, et al.Effects of Mortierella on nutrient availability and straw decomposition in soil [J].Acta Pedologica Sinica, 2022, 59(1):206-217.
[4] LI F, CHEN L, REDMILE‐GORDON M, et al.Mortierella elongata’s roles in organic agriculture and crop growth promotion in a mineral soil[J].Land Degradation &Development, 2018, 29(6):1642-1651.
[5] 裘智杰, 索萌, 王照贝, 等.被孢霉在可持续农业生产中的应用研究进展[J].江苏农业学报, 2024,40(4):762-768.QIU Z J, SUO M, WANG Z B, et al.Research progress on the application of Mortierella in sustainable agricultural production[J].Jiangsu Journal of Agricultural Sciences, 2024,40(4):762-768.
[6] 宋遥遥, 卢晓霆, 孙铭泽, 等.深黄被孢霉利用玉米粉糖液产多不饱和脂肪酸发酵条件优化[J].粮食与油脂, 2021,34(11):76-82.SONG Y Y, LU X T, SUN M Z, et al.Optimization of fermentation conditions for producing polyunsaturated fatty acids from corn flour sugar liquid by Mortierella isabellina[J].Cereals &Oils, 2021,34(11):76-82.
[7] 唐鑫, 顾舒婕, 常璐璐, 等.高山被孢霉产孢培养基的筛选[J].中国油脂, 2021,46(4):123-127.TANG X, GU S J, CHANG L L, et al.Screening of sporulation medium for Mortierella alpina[J].China Oils and Fats, 2021,46(4):123-127.
[8] 刘欣, 刘杨洋, 杨玉壮, 等.产γ-亚麻酸诱变菌拉曼被孢霉HLY0902的发酵条件优化[J].中国油脂, 2018, 43(4):101-105.LIU X, LIU Y Y, YANG Y Z, et al.Optimization of fermentation conditions for gamma-linolenic acid production by mutant strain Mortierella ramanniana HLY0902[J].China Oils and Fats, 2018, 43(4):101-105.
[9] 郝冉, 楚乐乐, 胡申才.基于代谢控制育种技术选育深黄被孢霉γ-亚麻酸高产菌株[J].中国酿造, 2016,35(4):51-55.HAO R, CHU L L, HU S C.Screening of Mortierella isabellina mutants for high-yield γ-linolenic acid by metabolic control breeding technique[J].China Brewing, 2016,35(4):51-55.
[10] 刘延波, 邢星月, 赵志军, 等.高产脂肪酶菌株的筛选鉴定及产酶条件优化[J].中国酿造, 2019,38(7):54-59.LIU Y B, XING X Y, ZHAO Z J, et al.Screening and identification of high yield lipase strains and optimization of enzyme production conditions[J].China Brewing, 2019,38(7):54-59.
[11] OU S H.Phycomycetes of China Ⅱ[J].Sinensia.1940, 11:427-450.
[12] CHEN F J.Mortierella species in China[J].Mycosystema.1992, 5:23-64.
[13] 李政宏, 普布次仁, 吕美林, 等.西藏接合菌物种多样性初探[J].微生物学通报, 2018, 45(6):1250-1261.LI Z H, PUBUCIREN, LYU M L, et al.Species diversity of zygomycotan fungi in the Tibet Autonomous Region[J].Microbiology China, 2018, 45(6):1250-1261.
[14] 程晗, 陈崇艺, 朱露露, 等.1株高产油脂长孢被孢霉MD-3菌株的诱变育种[J].食品科学, 2022,43(10):180-188.CHENG H, CHEN C Y, ZHU L L, et al.Obtainment and selection of a mutant strain of Mortierella elongata MD-3 showing improved oil production[J].Food Science, 2022, 43(10):180-188.
[15] 许本波, 巴敏, 谢伶俐, 等.高产PUFAs深黄被孢霉菌株的筛选[J].遗传, 2011,33(10):1147-1152.XU B B, BA M, XIE L L, et al.Screening of high-yield PUFAs Mortierella isabellina strain[J].Hereditas, 2011,33(10):1147-1152.
[16] 贾路遥, 卢晓霆, 宋遥遥.高山被孢霉产多不饱和脂肪酸发酵条件优化[J].中国酿造, 2023,42(11):224-229.JIA L Y, LU X T, SONG Y Y.Optimization of fermentation conditions for polyunsaturated fatty acids production by Mortierella alpina[J].China Brewing, 2023,42(11):224-229.
[17] 孙稳舟, 张保国, 袁丽霞, 等.基于PB设计和BBD响应面法优化高山被孢霉产花生四烯酸发酵培养基[J].安徽农业大学学报, 2020,47(1):12-17.SUN W Z, ZHANG B G, YUAN L X, et al.Optimization of culture medium for arachidonic acid production by Mortiella alpina using PB design and BBD design response surface methodology[J].Journal of Anhui Agricultural University, 2020,47(1):12-17.
[18] 宋遥遥. 丝状真菌生产多不饱和脂肪酸的研究[D].长春:长春工业大学, 2022.SONG Y Y.Study on the production of polyunsaturated fatty acids by filamentous fungi [D].Changchun:Changchun University of Technology, 2022.
[19] 张鑫, 凤元邦, 冯雪, 等.紫外-LiCl联合ARTP诱变选育高产花生四烯酸的高山被孢霉突变株[J].中国油脂, 2025, 50(4):82-87;110.ZHANG X, FENG Y B, FENG X, et al.Breeding of Mortierella alpina mutants with high yield of arachidonic acid by UV-LiCl combined with ARTP mutagenesis[J].China Oils and Fats, 2025, 50(4):82-87;110.
[20] VADIVELAN G, RAO P P, VENKATESWARAN G.Influence of supplementation of vegetable oil blends on omega-3 fatty acid production in Mortierella alpina CFR-GV15 [J].BioMed Research International.2017, 2017(1):1432970.