酱香型白酒以高温大曲为糖化发酵剂,以高粱为主要原料,采用“一二九八七”工艺酿造而来[1-2]。其酿造工艺复杂,酿造周期长,也因此具有极高的经济价值[3]。据统计,2022年我国酱香型白酒总销售收入突破2 100亿元[3]。赤水河产区是我国酱香型白酒的第一大产区,该产区的代表产品有贵州茅台和习酒以及四川郎酒,它们占据了较大的市场份额[4]。然而,酱酒企业数量增长极快,从2010年至2024年新增酱酒企业650多家,行业集中度有所下降,形成了不少酱酒新产区。目前位于我国鄂西北地区的保康县、南漳县和神农架林区已有数家成规模的酱酒企业,在省内均有一定的知名度。鄂西北地区位于鄂、豫、陕和渝四省交界,倚大巴山余脉,处长江和汉江流域,属亚热带季风气候,植被丰富,降水充足,自然环境优美。目前,该产区的大曲和酱酒品质已受到部分研究人员的关注。对比茅台高温大曲,侯强川等[5]发现保康县尧治河高温大曲中的芽孢杆菌属(Bacillus)丰度偏低。同时,HOU等[6]还对该企业不同颜色的高温大曲微生物类群、菌群功能和风味差异进行了全面分析,结果显示不同颜色高温大曲的品质各有不同,也因此在酱酒酿造中发挥了互补作用。GUO等[7]对保康县和南漳县的不同颜色高温大曲细菌类群进行合并分析发现,不同地区高温大曲菌群结构间的差异远大于不同颜色之间的。然而,先前已有的研究对鄂西北酱酒产区高温大曲的解析仍不够全面。
高通量测序技术是目前解析大曲、酒醅和窖泥等相关样品中微生物的主要技术手段之一。利用该技术,CAI等[8]对不同类型低温大曲的微生物类群进行了解析,结果显示Bacillus和覆膜孢酵母菌属(Saccharomycopsis)是其中主要的微生物类群。LI等[9]发现添加高产己酸乙酯酵母菌的强化大曲能够改变酒醅的微生物多样性。CHEN等[10]对特香型白酒大曲微生物进行了解析,结果发现曲霉菌属(Aspergillus)、克罗彭斯特德菌属(Kroppenstedtia)和海洋芽孢杆菌属(Oceanobacillus)为其中的主要微生物类群。
本研究以鄂西北酱酒产区的高温大曲为研究对象,采用MiSeq高通量测序对其微生物类群进行了分析,探究了该产区高温大曲中的核心微生物类群,同时甄别了该产区各县区高温大曲中的特有微生物类群,以期加深人们对鄂西北酱酒产区高温大曲特征的了解,同时对该产区产品品质提升提供一定的理论数据指导。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
高温大曲:纳入本研究的高温大曲样品分别采集自位于鄂西北地区南漳县(E 111°26′~112°9′,N 31°13′~32°1′)、保康县(E 110°45′~111°31′,N 31°21′~32°06′)和神农架林区(E 109°56′~110°58′,N 31°15′~31°75′)的3家酱香型白酒企业。于2022年8月从南漳县采集大曲样品30份,编号为NZ1~30;于2019年10月从保康县采集大曲样品30份,编号为BK1~30;于2023年9月从神农架林区采集样品10份,编号为SNJ1~10。
1.1.2 试剂
DP302细菌基因组DNA、DP307真菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司;正反向引物338F/806R和ITS3F/ITS4R,上海桑尼生物科技有限公司;AxyPre PCR清洁试剂盒,爱思进生物技术(杭州)有限公司;Illumina MiSeq测序试剂盒v3,美国Illumina公司。
1.2 仪器与设备
Vetiri PCR梯度基因扩增仪,美国AB公司;Fluor Chem FC3型化学发光凝胶成像系统,美国Protein Simple公司;MiSeq PE300高通量测序平台,美国Illumina公司;R930机架式服务器,美国DELL公司。
1.3 实验方法
1.3.1 样本总DNA提取
根据基因组DNA提取试剂盒DP302和DP307中提供的方法分别提取出大曲样品中的总DNA,使用紫外分光光度法对提取的DNA浓度进行检测,检测合格的DNA置于-20 ℃冰箱备用。
1.3.2 PCR扩增和高通量测序
首先在引物338F/806R和引物ITS1/ITS4中添加核苷酸标签,然后使用引物338F/806R对总DNA中16S rRNA的V3~V4区域进行PCR扩增,使用引物ITS3F/ITS4R对总DNA中内转录间隔区(internal transcribed spacer,ITS)2区域进行PCR扩增,引物序列信息见表1。PCR扩增体系和程序均参照GUO等[11]的方法。使用20 g/L琼脂糖凝胶对扩增产物的质量进行检测,检测合格的产物使用清洁试剂盒进行纯化,纯化后的产物寄至上海美吉生物医药科技有限公司,并基于MiSeq PE300高通量测序平台完成测序。
表1 本研究所用引物序列信息
Table 1 Primer sequence information in this study

扩增区域引物名称引物序列细菌16S rRNA V3~V4区338F5′-ACTCCTACGGGAGGCAGCAG-3′806R5′-GGACTACHVGGGTWTCTAAT-3′真菌ITS 2区ITS3F5′-GCATCGATGAAGAACGCAGC-3′ITS4R5′-TCCTCCGCTTATTGATATGC-3′
1.3.3 生物信息学分析
采集自南漳县和保康县的样品已分别于2020年和2021年完成了测序和分析[7,12-14],本研究直接引用了先前的测序数据。神农架林区大曲样品的测序数据由本次测序得到。本研究将3个地区大曲样品的测序数据进行了合并,并基于QIIME(v1.9.0)平台完成生物信息学分析。首先采用PyNAST软件依据Barcode信息对序列进行归并,然后使用FLASH软件(v 1.2.7)对双端序列进行拼接[15],过滤掉错配率≥0.2、引物碱基错配数≥2 bp或barcode碱基有错配的低质量序列[16],然后依据97%序列相似度对高质量序列进行操作分类单元(operational taxonomic units,OTU)[17]的构建,采用Chimera Slayer软件对含有嵌合体的OTU序列进行检查和删除[18],最后基于RDP(release 18)数据库完成高温大曲中细菌物种信息的注释[19]。
1.4 数据处理
使用Origin 2021软件绘制百分堆积柱状图,对优势微生物类群相对含量实现可视化;使用R(v 4.2.1)软件绘制花瓣图对各样本中的OTU数量实现可视化,绘制瀑布图对核心OTU的相对含量实现可视化,绘制主坐标分析(principal coordinates analysis,PCoA)散点图。
2 结果与分析
2.1 测序质量评估
在细菌方面,本研究通过测序共得到了3 463 360条16S rRNA基因序列,经过质量控制过滤掉了52 479条低质量16S rRNA基因序列,余下3 410 881条有效的16S rRNA基因序列,所有有效16S rRNA序列共被划分到17 304个细菌OTU,平均每个样品含有48 727条有效的16S rRNA基因序列和1 530个细菌OTU。在真菌方面,本研究共得到了4 413 687条ITS基因序列,经过质量控制过滤掉了27 738条低质量ITS基因序列,所有有效ITS序列共被划分到11 919个真菌OTU,余下4 385 949条有效的ITS基因序列,平均每个样品含有62 656条有效的ITS基因序列和1 841个真菌OTU。本研究首先基于发现物种数和香农指数的稀释曲线评估了测序质量。由图1-a和图1-b可知,随着测序深度的增加,3个县区高温大曲样品中细菌和真菌的发现物种数曲线呈不断上升趋势。由图1-c和图1-d可知,3个县区高温大曲中的细菌和真菌香农指数曲线随测序深度的增加呈先上升而后趋于稳定的趋势。当测序深度达到10 000条序列时,细菌和真菌的香农指数曲线均到达了平台期。这说明尽管测序深度超过10 000条后,仍可发现新的物种,但物种多样性并不会继续增加。由此可见,本研究的测序深度可满足后续的研究需要。
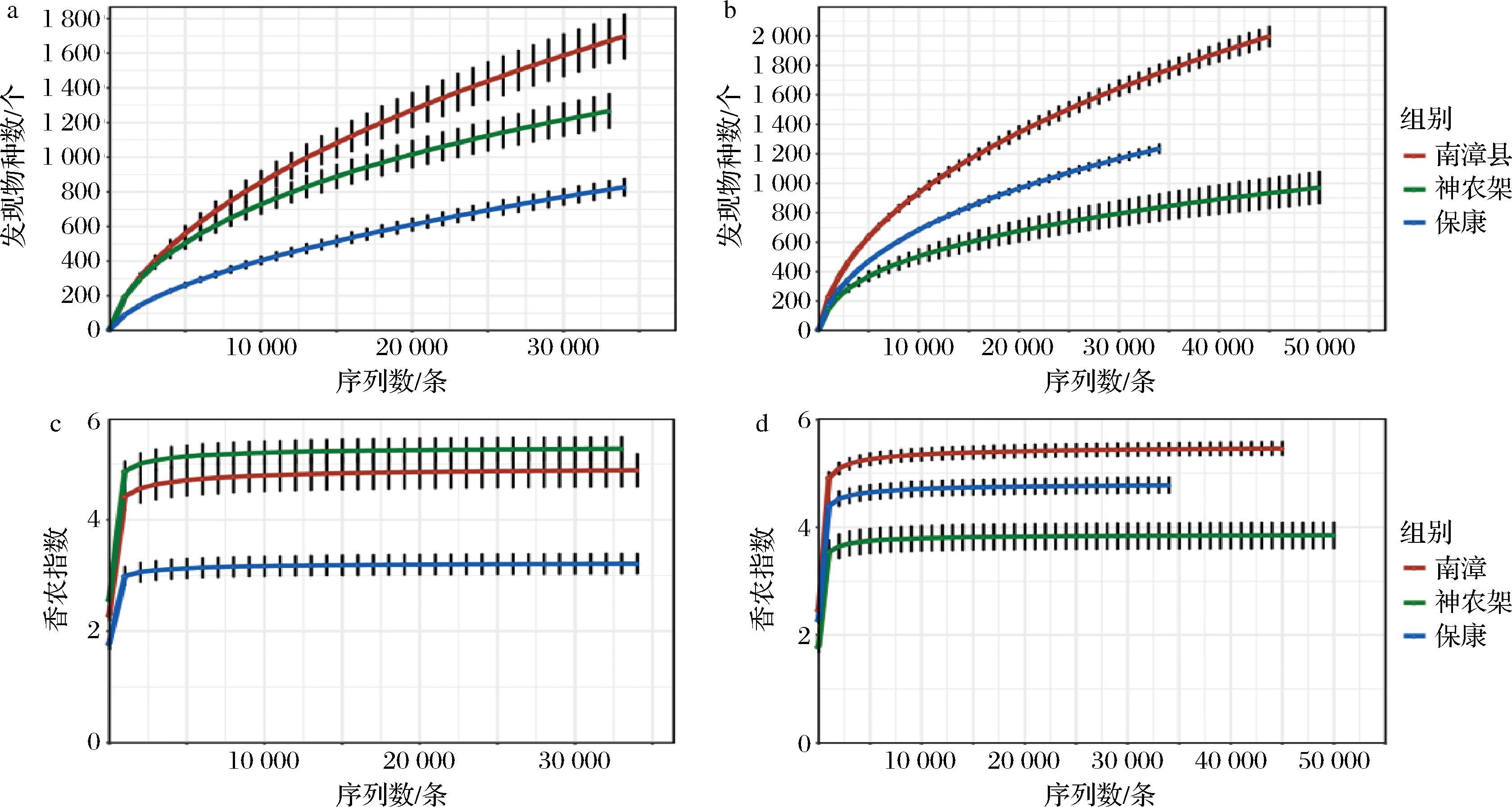
a-细菌的发现物种数;b-真菌的发现物种数;c-细菌的香农指数;d-真菌的香农指数
图1 高温大曲中细菌和真菌的发现物种数和香农指数曲线
Fig.1 Number of observed species and the Shannon index curves for bacteria and fungi in the high-temperature Daqu
2.2 鄂西北酱酒产区高温大曲的微生物类群解析
通过测序,所有有效16S rRNA基因序列共鉴定到29个门、54个纲、100个目、210个科和439个属,其中分别有0.37%和8.64%的序列未鉴定到门和属水平。所有有效ITS基因序列共鉴定到6个门、16个纲、30个目、50个科和82个属,其中分别有0.04%和8.06%的序列未鉴定到门和属水平。本研究将相对含量>1.0%的门和属定义为优势门和属。由图2-a可知,鄂西北地区高温大曲中含有3个优势细菌门,分别为厚壁菌门(Firmicutes,86.28%)、放线菌门(Actinobacteria,8.97%)和变形菌门(Proteobacteria,3.08%),平均累计相对含量达98.94%。由图2-c可知,鄂西北地区高温大曲中含有8个优势细菌属,分别为隶属于Firmicutes的Kroppenstedtia(22.04%)、慢生芽孢杆菌属(Lentibacillus,17.82%)、Bacillus(15.81%)、葡萄球菌属(Staphylococcus,10.48%)、高温放线菌属(Thermoactinomyces,10.20%)、岩石芽孢杆菌属(Scopulibacillus,4.44%)和Oceanobacillus(1.52%);隶属于Actinobacteria的糖多孢菌属(Saccharopolyspora,3.82%),平均累计相对含量达86.39%。在8个优势细菌属中,Lentibacillus、Bacillus、Scopulibacillus和Oceanobacillus均属于芽孢菌类群,累计相对含量达39.59%。

a-优势细菌门相对含量;b-优势真菌门相对含量;c-优势细菌属相对含量;d-优势真菌属相对含量
图2 鄂西北酱酒产区高温大曲中的优势微生物类群分析
Fig.2 Dominant microbial taxa in the high-temperature Daqu from the sauce-aroma Baijiu production region in the northwestern Hubei Province
由图2-b可知,在鄂西北地区高温大曲中含有2个优势真菌门,分别为Ascomycota(子囊菌门,94.85%)和Mucoromycota(毛霉菌门,4.77%),平均累计相对含量达99.62%。由图2-d可知,鄂西北地区高温大曲中含有5 个优势细菌属,分别为隶属于Ascomycota的嗜热丝孢菌属(Thermomyces,39.91%)、嗜热子囊菌属(Thermoascus,28.23%)、Aspergillus(10.10%)和Saccharomycopsis(1.34%);隶属于Mucoromycota的根霉菌属(Rhizopus,4.15%),平均累计相对含量达85.99%。在5个优势真菌属中,Thermomyces、Aspergillus和Rhizopus均为霉菌,累计相对含量为54.16%。
由此可见,该产区高温大曲中的优势微生物类群主要为芽孢菌和霉菌。PANG等[20]对我国北方地区高温大曲的微生物类群进行解析得到的结果与本研究结果相类似,发现其中亦含有较高含量的Bacillus和Thermoascus,它们均属于耐热菌群[21-22]。这与高温大曲的发酵温度较高密切相关。
2.3 鄂西北酱酒产区高温大曲中的核心微生物类群解析
为明确3个县区高温大曲中的核心微生物类群,本研究进一步从OTU水平展开了分析,并将所有样品中均含有的OTU定义为核心OTU。由图3-a可知,纳入本研究中的70份大曲样品中共存在7个核心细菌OTU。由图3-b可知,通过序列比对有4个OTU被鉴定为Kroppenstedtia,累计平均相对含量达18.11%;有2个OTU被鉴定为Lentibacillus,累计平均相对含量为11.72%;有1个OTU被鉴定为Saccharopolyspora,平均相对含量为2.93%。累计核心细菌OTU相对含量达32.77%,超过了优势细菌类群总量的1/3。由图3-c可知,纳入本研究中的所有样品中共存在2个核心真菌OTU。由图3-d可知,通过序列比对发现一个OTU被鉴定为Thermomyces,平均相对含量达26.00%;另一个OTU被鉴定为Aspergillus,平均相对含量为5.17%。累计核心真菌OTU相对含量达31.17%,亦超过了优势真菌类群总量的1/3。上述菌群是高温大曲中常见的几类微生物类群[23-24]。在比较不同等级高温大曲中的微生物和代谢特征时,ZHANG等[23]发现Kroppenstedtia是所有样品中含量最高的菌属,且它与葡萄糖含量呈正相关。YANG等[25]解析酱香型白酒堆积发酵过程中微生物群落多样性时发现,Lentibacillus与大曲表面还原糖含量呈正相关。Thermomyces能在高温环境下分泌多种酶[26]。因而,这些菌群在降解代谢原料中的大分子物质方面可能均有着积极作用。

a-各样本中的细菌OTU数量统计;b-核心细菌OTU相对含量分析;c-各样本中的真菌OTU数量统计;d-核心真菌OTU相对含量分析
图3 鄂西北酱酒产区高温大曲的核心菌群分析
Fig.3 Core microbial community analysis of high-temperature Daqu in the sauce-amora Baijiu production region in the northwestern Hubei Province
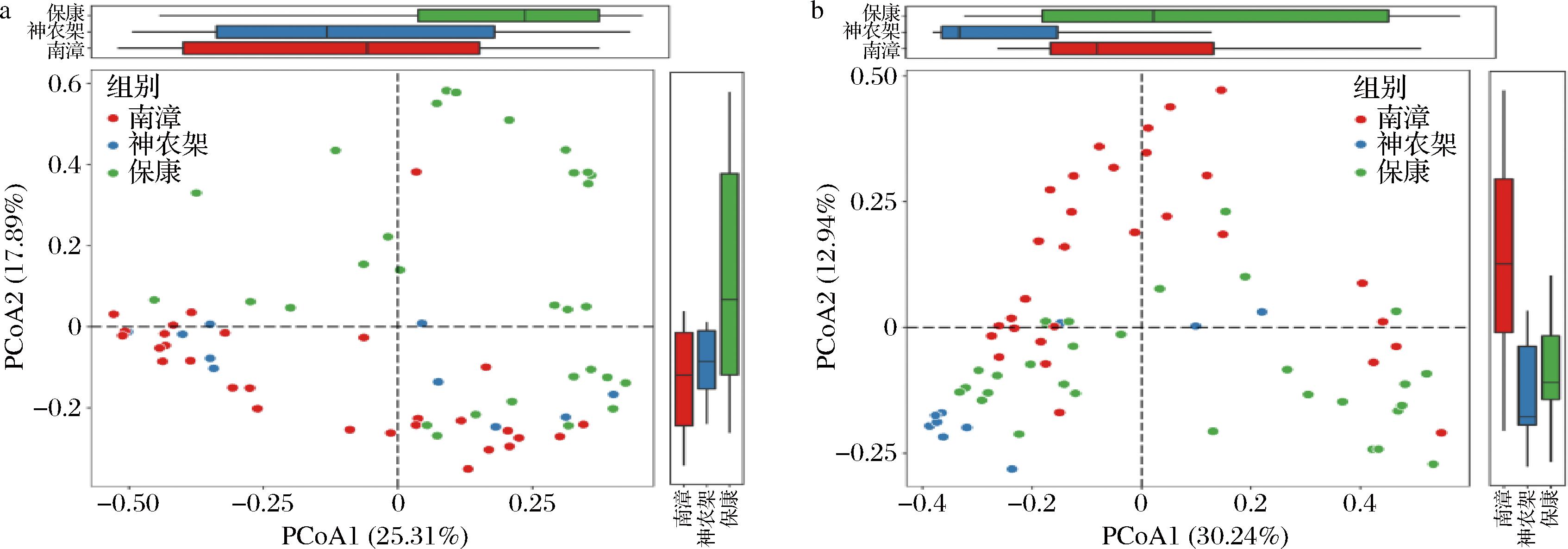
a-细菌菌群的PCoA;b-真菌菌群的PCoA
图4 三个县区高温大曲的β多样性分析
Fig.4 β-Diversity analysis of high-temperature Daqu in three counties
2.4 鄂西北酱酒产区各县区高温大曲中的特征微生物类群解析
本研究进一步基于Bray-curtis距离对三县区样品展开了PCoA。由图4-a可知,在二维空间分布中,保康样品中的细菌与其他2个地区样品有明显分离趋势。保康县样品主要分布在第一、第三象限对角线的上半部分,而其他2个县区中的细菌主要分布在第一、第三象限对角线的下半部分。由图4-b可知,3个县区样品中的真菌在二维空间中均有明显分离,南漳县样品主要分布在第二、第四象限对角线的上半部分,保康县样品主要分布在y轴的负半轴,而神农架样品主要分布在第四象限。由此可见,3个县区样品中的细菌和真菌群落结构亦存在一定差异。因此,本研究进一步探究了各县区高温大曲中的特征微生物。
本研究将在南漳县样品中均存在,而其他样品中均不存在的OTU定义为南漳县样品中的特征OTU,神农架林区和保康县的样品同理。由表2可知,在细菌方面,南漳县样品中含有4个特有细菌OTU,累计平均相对含量为25.60%,其中1个OTU隶属于Bacillus,相对含量占到23.75%。神农架林区样品中含有25个特有细菌OTU,累计相对含量达10.96%,其中有2个OTU隶属于Thermoactinomyces,4个OTU隶属于Bacillus,9个OTU隶属于Kroppenstedtia,累计相对含量分别为4.92%、3.11%和1.07%。保康县样品中含有1个特有细菌OTU,隶属于Staphylococcus,平均相对含量为17.63%。值得注意的是,ZHANG等[23]发现优级大曲中的Staphylococcus含量远低于普级大曲。Staphylococcus在高温大曲中亦较为常见,但也常被报道为致病菌,是人类足部表面的主要优势属[27]。因此高温大曲中的该菌属可能是由工人赤脚采曲时所引入进去的,但目前尚不清楚Staphylococcus是否会导致白酒生产中的食品安全问题。此外,神农架林区样品中的特有细菌OTU数量及其鉴定到的细菌种类最多,其特有的25个OTU被鉴定到了9个细菌种类,而南漳县和保康县样品中的特有OTU仅分别鉴定到4个和1个细菌种类。
表2 三个县区高温大曲中的特有细菌和真菌OTU相对含量分析
Table 2 Relative content of unique bacteria and fungi OTU in high-temperature Daqu from three counties
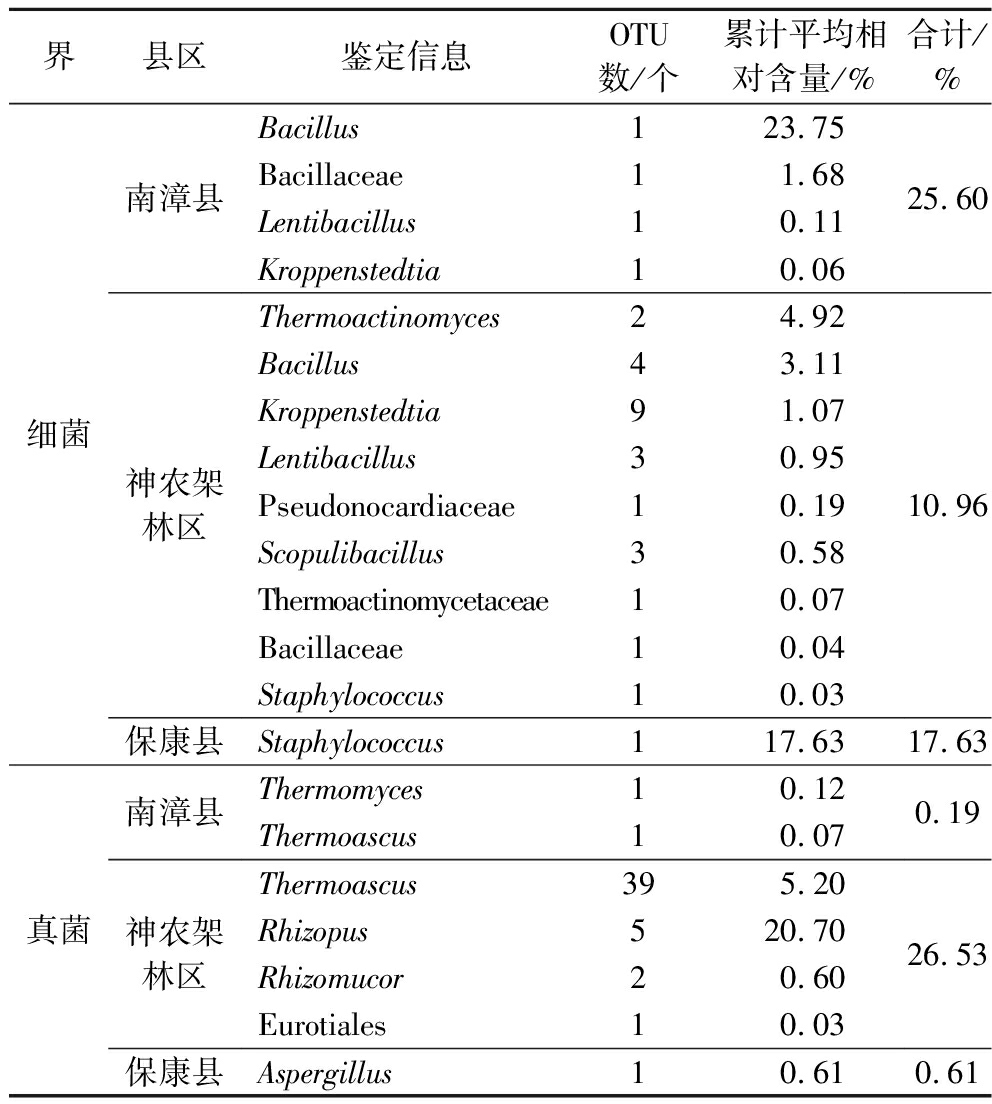
界县区鉴定信息OTU数/个累计平均相对含量/%合计/%细菌南漳县神农架林区保康县Bacillus123.75Bacillaceae11.68Lentibacillus10.11Kroppenstedtia10.06Thermoactinomyces24.92Bacillus43.11Kroppenstedtia91.07Lentibacillus30.95Pseudonocardiaceae10.19Scopulibacillus30.58Thermoactinomycetaceae10.07Bacillaceae10.04Staphylococcus10.03Staphylococcus117.6325.6010.9617.63真菌南漳县神农架林区保康县Thermomyces10.12Thermoascus10.07Thermoascus395.20Rhizopus520.70Rhizomucor20.60Eurotiales10.03Aspergillus10.610.1926.530.61
在真菌方面,南漳县样品中含有2个特有真菌OTU,分别隶属于Thermomyces和Thermoascus,累计相对含量为0.19%。神农架林区样品中含有47个特有真菌OTU,累计相对含量达26.53%,其中有39个OTU隶属于Thermoascus,累计平均相对含量为5.20%,有5个OTU隶属于Rhizopus,累计平均相对含量为20.70%。保康县样品中含有1个特有真菌OTU,平均相对含量为0.61%。神农架林区样品中的特有真菌OTU及其鉴定到的真菌种类亦最多。由此可见,神农架林区样品中的特有微生物类群相对丰富。
3 结论
鄂西北酱酒产区高温大曲中的优势微生物类群大多集中在芽孢菌和霉菌类群上,例如Lentibacillus、Bacillus、Thermomyces和Aspergillus。该产区高温大曲中的核心细菌类群为Kroppenstedtia、Lentibacillus和Saccharopolyspora,核心真菌类群为Thermomyces和Aspergillus,这些核心菌群的占比超过了优势菌群总量的1/3。然而,该产区不同县区样品中仍存在各自特有的细菌和真菌类群,其中神农架林区样品中的特有微生物种类最为丰富,主要为隶属于Thermoactinomyces、Bacillus、Kroppenstedtia、Thermoascus和Rhizopus的物种。综上,鄂西北酱酒产区高温大曲中的微生物主要以Bacillus和Thermomyces等为代表的耐热菌群为主。
[1] ZHOU W, CHEN Z Y, ZHANG G H, et al.A system-level investigation into the pharmacological mechanisms of flavor compounds in liquor[J].Journal of Food Biochemistry, 2020, 44(10):e13417.
[2] 唐维川, 孔祥凯, 王婷, 等.基于主成分分析法评价酱香型白酒的不同轮次基酒[J].现代食品科技, 2021, 37(7):269-277;268.TANG W C, KONG X K, WANG T, et al.Evaluation of different rounds of Moutai-flavor Baijiu based on principal component analysis[J].Modern Food Science and Technology, 2021, 37(7):269-277;268.
[3] GE J F, QI Y L, YAO W R, et al.Identification of trace components in sauce-flavor Baijiu by high-resolution mass spectrometry[J].Molecules, 2023, 28(3):1273.
[4] 姜政飞. 赤水河产区酱香型白酒酿造微生物来源及环境微生物分布[D].无锡:江南大学, 2023.JIANG Z F.Microbial sources and environmental microbial distribution of the sauce-flavor Baijiu in the Chishui River producing region[D].Wuxi:Jiangnan University, 2023.
[5] 侯强川, 王玉荣, 王文平, 等.茅台和尧治河高温大曲细菌群落结构差异及功能预测[J].食品与发酵工业, 2022, 48(1):36-44.HOU Q C, WANG Y R, WANG W P, et al.Difference of bacterial community structure and functional prediction in high-temperature Daqu of Maotai and Yaozhihe[J].Food and Fermentation Industries, 2022, 48(1):36-44.
[6] HOU Q C, WANG Y R, QU D W, et al.Microbial communities, functional, and flavor differences among three different-colored high-temperature Daqu:A comprehensive metagenomic, physicochemical, and electronic sensory analysis[J].Food Research International, 2024, 184:114257.
[7] GUO Z, XIANG F S, HOU Q C, et al.Analysis of bacterial community structure and taste quality of different colored high-temperature Daqu in the Xiangyang region, China[J].LWT, 2023, 188:115411.
[8] CAI W C, WANG Y R, NI H, et al.Diversity of microbiota, microbial functions, and flavor in different types of low-temperature Daqu[J].Food Research International, 2021, 150:110734.
[9] LI W W, FAN G S, FU Z L, et al.Effects of fortification of Daqu with various yeasts on microbial community structure and flavor metabolism[J].Food Research International, 2020, 129:108837.
[10] CHEN Y R, LI K M, LIU T, et al.Analysis of difference in microbial community and physicochemical indices between surface and central parts of Chinese special-flavor Baijiu Daqu[J].Frontiers in Microbiology, 2020, 11:592421.
[11] GUO Z, WANG Y R, XIANG F S, et al.Bacterial diversity in pickled cowpea (Vigna unguiculata[Linn.] walp) as determined by illumina MiSeq sequencing and culture-dependent methods[J].Current Microbiology, 2021, 78(4):1286-1297.
[12] 向凡舒, 蔡文超, 田龙新, 等.襄阳地区高温大曲真菌群落结构及其风味品质解析[J].食品科学, 2023, 44(24):211-219.XIANG F S, CAI W C, TIAN L X, et al.Analysis of fungal community structure and flavor quality of high-temperature Daqu from Xiangyang, China[J].Food Science, 2023, 44(24):211-219.
[13] WANG Y R, CAI W C, WANG W P, et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Science &Nutrition, 2021, 9(2):1003-1016.
[14] CAI W C, XUE Y A, WANG Y R, et al.The fungal communities and flavor profiles in different types of high-temperature Daqu as revealed by high-throughput sequencing and electronic senses[J].Frontiers in Microbiology, 2021, 12:784651.
[15] MAGO T, SALZBERG S L.FLASH:Fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics, 2011, 27(21):2957-2963.
T, SALZBERG S L.FLASH:Fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics, 2011, 27(21):2957-2963.
[16] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods, 2010, 7(5):335-336.
[17] WEI Z G, ZHANG X D, CAO M, et al.Comparison of methods for picking the operational taxonomic units from amplicon sequences[J].Frontiers in Microbiology, 2021, 12:644012.
[18] POLLOCK J, GLENDINNING L, WISEDCHANWET T, et al.The madness of microbiome:Attempting to find consensus “best practice” for 16S microbiome studies[J].Applied and Environmental Microbiology, 2018, 84(7):e02 627-17.
[19] BRANDT M I, TROUCHE B, QUINTRIC L, et al.Bioinformatic pipelines combining denoising and clustering tools allow for more comprehensive prokaryotic and eukaryotic metabarcoding[J].Molecular Ecology Resources, 2021, 21(6):1904-1921.
[20] PANG Z M, LI W W, HAO J, et al.Correlational analysis of the physicochemical indexes, volatile flavor components, and microbial communities of high-temperature Daqu in the northern region of China[J].Foods, 2023, 12(2):326.
[21] ZHAN E X, XU S X, CHEN X X, et al.Effects of high temperature pretreatment and inoculation of Bacillus coagulans on promoting aerobic composting of chicken manure[J].BioResources, 2023, 18(2):3089-3100.
[22] ZHU M, ZHENG J, XIE J, et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Research International, 2022, 153:110955.
[23] ZHANG Y D, DING F, SHEN Y, et al.Characteristics of the microbiota and metabolic profile of high-temperature Daqu with different grades[J].World Journal of Microbiology and Biotechnology, 2022, 38(8):137.
[24] SHI W, CHAI L J, ZHAO H, et al.Deciphering the effects of different types of high-temperature Daqu on the fermentation process and flavor profiles of sauce-flavor Baijiu[J].Food Bioscience, 2024, 61:104917.
[25] YANG L, XIAN C, LI P, et al.The spatio-temporal diversity and succession of microbial community and its environment driving factors during stacking fermentation of Maotai-flavor Baijiu[J].Food Research International, 2023, 169:112892.
[26] DENG L, MAO X, LIU D, et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Frontiers in Microbiology, 2020, 11:588117.
[27] ZHANG H X, WANG L, WANG H Y, et al.Effects of initial temperature on microbial community succession rate and volatile flavors during Baijiu fermentation process[J].Food Research International, 2021, 141:109887.