中国白酒,是世界上最古老的蒸馏酒之一,也是消费量最高的酒[1]。与其他蒸馏酒(威士忌和白兰地)相比,中国白酒的发酵是一个独特且复杂的过程,大曲因富含微生物群落、功能酶类和风味前体物质,在白酒发酵过程中发挥着重要作用[2]。大曲的生产是传统的开放环境自然固态发酵过程,在整个发酵过程中来自自然界的微生物自然接种并组装到大曲中[3],值得注意的是,这种看似粗放的开放式发酵体系,实际上蕴含着复杂且定向的微生物筛选机制,大曲生产环境及原料很有可能是大曲微生物群落的重要来源。
国内外有较多白酒发酵微生物来源的研究成果,如邓宇珂[4]研究表明大曲对发酵90 d酒醅贡献了39.10%的细菌和67.13%的真菌,主要是魏茨曼氏菌属(Weizmannia)、克罗彭斯特菌属(Kroppenstedtia)、Trichomonascus、曲霉属(Aspergillus)(6.20%)和热子囊菌属(Thermoascus)(18.28%)。而目前大曲微生物群落的来源以及这些微生物是如何富集到大曲中的研究较少。因此,对原料和环境中的微生物群落进行研究以解析大曲微生物来源很有必要,有利于合理控制大曲发酵过程。
传统的微生物溯源技术如微生物源示踪(microbial source tracking,MST)技术主要是基于特定目标,即侧重于检测预定的源特定标志性物种(例如与人类相关的HF183细菌群)或化学物质(例如胆固醇和粪甾醇),主要用于鉴定水体中细菌污染源的种类及占比,并判定其来源[5]。近年来,随着第二代高通量测序和组学技术的发展,加深了对发酵食品微生物群落演替及功能的进一步认识,也为微生物溯源提供了更高效、便捷的方法,已广泛应用于土壤[6]、珊瑚礁[7]和食品安全[8]等领域。
同时,多种统计学方法也逐渐引入微生物溯源分析[9-10],基于贝叶斯方法的多种微生物学源回溯(source tracker)技术因准确度高而成为了微生物溯源的热点,越来越多的研究学者开始对清香型白酒、浓香型白酒大曲和陈醋等发酵食品中微生物来源进行分析[3,11-14]。DU等[15]采用高通量测序结合source tracker技术对大曲微生物群落的来源进行分析,发现大曲中的真菌群落主要来源于大曲制作环境(主要是工具和室内地面),细菌群落大部分来自原材料。ZHANG等[16]利用source tracker技术分析了西凤酒大曲微生物来源,结果显示94.7%的真菌来自原材料,1.80%来自室外地面,60.95%的细菌来自室内地面,20.44%来自原材料,8.98%来自工具。然而,不同地区的环境微生物存在差异,使得大曲质量控制和生产安全更具复杂性,此外,传统食品的生产不稳定性也源于环境微生物的不可控性[16]。可见,了解大曲微生物群落的来源,对于大曲生产稳定性的保持及质量提升非常重要。因此,以原料(原料小麦、润料仓小麦、小麦粉)和环境样本(制曲工具、空气、水)为来源,应用高通量测序结合source tracker技术对发酵前后大曲微生物进行溯源性研究,以期揭示其微生物群落组成及其来源,为大曲群落定向驯化和驱动提供理论依据。
1 材料与方法
1.1 材料与试剂
CretMagTM Power Soil DNA Kit 提取试剂盒,中国白垩纪公司;NEXTFLEX® Rapid DNA-Seq Kit建库试剂盒,美国Bioo Scientific公司;VAHTS® Universal Plus DNA Library Prep Kit for MGI V2测序试剂盒,中国诺唯赞公司。
1.2 仪器与设备
FA-1H空气微生物采样器,青岛聚创环保集团有限公司;Eppendorf 5424R高速台式冷冻离心机,德国Eppendorf公司;NanoDrop2000超微量分光光度计,美国Thermo Fisher Scientific公司;QuantusTM Fluorometer微型荧光计,美国Promega公司;Miseq测序仪,美国Illumina公司。
1.3 实验方法
1.3.1 样品采集
采样时间:夏季连续生产期间,采样地点:西北某酒厂制曲车间。采用机械制曲工艺,选择3个曲房作为平行跟踪采集样品,共采集14种样品,包括原材料及大曲样品(原料小麦、润料仓小麦、小麦粉、水、0 d曲坯和成曲)、环境样品(液压压曲机、运输推车、草帘、曲架、糠壳)、空气样品(制曲场地和曲房空气)和其他(制曲工人)。取样方法参考刘英杰等[13]的方法,并稍作修改,具体如下:
原材料及大曲样品:大曲样本分别在大曲发酵开始与发酵结束时采集,每个样本随机取12片大曲,每片曲取1/4后混合粉碎,五点取样法取样,装入50 mL离心管,于-80 ℃冰箱贮存待测。原料小麦、润料仓小麦和小麦粉样本从当天生产仓库中随机收集,每隔30 min取200 g,取5次混为1个样,每种50 g。水样:收集制曲车间当日生产用水。
环境样品:采用PBS预先浸润的无菌脱脂棉球均匀擦拭制曲机器(液压压曲机)、制曲工具(运输推车)、草帘和曲架表面,无菌手套采集糠壳。每个房间每种工具采集5个点,汇集并装入50 mL无菌离心管,置于-80 ℃密封保存。
空气样品:曲房空气及制曲车间空气微生物使用空气微生物采样器收集于30 mL无菌的0.1 mol/L PBS中。采样流量15 L/min,采样时间67 min,装入50 mL无菌离心管,于-80 ℃保存。
其他:制曲工人双手微生物样本,采用PBS浸湿的无菌棉擦拭制曲工人的双手,放入50 mL离心管中及时转移至-80 ℃冰箱保存。
大曲微生物溯源取样记录表如表1所示。
表1 大曲微生物溯源性分析取样记录表
Table 1 Record of sampling for microbiological traceability analysis of Daqu
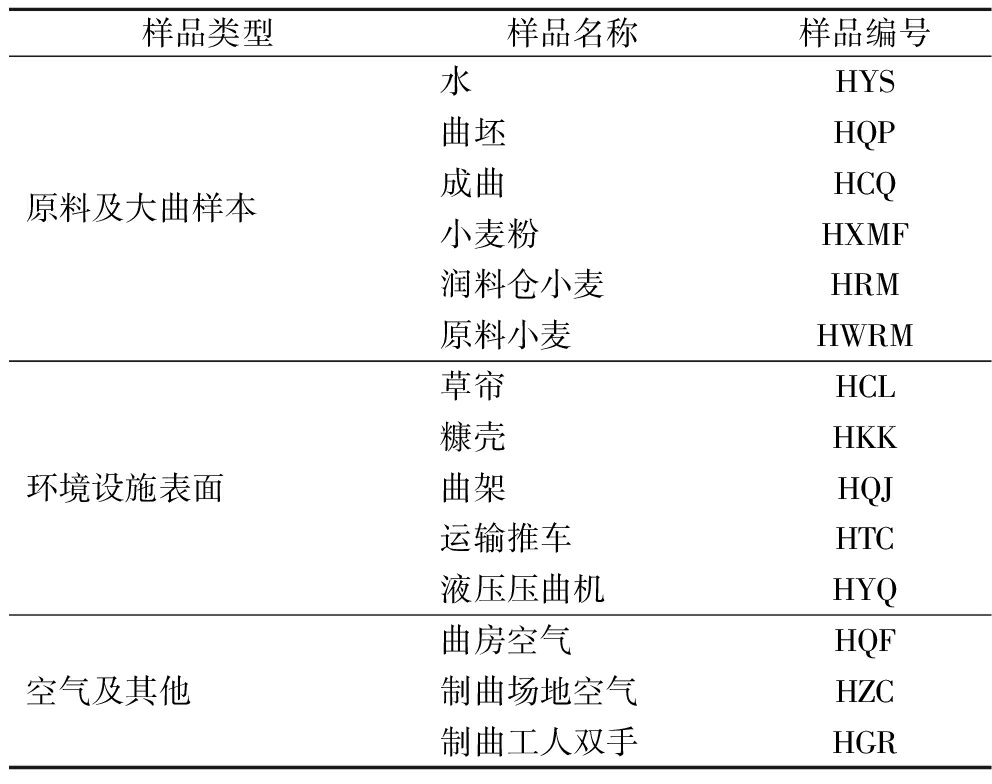
样品类型样品名称样品编号原料及大曲样本水HYS曲坯HQP成曲HCQ小麦粉HXMF润料仓小麦HRM原料小麦HWRM环境设施表面草帘HCL糠壳HKK曲架HQJ运输推车HTC液压压曲机HYQ空气及其他曲房空气HQF制曲场地空气HZC制曲工人双手HGR
1.3.2 DNA提取与扩增
大曲及环境样本DNA提取按照试剂盒说明书进行,使用超微量分光光度计检测DNA浓度和纯度,1%琼脂糖凝胶电泳检测DNA完整性。细菌和真菌PCR扩增:细菌V3~V4区采用通用引物341F/806R,真菌ITS1区使用引物ITS1F/ITS2R[17-18]。PCR扩增体系(50 μL):2×Es Taq Master Mix (Dye) 25 μL,正反引物各2 μL(10 μmol/L),Template DNA 2 μL,Nuclease-free Water 19 μL。PCR反应程序:94 ℃预变性2 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共30个循环,最后72 ℃保持10 min。使用2%琼脂糖凝胶电泳检测PCR产物后采用AxyPrep DNA Gel Extraction Kit试剂盒进行纯化。
1.3.3 高通量测序和序列分析
使用NEXTFLEX®Rapid DNA-Seq Kit进行建库,利用Illumina公司的NovaSeq PE250平台进行测序,使用fastp(https://github.com/OpenGene/fastp,version 0.20.0)对原始测序序列进行质控[19],使用FLASH(http://www.cbcb.umd.edu/software/flash,version 1.2.7)进行拼接[20],使用UPARSE软件(http://drive5.com/uparse/,version 7.1),根据97%的相似度[21-22]对序列进行操作分类单位(operational taxonomic unit,OTU)聚类。
1.4 数据处理
使用R软件进行非度量多维尺度分析、聚类热图分析和微生物溯源分析。
2 结果与分析
2.1 制曲环境、原料和大曲的微生物多样性
利用高通量测序技术探究了成曲、曲坯、原料和制曲环境(工具、空气、液压压曲机)中的微生物群落结构,从全部14个样品中共获得了来自16S rRNA基因序列V3~V4区的1 565 852个高质量序列,以及内部转录间隔区的1 486 764个高质量序列。稀释曲线用于评估测序数据合理性,并能反映出样品中物种的丰富程度,曲线趋平表明测序数据量合理,继续测序只能发现极少量的新OTU。图1中稀释曲线趋于平坦,表明本次测序的深度与广度已足够全面,能够较为精确地反映出样本中绝大多数细菌和真菌种群信息。
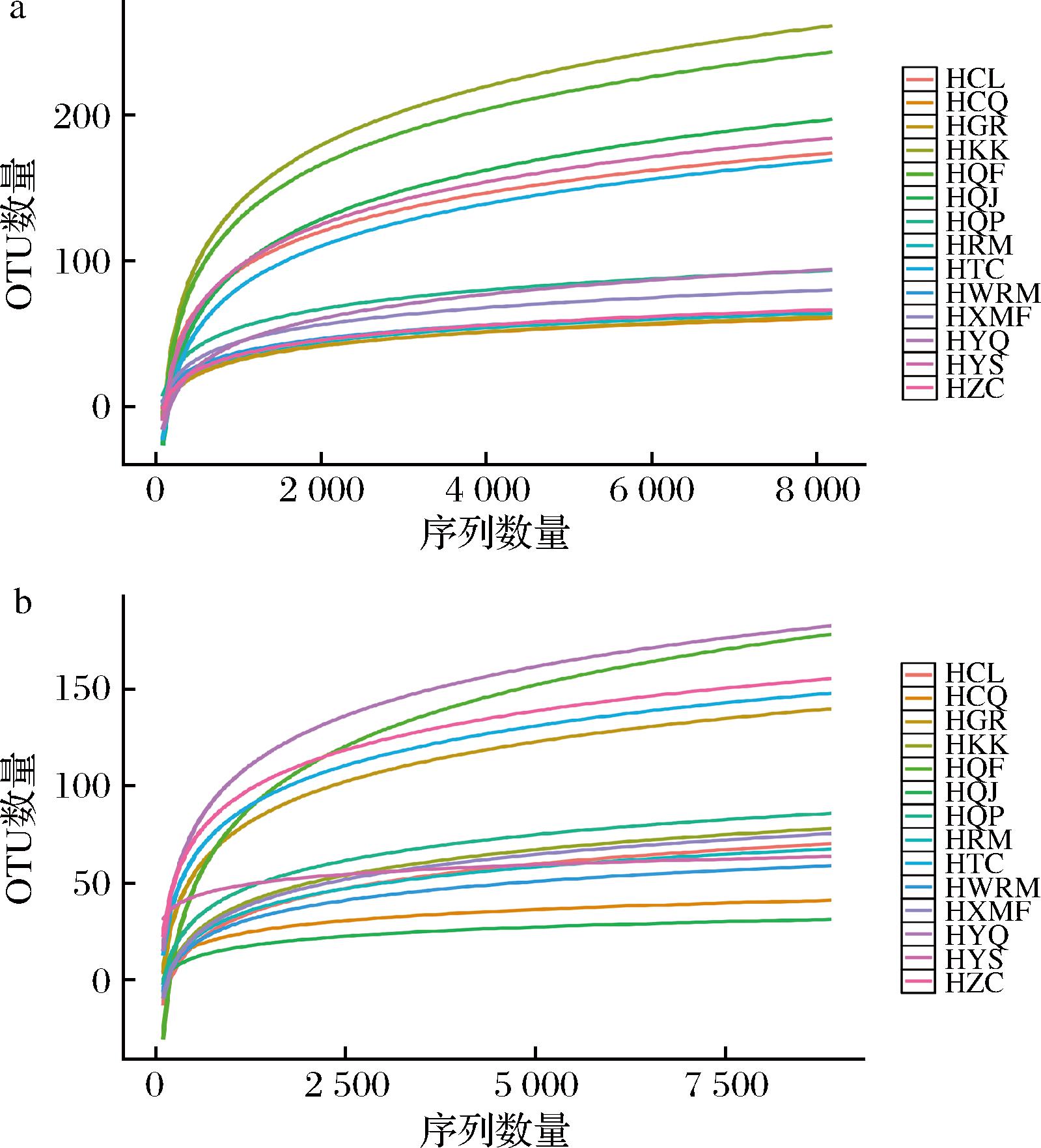
a-细菌;b-真菌
图1 高通量测序稀释曲线
Fig.1 High-throughput sequencing dilution curves
利用Chao 1和Shannon指数分别评估大曲、原料和环境样品微生物群落内物种分布的丰富度和多样性(表2),对于大曲样品,发现成曲细菌丰度低于曲坯,但群落分布多样性大于曲坯。原材料和环境样品中,曲房空气群落丰度最高,长期与地面和大曲接触的糠壳细菌多样性最高,而原材料的细菌多样性最低。成曲的真菌丰度和多样性低于曲坯,原因可能是曲坯在发酵至成曲的过程中,许多真菌已被消除,培育出了新的优势菌群[16]。曲房空气的真菌丰富度最高,而成曲最低。压曲机的真菌多样性最高,是成曲的2.72倍,该结果与ZHANG等[16]研究结果一致,其研究表明大曲真菌丰富度最低,空气真菌丰富度最高,大曲真菌多样性低于曲坯,可能是大曲的培养过程定向筛选出了独特的微生物群落结构。值得注意的是,3种原料样品微生物群落丰度和多样性并不相同,分析其原因在于机械化生产过程中,原料小麦经设备及管道进行润料、破碎、曲坯制作和运输等工序,影响了原料样品微生物群落组成。
表2 各样品细菌和真菌多样性差异
Table 2 Differences in bacterial and fungal diversity among samples
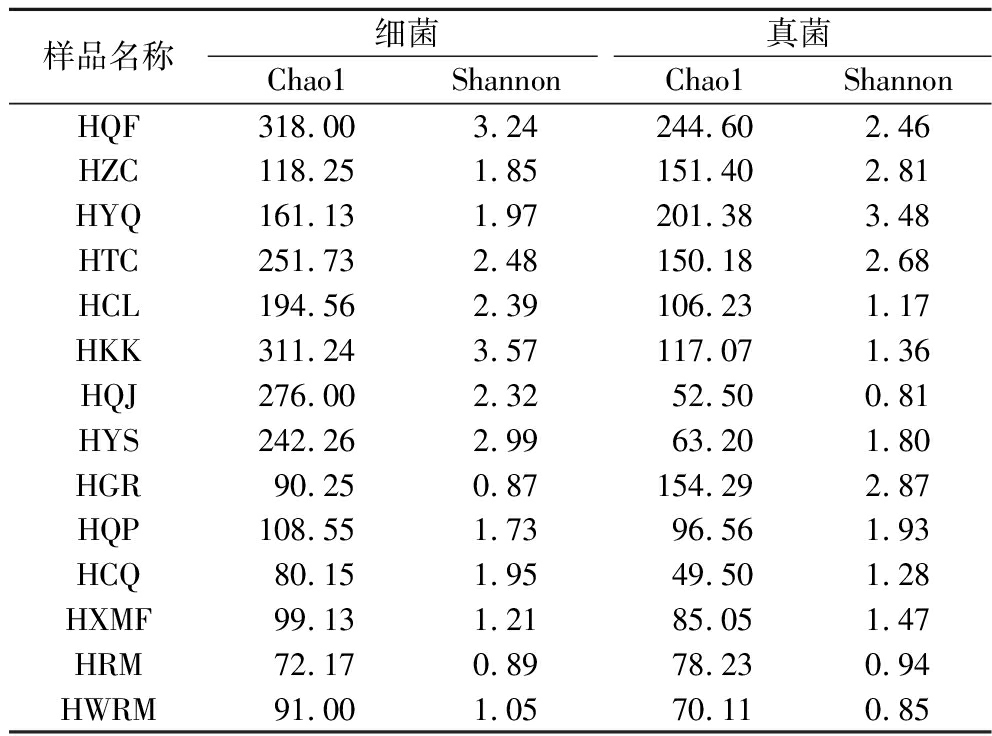
样品名称细菌真菌Chao1ShannonChao1ShannonHQF318.003.24244.602.46HZC118.251.85151.402.81HYQ161.131.97201.383.48HTC251.732.48150.182.68HCL194.562.39106.231.17HKK311.243.57117.071.36HQJ276.002.3252.500.81HYS242.262.9963.201.80HGR90.250.87154.292.87HQP108.551.7396.561.93HCQ80.151.9549.501.28HXMF99.131.2185.051.47HRM72.170.8978.230.94HWRM91.001.0570.110.85
2.2 微生物群落结构差异
2.2.1 细菌属水平分析
高通量测序结果显示所有样品(原料、大曲和制曲环境)在细菌属水平共检测到257个属,其中,在曲坯样品中仅检测到26个属,在成曲中检测到36个属,而在制曲原料和环境中仅能检测到195个属。
图2-a显示了各样品相对丰度>1%的细菌属水平信息,并采用非加权配对平均法(unweighted pair-group method with arithmetic means,UPGMA)聚类建树,各样品主要归属于31个属,曲坯与原料聚为一类,其优势细菌为魏斯氏菌属(Weissella)(60.76%)、乳球菌属(Lactococcus)(26.65%)、贪铜菌属(Cupriavidus)(2.72%)和乳杆菌属(Lactobacillus)(1.94%)。
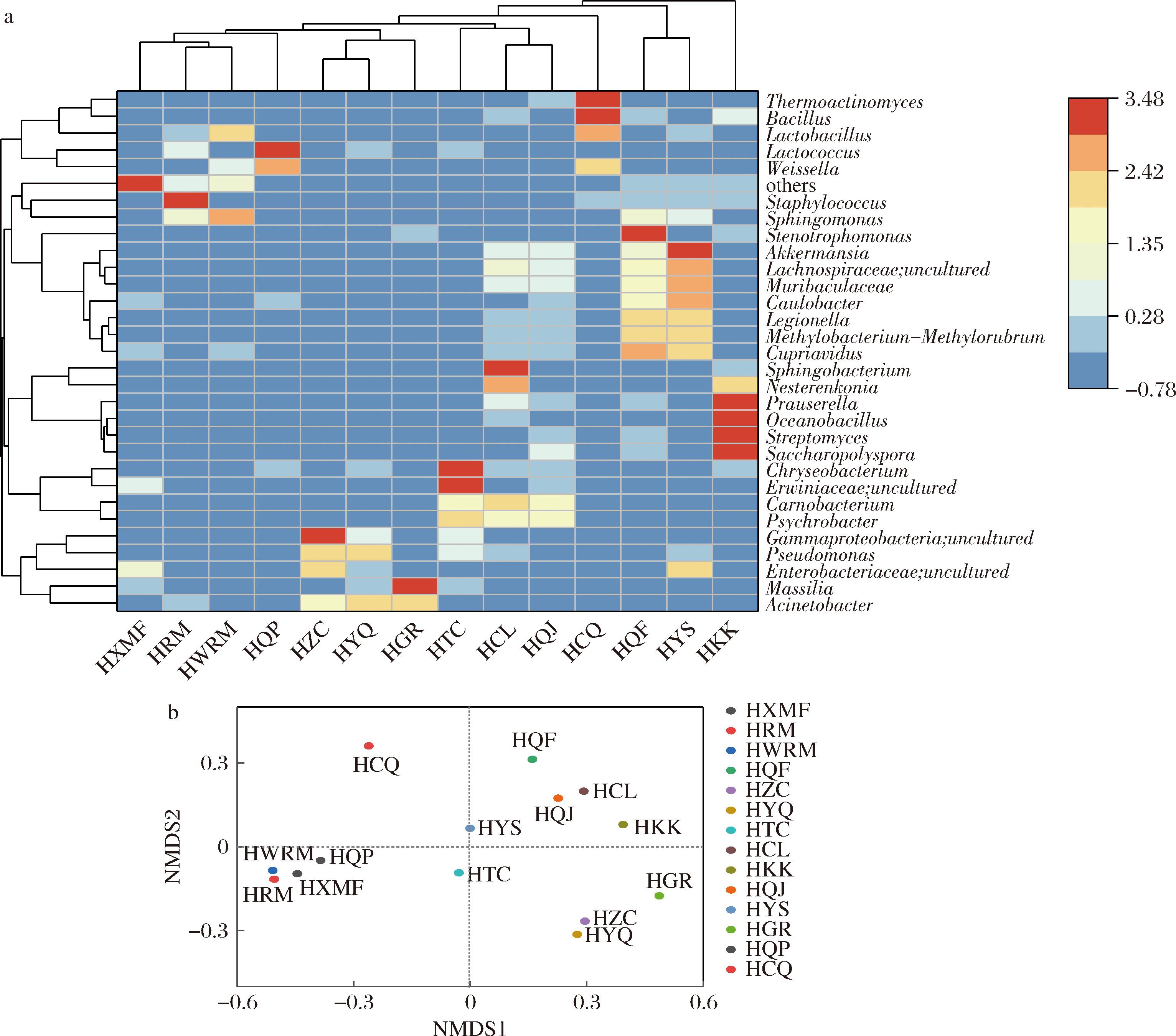
a-优势细菌分布;b-细菌非度量多维度分析
图2 优势细菌分布及非度量多维度分析
Fig.2 Distribution of dominant bacteria and non-metric multidimensional scaling (NMDS) analysis
发酵成熟的大曲富含多种发酵功能微生物,成曲中的细菌大多与风味物质的产生有关[23],经培菌发酵,成曲中魏斯氏菌属(Weissella)(46.75%)相对丰度逐渐降低,乳杆菌属(Lactobacillus)(30.68%)相对丰度显著增加,这2种细菌可能来源于原料小麦(魏斯氏菌属(Weissella)(17.65%)和乳杆菌属(Lactobacillus)(23.53%)),此外,魏茨曼氏菌属(Weizmannia)(10.85%)、高温放线菌属(Thermoactinomyces)(5.79%)相对丰度显著增加,共同构成了成曲主要的优势菌属。高温放线菌属的显著增加可能是因为高温放线菌丰度与大曲品温呈显著正相关[24]。此外,芽孢杆菌在酒类酿造过程中具有产生酶和风味的重要能力[25],乳杆菌是成熟大曲发酵中的重要细菌,它可以在不同发酵食品中贡献乙醇、醋酸和乳酸等重要风味物质[26]。这些微生物可能会迅速改变生态环境并抑制其他不耐受微生物的生长[27]。值得注意的是,这些功能发酵微生物大多在曲坯中的含量并不丰富,成曲微生物群落结构的变化表明大曲制作过程是一种从复杂的环境微生物中自然选择出有利于酒类发酵微生物的过程[15]。聚类结果显示,曲坯、成曲与推车、草帘、工人、曲架、液压压曲机、制曲场地空气和制曲原料聚为一类,表明这些样本可能是大曲的主要微生物来源。
为进一步解释原料、环境样品和大曲微生物之间的关系,利用非度量多维尺度法(non-metric multidimensional scaling,NMDS)对数据进行分析,结果如图2-b所示。曲坯与原料样品距离(HRM、HWRM、HXMF)最接近,表明曲坯和3种原料细菌组成相似程度较大。曲房内采集样本,如草帘、曲架、糠壳和曲房空气距离较近,说明曲房内各样本长期处于同一地理位置,形成了较为相似的细菌群落。同样的,制曲现场样本,如制曲场地空气和液压压曲机表面细菌群落距离较近,表明其相似程度较大。经为期1个月的发酵周期,成曲样本受温、湿度等环境因素调控,其细菌群落与液压压曲机、制曲场地、工人双手等样品距离较远,与聚类分析结果基本一致。
2.2.2 真菌属水平分析
在属水平上,所有样本中获得了233个真菌属,其中曲坯样品共鉴定出39个属,成曲仅鉴定出23个属,在原料和环境样品中鉴定出180个属。
图3-a显示至少一种样本类型中平均相对丰富度超过1.00%的真菌属水平信息,并显示聚类建树结果。与运输推车聚为同簇的曲坯优势真菌分别是未培养真菌属(Uncultured Fungi)、交链孢属(Alternaria)、镰刀菌属(Fusarium)、亚隔孢壳属(Uncultured Didymellaceae)、亚膜威克汉姆酵母属(Wickerhamomyces),平均相对丰度分别为57.68%、29.78%、4.36%、2.30%和1.89%。聚类结果显示成曲单独聚为一类,其他样本聚为一类,经培菌发酵,成曲微生物群落受温、湿度等环境参数调控,其嗜热真菌属(Thermomyces)、热子囊菌属(Thermoascus)、伊萨酵母属(Issatchenkia)、复膜孢酵母属(Saccharomycopsis)、根毛霉属(Rhizomucor)、子囊菌门(Rasamsonia)、曲霉菌属(Aspergillus)显著增加,平均相对丰度分别为69.37%、11.80%、6.61%、3.52%、3.47%、2.22%和1.61%。

a-优势真菌分布;b-真菌NMDS
图3 优势真菌分布及NMDS
Fig.3 Distribution of dominant fungi and NMDS
曲房空气、制曲场地空气、液压压曲机、推车、草帘、糠壳、曲架、用水和工人双手因曲霉菌属(Aspergillus)(9.55%~86.23%)丰度较高而聚为同亚簇。曲坯和成曲中检测出的细菌与真菌部分属于报道过的大曲与白酒发酵的优势功能菌[28],这些魏茨曼氏菌属(Weizmannia)、乳杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)、魏斯氏菌属(Weissella)、热子囊菌属(Thermoascus)和嗜热真菌属(Thermomyces)等,是大曲发酵和白酒酿造过程中产酒、生香、产酶和高效降解碳水化合物的关键功能微生物,直接影响大曲的发酵品质和白酒风味的形成[2]。
图3-b的NMDS分析结果中,点与点之间的距离反映不同样本之间的差异程度,结果表明曲坯与小麦粉、润料仓小麦和原料小麦距离最近,而成曲真菌群落结构与其他样品不同。此外,结果还表明处于同一地理位置且长期接触的样品间可能具有较为相似的真菌群落结构,如液压压曲机、工人双手和运输推车距离较近,草帘与糠壳其距离几乎重叠。
2.3 大曲微生物群落溯源性分析
以曲坯和成曲分别为目标样本,其余样本为不同的微生物来源样本,采用source tracker技术分析原料、制曲环境和工器具对曲坯和成曲微生物群落的贡献(图4)。
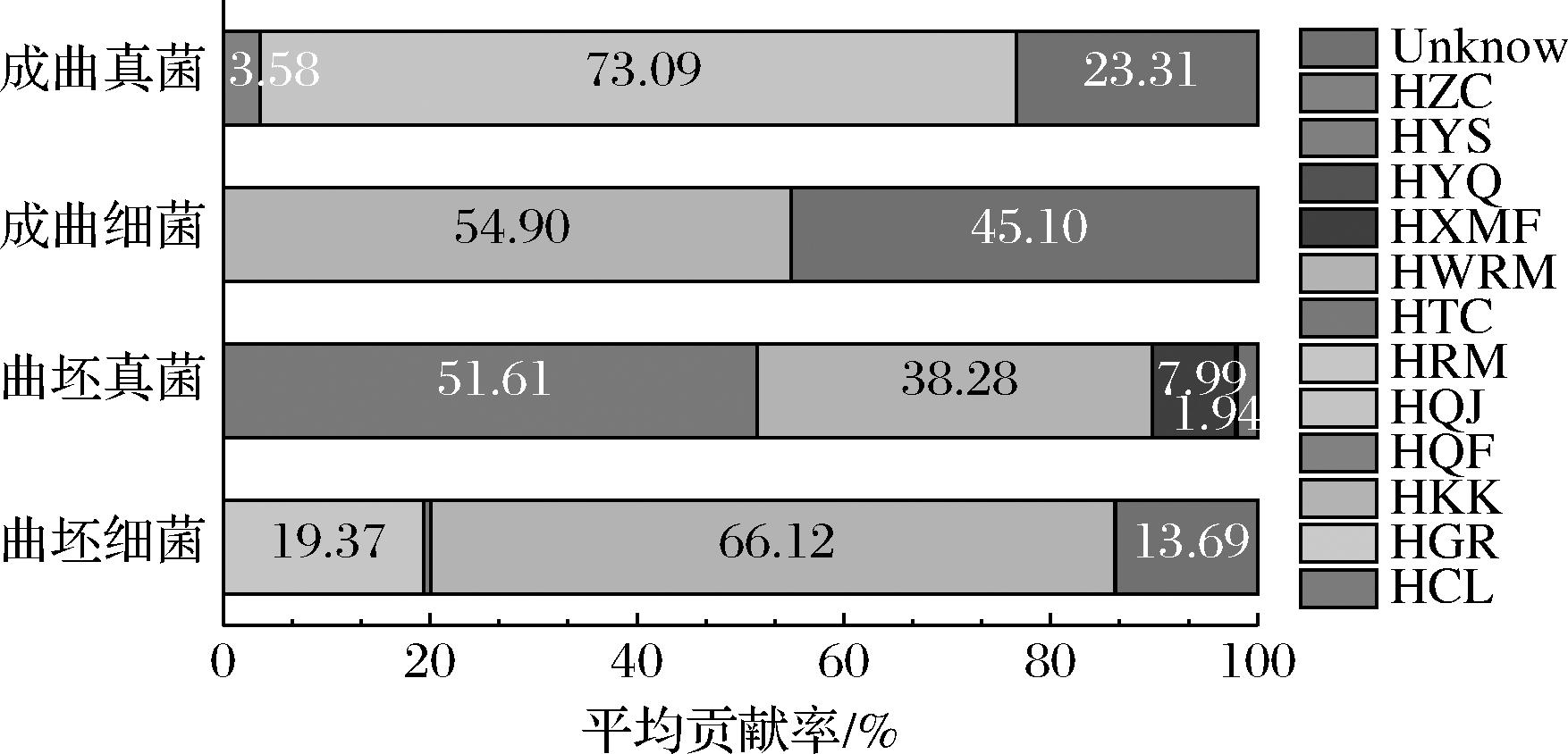
图4 不同来源微生物对曲坯及成曲的平均贡献率
Fig.4 Mean contribution of microorganisms from different sources to billets and formation of quarts
图4显示曲坯细菌属来源于原料小麦(66.12%)、润料仓小麦(19.37%)和未知成分(13.69%),而运输推车(0.67%)、制曲用水(0.15%)的贡献率较低。对曲坯属水平的细菌群落进行来源分析(图5-a),结果表明曲坯优势细菌如Weissella、Lactococcus、Cupriavidus和Lactobacillus主要来源于原料小麦、润料仓小麦和制曲用水。曲坯真菌群落(图4)主要来源于运输推车(51.61%)、原料小麦(38.28%)、小麦粉(7.99%)和液压压曲机(0.18%),未知来源较少(1.94%),车间空气及其他样本对曲坯真菌贡献较低。结果与周虞[29]的研究结果基本一致,其研究表明复产0 d曲胚细菌、真菌均主要来源于斗提机管道、原料小麦和筒仓小麦。曲坯细菌和真菌来源于不同小麦样品(原料小麦、润料仓小麦、小麦粉)的原因可能是机械化连续生产下,小麦粉中细菌、真菌不仅来源于原料小麦还来源于斗提式管道,且机械设备(润料仓、筒仓和斗提式管道等)内沉积的环境微生物会影响原料样品的群落组成[29]。图5-b属水平真菌群落的溯源分析结果表明曲坯优势真菌Uncultured Fungi、Aspergillus、Wallemia、Trichosporon和Debaryomyces等主要来源于运输推车,Alternaria、Fusarium、Uncultured Didymellaceae、Wickerhamomyces和Cladosporium主要来源于原料小麦和小麦粉。

a-曲坯细菌;b-曲坯真菌;c-成曲细菌;d-成曲真菌
图5 属水平溯源分析
Fig.5 Traceability analysis of genus levels
溯源分析结果(图4)表明成曲细菌群落主要来源于原料小麦和未知成分,其贡献比率分别为54.90%和45.10%,图5-c属水平溯源分析表明原料小麦主要贡献了Weissella、Lactobacillus、Cupriavidus、Sphingomonas、Acinetobacter细菌属,Bacillus、Thermoactinomyces、Staphylococcus、Saccharopolyspora细菌属则来源于未知成分。在真菌水平,图4显示制曲工具对成曲真菌群落的贡献度较高,尤其是曲架(73.09%),其次是未知成分(23.31%)和制曲场地空气(3.58%)。图5-d表明曲架主要为成曲贡献了Thermomyces、Saccharomycopsis、Aspergillus等其他真菌属,制曲场地空气提供了Thermomyces、Saccharomycopsis、Aspergillus、Wickerhamomyces、Uncultured Eurotiales其余优势真菌属。总的来说,曲坯及成曲真菌群落不仅来源于原料样品,也来源于长期接触曲粉和大曲的制曲工具(运输推车和曲架)。
成曲细菌和真菌的溯源结果中未知来源分别占45.10%和23.31%,这可能与样品采集和大曲微生物受温湿度环境调控有关。如周虞[29]的研究表明成曲中部分细菌主要来自曲粉、原料运输管道、制曲设备和转化室环境,较高丰度的真菌主要来源于润粮机表面、培菌室及制曲室曲架。本研究未知成分可能来源于机械化的制曲环境(制曲设备表面、原料运输管道等)。刘英杰等[13]研究表明老厂和新厂成曲真菌群落未知来源较多(分别是95.4%和73.8%),说明真菌群落相对稳定,受环境微生物的影响较小,这可能是大曲微生物群落受温、湿度等环境参数调控和驯化所致。
值得注意的是,发酵前后大曲(曲坯和成曲)微生物群落来源发生了明显变化,大曲细菌群落来源由原料小麦(66.12%)、润料仓小麦(19.37%)为主改变为原料小麦(54.90%)和未知成分(45.10%),真菌群落来源由运输推车(51.61%)、原料小麦(38.28%)和小麦粉(7.99%)为主改变为曲架(73.09%)和未知成分(23.31%)。大曲生产采用开放式培养,原料和培养环境中的微生物通过自然培养和不断富集,形成独特的微生物菌系[30]。就环境而言,曲坯新压制成型,其所处环境包括机械制曲设备和制曲工具(运输推车)等,而成曲所处环境为曲房,主要包括曲房内空气、墙壁、曲架、糠壳、草帘和地面等,所处环境的不同及发酵过程中温、湿度等环境参数的调控和驯化,可能是成曲与曲坯微生物来源差异的原因。明晰这些差异,有利于在大曲生产中定向驯化功能微生物菌群,驱动制曲工艺的精准调控。
3 结论与讨论
酿酒用大曲的微生物可能来自水、空气、原料、工具和地面等相关环境因素。了解大曲发酵过程中微生物的变化对于研究发酵机制和提高产品质量具有重要意义。为此,研究了浓香型中高温大曲生产原料和环境的微生物群落组成。结果表明,大曲中检出多种发酵功能微生物,曲坯优势菌以魏斯氏菌属(Weissella)、乳球菌属(Lactococcus)等乳杆菌和未培养真菌属(Uncultured Fungi)、交链孢属(Alternaria)为主,经培菌发酵,成曲微生物群落受温湿度等环境参数调控,魏斯氏菌属(Weissella)相对丰度逐渐降低,乳杆菌属(Lactobacillus)、魏茨曼氏菌属(Weizmannia)和高温放线菌属(Thermoactinomyces)相对丰度显著增加,真菌则以嗜热真菌属(Thermomyces)和热子囊菌属(Thermoascus)为主。在开放式自然发酵的中高温大曲生产过程中,生产环境中的微生物很可能参与其中,采用溯源分析技术解析原料和环境因素对曲坯和成曲微生物区系的影响,结果显示曲坯微生物主要来源于原料和制曲工具(运输推车),成曲微生物主要来源于原料、曲架和制曲场地空气,在成曲微生物溯源中有一定比例的未知成分,前人研究表明机械化生产下,许多酿酒功能微生物存在于生产环境中,如室内空气、机械管道内壁与制曲设备表面。且真菌群落可能受温、湿度等环境参数调控和驯化,受环境微生物的影响较小,因此分析未知成分可能与样品采集和温湿度环境参数调控有关。此外,发酵前后大曲(曲坯和成曲)微生物群落来源发生了明显变化,结合实际生产分析,发酵前后大曲所处不同空间且发酵期水分含量与温度等环境参数的驱动使曲坯和成曲微生物来源产生差异。本研究揭示了原料与环境中微生物之间的相互作用驱动了大曲微生物群落结构的形成,为大曲微生物的环境调控提供理论依据。未来可进一步明确机械化生产环境对制曲原料和大曲微生物群落的影响,针对制曲微生态稳定开展更全面系统的研究,以期实现生产稳定化、可控化。
[1] WANG C, WANG M, ZHANG M P.Ethyl carbamate in Chinese liquor (Baijiu):Presence, analysis, formation, and control[J].Applied Microbiology and Biotechnology, 2021, 105(11):4383-4395.
[2] LI H D, LIU S Y, LIU Y B, et al.Functional microorganisms in Baijiu Daqu:Research progress and fortification strategy for application[J].Frontiers in Microbiology, 2023, 14:1119675.
[3] XIAO C, YANG Y, LU Z M, et al.Daqu microbiota exhibits species-specific and periodic succession features in Chinese Baijiu fermentation process[J].Food Microbiology, 2021, 98:103766.
[4] 邓宇珂. 浓香型白酒酿造微生物溯源及大曲来源优势微生物功能研究[D].自贡:四川轻化工大学, 2022.DENG Y K.Study on the origin of fermentation microorganisms of Nongxiang Baijiu and the function of dominant microorganisms in Daqu[D].Zigong:Sichuan University of Science and Engineering, 2022.
[5] H GGLUND M, B
GGLUND M, B CKMAN S, MACELLARO A, et al.Accounting for bacterial overlap between raw water communities and contaminating sources improves the accuracy of signature-based microbial source tracking[J].Frontiers in Microbiology, 2018, 9:2364.
CKMAN S, MACELLARO A, et al.Accounting for bacterial overlap between raw water communities and contaminating sources improves the accuracy of signature-based microbial source tracking[J].Frontiers in Microbiology, 2018, 9:2364.
[6] VASILCHENKO A S, DILBARYAN D S, POSHVINA D V, et al.Bacillus-derived cyclic lipopeptides modulate microbiome structure and enzymatic activity of soil and increase productivity of potato (Solanum tuberosum L.)[J].Rhizosphere, 2025, 33:101033.
[7] MILLER T C, BENTLAGE B.Seasonal dynamics and environmental drivers of tissue and mucus microbiomes in the staghorn coral Acropora pulchra[J].PeerJ, 2024, 12:e17421.
[8] BARCENILLA C, COBO-D AZ J F, PUENTE A, et al.In-depth characterization of food and environmental microbiomes across different meat processing plants[J].Microbiome, 2024, 12(1):199.
AZ J F, PUENTE A, et al.In-depth characterization of food and environmental microbiomes across different meat processing plants[J].Microbiome, 2024, 12(1):199.
[9] ZHU J, LI H, JING Z Z, et al.Robust host source tracking building on the divergent and non-stochastic assembly of gut microbiomes in wild and farmed large yellow croaker[J].Microbiome, 2022, 10(1):18.
[10] ROBINSON B J, RITTER K J, ELLENDER R D.A statistical appraisal of disproportional versus proportional microbial source tracking libraries[J].Journal of Water and Health, 2007, 5(4):503-509.
[11] 王雪山. 不同环境清香类型白酒发酵微生物种群结构比较及溯源解析[D].无锡:江南大学, 2018.WANG X S.Microbial community structure and microbial source tracking of Chinese light-flavor liquor fermentation in different environments[D].Wuxi:Jiangnan University, 2018.
[12] 周天慈, 何宏魁, 周庆伍, 等.基于高通量扩增子测序技术解析中高温大曲微生物来源[J].食品与发酵工业, 2021, 47(16):66-71.ZHOU T C, HE H K, ZHOU Q W, et al.Exploring the source of microbiota in medium-high temperature Daqu based on high-throughput amplicon sequencing[J].Food and Fermentation Industries, 2021, 47(16):66-71.
[13] 刘英杰, 黄钧, 秦辉, 等.浓香型大曲与生产环境微生物群落间的溯源性分析[J].食品科学, 2022, 43(22):207-214.LIU Y J, HUANG J, QIN H, et al.Traceability analysis between strong-flavor Daqu, a traditional Chinese fermentation starter for nongxiangxing Baijiu, and microbial communities in the production environment[J].Food Science, 2022, 43(22):207-214.
[14] 寇蓉, 冯国杨, 李晨, 等.液固工艺山西陈醋发酵微生物群落组成、互作网络及溯源分析[J].微生物学通报, 2023, 50(6):2556-2568.KOU R, FENG G Y, LI C, et al.The composition, interaction network, and source of microbial community in Shanxi mature vinegar produced by liquid-solid fermentation[J].Microbiology China, 2023, 50(6):2556-2568.
[15] DU H, WANG X S, ZHANG Y H, et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].International Journal of Food Microbiology, 2019, 297:32-40.
[16] ZHANG Y L, XU C, XING G, et al.Evaluation of microbial communities of Chinese Feng-flavor Daqu with effects of environmental factors using traceability analysis[J].Scientific Reports, 2023, 13:7657.
[17] GUAN T W, WEI X Y, QIU X P, et al.Precipitation and temperature drive microbial community changes affecting flavor quality of Nongxiangxing Daqu[J].Food Chemistry:X, 2024, 24:102063.
[18] HUANG P, JIN Y, LIU M M, et al.Exploring the successions in microbial community and flavor of Daqu during fermentation produced by different pressing patterns[J].Foods, 2023, 12(13):2603.
[19] CHEN S F.Ultrafast one-pass FASTQ data preprocessing, quality control, and deduplication using fastp[J].iMeta, 2023, 2(2):e107.
[20] 罗丽蓉, 郭辉祥, 王军, 等.硬质与软质小麦制曲对浓香型白酒酿造的差异化影响[J].食品与发酵工业, 2025, 51(15):96-103.LUO L R, GUO H X, WANG J, et al.Differential effects of using hard and soft wheat Daqu on the brewing of Nongxiang Baijiu[J].Food and Fermentation Industries, 2025, 51(15):96-103.
[21] 曹丹, 吕嘉枥, 楚京嬴, 等.3种凤香型大曲中心区域特性的多维度表征及其差异性和相关性分析[J].食品科学, 2024, 45(20):20123-20135.CAO D, LYU J L, CHU J Y, et al.Central regions of three types of fengxiangxing Daqu:Multidimensional characterization and difference and correlation analysis[J].Food Science, 2024, 45(20):20123-20135.
[22] 曾波, 饶家权, 邹永芳, 等.浓香型白酒酒醅发酵过程中微生物群落结构演替及其与理化指标相关性[J].食品科学, 2024, 45(7):111-118.ZENG B, RAO J Q, ZOU Y F, et al.Structural succession of microbial communities in fermented grains for nongxiangxing Baijiu during the fermentation process and its correlation with physicochemical indicators[J].Food Science, 2024, 45(7):111-118.
[23] 于学健, 冯慧军, 翟磊, 等.芝麻香型白酒高温大曲中高温放线菌及其功能基因的动态变化规律[J].食品与发酵工业, 2019, 45(13):71-77.YU X J, FENG H J, ZHAI L, et al.Dynamic changes of Thermoactinomyces and their functional genes in high temperature Daqu of sesame-flavored Baijiu[J].Food and Fermentation Industries, 2019, 45(13):71-77.
[24] 王小平, 黄永光, 周文美.酱香型白酒大曲细菌菌群结构及功能研究进展[J].中国酿造, 2020, 39(2):19-25.WANG X P, HUANG Y G, ZHOU W M.Research progress on structure and function of bacterial community in Moutai-flavor Baijiu Daqu[J].China Brewing, 2020, 39(2):19-25.
[25] 罗莉, 李欣, 常煦, 等.芽孢杆菌在中国白酒酿造中的应用机理研究进展[J].酿酒科技, 2019(1):99-104.LUO L, LI X, CHANG X, et al.Research progress in the application of Bacillus and its mechanism in Baijiu production[J].Liquor-Making Science &Technology, 2019(1):99-104.
[26] LAAKSO K, KOSKENNIEMI K, KOPONEN J, et al.Growth phase-associated changes in the proteome and transcriptome of Lactobacillus rhamnosus GG in industrial-type whey medium[J].Microbial Biotechnology, 2011, 4(6):746-766.
[27] 熊君燕, 李小东, 谢圣凯, 等.清香型白酒中乳酸菌和酵母菌的相互作用[J].微生物学通报, 2017, 44(8):1767-1776.XIONG J Y, LI X D, XIE S K, et al.Interaction between lactic acid bacteria and yeasts in light-aroma liquor[J].Microbiology China, 2017, 44(8):1767-1776.
[28] CHEN Y R, LI K M, LIU T, et al.Analysis of difference in microbial community and physicochemical indices between surface and central parts of Chinese special-flavor Baijiu Daqu[J].Frontiers in Microbiology, 2020, 11:592421.
[29] 周虞. 浓香大曲复产前后微生物差异及环境来源解析[D].无锡:江南大学, 2023.ZHOU Y.Microbial community structure and environmental source of strong-flavor Daqu before and after production resumption[D].Wuxi:Jiangnan University, 2023.
[30] 何小容, 张庆, 唐家环, 等.浓香型白酒大曲发酵过程中主要微生物群系及其作用研究进展[J].中国酿造, 2024, 43(8):1-6.HE X R, ZHANG Q, TANG J H, et al.Research progress of main microflora and their roles during strong-flavor Baijiu Daqu fermentation[J].China Brewing, 2024, 43(8):1-6.