米酒曲是米酒酿造的糖化、发酵和生香剂,米酒曲对于酿造出的米酒的品质和风味起着至关重要的作用,因此又有“曲为酒骨”之称[1-2]。甜酒曲是以糯米粉或麸皮为主要原料,加入中草药、米糠等制成[3]。米酒曲中的微生物种类多样,传统米酒曲是以根霉菌群为优势菌的曲种,另外其中还包含酵母菌、曲霉等霉菌以及细菌[4-6],微生物间相互作用相互影响酿造产生风味物质不同的米酒[7]。
相较于传统培养法,高通量测序具有高通量、低成本、运行速度快的优点,被广泛应用在对食品样品中微生物多样性分析[4,8-9]。杨甜甜等[10]通过高通量测序技术对来自南宁市和孝感市的米酒曲真菌多样性进行分析,研究发现南宁和孝感地区酒曲优势真菌门均为子囊菌门和毛霉门。向凡舒等[11]通过高通量测序技术分析4个建始地区米酒曲微生物多样性,研究结果表明其中优势细菌属为假单胞菌属,优势真菌属为淀粉霉属。
根据我国地理位置差异,可将南方地区分为西南地区、中部地区和东南地区。本研究以我国南方地区15个地区的米酒曲为研究对象,采用Illumina MiSeq高通量测序技术研究米酒曲中的细菌真菌微生物多样性,同时对米酒曲样品进行微生物菌落计数协同分析米酒曲微生物多样性,探究米酒曲中的微生物群落结构。在基于高通量测序的基础上筛选出功能菌株后,接入米酒曲中并测定其酶活力和挥发性风味物质,为后续强化米酒曲提供一定的指导意义。
1 材料与方法
1.1 材料与试剂
具体样品来源如表1所示。米酒曲样品置于密封袋中,于4 ℃保存。采集米酒曲样品后将其装入已标记编号的无菌采样袋中,测序前将米酒曲样品破碎为粉末,每种样品取20 g置于无菌采样袋中,冷链运输至检测公司。
表1 米酒曲样品来源及其分组
Table 1 Sources and grouping of rice wine koji samples
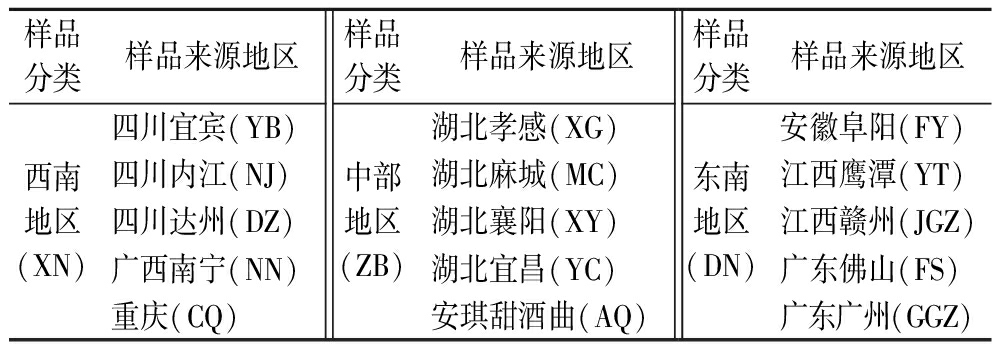
样品分类样品来源地区样品分类样品来源地区样品分类样品来源地区西南地区(XN)四川宜宾(YB)四川内江(NJ)四川达州(DZ)广西南宁(NN)重庆(CQ)中部地区(ZB)湖北孝感(XG)湖北麻城(MC)湖北襄阳(XY)湖北宜昌(YC)安琪甜酒曲(AQ)东南地区(DN)安徽阜阳(FY)江西鹰潭(YT)江西赣州(JGZ)广东佛山(FS)广东广州(GGZ)
1.2 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:称量200 g马铃薯去皮切丁,加1 000 mL水煮沸20~30 min,经纱布过滤后,加入2%葡萄糖,将水补足至1 000 mL,自然pH;如需固体培养基,再添加2%琼脂,121 ℃灭菌20 min。
平板计数琼脂(plate count agar,PCA)培养基(g/L):胰蛋白胨5,酵母浸出粉2.5,葡萄糖1;如需固体培养基,再添加2%琼脂,121 ℃灭菌20 min。
德曼-罗戈萨-夏普培养基(Man-Rogosa-Sharpe,MRS)培养基(g/L):蛋白胨10,牛肉浸粉8,酵母浸粉4,葡萄糖20,K2HPO4 2,柠檬酸氢二铵2,乙酸钠5,MgSO4 2,MnSO4 0.4,吐温-80 1;如需固体培养基,再添加2%琼脂,121 ℃灭菌20 min。MRS碳酸钙培养基在此基础上再添加1.5%碳酸钙。
产蛋白酶初筛培养基(g/L):牛肉膏3,大豆蛋白胨10,NaCl 5,琼脂20,脱脂奶粉15;脱脂牛奶应在115 ℃单独灭菌15 min,再与灭好菌的牛肉膏蛋白胨培养基混合。
豆芽汁培养基(g/L):豆芽汁100、葡萄糖50、蒸馏水调配,自然pH;如需固体培养基,再添加2%琼脂,121 ℃灭菌20 min。
1.3 仪器与设备
TE412-L精密电子天平,北京赛多利斯仪器系统有限公司;LDZX-40AI立式自动电热压力蒸汽灭菌锅,上海三申医疗核子仪器厂;DHG-9162电热恒温培养箱,上海一恒科技有限公司;YAM-5不锈钢电热蒸馏水器,上海江星仪器有限公司。
1.4 实验方法
1.4.1 高通量测序
15个地区的米酒曲样品送至罗宁生物测序,每种样品3个生物学重复。
高通量测序流程以及数据处理与分析:采用Zymo Research BIOMICS DNA Microprep Kit进行样本gDNA纯化,电泳检测gDNA完整性,使用0.8%(质量分数,下同)琼脂糖检测,然后使用Tecan F200(PicoGreen染料法)进行核酸浓度检测。根据测序区域,合成带有索引序列的特异引物扩增样本的16S rDNA V4区域。待6倍上样缓冲液与PCR产物混合均匀后,进行目的片段电泳检测,使用2%琼脂糖凝胶检测。经检测合格后的样品取目的条带进行回收,回收使用Zymoclean Gel Recovery Kit(D4008);使用Qubit@ 2.0 Fluorometer定量;最后等摩尔混合。文库构建使用NEW ENGLAND BioLabs公司NEBNext Ultra II DNA Library Prep Kit for Illumina建库。高通量测序采用PE250测序方式,测序试剂盒使用Illmina公司NovaSeq 6000 SP Reagent Kit V1.5。
1.4.2 菌落总数检测
真菌菌落总数参照GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》的方法;细菌菌落总数参照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》的方法对米酒曲菌落总数进行检测。将不同地区的米酒曲样品粉碎后取25 g加入225 mL灭菌后的生理盐水中,充分混合均匀15 min,在无菌操作条件下,吸取1 mL混匀后的菌悬液于装有9 mL无菌生理盐水的试管中制成10-1的稀释液,以此方法进行梯度稀释。选取合适的梯度吸取0.1 mL菌悬液分别涂布于PDA和PCA培养基平板上,按照适宜的温度时间进行倒置培养,对平板上生长出的单菌落进行菌落计数,按上述方法计算米酒曲样品中的微生物菌落总数。
1.4.3 功能菌株的筛选
1.4.3.1 产香酵母的筛选及鉴定
1)酵母菌的筛选
参照袁英豪等[12]的方法进行测定。
2)菌株鉴定
①形态鉴定及生理生化特性:参照《酵母菌的特征与鉴定手册》。
②分子鉴定:取菌株斜面,送至擎科生物有限公司进行通用ITS1/ITS4测序,测序结果经拼接后在NCBI网站上通过BLAST进行同源性比较,通过Mega 5.1软件构建系统进化树。
1.4.3.2 产蛋白酶菌株的筛选及鉴定
1)产蛋白酶菌株的筛选
测定蛋白酶活力参照李芳香等[13]的方法进行测定。
2)菌株鉴定
①形态鉴定及生理生化特性:参照《常见细菌系统鉴定手册》。
②分子鉴定:取菌株斜面,送至擎科生物有限公司进行通用27F/1492R细菌测序,测序结果经拼接后在NCBI网站上通过BLAST进行同源性比较,通过Mega 5.1软件构建系统进化树。
1.4.3.3 产酸乳酸菌的筛选
1)产酸乳酸菌的筛选
参照唐艳平等[14]的方法测定其产酸含量。
2)菌株鉴定
同1.4.3.2节2)进行鉴定。
1.4.4 米酒曲制作方法
将60 g辣蓼草、20 g茯苓和20 g甘草放入破壁机中打成粉末,过80目筛后与500 g糯米粉混合在一起搅拌均匀。少量分批次加入500 g清水,取适量菌悬液(霉菌0.8%、酵母菌0.03%、细菌0.06%),调整菌体浓度为107 CFU/mL,商业酒曲按1.0%(质量分数)接种,将其揉搓成2 cm左右的酒曲团,参照王家胜等[15]的方法,把揉好的酒曲摆在托盘,覆上保鲜膜。30 ℃发酵3 d,长出一层白色菌丝,酒曲上面生长出密密麻麻的白色绒毛,长度大约3~4 mm,没有杂色,说明甜酒曲霉菌生长正常,最后将酒曲于45 ℃烘干,置于真空袋中4 ℃保存。同时以接种商业酒曲(SY)、功能菌株(GN)、共同接种商业酒曲和功能菌株(SG)作为3个实验组,分别在0、1.5、3 d时取样。
1.4.5 米酒曲酶活力的测定
米酒曲糖化酶活力参照QB/T 4257—2011《酿酒大曲通用分析方法》的方法进行测定;米酒曲蛋白酶活力参照商海林[16]的方法进行测定。
1.4.6 挥发性风味物质测定
参照李琼[17]的方法。
固相微萃取前处理:在顶空样品瓶中加入4 mL样品、20 μL 2-辛醇内标(0.5 mg/mL)、1 g NaCl,在50 ℃条件下预平衡20 min,随后将萃取头插入样品液面上方顶空萃取吸附30 min,随后将其插入GC-MS进样口解析5 min。
色谱条件:进样口温度250 ℃,不分流。以40 ℃为初始温度进行程序升温,维持1 min,然后以5 ℃/min的速度升温到130 ℃,维持1 min,再以8 ℃/min的速度升温到230 ℃,保持12 min。
质谱条件:离子源温度230 ℃;MS四极杆温度150 ℃;离子化方式为EI;电子强度70 eV;采集模式全扫描。
定性、相对定量分析:将酒曲样品中已测出来的未知挥发性化合物的质谱图,与标准数据库NIST05匹配鉴定,将匹配度大于80的挥发性成分进行初步定性和相对定量分析。
2 结果与分析
2.1 米酒曲中细菌群落结构
2.1.1 三大地区组间的细菌群落结构差异
2.1.1.1 物种组成分析
三大地区酒曲样品属水平的细菌菌群相对丰度如图1所示。相对丰度1%以上的菌属共有24个,主要包括雷尔氏菌属(Ralstonia)、魏斯氏菌属(Weissella)、阿菲波菌属(Afipia)、乳杆菌属(Lactobacillus)等。其中DN和ZB地区酒曲样品中的菌群结构较为相似,雷尔氏菌属(Ralstonia)和魏斯氏菌属(Weisselca)均相对较高,DN地区酒曲样品中优势菌属为红球菌属(Rhodococcus),相对丰度较其他组相比较高,占14.6%。XN组中优势菌属为乳杆菌属,丰度较其他组相比较高,占7.7%。ZB组中优势菌属为葡萄球菌属(Staphylococcus),相对丰度较其他组相比较高,占12.4%。AQ组中雷尔氏菌属相对丰度较高,占20.4%。
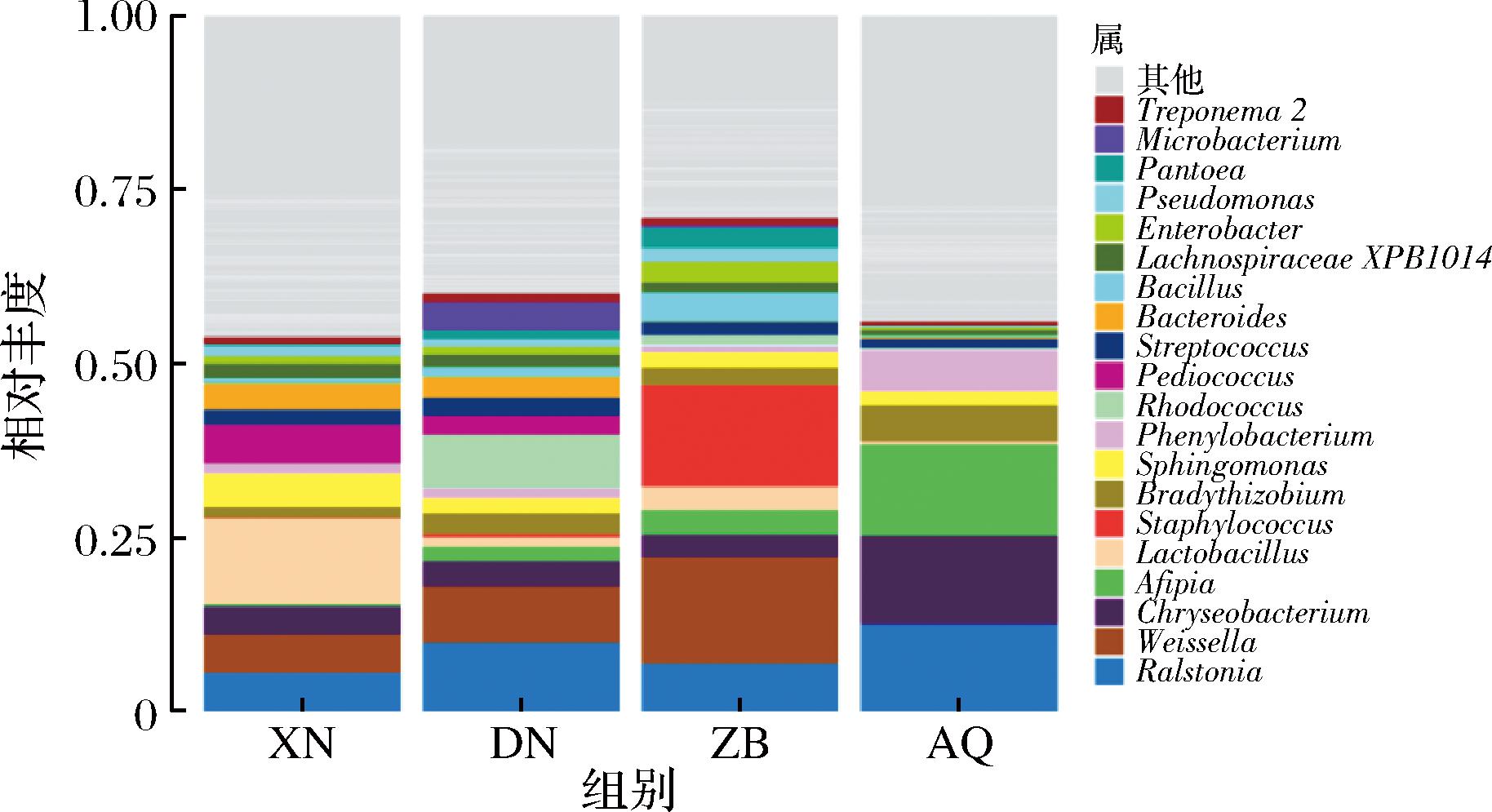
图1 三大地区酒曲在属水平的细菌菌群丰度
Fig.1 Abundance of bacterial communities at the genus level in koji from three major regions
2.1.1.2 主坐标分析
主坐标分析可用来研究4种酒曲中细菌菌群结构的相似性和差异性,三大地区米酒曲主坐标分析多样性结果如图2所示,第一主成分对差异的贡献率为22.9%,第二主成分对差异的贡献率为13%,累积贡献率为35.9%。4组在组间及组内距离均较近,说明4个地区的细菌菌群结构差异不大。
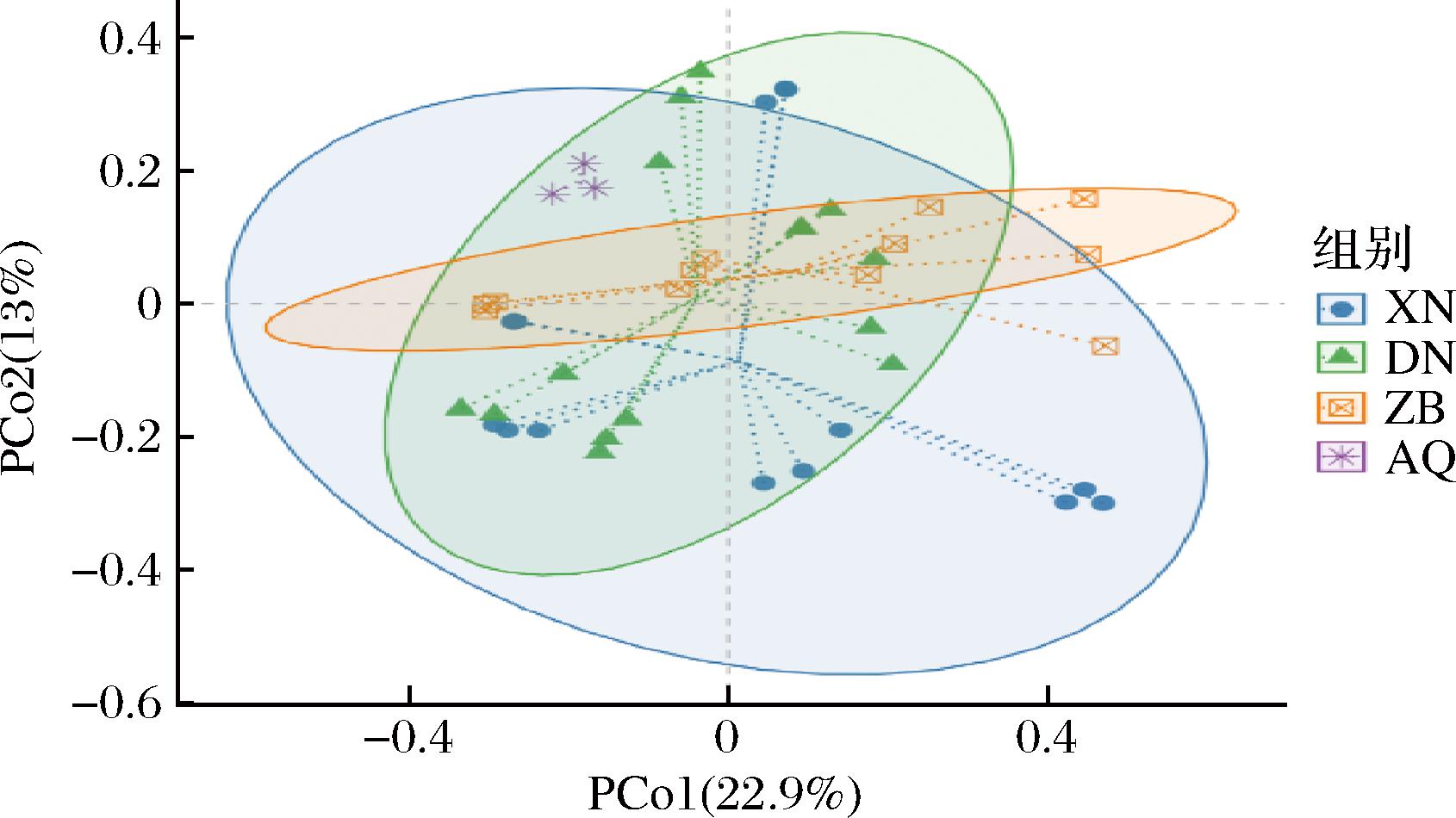
图2 三大地区酒曲细菌主坐标分析
Fig.2 Principal coordinates analysis of koji bacteria in three major regions
2.1.1.3 组间差异物种分析
线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)常用于表现物种差异情况。图3展示了4种酒曲间具有显著性差异的微生物。由图3可知,ZB组的主要差异菌种为厚壁菌门,在属分类水平上表现为葡萄球菌属、赤水菌属(Chishuiella)、芽孢杆菌属(Bacillus)、泛菌属(Pantoea)等。XN组的主要差异菌种在属分类水平上表现为乳杆菌属、片球菌属(Pediococcus)、拟杆菌属(Bacteroides)。DN组的主要差异菌种为放线菌门(Actinobacteria),在属分类水平上表现为红球菌属、微杆菌属(Microbacterium)、明串珠菌属(Leuconostoc)。AQ组的主要差异菌种为蓝藻门,在属水平上表现为阿菲波菌属(Afipia)、苯基杆菌属(Phenylobacterium)。

图3 三大地区酒曲细菌LEfSe分析
Fig.3 LEfSe analysis of koji bacteria in three major regions
2.1.2 三大地区组内的群落结构
对西南地区酒曲样品属水平的细菌菌群相对丰度进行分析,如电子版增强出版附图1所示(https://doi.org/10.13995/j.cnki.11-1802/ts.042427,下同)。相对丰度1%以上的主要包括金黄杆菌属(Chryseobacterium)、魏斯氏菌属、片球菌属、雷尔氏菌属等。其中YB组中相对丰度较高的为金黄杆菌属、鞘脂单胞菌属(Sphingomonas)、雷尔氏菌属等,其中金黄杆菌属相对丰度最高,占9.58%。DZ组的菌群结构相较于其他几组更为简单。NJ组中雷尔氏菌属相对丰度最高,占13.72%,其次为鞘脂单胞菌属,占9.34%。CQ组中魏斯氏菌属相对丰度最高,占20.98%,其次为红球菌属,其中还检测出微杆菌属和明串珠菌属,该2种菌属在其他几组样品中很低,均小于0.03%。
对中部地区酒曲样品属水平的细菌菌群相对丰度进行分析,如电子版增强出版附图2所示。相对丰度1%以上的主要包括魏斯氏菌属、乳杆菌属、葡萄球菌属等。YC组中相对丰度最高的为乳杆菌属,占48.61%,其余几组最高仅占4.04%,远高于其余几组。XY组中雷尔氏菌属的相对丰度最高,占16.17%,其次为魏斯氏菌属。XG中魏斯氏菌属相对丰度最高,占55.82%,远高于其余几组。MC组中葡萄球菌属相对丰度最高,占34.39%,而其余几组最高仅为7.09%。
对东南地区酒曲样品属水平的细菌菌群相对丰度进行分析,如电子版增强出版附图3所示。相对丰度1%以上的主要包括雷尔氏菌属、阿菲波菌属、红球菌属等。FS组中相对丰度较高的为雷尔氏菌属和红球菌属,其次为芽孢杆菌属。FY组和YT组的菌群结构较相似,相对丰度最高的均为雷尔氏菌属,分别占11.52%和17.75%。
2.2 真菌群落结构
2.2.1 三大地区组间的真菌群落结构差异
2.2.1.1 物种组成分析
对三大地区酒曲样品属水平的真菌菌群相对丰度进行分析,如图4所示。相对丰度1%以上的菌属共有8个,主要包括根霉属(Rhizopus)、假丝酵母菌属(Candida)、酿酒酵母属(Saccharomyces)、棒孢酵母属(Clavispora)、毕赤酵母属(Pichia)等。其中根霉属占绝对优势,AQ组中相对丰度最高为99.22%。XN组中相对丰度>1%的真菌菌属种类最多,为7个真菌属。ZB组根霉属占绝对优势,其相对丰度为95.72%,其余相对丰度>1%仅有酿酒酵母属。其中假丝酵母菌属相较于其他组在XN组中相对丰度最高,占4.85%,其他组均小于0.02%。
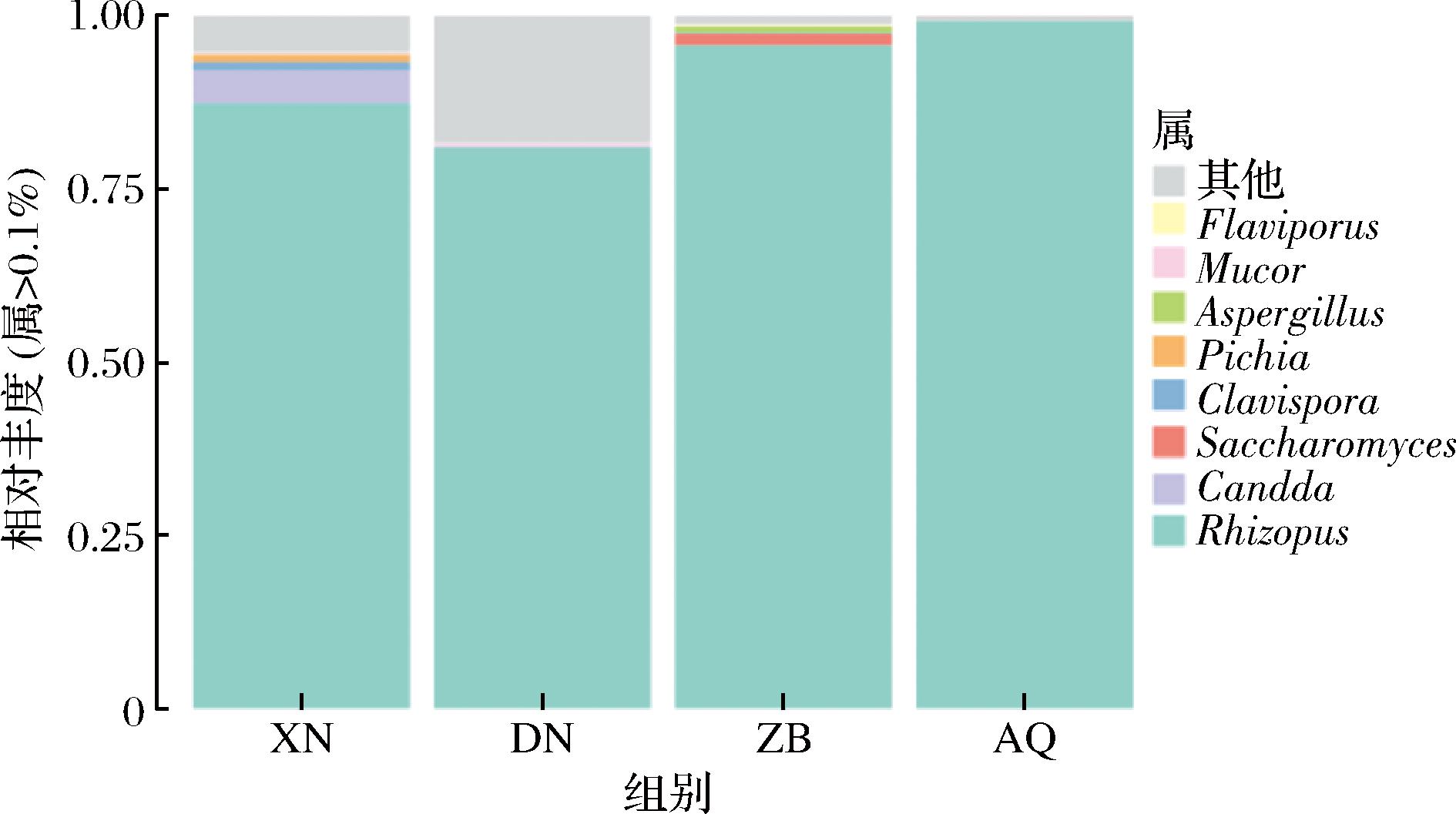
图4 三大地区酒曲在属水平的真菌菌群丰度
Fig.4 Abundance of fungi communities at the genus level in koji from three major regions
2.2.1.2 主坐标分析
主坐标分析可用来研究4种酒曲中真菌菌群结构的相似性和差异性,结果如图5所示,第一主成分对差异的贡献率为71.5%,第二主成分对差异的贡献率为15.7%,累积贡献率为87.2%。XN组在第一主成分上与其他3组差异较为明显,而DN、ZB、AQ组在第一主成分上距离均较为相近,其中ZB组和AQ组的真菌菌群结构较为相似。
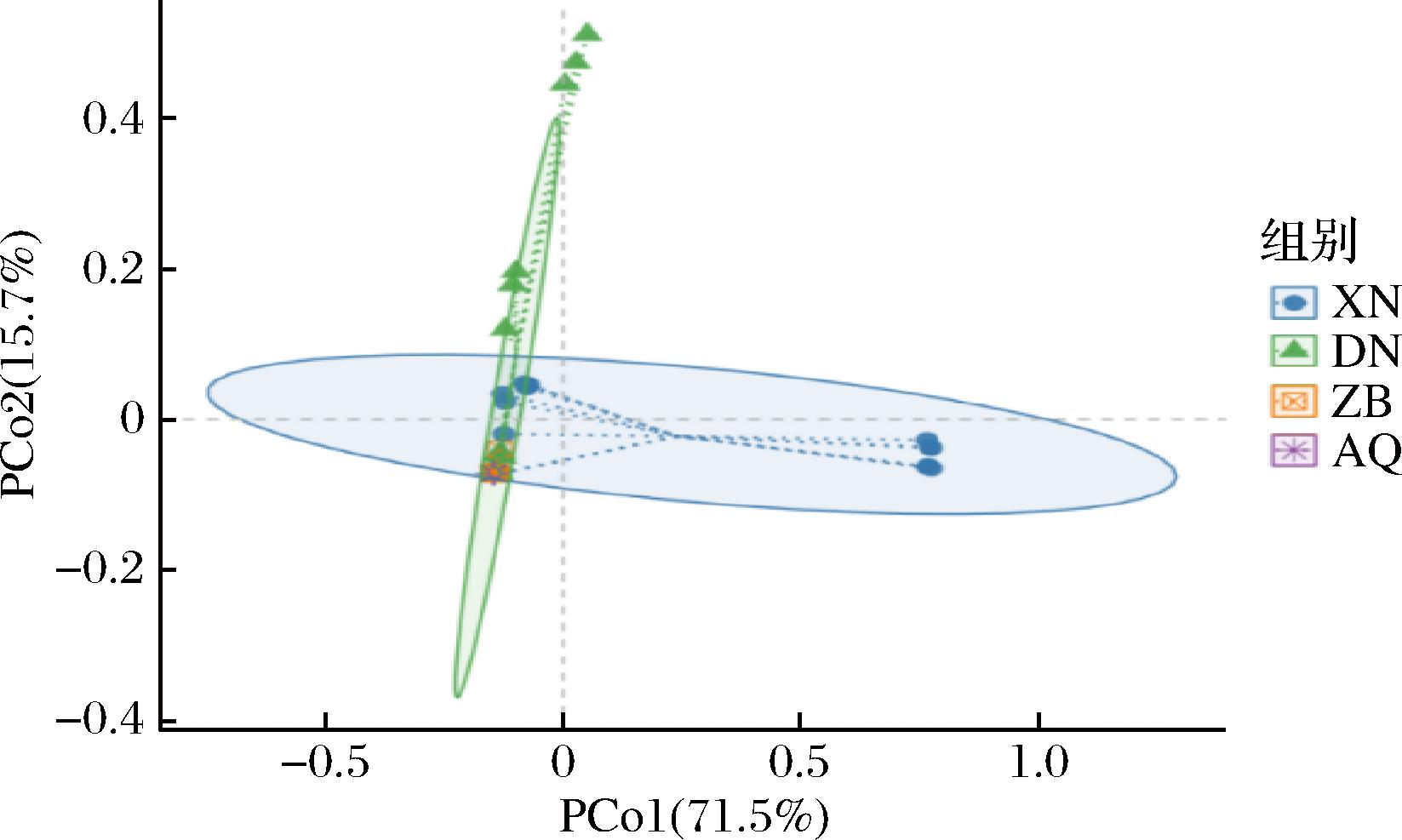
图5 三大地区酒曲真菌主坐标分析
Fig.5 Principal coordinates analysis of koji fungi in three major regions
2.2.1.3 组间差异物种分析
三大地区酒曲真菌LEfSe分析如图6所示。ZB组的主要差异菌种在属水平上表现为曲霉属(Aspergillus)。XN组的主要差异菌种在属水平上表现为毕赤酵母属(Pichia)。DN组的主要差异菌种在属水平上表现为毛霉菌属(Mucor)。AQ组的主要差异菌种在属水平上表现为根霉菌属(Rhizopus)。
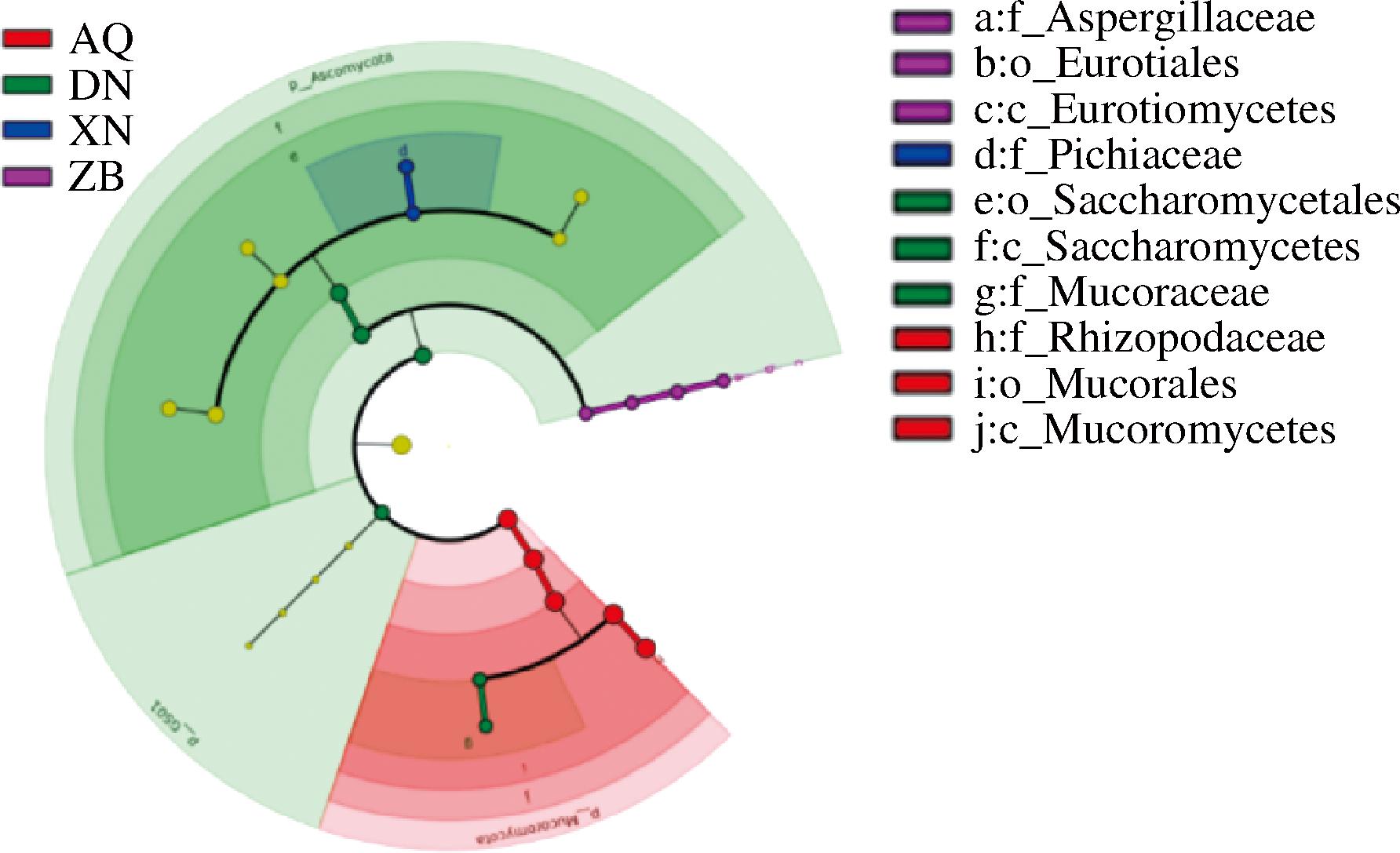
图6 三大地区酒曲真菌LEfSe分析
Fig.6 LEfSe analysis of koji fungi in three major regions
2.2.2 三大地区组内的真菌群落结构差异
西南地区属水平的真菌菌群相对丰度如电子版增强出版附图4所示。相对丰度1%以上的菌门包括葡萄牙棒孢酵母属、毕赤酵母属、根霉菌属和假丝酵母属。NN组中真菌菌群种类相对较多,其中根霉菌属占63.13%,其次为假丝酵母属、葡萄牙棒孢酵母属和毕赤酵母属,其相对丰度分别为23.62%、5.40%和5.17%。
中部地区属水平的真菌菌群相对丰度如电子版增强出版附图5所示。相对丰度1%以上的菌属包括根霉菌属、酿酒酵母属和曲霉菌属。MC组中酿酒酵母属相对其他几组较高,占6.42%,其余几组酵母菌数相对丰度均小于0.1%。
东南地区酒曲样品属水平的真菌菌群相对丰度如电子版增强出版附图6所示。相对丰度1%以上的菌属包括根霉菌和曲霉菌属。除FY组以外,根霉菌属在其余5组组中占比均大于95%。
2.3 米酒曲中微生物菌落总数
2.3.1 米酒曲中的细菌菌落总数
如图7-a所示,酒曲中细菌菌落总数最高的为XG组酒曲,达到8.21 lg CFU/g,含量最低的为FS组酒曲为6.02 lg CFU/g。其中西南组中YB组和DZ组细菌菌落总数较低,DZ组菌群落结构相较于西南组中其余几组更为简单,主要以片球菌属、魏斯氏菌属等为主,这与向凡舒等[18]的研究结果基本一致,结果表明DZ组的细菌丰度与数量均较低。中部组的细菌菌落总数在三大地区中最高,其中YC组中乳杆菌属相对丰度最高(48.61%),乳杆菌属可以增加米酒中有机酸的含量,并且可以抑制有害菌的生长,并且乳酸等有机酸与乙醇经酯化反应生成的酯类是米酒非常重要的风味物质。总体而言,东南地区的米酒曲中细菌菌落总数相较于其余2组更低。
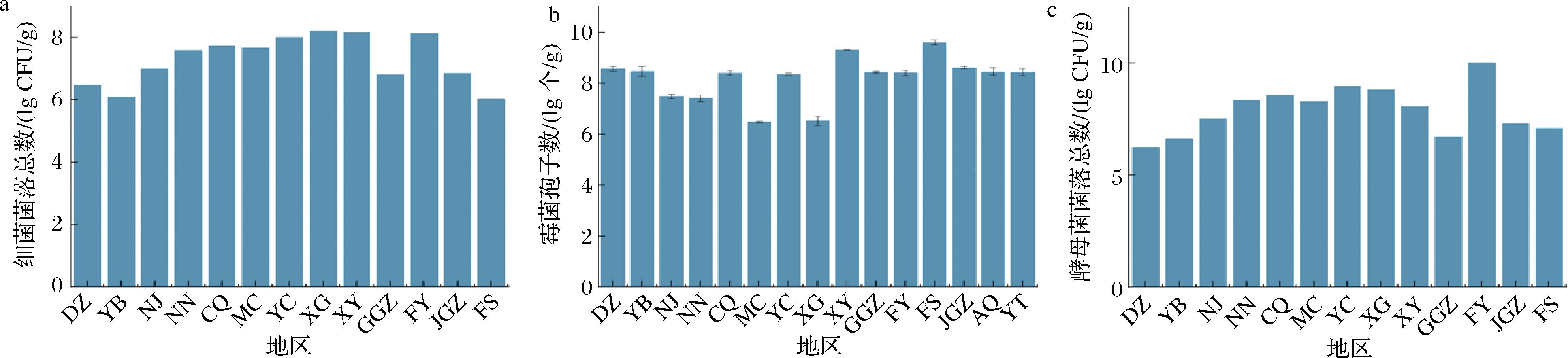
a-细菌菌落总数;b-霉菌孢子数;c-酵母菌菌落总数
图7 不同地区酒曲微生物菌落总数
Fig.7 Total number of microbial colonies in koji from different regions
2.3.2 米酒曲中霉菌孢子数
如图7-b所示,酒曲中霉菌孢子数最高的为FS组酒曲,达到9.61 lg个/g,含量最低的为MC组酒曲为6.48 lg个/g。与之对应的,其中MC在前期高通量测序中结果表明其中含有较多的酿酒酵母属,其毛霉属和曲霉属相较于其余几组相对较少。三大地区中东南组的霉菌孢子数相较于另外2组相对较高;相较于其余2组,中部组的霉菌孢子数较低,尤其是湖北省麻城(MC)和孝感地区(XG)的米酒曲。
2.3.3 米酒曲中酵母菌菌落总数
如图7-c所示,酒曲中酵母菌菌落总数最高的为FY组酒曲,达到10.02 lg CFU/g,含量最低的为DZ组酒曲为6.24 lg CFU/g。其中NN组酵母菌菌落总数相对较高,并且其真菌菌群较丰富,主要包括根霉菌属、假丝酵母属、葡萄牙棒孢酵母属和毕赤酵母属,这与杨甜甜等[10]的研究结果一致,其中葡萄牙棒孢酵母属和毕赤酵母属均能为米酒提供丰富的酯类[19-21],从而得到风味优良的米酒[22-24]。中部组中MC组的酿酒酵母属相对其他几组较高(6.42%),这与王奕芳[25]的研究结果较一致。东南组中除FY组酵母菌菌落总数最高以外,其余几组均较低。
2.4 功能菌的筛选及应用
经高通量测序发现南宁地区的米酒曲中生香酵母相对含量最高,麻城地区的芽孢杆菌属相对含量较高,宜昌地区的米酒曲中乳酸菌相对含量占比较高,因而对这3个地区的米酒曲进行筛菌,采用嗅闻法初筛、产酯能力复筛得到2株酵母菌,经过形态学、生理生化、分子生物学鉴定为库德里阿兹威毕赤酵母(Pichia kudriavzevii)和酿酒酵母(Saccharomyces cerevisiae),该2株酵母菌产酯均为3.93 g/L,经进一步挥发性风味物质检测,结果表明酯类含量丰富,且乙酸乙酯含量较高;筛选到1株乳酸菌,鉴定为戊糖片球菌(Pediococcus pentosaceus),其产乳酸量达到15.17 g/L;筛选到1株产蛋白酶菌株,鉴定为贝莱斯芽孢杆菌(Bacillus velezensis),其蛋白酶活力为27.55 U/mL。选用该4株功能性菌株进行下一步米酒曲的制备。
糖化酶主要负责将淀粉转化为葡萄糖,进而能被酵母等微生物发酵产生酒精。如图8所示,3组酒曲在发酵过程中的糖化酶活力均呈上升趋势,在3个取样时间点SG组糖化酶活力均高于SY组和GN组,其中GN组始终高于SY组,在3 d时SG组糖化酶活力达到最高为1 583.4 U,可能是由于功能菌株接种到酒曲中促进了酒曲中其他微生物产糖化酶的能力。在0~1.5 d的过程中,3个实验组的糖化酶活力迅速升高,这可能是由于在发酵初期霉菌占据优势地位,代谢产生大量糖化酶,从而大量分解了酒曲中的淀粉。在1.5~3 d的过程中,酵母等微生物占据优势地位,其分解产生的大量乙醇等物质抑制了霉菌的代谢及糖化酶活性,导致糖化酶增加速度减缓。
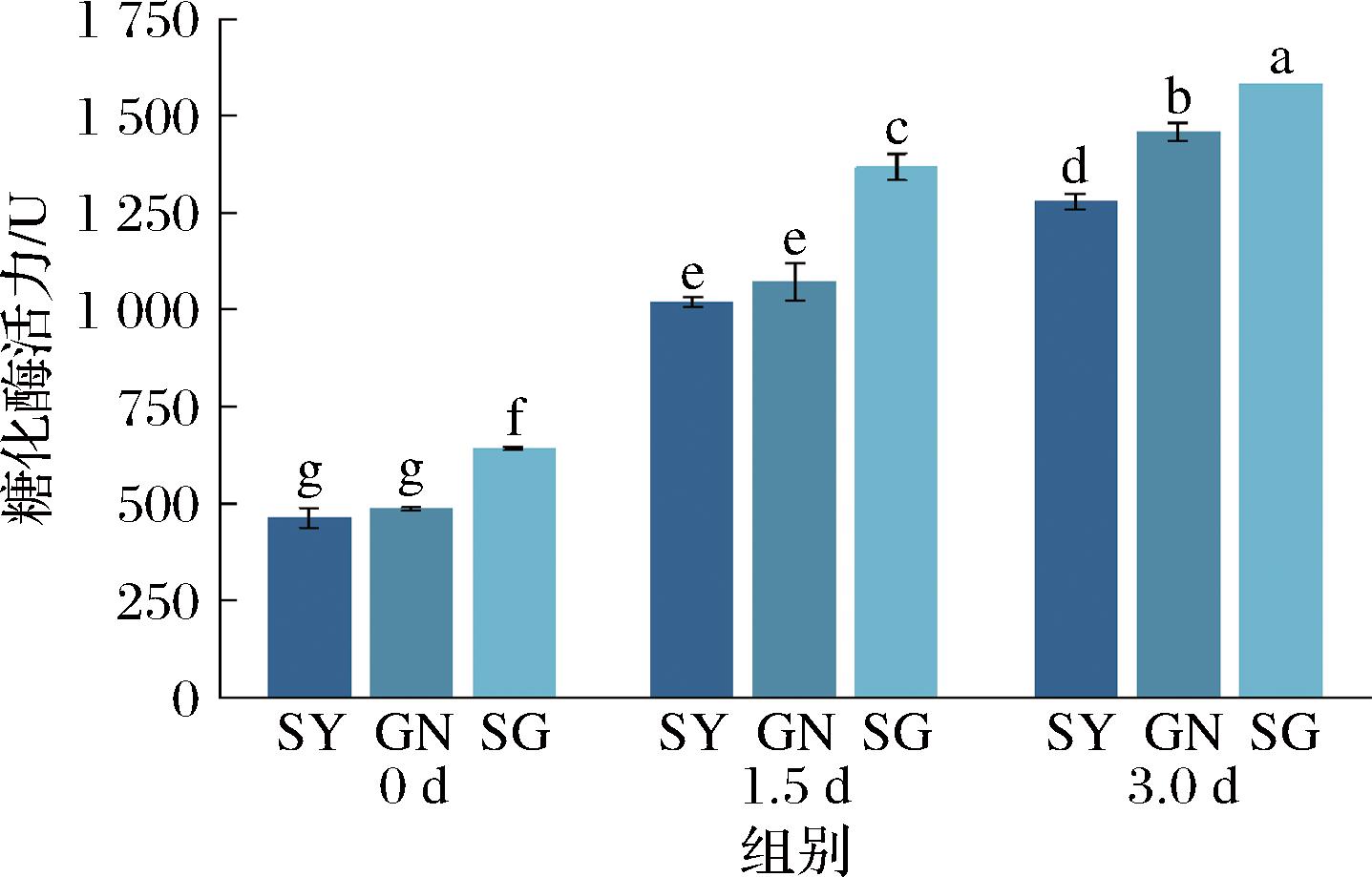
图8 米酒曲不同发酵阶段糖化酶活力变化
Fig.8 Changes in amylase activity during different fermentation stages of rice wine koji
注:不同小写字母代表不同组别在不同发酵时间点的糖化酶活力存在显著性差异(P<0.05,下同)。
蛋白酶是米酒中一类可以水解蛋白质肽链的重要酶类,蛋白酶不仅能将酒曲中的蛋白质分解成为氨基酸从而增加米酒的滋味,还可以在一定程度上增加米酒的挥发性风味物质,进一步提升米酒风味层次。如图9所示,3组酒曲在发酵过程中的蛋白酶活力均呈上升趋势,其中SY组的蛋白酶活力高于GN组,SG组的蛋白酶活力在3个时间节点均高于另外2组,在第3天时其蛋白酶活力达到了776.13 U/g。在1.5~3 d的过程中蛋白酶增加速度开始减缓,这可能是由于后期酒曲中的物质被不断消耗以及产生的乙醇等物质抑制了芽孢杆菌的生长。
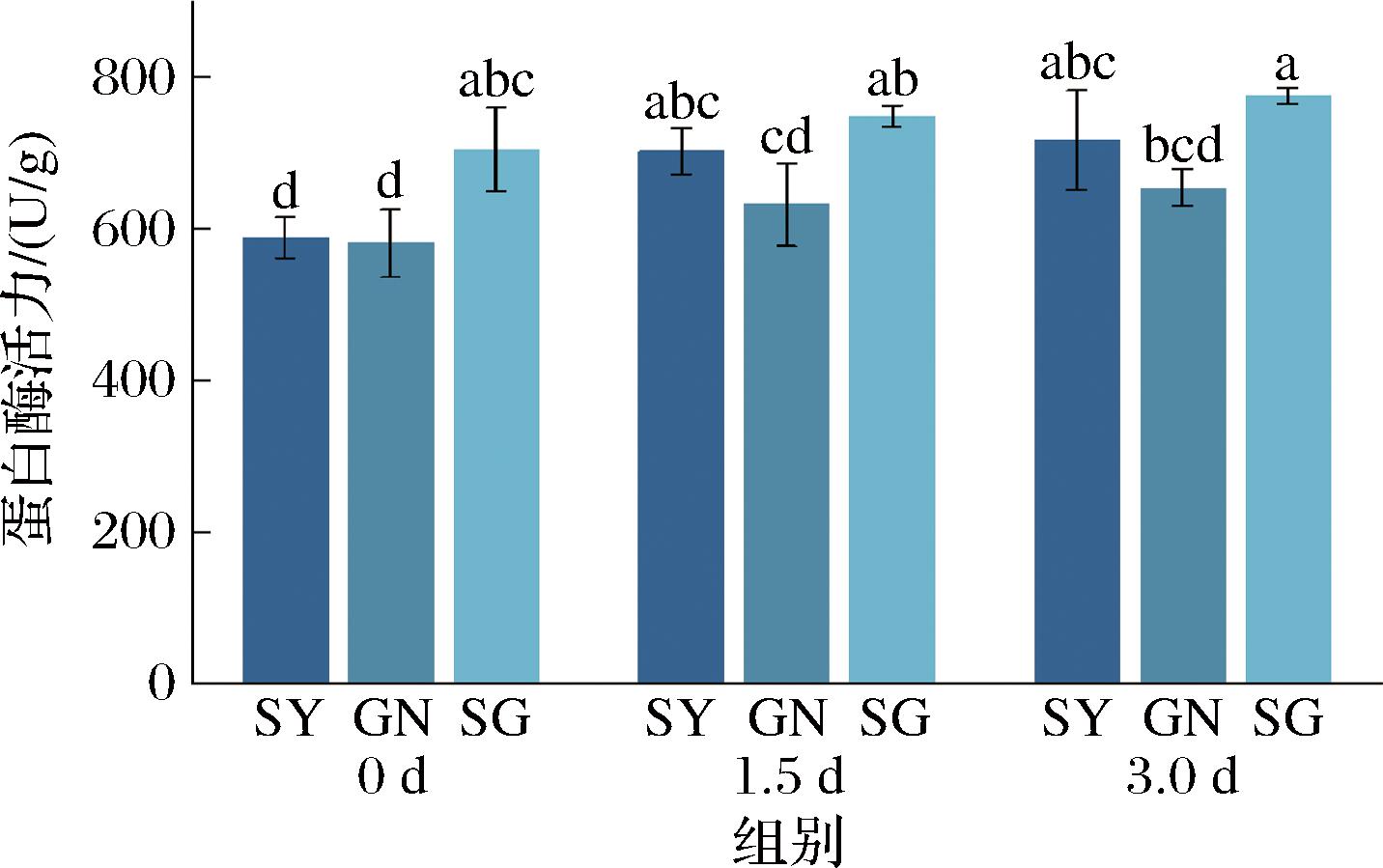
图9 米酒曲不同发酵阶段蛋白酶活力变化
Fig.9 Changes in protease activity during different fermentation stages of rice wine koji
对3个实验组米酒曲的挥发性风味物质进行GC-MS测定,检出的风味化合物含量如图10所示,其具体挥发性风味物质的含量和种类如电子版增强出版附表1所示。SY、GN和SG组分别检测出40、48、47种挥发性化合物。酯类是酒曲挥发性物质中最重要的一类,在3组中分别有10、14、17种酯类物质,其中酯类物质中苯乙酸乙酯、乙酸苯乙酯、肉豆蔻酸甲酯、月桂酸甲酯等是3组共有的;异丁酸乙酯、乙酸苄酯、异戊酸苯乙酯等为SG组独有的酯类物质,其中乙酸苄酯呈现馥郁茉莉花香气,异戊酸苯乙酯具有强烈的果香和玫瑰叶样的香气。此外,SG组中3组共有的苯乙酸乙酯、乙酸苯乙酯以及肉豆蔻酸甲酯的含量均相较于其余2组有显著提高。由图10可知,SG组的醇类物质和酯类物质相较于另外2组有显著提高,分别为1 021.94 μg/100 g和1 190.82 μg/100 g。其中SG组的酚类物质中2,4-二叔丁基酚和4-乙烯基愈创木酚含量较高,4-乙烯基愈创木酚具有强烈香辛料、丁香和发酵香味,是酒类的重要香气成分。
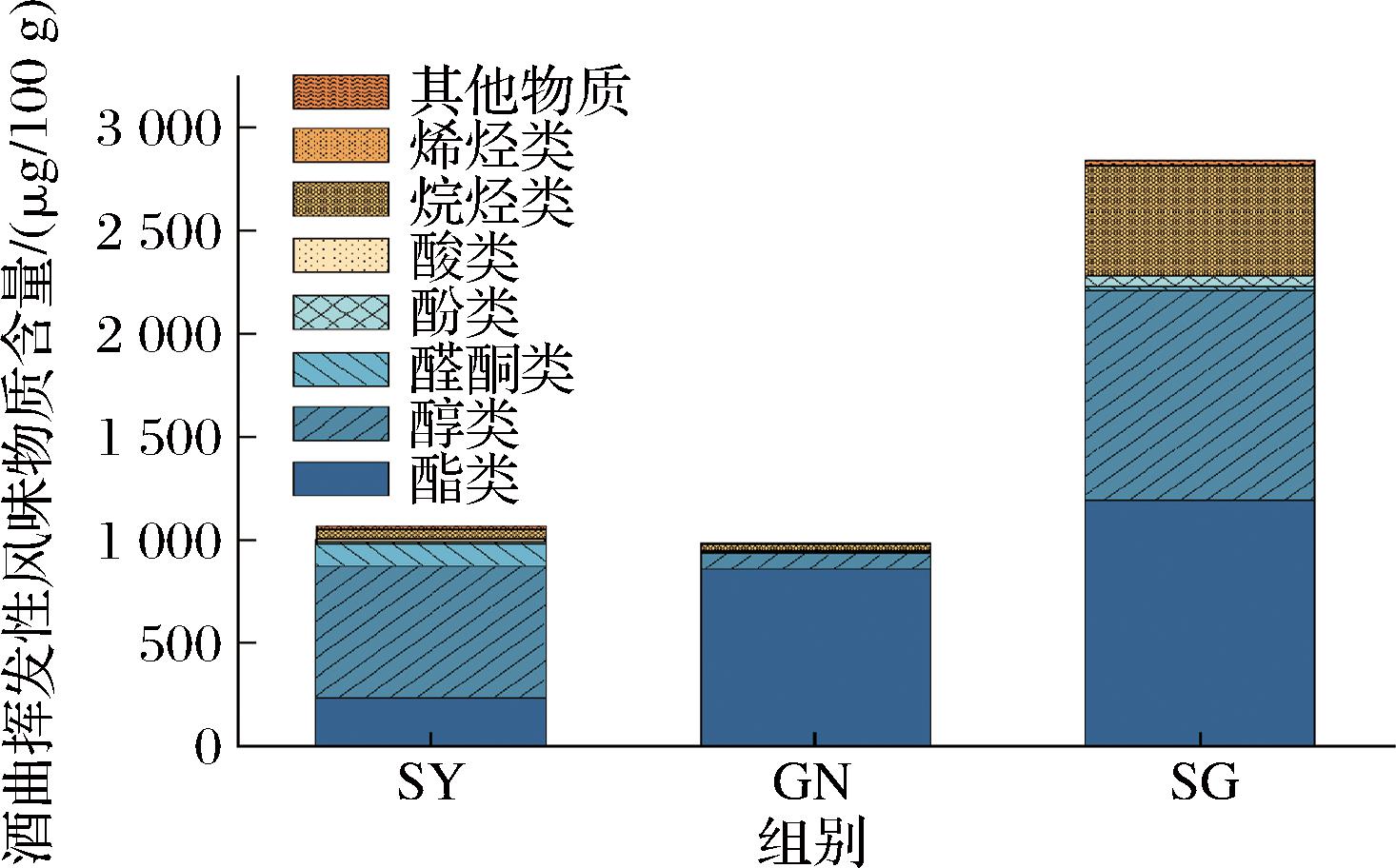
图10 米酒曲挥发性风味物质含量
Fig.10 Content of volatile flavor compounds in rice wine koji
3 结论
研究结果表明,DN组和ZB组米酒曲中的菌群结构较为相似,DN组的优势细菌属为红球菌属。根霉属在所有米酒曲样品中占绝对优势(80.98%~99.22%),XN组中南宁组真菌菌属种类最多为7个真菌属,包括根霉菌属、假丝酵母属、葡萄牙棒孢酵母属和毕赤酵母属。酒曲中霉菌孢子数最高的为FS组酒曲,相较于其余2组,ZB组的霉菌孢子数较低,细菌菌落总数最高的为XG组酒曲,酵母菌菌落总数最高的为FY组酒曲。由此可见,就细菌而言,南方地区中DN组和ZB组米酒曲中的菌群结构较为相似。就真菌而言,样品中的霉菌均以根霉菌属为主,其中JGZ组相对丰度较低的为曲霉菌属。基于高通量测序结果,后续实验从相应地区的米酒曲中筛选出了1株库德里阿兹威毕赤酵母、1株酿酒酵母、1株贝莱斯芽孢杆菌以及1株戊糖片球菌,将这几种菌复配强化米酒曲,结果表明米酒曲的糖化酶、蛋白酶活力以及挥发性风味物质均显著提高。这证明功能菌株的添加对改善米酒曲的性能有较大的作用,这对后续改善米酒品质有一定指导意义。
[1] 王菲, 钟小丹, 戴彩霞, 等.原料米和酒曲对米酒滋味品质影响的评价[J].食品研究与开发, 2017, 38(20):80-84.WANG F, ZHONG X D, DAI C X, et al.A comparative study on the taste profile characterization of rice wine fermented by different kinds of rice and rice wine koji[J].Food Research and Development, 2017, 38(20):80-84.
[2] 周恒刚. 制曲用药[J].酿酒科技, 2004(2):19-21.ZHOU H G.Pharmaceutical application in starter-making[J].Liquor-making Science &Technology, 2004(2):19-21.
[3] 王静, 刘孟格, 孙琳佳, 等.两种酒曲制备大麦若叶米酒品质对比[J].中国酿造, 2023, 42(8):166-171.WANG J, LIU M G, SUN L J, et al.Comparison of quality of barley leaf rice wine prepared with two kinds of Jiuqu[J].China Brewing, 2023, 42(8):166-171.
[4] ZHAO X X, WANG Y R, CAI W C, et al.High-throughput sequencing-based analysis of microbial diversity in rice wine koji from different areas[J].Current Microbiology, 2020, 77(5):882-889.
[5] CAI H Y, ZHANG T, ZHANG Q, et al.Microbial diversity and chemical analysis of the starters used in traditional Chinese sweet rice wine[J].Food Microbiology, 2018, 73:319-326.
[6] JIANG L, SU W, MU Y C, et al.Major metabolites and microbial community of fermented black glutinous rice wine with different starters[J].Frontiers in Microbiology, 2020, 11:593.
[7] 李术钗, 杨玉玲, 王佳佳.不同配方酒曲对贵州苗族米酒品质的影响[J].中国食品工业, 2023(4):90-93.LI S C, YANG Y L, WANG J J.Effects of different formulated daqu on the quality of Guizhou Miao rice wine[J].China Food Industry, 2023(4):90-93.
[8] 母应春, 姜丽, 苏伟.应用Illumina高通量测序技术分析3种酒曲中微生物多样性[J].食品科学, 2019, 40(14):115-122.MU Y C, JIANG L J, SU W.Analysis of microbial diversity in three rice wine kojis by Illumina high-throughput sequencing[J].Food Science, 2019, 40(14):115-122.
[9] WANG Y R, CAI W C, GAI J S, et al.Analysis of the effect of rice wine koji on the fermentation quality of rice wine based on high-depth sequencing[J].Food Bioscience, 2023, 56:103109.
[10] 杨甜甜, 杨少勇, 侯强川, 等.基于高通量测序技术分析比较南宁和孝感地区米酒曲中真菌多样性[J].中国酿造, 2021, 40(9):110-114.YANG T T, YANG S Y, HOU Q C, et al. Analysis and comparison of fungal diversity in rice-wine Jiuqu from Nanning and Xiaogan regions based on high-throughput sequencing technology[J].China Brewing, 2021, 40(9):110-114.
[11] 向凡舒, 朱媛媛, 邓风, 等.建始地区米酒曲细菌和真菌多样性研究[J].食品工业科技, 2021, 42(1):126-131.XIANG F S, ZHU Y Y, DENG F, et al.Bacterial and fungal diversity of rice wine koji in Jianshi aera[J].Science and Technology of Food Industry, 2021, 42(1):126-131.
[12] 袁英豪, 何梦娇, 唐春麟, 等.醋源生香酵母的筛选及其特性研究[J].食品与发酵工业, 2024, 50(15):63-71.YUAN Y H, HE M J, TANG C L, et al.Screening and characterization of vinegar-derived aroma-producing yeast[J].Food and Fermentation Industries, 2024, 50 (15):63-71.
[13] 李芳香, 郭中欢, 张稳, 等.酱香型高温大曲中蛋白酶高产菌株的选育[J].酿酒科技, 2024(8):43-48.LI F X, GUO Z H, ZHANG W, et al.Selection and breeding of strains with high yield of protease in high-temperature Jiangxiang daqu[J].Liquor-Making Science &Technology, 2024(8):43-48.
[14] 唐艳平, 张凤琴, 郝红梅.贵州白酸汤优势产酸乳酸菌的筛选及发酵性能比较[J].中国食品添加剂, 2023, 34(10):101-110.TANG Y P, ZHANG F Q, HAO H M, et al.Screening of dominant acid-producing lactic acid bacteria from Guizhou white sour soup and its fermentation performance comparison[J].China Food Additives, 2023, 34(10):101-110.
[15] 王家胜, 朱澳迪, 杨州, 等.风味型甜酒曲的研制[J].中国酿造, 2023, 42(5):97-104.WANG J S, ZHU A D, YANG Z, et al.Development of flavored sweet Jiuqu[J].China Brewing, 2023, 42(5):97-104.
[16] 商海林. 中高温大曲高产糖化酶及蛋白酶活力菌株的筛选与应用研究[D].济南:齐鲁工业大学, 2024.SHANAG H L.Screening and application of activestrainswith high yield of saccharificationenzymeand protease in middle andhightemperature Daqu[D].Jinan:Qilu University of Technology, 2024.
[17] 李琼. 米麦曲研发及与米酒曲的对比解析[D].自贡:四川轻化工大学, 2020.LI Q.Developing for Mimaiqu and contrast analysis of rice wine Qu[D].Zigong:Sichuan University of Light Chemical Technology, 2020.
[18] 向凡舒, 蔡文超, 郭壮, 等.大竹米酒滋味品质与细菌类群的关联性分析[J].食品科学, 2023, 44(18):231-238.XIANG F S, CAI W C, GUO Z, et al.Correlation between taste quality and bacterial community of Dazhu rice wine[J].Food Science, 2023, 44(18):231-238.
[19] 宋淑芬, 柳忠玉, 马立安.红曲甜米酒的研制[J].长江大学学报(自科版), 2017, 14(14):69-73;80;5.SONG S F, LIU Z Y, MA L A.Preparation of red koji sweet rice wine[J].Journal of Yangtze University (Natural Science Edition), 2017, 14(14):69-73;80;5.
[20] 刘波. 优质青稞米酒的酿造及其特征风味形成机制的研究[D].上海:上海应用技术大学, 2023.LIU B.Study on the brewing of high quality highlandbarley rice wine and forming mechanismof its characteristic flavor[D].Shanghai:Shanghai University of Applied Sciences, 2023.
[21] 肖曼琳. 米酒曲中乳酸菌的分离鉴定及米酒液态发酵工艺的研究[D].武汉:武汉轻工大学, 2020.XIAO M L.Isolation and identification of lactic acid bacteria in rice wine koji and study on liquid fermentation process of rice wine[D].Wuhan:Wuhan University of Light Industry, 2020.
[22] WU Q, YUAN Q L, WANG X, et al.Synergistic fermentation of Pichia kluyveri and Saccharomyces cerevisiae integrated with two-step sugar-supplement for preparing high-alcohol kiwifruit wine[J].Metabolites, 2024, 14(6):310.
[23] DING B, ZHAO S T, ZHANG W X, et al.The effect of co-culture with different Pichia kluyveri and Saccharomyces cerevisiae on volatile compound and characteristic fingerprints of mulberry wine[J].Foods, 2024, 13(3):422.
[24] 周枫, 曹蒙, 范玉飞, 等.酿酒酵母与毕赤酵母协同作用对山楂酒发酵的影响[J].食品科技, 2023, 48(8):1-6.ZHOU F, CAO M, FAN Y F, et al.Effect of synergistic of Saccharomyces cerevisiae and Pichia pastoris on the fermentation of hawthorn wine[J].Food Science and Technology, 2023, 48(8):1-6.
[25] 王奕芳. 麻城老米酒酿造微生物及关键功效成分的分析[D].武汉:湖北工业大学, 2020.WANG Y F.Analysis of the brewing microorganisms andkeyfunctionalcomponents of Macheng old rice wine[D].Wuhan:Hubei University of Technology, 2020.