血红素是一种含铁卟啉衍生物,作为许多酶和蛋白的辅因子,参与细胞中大量生理与生化反应,比如协助血红蛋白运输氧气,作为细胞色素的组分促进呼吸链中电子的传递,作为过氧化物酶的辅基缓解细胞中的氧胁迫等[1]。因此血红素在微生物和动植物细胞中均起到重要的作用。现今,血红素作为一种有效的铁补充剂在医学领域得到了广泛应用[2]。此外,血红素作为一种安全的天然色素,可替代合成色素,用于食品加工。目前血红素主要通过化学合成或者从生物材料(如新鲜的猪血)中提取。这些方法通常成本高,并且会污染环境[3]。因此利用微生物生产血红素成为当今研究的热点。
微生物细胞合成血红素主要有2种途径,一种是以甘氨酸为底物经5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)合酶(hemA编码)的催化,将甘氨酸与琥珀酰辅酶A缩合,形成5-ALA,例如酵母细胞的血红素合成[4],该途径被称为C4途径;另一种以谷氨酸为底物,在谷氨酸-tRNA合酶的作用下生成谷氨酰-tRNA,进而在谷氨酰-tRNA还原酶(hemA编码)的催化下,生成谷氨酸-1-半醛(glutamic acid-1-semialdehyde,GSA),GSA经GSA变位酶(hemL编码)异构生成5-ALA,例如大肠杆菌和古细菌的血红素合成[5],该途径被称为C5途径,其中谷氨酰-tRNA还原酶被认为是该途径的关键酶[6]。
在合成5-ALA后,两分子5-ALA单体在5-ALA脱水酶(hemB编码)的作用下,缩合形成胆色素原(porphobilinogen,PBG),四分子的PBG在PBG脱氨酶(hemC编码)以及尿卟啉原Ⅲ合酶(hemD编码)的作用下,形成尿卟啉原Ⅲ(uroporphyrinogen Ⅲ,URO)[7]。在URO之后,有3种合成血红素的途径[8],即西罗血红素依赖途径,该途径主要存在于古细菌中;粪卟啉依赖途径主要存在于革兰氏阳性菌中;以及原卟啉依赖(protoporphyrinogen-and protoporphyrin-dependent,PPD)途径[9]。大肠杆菌主要通过PPD途径合成血红素,即URO依次在URO脱羧酶(hemE编码),粪卟啉原Ⅲ氧化酶(hemF编码),原卟啉原Ⅸ氧化酶(hemG编码)的催化下,生成原卟啉Ⅸ(protoporphyrin Ⅸ,PPIX),最后PPIX由亚铁螯合酶(hemH编码)螯合Fe2+形成血红素,其中5-ALA脱水酶和亚铁螯合酶被认为是途径中的关键酶[10]。
由于野生型菌株的血红素产量低,无法满足商业化需求,因此构建基因工程菌,包括大肠杆菌、谷氨酸棒杆菌和枯草芽孢杆菌等,以提高血红素的合成成为关注的焦点[11-13]。大肠杆菌因其遗传背景清晰,遗传操作便利,培养成本低廉,成为重要的底盘菌株。表1列举了近年来利用遗传改造的大肠杆菌生产血红素的典型案例。强化菌株原有的血红素合成途径,无疑是提高血红素产量的首选策略。ZHAO等[13]通过优化表达大肠杆菌C5途径的血红素合成基因,敲除编码血红素降解的yfex基因,显著提高了胞内血红素的含量。在原有C5途径的基础上整合C4途径也被用于提高大肠杆菌和枯草芽孢杆菌的血红素合成,但是由于C5途径的谷氨酸的前体α-酮戊二酸和C4途径的前体琥珀酰辅酶A均为中心代谢三羧酸循环的中间代谢物,双途径并存可能导致前体供给不足。因此本文采用了敲除C5途径关键酶基因hemL,阻断原有的C5途径,导入类球红细菌(Rhodobacter sphaeroides)的5-ALA合酶基因hemAR,构建异源的C4途径,发现重组菌的血红素产量显著高于仅强化C5途径,或双途径共存的菌株。进一步过表达5-ALA下游关键基因hemB与hemH,并结合外源添加甘氨酸和Fe2+的发酵优化,血红素产量大幅提高。本研究的结果为大肠杆菌的基因工程改造、强化血红素的合成提供了新的策略(图1)。
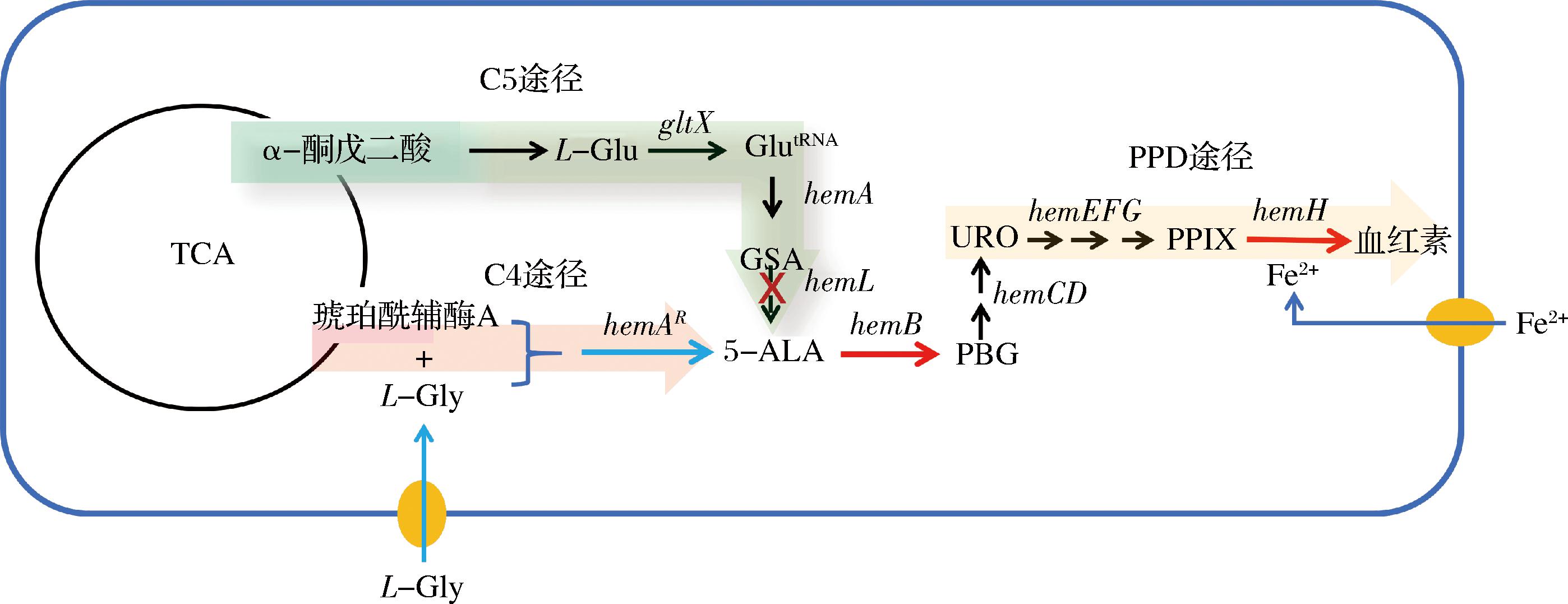
图1 大肠杆菌血红素合成及改造示意图
Fig.1 Schematic diagram of heme synthesis and modification in E. coli
注:红色箭头表示过表达该基因,蓝色箭头表示导入异源C4途径基因,红色的叉号表示敲除C5途径基因。粉色、绿色和橙色阴影分别为5-ALA生物合成的C4途径、5-ALA合成的C5途径和下游血红素生物合成的PPD途径。TCA为三羧酸循环;GlutRNA为谷氨酰-tRNA;GSA为谷氨酸-1-半醛;PBG为胆色素原;URO为尿卟啉原Ⅲ;PPIX为原卟啉Ⅸ;L-Gly为L-甘氨酸;L-Glu为L-谷氨酸。
表1 遗传改造大肠杆菌生产血红素的典型案例
Table 1 Typical examples of heme production by genetically modified E.coli
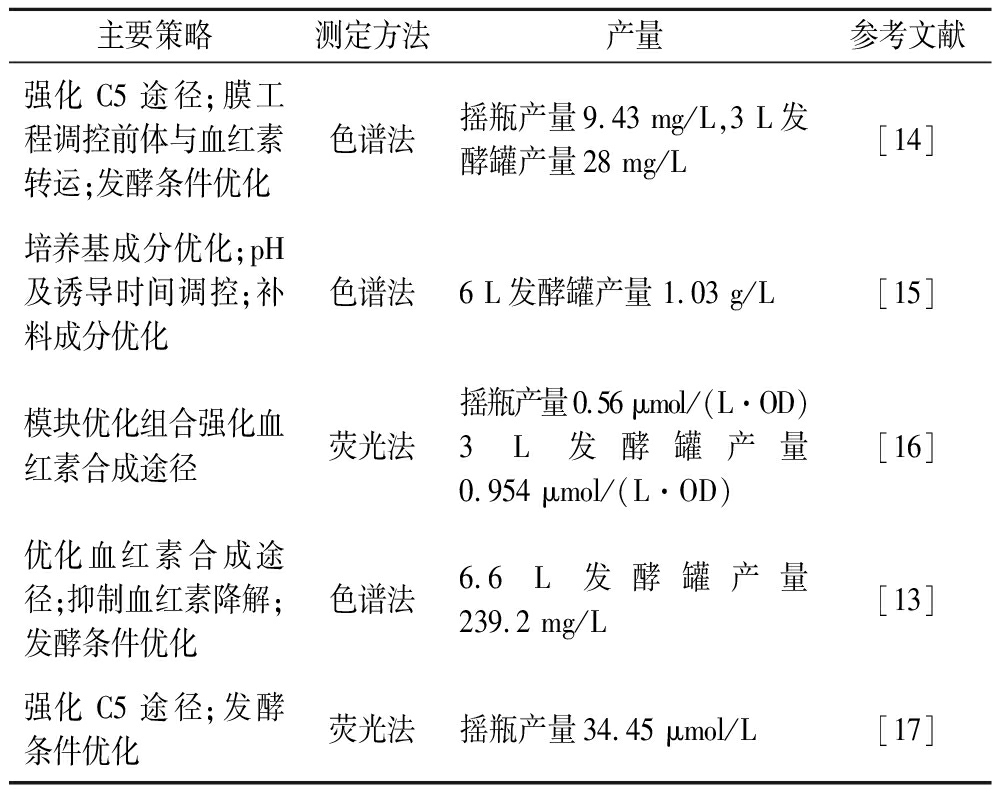
主要策略测定方法产量参考文献强化C5途径;膜工程调控前体与血红素转运;发酵条件优化色谱法摇瓶产量9.43 mg/L,3 L发酵罐产量28 mg/L[14]培养基成分优化;pH及诱导时间调控;补料成分优化色谱法6 L发酵罐产量 1.03 g/L[15]模块优化组合强化血红素合成途径荧光法摇瓶产量0.56 μmol/(L·OD)3 L发酵罐产量0.954 μmol/(L·OD)[16]优化血红素合成途径;抑制血红素降解;发酵条件优化色谱法6.6 L发酵罐产量239.2 mg/L[13]强化C5途径;发酵条件优化荧光法摇瓶产量34.45 μmol/L[17]
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
实验中所用到的菌株和质粒相关信息见表2。
表2 本研究中使用的菌株与质粒
Table 2 Strains and plasmids in this study
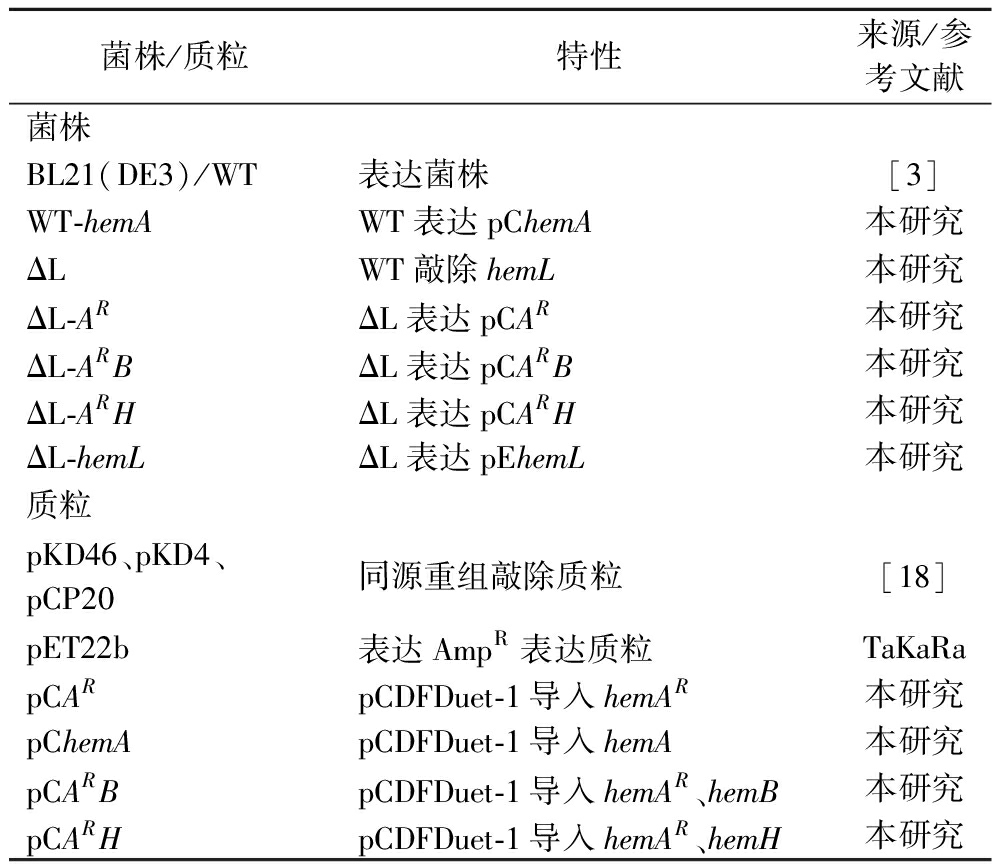
菌株/质粒特性来源/参考文献菌株BL21(DE3)/WT表达菌株[3]WT-hemAWT表达pChemA本研究ΔLWT敲除hemL本研究ΔL-ARΔL表达pCAR本研究ΔL-ARBΔL表达pCARB本研究ΔL-ARHΔL表达pCARH本研究ΔL-hemLΔL表达pEhemL本研究质粒pKD46、pKD4、pCP20同源重组敲除质粒[18]pET22b表达AmpR表达质粒TaKaRapCARpCDFDuet-1导入hemAR本研究pChemApCDFDuet-1导入hemA本研究pCARBpCDFDuet-1导入hemAR、hemB本研究pCARHpCDFDuet-1导入hemAR、hemH本研究
1.1.2 试剂
质粒提取、纯化试剂盒、限制性内切酶、T4连接酶,TaKaRa公司;IPTG、硫酸卡那霉素、氨苄青霉素、氯霉素,生工生物工程(上海)股份有限公司;草酸,美国Sigma公司;ABTS,BBI生命科学有限公司;Premix TaqTM、rTaq酶,宝生物工程(大连)有限公司;FeSO4·7H2O,国药集团;L-GLy、L-GLu,上海研玘生物。
1.1.3 培养基
LB培养基:10 g/L胰蛋白胨,5 g/L酵母粉,10 g/L NaCl(固体培养基加入20 g/L琼脂),抗性固体培养基在LB培养基灭菌温度降至60 ℃后,加入抗生素(终质量浓度为50 mg/L)。外源添加L-甘氨酸或FeCl2的培养基为在LB液体培养基中加入不同浓度的L-甘氨酸或FeCl2。
1.2 仪器与设备
组合式摇床,太仓市强乐实验设备有限公司;超净工作台,苏州净化设备有限公司;高压灭菌锅,致微(厦门)设备有限公司;分光光度计,上海美普达仪器有限公司;PCR仪、核酸电泳仪、凝胶成像仪,美国Bio-Rad公司;pH分析计,梅特勒-托利多公司。
1.3 实验方法
1.3.1 hemL敲除菌株的构建
采用DATSENKO等[18]的方法,以NCBI上公布的E.coli BL21(DE3)基因组序列为模板,设计敲除hemL上下游同源序列的引物。引物UhemLF/R、DhemLF/R分别扩增出hemL基因上下游各500 bp左右的同源序列基因,将上下游基因与携带Amp抗性的pKD4质粒上的特定序列连接起来,获得敲除hemL的打靶片段。
将上述打靶片段电转转入含pKD46质粒的菌株中37 ℃、200 r/min旋转振荡过夜复苏后,涂布抗性平板,37 ℃培养,筛选阳性单克隆菌落。利用引物进行PCR扩增,验证条带大小正确后,再导入pCP20质粒,30 ℃培养后,涂布至氯霉素抗性平板上,30 ℃过夜培养,挑转化子,利用引物 UhemLF、DhemLR 进行PCR扩增验证后,送至华大基因有限公司测序验证,测序正确的转化子,再通过42 ℃摇床培养,得到没有任何抗性的菌株。
1.3.2 过表达菌株的构建
插入hemAR的pCDFDuet1质粒pCAR由生工生物(上海)股份有限公司合成,hemAR基因序列来源于NCBI。以E.coli BL21(DE3)基因组为模板扩增得到带有同源臂与酶切位点的hemA、hemB与hemH基因片段,并分别与线性化的载体pCDFDuet1和pCAR 进行连接,得到质粒pChemA、pCARB 与pCARH,使用引物pCDF F/R对质粒进行验证,验证正确后导入原始菌株(WT)或ΔL感受态细胞中,获得菌株WT-pChemA、ΔL-pCAR、ΔL-pCARB、ΔL-pCARH。本研究中使用的引物序列见表3。
表3 本研究中使用的引物
Table 3 Primers in this study

引物名称序列(5′-3′)来源pCDF FCGACTCCTGCATTAGGAAAT本研究pCDF RACCGTGTGCTTCTCAAAT本研究UhemLFCTTACTCATGGAGGGTTCCTGATT本研究UhemLRgaagcagctccagcctacacTAACGTGAGTGCGCCAGAAC本研究DhemLFgctaattcccatgtcATCATCGGCGGTGGAATG本研究DhemLRCTTCGCAAACACCCGACG本研究hemAFATGACCCTTTTAGCACTCGG本研究hemARTATTCAGGCGTTCGTTATCCCC本研究hemARFATGCGTCAGACTAAAACCGG本研究hemARRTTAGCGATACGCGGCAACAAG本研究hemBFaccacagccaggatccATGACAGACTTAATCCAACGCCC本研究hemBRtaagcattatgcggccgcTAACGCAGAATCTTCTTCTCAGCC本研究hemHFatcaccacagccaggatccATGCGTCAGACTAAAACCGG本研究hemHRtaagcattatgcggccgcTTAGCGATACGCGGCAACAA本研究
注:表中小写字母代表同源臂序列。
1.3.3 培养方法
各菌株接种于装有50 mL LB培养基的摇瓶中,37 ℃、200 r/min培养到OD600值达到0.6~0.8时,加入终浓度为0.2 mmol/L的IPTG,37 ℃、200 r/min继续培养,分别在不同的时间点取样,测定菌体生长(OD600处的吸光值)和血红素浓度。
1.3.4 血红素浓度测定
参考张鑫[19]的方法检测血红素浓度。取出体积V=8/OD600的菌液,离心洗涤,加入500 μL低浓度草酸(20 mmol/L),4 ℃冰箱放置16 h后取出,向其中加入500 μL高浓度草酸(2 mol/L),吹吸混匀后等分为2份,一份室温静置,一份置于95 ℃水浴锅中,加热30 min后室温静置。2份样品分别离心后,各取200 μL上清液,加入酶标板,激发波长400 nm,发射波长620 nm,测得对应的荧光值后,将二者的差值代入标准曲线得到血红素浓度。标准曲线以氯高铁血红素为标准品测得。
2 结果与分析
2.1 hemL敲除菌与过表达验证
2.1.1 hemL缺失对菌体生长及血红素合成的影响
血红素为大肠杆菌生长所必需,大肠杆菌依赖C5途径合成血红素。有研究表明在该途径中,由hemA编码的谷氨酰-tRNA还原酶与hemL编码的GSA变位酶相互作用,形成漏斗状结构,从而加速前体5-ALA的合成[20]。本研究试图探究单独表达C4途径的效果,就必然要阻断大肠杆菌自身的C5途径,但前人的研究表明,敲除C5途径上的大多数基因,如hemA、hemB、hemH等,均会导致细菌无法生长[21]。而敲除hemL菌株仍旧可以生长,一种可能的原因在于GSA会自发降解生成5-ALA,但这个过程非常缓慢,从而导致菌株生长严重下降[22]。因此本文最终选择敲除hemL,并与原始菌株(WT)、回补hemL菌株,异源过表达hemAR的菌株相比较,结果表明,12 h时敲除菌株的生长显著低于其他菌株,在培养基中添加前体5-ALA也可以使菌株的生长得以恢复(图2-a),而且诱导8 h时血红素的含量敲除菌株也显著低于出发菌株和回补菌株(图2-b),说明敲除hemL阻断了C5途径。
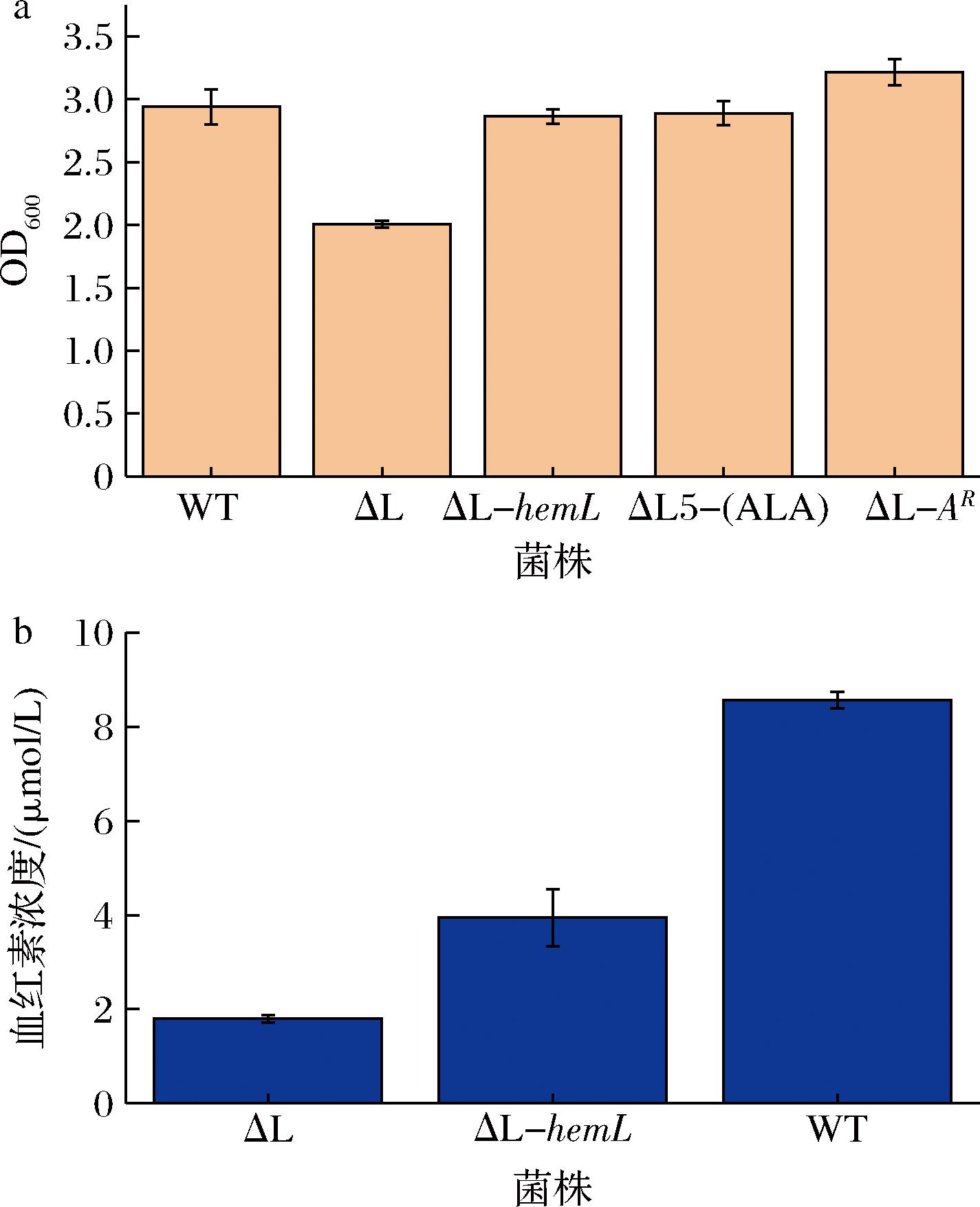
a-菌株生长;b-血红素浓度
图2 hemL敲除菌株的生长及血红素合成
Fig.2 Growth and heme synthesis of hemL knockout strains
2.1.2 C4与C5途径对菌株生长和血红素合成的影响
在出发菌株E.coli BL21(DE3)中分别过表达同源hemA,构建菌株WT-hemA,强化C5途径;过表达源于Rhodobacter sphaeroides C4途径ALA合酶基因hemAR,构建在原有C5基础上,引入C4途径的C5/C4双途径并存的菌株WT-AR;在阻断了C5途径的敲除菌ΔL中导入异源的hemAR基因,构建仅有C4途径的菌株ΔL-AR,比较了3株重组菌的生长与血红素合成情况,以出发菌株WT为对照。结果表明4株菌在0~12 h的生长区别并不大,12 h后,导入hemA与异源的hemAR相较于野生菌生长均有所提升。其中ΔL-AR生长速度最快,OD600值最高为2.67,比WT高了24%(图3-a)。
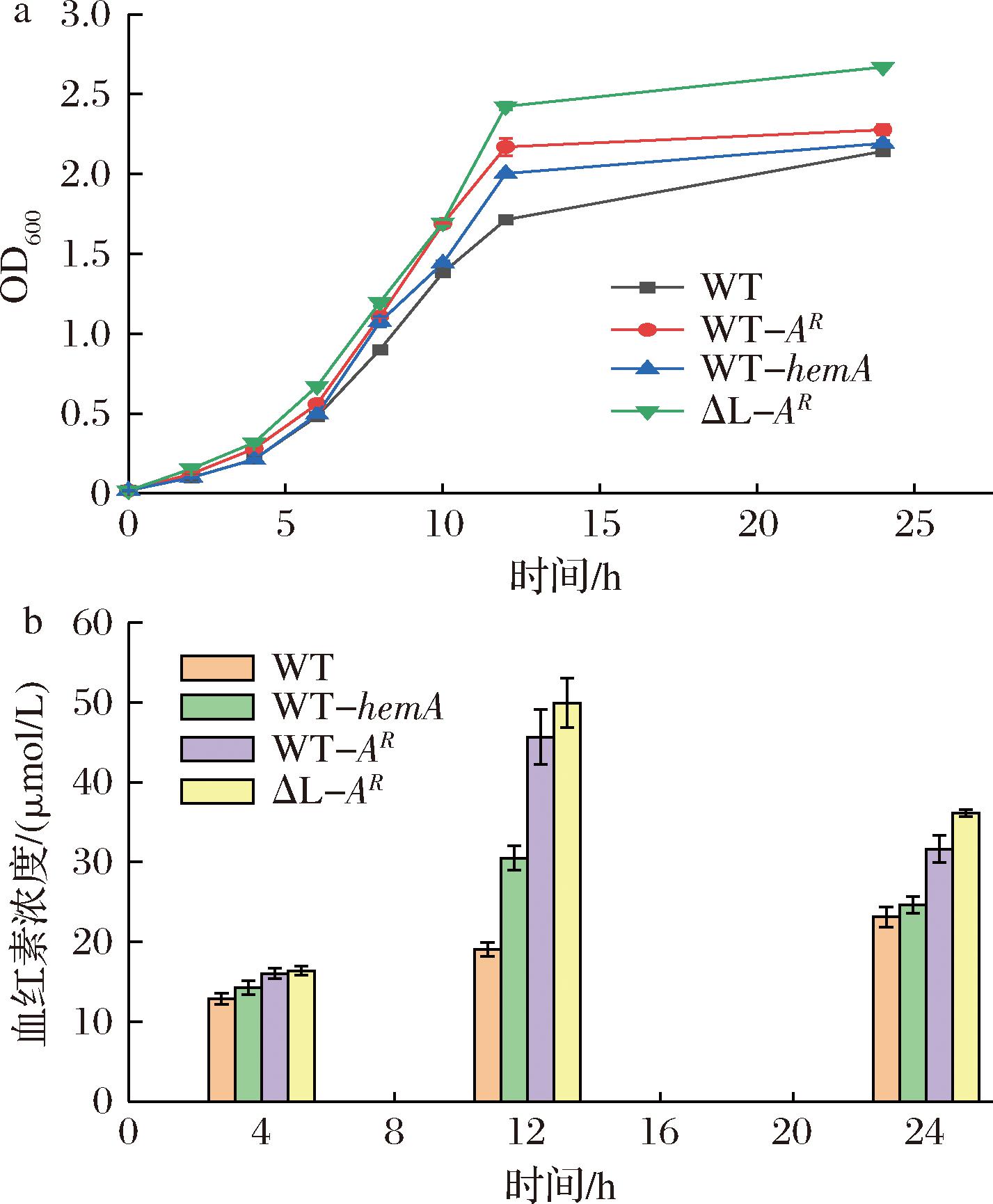
a-生长曲线;b-血红素浓度
图3 过表达C4与C5 途径菌株 的生长与血红素浓度
Fig.3 Growth and heme concentration in C4/C5 pathway overexpressing strains
血红素浓度在12 h时各菌株达到了峰值,其中ΔL-AR的血红素达到最高为49.95 μmol/L,是原始菌株WT的2.6倍,24 h时各菌株血红素浓度均下降(图3-b)。有研究表明血红素对谷氨酰-tRNA还原酶具有反馈抑制作用[23],除此之外,同时表达C4和C5途径的基因,对前体琥珀酰辅酶A与谷氨酸的需求增加,不利于菌株自身的生长,因此仅含有C4途径的菌株更具优势。所以选择ΔL-AR进行后续研究。
2.1.3 强化5-ALA下游关键基因对菌体生长及血红素合成的影响
在ΔL-AR的基础上,本研究试图强化5-ALA下游的途径基因,进一步提高血红素的合成。有研究表明同源过表达了hemB有利于5-ALA向下游血红素的转化[24],而亚铁螯合酶是催化PPIX生成血红素的关键酶。因此选择在ΔL-AR菌株中过表达hemH或hemB基因,并比较了3株菌在生长和血红素合成上的差异。
结果表明在ΔL-AR中过表达hemH或hemB后,前12 h各菌株的生长并无显著差异,而12 h后,过表达hemH的ΔL-ARH生长优于其他2株菌,OD600值在24 h时达到了3.17(图4-a),同时血红素的合成也优于其他菌株,并最终在24 h时达到62.67 μmol/L(图4-b);过表达hemB的ΔL-ARB菌株虽然在一定程度上促进后期血红素的合成,但低于ΔL-ARH菌株。因此亚铁螯合酶的作用更为显著,进一步选择ΔL-ARH进行添加前体物质的发酵优化。
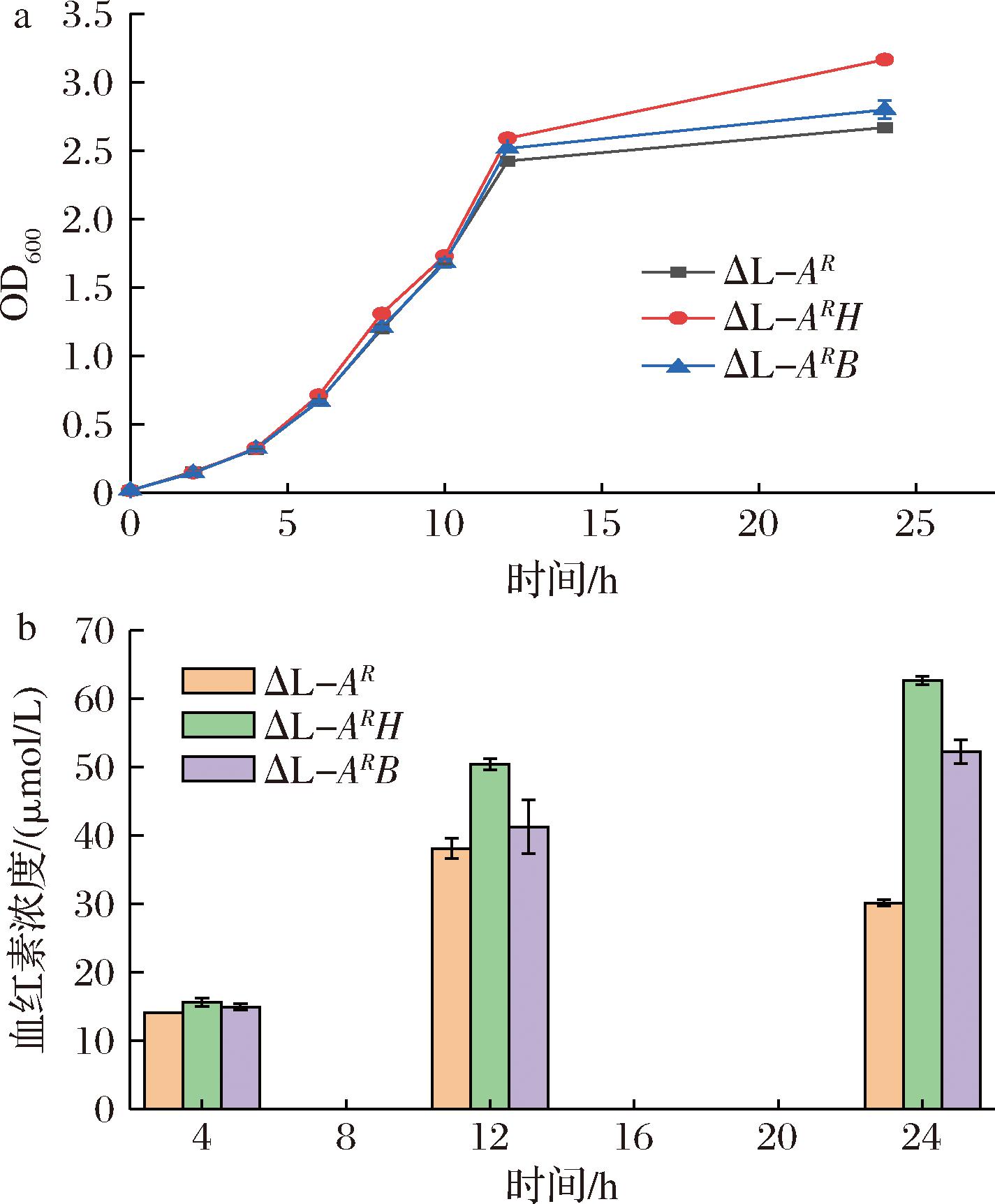
a-生长曲线;b-血红素浓度
图4 强化下游关键基因菌株生长与血红素浓度
Fig.4 Growth and heme concentration in strains with enhanced key 5-ALA downstream genes
2.2 外源添加前体物质对菌体生长及血红素合成的影响
2.2.1 添加甘氨酸对菌株生长和血红素合成的影响
外源补充终产物的前体可以有效提高产物的最终产量[25],甘氨酸是外源导入的C4途径的前体,并且在一定范围内,可以作为营养成分,促进菌株的生长[26]。因此在ΔL-ARH培养时,外源添加100、250、500、1 000 mg/mL甘氨酸于LB培养基中。结果表明添加甘氨酸确实促进了菌株的生长,当添加500 mg/L的甘氨酸时,生长效果最佳,OD600值在24 h可达到3.19,并且在前期的生长阶段也快于添加其他浓度的甘氨酸,但当进一步增加甘氨酸添加量时,菌株生长出现了下降。有研究表明甘氨酸浓度过高,会抑制大肠杆菌的繁殖[27],与本研究结果一致。添加甘氨酸同样提高了血红素的产量,当添加250 mg/L的甘氨酸时,血红素浓度最高达到了82.39 μmol/L。但当甘氨酸浓度进一步增加时,血红素浓度出现下降,因为甘氨酸合成的产物是5-ALA,过量的5-ALA会抑制上游基因的表达。综合考虑上述因素,认为甘氨酸的最佳补充浓度是250 mg/L。外源添加甘氨酸对菌株ΔL-ARH 的影响见图5。
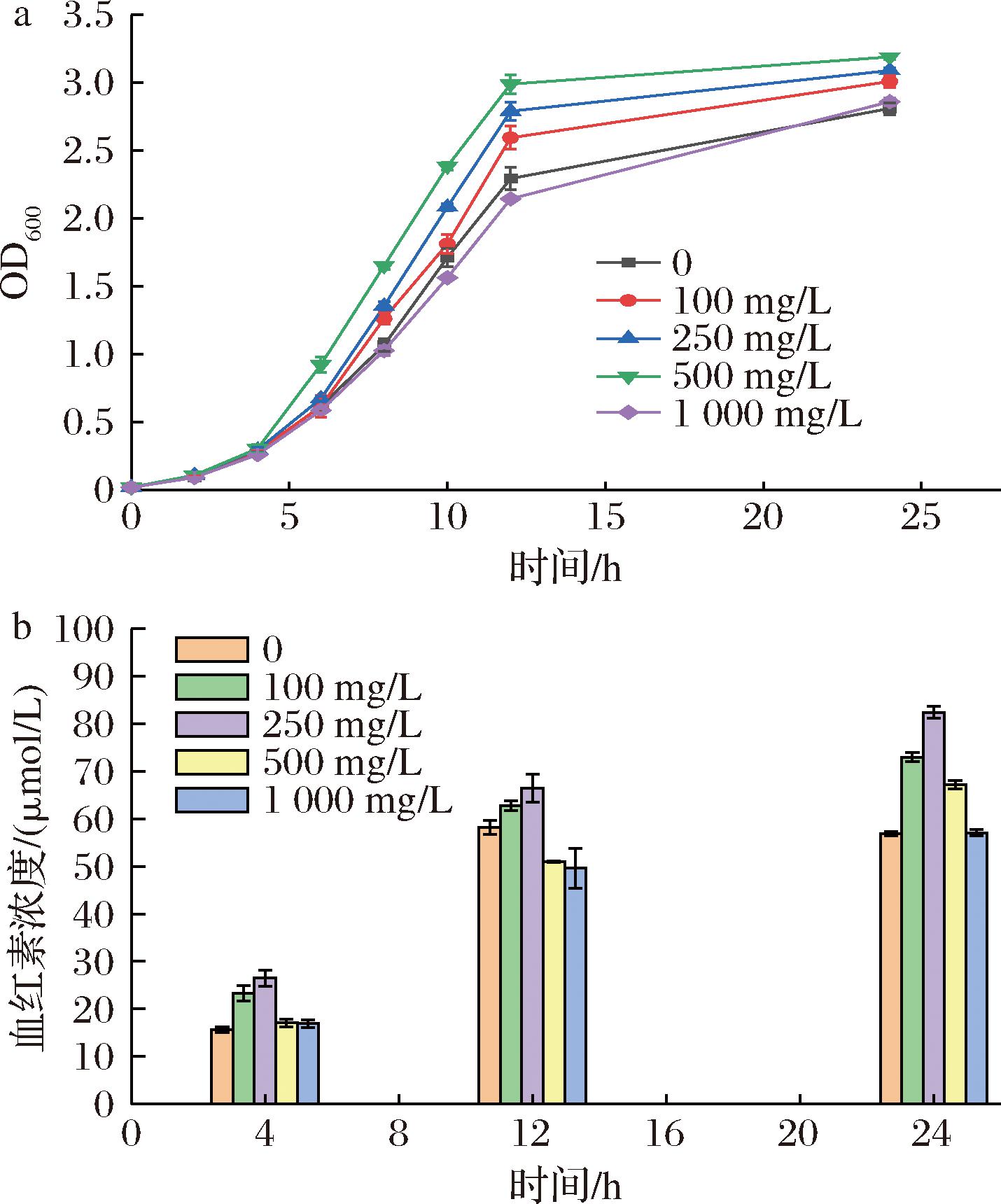
a-生长曲线;b-血红素浓度
图5 外源添加甘氨酸对菌株ΔL-ARH 的影响
Fig.5 Effect of exogenous addition of glycine on strain ΔL-ARH
2.2.2 添加Fe2+对菌株生长和血红素合成的影响。
铁元素对于绝大多数细菌来说是必不可少的营养物质,细胞内的氧化还原反应、呼吸作用以及DNA前体的合成都离不开铁元素的参与[28]。在血红素合成的最后一步反应中,亚铁螯合酶会将Fe2+插入到PPIX中,形成血红素[10]。在补料发酵中,Fe2+浓度也是补料成分优化的关键因素[15]。因此,研究了外源铁离子添加量对菌体生长和血红素产量的影响。结果表明当Fe2+浓度为50 μmol/L时,细胞生长最好,OD600值可以达到3.06(图6-a)。而当外源添加终浓度200 μmol/L Fe2+时,血红素浓度最高达到73.16 μmol/L(图6-b)。虽然加入Fe2+产生一定的作用,但是取得的效果不及加入甘氨酸对菌株的影响,分析原因可能是由于Fe2+在细胞中本身是足量的,因此外源补充Fe2+的效果弱于补充甘氨酸。
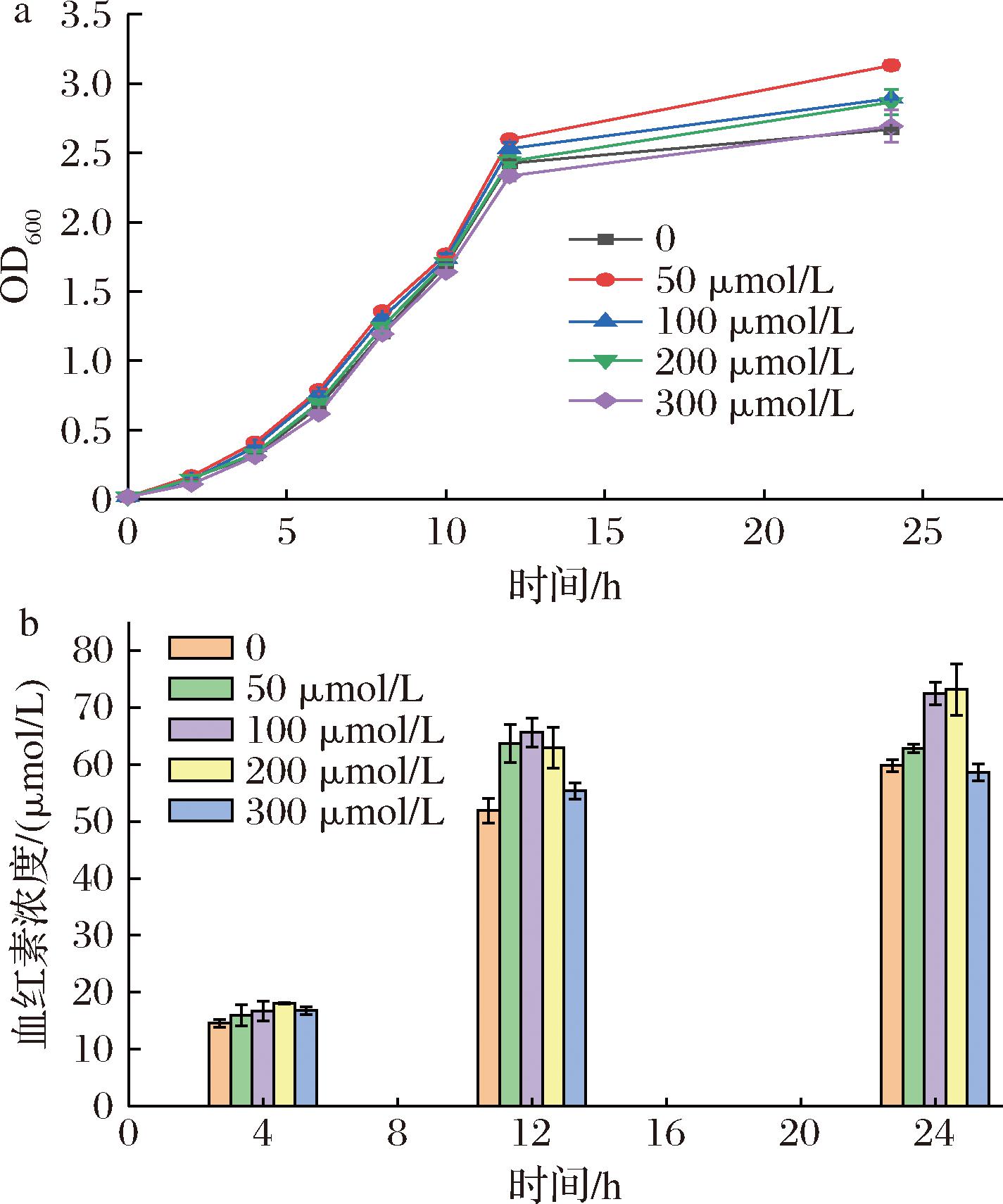
a-生长曲线;b-血红素浓度
图6 外源添加Fe2+对菌株ΔL-ARH 的影响
Fig.6 Effect of exogenous addition of Fe2+ on strain ΔL-ARH
3 结论
代谢工程改造大肠杆菌提高血红素的产量,被认为是微生物生产血红素的有效方法。强化大肠杆菌自有的C5途径;或筛选合适的5-ALA合酶,导入异源C4途径,使得C4/C5途径共同表达,曾被用于血红素的增产。本研究首次通过敲除C5途径关键基因hemL,导入异源C4途径,获得了仅表达C4途径的大肠杆菌。结果表明血红素产量高于过表达C5或C4/C5的菌株,可能的原因是敲除C5途径关键基因hemL一定程度解除了血红素的反馈,从而合成更多的血红素。继而,以表达C4途径的大肠杆菌ΔL-AR为底盘菌株,分别过表达PPD途径上的2种关键基因5-ALA脱水酶基因(hemB)以及亚铁螯合酶基因(hemH),发现过表达hemH的菌株,血红素积累高于过表达hemB的菌株,血红素产量可以达到62.67 μmol/L。最后,通过外源添加C4途径的前体甘氨酸,以及Fe2+进一步提高了胞内血红素的含量,最高达到82.39 μmol/L。
由于胞内血红素及其前体物质的积累,会对合成途径中的关键酶产生反馈调节,因此后期研究可通过促进血红素的外泌,提高终产物血红素的合成。
[1] FENG C Q, PAN M, TANG L.5-Aminolevulinic acid level and dye-decolorizing peroxidase expression regulate heme synthesis in Escherichia coli[J].Biotechnology Letters, 2022, 44(2):271-277.
[2] GE J Z, WANG X L, BAI Y G, et al.Engineering Escherichia coli for efficient assembly of heme proteins[J].Microbial Cell Factories, 2023, 22(1):59.
[3] ROMANOWSKI S, EUST QUIO A S.Synthetic biology for natural product drug production and engineering[J].Current Opinion in Chemical Biology, 2020, 58:137-145.
QUIO A S.Synthetic biology for natural product drug production and engineering[J].Current Opinion in Chemical Biology, 2020, 58:137-145.
[4] 李怿韬, 曾伟主, 唐蕾.发酵过程优化提高毕赤酵母合成血红素[J].食品与发酵工业, 2024, 50(22):60-66.LI Y T, ZENG W Z, TANG L.Enhancing heme biosynthesis in Pichia pastoris by fermentation process optimization[J].Food and Fermentation Industries, 2024, 50(22):60-66.
[5] KWON S J, DE BOER A L, PETRI R, et al.High-level production of porphyrins in metabolically engineered Escherichia coli:Systematic extension of a pathway assembled from overexpressed genes involved in heme biosynthesis[J].Applied and Environmental Microbiology, 2003, 69(8):4875-4883.
[6] YANG S M, WANG A L, LI J C, et al.Improved biosynthesis of heme in Bacillus subtilis through metabolic engineering assisted fed-batch fermentation[J].Microbial Cell Factories, 2023, 22(1):102.
[7] LUO Z S, PAN F, ZHU Y F, et al.Synergistic improvement of 5-aminolevulinic acid production with synthetic scaffolds and system pathway engineering[J].ACS Synthetic Biology, 2022, 11(8):2766-2778.
[8] WANG W Q, XIANG Y L, YIN G B, et al.Construction of 5-aminolevulinic acid microbial cell factories through identification of novel synthases and metabolic pathway screens and transporters[J].Journal of Agricultural and Food Chemistry, 2024, 72(14):8006-8017.
[9] CUI Z Y, JIANG Z N, ZHANG J H, et al.Stable and efficient biosynthesis of 5-aminolevulinic acid using plasmid-free Escherichia coli[J].Journal of Agricultural and Food Chemistry, 2019, 67(5):1478-1483.
[10] FRUSTACI J M, O’BRIAN M R.Analysis of the Bradyrhizobium japonicum hemH gene and its expression in Escherichia coli[J].Applied and Environmental Microbiology, 1993, 59(8):2347-2351.
[11] YANG Q Y, SUN X, WANG H, et al.Multi-modular metabolic engineering of heme synthesis in Corynebacterium glutamicum[J].Synthetic and Systems Biotechnology, 2024, 9(2):285-293.
[12] WANG M M, SHI Z, GAO N, et al.Sustainable and high-level microbial production of plant hemoglobin in Corynebacterium glutamicum[J].Biotechnology for Biofuels and Bioproducts, 2023, 16(1):80.
[13] ZHAO X R, CHOI K R, LEE S Y.Metabolic engineering of Escherichia coli for secretory production of free haem[J].Nature Catalysis, 2018, 1(9):720-728.
[14] GENG Z X, GE J X, CUI W, et al.Efficient de novo biosynthesis of heme by membrane engineering in Escherichia coli[J].International Journal of Molecular Sciences, 2022, 23(24):15524.
[15] CHOI K R, YU H E, LEE H, et al.Improved production of heme using metabolically engineered Escherichia coli[J].Biotechnology and Bioengineering, 2022, 119(11):3178-3193.
[16] 翁焕娇, 丁雯雯, 石雅南, 等.基于模块化优化策略强化大肠杆菌合成血红素[J].食品与生物技术学报, 2019, 38(6):86-94.WENG H J, DING W W, SHI Y N, et al.Enhancement of heme synthesis pathway in Escherichia coli via a modular optimization strategy[J].Journal of Food Science and Biotechnology, 2019, 38(6):86-94.
[17] 陈丹园. 大肠杆菌血红素合成途径关键酶基因的表达与调控[D].无锡:江南大学, 2018.CHEN D Y.Expression and regulation of genes coding for the key enzyme in heme synthetic pathway in Escherichia coli[D].Wuxi:Jiangnan University, 2018.
[18] DATSENKO K A, WANNER B L.One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J].Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(12):6640-6645.
[19] 张鑫.大肠杆菌血红素代谢途径的改造及DyP酶的异源表达[D].无锡:江南大学,2023.ZHANG X.Modification of heme metabolic pathway in Escherichia coli and heterologous expression of DyP enzyme[D].Wuxi:Jiangnan University, 2023.
[20] DAILEY H A, DAILEY T A, GERDES S, et al.Prokaryotic heme biosynthesis:Multiple pathways to a common essential product[J].Microbiology and Molecular Biology Reviews, 2017, 81(1):e00048-16.
[21] VERDERBER E, LUCAST L J, VAN DEHY J A, et al.Role of the hemA gene product and delta-aminolevulinic acid in regulation of Escherichia coli heme synthesis[J].Journal of Bacteriology, 1997, 179(14):4583-4590.
[22] LÜER C, SCHAUER S, MÖBIUS K, et al.Complex formation between glutamyl-tRNA reductase and glutamate-1-semialdehyde 2, 1-aminomutase in Escherichia coli during the initial reactions of porphyrin biosynthesis[J].Journal of Biological Chemistry, 2005, 280(19):18568-18572.
[23] IKUSHIRO H, NAGAMI A, TAKAI T, et al.Heme-dependent inactivation of 5-aminolevulinate synthase from Caulobacter crescentus[J].Scientific Reports, 2018, 8:14228.
[24] KANG Z, WANG Y, GU P F, et al.Engineering Escherichia coli for efficient production of 5-aminolevulinic acid from glucose[J].Metabolic Engineering, 2011, 13(5):492-498.
[25] KIM S, LINDNER S N, ASLAN S, et al.Growth of E.coli on formate and methanol via the reductive glycine pathway[J].Nature Chemical Biology, 2020, 16(5):538-545.
[26] 李凤辰, 段纪甫, 宫衡.氨基酸对大肠杆菌BL21生长影响的研究[J].工业微生物, 2013, 43(3):29-31.LI F C, DUAN J F, GONG H.Effects of amino acid on growth of Escherichia coli BL21[J].Industrial Microbiology, 2013, 43(3):29-31.
[27] 冯言, 刘马峰, 程安春.革兰氏阴性菌亚铁离子转运系统的组成及作用机制[J].微生物学报, 2016, 56(7):1061-1069.FENG Y, LIU M F, CHENG A C.Component and functional mechanism of the ferrous iron acquisition system in gram-negative bacteria-a review[J].Acta Microbiologica Sinica, 2016, 56(7):1061-1069.
[28] AGASHE P, KUZMINOV A.Nitric oxide precipitates catastrophic chromosome fragmentation by bolstering both hydrogen peroxide and Fe(Ⅱ) Fenton reactants in E.coli[J].Journal of Biological Chemistry, 2022, 298(4):101825.