苹果(Malus pumila Borkh.)在中国的栽培面积约为3 132.12万hm2、产量可达4 000万t以上,均居世界首位[1]。目前我国苹果消费模式主要以鲜食为主,但随着新定植果园陆续进入盛果期,鲜果产大于销的危机日益显现,对果品进行精深加工势在必行[2]。以苹果汁为原料发酵而成富含氨基酸、有机酸、酚类物质和维生素等多种营养成分,且酒精度小于7% vol的低醇苹果酒,既具有良好的口感和保健价值,还减轻了高酒精度对人体的危害,深受女性和年轻消费者的喜爱[3]。苹果酒在国外苹果深加工中占比可达40%以上,而我国的苹果酒生产仍处于起步阶段,存在缺乏酿酒专用苹果品种、酒体风味同质化和安全性有待提高等诸多问题,严重制约了产业的可持续发展[2-3]。
酿造苹果酒时需要根据原料品质及破损程度添加约50 mg/L SO2,用于抑制野生酵母和霉菌等未知菌群产生的不良影响;当酒精发酵结束时为了降低酒体氧化还原电位,保护芳香物质和色素等化学成分,同时防止果酒在贮藏过程中的二次发酵,还需再补加30~50 mg/L SO2[4-5]。然而过量使用SO2会导致果酒色泽不稳定并破坏其特定营养素[6];更为重要的是,SO2已被广泛应用于干果、蔬菜干、腌菜、果汁及果酒生产中,持续摄入和积累会加速消费者体内钙流失,诱发特殊体质人群的过敏和哮喘反应。此外SO2及其衍生物还能够蓄积于大脑、心脏、肝脏和肾脏等人体关键组织器官,引发毒理反应,严重时危及生命[7]。因此,如何降低果酒中SO2含量,寻找可能的替代方案已经成为果酒产业急需解决的关键问题之一。
已有研究表明,超声波、电脉冲、高压CO2和超高压等技术可以用于减少或部分替代果酒中的SO2[8]。然而物理方式虽然见效快、无污染,但存在产品营养成分损失大、设备价格和能耗高等问题,限制了工业化生产应用。谷胱甘肽、半胱氨酸、乙二胺四乙酸二钠、延胡索酸和山梨酸等化学抑菌剂作用单一,抑菌效果有限[9-11]。新型抑菌剂胶体银和羟基苯甲酸酯虽然能够抑制大多数细菌、真菌和霉菌孢子[12],但应用成本较高,加之研究者对它们在酒精饮料中的安全性还存在争议,其在果酒中的应用还需进一步探究。
羟基酪醇(hydroxytyrosol,HT)主要存在于油橄榄果实和叶片中,具有抑菌、抗氧化和预防心脑血管疾病等生物学活性[13-15]。李春燕[16]采用橄榄叶酿造出富含羟基酪醇、酒香协调且抗氧化水平较高的橄榄酒,拓展了其在食品中的应用范畴。RAPOSO等[17]的研究显示,外源羟基酪醇对刚瓶装时无硫葡萄酒的抗氧化作用较强,但在贮存6个月葡萄酒中的作用效果明显减弱。壳寡糖(chitooligosaccharide,COS)是由壳聚糖或甲壳素水解制备的小分子低聚糖,具有良好的水溶性、抑菌性和抗氧化等生物活性[18-19]。郝振铭等[18]的研究表明,在酒精发酵前添加250 mg/L 壳寡糖,对巨峰葡萄酒中的已知腐败菌抑制率达到99.90%;发酵酒样中原花青素含量、还原能力、DPPH自由基清除率和羟自由基清除率相比于未添加抑菌剂酒样分别增强了22.61%、210.61%、10.10%和14.90%。综上所述,虽然外源添加羟基酪醇和壳寡糖在提高葡萄酒抗氧化能力方面已有相关研究,但它们作为抑菌剂对苹果酒酒精发酵参数和品质的影响效应尚不明确。
本研究以红富士苹果为原料,选用纯度≥98%和≥20%的羟基酪醇以及纯度≥90%的壳寡糖添加于苹果汁中,测定酒精发酵过程中酿酒酵母(Saccharomyces cerevisiae)生长曲线和还原糖消耗动力学;在酒精发酵结束后分析低醇苹果酒的理化性质、颜色指标以及挥发性香气物质,并结合感官评价,综合评价羟基酪醇和壳寡糖对果酒品质的影响,以期为天然抑菌剂在果酒生产实践应用提供技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 试验原料及主要试剂
红富士苹果,甘肃礼县果农合作社。还原糖(以葡萄糖计)为125.50 g/L,可溶性固形物12.50 °Brix,总酸(以苹果酸计)4.48 g/L,pH 3.65。
羟基酪醇,南京普怡生物科技有限公司。分别为通过酶促化学反应合成的商业HT制剂(纯度≥98%)以及源自油橄榄的天然提取物(纯度≥20%);壳寡糖(纯度≥90%,分子质量≤ 2 000 Da),大连中科格莱克生物科技有限公司。
WL琼脂培养基(g/L):葡萄糖50、琼脂粉20、酪胨5、酵母粉4、K2HPO4 0.55、KCl 0.425、CaCl2 0.125、MgSO4 0.125、溴甲酚绿0.022、FeCl3 0.002 5和MnSO4 0.002 5,北京奥博星生物技术有限公司。
果胶酶(100 000 U/g),上海酶联生物科技有限公司;香茅醇、香叶醇、芳樟醇、异戊醇、苯乙醇、乙酸乙酯、乙酸戊酯、乙酸己酯、乙酸异戊酯、乙酸庚酯、3-羟基丁酸乙酯、己酸甲酯、苯乙酸乙酯、庚酸乙酯和辛酸乙酯等香气化合物和内标物2-辛醇标准品,美国Sigma公司;偏重亚硫酸钠、NaOH、无水葡萄糖、NaCl、CuSO4、酒石酸钾钠、无水乙醇和NaH2PO4均为分析纯,天津市致远化学试剂有限公司。
1.1.2 酿酒酵母
商业S.cerevisiae ES488,意大利Enartis公司。
1.2 主要仪器
SPX-150-Ⅱ生化培养箱、SHH·W21·600S恒温水浴锅,上海跃进医疗器械有限公司;PAL-2数显手持折光仪,日本爱宕ATAGO公司;pH S-3C精密pH计,上海雷磁仪器厂;H2050R台式冷冻离心机,长沙湘仪离心机有限公司;SW-CJ-2FD超净工作台,苏州安泰空气技术有限公司;500051S立式高压灭菌锅,上海申安医疗器械厂;1810D摩尔超纯水机,上海摩勒科学仪器有限公司;V-5100紫外可见分光光度计,上海精科实业有限公司;TRACE 1310-ISQ气相色谱-质谱联用仪,美国Thermo Scientific公司。
1.3 试验方法
1.3.1 苹果酿造工艺
参照吴霞等[20]的方法,略做调整。苹果去核切块后匀浆,添加30 mg/L果胶酶40 ℃酶解3 h后用4层纱布过滤澄清。参照生产厂家操作说明,称取相应质量的酿酒酵母干粉,加入10倍体积的蒸馏水溶解并置于37 ℃恒温水浴活化15 min,加入等体积的苹果汁于28 ℃活化10 min后接种发酵。在酒精发酵(20 ℃)过程中每天测定发酵液还原糖,待还原糖质量浓度< 4 g/L时终止发酵,置于4 ℃完全沉淀酵母及果渣,再以3 500 r/min、4 ℃离心10 min,取样测定各指标。
1.3.2 抑菌剂添加方案
参照RAPOSO等[17]的方法,羟基酪醇(纯度≥98%或≥20%)均按照低(10 mg/L)、中(30 mg/L)和高(50 mg/L)质量浓度进行添加。各处理组均设置3个平行,下同。
参照郝振铭等[18]的方法,壳寡糖(纯度≥90%)添加量分别设置为低(100 mg/L)、中(250 mg/L)和高质量浓度(500 mg/L)进行添加。对照组为添加50 mg/L SO2溶液。
1.3.3 菌落数测定
参照周得刚等[21]的方法,每2 d用移液枪无菌移取100 μL样品,稀释至10-6。选取10-5和10-6 2个稀释梯度,吸取各100 μL稀释液均匀涂布于无菌WL培养基表面,每个稀释度3个平行。培养皿倒置放入培养箱中,28 ℃培养48 h后进行菌落计数。
1.3.4 酿酒学参数测定
根据GB/T 15038—2006《葡萄酒、果酒通用分析方法(含第1号修改单)》测定苹果酒的总酸、挥发酸、还原糖含量和pH;酒精度参考GB 5009.225—2023《食品安全国家标准 酒和食用酒精中乙醇浓度的测定》方法测定。采用NaOH滴定法测定总酸含量,以苹果酸(g/L)计;采用直接滴定法,通过水蒸气蒸馏分离,用NaOH标准溶液滴定馏出液,测定挥发酸含量,以乙酸(g/L)计;采用斐林试剂法测定还原糖含量,以葡萄糖(g/L)计;采用pH计测定pH;采用密度瓶法测定酒精度(%vol)。总酚含量测定采用福林-酚法[22],标准曲线回归方程:y=0.001x+0.008 9,相关系数R2=0.999 6。
1.3.5 褐变度及颜色参数测定
1.3.5.1 褐变度测定
苹果酒在12 000 r/min离心5 min,用分光光度计测量420 nm处苹果酒的吸光度(A420 nm),以蒸馏水作为空白对照[7]。
1.3.5.2 色度-色调测定
参考袁倩等[23]的方法,吸取酒样1 mL,用与酒样相同pH的磷酸氢二钠-柠檬酸缓冲液定容至10 mL容量瓶中,取稀释后的酒样于比色皿(10 mm×10 mm×35 mm)中,分别测定在420、520、620 nm处的吸光度值,色度和色调按公式(1)和公式(2)计算:
色度=A420 nm+A520 nm+A620 nm
(1)
色调![]()
(2)
1.3.5.3 CIELab参数测定
参照藏伟等[24]的方法,并稍作修改。酒样通过0.45 μm水系滤膜过滤,取酒样于比色皿(10 mm×10 mm×35 mm)中,测定380~780 nm谱段下的透光率。以蒸馏水作为空白对照,建立CIE颜色坐标系,计算各酒样的L*(亮度)、a*(红绿坐标)、b*(黄蓝坐标)、C*(色度)和H*(色相)。每个样品重复测定3次。
色差![]() 值的计算如公式(3)所示:
值的计算如公式(3)所示:
(3)
式中:ΔL*,处理组和对照组之间L*的差值;Δa*,处理组和对照组之间a*的差值;Δb*,处理组和对照组之间b*的差值。
1.3.6 挥发性成分检测
参照祝霞等[25]的方法,并略做修改。将8 mL苹果酒酒样、2.4 g NaCl、10 μL 2-辛醇(81.06 mg/L)和磁力搅拌转子置于15 mL顶空瓶中,40 ℃水浴30 min,萃取30 min。检测到的香气化合物通过NIST-11、Wiley、香精香料谱库和人工图谱解析进行定性分析。已确定香气化合物的化学成分(匹配度>700),采用内标-标准曲线法(R2>0.995)定量。无标准品的化合物以化学结构相似、分子质量相近和官能团相似的原则进行半定量,气味活性值(odor active value,OAV)按公式(4)计算:
(4)
1.3.7 模糊数学感官评价
参考袁倩等[23]的方法,建立模型进行分析。苹果酒的评价因素为(U={U1, U2, U3, U4});评价等级集为优、良、差(V={V1, V2, V3});评价等级为8、5、2(W={W1, W2, W3})。为了衡量外观、香气、滋味和典型性对苹果酒的影响,本试验确定了4个评价指标的权重。试验调查的10名学生(5名男生,5名女生,均无任何感官缺陷),对4个评价指标进行权重分析,从而得到权重集Q,Q={0.243, 0.275, 0.267, 0.215}。对所得的评价结果按不同等级进行划分,计算各等级的得票数,以各等级票数除以总票数即得模糊关系矩阵A,第i个样品的评价结果如公式(5)所示,该样品的综合评价矩阵B如公式(6)所示。
Yi=Q×Ai
(5)
B=W×Yi
(6)
由感官评定小组(男女各5人,均无身体缺陷和感官缺陷),以苹果酒感官质量评定标准进行感官评价(表1)[26]。
表1 苹果酒感官品质评价标准
Table 1 Criteria of sensory evaluation for cider

分值指标外观香气滋味典型性优987澄清透明、无杂质、颜色呈浅金色、光泽感强果香浓郁,酒体醇和,香气协调酒体丰满,柔和爽口,酸甜适口,回味悠长典型性突出,风格独特、优雅,富有苹果独特风味良654透明、有少许沉淀、颜色呈麦芽糖色、有一定光泽感果香和酒香较淡,有明显不良气味酒体较丰满,较柔和,无异味,味单一有典型性,但不够怡雅差321酒体浑浊、有明显杂质、颜色呈浅柠檬黄色、基本无光泽香气不足,有明显的不良气味酒体瘦弱,缺少柔和性,回味很淡缺少典型性,风格一般
1.4 统计分析
数据采用Excel 2013进行基础分析,采用SPSS 19.0软件进行Duncan’s多重比较以及差异显著性分析(P<0.05)。采用Origin 2021软件绘制折线图和主成分分析图。采用Tbtools以及派森诺基因云平台网站绘制热图。
2 结果与分析
2.1 添加不同抑菌剂的苹果酒酒精发酵动力学
添加不同抑菌剂苹果汁酒精发酵过程中,S.cerevisiae的生物量和还原糖变化差异显著(P<0.05)。其中添加低纯度羟基酪醇和对照组酒样在第7天完成发酵,其他组均在第9天结束发酵。由图1-a~图1-c可知,酒精发酵前期对照组中S.cerevisiae生长速度最快,其余9个发酵组S.cerevisiae生长速度从大到小依次是SO2>低纯度羟基酪醇(≥20%)>高纯度羟基酪醇(≥98%)>壳寡糖(≥90%),且随着抑菌剂质量浓度降低,生长速率逐渐增加。S.cerevisiae的生物量均在第6天时达到最大值后开始下降,其中添加壳寡糖和SO2组下降速度较慢,而羟基酪醇组下降速度较快。整体而言,虽然添加高纯度羟基酪醇和壳寡糖发酵酒样的S.cerevisiae生长速度较慢,延长了发酵周期,但最终还原糖质量浓度均< 4 g/L(图1-d~图1-f),可以顺利完成酒精发酵。
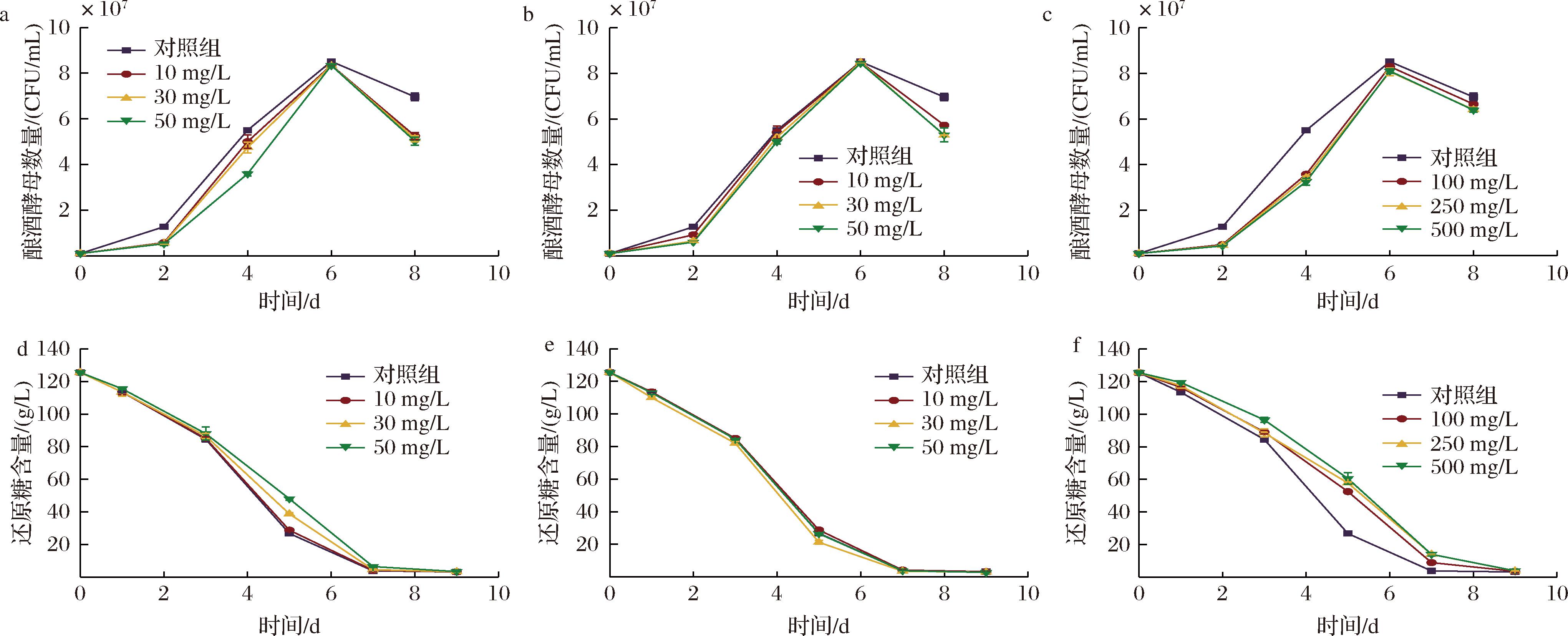
酿酒酵母生长动力学:a-高纯度羟基酪醇;b-低纯度羟基酪醇;c-壳寡糖;还原糖消耗动力学:d-高纯度羟基酪醇;e-低纯度羟基酪醇;f-壳寡糖
图1 添加不同抑菌剂苹果汁酒精发酵过程中发酵动力学
Fig.1 Kinetics of apple juice added with different antibacterial agent during alcoholic fermentation
2.2 添加不同抑菌剂苹果酒的理化指标
酒精发酵结束后供试酒样的理化指标均符合GB/T 15038—2006《葡萄酒、果酒通用分析方法(含第1号修改单)》和GB 5009.225—2023《食品安全国家标准 酒和食用酒精中乙醇浓度的测定》中低醇果酒的相关要求。不同抑菌剂处理组苹果酒的酒精度均小于7%vol,但各酒样之间差异显著(P<0.05),与发酵结束后各组还原糖含量差异相符合(图2)。供试酒样的pH值在3.63~3.72之间,处理组之间存在显著差异(P<0.05)。随着供试酒样pH值降低,可滴定酸含量升高。10个发酵组的挥发酸含量均<0.4 g/L。添加高纯度羟基酪醇的3个酒样中总酸含量没有差异,但显著高于对照组(P<0.05);添加低纯度羟基酪醇的3个酒样中,添加质量浓度为10 mg/L和30 mg/L的酒样高于对照组,且差异显著(P<0.05);添加壳寡糖发酵的3个酒样中,总酸含量均低于对照组,且存在显著差异(P<0.05)。总酚含量在添加不同抑菌剂酒样之间也存在显著差异(P<0.05)。
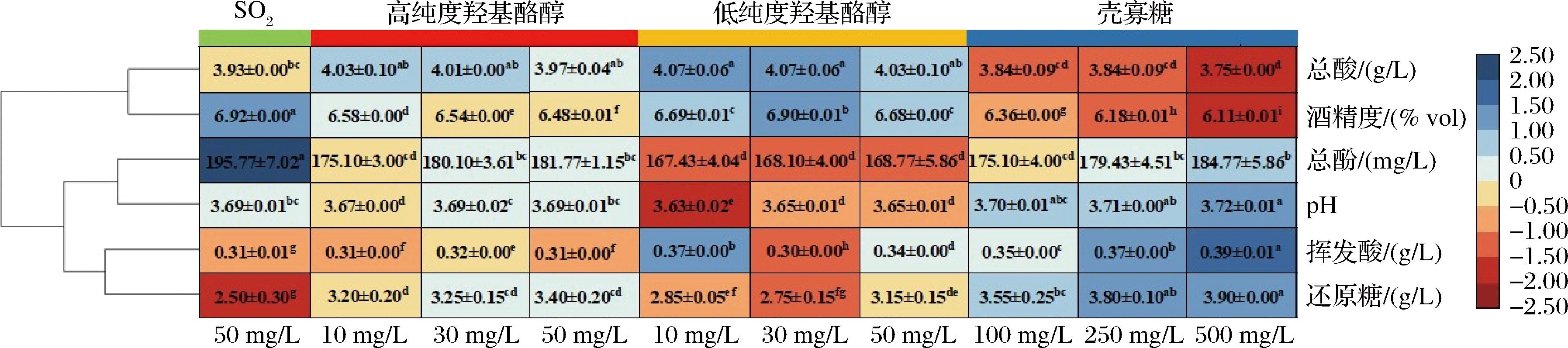
图2 添加不同抑菌剂苹果酒的理化指标热图
Fig.2 Heatmap of physicochemical parameters in cider added with different antibacterial agents
注:字母a~i表示在P<0.05水平下不同处理组具有差异显著性。每列表示不同的试验处理,每行表示不同的理化指标。
2.3 添加不同抑菌剂苹果酒的颜色指标
2.3.1 颜色相关参数
苹果酒的色度越高,则色调越低。由表2可知,对照组的色度低于其他处理组酒样,而添加羟基酪醇的各处理组中,随着羟基酪醇纯度降低及质量浓度减小,色度值逐渐降低,色调值增加;添加壳寡糖处理组中,随着壳寡糖质量浓度降低,其变化趋势和羟基酪醇处理组基本一致。对照组酒样的褐变度低于其他处理组,表明在未添加SO2的情况下苹果酒颜色相对较深,尤其是添加高纯度羟基酪醇的酒样表现较为明显;添加500 mg/L壳寡糖的酒样褐变度低于添加100 mg/L和250 mg/L壳寡糖的酒样,且存在显著差异(P<0.05)。
表2 添加不同抑菌剂苹果酒的颜色指标
Table 2 Color index in cider added with different antibacterial agents
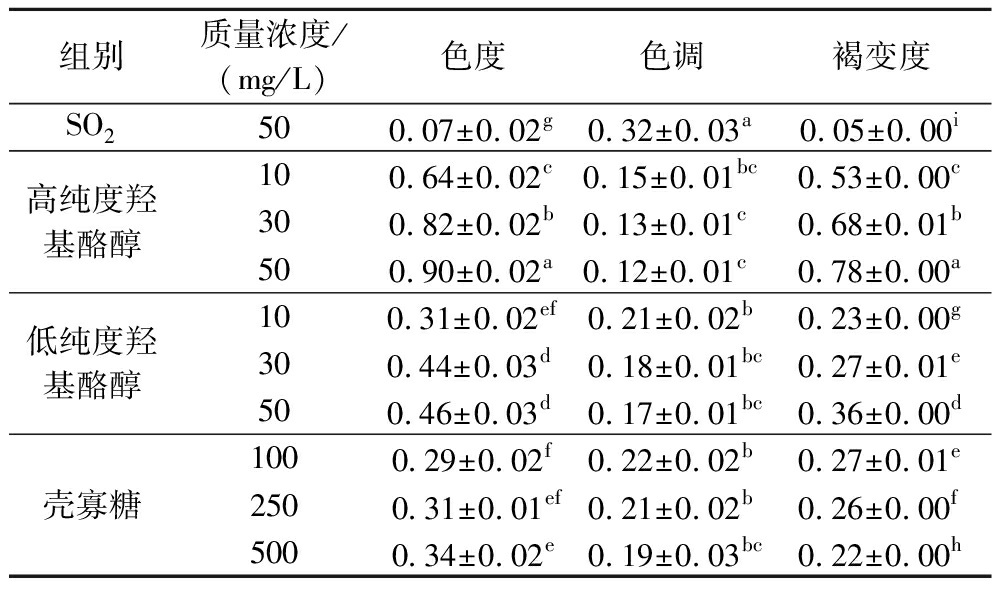
组别质量浓度/(mg/L)色度色调褐变度SO2500.07±0.02g0.32±0.03a0.05±0.00i高纯度羟基酪醇100.64±0.02c0.15±0.01bc0.53±0.00c300.82±0.02b0.13±0.01c0.68±0.01b500.90±0.02a0.12±0.01c0.78±0.00a低纯度羟基酪醇100.31±0.02ef0.21±0.02b0.23±0.00g300.44±0.03d0.18±0.01bc0.27±0.01e500.46±0.03d0.17±0.01bc0.36±0.00d壳寡糖1000.29±0.02f0.22±0.02b0.27±0.01e2500.31±0.01ef0.21±0.02b0.26±0.00f5000.34±0.02e0.19±0.03bc0.22±0.00h
注:表中同一列数据后的不同字母表示各组差异显著(P<0.05),下表同。
2.3.2 CIELab参数
如表3所示,与对照组相比,添加羟基酪醇和壳寡糖的酒样L*值呈下降趋势,而对照组酒体更明亮清澈。供试酒样整体色泽呈现a*值相对于b*值占比较小,酒体的红色成分有限,均以黄色色调为主。添加羟基酪醇的酒样中,a*值随羟基酪醇纯度增大呈下降趋势,b*值和C*值呈上升趋势。添加250 mg/L壳寡糖的酒样相比于添加100、500 mg/L壳寡糖的酒样,a*值较低,b*值较高,且存在显著差异(P<0.05)。
表3 添加不同抑菌剂苹果酒的CIElab值
Table 3 CIElab value in cider added with different antibacterial agents
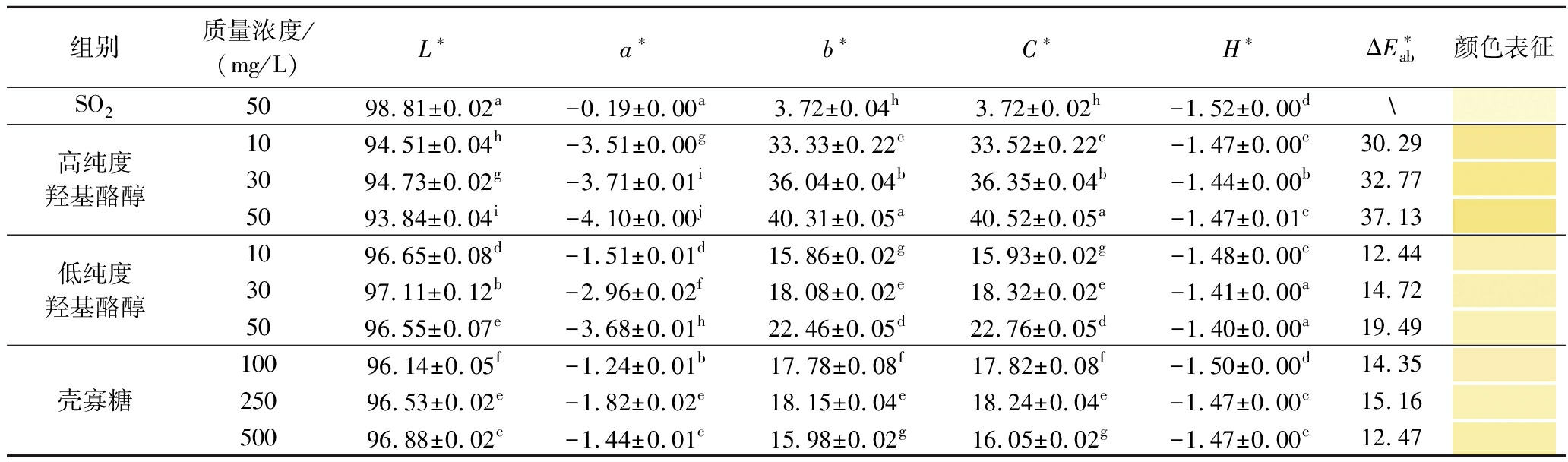
组别质量浓度/(mg/L)L∗a∗b∗C∗H∗ΔE∗ab颜色表征SO25098.81±0.02a-0.19±0.00a3.72±0.04h3.72±0.02h-1.52±0.00d\高纯度羟基酪醇1094.51±0.04h-3.51±0.00g33.33±0.22c33.52±0.22c-1.47±0.00c30.293094.73±0.02g-3.71±0.01i36.04±0.04b36.35±0.04b-1.44±0.00b32.775093.84±0.04i-4.10±0.00j40.31±0.05a40.52±0.05a-1.47±0.01c37.13低纯度羟基酪醇1096.65±0.08d-1.51±0.01d15.86±0.02g15.93±0.02g-1.48±0.00c12.443097.11±0.12b-2.96±0.02f18.08±0.02e18.32±0.02e-1.41±0.00a14.725096.55±0.07e-3.68±0.01h22.46±0.05d22.76±0.05d-1.40±0.00a19.49壳寡糖10096.14±0.05f-1.24±0.01b17.78±0.08f17.82±0.08f-1.50±0.00d14.3525096.53±0.02e-1.82±0.02e18.15±0.04e18.24±0.04e-1.47±0.00c15.1650096.88±0.02c-1.44±0.01c15.98±0.02g16.05±0.02g-1.47±0.00c12.47
酒样色差值≥3时可被人眼感知到颜色差异。9个处理组与对照组的色差值均大于3,处于视觉可观察到差异的范围。其中高纯度羟基酪醇组酒样表现为浅麦芽糖色,低纯度羟基酪醇和壳寡糖组酒样为淡金色,对照组酒样呈现浅柠檬黄色。
2.4 添加不同抑菌剂对苹果酒香气物质的影响
2.4.1 香气化合物组成分析
供试酒样采用GC-MS共检测出69种香气成分,其中品种香13种,发酵香56种。添加高纯度羟基酪醇酒样与对照组相比,总量分别提高了14.13%(10 mg/L)、12.48%(30 mg/L)和7.67%(50 mg/L);添加低纯度羟基酪醇酒样的香气物质总含量与对照组相比,除添加50 mg/L低纯度羟基酪醇的酒样降低了0.45%,其他2组分别提高了5.35%(10 mg/L)和2.02%(30 mg/L),但明显低于添加高纯度羟基酪醇发酵的酒样(P<0.05)。添加500 mg/L壳寡糖发酵酒样香气物质总含量相比对照组降低了2.18%;添加250 mg/L壳寡糖发酵的酒样与对照组之间存在微小差异,仅提高了0.53%;添加100 mg/L壳寡糖发酵的酒样明显高于对照组,总含量提高了4.87%(P<0.05)。
相比于对照组,添加羟基酪醇的酒样中C6化合物的含量增加(图3-a~图3-b)。对照组中C6化合物含量显著高于添加250、500 mg/L的壳寡糖处理组,但低于添加100 mg/L的壳寡糖处理组(图3-c)。添加高纯度羟基酪醇还可以提高酒样中萜烯类物质含量(图3-a),而添加壳寡糖则相反(图3-c)。试验仅在添加高纯度羟基酪醇(10 mg/L)、低纯度羟基酪醇(10 mg/L)、低纯度羟基酪醇(30 mg/L)、壳寡糖(100 mg/L)和壳寡糖(500 mg/L)发酵的酒样中检测到C13-降异戊二烯类化合物。与对照组相比,添加羟基酪醇和壳寡糖的苹果酒中高级醇的含量均有降低。添加羟基酪醇和壳寡糖的酒样中酯类香气物质含量较高,特别是添加高纯度羟基酪醇的酒样尤为显著(图3),但不同质量浓度处理之间均存在差异。添加高纯度羟基酪醇的3组酒样中,苯衍生物、羰基化合物和挥发性酚类物质含量均低于对照组(图3-a);以低纯度羟基酪醇和壳寡糖为抑菌剂的酒样与对照组相比,苯衍生物和羰基化合物的含量降低,挥发性酚类物质含量增加(图3-b~图3-c)。
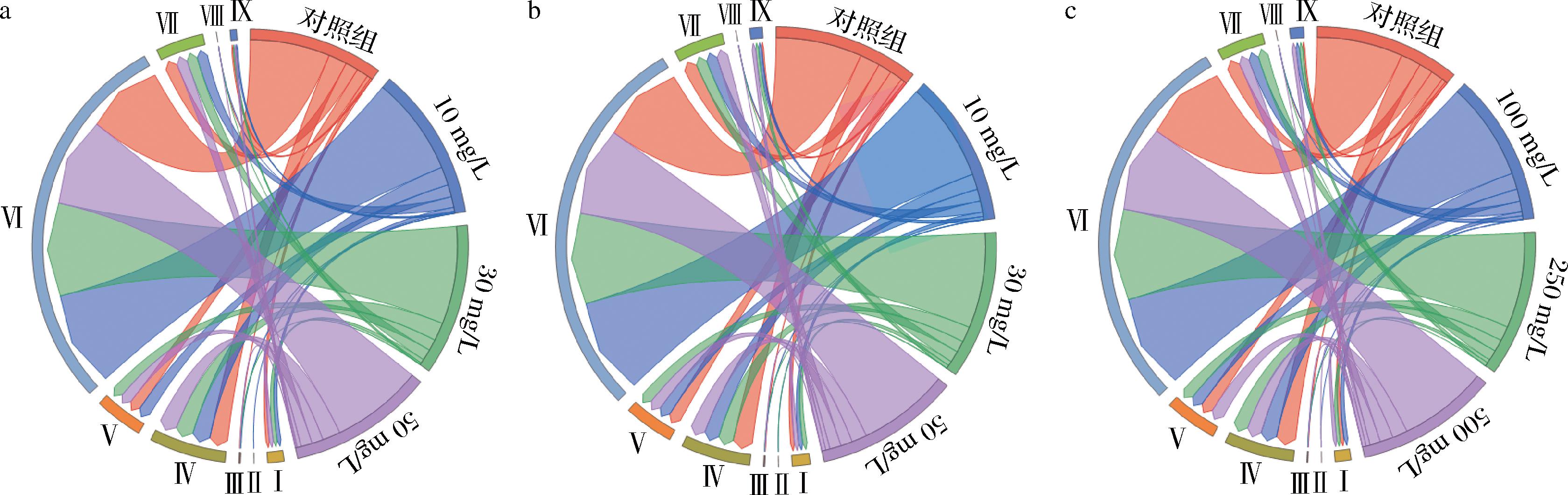
a-高纯度羟基酪醇;b-低纯度羟基酪醇;c-壳寡糖
图3 添加不同抑菌剂苹果酒中的挥发性香气物质分析
Fig.3 Analysis of volatile aroma compounds in cider added with different antimicrobial agents
注:罗马数字I~IX表示在不同香气种类C6化合物、C13-降异戊二烯、萜烯类、高级醇、脂肪酸、酯类、苯衍生物、羰基类、挥发性酚。
2.4.2 品种香气化合物聚类分析
添加高纯度羟基酪醇的酒样中共检测到13种品种香气化合物,包括5种C6化合物,1种C13-降异戊二烯类以及7种萜烯类。其中高纯度羟基酪醇(10 mg/L)和高纯度羟基酪醇(30 mg/L)酒样聚为一类,高纯度羟基酪醇(50 mg/L)单独聚为一类,对照组酒样聚为第三类(图4-a)。不同处理组的品种香气物质含量为302.35~347.49 μg/L。与对照组相比,添加高纯度羟基酪醇(50 mg/L)酒样中芳樟醇、(E)-3-己烯-1-醇及2-乙基己醇等物质含量较高,而高纯度羟基酪醇(10 mg/L)和高纯度羟基酪醇(30 mg/L)酒样中正己醇和香叶醇含量较高,这些化合物阈值较低,可为果酒提供苹果和花香味。由图4-b可见,低纯度羟基酪醇(50 mg/L)和低纯度羟基酪醇(10 mg/L)酒样聚为一类、低纯度羟基酪醇(30 mg/L)单独聚为一类、对照组酒样聚为第三类。添加低纯度羟基酪醇的酒样中(E)-橙花叔醇、正己醇和香叶基丙酮的含量较高。由图4-c可知,添加壳寡糖的酒样中共检测出芳樟醇、香茅醇、橙花醇、(E)-橙花叔醇、香叶基丙酮以及金和欢醇等6种萜烯类物质,其中,添加壳寡糖(100 mg/L)的酒样中β-大马士酮、香叶基丙酮及正己醇等物质含量较高。
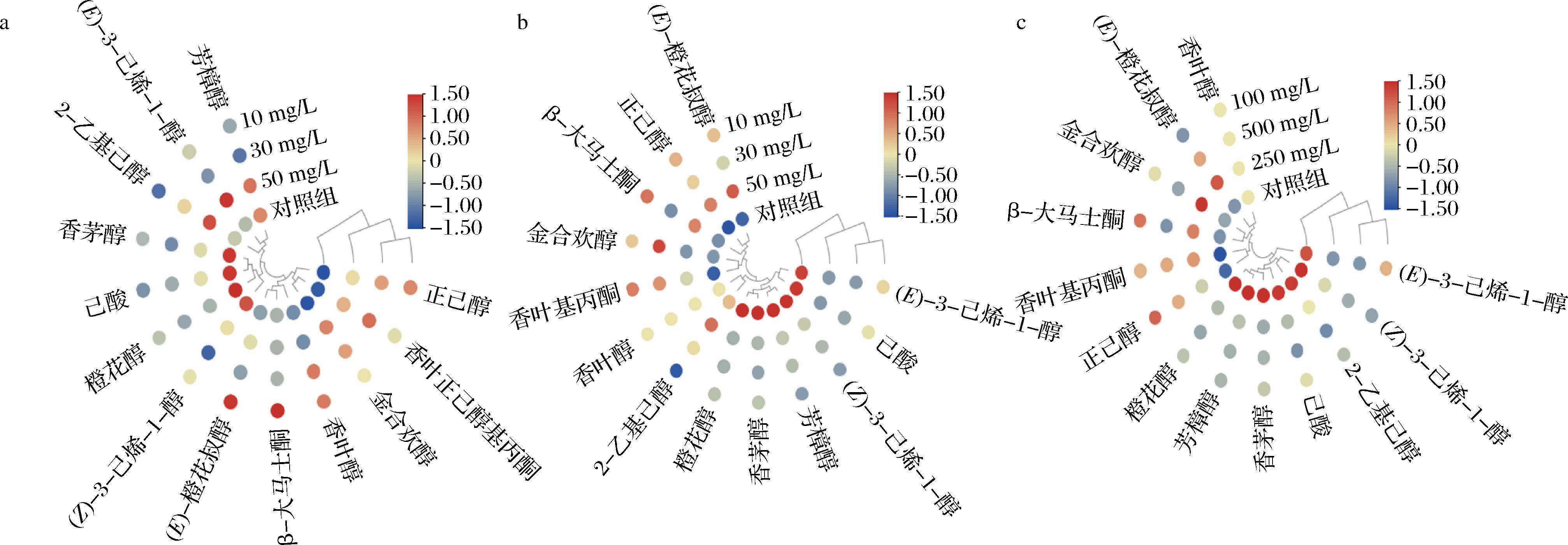
a-高纯度羟基酪醇;b-低纯度羟基酪醇;c-壳寡糖
图4 添加不同抑菌剂苹果酒中的品种香气物质热图
Fig.4 Heatmap of varietal aroma compounds in cider added with different bacteriostatic agents
2.4.3 发酵香气化合物聚类分析
添加羟基酪醇的酒样中共检测到27种酯类物质,包括9种乙酸酯、13种乙基酯和5种其他酯类,其含量均明显高于对照组。主要表现为乙酸乙酯、乙酸异戊酯、辛酸乙酯及癸酸乙酯等物质含量相对增加(图5)(OAV>0.1,表4),这些化合物能够直接或协同影响苹果酒的香气属性。此外,对照组与添加壳寡糖组酒样聚类结果显示,添加250 mg/L和500 mg/L壳寡糖处理的酒样聚为一类,壳寡糖(100 mg/L)酒样单独聚为一类,对照组酒样为第三类。与对照组相比,添加壳寡糖的3种酒样中,乙酸异戊酯、乙酸己酯和辛酸乙酯等物质相对含量较高,但乙酸戊酯和苯乙醇等物质含量较低。
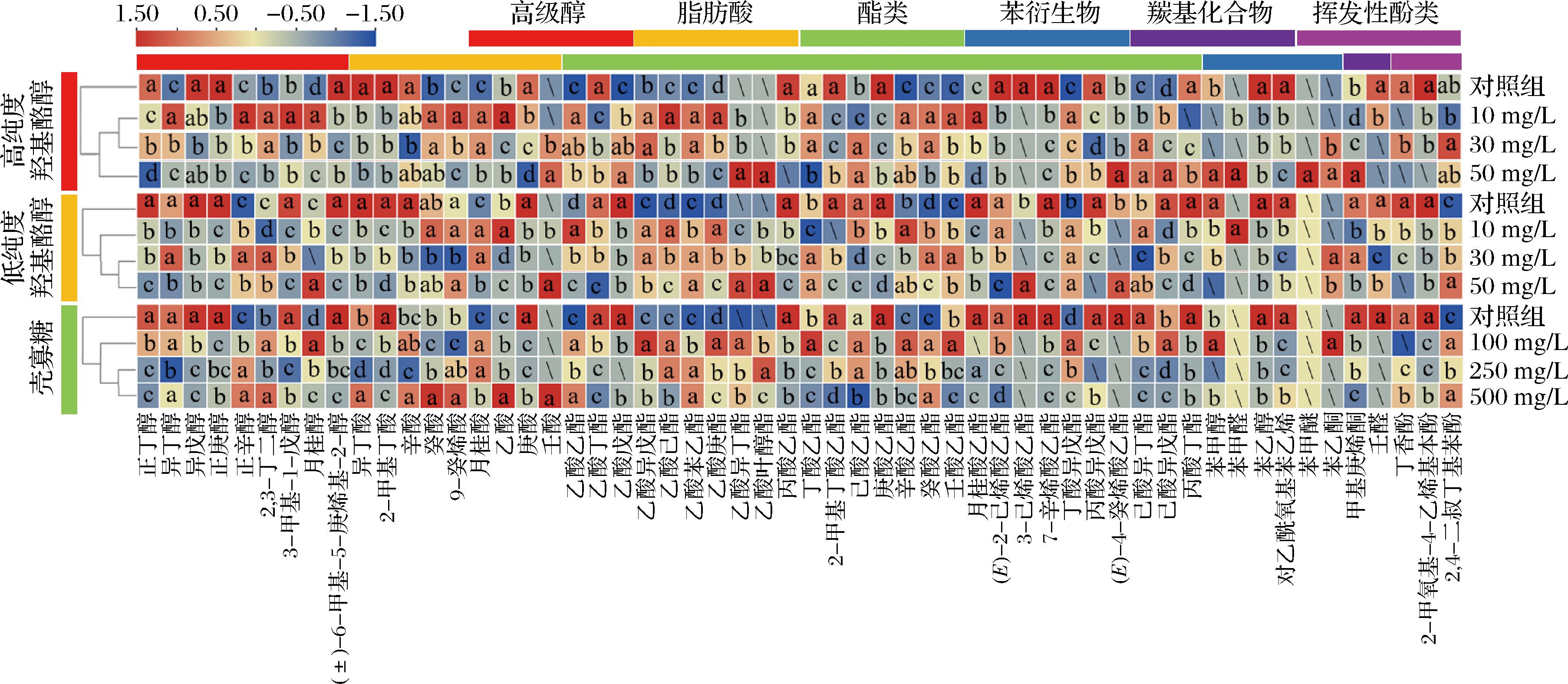
图5 添加不同抑菌剂苹果酒中的发酵香气物质热图
Fig.5 Heatmap of fermentative aroma compounds in cider added with different antibacterial agents
注:图中添加不同抑菌剂处理组同一列中不同字母表示各组差异显著(P<0.05)。
表4 添加高纯度羟基酪醇的苹果酒中OAV>0.1的挥发性香气物质
Table 4 Volatile aroma compounds with OAV>0.1 in cider added with high purity hydroxytyrosol
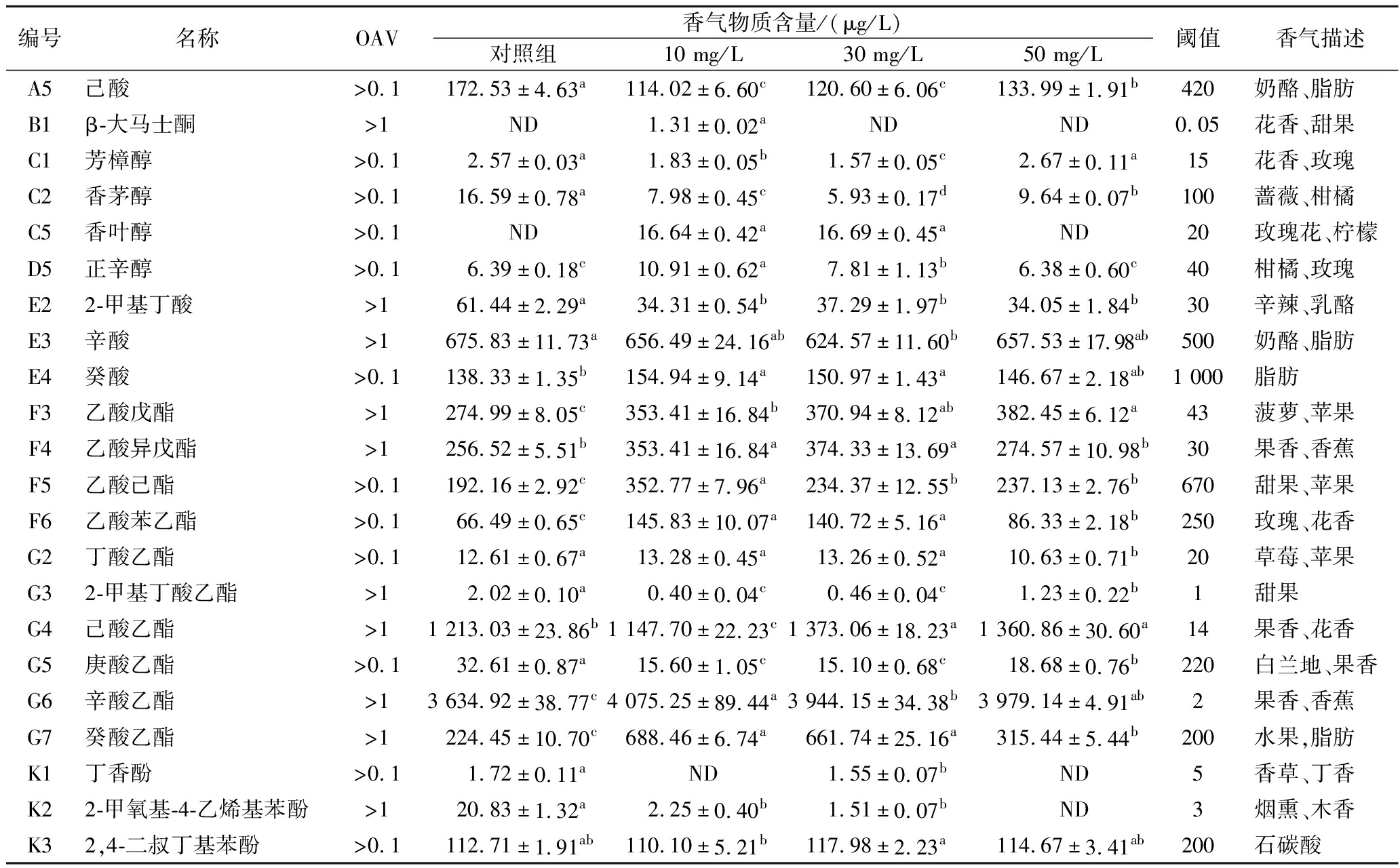
编号名称OAV香气物质含量/(μg/L)对照组10 mg/L30 mg/L50 mg/L阈值香气描述A5己酸>0.1172.53±4.63a114.02±6.60c120.60±6.06c133.99±1.91b420奶酪、脂肪B1β-大马士酮>1ND1.31±0.02aNDND0.05花香、甜果C1芳樟醇>0.12.57±0.03a1.83±0.05b1.57±0.05c2.67±0.11a15花香、玫瑰C2香茅醇>0.116.59±0.78a7.98±0.45c5.93±0.17d9.64±0.07b100蔷薇、柑橘C5香叶醇>0.1ND16.64±0.42a16.69±0.45aND20玫瑰花、柠檬D5正辛醇>0.16.39±0.18c10.91±0.62a7.81±1.13b6.38±0.60c40柑橘、玫瑰E22-甲基丁酸>161.44±2.29a34.31±0.54b37.29±1.97b34.05±1.84b30辛辣、乳酪E3辛酸>1675.83±11.73a656.49±24.16ab624.57±11.60b657.53±17.98ab500奶酪、脂肪E4癸酸>0.1138.33±1.35b154.94±9.14a150.97±1.43a146.67±2.18ab1 000脂肪F3乙酸戊酯>1274.99±8.05c353.41±16.84b370.94±8.12ab382.45±6.12a43菠萝、苹果F4乙酸异戊酯>1256.52±5.51b353.41±16.84a374.33±13.69a274.57±10.98b30果香、香蕉F5乙酸己酯>0.1192.16±2.92c352.77±7.96a234.37±12.55b237.13±2.76b670甜果、苹果F6乙酸苯乙酯>0.166.49±0.65c145.83±10.07a140.72±5.16a86.33±2.18b250玫瑰、花香G2丁酸乙酯>0.112.61±0.67a13.28±0.45a13.26±0.52a10.63±0.71b20草莓、苹果G32-甲基丁酸乙酯>12.02±0.10a0.40±0.04c0.46±0.04c1.23±0.22b1甜果G4己酸乙酯>11 213.03±23.86b1 147.70±22.23c1 373.06±18.23a1 360.86±30.60a14果香、花香G5庚酸乙酯>0.132.61±0.87a15.60±1.05c15.10±0.68c18.68±0.76b220白兰地、果香G6辛酸乙酯>13 634.92±38.77c4 075.25±89.44a3 944.15±34.38b3 979.14±4.91ab2果香、香蕉G7癸酸乙酯>1224.45±10.70c688.46±6.74a661.74±25.16a315.44±5.44b200水果,脂肪K1丁香酚>0.11.72±0.11aND1.55±0.07bND5香草、丁香K22-甲氧基-4-乙烯基苯酚>120.83±1.32a2.25±0.40b1.51±0.07bND3烟熏、木香K32,4-二叔丁基苯酚>0.1112.71±1.91ab110.10±5.21b117.98±2.23a114.67±3.41ab200石碳酸
注:表中同一行数据后的不同字母表示各组差异显著(P<0.05),“ND”表示未检测出该挥发性香气物。
2.4.4 香气化合物主成分分析
对本试验中10个处理组酒样的香气化合物绘制香气种类堆积图见图6-a。其中,添加高纯度羟基酪醇组酒样香气物质含量明显高于其他处理组,主要表现为酯类物质含量较高,这些化合物能够直接或协同影响苹果酒的香气属性。由此进一步选取添加高纯度羟基酪醇发酵酒样和对照组中OAV>0.1的22种化合物(表4)进行主成分分析。由图6-b可知,2个主成分分别占总方差的64.00%和20.60%,二者累计贡献率为84.60%。高纯度羟基酪醇(30 mg/L)和高纯度羟基酪醇(50 mg/L)酒样位于PC2的负半轴,周围分布的化合物较少;对照组酒样位于第二象限,周围分布的物质多为脂肪酸类和高级醇类;高纯度羟基酪醇(10 mg/L)位于第一象限,周围分布的物质最多,主要为乙酸己酯、丁酸乙酯、香叶醇、癸酸乙酯、乙酸苯乙酯和乙酸异戊酯等酯类和C13-降异戊二烯类化合物。
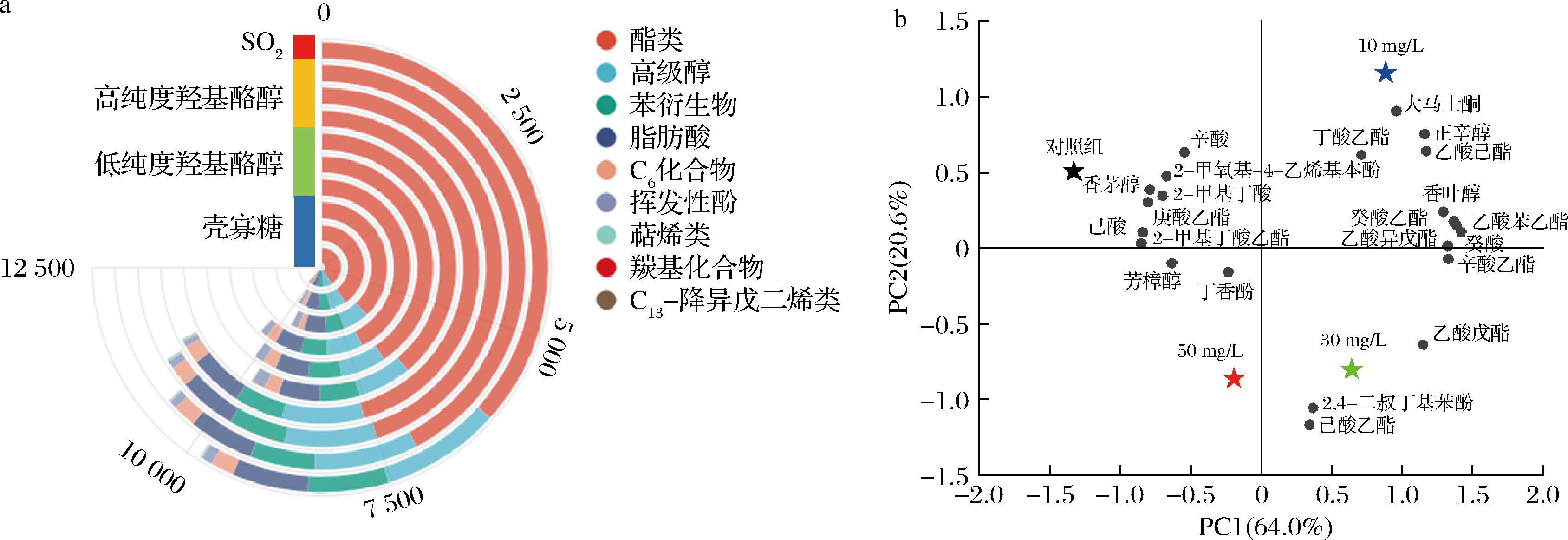
a-挥发性香气物质玉玦图;b-添加高纯度羟基酪醇酒样PCA
图6 添加不同抑菌剂苹果酒中的挥发性香气物质玉玦图及添加高纯度羟基酪醇酒样PCA
Fig.6 Radial bar chart of aroma compounds in cider added with different antimicrobial agents and PCA of cider added with high purity hydroxytyrosol
2.5 添加不同抑菌剂苹果酒的感官评价
将添加不同抑菌剂苹果酒的感官,评价结果换算为数字矩阵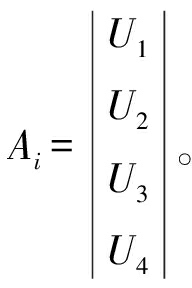 其中以SO2发酵酒样的4个评价指标为例,首先根据酒样的第1个指标外观评价结果(优2人、良2人、差6人),计算各等级评价的比例,即外观
其中以SO2发酵酒样的4个评价指标为例,首先根据酒样的第1个指标外观评价结果(优2人、良2人、差6人),计算各等级评价的比例,即外观![]() 同理,香气
同理,香气![]() 滋味
滋味![]() 典型性
典型性![]()
i为样品编号,i=1,2,3,4,5,6,7,8,9,10,即有:
模糊矩阵

根据调查结果权重集![]() 以评价结果为Y,计算各样品的评价结果。
以评价结果为Y,计算各样品的评价结果。
 同理苹果酒模糊数学感官综合评分,根据公式Bi=W×Yi计算。以B1为例,Y1为
同理苹果酒模糊数学感官综合评分,根据公式Bi=W×Yi计算。以B1为例,Y1为![]() 为
为![]() 两者相乘,即得
两者相乘,即得 4.023 4;同理B2=7.307 9;B3=7.166 1;B4=7.293 1;B5=6.678 2;B6=6.820 4;B7=6.737 9;B8=6.800 0;B9=6.575 3;B10=6.232 4。通过计算可知,供试酒样感官评分从高到低依次是高纯度羟基酪醇(≥98%)>低纯度羟基酪醇(≥20%)>壳寡糖(≥90%)>SO2,特别是添加高纯度羟基酪醇(10 mg/L)酒样澄清透明、果香浓郁且香气协调,模糊数学感官评分最高(7.307 9分),与主成分分析显示添加10 mg/L高纯度羟基酪醇发酵酒样中香叶醇、乙酸己酯、辛酸乙酯和癸酸乙酯等物质含量较高相一致。由此表明,在酒精发酵前添加10 mg/L高纯度羟基酪醇(≥98%)具有替代SO2发酵的应用潜力。
4.023 4;同理B2=7.307 9;B3=7.166 1;B4=7.293 1;B5=6.678 2;B6=6.820 4;B7=6.737 9;B8=6.800 0;B9=6.575 3;B10=6.232 4。通过计算可知,供试酒样感官评分从高到低依次是高纯度羟基酪醇(≥98%)>低纯度羟基酪醇(≥20%)>壳寡糖(≥90%)>SO2,特别是添加高纯度羟基酪醇(10 mg/L)酒样澄清透明、果香浓郁且香气协调,模糊数学感官评分最高(7.307 9分),与主成分分析显示添加10 mg/L高纯度羟基酪醇发酵酒样中香叶醇、乙酸己酯、辛酸乙酯和癸酸乙酯等物质含量较高相一致。由此表明,在酒精发酵前添加10 mg/L高纯度羟基酪醇(≥98%)具有替代SO2发酵的应用潜力。
3 讨论
苹果酒酒精发酵过程中,还原糖消耗速度与发酵环境中的微生物生长和代谢活力有关[27]。本研究添加高纯度羟基酪醇和壳寡糖的酒样中S.cerevisiae生长速度较慢,酒样发酵时间相对于对照组延长了2 d,但还原糖含量均<4 g/L,这与RAPOSO等[17]和郝振铭等[18]的研究结果一致。此外,羟基酪醇的纯度对S.cerevisiae的生长增殖影响也存在差异[17,28]。
添加羟基酪醇和壳寡糖发酵酒样的酒精度和总酚含量均低于对照组,其中添加高纯度羟基酪醇发酵酒样显著高于添加低纯度羟基酪醇,且添加质量浓度越大,酚类物质含量越高,这与高纯度羟基酪醇可以抑制酚类转换为醌类物质有关[17,28]。上述基本理化指标变化规律与MART NEZ等[29]在迷思贵亚白葡萄酒中使用胶体银络合物代替SO2后,酒样的酒精度、总酸、挥发酸以及有机酸含量均与SO2组差异不显著的结果不一致,可归因于实验原料和抑菌剂种类不同所致。
NEZ等[29]在迷思贵亚白葡萄酒中使用胶体银络合物代替SO2后,酒样的酒精度、总酸、挥发酸以及有机酸含量均与SO2组差异不显著的结果不一致,可归因于实验原料和抑菌剂种类不同所致。
颜色是评价果酒的重要直观感官指标之一。酿造工艺和后期储藏过程中一系列氧化反应都会造成苹果酒颜色变化[24]。本研究中添加羟基酪醇和壳寡糖均可以提高苹果酒的黄蓝色调并降低其红绿色调。RAPOSO等[17,28]的研究表明,羟基酪醇可以加深葡萄酒的颜色,且其纯度越高、质量浓度越大,色泽加深越明显,与本文的研究结果一致。郝振铭等[18]将添加500 mg/L壳寡糖和添加100 mg/L SO2的葡萄酒色泽对比发现,添加壳寡糖并不会引起酒体颜色变化,这与本文结果不符,可能与壳寡糖处理组苹果酒中酚类物质含量和种类的差异有关。
香气是决定果酒感官属性和消费者选择意愿的核心指标[30]。抑菌剂对果酒香气品质的影响不仅基于抑菌物质自身的物理性质,其对酵母细胞的化学作用也会调节酒精发酵过程中氨基酸和脂肪酸等香气前体成分的生物转化[31]。已有研究表明,羟基酪醇对提升葡萄酒中香气物质含量具有积极影响[17,28],而壳寡糖对葡萄酒的香气物质含量影响较小[18]。本研究中添加羟基酪醇发酵的酒样品种香气物质总量与对照组相比均有所提高,且羟基酪醇纯度越高影响越大;但添加质量浓度对品种香气物质总量的影响较小。添加壳寡糖发酵的酒样中品种香气物质含量随着添加质量浓度增加其含量明显降低,表明其与壳寡糖的吸附能力总水平密切相关[32]。此外,SO2可以与细胞表面带负电的离子相互作用,改变细胞的渗透性,从而使己酸含量增加[32],与本研究结果一致。
高级醇主要由酵母细胞的氨基酸分解和糖代谢途径产生[33]。本实验选取的抑菌剂对酒样中高级醇含量均明显低于对照组。这一方面与对照组酒样中异丁醇和3-甲基-1-丁醇的含量较高有关,因为SO2的存在有利于发酵过程中缬氨酸和亮氨酸的快速转化[32]。另一方面也与添加羟基酪醇和壳寡糖发酵的酒样中部分高级醇转化为乙酸异戊酯和乙酸己酯等密切相关[32]。各处理组中酯类物质含量均明显高于对照组,尤其是添加羟基酪醇处理的酒样中乙酸酯含量明显高于壳寡糖组,且羟基酪醇纯度越大、质量浓度越小,其含量越高;而壳寡糖组表现为添加质量浓度越小,乙酸酯含量越高。此外,不同处理组之间的中链脂肪酸乙酯(己酸乙酯、辛酸乙酯和癸酸乙酯)含量存在明显差异,这与它们的合成底物中链脂肪酸(己酸、辛酸和癸酸)含量相关[32]。
4 结论
本试验结果表明,外源羟基酪醇或壳寡糖替代SO2作为抑菌剂时均可完成低醇苹果酒酒精发酵,酒样基本理化指标均符合国标相关规定,但添加高纯度羟基酪醇(≥98%)和壳寡糖会减缓酿酒酵母生长、延长酒精发酵周期。此外,添加不同质量浓度羟基酪醇或壳寡糖均会提高苹果酒的色度及CIELab参数、降低色调。
酒精发酵前添加高纯度羟基酪醇能够增加低醇苹果酒中香叶醇、乙酸戊酯、辛酸乙酯和癸酸乙酯等花香和果香类挥发性香气物质的含量,降低己酸、异戊醇和辛酸等具有脂肪味和刺激味物质含量,酒体感官评分最高。综合分析,在酒精发酵前添加10 mg/L纯度≥98%的羟基酪醇虽然会相对延长苹果酒酒精发酵时间,但酒体澄清透明、色泽更饱满,香气物质含量更丰富,具有良好的酿造应用潜力。
[1] 陈青, 殷程凯, 郭自良, 等.基于改进YOLOv7的苹果生长状态及姿态识别[J].农业工程学报, 2024, 40(6):258-266.CHEN Q, YIN C K, GUO Z L, et al.Apple growth status and posture recognition using improved YOLOv7[J].Transactions of the Chinese Society of Agricultural Engineering, 2024, 40(6):258-266.
[2] 彭彦昆, 孙晨, 刘乐, 等.苹果外部缺陷全表面在线检测分选装置研发[J].农业工程学报, 2022, 38(23):266-275.PENG Y K, SUN C, LIU L, et al.Development of full-surface online detection and sorting device for external defects of apples[J].Transactions of the Chinese Society of Agricultural Engineering, 2022, 38(23):266-275.
[3] 杨超, 肖媚, 张菡, 等.苹果酒发酵过程中绿原酸胁迫对酿酒酵母生理特性的影响[J].中国食品学报, 2022, 22(1):116-124.YANG C, XIAO M, ZHANG H, et al.Effects of chlorogenic acid stress on the physiological characteristics of Saccharomyces cerevisiae during the fermentation of cider[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(1):116-124.
[4] ESPARZA I, MART NEZ-INDA B, CIMMINELLI M J, et al.Reducing SO2 doses in red wines by using grape stem extracts as antioxidants[J].Biomolecules, 2020, 10(10):1369.
NEZ-INDA B, CIMMINELLI M J, et al.Reducing SO2 doses in red wines by using grape stem extracts as antioxidants[J].Biomolecules, 2020, 10(10):1369.
[5] 魏广芬, 李梦递, 赵捷, 等.基于DFI-RSE电子鼻传感器阵列优化的葡萄酒SO2检测[J].农业工程学报, 2022, 38(7):291-299.WEI G F, LI M D, ZHAO J, et al.Determination of SO2 in wine based on DFI-RSE electronic nose sensor array optimization[J].Transactions of the Chinese Society of Agricultural Engineering, 2022, 38(7):291-299.
[6] 陈晓姣, 刁体伟, 赖晓琴, 等.不同酿造阶段添加富含谷胱甘肽酵母衍生物对梨酒品质的影响[J].食品科学, 2023, 44(6):134-142.CHEN X J, DIAO T W, LAI X Q, et al.Effect of addition of glutathione-enriched inactive dry yeast at different stages of brewing on the quality of pear wine[J].Food Science, 2023, 44(6):134-142.
[7] 冯帆, 姜醒睿, 王凌云, 等.没食子酸稳定‘户太八号’桃红葡萄酒香气与色泽[J].中国农业科学, 2024, 57(8):1592-1605.FENG F, JIANG X R, WANG L Y, et al.The stabilization of aroma and color during Hutai-8 rose winemaking by gallic acid treatment[J].Scientia Agricultura Sinica, 2024, 57(8):1592-1605.
[8] NEHMÉ L, EL TEKLE M, BARAKAT N, et al.Alternative processes for apple juice stabilization and clarification:A bibliometric and comprehensive review[J].Processes, 2024, 12(2):296.
[9] YANG H, WANG S, CHEN M, et al.The Saccharomyces cerevisiae through increasing the expression of membrane transporter to produce more GSH inhibit the browning of pear wine[J].Food Bioscience, 2024, 58:103689.
[10] 马雷. 天然抑菌剂在葡萄酒酿造中的应用[D].大连:大连工业大学, 2017.MA L.Application of natural antimicrobial agents in wine brewing[D].Dalian:Dalian Polytechnic University, 2017.
[11] MOTA C J A.Green routes to dimethyl carbonate:A green and versatile methylating reactant[J].Current Organic Chemistry, 2024, 28(14):1069-1078.
[12] NADERI-SAMANI E, RAZAVI R S, NEKOUEE K, et al.Synthesis of silver nanoparticles for use in conductive inks by chemical reduction method[J].Heliyon, 2023, 9(10):e20548.
[13] DOM NGUEZ-PERLES R, AU
NGUEZ-PERLES R, AU
 N D, FERRERES F, et al.Physiological linkage of gender, bioavailable hydroxytyrosol derivatives, and their metabolites with systemic catecholamine metabolism[J].Food &Function, 2017, 8(12):4570-4581.
N D, FERRERES F, et al.Physiological linkage of gender, bioavailable hydroxytyrosol derivatives, and their metabolites with systemic catecholamine metabolism[J].Food &Function, 2017, 8(12):4570-4581.
[14] TERRACINA S, PETRELLA C, FRANCATI S, et al.Antioxidant intervention to improve cognition in the aging brain:The example of hydroxytyrosol and resveratrol[J].International Journal of Molecular Sciences, 2022, 23(24):15674.
[15] NOGUERA-NAVARRO C, MONTORO-GARC A S, ORENES-PI
A S, ORENES-PI ERO E.Hydroxytyrosol:Its role in the prevention of cardiovascular diseases[J].Heliyon, 2023, 9(1):e12963.
ERO E.Hydroxytyrosol:Its role in the prevention of cardiovascular diseases[J].Heliyon, 2023, 9(1):e12963.
[16] 李春燕. 油橄榄叶中羟基酪醇的提取及橄榄酒的研制[D].成都:西华大学, 2014.LI C Y.Research on hydroxytyrosol extraction form olive leaves and olive wine brewing[D].Chengdu:Xihua University, 2014.
[17] RAPOSO R, RUIZ-MORENO M J, GARDE-CERD N T, et al.Effect of hydroxytyrosol on quality of sulfur dioxide-free red wine[J].Food Chemistry, 2016, 192:25-33.
N T, et al.Effect of hydroxytyrosol on quality of sulfur dioxide-free red wine[J].Food Chemistry, 2016, 192:25-33.
[18] 郝振铭, 孙珍.壳寡糖对葡萄酒的抗氧化和抑菌作用[J].现代食品科技, 2019, 35(12):216-224;60.HAO Z M, SUN Z.Antioxidant and antibacterial effects of wine added with chitooligosaccharide[J].Modern Food Science &Technology, 2019, 35(12):216-224;60.
[19] 刁体伟, 陈晓姣, 赖晓琴.壳聚糖及其衍生物在果酒中应用的研究进展[J].食品工业科技, 2022, 43(6):467-473.DIAO T W, CHEN X J, LAI X Q.Research progress on application of chitosan and its derivatives in fruit wine[J].Science and Technology of Food Industry, 2022, 43(6):467-473.
[20] 吴霞, 孟掉琴, 岳田利, 等.血脂干预型复合苹果汁果实品种筛选与果汁品质评价[J].中国食品学报, 2020, 20(8):286-294.WU X, MENG D Q, YUE T L, et al.Variety screening and fruit juice quality evaluation of lipid-interfered compound apple juice[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(8):286-294.
[21] 周得刚, 徐彬艳, 王青霞, 等.戴尔有孢圆酵母与酿酒酵母细胞间接触对‘赤霞珠’葡萄酒风味品质的影响[J].中国农业科学, 2024, 57(16):3264-3282.ZHOU D G, XU B Y, WANG Q X, et al.Effects of cell-to-cell contact between Torulaspora delbrueckii and Saccharomyces cerevisiae on the flavor and quality of Cabernet Sauvignon wine[J].Scientia Agricultura Sinica, 2024, 57(16):3264-3282.
[22] LIANG Z J, ZHANG P Z, MA W, et al.Physicochemical properties, antioxidant activities and comprehensive phenolic profiles of tea-macerated Chardonnay wine and model wine[J].Food Chemistry, 2024, 436:137748.
[23] 袁倩, 李嘉欣, 柳秉红, 等.不同酵母多糖添加条件下早酥梨-美乐低醇复合果酒品质研究[J].农业机械学报, 2024, 55(5):419-430.YUAN Q, LI J X, LIU B H, et al.Quality of low-alcohol Zaosu pear-merlot wine under different yeast polysaccharide addition conditions[J].Transactions of the Chinese Society for Agricultural Machinery, 2024, 55(5):419-430.
[24] 藏伟, 刘叶, 刘宇, 等.本土季也蒙毕赤酵母在干红葡萄酒中试生产中的应用潜力[J].食品科学, 2023, 44(18):117-125.ZANG W, LIU Y, LIU Y, et al.Application potential of native Meyerozyma guilliermondii in pilot production of dry red wine[J].Food Science, 2023, 44(18):117-125.
[25] 祝霞, 赵丹丹, 李俊娥, 等.河西走廊产区酒球菌酯酶活性对葡萄酒酯类香气物质的影响[J].农业工程学报, 2021, 37(1):315-322.ZHU X, ZHAO D D, LI J E, et al.Effects of esterase activity of alcoholicus in Hexi Corridor production areas on ester aroma compounds in wine[J].Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(1):315-322.
[26] YANG H, SUN J Y, TIAN T T, et al.Physicochemical characterization and quality of Dangshan pear wines fermented with different Saccharomyces cerevisiae[J].Journal of Food Biochemistry, 2019, 43(8):e12891.
[27] HAO Z M, ZHANG Y R, SUN Z, et al.Chitooligosaccharide as a possible replacement for sulfur dioxide in winemaking[J].Applied Sciences, 2020, 10(2):578.
[28] RAPOSO R, RUIZ-MORENO M J, GARDE-CERD N T, et al.Replacement of sulfur dioxide by hydroxytyrosol in white wine:Influence on both quality parameters and sensory[J].LWT, 2016, 65:214-221.
N T, et al.Replacement of sulfur dioxide by hydroxytyrosol in white wine:Influence on both quality parameters and sensory[J].LWT, 2016, 65:214-221.
[29] MART NEZ J A, MELGOSA M, PÉREZ M M, et al.Note.visual and instrumental color evaluation in red wines[J].Food Science and Technology International, 2001, 7(5):439-444.
NEZ J A, MELGOSA M, PÉREZ M M, et al.Note.visual and instrumental color evaluation in red wines[J].Food Science and Technology International, 2001, 7(5):439-444.
[30] 陈鑫龙, 张媛媛, 徐令斌, 等.用多酚类指标表征干红葡萄酒味感质量的模型构建[J].农业工程学报, 2024, 40(8):281-289.CHEN X L, ZHANG Y Y, XU L B, et al.Model construction for characterizing the flavor quality of dry red wine based on polyphenolic indexes[J].Transactions of the Chinese Society of Agricultural Engineering, 2024, 40(8):281-289.
[31] ZHAI X C, FENG Y X, ZHAO R J, et al.Nisin as a safe and effective alternative to sulfur dioxide in enhancing dateplum persimmon (Diospyros lotus L.) wine quality[J].LWT, 2024, 193:115774.
[32] CASTRO-MAR N A, BUGLIA A G, RIPONI C, et al.Volatile and fixed composition of sulphite-free white wines obtained after fermentation in the presence of chitosan[J].LWT, 2018, 93:174-180.
N A, BUGLIA A G, RIPONI C, et al.Volatile and fixed composition of sulphite-free white wines obtained after fermentation in the presence of chitosan[J].LWT, 2018, 93:174-180.
[33] JIANG X H, LU Y Y, LIU S Q.Effects of pectinase treatment on the physicochemical and oenological properties of red dragon fruit wine fermented with Torulaspora delbrueckii[J].LWT, 2020, 132:109929.