葡萄酒根据颜色可分为红、白和桃红葡萄酒,白葡萄酒通常使用白葡萄或者浅色葡萄经过榨汁澄清后,在低温条件下发酵而成[1]。霞多丽作为世界上著名的白色酿酒葡萄品种之一,其历史久远、分布广泛,在贺兰山东麓产区有广泛的种植[2]。目前葡萄酒厂普遍采用商业酵母进行酿造,虽可以保证产品质量的稳定性以及酿造过程的可控性[3],但会导致葡萄酒口感、香气方面没有典型性和复杂性,同质化现象严重[4]。为解决这一问题,本土酿酒酵母受到越来越多的关注,通过筛选适应本地自然环境和葡萄品种的野生本土酵母来酿造葡萄酒,使葡萄酒的香气质量和口感品质得到提升[5]。事实上,本土酿酒酵母可以更好地适应当地气候和酿酒环境,为葡萄酒提供独特的风土特性[6]。
许多研究表明,本土酿酒酵母可以高产酯类、醇类等香气化合物,且产量优于商业酵母,能显著提升葡萄酒中的花香和果香[7]。程仕伟等[8]等将筛选自新疆的3株本土酿酒酵母进行霞多丽葡萄酒的酿造,发现本土酿酒酵母XXF3菌株酿造酒样中苯乙醇含量是商业酿酒酵母RHST的7倍多,增加了葡萄酒中的玫瑰花香。CHEN等[9]发现,与商业菌株TXL相比,本土酿酒酵母NX16和NX18在增加果香、花香这类芳香酯生成方面具有很大优势。VARELA等[10]发现本土酿酒酵母自然发酵的霞多丽葡萄酒在挥发性香气化合物方面表现出高度的复杂性和多样性,其中较高浓度的2-甲基丙醇(杂醇油、烈酒香气)、2-甲基丁酸(奶酪、汗渍气味)、2-甲基丙酸乙酯(果香)、癸酸乙酯(油脂、坚果香气)和十二酸乙酯(皂香、酯香)在感官上起着重要的作用。CHEN等[11]发现相比商业酵母,宁夏当地本土酿酒酵母可以通过释放果味酯(如丁酸乙酯、乳酸乙酯、异戊酸乙酯和癸酸乙酯)为霞多丽葡萄酒提供更积极的香气属性。
贺兰山东麓葡萄酒产区因独特的地理自然条件,成为世界公认的优质葡萄酒产区,也因此孕育了丰富的微生物资源。虽然已有很多宁夏本土酵母相关研究,但相较于产区巨大的微生物多样性潜力,大量具有潜在应用价值的菌种资源仍有待深入挖掘,并且关于酿造霞多丽白葡萄酒的本土酵母筛选研究仍存在不足,本土酵母塑造具有产区风土特色霞多丽葡萄酒相关研究也亟待深入。因此,本研究使用宁夏贺兰山东麓产区分离的4株本土酿酒酵母(YQY-E18、QTX-D17、QTX-D7、YC-E8)酿造霞多丽葡萄酒,并以3株商业酵母(CEC01、F33、XR)作为对照组,对酿造的葡萄酒进行理化指标测定、感官分析以及挥发性成分的测定,以期获得适合酿造霞多丽葡萄酒的优良本土酿酒酵母菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
霞多丽葡萄于2023年8月31日采收自宁夏青铜峡市雅岱酒庄,葡萄原料总糖为207.15 g/L,pH值为3.65,总酸为5.2 g/L。
1.1.2 菌株与培养基
本土酿酒酵母:YC-E8、QTX-D7、QTX-D17、YQY-E18,分离自贺兰山东麓产区;商业酿酒酵母:F33(LAFFORT公司)、XR(诺盟公司)、CEC01(安琪酵母股份有限公司)。实验所用的7株酿酒酵母均保存于-80 ℃冰箱。
YPD液体培养基:蛋白胨20.0 g,酵母浸粉10.0 g,葡萄糖20.0 g;溶解于1 L蒸馏水中,121 ℃高压灭菌15 min。固体培养基添加20 g琼脂。
WL固体培养基,青岛海博生物技术有限公司。
1.1.3 试剂
0.1 mol/L柠檬酸钠缓冲液:称取29.0 g柠檬酸钠,用蒸馏水定容至1 L。
柠檬酸钠、偏重亚硫酸钾、果胶酶、NaCl、NaOH、葡萄糖、没食子酸、次甲基蓝、CuSO4等均为分析纯。
1.2 仪器与设备
TU-1901紫外可见分光光度计,北京普析公司;Y15全自动葡萄酒分析仪,Biosystems公司;PHS-3C型pH计,上海仪电科学仪器股份有限公司;7890 B气相色谱-7000 D质谱仪、DB-Wax色谱柱(60 m×250 μm, 0.25 μm),美国Agilent公司。
1.3 实验方法
1.3.1 发酵实验
1.3.1.1 菌种活化
将实验室保藏的本土酿酒酵母菌株和商业酿酒酵母菌株放在4 ℃冰箱内解冻,蘸取少量菌液在WL平板上划线,28 ℃条件下静置培养4~5 d,挑取少量单菌落在YPD固体平板上划线,28 ℃静置培养3 d。挑取完整单个菌落置于YPD液体培养基中,28 ℃、180 r/min振荡培养10 h后,25 ℃、5 000 r/min 离心5 min,倒掉上清液,使用柠檬酸钠缓冲溶液洗涤2~3次。
1.3.1.2 葡萄酒发酵实验
将采收的霞多丽葡萄果实除梗破碎,偏重亚硫酸钾按80 mg/L添加,在破碎的同时加入总量一半的偏重亚硫酸钾,防止氧化。压榨出汁时加入剩余的偏重亚硫酸钾,间隔10 min左右,加入30 mg/L的果胶酶。8~11 ℃低温静置澄清24 h。取上层澄清汁分装进5 L玻璃罐中,装液量4 L。回温至15 ℃,将活化的7株酿酒酵母以1×106 CFU/mL接种量分别接种于葡萄汁中,控制发酵温度15~18 ℃,每个菌株设置3个平行重复。发酵过程中全程监测比重变化,待发酵液比重为0.992~0.996时视为发酵结束,加入60 mg/L的偏重亚硫酸钾终止发酵。将酒样放置在干燥低温的环境,澄清3周左右,取样进行理化指标测定、感官分析和挥发性化合物测定。
1.3.2 理化指标测定
1.3.2.1 基础理化指标
参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定酒精度;使用全自动分析仪测定总糖、总酸(g/L,以酒石酸计)、挥发酸(g/L,以乙酸计)、游离SO2、总SO2和甘油;pH使用pH计测定。
1.3.2.2 总酚含量测定
采用Folin-Ciocalteau法测定总酚含量[12],将葡萄酒样品稀释20倍,Folin-Ciocalteau试剂稀释10倍,配制7.5%(质量分数)的Na2CO3(显色作用)。在96孔板中依次加入100 μL Folin-Ciocalteau试剂,20 μL酒样,80 μL Na2CO3,摇匀后暗处静置,在30 min之后,760 nm波长下测吸光值,平行测定8次,舍弃最大值和最小值。
标准曲线建立:将20 μL酒样替换为20 μL 0.004 685 5、0.009 371 5、0.018 75、0.037 5、0.075、0.15、0.3 g/L的没食子酸溶液,得到标准曲线方程y=2.259x-0.000 2,回归系数R2为0.999 7。
1.3.2.3 色度色调的测定
将葡萄酒样品用0.45 μm滤膜过滤,加入到1 mL比色皿中,分别在620、520、420 nm处测定吸光值,色度为3个波长的吸光度值之和,色调为420 nm处与520 nm处吸光值之比[12]。
1.3.3 感官分析
选择具有专业知识和品鉴经验的人员共18人进行感官分析,在本学院的品酒室进行。在感官评价实行10分制,包括颜色、澄清度、香气浓郁度、香气复杂度、香气协调性、口感香气浓郁度、酸甜平衡度、余味以及整体性。葡萄酒香气描述实行5分制,包括花香、绿色水果香、热带水果香、核果类香、柑橘类香、草本味、香辛料味、坚果类香以及不良风味[13-14]。感官分析结果为所有成员评分的平均值,绘制雷达图。
1.3.4 挥发性化合物测定
采用顶空固相微萃取-气相色谱-质谱技术对葡萄酒香气成分进行测定,方法参照李伟等[15]的研究。将5 mL葡萄酒样品、1.5 g NaCl和10 μL内标4-甲基-2-戊醇(1 g/L)依次加入顶空瓶,之后放置于自动进样器上启动检测。
色谱条件:进样口温度230 ℃。升温程序:起始柱温50 ℃,恒温1 min,以3 ℃/min升到220 ℃,保持5 min。载气:高纯氦气(纯度≥99.999%),流速1 mL/min,不分流进样。质谱条件:传输线温度235 ℃,离子源温度230 ℃,电子能量70 eV。质量扫描范围m/z 29~350。将质谱图通过NIST检索,根据C8~C20烷烃混合标准品的保留时间进行定性分析。使用标准曲线对香气成分定量分析并对其香气活度值(odor activity value,OAV)进行计算。
1.4 数据分析
使用Microsoft Office 2019软件进行数据统计,SPSS软件中单因素ANOVA检验对数据进行显著性分析,Origin 2021软件进行折线图、柱状图、热图和雷达图的绘制。
2 结果与分析
2.1 葡萄酒发酵过程中比重变化
目前,葡萄酒生产中普遍使用比重作为检测发酵进程的指标[16]。由图1可知,7株酿酒酵母发酵的酒样从比重1.086左右到0.992发酵结束用时8 d。在发酵期间,前3 d所有菌株发酵酒样比重缓慢降低,说明酒精发酵开始启动;3~6 d比重下降增快,说明发酵速率加快;6 d后比重变化缓慢,直至0.992发酵结束。4株本土酿酒酵母与商业酵母相比,比重下降变化差异不明显,说明这4株本土酿酒酵母的发酵性能良好。
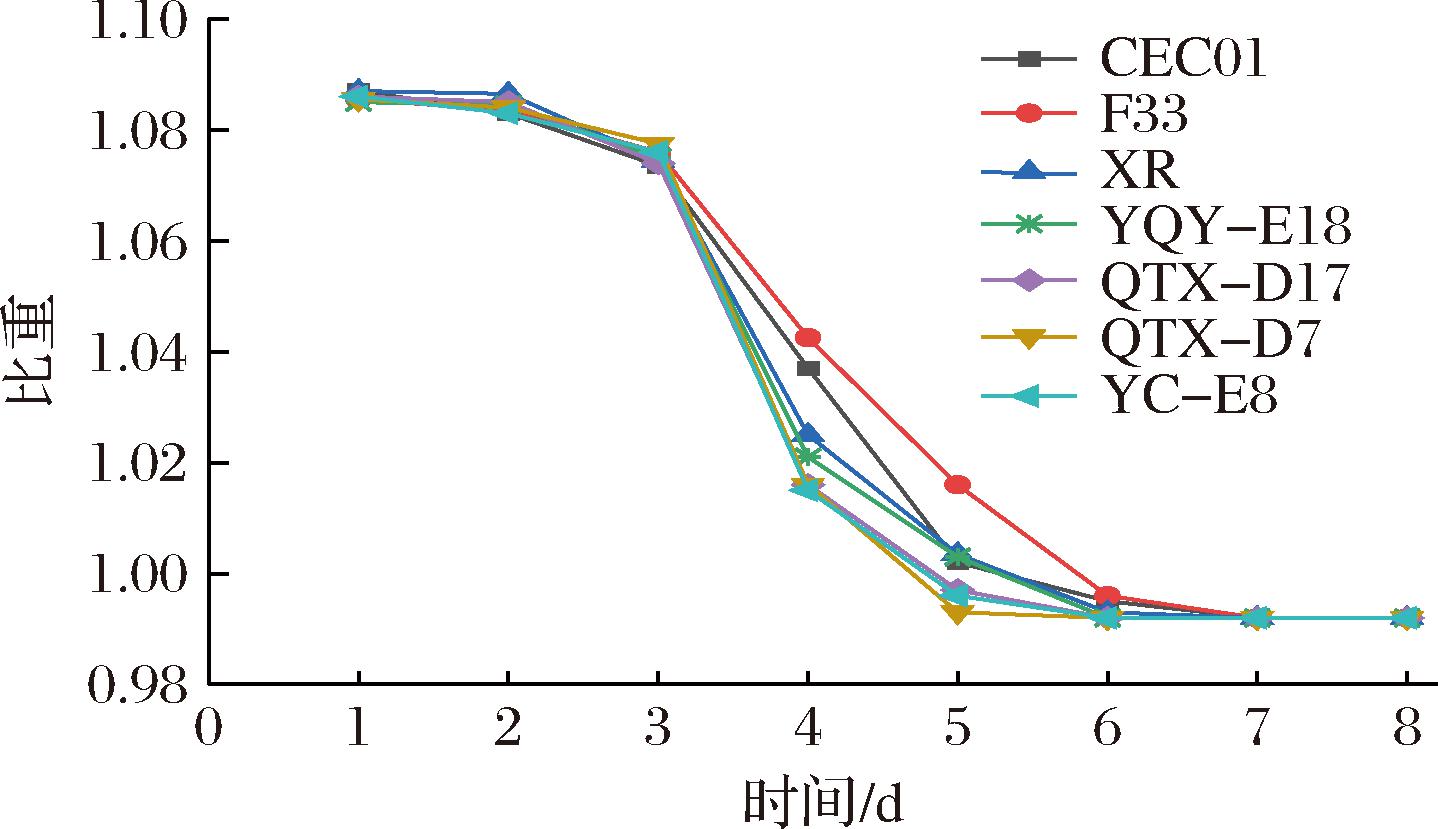
图1 不同菌株发酵霞多丽葡萄酒过程中比重的变化
Fig.1 Changes in specific gravity during fermentation of Chardonnay wines by different yeast strains
2.2 葡萄酒基本理化指标
挥发酸是微生物自身代谢所产生的副产物之一,根据GB/T 15037—2006《葡萄酒》要求,葡萄酒挥发酸不能高于1.2 g/L,而当挥发酸含量超过0.8 g/L时,葡萄酒会呈现醋味[4]。由表1可以看出,所有酒样的挥发酸含量均符合国标要求。而适量的挥发酸会增加葡萄酒的香气[17],实验中发现本土酿酒酵母YC-E8、QTX-D17发酵酒样的挥发酸含量高于商业酵母F33与XR,可能这2株本土酿酒酵母发酵酒样的香气会优于商业酵母。另外,4株本土酿酒酵母发酵酒样的总酸值差异不显著,且与商业酵母CEC01、F33差异不显著。所有酒样的游离SO2含量在7.74~9.28 mg/L,差异不显著。酿酒酵母F33发酵酒样的总SO2含量最低,与其他6个酒样差异显著,酒样XR的总SO2含量最高,其次为酿酒酵母CEC01和4株本土酿酒酵母。本土酿酒酵母YQY-E18发酵酒样的残糖含量是4株本土酵母中最高的,为7.75 g/L,与商业酵母CEC01相同,且高于其余2株商业酵母,在4株本土酵母中YC-E8的残糖含量最低,为5.63 g/L。商业酵母XR的酒精度最高,为11.65%vol,其次是本土酵母YQY-E18,其余的3株本土酵母都略高于另2株商业酵母,所有酒样酒精度差异不显著。所有酒样总酚含量相对较低,且差异不显著,这与葡萄品种有关,因为霞多丽葡萄是皮中酚类物质含量较低的白葡萄,而白葡萄酒的发酵是采用清葡萄汁进行酒精发酵的去皮发酵法,没有红葡萄酒浸渍阶段[18]。甘油是乙醇发酵中最主要的副产物之一,它能够平衡酒体中的酸感,抑制不愉快的气味,葡萄酒中甘油含量一般在4~15 g/L[19]。本实验中的本土酿酒酵母和商业酿酒酵母发酵酒样的甘油含量为5.03~5.2 g/L,差异不显著。
表1 不同酿酒酵母发酵霞多丽葡萄酒样品的基本理化指标
Table 1 Physicochemical parameters of Chardonnay wine samples fermented by different yeast strains
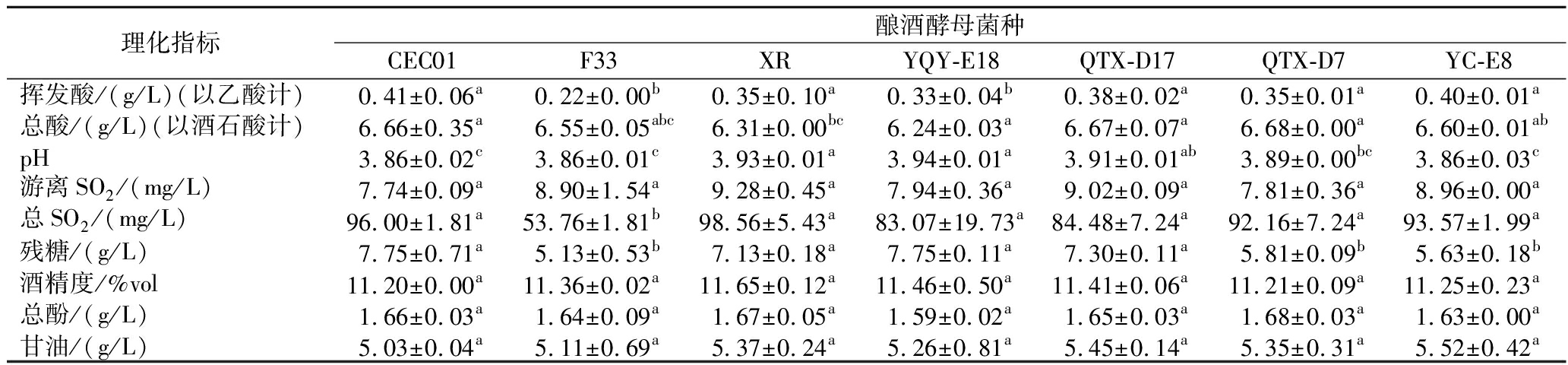
理化指标酿酒酵母菌种CEC01F33XRYQY-E18QTX-D17QTX-D7YC-E8挥发酸/(g/L)(以乙酸计)0.41±0.06a0.22±0.00b0.35±0.10a0.33±0.04b0.38±0.02a0.35±0.01a0.40±0.01a总酸/(g/L)(以酒石酸计)6.66±0.35a6.55±0.05abc6.31±0.00bc6.24±0.03a6.67±0.07a6.68±0.00a6.60±0.01abpH3.86±0.02c3.86±0.01c3.93±0.01a3.94±0.01a3.91±0.01ab3.89±0.00bc3.86±0.03c游离SO2/(mg/L)7.74±0.09a8.90±1.54a9.28±0.45a7.94±0.36a9.02±0.09a7.81±0.36a8.96±0.00a总SO2/(mg/L)96.00±1.81a53.76±1.81b98.56±5.43a83.07±19.73a84.48±7.24a92.16±7.24a93.57±1.99a残糖/(g/L)7.75±0.71a5.13±0.53b7.13±0.18a7.75±0.11a7.30±0.11a5.81±0.09b5.63±0.18b酒精度/%vol11.20±0.00a11.36±0.02a11.65±0.12a11.46±0.50a11.41±0.06a11.21±0.09a11.25±0.23a总酚/(g/L)1.66±0.03a1.64±0.09a1.67±0.05a1.59±0.02a1.65±0.03a1.68±0.03a1.63±0.00a甘油/(g/L)5.03±0.04a5.11±0.69a5.37±0.24a5.26±0.81a5.45±0.14a5.35±0.31a5.52±0.42a
注:同行字母不同表示差异显著(P<0.05)。
2.3 葡萄酒色度色调分析
颜色是评价葡萄酒外观质量的重要指标,一瓶葡萄酒的氧化程度和质量的好坏,可通过葡萄酒的色度色调来判断。色度表示的是颜色的深浅,其变化与花青素衍生物的形成有关[20],酒体中花色素苷、单宁含量越高,颜色越深,色度值也就越高[21]。而色调表明酒体颜色的红黄偏向程度,色调越高,说明酒体颜色整体偏黄色调,这是色素、辅色素和花青素衍生物前体数量导致的[22]。白葡萄酒外观色泽近似无色或呈现微黄带绿、浅黄、金黄色等颜色。从图2可看出,本土酿酒酵母YQY-E18发酵的酒样色度值最大,与本土酿酒酵母QTX-D7、YC-E8和商业酵母XR发酵酒样的色度值具有显著差异,YC-E8发酵的酒样色度值最小,说明YQY-E18发酵的酒样中花色素苷和单宁含量最高,颜色较其他酒样来说较深。本土酿酒酵母QTX-D17发酵的酒样色调值最高,与本土酿酒酵母YQY-E18和商业酵母F33发酵的酒样色调具有显著差异,说明本土酿酒酵母QTX-D17酿造的酒样酒体颜色相对于其他6个酒样更偏黄色调。
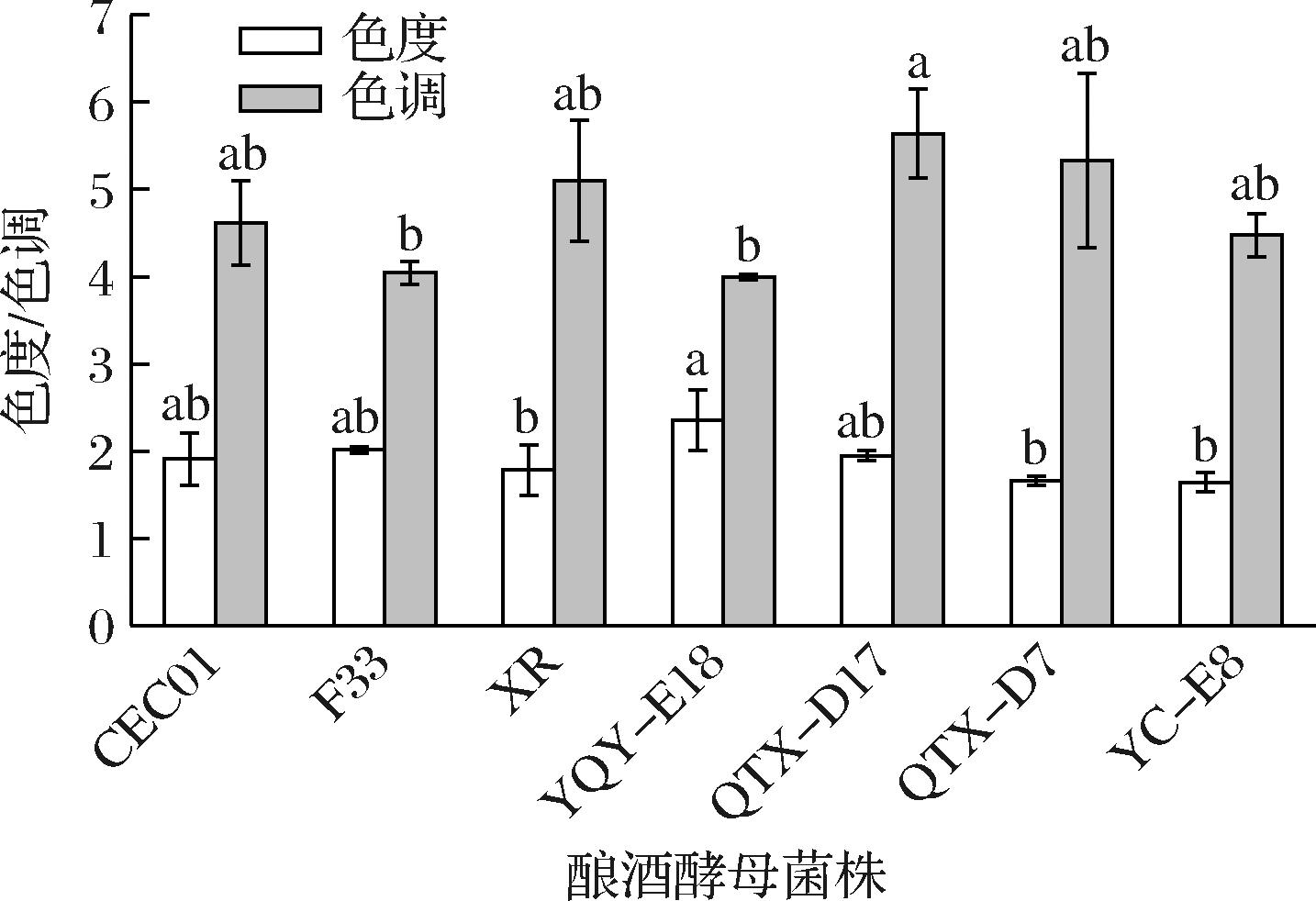
图2 不同菌株发酵霞多丽葡萄酒的色度、色调
Fig.2 Chromaticity and hue of Chardonnay wines fermented by different yeast strains
注:同一指标字母不同表示差异显著(P<0.05)(下同)。
2.4 葡萄酒感官分析
如图3-a所示,在整体性与余味方面,各酒样之间的差异不明显,酒体较为丰满,口感较佳,余味较长,比较有典型性;在复杂度方面,商业酵母F33、XR和本土酵母QTX-D17发酵的酒样高于其余酵母;本土酵母QTX-D17在透明度、酸甜平衡度以及香气浓郁度明显高于其余的酿酒酵母;在协调性方面商业酵母XR略高于其他酵母,其次为本土酵母QTX-D17。从图3-b可以看出,QTX-D17的柑橘类香气与花香最为浓郁;各酒样在热带水果香、核果类香及草本味方面差异不显著。综上所述,本土酿酒酵母的感官品质与商业酿酒酵母相似,其中本土酵母中QTX-D17的整体香气评分高于其他组别。
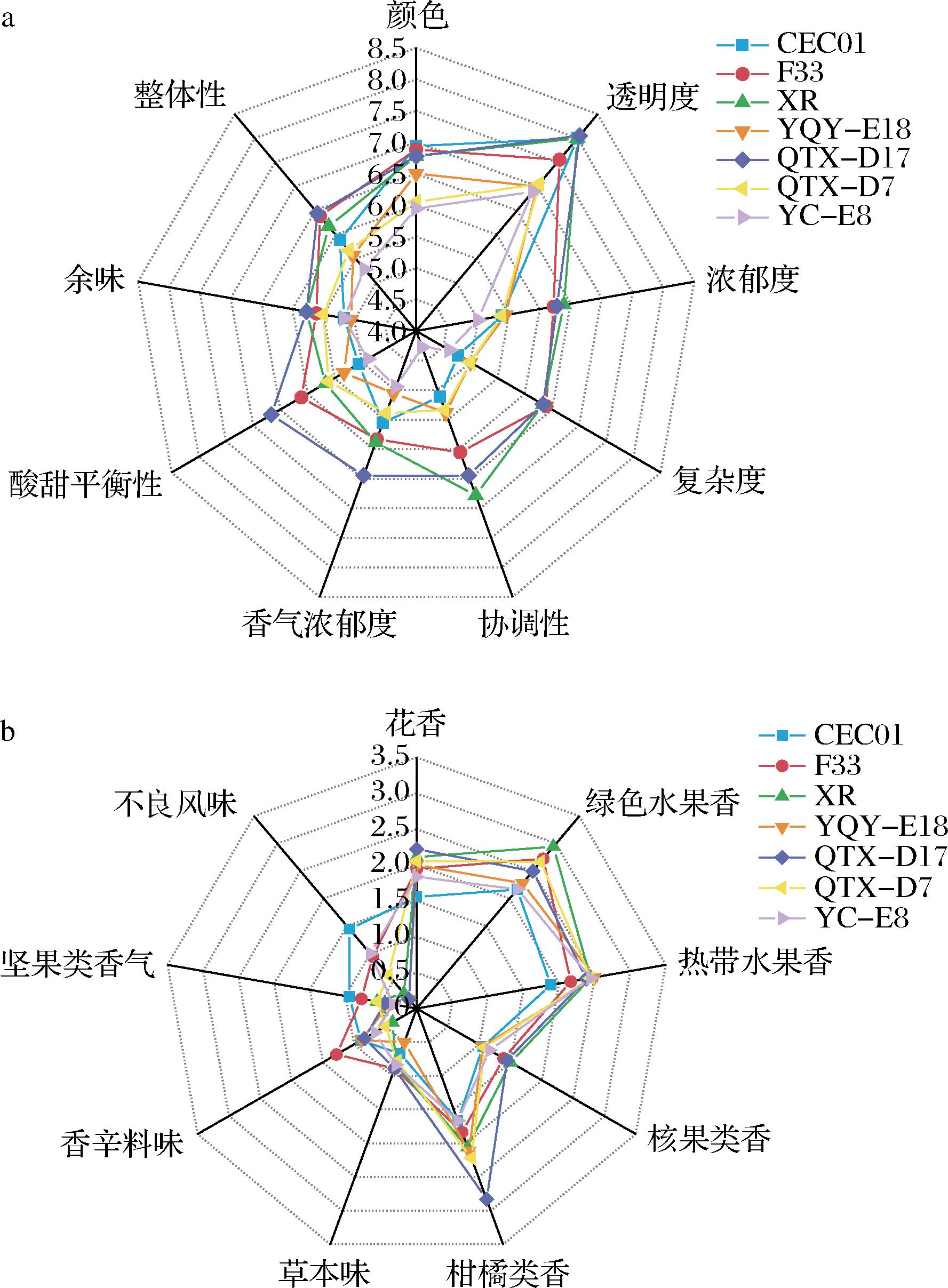
a-感官属性强度分析;b-香气类型感官强度分析
图3 七株酿酒酵母发酵酒样感官分析雷达图
Fig.3 Sensory analysis of wine samples fermented by seven yeast strains
2.5 葡萄酒挥发性香气物质分析
挥发性香气物质对葡萄酒的风味有很大的贡献[23]。各葡萄酒样品中共检测出44种香气物质,包括酯类物质24种、醇类物质9种、酸类物质3种,以及其他类化合物8种,如电子版增强出版附表1所示(https://doi.org/10.13995/j.cnki.11-1802/ts.043825)。7株菌发酵酒样产生的酯类、醇类、酸类和其他物质含量如图4所示。
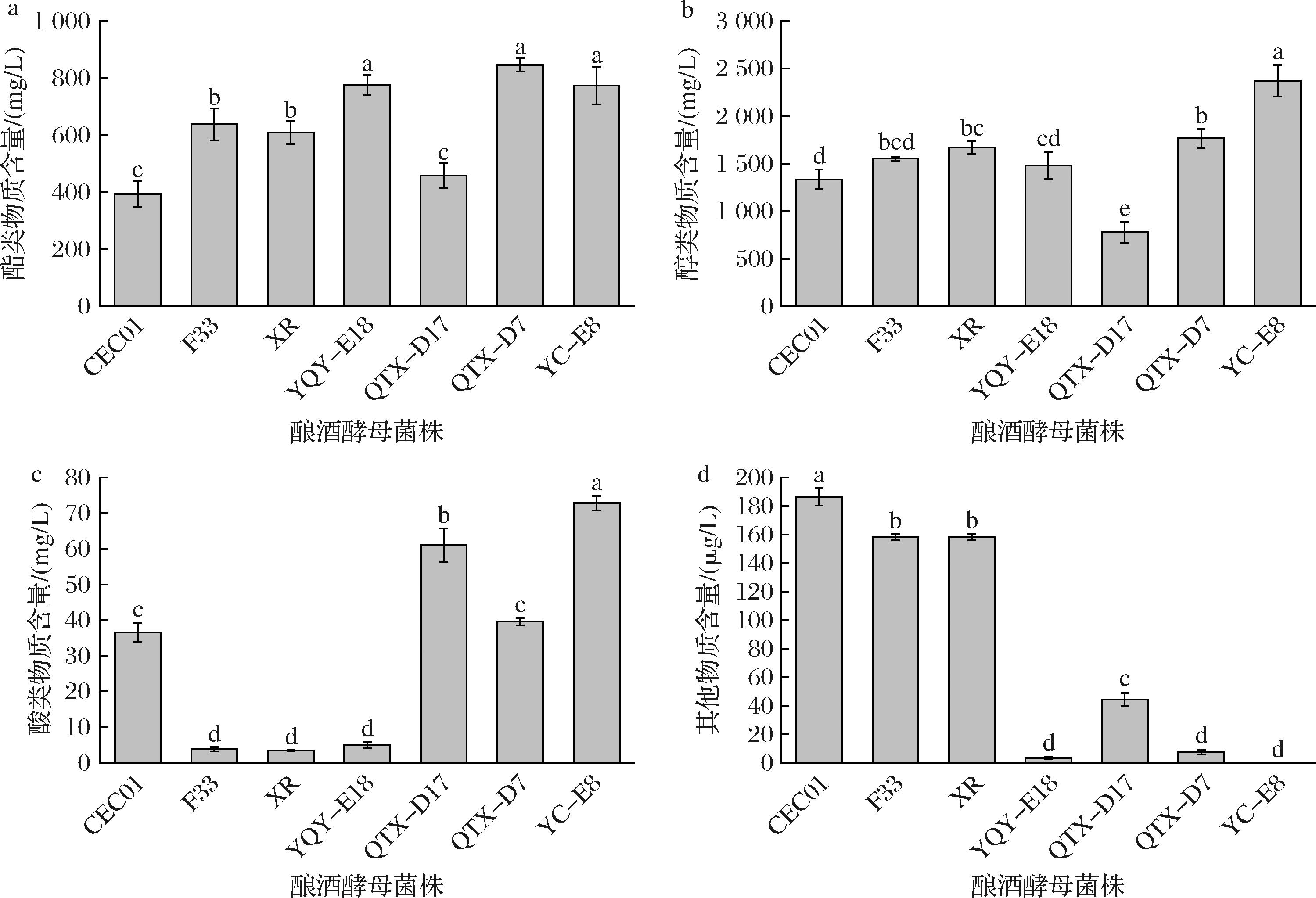
a-酯类物质;b-醇类物质;c-酸类物质;d-其他物质
图4 不同菌株发酵霞多丽葡萄酒的香气成分含量
Fig.4 Content of aroma compounds in Chardonnay wines fermented by different yeast strains
酯类物质是一类重要的挥发性化合物,是霞多丽葡萄酒具有果香和花香的原因,主要是在酵母菌等微生物的酶催化作用下合成的[24]。如电子版增强出版附表1所示,不同酿酒酵母菌株发酵的霞多丽葡萄酒酯类物质总含量在393 621.44~846 421.68 μg/L,在本土酿酒酵母中含量高的酯类物质有乙酸乙酯、正己酸乙酯、辛酸乙酯、癸酸乙酯,具有香蕉、苹果等水果的甜果香。癸酸乙酯、乙酸苯乙酯和棕榈酸乙酯在YC-E8发酵酒样中的含量最高,赋予其果香和花香。此外,由图4可以看出,本土酿酒酵母QTX-D7发酵的酒样酯类物质含量最高,其次为本土酿酒酵母YQY-E18、YC-E8,这3株本土酿酒酵母与3株商业酵母发酵酒样产生的酯类物质浓度具有显著差异,而含量最低的是商业酵母CEC01发酵酒样。
醇类物质是酵母菌代谢的次级产物。由电子版增强出版附表1可知,所有酒样的醇类物质含量为780 608.85~2 372 612.09 μg/L,异丁醇、异戊醇、1-戊醇和苯乙醇是霞多丽葡萄酒中的主要醇类。其中,商业酵母CEC01中的异丁醇含量最高 (148 779.92 μg/L),赋予了葡萄酒淡甜和醇香的特性[25]。本土酿酒酵母YC-E8酒样中的异戊醇含量最高(1 995 209.99 μg/L),增加了葡萄酒中的威士忌和香蕉的香味。如图4所示,本土酿酒酵母YC-E8发酵酒样的醇类物质含量最高,其次为QTX-D7和商业酵母,本土酿酒酵母QTX-D17最少,且YC-E8和QTX-D17发酵酒样的醇类物质浓度与3株商业酵母具有显著差异。此外,被确定为年份标志物的苯乙醇在QTX-D17酒样中含量较高,有可能改善葡萄酒的花香属性[26]。
酸类物质是酵母菌在进行酒精发酵过程中代谢的产物,适量的酸类物质不仅能增加葡萄酒口感的复杂性,还会对葡萄酒的稳定性和保质期有所帮助。由电子版增强出版附表1可知,本实验中共检测出3种酸类物质,分别为乙酸、辛酸、癸酸。在商业酿酒酵母CEC01和本土酿酒酵母YC-E8、QTX-D17、QTX-D7酿造的酒样中检测到乙酸,其含量在34 456.28~59 843.99 μg/L之间,含量低于感知阈值(200 000 μg/L),这可能是微生物在葡萄酒发酵过程中对乙醇氧化的结果[25]。另外2种酸类物质辛酸和癸酸属于C6~C10脂肪酸,有研究指出,C6~C10脂肪酸的存在通常与负面气味的出现有关,但它们可以抑制相应酯类的水解,从而对葡萄酒香气的平衡有着重要作用[27]。含量在4 000~10 000 μg/L的C6~C10脂肪酸为葡萄酒提供了温和宜人的香气,而含量>20 000 μg/L则会对感官产生负面影响[28]。本实验中各酒样的C6~C10脂肪酸含量均低于此水平,说明对葡萄酒的香气具有积极作用。
本实验的酒样中还检测到三甲苯、2-壬酮、芳樟醇等8种其他物质,这些物质对葡萄酒酒体的平衡具有一定的作用。芳樟醇作为葡萄酒样品中的主要单萜类化合物,是单萜类化合物中最重要的香气活性物质之一[29],从电子版增强出版附表1看出,芳樟醇在本土酿酒酵母YQY-E18、QTX-D17和商业酵母CEC01、XR酿造的酒样中都有存在。三甲苯只在商业酵母中检测到,4株本土酿酒酵母酿造的酒样中均没有三甲苯。由图4可看出,商业酵母CEC01酿造的酒样中其他物质含量最高,本土酿酒酵母YC-E8发酵酒样中则没有检测到其他物质的含量,3株商业酿酒酵母酿造酒样中其他物质含量均高于本土酿酒酵母。
挥发性化合物的香气表现与其气味阈值有关,通常将挥发性物质浓度与其气味阈值的比值称为气味活性值(OAV)[30]。当OAV>1时,说明该挥发性物质在葡萄酒中的香气中起决定性作用,而OAV>0.1的挥发性化合物对葡萄酒的整体香气有影响。本研究中共检测到22种挥发性香气物质OAV>0.1,并对这些香气物质进行聚类分析。如图5所示,各酒样的香气聚为6类:第1类包括商业酵母F33和本土酵母YQY-E18;第2类包括商业酵母XR;第3类包括本土酵母QTX-D7;第4类包括商业酵母CEC01;第5类包括本土酵母YC-E8;第6类包括本土酵母QTX-D17。乙酸异丁酯、异戊醇乙酯、乳酸乙酯、辛酸甲酯、壬酸乙酯、癸酸甲酯、庚醇、1-壬醇、1-癸醇、2,4-二叔丁基对甲酚是本土酿酒酵母QTX-D17发酵酒样的特有香气,在其他6株酵母发酵的酒样中没有发现,这些物质赋予酒样花香、热带水果以及成熟水果的香气。YQY-E18发酵酒样中1-戊醇的OAV>1,使酒样表现出苦杏仁味和香脂味等香气;QTX-D17发酵酒样中的丁酸乙酯、辛酸乙酯、丁二酸二乙酯、庚醇的OAV>1,赋予酒样玫瑰香、水果香、柠檬味和橙子味等香气特征;QTX-D7发酵酒样中乙酸乙酯的OAV>1,赋予酒样水果味、甜香等香气特征;YC-E8发酵酒样中癸酸乙酯、苯乙酸乙酯、乙酸苯乙酯、异戊醇、苯乙醇的OAV>1,使酒样呈现出椰子香、蜂蜜香、花香和威士忌味等丰富的香气特征。此外,本土酿酒酵母YQY-E18与商业酿酒酵母在同一个分支,说明这2株酿酒酵母发酵的酒样香气特征相似。
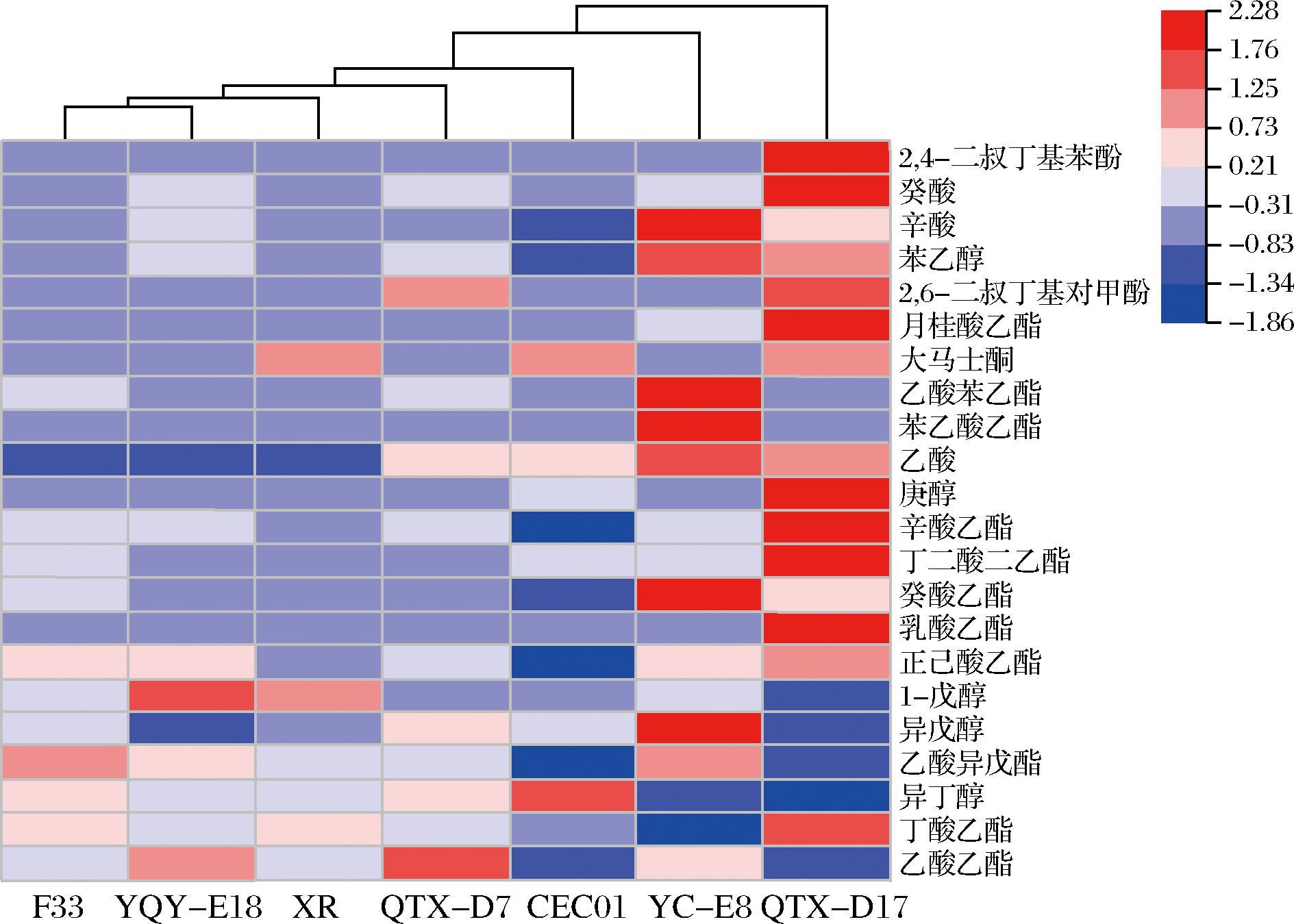
图5 不同酿酒酵母发酵霞多丽葡萄酒挥发性成分聚类分析
Fig.5 Cluster analysis of volatile components in Chardonnay wines fermented by different yeast strains
3 结论与讨论
酵母菌作为影响葡萄酒品质中最重要的因素之一,在不同葡萄酒产区表现出不同的区域特征,从而影响着葡萄酒的香气品质和口感特性。贺兰山东麓葡萄酒产区作为我国最具代表性的产区之一,因其独特的地理位置优势等,使其成为国内研究微生物的热点区域。本实验选用从贺兰山东麓葡萄酒产区筛选出的4株本土酿酒酵母和3株商业酵母发酵霞多丽葡萄酒总共用时8 d,4株本土酿酒酵母的发酵性能良好,与商业酵母的比重变化差异不明显。通过对发酵酒样的理化指标分析检测,发现4株本土酿酒酵母的乙醇、总酚、甘油等产量与商业酵母差异不显著,挥发酸含量中本土酿酒酵母YC-E8、QTX-D7、QTX-D17要高于商业酵母F33和XR,且在葡萄酒的正常范围内。本土酿酒酵母YQY-E18发酵的酒样色度值最大,表明花色素苷和单宁含量最高,颜色对比其他酒样来说较深。QTX-D17发酵的酒样色调值最高,相对于其他6株酿酒酵母酿造的酒样酒体颜色更偏黄色调。另外,QTX-D17的透明度、酸甜平衡度以及香气浓郁度高于其他酿酒酵母,柑橘类香气与花香最为浓郁,整体香气评分高于其他组别。
在挥发性物质方面,本土酿酒酵母中含量高的酯类物质有乙酸乙酯、正己酸乙酯、辛酸乙酯、癸酸乙酯,具有香蕉、苹果等水果的甜果香。CHEN等[11]研究发现,丁酸乙酯、己酸乙酯、癸酸乙酯、乙酸乙酯、乙酸异戊酯的含量在本土酿酒酵母中占比较高,与本研究结果相似。QTX-D17发酵酒样中的主要香气物质包括丁酸乙酯、辛酸乙酯、丁二酸二乙酯、庚醇,给葡萄酒带来了水果香、玫瑰花香和柑橘香,这也使得其在感官分析评价中优于其他菌株。辛酸乙酯作为白葡萄酒中重要的香味物质[31],提升了葡萄酒的花香和果香,4株本土酿酒酵母具有较强的产辛酸乙酯能力,其中QTX-D17产辛酸乙酯的能力最强。刘沛通[7]等研究发现,本土酿酒酵母60258在雷司令和西拉中均高产辛酸乙酯,提高了葡萄酒中的花果香气,与本研究结果一致。QTX-D17发酵酒样中的2,4-二叔丁基苯酚、乳酸乙酯、辛酸甲酯等物质在其他酒样中均未被检测到,是本土酿酒酵母QTX-D17的特征香气物质。巩丽莉[32]等对贺兰山东麓本土酿酒酵母进行了筛选并研究其发酵特性,发现同样的本土酿酒酵母QTX-D17在赤霞珠葡萄酒中检测出了商业酵母缺少的2-己烯酸乙酯,是该菌株的特异性香气化合物。此外,课题组选用与本实验相同的7株菌株进行赤霞珠葡萄酒的酿造,发现菌株QTX-D7所发酵酒样香气更为丰富,赋予了葡萄酒香蕉味、苹果味、菠萝味、椰子味等愉悦花果香[32],与本实验结果不一致,这可能是由于酿酒酵母菌株和葡萄品种之间的相互作用。比如,许多发酵衍生的高级醇是通过Ehrlich途径由相应的氨基酸代谢产生的[33]。酿酒酵母菌株对氨基酸的优先消耗和葡萄汁中氨基酸的组成等因素会明显影响高级醇的形成,进而对相应的酯类合成产生影响[9]。另外,YC-E8发酵酒样中癸酸乙酯、乙酸苯乙酯、苯乙酸乙酯、棕榈酸乙酯、异戊醇、苯乙醇的含量相较于其他酒样较高,赋予了葡萄酒浓郁的蜂蜜气息和花香,苯乙酸乙酯是该菌株特有的香气物质。在厌氧条件下,酵母菌以苯丙氨酸为原料生成苯乙醇[34],本实验中本土酿酒酵母酿造酒样的苯乙醇含量高于商业酿酒酵母,这与GE等[35]研究结果一致。
综上所述,4株本土酿酒酵母中,YC-E8和QTX-D17菌株表现出优异的产香性能,适合酿造霞多丽葡萄酒。这对于开发贺兰山东麓本土酿酒酵母资源,发挥当地葡萄酒本土特色,避免商业酵母垄断市场具有重要意义,为研究贺兰山东麓葡萄酒产区的本土酿酒酵母多样性,以及酿造具有地域风土特色的葡萄酒提供了科学依据。
[1] MA T Z, HAN S Y, ZHANG B, et al.White winemaking in cold regions with short maturity periods in Northwest China[J].White Wine Technology, 2022:355-367.
[2] 郑明朋, 李亚军, 张众, 等.贺兰山东麓‘霞多丽’干白葡萄酒发酵过程中香气成分与特征变化[J].食品与发酵工业, 2023, 49(16):188-195.ZHENG M P, LI Y J, ZHANG Z, et al.Changes in aroma compounds and characteristics of ‘Chardonnay’ dry white wine from the Eastern Foot of Helan Mountain during fermentation[J].Food and Fermentation Industries, 2023, 49(16):188-195.
[3] GAO J, WANG M F, HUANG W D, et al.Indigenous Saccharomyces cerevisiae could better adapt to the physicochemical conditions and natural microbial ecology of prince grape must compared with commercial Saccharomyces cerevisiae FX10[J].Molecules, 2022, 27(20):6892.
[4] 冯丹萍, 何荣荣, 程思琦, 等.本土酵母NX11424对赤霞珠葡萄酒发酵中酵母菌多样性及香气成分的影响[J].微生物学通报, 2022, 49(9):3722-3739.FENG D P, HE R R, CHENG S Q, et al.Effects of indigenous yeast NX11424 inoculation on the yeast diversity and aroma compounds during Cabernet Sauvignon wine fermentation[J].Microbiology China, 2022, 49(9):3722-3739.
[5] PETRIGNANI D B, MESTRE M V, VARGAS M F, et al.Bioprospecting and selection of indigenous Saccharomyces cerevisiae yeasts from Pozo de Los Algarrobos (Argentina) for the production of genuine white wines[J].Fermentation, 2024, 10(6):279.
[6] WANG X D, DANG C, LIU Y Q, et al.Effect of indigenous Saccharomyces cerevisiae strains on microbial community successions and volatile compounds changes during Longyan wine fermentation[J].Food Bioscience, 2024, 57:103595.
[7] 刘沛通, 丁子元, 于庆泉, 等.优良本土酿酒酵母的酿造特性研究[J].中国食品学报, 2023, 23(1):204-215.LIU P T, DING Z Y, YU Q Q, et al.Studies on oenological characteristics of high-quality Chinese indigenous Saccharomyces cerevisiae strains[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(1):204-215.
[8] 程仕伟, 屈慧鸽, 栾丽英, 等.新疆霞多丽自然发酵醪中本土酿酒酵母的选育与发酵特性[J].中国食品学报, 2017, 17(8):119-125.CHENG S W, QU H G, LUAN L Y, et al.Screening and fermentation characteristics of indigenous Saccharomyce scerevisiae from spontaneous fermentation of Chardonnay grapes[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(8):119-125.
[9] CHEN Y, JIANG J, SONG Y Y, et al.Yeast diversity during spontaneous fermentations and oenological characterisation of indigenous Saccharomyces cerevisiae for potential as wine starter cultures[J].Microorganisms, 2022, 10(7):1455.
[10] VARELA C, SIEBERT T, COZZOLINO D, et al.Discovering a chemical basis for differentiating wines made by fermentation with ‘wild’ indigenous and inoculated yeasts:Role of yeast volatile compounds[J].Australian Journal of Grape and Wine Research, 2009, 15(3):238-248.
[11] CHEN Y, LEI X M, WU Q, et al.Oenological suitability of Chinese indigenous Saccharomyces cerevisiae in Chardonnay wine:The observation of grape maturity and vintage[J].Food Bioscience, 2024, 61:104904.
[12] 王紫昕. 不同SO2添加量对葡萄酒发酵及陈酿品质的影响[D]. 银川:宁夏大学, 2025.WANG Z X. Effects of different SO2 additions levels on wine quality fermentation and aging[D]. Yinchuan:Ningxia University, 2025.
[13] 王克清. 红色酿酒葡萄中香草酰单宁组分及其在葡萄酒中演变的研究[D].银川:宁夏大学, 2023.WANG K Q.Study of vanillyl tannin fractions in red wine grapes and their evolution in wine[D].Yinchuan: Ningxia University, 2023.
[14] 刘晓燕. 混菌发酵、酒泥陈酿对赤霞珠干红葡萄酒品质的影响[D].乌鲁木齐:新疆农业大学, 2023.LIU X Y.Effects of mixed-bacteria fermentation and aging on the quality of Cabernet Sauvignon red wines[D].Urumqi:Xinjiang Agricultural University, 2023.
[15] 李伟, 张众, 王礼, 等.贺兰山东麓‘美乐’自然发酵干红葡萄酒品质特性[J].食品科学, 2022, 43(8):204-212.LI W, ZHANG Z, WANG L, et al.Quality characteristics of natural ‘Merlot’Dry red wine from eastern foothill of Helan Mountain[J].Food Science, 2022, 43(8):204-212.
[16] 栗甲, 李娇娇, 施云鹏.葡萄酒发酵过程比重与还原糖消耗及酒精生成量关系研究[J].酿酒科技, 2015(2):76-77;80.LI J, LI J J, SHI Y P.The relationship between the proportion and reducing sugar consumption and alcohol yield in the fermenting process of grape wine[J].Liquor-Making Science &Technology, 2015(2):76-77;80.
[17] 曹炜玉, 路文鹏, 舒楠, 等.葡萄酒风味物质及其影响因素研究进展[J].中国酿造, 2022, 41(5):1-7.CAO W Y, LU W P, SHU N, et al.Research progress on wine flavor substances and their influencing factors[J].China Brewing, 2022, 41(5):1-7.
[18] 李毅丽, 李红玉, 贺艳楠, 等.混菌发酵对昌黎赤霞珠葡萄酒品质的影响[J].食品与发酵工业, 2022, 48(21):54-60.LI Y L, LI H Y, HE Y N, et al.Effect of mixed fermentation on quality of Cabernet Sauvignon wine in Changli region[J].Food and Fermentation Industries, 2022, 48(21):54-60.
[19] 周文亚, 杨金仙, 梁树英, 等.酒精发酵温度对不同酿酒酵母菌株甘油产量的影响研究[J].食品与发酵科技, 2022, 58(1):15-22.ZHOU W Y, YANG J X, LIANG S Y, et al.Study on the effect of alcohol fermentation temperature on glycerol yield of different Saccharomyces cerevisiae strains[J].Food and Fermentation Science &Technology, 2022, 58(1):15-22.
[20] ZHAO Y Q, ZENG Y Y, LI X S, et al.Modeling and application of sensory evaluation of blueberry wine based on principal component analysis[J].Current Research in Food Science, 2023, 6:100403.
[21] 李坚. 葡萄酒的氧化程度对酒质的影响及其判别模型的构建[D].长沙:湖南农业大学, 2017.LI JIAN.The impact of wine oxidation level on wine quality and the construction of a discrimination model[D].Changsha:Hunan Agricultural University, 2017.
[22] LI S Y, ZHAO P R, LING M Q, et al.Blending strategies for wine color modification Ⅰ:Color improvement by blending wines of different phenolic profiles testified under extreme oxygen exposures[J].Food Research International, 2020, 130:108885.
[23] SIEBERT T E, BARTER S R, DE BARROS LOPES M A, et al.Investigation of ‘stone fruit’ aroma in Chardonnay, Viognier and botrytis Semillon wines[J].Food Chemistry, 2018, 256:286-296.
[24] YANG L, ZHU X, MAO Y L, et al.Effect of different inoculation strategies of mixed culture Saccharomyces cerevisiae/Oenococcus oeni on the aroma quality of Chardonnay wine[J].Food Research International, 2024, 190:114636.
[25] XI C X, ZHANG J B, ZHANG F M, et al.Effect of postharvest grape dehydration on chemical composition, antioxidant activity and sensory characeteristics of Marselan wines[J].Food Chemistry:X, 2024, 22:101503.
[26] FERRERO-DEL-TESO S, ARIAS I, ESCUDERO A, et al.Effect of grape maturity on wine sensory and chemical features:The case of Moristel wines[J].LWT, 2020, 118:108848.
[27] TUFARIELLO M, CAPONE S, SICILIANO P.Volatile components of Negroamaro red wines produced in Apulian Salento area[J].Food Chemistry, 2012, 132(4):2155-2164.
[28] SHINOHARA T.Gas chromatographic analysis of volatile fatty acids in wines[J].Agricultural and Biological Chemistry, 1985, 49(7):2211-2212.
[29] PAOLINI M, RONCONE A, CUCINOTTA L, et al.Aromatic characterisation of moscato giallo by GC-MS/MS and validation of stable isotopic ratio analysis of the major volatile compounds[J].Biomolecules, 2024, 14(6):710.
[30] WANG X C, LI A H, DIZY M, et al.Evaluation of aroma enhancement for “Ecolly” dry white wines by mixed inoculation of selected Rhodotorula mucilaginosa and Saccharomyces cerevisiae[J].Food Chemistry, 2017, 228:550-559.
[31] 余欢, 管敬喜, 杨莹, 等.7株野生葡萄酒酵母对‘桂葡3号’干白葡萄酒香气成分的影响[J].食品科学, 2019, 40(4):251-258.YU H, GUAN J X, YANG Y, et al.Effects of seven wild wine yeast strains on the aroma compounds of ‘Guipu 3’ dry white wines[J].Food Science, 2019, 40(4):251-258.
[32] 巩丽莉, 周迪, 卢玲, 等.贺兰山东麓优良本土酿酒酵母筛选及发酵特性分析[J].微生物学通报, 2023, 50(9):4021-4044.GONG L L, ZHOU D, LU L, et al.Screening and fermentation of excellent indigenous Saccharomyces cerevisiae strains from eastern foothills of Helan Mountains[J].Microbiology China, 2023, 50(9):4021-4044.
[33] HAZELWOOD L A, DARAN J M, VAN MARIS A J A, et al.The Ehrlich pathway for fusel alcohol production:A century of research on Saccharomyces cerevisiae metabolism[J].Applied and Environmental Microbiology, 2008, 74(8):29-2266.
[34] MILJI U, PU
U, PU KA
KA V, VU
V, VU UROVI
UROVI V, et al.Fermentation characteristics and aromatic profile of plum wines produced with indigenous microbiota and pure cultures of selected yeast[J].Journal of Food Science, 2017, 82(6):1443-1450.
V, et al.Fermentation characteristics and aromatic profile of plum wines produced with indigenous microbiota and pure cultures of selected yeast[J].Journal of Food Science, 2017, 82(6):1443-1450.
[35] GE X X, LIU Y Q, WANG X D, et al.Correlations between microbes with volatile compounds and physicochemical indicators of Cabernet Sauvignon wines fermented with different starters[J].LWT, 2024, 198:115918.