糖尿病已成为全球公共卫生的主要问题之一。据国际糖尿病联合会统计,2021年,全球约有5.37亿糖尿病患者,而我国是糖尿病人数最多的国家。其中,2型糖尿病约占所有糖尿病病例的90%[1-2]。2型糖尿病发病原因与遗传、环境和肥胖等因素有关[1],同时,不合理的膳食结构也是影响糖尿病患者健康的重要因素之一。目前,通过抑制碳水化合物水解酶(如α-淀粉酶等)控制高血糖是治疗2型糖尿病的最佳策略之一[3]。
α-淀粉酶在分解碳水化合物方面起着至关重要的作用。α-淀粉酶可将淀粉分解成更小的碳水化合物[4],消化后的糖进入血液会导致糖尿病患者血糖水平升高[5]。为了有效地控制血糖水平,一些糖尿病患者可能会考虑使用α-淀粉酶抑制剂,它们可以减缓碳水化合物的消化和吸收。阿卡波糖是一种广泛使用的α-淀粉酶合成类抑制剂,但会引起肠胃胀气、腹泻和腹痛等胃肠道不良反应[6]。因此,越来越多的研究人员致力于从自然资源中开发淀粉消化酶抑制剂[7]。
已有研究者利用从植物中获得的生物活性化合物降低餐后葡萄糖[8]。也有研究者报道了不同植物来源的酶抑制剂化合物,如枸杞叶多糖[9]、山楂原花青素[10]、黄秋葵果胶[11]等。有研究指出,肉桂中的活性成分可以降低糖尿病大鼠的血浆葡萄糖水平[12]。肉桂酸作为肉桂中的主要植物化学物质之一,具有抗氧化、抗菌、抗癌和抗炎的特性[13]。目前,有关肉桂酸对α-淀粉酶活性的抑制及其机理的研究较少且无定论。故本研究从抑制率测定、紫外光谱分析、荧光光谱、分子对接等多角度探究肉桂酸对α-淀粉酶的抑制效果及其作用机制。这将有助于从理论上更好地理解肉桂酸对α-淀粉酶的影响,同时为2型糖尿病患者功能食品的开发提供新的理论依据。
1 材料与方法
1.1 材料与试剂
α-淀粉酶(酶活性3 700 U/g),北京索莱宝科技有限公司;肉桂酸(纯度99%),上海麦克林生化科技股份有限公司;实验用有机溶剂均为国产分析纯。
1.2 仪器与设备
P3紫外可见分光光度计,上海美谱达仪器有限公司;AFS-9750荧光光谱仪,日本株式会社日立高新技术科学那珂事业所。
1.3 实验方法
1.3.1 肉桂酸对α-淀粉酶活性抑制的测定
移取0.125 mL α-淀粉酶溶液,分别加入等体积不同浓度的肉桂酸(0.04、0.08、0.12、0.16、0.20 mmol/L),37 ℃水浴30 min,加入0.25 mL质量分数1%淀粉溶液后继续37 ℃加热5 min,加入0.5 mL DNS显色剂,沸水浴10 min,冷却、定容至10 mL,于520 nm处测吸光值,记为A1。对照组用PBS代替待测液,吸光值记为A0。抑制率计算如公式(1)所示:
抑制率![]()
(1)
1.3.2 紫外-可见吸收光谱测定
利用紫外-可见光吸收光谱研究肉桂酸与α-淀粉酶的相互作用[14]。具体操作如下:移取1 mg/mL的淀粉酶溶液9 mL于试管中,加入900 μL不同浓度(0.2、0.25、0.3、0.35、0.4、0.45、0.5 mmol/L)的肉桂酸溶液,使其充分混匀,并以PBS作为参比溶液。设置扫描范围为240~400 nm,扫描精度0.1 nm。
1.3.3 荧光光谱测定
配制不同浓度的肉桂酸溶液(0、0.2、0.25、0.3、0.35、0.4、0.45、0.5 mmol/L,分别移取900 μL于试管中,加入9 mL淀粉酶溶液(1 mg/mL),充分混匀后分别在297 K和310 K下水浴5 min,测定荧光光谱。荧光光度计测定参数设置为:狭缝宽度5 nm,激发波长280 nm,发射波长300~500 nm。
1.3.3.1 肉桂酸对α-淀粉酶荧光光谱的影响以及猝灭类型判断
根据Stern-Volmer方程(2)计算荧光猝灭参数,进而判断猝灭类型。
![]() =Kqτ0[Q]+1=Ksv[Q]+1
=Kqτ0[Q]+1=Ksv[Q]+1
(2)
式中:F0,不加肉桂酸时的荧光强度;[Q],肉桂酸浓度;F,肉桂酸和α-淀粉酶体系混合后的荧光强度;Kq,α-淀粉酶和肉桂酸的猝灭速率常数;τ0,不加肉桂酸时荧光分子的平均寿命(一般为10-8s);Ksv,α-淀粉酶和肉桂酸相互作用时的猝灭常数。
1.3.3.2 肉桂酸与α-淀粉酶作用后结合位点数和结合常数
结合常数能够评价肉桂酸与α-淀粉酶的结合强弱[15],具体计算如公式(3)所示:
lg[F0-F]=nlg[Q]+lgKa
(3)
式中:F0,不加肉桂酸时的荧光强度;F,肉桂酸和α-淀粉酶混合体系的荧光强度;Ka,肉桂酸与α-淀粉酶的结合常数;n,结合位点数。
1.3.3.3 肉桂酸与α-淀粉酶的相互作用力
热力学参数——焓变和熵变可以用范霍夫方程计算求得,进而判断2种分子间的结合,具体计算如公式(4)~公式(5)所示:
(4)
ΔG=ΔH-TΔS
(5)
式中:K1、K2,反应温度T1和T2下的结合常数;ΔS,熵变;ΔH,焓变;ΔG,吉布斯自由能变;R是气体常数,8.314 J/(mol·K)。
1.3.4 分子对接
从PDB蛋白质数据库(https://www.rcsb.org/)中获取α-淀粉酶的三维结构(PDB ID:1P1F),并对该分子进行去水加氢。从PubChem(https://pubchem.ncbi.nlm.nih.gov/)获取肉桂酸(ID:444 539)的3D结构,并给该分子加氢。采用AutoDock Tools-1.5.6模拟软件进行分子对接,网格盒子设置为110×110×110个格点,且网格间距为0.9 Å,运行次数为100次,选取最低结合能构象进行可视化,并分析肉桂酸与α-淀粉酶的相互作用力。
1.4 数据处理
使用SPSS软件对数据进行处理和分析,用Origin 2018软件绘图,方差分析采用单因素one-way ANOVA检验,P<0.05表示差异显著。
2 结果与分析
2.1 酶活性测定
如图1所示,肉桂酸浓度在0.04~0.20 mmol/L时,对α-淀粉酶的抑制率最高为78.05%。目前,有关肉桂酸对α-淀粉酶抑制效果尚无定论。GUNNY等[16]研究指出,咖啡酸作为一种含有肉桂酸骨架的酚酸,其对α-淀粉酶的抑制作用也表现出较强的活性,其抑制效果优于合成抑制剂阿卡波糖,这进一步证明了肉桂酸及其衍生物在抑制α-淀粉酶方面的潜力。然而,也有研究指出,肉桂酸对α-淀粉无抑制作用。即使是高质量浓度下(0.40 mg/mL),肉桂酸对酶的活性也没有影响[17]。ADISAKWATTANA等[18]利用肉桂酸衍生物观察其对α-淀粉酶的抑制活性,提出所有肉桂酸衍生物也无抑制作用。而MENSHAZ等[19]指出,肉桂酸质量浓度为5 mg/mL时可使α-淀粉酶活性提高约1倍,在10、15 mg/mL时可使α-淀粉酶活性提高约2倍,故认为肉桂酸是α-淀粉酶的良好活化剂。该激活作用使得α-淀粉酶在洗涤剂、制药、造纸、纺织、发酵、燃料酒精生产及食品工业具有潜在的用途[20]。此外,MOKHELE等[21]研究了芦荟叶粉提取物对酶的抑制作用。结果显示,提取物对α-淀粉酶没有明显抑制作用,但对α-葡萄糖苷酶的抑制作用较强。另有报道指出,肉桂酸对α-淀粉酶活性的抑制作用强于α-葡萄糖苷酶[22]。说明不同提取物对酶的抑制具有选择性[23]。故关于肉桂酸对α-淀粉酶的抑制作用还需要更多的深入研究来验证。
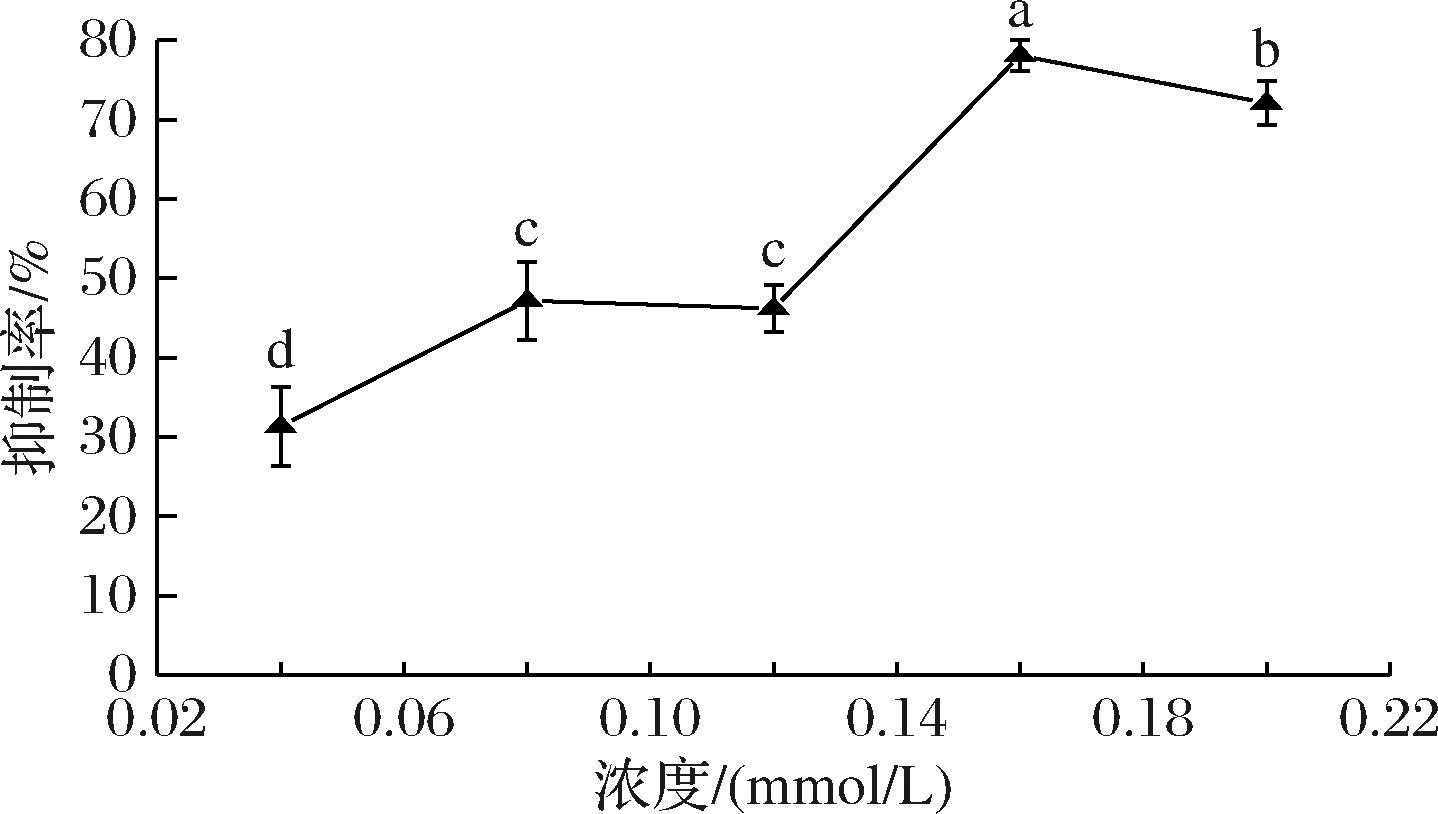
图1 肉桂酸对α-淀粉酶的抑制活性
Fig.1 Inhibition of α-amylase activity by cinnamic acid
注:不同小写字母表示组间差异显著(P<0.05)。
2.2 紫外可见光谱
紫外可见光谱用于指示蛋白质与配体相互作用而导致芳香族氨基酸残基周围微环境的差异[24]。如图2所示,不同浓度的肉桂酸与α-淀粉酶混合后吸光度在270 nm左右达到峰值,该特征峰与LI等[25]的研究结果一致,这可能与色氨酸、酪氨酸,以及苯丙氨酸残基的π→π*跃迁有关[26]。此外,同一波长下肉桂酸的浓度增加,α-淀粉酶对紫外光的吸收增强,表明肉桂酸与α-淀粉酶相互作用后紫外吸收峰强度具有浓度依赖性,这与沈荷玉等[26]的研究结果相一致。
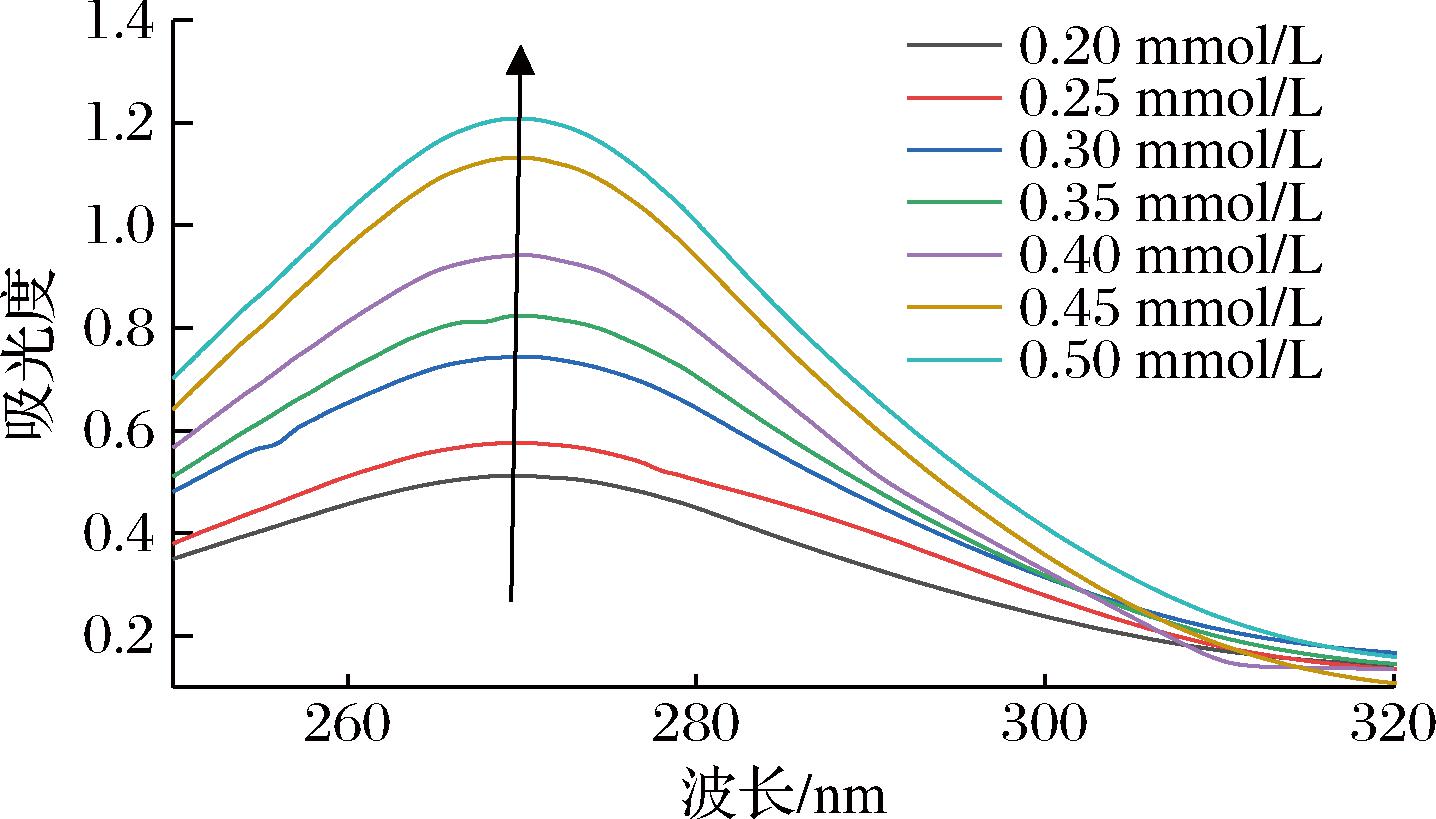
图2 肉桂酸与α-淀粉酶作用的紫外光谱图
Fig.2 Ultraviolet spectra of the interaction of cinnamic acid with α-amylase
2.3 荧光光谱
2.3.1 肉桂酸对α-淀粉酶的荧光猝灭
荧光光谱技术可用于研究小分子与蛋白质之间的相互作用[27]。α-淀粉酶的内源性荧光主要由色氨酸和酪氨酸等残基产生[28]。荧光的强度和位置可以准确反映α-淀粉酶内氨基酸残基微环境的变化[29-30]。如图3所示,随着肉桂酸浓度增加,α-淀粉酶的荧光峰出现了轻微的蓝移,且荧光强度逐渐降低。表明肉桂酸能够通过与α-淀粉酶发生相互作用进而猝灭α-淀粉酶的固有荧光。具体来看,298 K时,浓度0.50 mmol/L的肉桂酸对α-淀粉酶的荧光猝灭率为67.90%,310 K时对α-淀粉酶的荧光猝灭率为52.92%。有研究指出,荧光强度的降低表明蛋白质结构的展开和色氨酸残基暴露于更极性的环境中[31],表明氨基酸残基的微环境发生了变化。
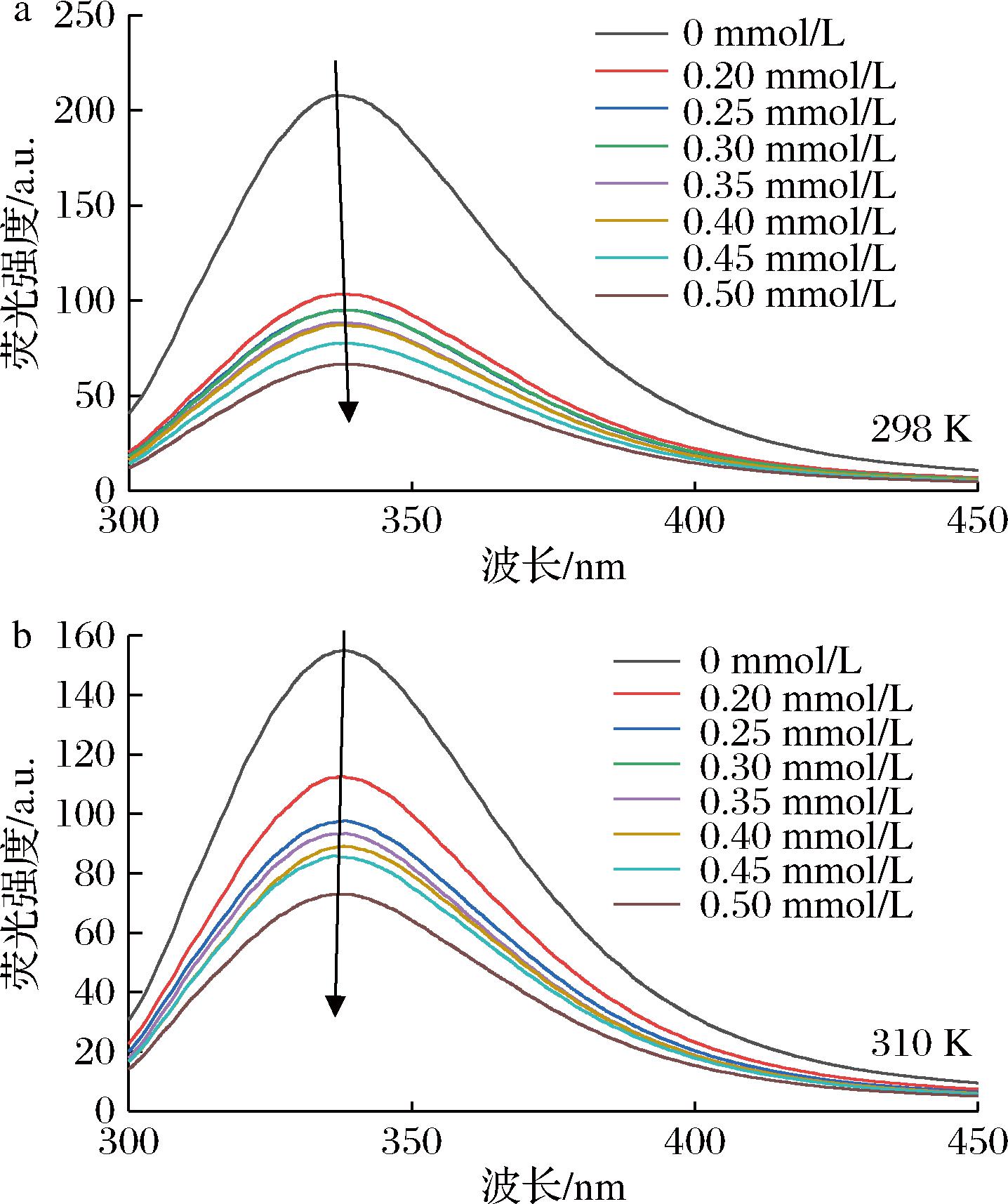
a-298 K;b-310 K
图3 不同温度下肉桂酸与α-淀粉酶相互作用的荧光光谱图
Fig.3 Fluorescence spectra of the interaction between cinnamic acid and α-amylase at different temperatures
2.3.2 肉桂酸对α-淀粉酶的猝灭类型
不同温度下肉桂酸与α-淀粉酶相互作用的Stern-Volmer曲线图如图4所示,据此计算肉桂酸与α-淀粉酶的Kq与Ksv(表1),进而判断猝灭类型。
表1 不同温度下肉桂酸与α-淀粉酶作用后的猝灭方程和猝灭常数
Table 1 Quenching equation and quenching constant of cinnamic acid and α-amylase at different temperatures

系统温度/KStern-Volmer方程Ksv/(L/mol)Kq/[L/(mol·s)]R2肉桂酸+α-淀粉酶298F0/F=3.599 3[Q]+1.244 63.599 3×103 3.599 3×10110.953 6310F0/F=2.329 1[Q]+0.929 92.329 1×103 2.329 1×10110.951 9
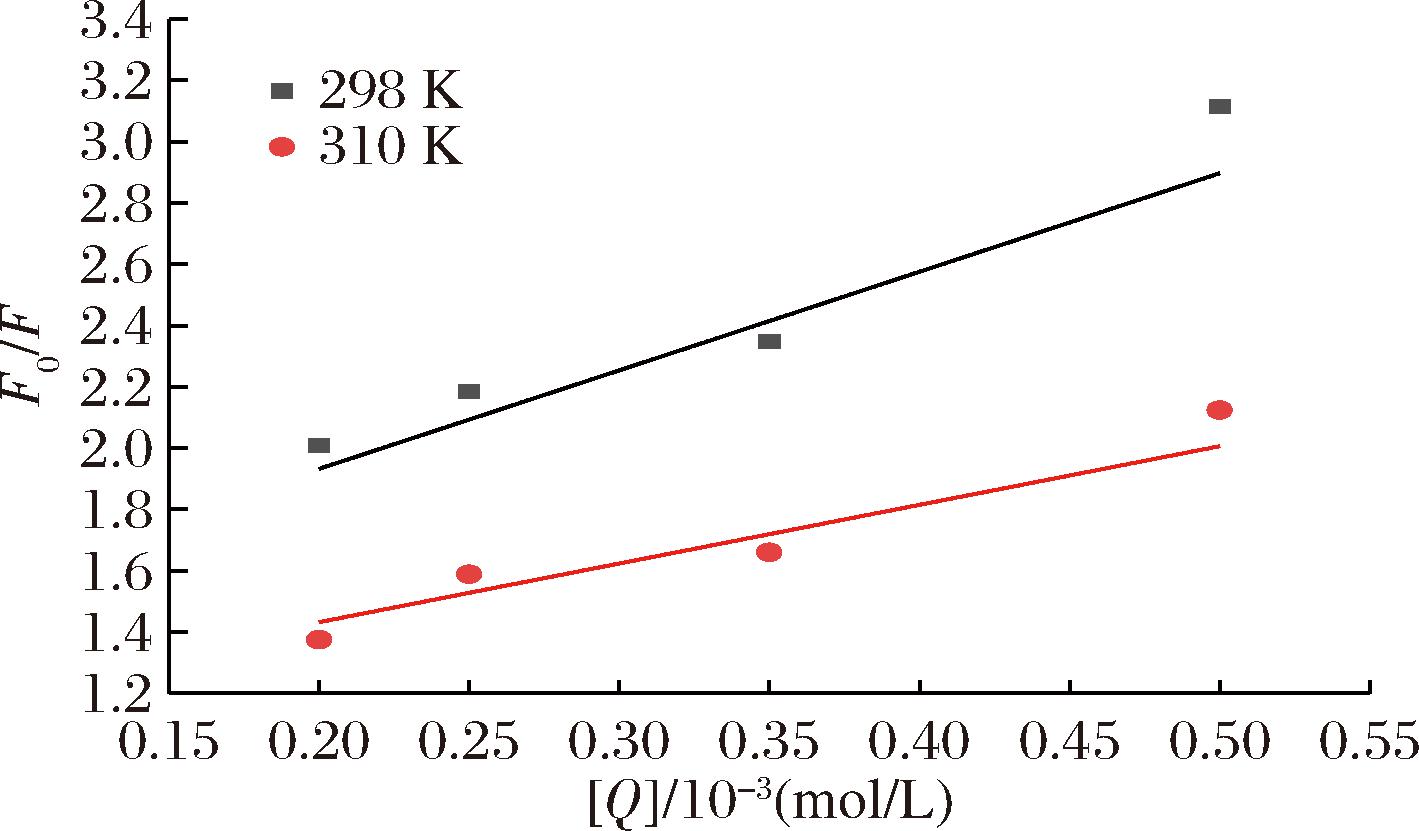
图4 肉桂酸与α-淀粉酶相互作用的Stern-Volmer曲线图
Fig.4 Stern-Volmer curve of the interaction between cinnamic acid and α-amylase
蛋白质荧光猝灭的机理主要可分为猝灭剂-荧光基团复合物形成产生的静态机理和猝灭剂-荧光团碰撞产生的动态机理[32-33]。表1中不同温度下的Ksv和Kq可判断荧光猝灭类型。298 K和310 K下肉桂酸对α-淀粉酶的荧光猝灭速率常数Kq值分别为3.599 3×1011、2.329 1×1011 L/(mol·s),高于最大动态猝灭常数2.0×1010 L/(mol·s)。以上数据说明,肉桂酸对α-淀粉酶猝灭为静态猝灭,即形成了肉桂酸-α-淀粉酶的复合。该结果与YU等[22]的研究结果相吻合。
2.3.3 肉桂酸与α-淀粉酶的结合常数及结合位点数
通过作双对数曲线图(图5),并根据线性拟合的回归方程计算获得肉桂酸与α-淀粉酶相互作用的结合位点数(Ka)和结合常数(n)(表2)。
表2 不同温度下肉桂酸与α-淀粉酶的结合常数及结合位点数
Table 2 Binding constants and number of binding sites of cinnamic acid and α-amylase at different temperatures

系统温度/K双对数方程Ka/(L/mol)nR2肉桂酸+α-淀粉酶298lg[(F0-F)/F]=0.741 6lg[Q]+2.729 65.365×1020.741 60.956 3310lg[(F0-F)/F]=1.103 1lg[Q]+3.644 14.407×1031.103 10.960 8
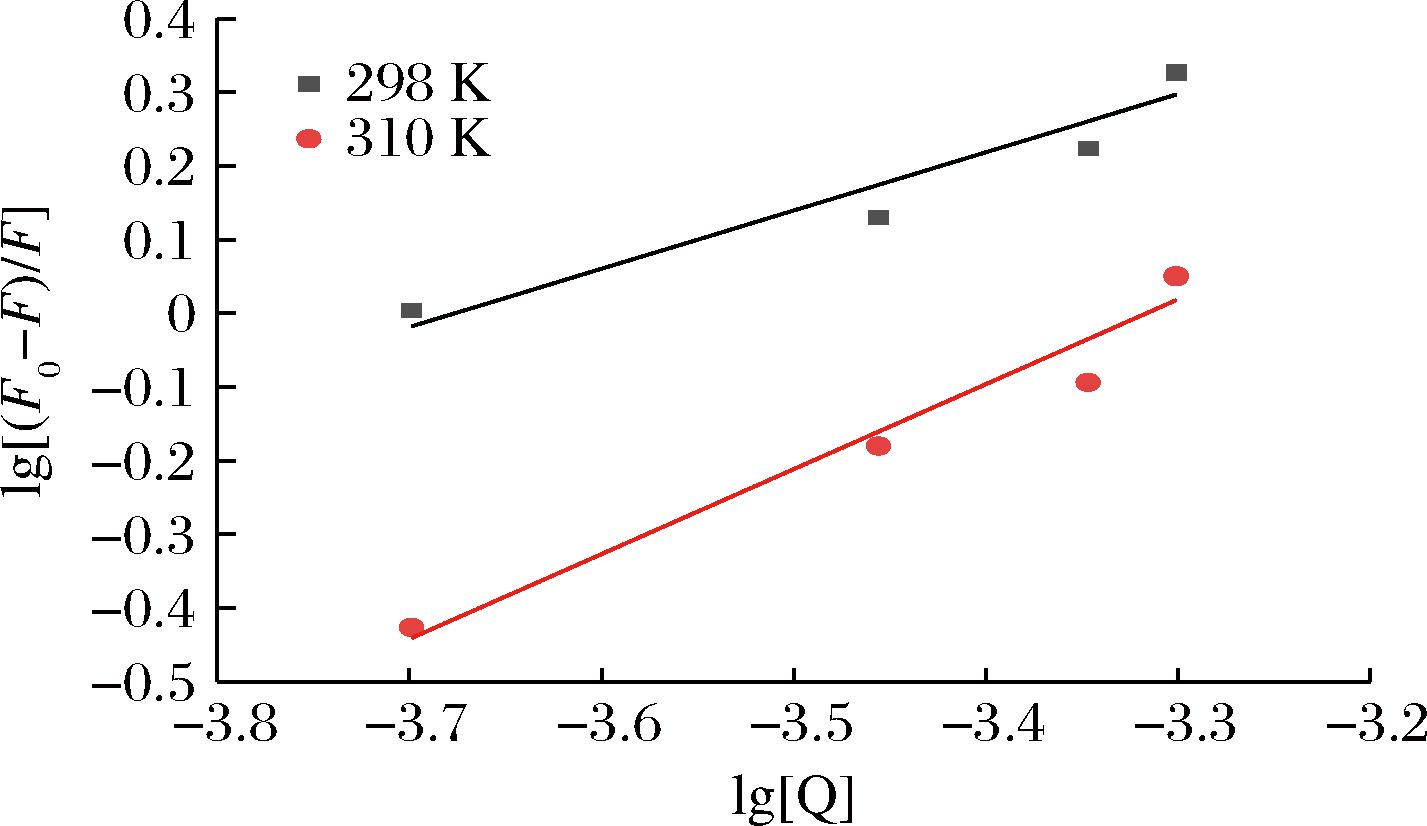
图5 不同温度下肉桂酸与α-淀粉酶相互作用的双对数曲线图
Fig.5 Double logarithmic plots of the interaction between cinnamic acid and α-amylase at different temperatures
在298 K时,肉桂酸与α-淀粉酶的结合常数为5.365×102 L/mol。在310 K时,该结合常数为4.407×103 L/mol。据报道,结合常数越大,结合强度越高[15]。对比以上数据可以看出,肉桂酸在升温后结合常数有所提高,表明升高温度有利于其与α-淀粉酶的结合。表2中结合位点数n近似为1,表明肉桂酸与α-淀粉酶有1个结合位点。
2.3.4 肉桂酸与α-淀粉酶的相互作用力
根据热力学参数ΔH、ΔS、ΔG的数值探究肉桂酸与α-淀粉酶作用时的主要作用力。据报道,若ΔH<0、ΔS>0,则表明两物质存在静电作用;若ΔH>0、ΔS>0,则表明两物质之间存在疏水作用;若ΔH<0,ΔS<0,则说明分子之间主要有氢键和范德华力[34]。
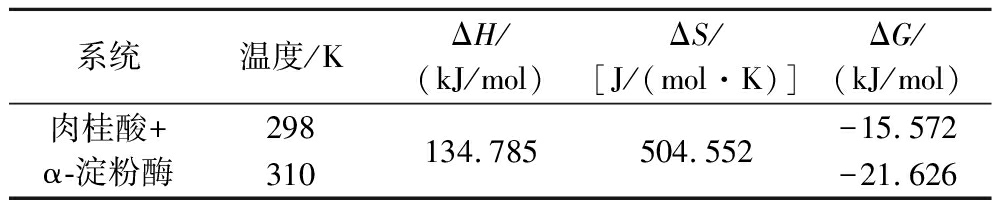
由表3可知,肉桂酸与α-淀粉酶在298 K和310 K下ΔG均小于0,证明该反应在自然条件下能够自发进行[35]。肉桂酸与α-淀粉酶相互作用的ΔH为134.785 kJ/mol,ΔS为504.552 J/(mol·K),均大于0,表明肉桂酸与α-淀粉酶的主要驱动力为疏水作用,但不排除其他作用力的存在。此外,ΔH>0表示肉桂酸与α-淀粉酶发生反应时会出现吸热现象[34],即温度的升高有利于其发生反应,这与表2中温度升高会使得肉桂酸与α-淀粉酶的结合常数升高的变化趋势相吻合。
表3 肉桂酸与α-淀粉酶相互作用的热力学参数
Table 3 Thermodynamic parameters of the interaction between cinnamic acid and α-amylase
系统温度/KΔH/(kJ/mol)ΔS/[J/(mol·K)]ΔG/(kJ/mol)肉桂酸+α-淀粉酶298310134.785504.552-15.572-21.626
2.4 分子对接
分子对接技术可作为研究分子间相互作用的重要手段。该模拟技术通过分子间的空间匹配和能量匹配,预测抑制剂和酶之间的结合位点、结合模式和结合能等信息[36],增强对分子间相互作用的理解,为潜在的治疗干预提供有价值的见解。
据报道,当结合能ΔG≤-5 kcal/mol,表明2种物质能够在自然状态下进行结合。肉桂酸与α-淀粉酶最佳构象的结合能为-23.263 kJ/mol,表明肉桂酸与α-淀粉酶对接较好。该结合能略低于SYAMA等[37]的研究结果(-4.88 kcal/mol),显示肉桂酸对酶表现出适度的结合亲和力。同时,SYAMA等[37]通过对比肉桂酸、阿卡波糖与α-淀粉酶的结合能得出,肉桂酸对α-淀粉酶的抑制作用低于阿卡波糖。故后续研究可进一步通过抑制剂复配等手段开发与阿卡波糖抑制能力相当的天然酶抑制剂。
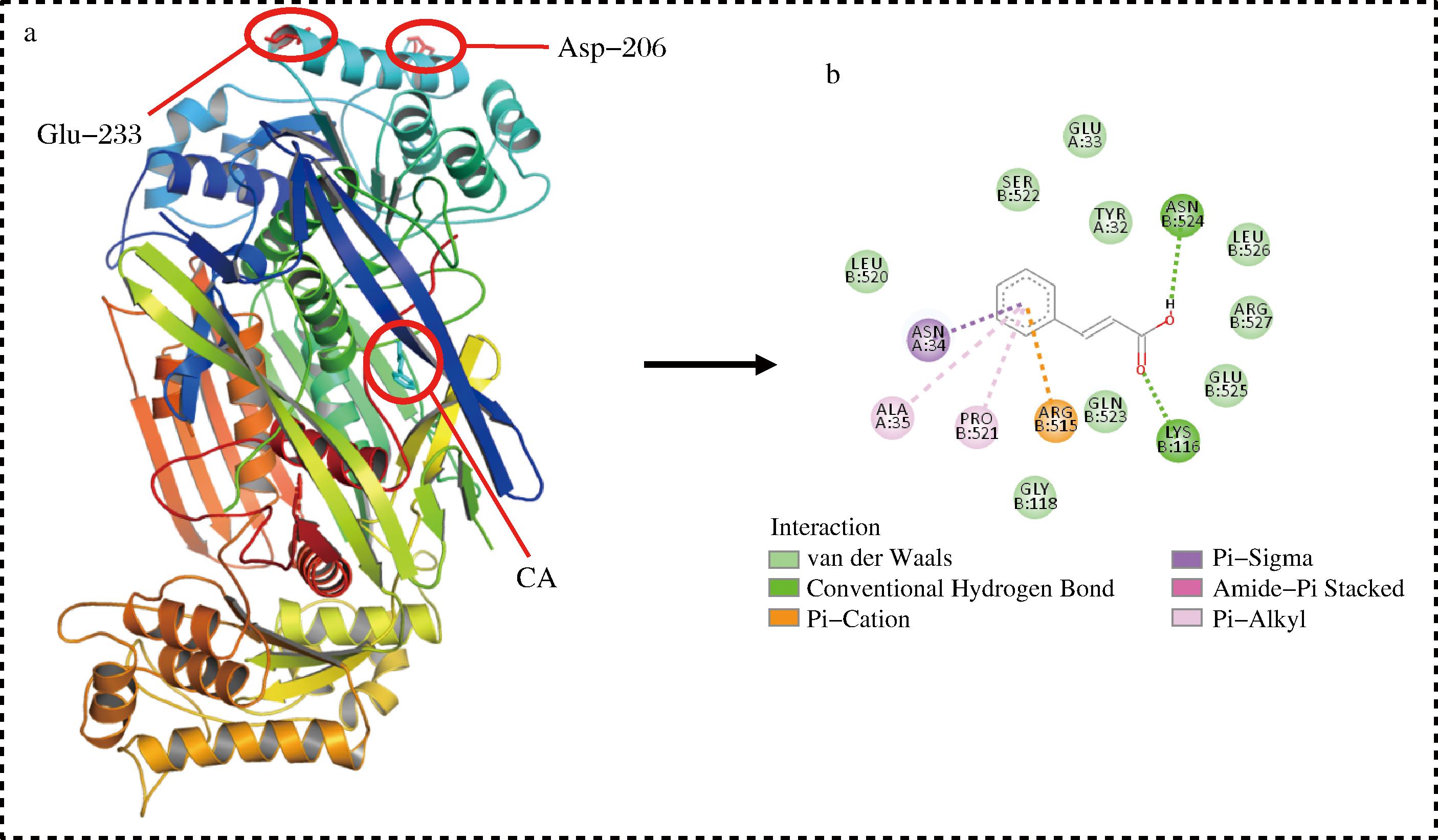
肉桂酸与α-淀粉酶的分子对接结果如图6所示。图6-a中显示,肉桂酸距离α-淀粉酶的活性催化位点(Asp-206、Glu-233)距离较远,推测肉桂酸对α-淀粉酶的抑制属于非竞争性抑制。TOLMIE等[38]也证实,肉桂酸对α-淀粉酶具有非竞争性抑制作用。在没食子酸对α-淀粉酶的抑制研究中也发现了类似的结果[39]。如图6-b所示,肉桂酸与α-淀粉酶的LYS-116、ASN-524残基形成氢键。该结果在SYAMA等[37]的研究中得到了证实。有研究指出,氢键数目越多、平均键长越短,则越有利于反应发生,反之则不利于二者的结合[34]。肉桂酸与LEU-520、SER-522、GLU-33、TYR-32、LEU-526、ARG-527、GLU-525、GLN-523、GLY-118之间存在范德华力;除此之外,亦观察到π-烷基、π-σ、π-阳离子相互作用,这些高度共轭的π -体系也与抑制酶活性有关[40]。YU等[22]也证实肉桂酸的苯环结构能够与α-淀粉酶的氨基酸残基形成共轭π-体系,这种相互作用是其抑制机制的关键因素之一。结合表3的热力学参数和分子对接结果来看,除疏水相互作用外,范德华力、氢键等作用力也是肉桂酸与α-淀粉酶分子维持稳定的重要因素。
a-分子对接三维图;b-相互作用二维表征
图6 肉桂酸和α-淀粉酶的分子对接
Fig.6 Molecular docking of cinnamic acid and α-amylase
注:CA-肉桂酸。
3 结 论
肉桂酸通过疏水作用、范德华力、氢键等相互作用与α-淀粉酶形成1个结合位点,进而对α-淀粉酶的活性具有一定的抑制作用,并通过静态猝灭机制对α-淀粉酶的固有荧光产生猝灭效应。表明肉桂酸在抑制α-淀粉酶活性方面具有一定的潜力,为自然资源中酶抑制剂的挖掘提供新的见解,也为糖尿病的预防及治疗奠定理论基础。
本研究未解析肉桂酸的具体抑制类型,在后续工作中将设计更系统的动力学实验,并结合分子对接技术,以进一步完善机制解析。此外,α-淀粉酶分解长链碳水化合物、α-葡萄糖苷酶将淀粉和双糖分解成葡萄糖,两者具有协同作用。因此,为了更好地确定肉桂酸在降血糖方面的潜力,后续也应开展其对α-葡萄糖苷酶抑制作用的相关研究。同时,也可通过与其他天然抑制剂复配以提高其抑制效果,为2型糖尿病患者功能食品的开发奠定理论基础。
[1] OLOKOBA A B, OBATERU O A, OLOKOBA L B.Type 2 diabetes mellitus:A review of current trends[J].Oman Medical Journal, 2012, 27(4):269-273.
[2] WILKE T, BOETTGER B, BERG B, et al.Epidemiology of urinary tract infections in type 2 diabetes mellitus patients:An analysis based on a large sample of 456, 586 German T2DM patients[J].Journal of Diabetes and Its Complications, 2015, 29(8):1015-1023.
[3] HUANG Y Y, CONDICT L, RICHARDSON S J, et al.Exploring the inhibitory mechanism of p-coumaric acid on α-amylase via multi-spectroscopic analysis, enzymatic inhibition assay and molecular docking[J].Food Hydrocolloids, 2023, 139:108524.
[4] TUNDIS R, LOIZZO M R, MENICHINI F.Natural products as alpha-amylase and alpha-glucosidase inhibitors and their hypoglycaemic potential in the treatment of diabetes:An update[J].Mini Reviews in Medicinal Chemistry, 2010, 10(4):315-331.
[5] GROMOVA L V, FETISSOV S O, GRUZDKOV A A.Mechanisms of glucose absorption in the small intestine in health and metabolic diseases and their role in appetite regulation[J].Nutrients, 2021, 13(7):2474.
[6] ROUZBEHAN S, MOEIN S, HOMAEI A, et al.Kinetics of α-glucosidase inhibition by different fractions of three species of Labiatae extracts:A new diabetes treatment model[J].Pharmaceutical Biology, 2017, 55(1):1483-1488.
[7] PROENÇA C, FREITAS M, RIBEIRO D, et al.Evaluation of a flavonoids library for inhibition of pancreatic α-amylase towards a structure-activity relationship[J].Journal of Enzyme Inhibition and Medicinal Chemistry, 2019, 34(1):577-588.
[8] CHOUDHURY H, PANDEY M, HUA C K, et al.An update on natural compounds in the remedy of diabetes mellitus:A systematic review[J].Journal of Traditional and Complementary Medicine, 2017, 8(3):361-376.
[9] 张涛, 马麦迈, 卢顺, 等.枸杞叶多糖结构表征及体外抗氧化与酶活抑制活性评价[J].中国食品学报, 2024, 24(11):59-70.ZHANG T, MA M M, LU S, et al.Structural characterization and evaluation of antioxidant and enzyme activity of Lycium barbarum leaves polysaccharide in vitro[J].Journal of Chinese Institute of Food Science and Technology, 2024, 24(11):59-70.
[10] 刘俊. 不同品种山楂原花青素的提取优化、理化性质、抗氧化活性和抗糖作用 [D].保定:河北大学,2024.LIU J.Different hawthorn varieties, proanthocyanidins extration optimization, antioxidant activity, and research on α-glucosidase/α-amylase inhibitory [D].Baoding:Hebei University, 2024.
[11] 马晓婷. 黄秋葵果胶抑制小麦淀粉消化的作用机理及其在酥性饼干中的应用 [D].泰安:山东农业大学,2024.MA X T.Mechanism of okra pectin inhiting wheat starch digestion and its application in cookies-making[D].Tai’an:Shandong Agricultural University, 2024.
[12] MOHAMED SHAM SHIHABUDEEN H, HANSI PRISCILLA D, THIRUMURUGAN K.Cinnamon extract inhibits α-glucosidase activity and dampens postprandial glucose excursion in diabetic rats[J].Nutrition &Metabolism, 2011, 8(1):46.
[13] RUWIZHI N, ADERIBIGBE B A.Cinnamic acid derivatives and their biological efficacy[J].International Journal of Molecular Sciences, 2020, 21(16):5712.
[14] 甘传发. 姜黄素、芹菜素和儿茶素与生物代谢酶作用特性研究 [D].洛阳:河南科技大学,2022.GAN C F.Study on the interaction characteristics of curcumin, apigenin and catechin with biological metabolic enzymes [D].Luoyang:Henan University of Science and Technology, 2022.
[15] 王振. 多酚与胃蛋白酶相互作用的研究 [D].郑州:河南工业大学,2021.WANG Z.Study on the interaction between polyphenols and pepsin [D].Zhengzhou:Henan University of Technology, 2021.
[16] GUNNY A A N, SUBRAMANIAN P, MAHMOD S S, et al.Mechanism of inhibition of alpha-amylase by caffeic acid using in-vitro and in-silico techniques[J].Natural Product Research, 2024:1-5.
[17] ANJALI, SADAF A, KHARE S K.Evaluation of trans-cinnamaldehyde as an anti-hyperglycemic compound through inhibition of α- amylase [J].Indian Journal of Biochemistry &Biophysics, 2022, 59(2):183-188.
[18] ADISAKWATTANA S, CHANTARASINLAPIN P, THAMMARAT H, et al.A series of cinnamic acid derivatives and their inhibitory activity on intestinal α-glucosidase[J].Journal of Enzyme Inhibition and Medicinal Chemistry, 2009, 24(5):1194-1200.
[19] MENSHAZ A, ALTUNER E M.The potential of some plant-derived compounds in inhibition of α-amylase, important for diabetic patients [J].Fresenius Environmental Bulletin, 2020, 29(9A):8642-8646.
[20] DE SOUZA P M, DE OLIVEIRA MAGALH ES P.Application of microbial α-amylase in industry - A review[J].Brazilian Journal of Microbiology, 2010, 41(4):850-861.
ES P.Application of microbial α-amylase in industry - A review[J].Brazilian Journal of Microbiology, 2010, 41(4):850-861.
[21] MOKHELE M S, TSWALEDI D, ABOYADE O, et al.Investigation of Aloe fero x leaf powder on anti-diabesity activity[J].South African Journal of Botany, 2020, 128:174-181.
[22] YU M H, ZHU S, HUANG D J, et al.Inhibition of starch digestion by phenolic acids with a cinnamic acid backbone:Structural requirements for the inhibition of α-amylase and α-glucosidase[J].Food Chemistry, 2024, 435:137499.
[23] OLAOKUN O O, MCGAW L J, ELOFF J N, et al.Evaluation of the inhibition of carbohydrate hydrolysing enzymes, antioxidant activity and polyphenolic content of extracts of ten African Ficus species (Moraceae) used traditionally to treat diabetes[J].BMC Complementary and Alternative Medicine, 2013, 13:94.
[24] SHEN H Y, WANG J, AO J F, et al.The inhibitory mechanism of pentacyclic triterpenoid acids on pancreatic lipase and cholesterol esterase[J].Food Bioscience, 2023, 51:102341.
[25] LI X, CAI J J, YU J L, et al.Inhibition of in vitro enzymatic starch digestion by coffee extract[J].Food Chemistry, 2021, 358:129837.
[26] 沈荷玉, 李梦阳, 敖婧芳, 等.没食子酸对α-淀粉酶和α-葡萄糖苷酶的抑制作用及机理[J].食品科学, 2023, 44(22):31-38.SHEN H Y, LI M Y, AO J F, et al.Inhibitory effect and mechanism of Gallic acid on α-amylase and α-glucosidase activities[J].Food Science, 2023, 44(22):31-38.
[27] HAN L, FANG C, ZHU R X, et al.Inhibitory effect of phloretin on α-glucosidase:Kinetics, interaction mechanism and molecular docking[J].International Journal of Biological Macromolecules, 2017, 95:520-527.
[28] PAYAKA A, MANSALAI P, SANSENYA S.Synergic effect of phenolic compounds by concentration dependence of andrographolide against carbohydrate digestive enzyme (α-glucosidase and α-amylase) by in vitro, in silico, and fluorescence analysis[J].International Journal of Food Science and Technology, 2025, 60(1):vvae009.
[29] DAI T T, LI T, HE X H, et al.Analysis of inhibitory interaction between epigallocatechin gallate and alpha-glucosidase:A spectroscopy and molecular simulation study[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2020, 230:118023.
[30] JING H J, HUANG X, JIANG C, et al.Effects of tannic acid on the structure and proteolytic digestion of bovine lactoferrin[J].Food Hydrocolloids, 2021, 117:106666.
[31] AKHAVAN T, EBRAHIMI M, HEKMAT A.Structural evidence for kinetic and thermal stability changes of α-amylase due to exposure to [emim] [lactate] ionic liquid[J].Turkish Journal of Biochemistry, 2020, 45(6):785-791.
[32] ZHANG G W, MA Y D, WANG L, et al.Multispectroscopic studies on the interaction of maltol, a food additive, with bovine serum albumin[J].Food Chemistry, 2012, 133(2):264-270.
[33] WU X Q, DING H F, HU X, et al.Exploring inhibitory mechanism of gallocatechin gallate on α-amylase and α-glucosidase relevant to postprandial hyperglycemia[J].Journal of Functional Foods, 2018, 48:200-209.
[34] 杨玉娇. 凤眼果壳酚类化合物的鉴定及抑制淀粉消化酶和调控肠道葡萄糖吸收的机制研究 [D].广州:华南理工大学,2022.YANG Y J.Identification of phenolics from sterculia nobilis smithpericarp and study on mechanism of inhibiting starchdigestive enzyme and regulating intestinal glucoseabsorption [D].Guangzhou:South China University of Technology, 2022.
[35] YANG J C, WANG X L, ZHANG C Y, et al.Comparative study of inhibition mechanisms of structurally different flavonoid compounds on α-glucosidase and synergistic effect with acarbose[J].Food Chemistry, 2021, 347:129056.
[36] STANZIONE F, GIANGRECO I, COLE J C.Chapter Four Use of molecular docking computational tools in drug discovery[J].Progress in Medicinal Chemistry, 2021, 60:273-343.
[37] SYAMA H P, ARUN K B, SINUMOL G, et al.Syzygium cumini seed exhibits antidiabetic potential via multiple pathways involving inhibition of α-glucosidase, DPP-IV, glycation, and ameliorating glucose uptake in L6 cell lines[J].Journal of Food Processing and Preservation, 2018, 42(2):e13464.
[38] TOLMIE M, BESTER M J, APOSTOLIDES Z.Inhibition of α-glucosidase and α-amylase by herbal compounds for the treatment of type 2 diabetes:A validation of in silico reverse docking with in vitro enzyme assays[J].Journal of Diabetes, 2021, 13(10):779-791.
[39] 邹加利, 吕俊丽, 云月英, 等.没食子酸对α-淀粉酶的抑制机理[J].食品工业科技,2025,46(20):107-113.ZOU J L, LYU J L, YUN Y Y, et al.Mechanism of α-amylase inhibition by gallic acid[J].Science and Technology of Food Industry,2025,46(20):107-113.
[40] PIPARO E L, SCHEIB H, FREI N, et al.Flavonoids for controlling starch digestion:Structural requirements for inhibiting human alpha-amylase[J].Journal of Medicinal Chemistry, 2008, 51(12):3555-3561.