环糊精(cyclodextrin,CD)是一种环状低聚糖,由于CD分子具有内部疏水、外部亲水的特性,使其能容纳与其大小和形状合适的疏水性分子或基团而形成包合物,改变这些被包埋物质的溶解度、挥发性及化学反应性能等理化性质,进而在食品[1]、制药、化妆品、农业、分析化学及环保等领域中有广泛的应用。CD通常由环糊精葡萄糖基转移酶(cyclodextrin glucosyltransferase,CGTases)转化淀粉制备。CGTase不能水解淀粉α-1,6-糖苷键,因此单独用CGTase处理时,靠近分支部分的淀粉不能被水解,只有一部分淀粉分子可以转化为CD。
为了提高CD生产的产量,工业上将CGTase与普鲁兰酶或异淀粉酶等脱支酶结合使用。在这种方法中,脱支和环化反应同步进行,能有效的缩短反应时间,提高淀粉的利用率,目前已有很多研究将淀粉脱支酶应用于CD的生产当中[2],但同时也会产生许多无法高效利用的短直链麦芽寡糖,因此希望寻找一种新型脱支酶来解决这些问题。许多物种的糖原脱支酶(glycogen debranching enzyme,GDE)已被纯化和表征,如猪脑GDE、鸡胸肌GDE、角鲨肌肉脱支酶、兔骨骼肌脱支酶、酵母脱支酶[3]。SHEN等[4]确定了光滑念珠菌(Candida glabrata)GDE (CgGDE)的晶体结构,揭示了CgGDE的活性位点,这为进一步探索GDE与其底物糖原之间的相互作用机制提供了依据。GDE在动物和真菌中高度保守,同时具有葡聚糖转移酶(α-1,4-glucanotransferase,GT)活性和葡萄糖苷酶(α-1,6-glucosidase,GC)活性,而细菌和植物中参与糖原或淀粉脱支的酶只具有GC活性[5]。
在典型的GDE中GT识别并切割支链上紧挨着分支点的α-1,4-糖苷键,并将切下的直链麦芽寡糖通过α-1,4-糖苷键转移到其他直链的末端,然后GC识别并水解分支点残留的α-1,6-糖苷键连接的葡萄糖,释放1分子葡萄糖[6],整个过程在完成脱支的同时还可以延长糖链,减少短直链的产生,这能更好地满足工业生产中对淀粉聚合度的需求。目前,国外已有学者注意到GDE的脱支活性并对其在淀粉的预处理和环状淀粉生产中的作用进行了研究[7],但对其在淀粉加工应用上的报道较少,而且在目前的工艺中,常使用有机试剂以提高产物特异性、减弱产物抑制,这伴随着成本的提升和环境的污染。因此,在非溶剂条件下,探索能够与CGTase结合生产CD的GDE具有很高的工业意义。
本研究选取来源于Candida glabrata的GDE基因,构建了重组大肠杆菌Escherichia coli BL21(DE3)/p ET-24a(+)-cggde,在摇瓶中进行培养,得到了GDE的粗酶液,并对其酶学性质进行了测定。同时,将GDE应用于β-CD的制备,对酶转化工艺进行了优化,旨在获得高效、低成本、无污染生产β-CD的方法,开发GDE在淀粉加工工艺中的应用。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
菌株E.coli JM109、E.coli BL 21(DE3)、载体pET-24a(+)均为本实验室保藏。来源于C.glabrata的糖原脱支酶CgGDE(GenBank ID:CP048124.1)的编码基因由无锡塞索飞生物科技物有限公司合成并连接至pET-24a(+)载体。
1.1.2 化学品和试剂
蛋白胨、酵母粉,英国Oxoid公司;支链淀粉,上海维塔化学试剂有限公司;IPTG、卡那霉素,上海生工生物工程有限公司;α-CD、β-CD、γ-CD,美国Sigma-Aldrich公司;质粒提取试剂,康为世纪生化科技公司;蛋白胶配制试剂盒,南京诺唯赞生物科技股份有限公司;标准分子质量蛋白Marker、DNA Marker,宝生物工程(大连)有限公司;其他化学品,国药集团化学试剂有限公司。
1.2 仪器与设备
Waters 1525高效液相色谱仪、2414 RID示差检测器,美国沃特世公司;HYPERSIL APS2(250 mm×4.6 mm,5 μm)色谱柱、Dionex ICS-5000 HPIC高压离子色谱仪系统,美国赛默飞公司。
1.3 实验方法
1.3.1 克隆和表达
CgGDE基因的密码子根据大肠杆菌宿主的偏好进行了优化。通过在pET24a(+)载体的Nde I和Hind Ⅲ位点之间插入相应的基因,构建了CgGDE的表达载体。在重组蛋白的C端添加His-tag标记序列。将含有重组蛋白表达质粒的E.coli BL21(DE3)转化株在37 ℃的LB培养基中培养12 h至对数生长。然后将细菌细胞以体积分数为5%的接种量转移到TB培养基中,用0.1 mmol/L IPTG溶液诱导36 h以表达蛋白。离心上清液即为GDE粗酶液。
1.3.2 酶活力测定方法
GDE活力的测定根据王亚梅[8]报道的方法,稍作修改。吸取700 μL 10 g/L的支链淀粉溶液于离心管中(20 mmol/L pH 6.0磷酸缓冲液悬浮溶解),然后加入150 μL缓冲液混匀后置于35 ℃水浴锅中保温10 min,在底物中加入150 μL经过适当稀释的GDE粗酶液反应10 min;反应结束后将反应产物沸水浴10 min终止反应,待冷却后吸取100 μL反应液于离心管中,加入100 μL 0.01 mol/L I2-0.1 mol/L KI静置显色15 min,加入4.8 mL去离子水,充分振荡混匀后于530 nm条件下测定吸光度值。以高温灭酶的粗酶液作为空白对照。一个酶活力单位(U):在50 ℃、pH 5.5条件下,1 min使吸光值增加0.01的酶量。
CGTase生成β-CD的酶活力检测条件参考文献[9]。
1.3.3 酶学性质检测
参考文献[10]的方法。采用20 mmol/L磷酸缓冲液(pH 6.0)测量酶的最适温度和温度稳定性,25~65 ℃,每隔5 ℃测定CgGDE酶活力,确定酶的最适温度,将酶活力最高的计为100%,计算各温度下的相对酶活力;在20 mmol/L磷酸缓冲液(pH 6.0)中,将酶置于上述温度下保温6 h,测定残留酶活力以确定酶的热稳定性。
采用20 mmol/L磷酸缓冲液测量酶的最适pH和pH稳定性,测定不同pH值(4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0)下CgGDE酶活力,确定酶的最适pH,以酶活力最高的计为100%,计算其他pH条件下酶的相对酶活力;将酶在上述pH缓冲液中于4 ℃放置24 h后测量酶活力,测定残留酶活力以确定酶的pH稳定性。
1.3.4 CD的生产以及含量测定
用0.5 mol/L,pH 6.0的磷酸缓冲溶液配制质量浓度为150 g/L马铃薯淀粉悬浊液,并调整至所需pH,加入3.0 U/g干淀粉的β-CGTase,加热至70~80 ℃并搅拌液化20 min,冷却至反应温度后添加一定量的β-CGTase、GDE和体积分数为5%环己烷,充分混匀后在40 ℃、150 r/min水浴摇床中反应24 h。转化后的液体加热灭酶后,蒸馏液与纯乙腈按体积比1∶1混匀,静置2 h,12 000 r/min离心20 min,除去未转化的糊精,取10 μL上机分析。采用HPLC进行产物分析,色谱条件:Aps-2 Hypersil(4.6 mm×250 mm),柱温40 ℃,流动相为体积分数75%的乙腈,流速0.8 mL/min,检测器为示差折光检测器。转化率定义为生成的β-CD的质量比上底物的质量乘以100。
1.3.5 不同转化条件对CD生产的影响
底物种类影响:用pH 6.0的磷酸缓冲液分别配制质量浓度为50、100、150、200 g/L的马铃薯淀粉,β-CGTase加酶量为3 U/g干淀粉,控温70 ℃,搅拌液化20 min,加入7 U/g干淀粉的β-CGTase和750 U/g干淀粉的GDE,置于35 ℃水浴摇床中,150 r/min反应24 h后沸水浴10 min,终止反应,HPLC检测CD生成量。
GDE添加量影响:GDE加酶量分别为250、500、750、1 000、1 250 U/g干淀粉,β-CGTase和其他条件同上。
反应时间影响:选取在反应0~36 h定时取样后处理,考察不同时间CD生产情况。
反应pH影响:分别用pH 4.0、4.5、5.0、5.5、6.0、6.5、7.0的磷酸盐-柠檬酸缓冲液配制质量浓度为50 g/L的马铃薯淀粉,其余条件同上。
反应温度影响:酶反应分别在30、35、40、45、50 ℃下进行,其余条件同上考察反应温度对CD生产情况的影响。
1.3.6 聚合度分布测定
将样品稀释至0.5 g/L。使用高效离子色谱检测多糖中各大小组分分布状况,其检测条件为:DionexTM ICS-5000型离子色谱仪搭配PAD脉冲安培检测器,色谱柱CarboPac PA200,进样量10 μL,柱温保持在30 ℃。使用3种洗脱剂A(超纯水)、B(250 mmol/L NaOH)和C(1 mol/L CH3COONa和100 mmol/L NaOH),以0.5 mL/min的速度运行0~40 min的线性梯度,期间B从38%减少到24%,C从4%增加到40%。在40~41 min,B从24%增加到38%,C从40%减少到4%,之后洗脱液保持在38%的B和4%的C上9 min。
2 结果与分析
2.1 CgGDE的克隆表达
将重组质粒pET24a(+)-cggde转入E.coli BL21(DE3)感受态细胞,获得重组菌,经摇瓶发酵培养后离心收集上清液,测得上清液中CgGDE酶活力为69.3 U/mL。然后将上清液进行SDS-PAGE分析,如图1所示,在170 kDa左右有明显条带,与重组CgGDE的分子质量大小一致,表明重组CgGDE在大肠杆菌中成功表达。
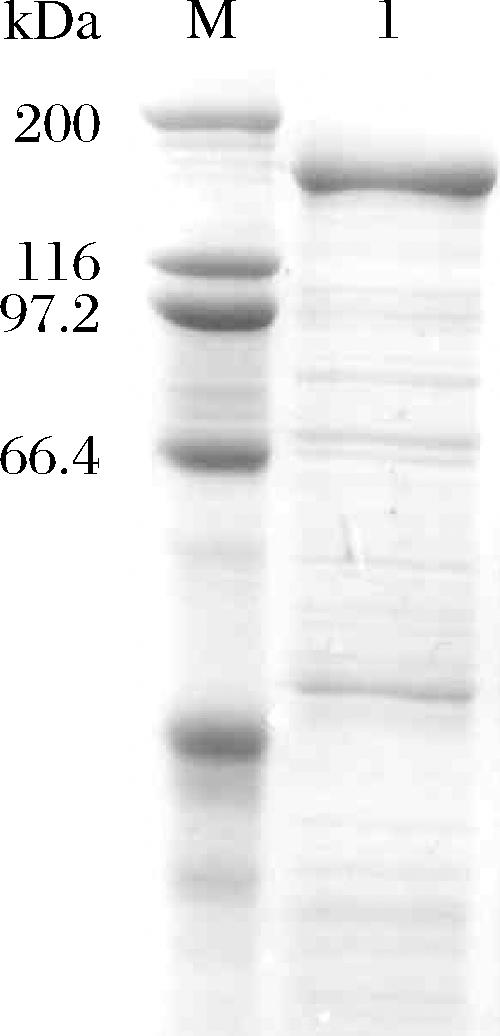
M-标准蛋白样品;1-重组酶CgGDE。
图1 重组CgGDE上清液SDS-PAGE图
Fig.1 Soluble fraction SDS-PAGE of recombinant CgGDE
2.2 重组CgGDE的酶学性质
为了研究重组CgGDE的最适温度和热稳定性,在不同温度下测定重组CgGDE的酶活力,结果如图2-a所示,在35 ℃时,酶活力最高,温度逐渐升高,酶活力迅速下降,说明CgGDE的最适温度为35 ℃,且在高温下活力较低。CgGDE在25~65 ℃下的热稳定性结果如图2-b所示,孵育6 h以后,在25~35 ℃时,残留酶活力能够维持在80%以上,稳定性良好,随着温度升高,残留酶活力越来越低,在高于40 ℃时,残留酶活力降至20%以下,表明该酶的耐热性能不好。
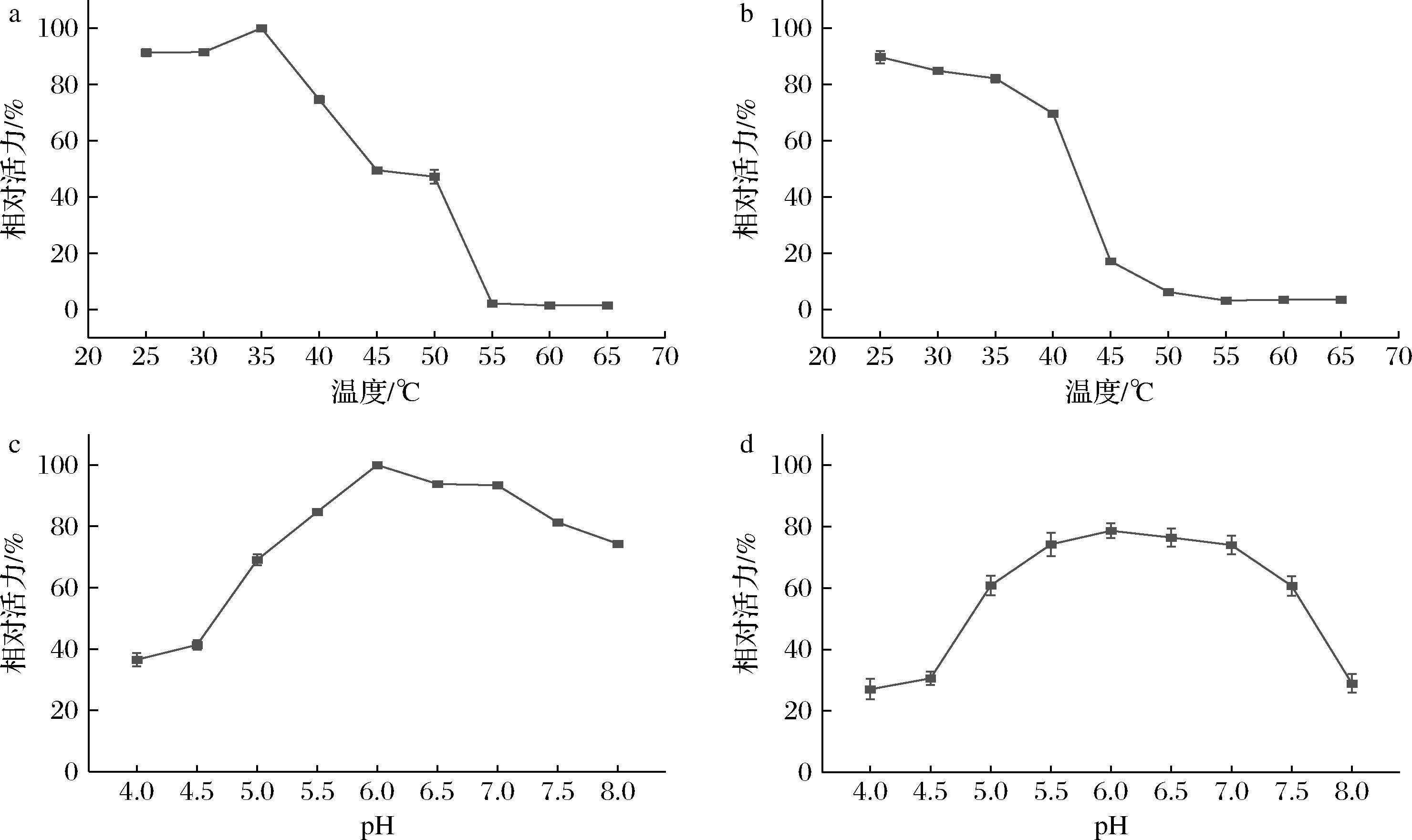
a-最适温度;b-温度稳定性;c-最适pH;d-pH稳定性
图2 重组CgGDE的酶学性质
Fig.2 Enzymatic properties of recombinant CgGDE
在pH 4.0~8.0确定重组酶的最佳pH。由图2-c可知,重组CgGDE在pH为6.0~7.0的范围内保持90%以上的相对活性,pH<5.0时酶活力降至50%以下。pH对酶活力稳定性(图2-d)显示,经过24 h保温后,pH值在5.5~7.0残留酶活力都保持在70%以上,表明该酶的活力在此pH范围内稳定性良好,适用于淀粉加工业。
2.3 GDE与β-CGTase复配制备β-CD
为探究多功能脱支酶在CD制备中的应用,本研究将β-CGTase分别与CgGDE和异淀粉酶进行复配,以体现GDE在β-CD制备中的优势。
2.3.1 底物质量浓度对β-CD生产的影响
工业生产中,底物质量浓度的增加往往导致产物转化率的降低,因此为探究合适的底物质量浓度,本研究选择50、100、150、200 g/L的马铃薯淀粉作为底物,保持其他条件不变,以考察马铃薯淀粉质量浓度对β-CD转化率的影响,结果如图3所示。在底物质量浓度为50 g/L时,添加GDE和异淀粉酶转化率最高,分别为50.6%和34.2%,随着马铃薯淀粉质量浓度的增大,虽然β-CD的产量有所提高,但CD转化率越来越低。后续选择质量浓度为50 g/L的底物。
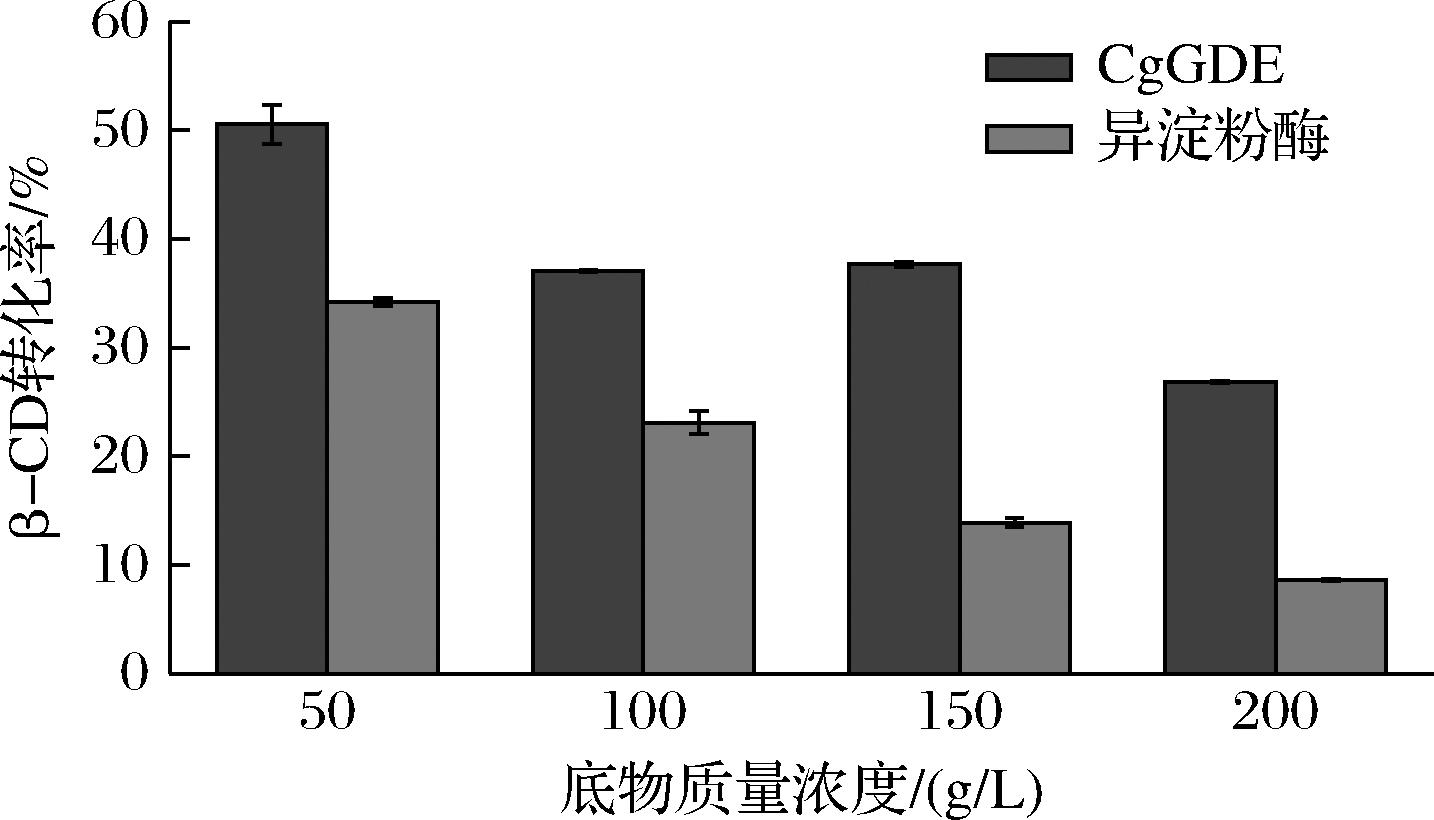
图3 淀粉浓度对β-CD转化率的影响
Fig.3 Effects of potato starch concentration on the conversion rate of β-CD
2.3.2 CgGDE加酶量对β-CD生产的影响
脱支酶的加酶量会影响其与β-CGTase的匹配效果,为了确定最适的加酶量,本实验考察了在不同加酶量下CD的转化率。如图4所示,CgGDE加酶量在750~1 250 U/g干淀粉时转化率变化不大,为节约成本考虑,选择加酶量750 U/g干淀粉,此时β-CD转化率为50.0%。异淀粉酶最优加酶量为50 U/g干淀粉,转化率为34.6%。
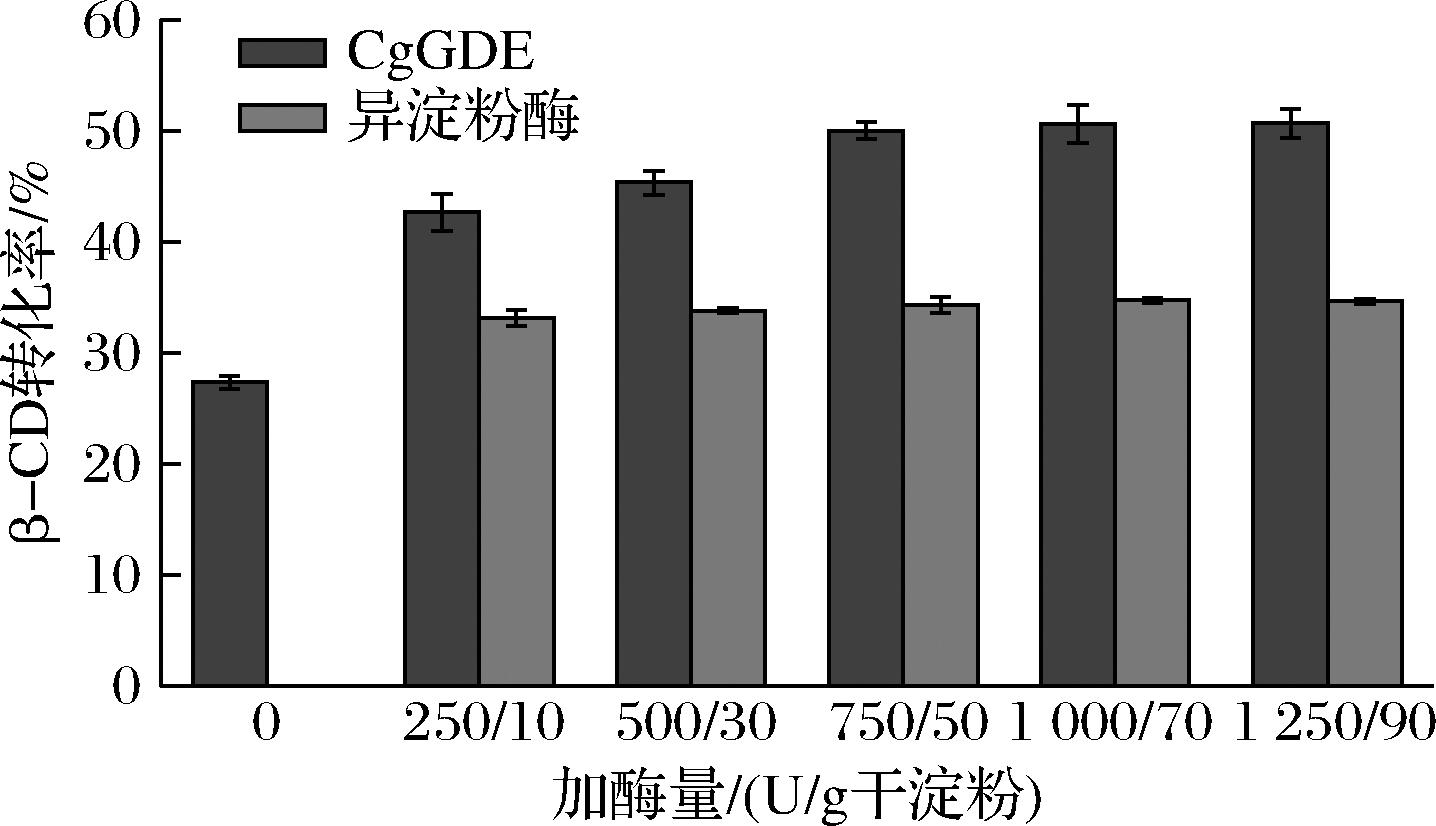
图4 加酶量对β-CD转化率的影响
Fig.4 Effects of enzyme dosage on the conversion rate of β-CD
注:250/10表示CgGDE加酶量为250 U/g干淀粉;异淀粉酶加酶量为10 U/g干淀粉。
2.3.3 反应时间对β-CD生产的影响
反应时间会影响CD的生产效率。时间过长,不仅会降低生产强度,还会发生偶合反应,导致副产物的增多;而转化时间太短,则会使CD得率太低。为考察转化β-CD的最适反应时间,将反应时间定为36 h,在0~36 h定时取样,结果如图5所示。随着转化时间的延长,β-CD转化率一直增加,直至24 h左右,达到平衡,此时转化率分别为49.6%和34.0%。
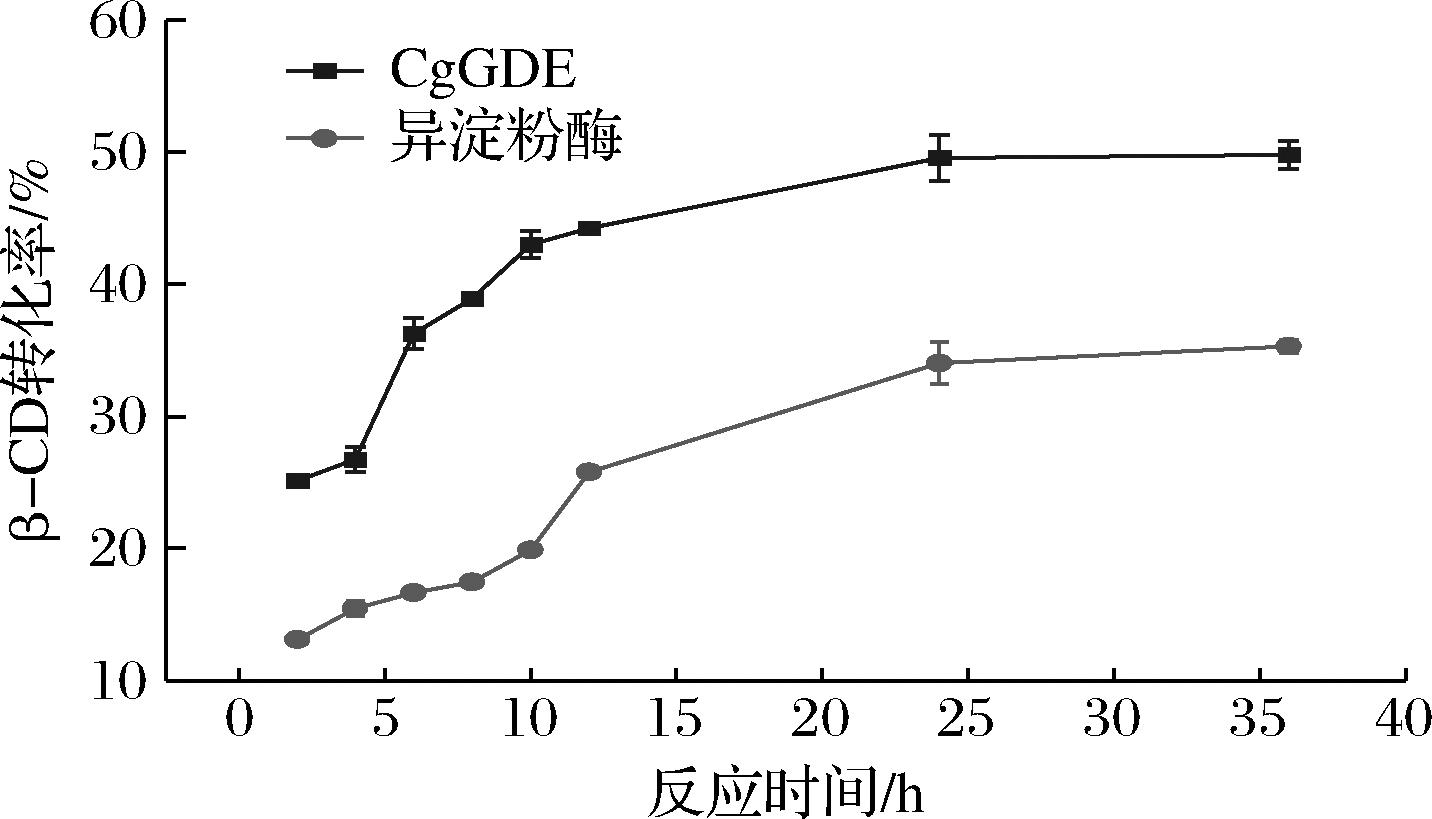
图5 转化时间对β-CD转化率的影响
Fig.5 Effect of time on the conversion rate of β-CD
2.3.4 反应pH对β-CD生产的影响
pH对酶的稳定性有很大影响,过高或过低pH都会改变酶活力中心的构象,使酶活力下降甚至失活[11],影响转化率。为考察制备β-CD的最适pH,分别在pH 4.0~7.0进行酶转化反应,保持其他条件不变。如图6所示,CgGDE在pH值为6.0时,β-CD转化率最高,为50.8%,高于其他pH条件下的转化率,且在pH 5.5~7.0,CD转化率均在40%以上,这主要是因为在上述pH范围内,CgGDE的活力较高;而当pH<5.5时,转化率较低。因此,将酶转化pH值定为6.0。而异淀粉酶在最适转化pH 5.5下的转化率仅为35.0%。
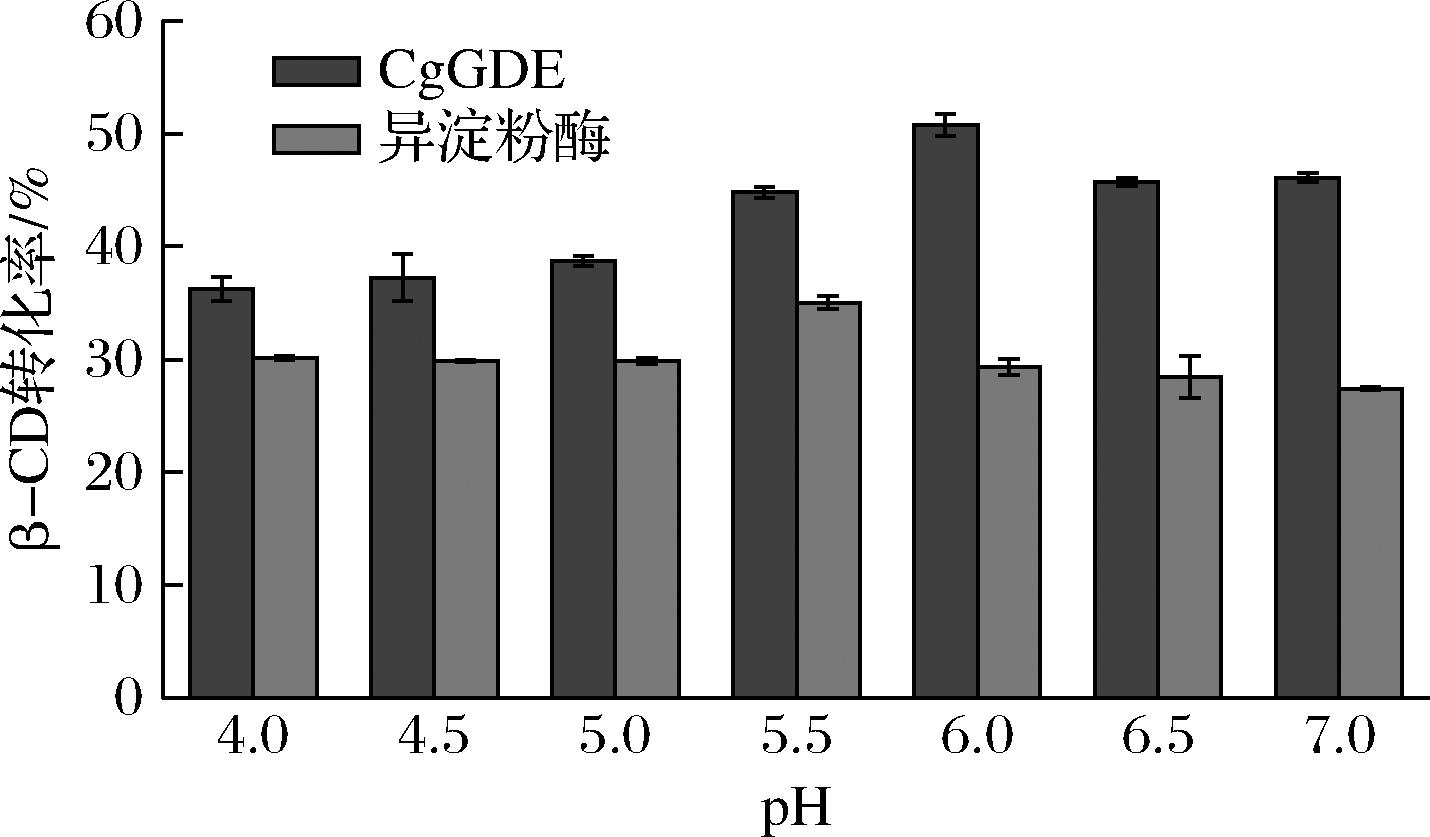
图6 pH对β-CD转化率的影响
Fig.6 Effects of pH on the conversion rate of β-CD
2.3.5 反应温度对β-CD生产的影响
酶催化反应速率存在最适反应温度,高于或低于最适酶催化反应温度,都会影响酶转化效率。为了探究温度对生成β-CD的影响,分别在30~50 ℃进行酶转化反应实验,结果发现,CgGDE和异淀粉酶均在催化温度为40 ℃时,生成β-CD的得率最大(图7),分别为53.1%和35.2%,而低于或者高于40 ℃时,β-CD得率都有所减少,因此选择在40 ℃制备CD。

图7 反应温度对β-CD转化率的影响
Fig.7 Effects of temperature on the conversion rate of β-CD
在非溶剂条件下,通过条件优化,在马铃薯淀粉质量浓度为50 g/L、温度40 ℃、反应pH 6.0、CgGDE添加量750 U/g干淀粉、β-CGTase添加量7 U/g干淀粉,转化周期24 h,β-CD转化率为53.1%,比单独使用β-CGTase转化率提高了93.8%,比复配异淀粉酶高了50.9%。
2.4 GDE与β-CGTase复配制备β-CD机理分析
为了验证GDE能否在一定程度上延长糖链,将经GDE处理和未处理的淀粉产物同时脱支后进行聚合度的对比,结果显示,添加GDE的样品高聚合度产物的含量明显增多(图8),表明GDE可以有效延长淀粉链。GDE酶与异淀粉酶相比,更能提升β-CGTase的CD转化率,可能是因为长糖链较短糖链更利于CD合成。
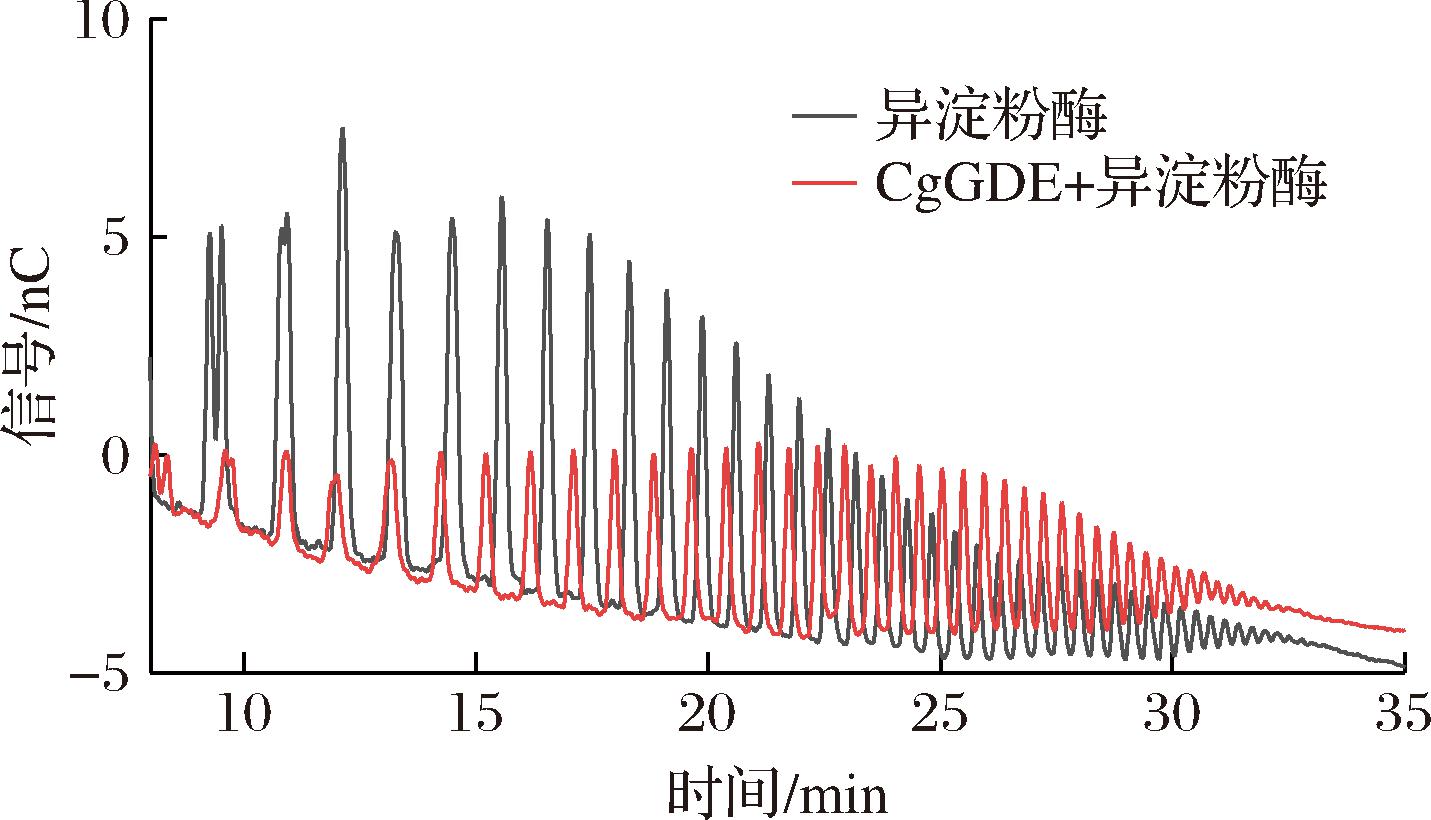
图8 不同酶处理方式的离子色谱检测结果
Fig.8 Ion chromatography detection results of different enzyme treatment methods
为进一步探究底物链长对β-CGTase产生β-CD的影响,以不同聚合度的麦芽寡糖和不同液化程度的麦芽糊精为底物,分别检测单酶和双酶复配条件下的β-CD产量,结果如图9所示,单酶反应时,β-CGTase对聚合度更高的麦芽寡糖和适当液化程度糊精转化率更高,对于双酶复配,仅具有脱支作用的异淀粉酶在以葡萄糖当量2~3的麦芽糊精为底物时表现较好,而GDE则对葡萄糖当量6~8麦芽糊精转化率最高,对葡萄糖当量2~3的麦芽糊精转化率稍有降低,但仍高于异淀粉酶组。这可能是因为GDE在脱支时同时具有延长糖链的作用(图8),因此GDE对底物聚合度要求降低,在GDE参与CD制备时,可放宽对淀粉的液化要求。
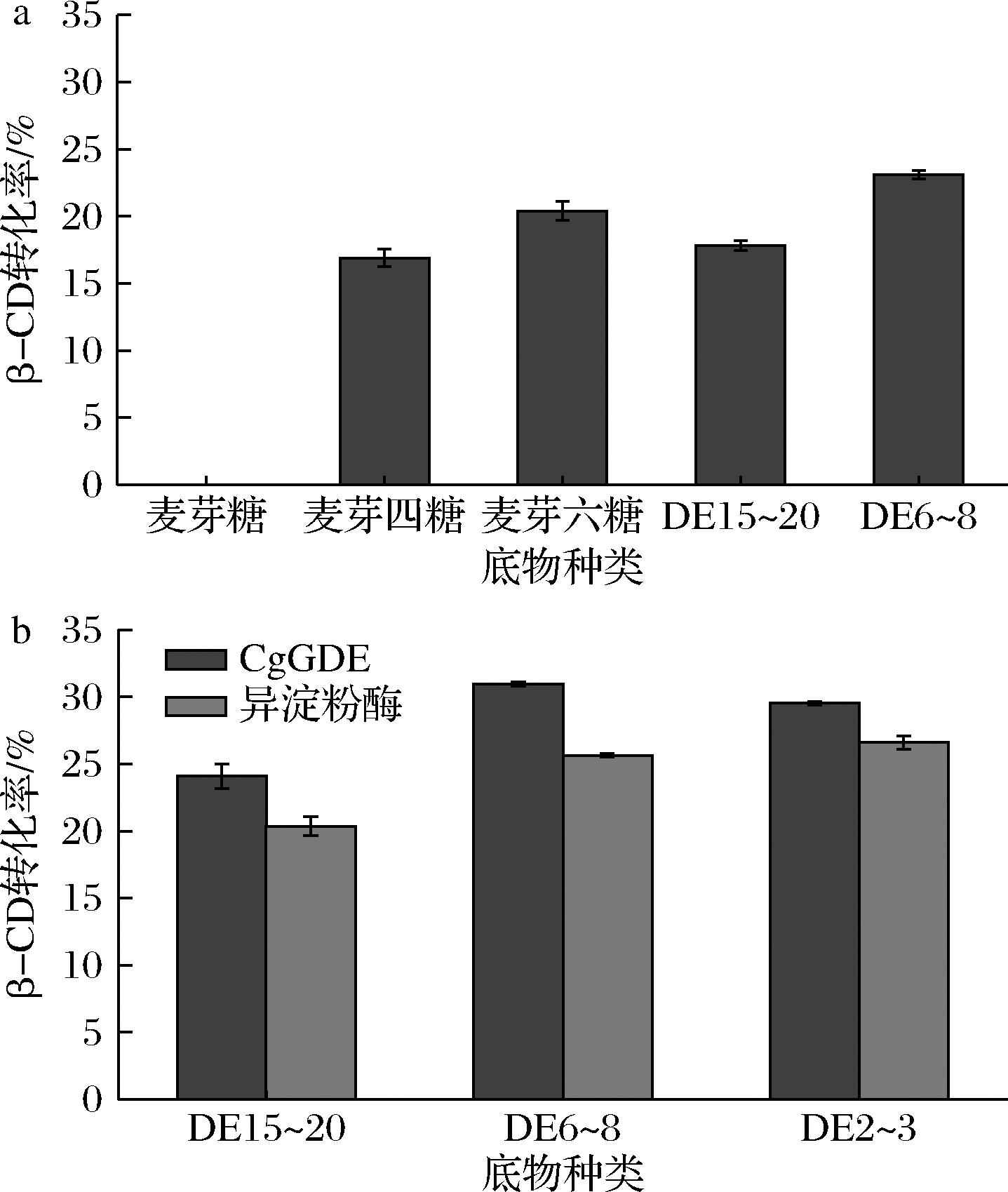
a-不同底物对单酶制备环糊精的影响;b-不同底物对双酶制备环糊精的影响
图9 不同底物下β-CD的产率
Fig.9 Yield of β-CD under different substrates
3 结论与讨论
目前,淀粉脱支酶在淀粉加工工业中具有广阔的应用前景,已经被应用于葡萄糖浆、麦芽糖浆、海藻糖、CD、分支环糊精、抗性淀粉、焙烤、酿酒和洗涤剂等淀粉加工领域[12]。大多数分支酶仅含有水解支链淀粉α-1,6-糖苷键的功能,而GDE同时包含水解和转苷2种不同的酶活力,能在水解α-1,6-糖苷键完成脱支的同时,通过转苷反应延长糖链,从而更好满足特定工业产品及工艺的需求。目前,国内有学者证明在液化阶段整合溶脂酵母STB09的GDE是提高β-CD收率的最有效策略,提高了43.9%[13]。国外学者SUKSIRI等[14]通过使用谷氨酸棒杆菌的GDE进行淀粉预处理,提高了淀粉麦芽糖酶的大环环糊精产量,且与商业异淀粉酶相比,GDE的孵育时间更短,并且产生的副产物更少。推测其原因可能是由于在淀粉预处理过程中,GDE通过转苷反应延长糖链,从而提高淀粉的利用率且降低副产物的产生,达到较高的转化率。
总的来说,本研究成功获得了能够分泌表达GDE的重组E.coli BL21(DE3)菌株,初步实验表明重组菌发酵上清液中GDE酶活力可达69.3 U/mL,最适温度为35 ℃,最适pH值为6.0。分别使用GDE和异淀粉酶与β-CGTase复配反应来提高淀粉转化效率。结果表明,底物种类、底物质量浓度、反应时间、加酶量、反应温度及pH对CD的转化率都有不同程度的影响。在非溶剂条件下,GDE复配体系中生物转化的β-CD转化率可达53.1%,比单独使用β-CGTase时高出近93.8%,而异淀粉酶仅为35.2%。该工艺相较之前的研究,降低了生产原料成本,提高了非溶剂条件下β-CD的转化率,减少了工业生产中有机试剂的污染,这为GDE应用于现代工业生产,以提高淀粉原料利用率和生产效率奠定了基础。
[1] 李光辉. 环糊精包合物的制备方法及其在食品工业中的应用[J].食品安全导刊, 2023(7):151-153.LI G H.Preparation of cyclodextrin inclusion compounds and their application in the food industry[J].China Food Safety Magazine, 2023(7):151-153.
[2] LI X X, JI H Y, BAI Y X, et al.Development of pullulanase mutants to enhance starch substrate utilization for efficient production of β-CD[J].International Journal of Biological Macromolecules, 2021, 168:640-648.
[3] TABATA S, HIZUKURI S.Properties of yeast debranching enzyme and its specificity toward branched cyclodextrins[J].European Journal of Biochemistry, 1992, 206(2):345-348.
[4] SHEN M M, GONG X X, XIANG S.Crystal structures of glycogen-debranching enzyme mutants in complex with oligosaccharides[J].Acta Crystallographica.Section F, Structural Biology Communications, 2021, 77(Pt 11):420-426.
[5] ZMASEK C M, GODZIK A.Phylogenomic analysis of glycogen branching and debranching enzymatic Duo[J].BMC Evolutionary Biology, 2014, 14(1):183.
[6] DITTMER K E, PRADHAN P, TOMPKINS Q C, et al.Cloning and characterization of glycogen branching and debranching enzymes from the parasitic protist Trichomonas vaginalis[J].Biochimie, 2021, 186:59-72.
[7] YANASE M, TAKATA H, TAKAHA T, et al.Cyclization reaction catalyzed by glycogen debranching enzyme (EC 2.4.1.25/EC 3.2.1.33) and its potential for cycloamylose production[J].Applied and Environmental Microbiology, 2002, 68(9):4233-4239.
[8] 王亚梅. 来源于Thermococccus gammatolerans糊精脱支酶的分泌表达,酶学性质表征与晶体结构解析[D].无锡:江南大学,2022.WANG Y M.Secretion expression, enzymatic properties and crystal structure analysis of dextrin debranching enzyme from Thermococccus gammatolerans[D].Wuxi:Jiangnan University, 2022.
[9] 孔德民, 左方圆, 吴敬, 等.Bacillus stearothermophilus NO2环糊精葡萄糖基转移酶Leu277突变提高α-环糊精产量[J].食品与发酵工业, 2023, 49(15):1-7.KONG D M, ZUO F Y, WU J, et al.Improvement of α-cyclodextrin yield by mutants of Leu277 about CGTase from Bacillus stearothermophilus NO2[J].Food and Fermentation Industries, 2023, 49(15):1-7.
[10] 杨玉路, 王蕾, 陈晟, 等.重组β-环糊精葡萄糖基转移酶生产β-环糊精的工艺条件优化[J].生物技术通报, 2014, 30(8):175-181.YANG Y L, WANG L, CHEN S, et al.Optimization of β-cyclodextrin production by recombinant β-cyclodextrin glycosyltransferase[J].Biotechnology Bulletin, 2014, 30(8):175-181.
[11] ATANASOVA N, KITAYSKA T, BOJADJIEVA I, et al.A novel cyclodextrin glucanotransferase from alkaliphilic Bacillus pseudalcaliphilus 20RF:Purification and properties[J].Process Biochemistry, 2011, 46(1):116-122.
[12] ZHANG H X, JIN Z Y.Preparation of resistant starch by hydrolysis of maize starch with pullulanase[J].Carbohydrate Polymers, 2011, 83(2):865-867.
[13] WANG L X, CHEN S D, LI C M, et al.Enhancement of β-cyclodextrin production using a glycogen debranching enzyme from saccharolobus solfataricus STB09[J].Journal of Agricultural and Food Chemistry, 2024, 72(12):6491-6499.
[14] SUKSIRI P, ISMAIL A, SIRIRATTANACHATCHAWAN C, et al.Enhancement of large ring cyclodextrin production using pretreated starch by glycogen debranching enzyme from Corynebacterium glutamicum[J].International Journal of Biological Macromolecules, 2021, 193:81-87.