2型糖尿病(type 2 diabetes,T2DM)是一种由遗传缺陷、生活方式及环境等多因素共同作用引发的慢性代谢性疾病,其病理特征表现为糖代谢紊乱、肥胖,并最终导致胰岛素抵抗和胰岛素分泌不足[1]。α-葡萄糖苷酶是一种位于小肠上皮细胞内的跨膜酶,可水解含α-糖苷键的底物(如淀粉、蔗糖),释放葡萄糖并升高餐后血糖水平[2]。抑制α-葡萄糖苷酶活性是当前治疗T2DM的策略之一,通过延缓小肠对葡萄糖的吸收以降低餐后血糖[3]。目前临床公认的α-葡萄糖苷酶抑制剂类药物包括阿卡波糖(acarbose)和米格列醇(miglitol)[4],但存在引发肥胖、肝毒性或胃肠道疾病等副作用的风险[5]。因此寻找安全高效的天然α-葡萄糖苷酶抑制剂具有重要意义[6]。
青钱柳(Cyclocarya paliurus),又名“甜茶树”或“摇钱树”,是中国南方特有的单型属植物,民间常用青钱柳嫩叶作茶饮,调控高血压和糖尿病[7],青钱柳叶提取物具有良好的降血糖作用且副作用小,是α-葡萄糖苷酶抑制剂的重要来源[8],其生物活性成分及药理机制尚未明确,青钱柳在疾病防治中的临床应用受到较大限制。传统方法从复杂粗提物中分离活性成分耗时耗力[9],近年来磁性微球固定化酶技术被广泛用于从复杂粗提物中捕获潜在活性成分,如α-葡萄糖苷酶偶联磁性纳米颗粒筛选淫羊藿叶活性成分[10],磁性纳米颗粒具有固有磁性,在外加磁场中可便捷分离与调控[11],该特性使磁性微球固定化酶技术成为筛选天然产物生物活性成分的重要方法[12]。
本研究建立了一种基于固定化酶-配体结合亲和特性联合超高效液相色谱-四极杆-飞行时间串联质谱(ultra-high performance liquid chromatography-quadrupole-time-of-flight tandem mass spectrometry, UHPLC-Q-TOF/MS)联用技术的活性化合物筛选方法,用于青钱柳提取物中α-葡萄糖苷酶抑制剂的快速发现与鉴定。通过戊二醛交联法将α-葡萄糖苷酶固定于磁性微粒表面,经单因素试验优化获得最佳固定化参数。基于构建的固定化酶反应体系,首先通过人工混合溶液模型验证方法可行性,随后应用于青钱柳提取物的活性成分筛选。通过UHPLC-Q-TOF/MS对筛选获得的活性配体进行快速结构表征,结合体外酶抑制实验验证其生物活性,该方法具有高特异性、高灵敏度及易分离性。本研究不仅为天然产物中α-葡萄糖苷酶抑制剂的快速筛选提供了高效可靠的技术平台,更为复杂基质中生物活性成分的系统挖掘提供了新的研究范式。
1 材料与方法
1.1 材料与试剂
青钱柳干燥叶(批号20210618)购于江西省修水县,经江西中医大学舒任庚教授鉴定为胡桃科青钱柳属植物青钱柳的干燥叶;α-葡萄糖苷酶、4-硝基苯基-α-D-吡喃葡糖苷(p-nitrophenyl-α-D-galactopyranoside PNPG)、山柰酚、阿卡波糖(批号:S10050-250U、S10137-1 g、G11A11L110978、S11190-500 mg),上海源叶生物科技有限公司;金丝桃苷、水杨酸、槲皮素、阿魏酸、(-)-表没食子儿茶素没食子酸酯(批号:22041804、21061106、22062302、22032207、21060907),成都普菲德生物技术有限公司;杨梅素3-O-β-D-葡萄糖苷、槲皮苷、杨梅素(批号:AFBG2006、AFCD1908、AFCB1751),成都埃法生物科技有限公司;异绿原酸A、山柰酚-3-O-β-D-吡喃葡萄糖醛酸苷、阿福豆苷(批号:103720、YJ0264、103852),江苏永健医药科技有限公司;对硝基苯酚和25%(体积分数,下同)戊二醛(批号:N814718-100 g、C12890699),上海麦克林生化有限公司;甲醇、乙腈(色谱级),德国Merck公司;95%乙醇(食品级),阿普斯戴尔生物科技有限公司;氨基修饰磁性颗粒(Fe3O4-NH2,200~300 nm),厦门普睿迈格生物科技有限公司;甲酸(色谱纯),美国Dikama Pure;其他试剂均为分析纯。
1.2 仪器与设备
SPD131DDA P1-230离心浓缩系统,美国Thermo Fisher Scientific;SpectraMax Plus 384酶标仪,美国美谷分子仪器有限公司;Milli-Q Advantage A10超纯水仪,美国Millipore公司;Infinity 1290超高效液相色谱仪联合G6538型四级杆-飞行时间串联质谱仪,美国Agilent公司;Spectrum Two傅里叶变换红外光谱仪,美国Perkin Elmer公司;场发射扫描电子显微镜,德国ZEISS公司。
1.3 实验方法
1.3.1 固定化酶的制备
参考文献[10,13-14]的方法,取适量Fe3O4-NH2磁性微粒于2 mL离心管中,用0.2 mol/L磷酸缓冲液(phosphate buffer,PB)(pH 6.8)反复洗涤3~4次,磁分离,去除上清液。随后加入2 mL 10%戊二醛溶液,并在避光条件下于轨道摇床上反应4 h。经戊二醛修饰后,PB清洗该微粒3~4次,除去未反应的戊二醛,弃除上清液,得具有醛基功能化的磁性微粒。将溶解在PB中的一定量α-葡萄糖苷酶加入到醛基功能化的磁性微粒中,于摇床上反应4 h(37 ℃)。反应结束后,PB洗涤3~4次,磁分离并丢弃上清液,得到固定化的α-葡萄糖苷酶。将得到的固定化酶分散在含有PB的离心管中,4 ℃保存备用。
1.3.2 固定化酶的表征
用傅里叶变换红外光谱仪研究了Fe3O4-NH2、戊二醛修饰的Fe3O4(Fe3O4-GA)和Fe3O4-α-葡萄糖苷酶之间的官能团差异。测量的波数范围设定为4 000~500 cm-1。用场发射扫描电子显微镜研究了Fe3O4-NH2和Fe3O4-α-葡萄糖苷酶的粒径和形态。
1.3.3 固定化酶的活性测定
采用HPLC对Fe3O4-α-葡萄糖苷酶进行活性考察[15]。用PB配制浓度为600 μmol/L的PNPG底物浓液,将Fe3O4-α-葡萄糖苷酶和1 mL PNPG溶液于37 ℃孵育30 min,收集上清液用于HPLC分析。以0.1%甲酸水溶液(A)与甲醇(B)为流动相,采用依利特C18柱(150 mm×4.6 mm,5 μm)。洗脱方式为50% B等度洗脱,进样时间10 min,进样量10 μL,流速0.6 mL/min,柱温35 ℃,紫外检测波长254 nm。基于PNPG的水解速率计算固定化酶的相对活性。相对活性的计算如公式(1)所示:
相对活性![]()
(1)
式中:S0、S1,底物PNPG与Fe3O4-α-葡萄糖苷酶孵育前、孵育后的峰面积。
1.3.4 固定化酶单因素制备条件的优化
使用上述HPLC方法,进行单因素试验,研究戊二醛体积分数(5%~25%)、α-葡萄糖苷酶浓度(3~11 U/mL)和固定化时间(1.0~4.0 h)对固定化酶相对活性的影响。
1.3.5 青钱柳提取物中α-葡萄糖苷酶抑制剂的筛选
1.3.5.1 混合模型验证固定化酶
为了验证固定化酶在混合溶液中的筛选能力,以PB(含5%乙醇)为溶剂,制备了含有(-)-表没食子儿茶素没食子酸酯、金丝桃苷、水杨酸和阿魏酸的混合溶液。其中,(-)-表没食子儿茶素没食子酸酯和金丝桃苷作为阳性对照[16],不具有α-葡萄糖苷酶抑制活性的水杨酸和阿魏酸作为阴性对照[17]。
采用磁分离固相萃取联用HPLC技术进行活性成分筛选。具体操作如下:取1.0 mL含4种标准品(S0)的混合溶液与5 mg Fe3O4-α-葡萄糖苷酶复合物于离心管中,37 ℃恒温振荡孵育30 min使酶-配体充分结合。采用磁分离法收集上清液(S1)后,依次进行三步净化处理:使用500 μL PB连续洗涤3次(D1~D3)以去除非特异性吸附杂质;采用90%乙腈水溶液(体积分数)洗脱3次(E1~E3)解离活性配体。所有组分(S0~E3)经0.22 μm微孔滤膜过滤后,采用Agilent 1260 HPLC系统进行分析。色谱条件:依利特Supersil ODS2 C18色谱柱(150 mm×4.6 mm,5 μm),流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱程序(0~25 min,30%~70% B;25~27 min,70%~30% B;27~30 min,30% B),流速0.6 mL/min,柱温35 ℃,检测波长254 nm,进样量10 μL。
1.3.5.2 固定化酶筛选青钱柳中潜在活性成分
用磁固定化酶技术结合UHPLC-Q-TOF/MS开展活性成分筛选,实验流程如图1所示。具体操作如下:精密量取1.0 mL青钱柳提取物(5 mg/mL,制备方法参照文献[18])与5.0 mg Fe3O4-α-葡萄糖苷酶复合物于2 mL离心管中,37 ℃恒温振荡(200 r/min)孵育30 min完成酶-配体特异性结合。通过磁分离技术移除上清液后,依次进行:PB(pH 6.8)洗涤3次去除物理吸附杂质;90%乙腈水溶液(体积分数)洗脱3次解离活性配体。收集的洗脱液经0.22 μm尼龙滤膜过滤后,采用Agilent 1290 UHPLC系统联用6538 Q-TOF质谱仪进行分析。色谱条件:Poroshell 120 EC-C18色谱柱(3.0 mm×100 mm,2.7 μm),流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度程序:0~42 min(2%~72% B),42~44 min(72%~77% B),44~47 min(77%~84% B),47~58 min(77%~100% B),58~59 min(100%~2% B),59~61 min(2% B);流速0.3 mL/min,柱温35 ℃,进样量3 μL。质谱参数:双喷雾电喷雾离子源(Dual ESI),正/负离子模式分别施加4.0 kV/3.5 kV电离电压,干燥气温度350 ℃,锥孔电压60 V,二级质谱采用动态碰撞能量(10、20、40 eV),质量扫描范围m/z 50~1 100。参比溶液(0.136个标准大气压)实时校正确保质量精度<3×10-6。平行分析青钱柳提取物(5 mg/mL)作为空白对照,有效排除假阳性干扰。
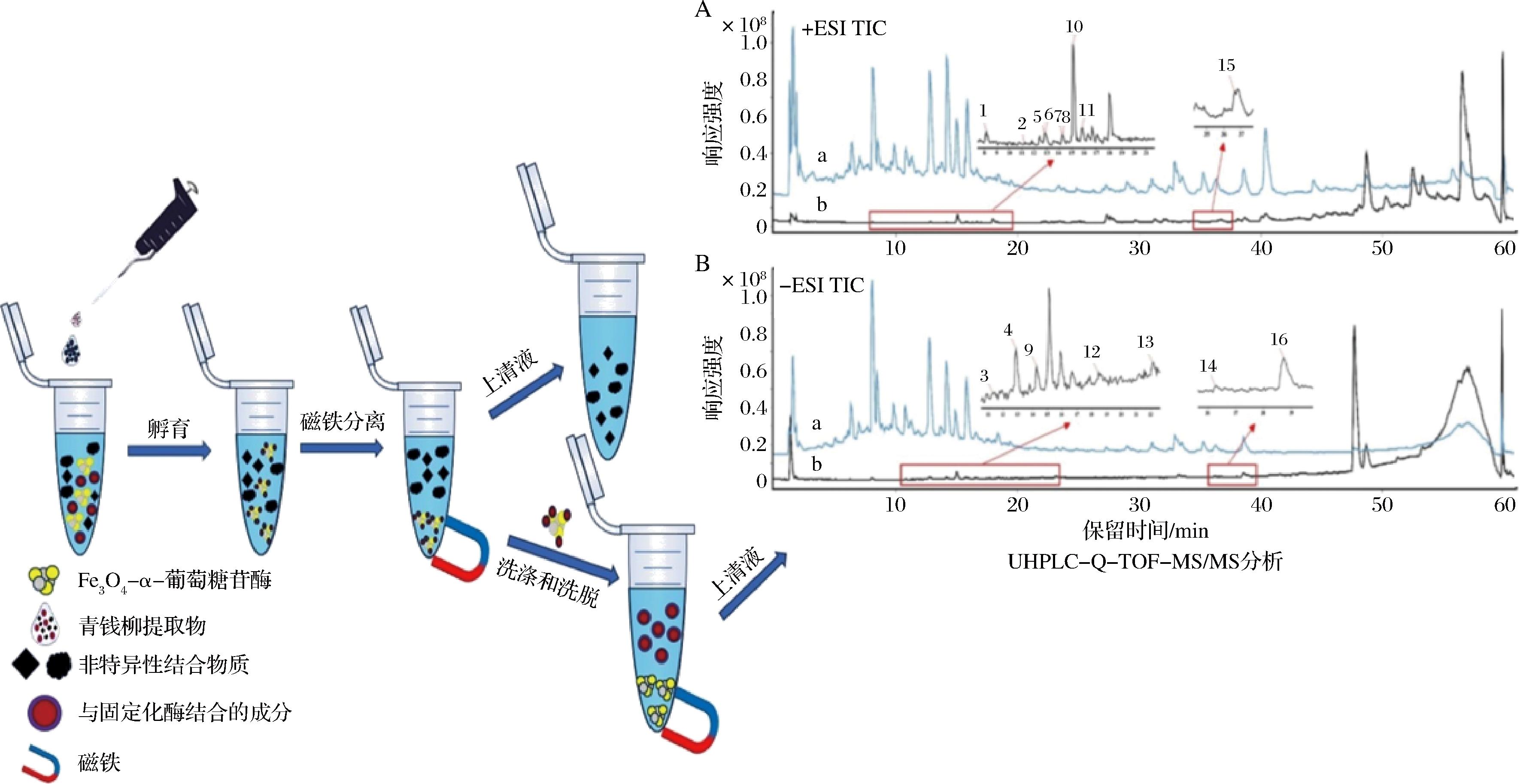
A-正离子模式下总离子流图;B-负离子模式下总离子流图
图1 Fe3O4-α-葡萄糖苷酶实验流程示意图
Fig.1 Schematic diagram of the Fe3O4-α-glucosidase experiment
注:图中a为青钱柳提取物的总离子流图,b为固定化酶筛选活性成分。
1.3.6 体外α-葡萄糖苷酶抑制实验
1.3.6.1 标准曲线的建立
在酶标96孔板中加入120 μL的对硝基苯酚(p-nitrophenyl, PNP)溶液(1、10、25、50、100、150、200、400 μmol/L),再加入80 μL的0.20 mol/L Na2CO3溶液,混匀,于405 nm处测定吸光度值A。以PNP浓度为横坐标,吸光度值A为纵坐标来绘制标准曲线。平行重复实验3次,取平均值。
1.3.6.2 α-葡萄糖苷酶活性验证
以PNPG为底物,将实验分为空白组(不加待测样品)、样品组、样品背景组(不加α-葡萄糖苷酶),于酶标96孔板中依次加入60 μL PB、待测样品20 μL和PNPG(15 mmol/L)20 μL,于37 ℃振荡孵育10 min。孵育完成后再加入α-葡萄糖苷酶溶液(0.20 U/mL)20 μL,在振荡培养箱中反应20 min。最后加入Na2CO3(0.20 mol/L)80 μL终止反应,在405 nm处测定吸光度值A。平行重复实验3次,取平均值。化合物抑制率的计算如公式(2)所示:
抑制率![]()
(2)
式中:AS,样品组吸光度值;AC,背景组吸光度值;AB,空白组吸光度值。
1.3.7 数据处理
Qualitative Analysis B.06.00软件获取保留时间(tR)、离子碎片信息等,结合标准品与文献、Massbank、HMDB、Pubchem等在线数据库对潜在活性成分进行定性分析。GraphPad-Prism 8.0.2软件计算各化合物的半数抑制浓度。
2 结果与分析
2.1 固定化酶的表征
通过场发射扫描电子显微镜对Fe3O4-NH2和Fe3O4-α-葡萄糖苷酶的粒径和形貌进行比较。由图2-a和图2-b可以观察到Fe3O4-NH2与酶反应后,磁性微粒表面形貌显著改善,呈现更为光滑的表征,且平均粒径略有增加,表现出良好的分散性。傅里叶变换红外光谱结果如图2-c所示,表明Fe3O4-NH2经戊二醛修饰和固定化α-葡萄糖苷酶后,Fe3O4-NH2在1 639 cm-1(δN—H)处的吸收峰移至1 644 cm-1和1 648 cm-1。Fe3O4-GA在1 721 cm-1和1 550 cm-1处的吸收峰分别是由C![]() O和C
O和C![]() N的弯曲振动引起的,这表明Fe3O4-NH2上的氨基和戊二醛的醛基之间发生席夫碱反应。α-葡萄糖苷酶的氨基与Fe3O4-GA上的醛基反应后,在1 555 cm-1(δC
N的弯曲振动引起的,这表明Fe3O4-NH2上的氨基和戊二醛的醛基之间发生席夫碱反应。α-葡萄糖苷酶的氨基与Fe3O4-GA上的醛基反应后,在1 555 cm-1(δC![]() N)处出现强吸收峰,说明α-葡萄苷酶通过席夫碱反应成功固定在磁性微粒上[10,19]。
N)处出现强吸收峰,说明α-葡萄苷酶通过席夫碱反应成功固定在磁性微粒上[10,19]。
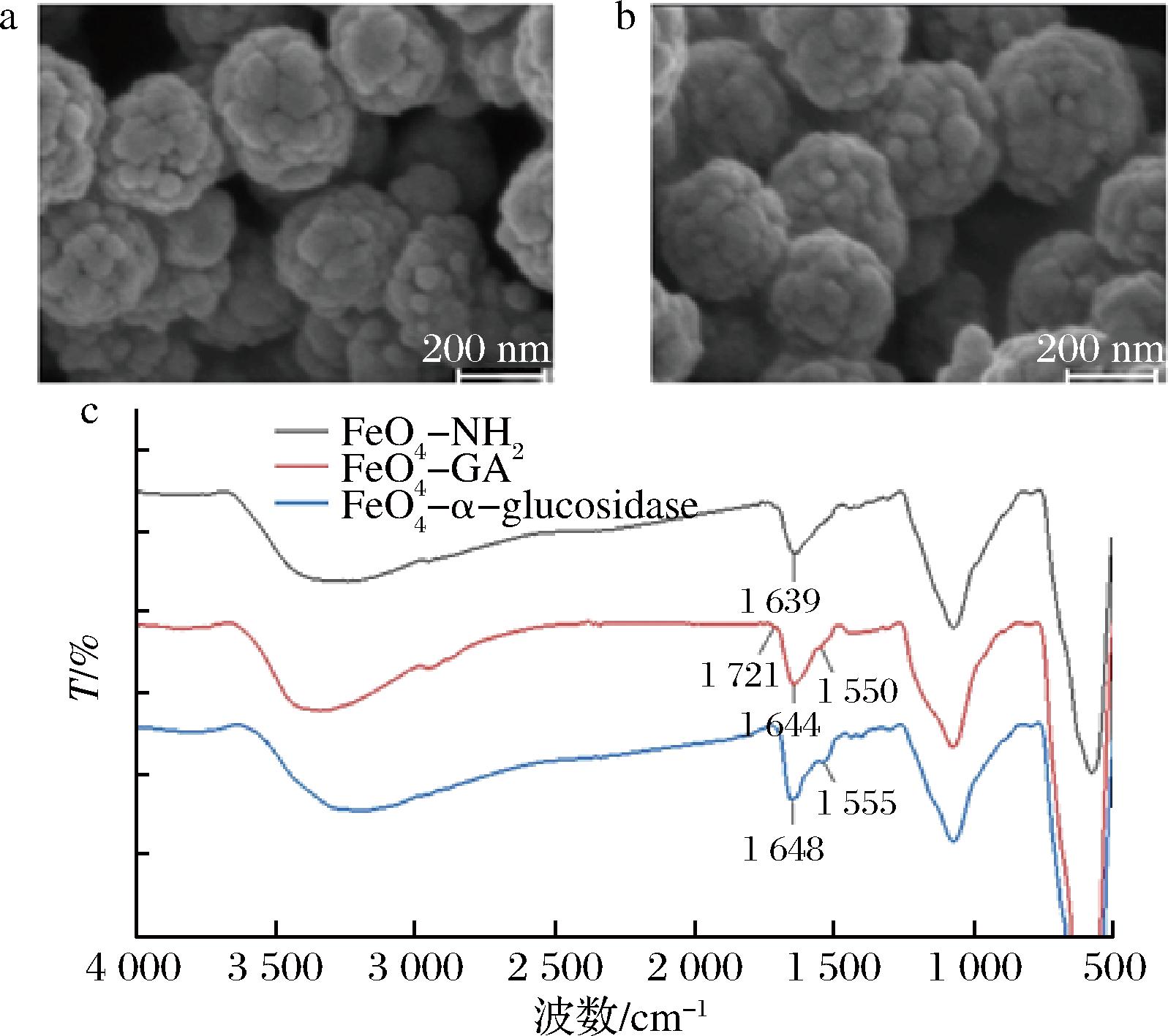
a-Fe3O4-NH2场发射扫描电镜图;b-Fe3O4-α-葡萄糖苷酶场发射扫描电镜图;c-Fe3O4-NH2、Fe3O4-GA、Fe3O4-α-葡萄糖苷酶红外光谱图
图2 场发射扫描电镜图和红外光谱图
Fig.2 Scanning electron microscope images and Fourier transform infrared spectroscopy
2.2 固定化酶制备单因素条件的优化
在α-葡萄糖苷酶负载量3 U/mL、固定化时间4 h的优化条件下,如图3-a所示,随着戊二醛体积分数从5%梯度增加至25%,Fe3O4-α-葡糖苷酶复合物的相对活性呈现先升后降趋势。当交联剂体积分数为15%时达到峰值活性,体积分数超过15%时,酶活性显著下降,戊二醛在低体积分数下表现出良好的交联活性,但在较高体积分数下它会导致一些α-葡萄糖苷酶变性,进而使Fe3O4-α-葡萄苷酶的相对活性降低,15%戊二醛体积分数被确立为后续实验的最优条件。
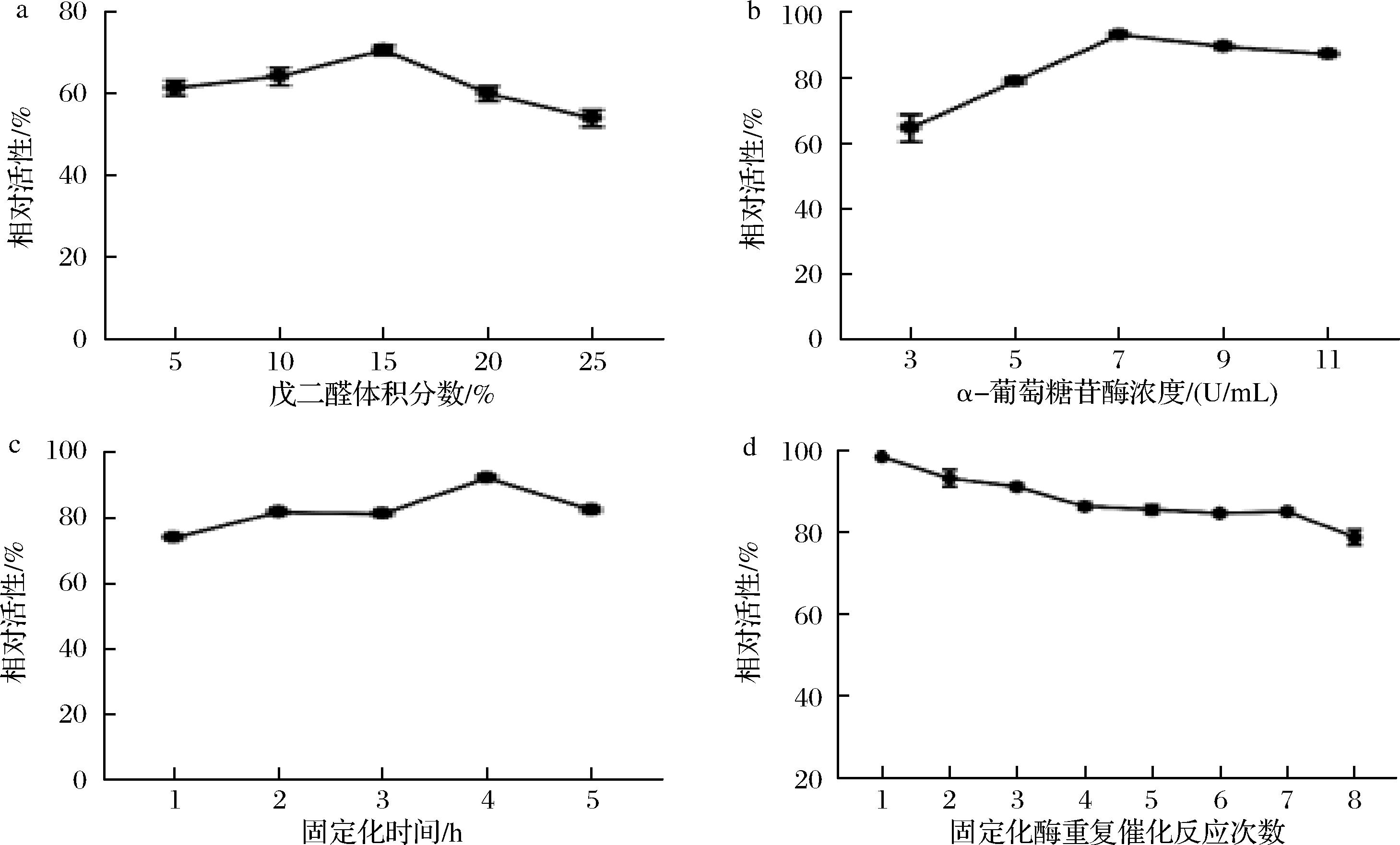
a-戊二醛浓度;b-α-葡萄糖苷酶浓度;c-固定化时间对固定化酶相对活性的影响;d-固定化酶重复催化反应8次
图3 固定化酶制备单因素条件的优化
Fig.3 Optimization of single factor conditions for immobilized enzyme preparation
不同浓度的α-葡萄糖苷酶对Fe3O4-α-葡萄苷酶相对活性的影响,如图3-b所示,固定化酶相对活性随着α-葡萄糖苷酶浓度的增加而增加,然后降低。当α-葡萄糖苷酶浓度为7 U/mL固定化酶的相对活力最佳,可能是因为Fe3O4-GA上与α-葡萄糖苷酶结合的醛基位点数量是一定的。当结合位点饱和时,酶浓度的进一步增加可能会阻碍活性位点的暴露,导致其相对活性降低[20]。固定化反应时间对Fe3O4-α-葡萄糖苷酶相对活性的影响的考察,根据图3-c所示,过长的固定化反应时间也可能导致酶聚集在Fe3O4-α-葡萄糖苷酶表面,阻碍活性位点的暴露,导致相对活性降低。最终选择戊二醛的体积分数15%、α-葡萄糖苷酶7 U/mL、固定化反应时间4 h的参数,制备固定化酶。Fe3O4-α-葡萄糖苷酶重复使用性考察,如图3-d所示,经过连续8个催化循环,Fe3O4-α-葡萄糖苷酶仍保留79%的相对活性。
2.3 青钱柳提取物中α-葡萄糖苷酶抑制剂的筛选
2.3.1 混合模型验证固定化酶特异性
如图4所示,与溶液S0相比,(-)-表没食子儿茶素没食子酸酯(Ⅰ)与金丝桃苷(Ⅲ)在溶液S1中的峰面积减小,说明一些成分与固定化酶结合。阿魏酸(Ⅱ)和水杨酸(Ⅳ)仅出现在D1~D3中,用PB洗涤固定化酶3次,消除非特异性成分的干扰。90%乙腈用于洗脱与酶特异性结合的配体,在E1中检测到阳性对照组成分而未检测到阴性对照组成分[21],结果表明固定化酶在混合模型中具有较高的特异性,可用于天然产物中α-葡萄糖苷酶抑制剂的筛选。
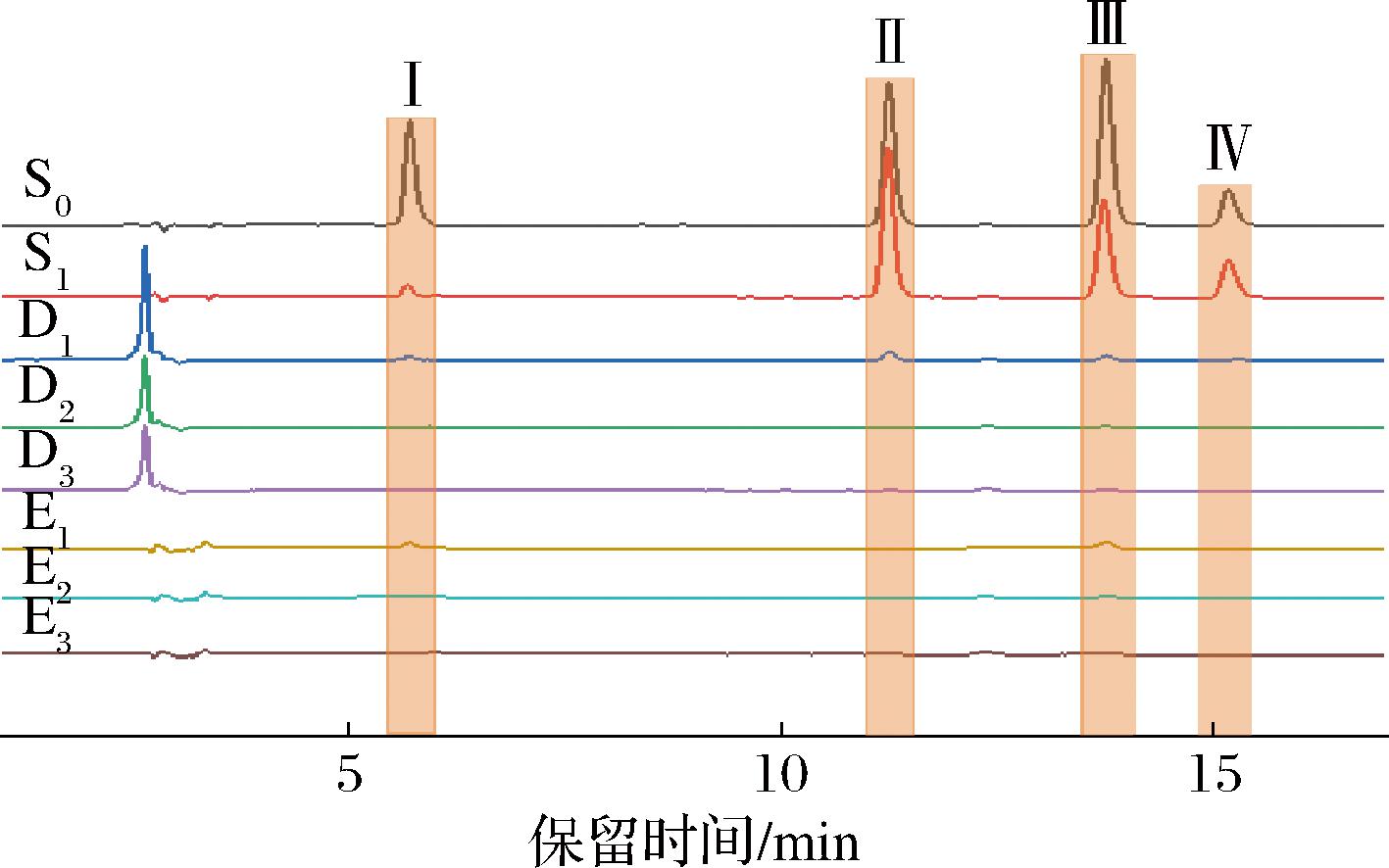
图4 S0-E3混合模型验证过程
Fig.4 Validation process of the S0-E3 hybrid model
注:Ⅰ为(-)-表没食子儿茶素没食子酸酯,Ⅱ为阿魏酸,Ⅲ为金丝桃素,Ⅳ为水杨酸。
2.3.2 固定化酶筛选青钱柳活性成分
运用上述建立方法,筛选青钱柳提取物中α-葡萄糖苷酶抑制剂,洗脱溶液的总离子流(total ion chromatogram, TIC)如图5所示,显示16个潜在的活性化合物,通过采集的二级碎片离子信息与标准品和文献[22-23]中已报道化合物的二级碎片信息对比,进行化合物初步鉴定。化合物1与化合物13经标准品比对,保留时间有着显著差异,表明可能存在假阳性结果,化合物信息见表1。
表1 青钱柳提取物中筛选的潜在α-葡萄糖苷酶抑制剂
Table 1 Potential α-glucosidase inhibitors screened from Cyclocarya paliurus extract

NotRm/z实测理论误差/×10-6加合形式分子式鉴定化合物碎片离子m/z18.11355.101 0355.102 4 3.8[M+H]+C16H18O9新绿原酸164.041 7,163.038 4,145.022 9,136.047 6,135.042 52∗11.20319.044 4319.044 81.3[M+H]+C15H10O8杨梅素319.046 0,153.016 3,137.021 83∗11.21479.083 9479.083 1-1.6[M-H]-C21H20O13杨梅素-3-O-β-D-葡萄糖苷479.079 4,316.025 6,271.026 24∗12.77463.090 5463.088 2-4.9[M-H]-C21H20O12金丝桃苷463.088 6,301.034 1,271.026 75∗12.79303.050 0303.049 90.4[M+H]+C15H10O7槲皮素303.049 5,257.044 6,121.027 76∗12.81479.081 9479.082 00.2[M+H]+C21H18O13槲皮素-3-O-葡萄糖醛酸苷303.048 1,257.041 9,229.048 3,137.020 5,113.023 1,85.027 77∗14.24463.086 2463.087 11.9[M+H]+C21H18O12山柰酚-3-O-β-D-吡喃葡萄糖醛酸苷463.086 4,288.056 4,287.053 3,165.016 2,153.019 0,141.079 4,121.024 6,85.028 38∗14.28287.054 1287.055 03.1[M+H]+C15H10O6山柰酚287.053 2,213.052 2,165.016 6,153.018 29∗14.37447.092 3447.093 3-3.1[M-H]-C21H20O11槲皮苷271.025 8,255.031 8,151.003 9,121.028 9,227.039 0,254.024 910∗15.01517.136 3517.134 1-4.3[M+H]+C25H24O12异绿原酸A163.039 0,145.029 0,135.045 0,117.034 211∗15.86433.112 2433.112 91.6[M+H]+C21H20O10阿福豆苷288.057 2,287.055 2,147.063 6,129.054 3,85.027 81218.51677.157 5677.151 2-9.3[M-H]-C34H30O151,3,5-三咖啡酰奎宁酸677.158 3,515.119 0,353.089 8,179.034 71321.17329.068 3329.066 7-4.9[M-H]-C17H14O7苜蓿素329.068 9,314.046 5,299.018 8,271.028 51436.44663.416 1663.411 4-7.3[M-H]-C37H60O10青钱柳苷O471.349 9,131.037 3,101.023 81536.55455.353 6455.352 0-3.5[M+H]+C30H46O3青钱柳酸A409.345 4,357.274 4,109.102 7,1638.58621.405 2621.400 8-7.0[M-H]-C35H58O9青钱柳苷J471.345 3,101.023 8
注:*表示化合物经标准品比对。
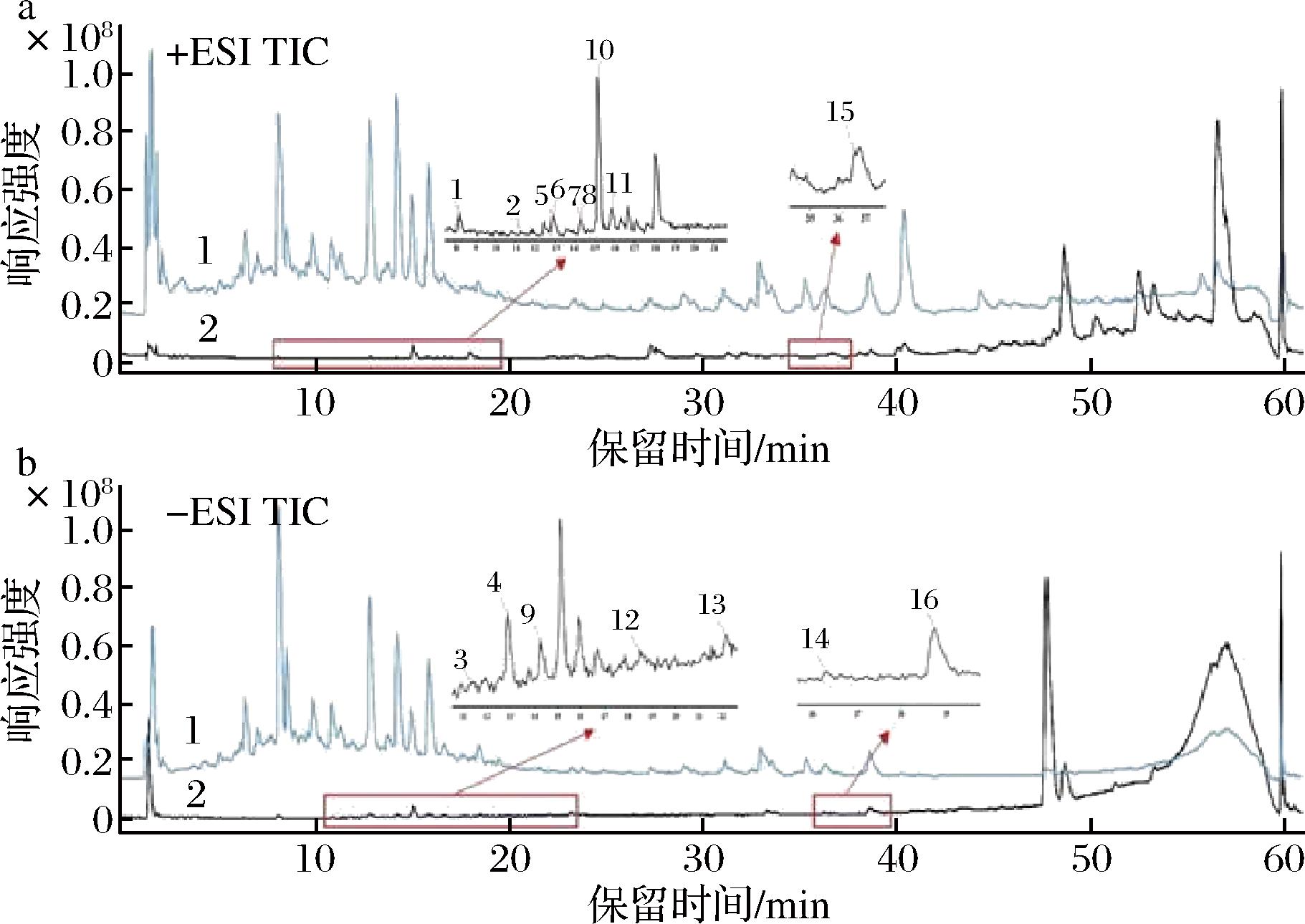
a-正离子模式;b-负离子模式
图5 正、负离子模式下总离子流图
Fig.5 TICs in positiveand negative ion mode
注:1为青钱柳提取物的总离子流图,2为固定化酶筛选活性成分。
2.4 体外活性验证
2.4.1 PNP标准曲线
PNP的浓度范围在5~400 μmol/L内,标准曲线方程y=0.005 017x+0.043 34(R2=0.999 8),表明PNP在检测浓度范围内线性关系良好,PNP浓度与吸光度A值呈正比。
2.4.2 体外α-葡糖苷酶活性验证
排除化合物1和13假阳性结果并对剩余成分进行体外活性验证。随着活性化合物浓度的增加,各化合物对α-葡萄糖苷酶的抑制活性逐渐增强,如图6所示,各活性化合物和阿卡波糖IC50值如下:异绿原酸A(870.3 μg/mL)、杨梅素-3-O-β-D-葡萄糖苷(123.9 μg/mL)、槲皮素-3-O-葡萄糖醛酸苷(587.2 μg/mL)、槲皮苷(320.9 μg/mL)、杨梅素(25.7 μg/mL)、金丝桃苷(394.1 μg/mL)、阿福豆苷(272.7 μg/mL)、山柰酚-3-O-β-D-吡喃葡萄糖醛酸苷(524.9 μg/mL)、山柰酚(21.6 μg/mL)、槲皮素(31.0 μg/mL)和阿卡波糖(0.62 μg/mL)。结果表明,10种活性成分对α-葡萄糖苷酶具有较强的抑制作用,但与阳性药物阿卡波糖相比效果较差。
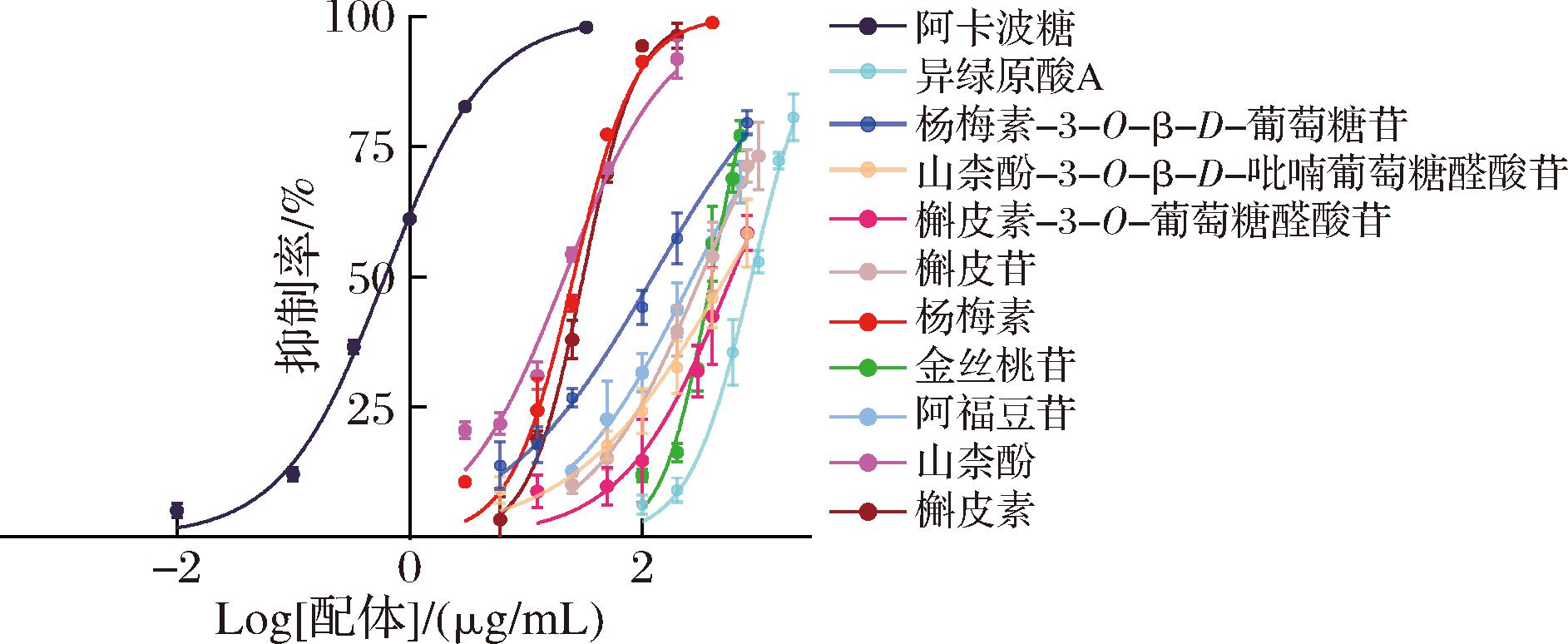
图6 各活性化合物的质量浓度变化对α-葡萄糖苷酶活性的影响
Fig.6 The effects of active compound concentration variations on α-glucosidase activity
α-葡萄糖苷酶主要分布在小肠上皮绒毛膜刷状沿上,具有将碳水化合物末端的α-1,4-葡萄糖残基水解为葡萄糖的选择性活性,抑制其活性可延缓碳水化合物的消化和吸收,是防治T2DM的有效途径之一。本研究以戊二醛为交联剂将α-葡萄糖苷酶固定于磁性微粒上,来筛选青钱柳中潜在的α-葡萄糖苷酶抑制剂。通过UHPLC-Q-TOF/MS技术进行快速定性分析,鉴定过程中发现绿原酸标准品tR为6.50 min、苜蓿素标准品tR为18.10 min,与筛选出的化合物1与13保留时间有显著差异,但二者与相应标准品有相似的二级碎片离子可能为同分异构体,对于该成分需要后续进一步分离鉴定研究。研究表明[24],咖啡酰奎宁酸类化合物含有的咖啡酰氧基团数量对α-葡萄糖苷酶的抑制活性起关键性作用,1,3,5-三咖啡酰奎宁酸比异绿原酸A多1个咖啡酰氧基团,由此推测1,3,5-三咖啡酰奎宁酸对α-葡萄糖苷酶抑制作用强于异绿原酸A。青钱柳苷J对α-葡萄糖苷酶活性有一定的抑制能力,其IC50值在451.22~478.15 μmol/L[25]。由于三萜类化合物市面上缺少标准品,所鉴定出的青钱柳酸A、青钱柳苷O与青钱柳苷J需进一步确定其对α-葡萄糖苷酶抑制作用。
3 结论
本研究通过构建固定化酶体系,结合UHPLC-Q-TOF/MS技术,快速筛选并鉴定了青钱柳提取物中的潜在抑制α-葡萄糖苷酶活性成分。结果表明,共鉴定出16个化合物分子,通过与标准品比对排除了2例假阳性结果,最终通过实验验证,其中10个具有抑制α-葡萄糖苷酶活性成分,该方法为天然产物中生物活性化合物的高效识别及创新药物开发提供了可靠的技术支撑。
[1] SU J Q, LUO Y S, HU S, et al.Advances in research on type 2 diabetes mellitus targets and therapeutic agents[J].International Journal of Molecular Sciences, 2023, 24(17):13381.
[2] 李焯颖, 刘精杏, 廖丹葵, 等.火麻仁α-葡萄糖苷酶抑制肽的快速筛选、鉴定及抑制机理研究[J].食品与发酵工业,2025,51(22):264-271.LI Z Y, LIU J X, LIAO D K, et al.Rapid screening, identification and inhibition mechanism of α-glucosidase inhibitory peptide from hemp seed[J].Food and Fermentation Industries, 2025,51(22):264-271.
[3] RENGASAMY K R R, ADEROGBA M A, AMOO S O, et al.Potential antiradical and alpha-glucosidase inhibitors from Ecklonia maxima (Osbeck) Papenfuss[J].Food Chemistry, 2013, 141(2):1412-1415.
[4] LIU Z Y, MA S T.Recent advances in synthetic α-glucosidase inhibitors[J].ChemMedChem, 2017, 12(11):819-829.
[5] PADHI S, NAYAK A K, BEHERA A.Type II diabetes mellitus:A review on recent drug based therapeutics[J].Biomedecine &Pharmacotherapie, 2020, 131:110708.
[6] AGRAWAL N, SHARMA M, SINGH S, et al.Recent advances of α-glucosidase inhibitors:A comprehensive review[J].Current Topics in Medicinal Chemistry, 2022, 22(25):2069-2086.
[7] QIU M, PENG J, DENG H, et al.The leaves of Cyclocarya paliurus:A functional tea with preventive and therapeutic potential of type 2 diabetes[J].The American Journal of Chinese Medicine, 2022, 50(6):1447-1473.
[8] PENG X J, CHEN S S, ZHONG L, et al.Cyclocarya paliurus leaves extracts alleviate metabolic phenotypes in Chinese T2DM patients by modulating gut microbiota and metabolites:A clinical randomized controlled trial[J].Frontiers in Endocrinology, 2023, 14:1176256.
[9] ZHU L P, FANG S Y, LU X C, et al.Structurally diverse glycosides with α-glucosidase inhibitory properties from water extract of the leaves of Cyclocarya paliurus[J].Fitoterapia, 2023, 167:105473.
[10] SHEN Y P, WANG M, ZHOU J W, et al.Construction of Fe3O4@α-glucosidase magnetic nanoparticles for ligand fishing of α-glucosidase inhibitors from a natural tonic Epimedii Folium[J].International Journal of Biological Macromolecules, 2020, 165:1361-1372.
[11] LIU D M, CHEN J, SHI Y P.α-Glucosidase immobilization on chitosan-enriched magnetic composites for enzyme inhibitors screening[J].International Journal of Biological Macromolecules, 2017, 105:308-316.
[12] ZHUO R J, LIU H, LIU N N, et al.Ligand fishing:A remarkable strategy for discovering bioactive compounds from complex mixture of natural products[J].Molecules, 2016, 21(11):1516.
[13] WUBSHET S G, BRIGHENTE I M C, MOADDEL R, et al.Magnetic ligand fishing as a targeting tool for HPLC-HRMS-SPE-NMR:α-glucosidase inhibitory ligands and alkylresorcinol glycosides from Eugenia catharinae[J].Journal of Natural Products, 2015, 78(11):2657-2665.
[14] LI Y F, CHEN Y, XIAO C Y, et al.Rapid screening and identification of α-amylase inhibitors from Garcinia xanthochymus using enzyme-immobilized magnetic nanoparticles coupled with HPLC and MS[J].Journal of Chromatography B, 2014, 960:166-173.
[15] 刘蕊洁. α-葡萄糖苷酶抑制剂筛选平台的建立及其在天然产物中的应用研究[D].广州:暨南大学, 2020.LIU R J.Establishments of two platforms for α-glucosidase inhibitors screening and their application in natural products[D].Guangzhou:Jinan University, 2020.
[16] LIU R J, KOOL J, JIAN J Y, et al.Rapid screening α-glucosidase inhibitors from natural products by at-line nanofractionation with parallel mass spectrometry and bioactivity assessment[J].Journal of Chromatography A, 2021, 1635:461740.
[17] JIANG J B, YU Y J, WANG L P, et al.Enzyme immobilized on polyamidoamine-coated magnetic microspheres for α-glucosidase inhibitors screening from Radix Paeoniae Rubra extracts accompanied with molecular modeling[J].Talanta, 2019, 195:127-136.
[18] 陈祖德, 马博稷, 肖岩, 等.基于亲和超滤-液质联用结合相关性分析方法筛选青钱柳提取物中α-葡萄糖苷酶抑制剂[J].食品工业科技, 2024, 45(23):290-299.CHEN Z D, MA B J, XIAO Y, et al.Screening of α-glucosidase inhibitors in Cyclocarya paliurus extracts based on affinity ultrafiltration-liquid chromatography-mass spectrometry combined with correlation analysis[J].Science and Technology of Food Industry, 2024, 45(23):290-299.
[19] WANG Z, LI X Q, CHEN M H, et al.A strategy for screening of α-glucosidase inhibitors from Morus alba root bark based on the ligand fishing combined with high-performance liquid chromatography mass spectrometer and molecular docking[J].Talanta, 2018, 180:337-345.
[20] CHENG G R, XING J P, PI Z F, et al.α-Glucosidase immobilization on functionalized Fe3O4 magnetic nanoparticles for screening of enzyme inhibitors[J].Chinese Chemical Letters, 2019, 30(3):656-659.
[21] WUBSHET S G, LIU B R, KONGSTAD K T, et al.Combined magnetic ligand fishing and high-resolution inhibition profiling for identification of α-glucosidase inhibitory ligands:A new screening approach based on complementary inhibition and affinity profiles[J].Talanta, 2019, 200:279-287.
[22] LI Y J, WAN G Z, XU F C, et al.Screening and identification of α-glucosidase inhibitors from Cyclocarya paliurus leaves by ultrafiltration coupled with liquid chromatography-mass spectrometry and molecular docking[J].Journal of Chromatography A, 2022, 1675:463160.
[23] CAO Y N, FANG S Z, YIN Z Q, et al.Chemical fingerprint and multicomponent quantitative analysis for the quality evaluation of Cyclocarya paliurus leaves by HPLC-Q-TOF-MS[J].Molecules, 2017, 22(11):1927.
[24] 颜欢, 邱琛, 钟凯, 等.金银花花蕾中3,5-二咖啡酰奎宁酸对α-葡萄糖苷酶抑制作用的研究[J].现代食品科技, 2015, 31(7):44-49.YAN H, QIU C, ZHONG K, et al.Inhibition of α-glucosidase activity by 3,5-dicaffeoylquinic acid from Lonicera japonica thunb flower buds[J].Modern Food Science and Technology, 2015, 31(7):44-49.
[25] LI C G, DENG S P, LIU W, et al.α-Glucosidase inhibitory and anti-inflammatory activities of dammarane triterpenoids from the leaves of Cyclocarya paliurus[J].Bioorganic Chemistry, 2021, 111:104847.