植物蛋白具有成本低、环境友好、来源广泛、致敏性低等优点[1],被推荐用于多种疾病的预防,如心脏病、糖尿病、肥胖症等[2]。蚕豆作为一种蛋白质含量高(25%~34%)且易于种植的可持续蛋白质来源,是一种很有前景的动物蛋白替代品,是欧盟智能蛋白质项目确定的4种作物之一。蚕豆富含淀粉,常用于制作粉丝、粉皮,也可直接作为动物饲料[3],而蚕豆中大量的蛋白质很少被利用。蚕豆蛋白含有人体所需的8种必需氨基酸,是一种优质的植物蛋白。蚕豆中的主要蛋白质是球状贮藏蛋白legumin(11S)和vicilin(7S)[4],分别占蚕豆总蛋白的40%~45%和20%~25%[5]。为了降低资源浪费,深入研究蚕豆蛋白的综合利用显得尤为重要。
蛋白质淀粉样纤维化是一种高效的蛋白质修饰技术,它能在高温和强酸的环境下将食源性蛋白转变为具有高度结构化、线性结构特征以及高长径比的棒状聚集体,如大豆蛋白[6]、米谷蛋白[7]、蛋清蛋白[8]等均可在一定条件下形成纤维状蛋白。与原始蛋白相比,纤维化蛋白表现出更好的起泡性、乳化性、抗氧化性和抗菌性等[9]。植物源纤维状蛋白在食品、材料、医药等领域有广泛应用,可用于开发新型食品配料、制备生物可降解材料以及作为药物载体等。已有报道表明,在酸热处理后蚕豆蛋白可以形成纤维状聚集体[10],但有关蚕豆11S蛋白淀粉样纤维化聚集(fibrotic aggregation of 11S protein in fava bean,FPF)形成过程中的动力学特征及其功能性状的研究有限。
本研究将蚕豆11S蛋白(fava bean 11S protein,FP)置于pH 2、85 ℃环境中处理0~24 h,动态监测其纤维状蛋白的形成和微观结构的改变。此外,探究其起泡性、乳化性和凝胶特性等变化,探究FP向FPF转化的表征,有助于揭示其功能特性的演变,并为FPF的形成过程及其特性提供坚实的理论基础。
1 材料与方法
1.1 材料与试剂
蚕豆,云南蔬芳斋有限公司(中国云南);SDS-PAGE预制胶,上海碧云天生物技术股份有限公司;考马斯亮蓝(G250)、考马斯亮蓝(R250)、硫黄素T(thioflavin T,ThT),国药集团化学试剂有限公司;大豆油,金龙鱼食品集团股份有限公司;化学试剂均为分析纯。
1.2 仪器与设备
HH-1数显恒温水浴锅,江苏金坛江南仪器厂;Spark 20M多功能酶标仪,帝肯(上海)实验器材有限公司;HT7700透射电子显微镜(transmission electron microscopy,TEM),日本日立公司;Nicolet iS50傅里叶红外光谱(Fourier infrared spectroscopy,FTIR)仪,美国Thermo Fisher有限公司;PD500-TP均质机,戈普仪器(上海)有限公司。
1.3 实验方法
1.3.1 FP的提取
参考SUCHKOV等[11]的方法。将蚕豆粉与蒸馏水按料液比1∶9(g∶mL)混合后用NaOH溶液调节pH值为8.0,在45 ℃下混合2 h后5 000×g离心30 min。向上清液中加入NaCl至浓度为0.6 mol/L,用HCl溶液调节pH值为5.1,室温搅拌30 min后,5 000×g离心30 min。取上清液,用蒸馏水将NaCl浓度调节为0.3 mol/L后于1 000×g离心15 min。加入0.6 mol/L NaCl溶液使沉淀完全溶解后,5 000×g离心30 min,取上清液,加蒸馏水使体系NaCl浓度为0.3 mol/L后,1 000×g离心15 min,沉淀为蚕豆11S粗蛋白。将所得沉淀透析冻干后得到FP。
1.3.2 FPF的制备
参考文献[12-13]的方法,略有修改。将FP溶于超纯水(pH 2),终质量浓度60 g/L,搅拌2 h后用HCl溶液调节pH值为2,4 ℃水合过夜。然后将溶液以150 r/min在85 ℃孵育24 h,得到FPF。在不同时间点(0、4、8、12、16、20、24 h)取样,并立即在冰上淬灭终止反应,4 ℃下贮存备用。
1.3.3 ThT荧光光谱测定
参考LIU等[14]的方法,略有修改。用磷酸盐缓冲溶液(10 mmol/L,pH 7.0,150 mmol/L NaCl)配制1 mmol/L的ThT浓缩液,过0.22 μm滤膜后得到ThT储备液。实验前,用上述磷酸缓冲液将储备液稀释50倍得到工作液,将50 μL原纤维样品溶液与5 mL ThT工作液混匀后静置2 min,测定荧光强度(激发波长440 nm,发射波长460~600 nm)。
1.3.4 二酪氨酸的测定
用磷酸盐缓冲液(0.1 mol/L,0.6 mol/L NaCl,pH 7.0)将原纤维样品稀释至1 mg/mL。使用荧光分光光度计测定荧光强度(激发波长325 nm,发射波长420 nm,狭缝5 nm)。
1.3.5 TEM
将原纤维样品用pH 2的蒸馏水稀释为1 mg/mL,取适量稀释液到铜网上,用1%(质量分数)磷钨酸溶液对网格染色1 min后除去多余染色剂,干燥后通过TEM在100 kV的加速电压下进行观察。
1.3.6 SDS-PAGE
将不同处理时间的样品与还原性上样缓冲液(5×)混合并煮沸5 min。分离胶和堆积胶分别为14 g/100 mL 和4 g/100 mL。上样量为8 μL,电泳完成后用考马斯亮蓝R250染色后脱色。
1.3.7 FTIR
将不同处理时间的纤维化蛋白冻干样品和KBr混合后压片。使用FTIR仪全频段扫描(4 000~400 cm-1),分辨率为1 cm-1。Peakfit 4.12软件用于二级结构拟合。
1.3.8 起泡性和起泡稳定性
使用均质机将20 mL 1 mg/mL纤维化蛋白以10 000 r/min均质1 min后记录液体体积。静置10 min后记录液体体积。按照公式(1)、公式(2)计算起泡性和起泡稳定性。
起泡性![]()
(1)
起泡稳定性![]()
(2)
式中:V,均质前蛋白质溶液的体积,mL;V0,均质后蛋白质溶液的体积,mL;V10,均质后蛋白质溶液在室温下10 min后液体体积,mL。
1.3.9 乳化性和乳化稳定性
将30 mL 1 mg/mL原纤维蛋白分散在10 mL大豆油中,混合物在10 000 r/min下均质1 min。取50 μL乳状液用1 g/L SDS溶液稀释(1∶100,体积比)。在500 nm处测定吸光度。以SDS溶液为空白。按照公式(3)、公式(4)计算乳化性和乳化稳定性。
乳化性![]()
(3)
乳化稳定性![]()
(4)
式中:N,稀释倍数,100;θ,油相体积比,0.25;L,光路,1 cm;ρ,蛋白质质量浓度,0.001 g/mL;10,2次测量之间的时间间隔,min。
1.3.10 细胞毒性
使用MTT法测定不同反应时间后FPF与Caco-2细胞孵育24 h后的细胞活力,在570 nm处测定吸光度,按照公式(5)计算细胞毒性。
细胞毒性![]()
(5)
式中:A1和A2分别为有和无纤维化蛋白孵育的细胞的吸光度;A0是培养基的吸光度。
1.3.11 凝胶特性
将60 g/L FP(pH 2~3)和经过24 h反应后的60 g/L FPF(pH 2~3),与一定浓度的CaCl2溶液(15、30、60、90 mmol/L)充分混合,80 ℃加热30 min后冰水浴,并在4 ℃中贮存。在0.1~100 rad/s的动态频率扫描范围内对样品进行测量,以获得弹性模量。
1.4 数据分析
使用SPSS 26进行差异显著性分析,采用Duncan模式比较组间差异(P<0.05),使用Origin Pro 2025绘图。
2 结果与分析
2.1 ThT荧光强度
ThT是一种苯并噻唑染料,当ThT与淀粉样纤维状蛋白中的交叉-β结构结合时,ThT荧光强度增强。已有研究表明,淀粉样纤维状蛋白形成过程遵循Sigmoid生长模型,该模型包括滞后期、生长期和平衡期[15]。如图1-a和图1-b所示,随着反应时间的增加,荧光强度增强。加热0~16 h,荧光强度迅速增强,这一过程主要是蛋白质酸水解成肽、肽组装成具有交叉-β结构的纤维状蛋白[14],16~24 h荧光强度增强减缓,趋于平稳,结合TEM图(图2-a)可知,反应还未达到平台期,纤维长度仍在增长。
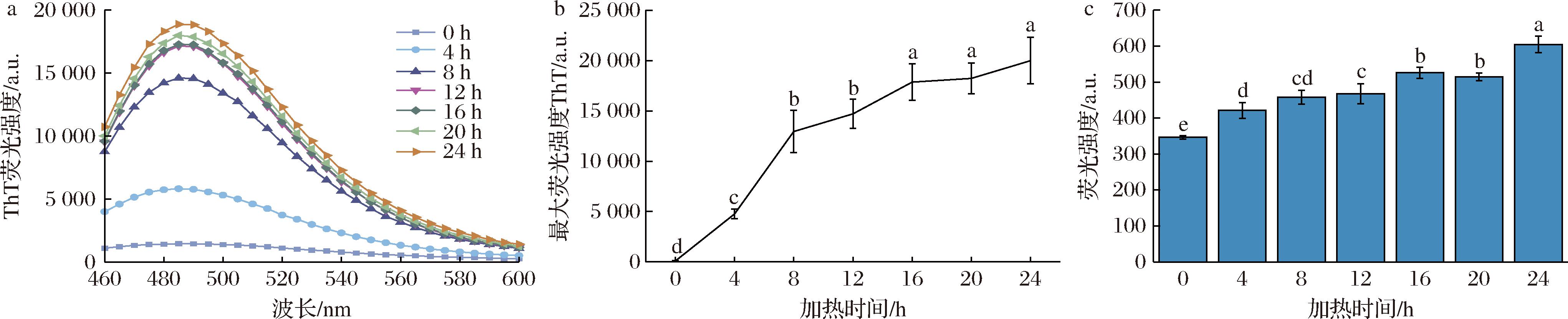
a-ThT荧光强度;b-ThT最大荧光强度;c-二酪氨酸荧光强度
图1 加热过程中ThT荧光强度变化、ThT最大荧光强度变化和二酪氨酸荧光强度变化
Fig.1 Changes in ThT fluorescence intensity, maximum ThT fluorescence intensity, and dityrosine fluorescence intensity during heating
注:不同的字母代表有显著性差异(P<0.05,下同)。

a-TEM图;b-长度分布
图2 加热过程中FPF TEM和长度分布
Fig.2 TEM and length distribution of FPF during heating process
2.2 二酪氨酸含量变化
二酪氨酸在发射波长420 nm条件下有特征性荧光,在阿尔兹海默症和帕金森患者的纤维状蛋白的病理组织中发现了二酪氨酸,这是维持纤维状蛋白结构的关键因素[16]。在反应时间内,荧光强度显著增强(图1-c),由(346.26±4.08) a.u.增强为(604.53±22.75) a.u.。这表明随着反应时间延长,二酪氨酸含量增加。经UniProt数据库(https://www.uniprot.org/uniprotkb/Q99304/entry)检索发现蚕豆(Vicia faba)蛋白Legumin A序列氨基酸83~84为2个酪氨酸“YY”,证实具备二酪氨酸形成条件。因此,促进FP纤维化的驱动力涉及二酪氨酸共价键,与LIU等[17]的结果一致。
2.3 TEM
图2-a显示了在pH 2、85 ℃条件下,反应0~24 h后制备的FPF的TEM图像,为了分析纤维长度的分布,通过ImageJ软件从不同反应时间形成的原纤维溶液的TEM图像中分别随机选择了100个单独的原纤维进行纤维长度分布拟合[18](图2-b)。未反应的蛋白(0 h)样品主要由球状纳米颗粒组成,未观察到纤维状聚集现象。反应4 h后,出现一些较短的纤维状蛋白,平均长度为(224.32±7.23) nm,这些纤维状蛋白由酸热处理过程中多肽片段组装而成[19];反应8 h后,出现一些交织的纤维状蛋白,平均长度也增加为(397.94±22.70) nm;在12 h时,交织的纤维状蛋白增长,平均长度增加为(650.41±19.61) nm;反应16、20、24 h后,生成的长纤维增多,纤维平均长度分别为(679.26±24.88)、(778.84±37.15)、(1 278.10±21.45) nm,长纤维重叠交织形成了网状结构。随着反应时间延长,FPF的平均长度也增加。FPF形成过程符合次级成核模型,呈现出“蛋白水解成肽→组装成核→延长→成熟”的形成规律[20]。
2.4 SDS-PAGE
FP主要显示~37 kDa(α-legumin)和~20 kDa(β-legumin)蛋白条带[21]。经过不同反应时间后FP和FPF的SDS-PAGE图像如图3所示。加热4 h时,大分子的条带向下移动,蛋白质由于酸热水解,分子质量发生改变,随着反应时间的延长,大分子条带逐渐水解成16 kDa以下的片段。这一结果与前人研究一致,植物蛋白(如大豆蛋白[19]、豌豆蛋白[22]和花生蛋白[23]等)经过酸热处理(85 ℃,pH 2.0)后,蛋白水解成小于16 kDa的片段,表明纤维状蛋白是由球形蛋白水解产生的多肽片段构成。
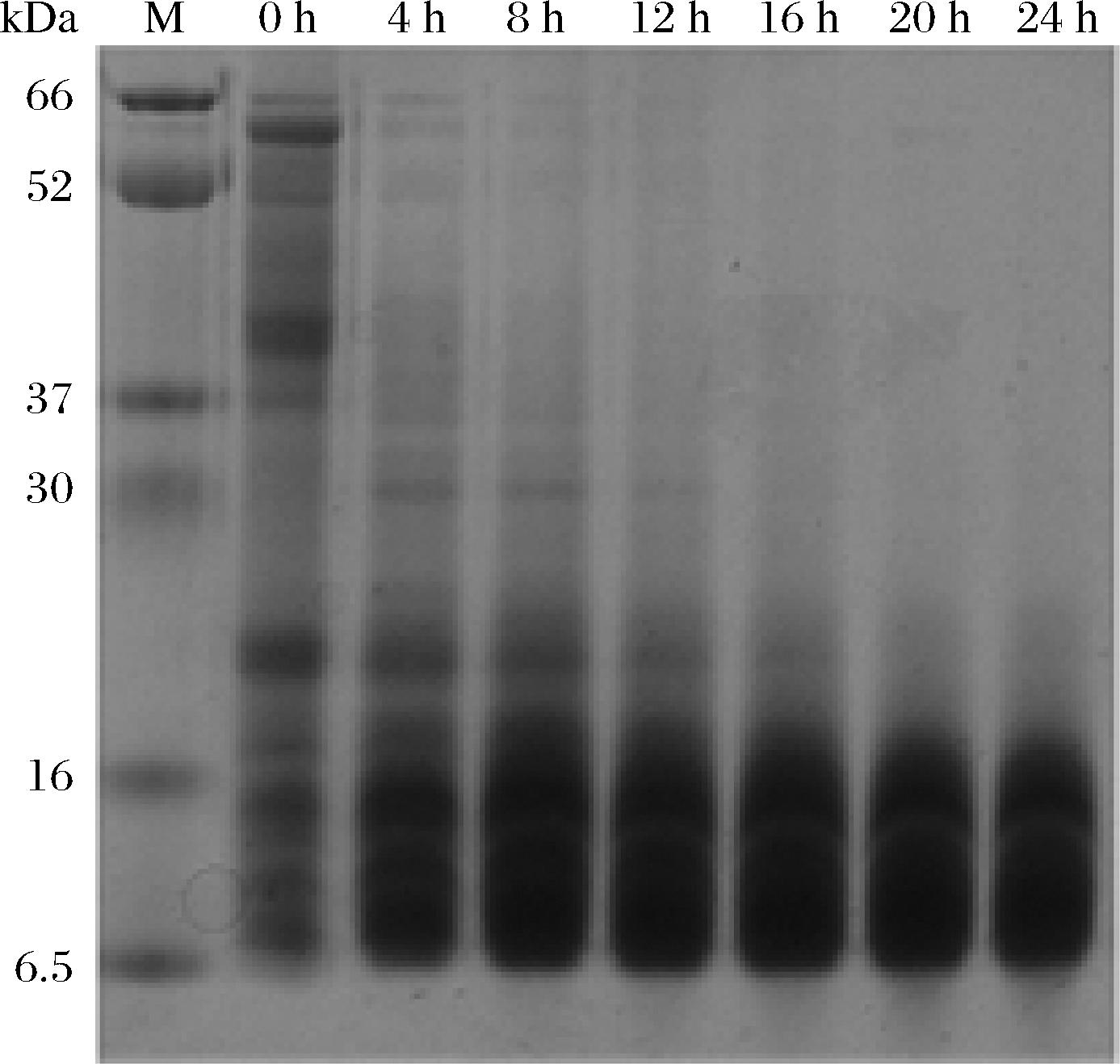
图3 加热过程中FPF SDS-PAGE图
Fig.3 SDS-PAGE image of FPF during heating process
2.5 FTIR
纤维化蛋白形成的过程中往往伴随着蛋白质二级结构的改变,FPF在不同处理时间的FTIR谱图如图4-a所示,二级结构含量的变化如图4-b所示。蛋白处理24 h后,酰胺A带由3 280.39 cm-1移动到3 273.22 cm-1,表明N—H基团的氢键作用增强,可能源于分子间或分子内氢键网络的形成。这通常与蛋白质聚集或结构紧密化有关,如形成β-折叠或淀粉样纤维,导致N—H更多参与氢键;酰胺Ι带由1 652.32 cm-1显著红移到1 626.02 cm-1,提示α-螺旋向β-折叠的构象转变,或蛋白质聚集形成β-转角结构,导致C![]() O基团振动模式改变,表明C—N伸缩和N—H弯曲振动模式变化,进一步支持β-折叠形成或主链构象调整,可能与氢键增强或侧链相互作用变化有关,与酰胺Ⅰ带的β-折叠特征一致[24];酰胺Ⅱ带由1 544.74 cm-1移动到1 523.22 cm-1,酰胺Ⅰ带向较低波数移动说明蛋白质二级结构改变[25]。随着反应时间增加,α-螺旋含量减小,β-折叠含量增加,由0 h的34.44%增加到24 h的45.89%,说明处理导致分子间氢键强化,结构更紧密或刚性,蛋白质发生分子聚集,形成有序的淀粉样纤维的β-折叠结构。
O基团振动模式改变,表明C—N伸缩和N—H弯曲振动模式变化,进一步支持β-折叠形成或主链构象调整,可能与氢键增强或侧链相互作用变化有关,与酰胺Ⅰ带的β-折叠特征一致[24];酰胺Ⅱ带由1 544.74 cm-1移动到1 523.22 cm-1,酰胺Ⅰ带向较低波数移动说明蛋白质二级结构改变[25]。随着反应时间增加,α-螺旋含量减小,β-折叠含量增加,由0 h的34.44%增加到24 h的45.89%,说明处理导致分子间氢键强化,结构更紧密或刚性,蛋白质发生分子聚集,形成有序的淀粉样纤维的β-折叠结构。
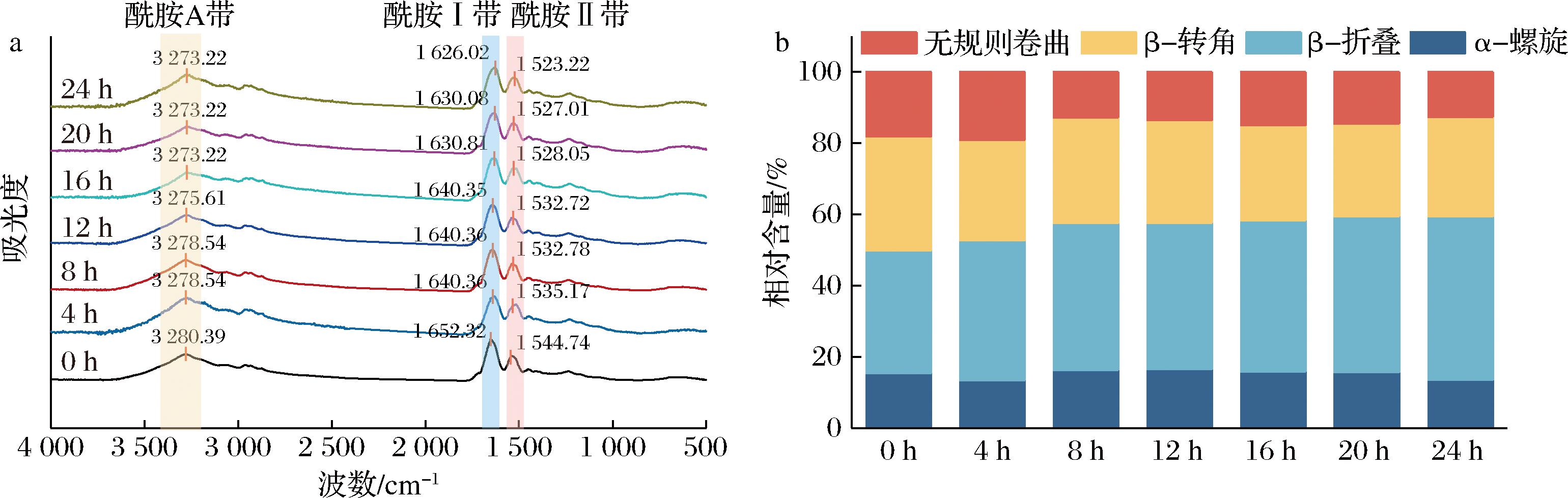
a-FTIR谱图;b-二级结构含量
图4 加热过程中FPF的FTIR谱图及其二级结构含量
Fig.4 FTIR pattern and secondary structure content of FPF during heating process
2.6 乳化性和乳化稳定性
通过测定FP经过不同反应时间后的乳化性和乳化稳定性(图5-a),表征蛋白在油水界面的吸附能力和稳定性。与原始蛋白相比,经过酸热反应后,蛋白乳化性和乳化稳定性都随着反应时间的延长而增加,并在24 h达到最大值。反应24 h后,蛋白乳化性由53.28 m2/g增加到87.92 m2/g,乳化效率增加了65.02%,表明24 h纤维化蛋白比原始蛋白在油水界面的吸附能力更强;乳化稳定性由32.72 min增加到84.89 min,增加了159.44%,表明24 h纤维化使FP乳化稳定性显著提高。结果进一步证明,球状蛋白的展开与重组形成的纤维化蛋白增强了其在油水界面的吸附能力和稳定性[8]。
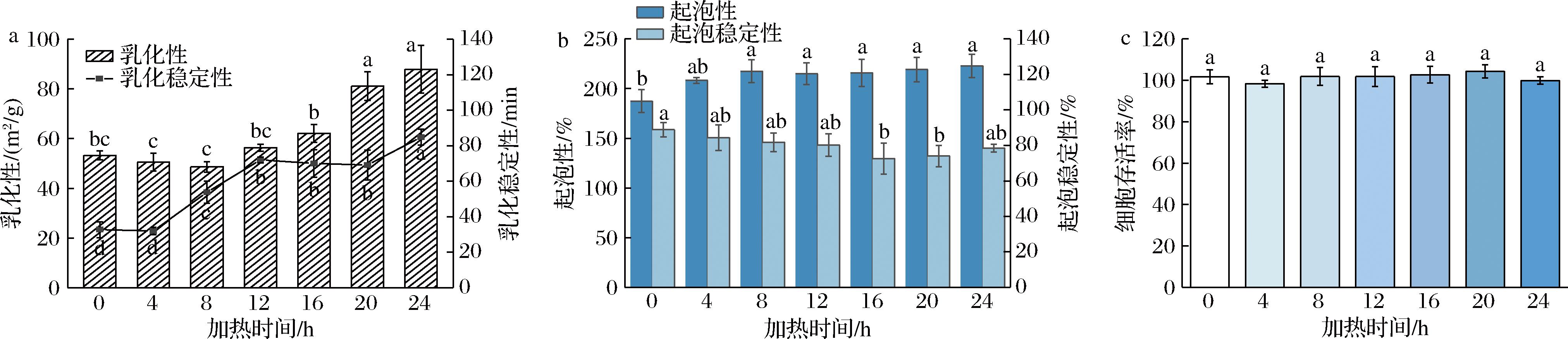
a-乳化性和乳化稳定性;b-起泡性和起泡稳定性;c-细胞毒性
图5 加热过程中FPF功能特性变化
Fig.5 Functional characteristics of FPF during heating process
2.7 起泡性和起泡稳定性
如图5-b所示,在0~24 h反应时间内,FP的起泡性随时间的延长而增加,FP起泡性较好,为187.50%,处理24 h后,起泡性为222.83%,增加了35.33%,这显示原始蛋白水解释放的肽片段、暴露基团和纤维化蛋白易吸附于空气-水界面,形成更多气泡[26]。在0~24 h反应时间内,FP的起泡稳定性由原始蛋白的88.83%降低至78.45%,这表明形成的FPF更容易吸附到空气-水界面,与FP相比起泡稳定性降低,但不同反应时间对FP的起泡稳定性影响不大,基本保持在80%左右。虽然反应24 h后样品起泡稳定性差异不显著,但起泡性显著增加,这一结果与WANG等[27]研究结果一致。
2.8 细胞毒性
为了评估纤维化蛋白的安全性,本研究采用Caco-2细胞来评价纤维化蛋白的体外细胞毒性。如图5-c所示,孵育24 h后,在所有样品中都未观察到细胞活力有显著性变化(P>0.05),细胞活力均在100%左右。已有研究表明,其他食物源的纤维化蛋白,如β-乳球蛋白和溶菌酶[28],都未表现出细胞毒性。这表明FPF展现出卓越的生物相容性,使其在食品领域的应用前景广阔。
2.9 凝胶特性
Ca2+已被广泛用于诱导蛋白凝胶的形成,如中国传统豆制品豆腐的形成。在同等条件(pH 2~3,60 g/L)下,FPF可与15 mmol/L CaCl2溶液形成凝胶,但FP与90 mmol/L CaCl2溶液都无法形成凝胶,说明在酸性条件下,纤维化赋予了FP的凝胶性能,如图6-a所示。在热变性过程中,Ca2+的引入可与FPF形成钙桥,钙桥使肽链更靠近,通过氢键形成稳定的聚集体[29]。如图6-b和图6-c所示,在FPF中加入一定浓度的Ca2+(15~90 mmol/L)后,在一定的角频率(0.1~100 rad/s)下,随着角频率的增加,凝胶的储能模量和损耗模量都增加,样品的G′>G″,表现出半固体状行为[30]。表明FPF与一定浓度的Ca2+(15~90 mmol/L)形成凝胶的过程中,储能模量和损耗模量与Ca2+浓度呈正相关。
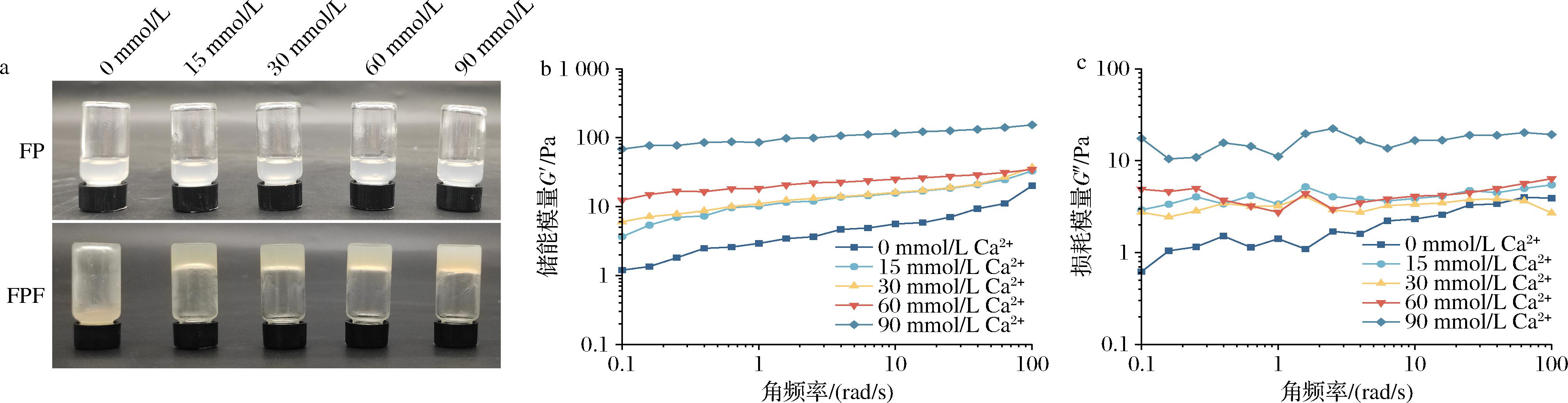
a-凝胶图片;b-储能模量;c-损耗模量
图6 CaCl2对FP和FPF凝胶形态与流变特性的影响
Fig.6 Influence of CaCl2 on the gel morphology and rheological properties of FP and FPF
3 结论
本研究在酸热条件下(pH 2,85 ℃)制备了具有纤维状结构的FPF。FPF的形成有滞后期、生长期和平衡期这3个阶段。FP在反应初期,球状蛋白水解成大量具有自组装能力的肽;随着反应时间的延长,蛋白的ThT荧光强度增大,肽组装形成较多的长纤维状蛋白,二级结构也发生改变,β-折叠含量由0 h的34.44%增加到24 h的45.89%。酸热反应24 h后,FPF与FP相比表现出更好的起泡性、乳化性和凝胶特性。本研究为FP纤维化改性提供了理论基础,且纤维化过程中不涉及其他化学试剂的残留,因此,纤维化蛋白具有良好的应用前景。
[1] WANG Z M, LAN T T, JIANG J, et al.On the modification of plant proteins:Traditional methods and the hofmeister effect[J].Food Chemistry, 2024, 451:139530.
[2] 王悦, 管春花, 毕洪, 等.植物蛋白的降脂功效及其应用潜力[J].食品工业科技, 2025, 46(2):412-421.WANG Y, GUAN C H, BI H, et al.Lipid-lowering efficacy of plant proteins and their application potential[J].Science and Technology of Food Industry, 2025, 46(2):412-421.
[3] JOHANSSON M, JOHANSSON D, STRÖM A, et al.Effect of starch and fibre on faba bean protein gel characteristics[J].Food Hydrocolloids, 2022, 131:107741.
[4] JOHANSSON M, KARKEHABADI S, JOHANSSON D P, et al.Gelation behaviour and gel properties of the 7S and 11S globulin protein fractions from faba bean (Vicia faba var.minor) at different NaCl concentrations[J].Food Hydrocolloids, 2023, 142:108789.
[5] GUEGUEN J, CERLETTI P.Proteins of Some Legume Seeds:Soybean, Pea, Fababean and Lupin[M].Boston, MA:Springer US, 1994.
[6] 王金梅, 王梦萍, 韦翠兰, 等.大豆球蛋白的纤维聚集体行为及其稳定性研究[J].现代食品科技, 2017, 33(11):42-48;118.WANG J M, WANG M P, WEI C L, et al.Fibrillar aggregation behavior and stability of soy globulin[J].Modern Food Science and Technology, 2017, 33(11):42-48;118.
[7] 彭圆, 翟月滢, 刘采怡, 等.米谷蛋白淀粉样纤维聚集体自组装过程中蛋白质结构演变、功能性质及体外消化性研究[J].中国食品学报, 2023, 23(3):30-38.PENG Y, ZHAI Y Y, LIU C Y, et al.Studies on the structural evolution, functional and in vitro digestive properties of rice glutelin during the self-assembly of the amyloid fibril aggregates[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(3):30-38.
[8] DONG W Y, ZHANG X Y, DING L X, et al.Enhancement of emulsification properties by modulation of egg white protein fibril structure with different heating times[J].Food Hydrocolloids, 2023, 135:108203.
[9] XU J Z, TANG M Q, WANG D P, et al.Exploring the self-assembly journey of oat globulin fibrils:From structural evolution to modified functionality[J].Food Hydrocolloids, 2024, 149:109587.
[10] HERNEKE A, LENDEL C, KARKEHABADI S, et al.Protein nanofibrils from fava bean and its major storage proteins:Formation and ability to generate and stabilise foams[J].Foods, 2023, 12(3):521.
[11] SUCHKOV V V, POPELLO I A, GRINBERG V Y, et al.Isolation and purification of 7S and 11S globulins from broad beans and peas[J].Journal of Agricultural and Food Chemistry, 1990, 38(1):92-95.
[12] KUTZLI I, ZHOU J T, LI T, et al.Formation and characterization of plant-based amyloid fibrils from hemp seed protein[J].Food Hydrocolloids, 2023, 137:108307.
[13] TANG C H, WANG C S.Formation and characterization of amyloid-like fibrils from soy β-conglycinin and glycinin[J].Journal of Agricultural and Food Chemistry, 2010, 58(20):11058-11066.
[14] LIU C R, WU D, WANG P J, et al.Study on the formation mechanism of pea protein nanofibrils and the changes of structural properties of fibril under different pH and temperature[J].Food Hydrocolloids, 2024, 150:109735.
[15] AROSIO P, KNOWLES T P J, LINSE S.On the lag phase in amyloid fibril formation[J].Physical Chemistry Chemical Physics, 2015, 17(12):7606-7618.
[16] MAINA M B, AL-HILALY Y K, OAKLEY S, et al.Dityrosine cross-links are present in Alzheimer’s disease-derived tau oligomers and paired helical filaments (PHF) which promotes the stability of the PHF-core tau (297-391) in vitro[J].Journal of Molecular Biology, 2022, 434(19):167785.
[17] LIU Z W, TANG P P, LIU C, et al.Promoting ovalbumin amyloid fibrils formation by cold plasma treatment and improving its emulsifying properties[J].Food Hydrocolloids, 2025, 158:110531.
[18] XU Z J, WANG X S, GAO Y, et al.Structural insights into acidic heating-induced amyloid fibrils derived from soy protein as a function of protein concentration[J].Food Hydrocolloids, 2023, 145:109085.
[19] JI F Y, XU J J, OUYANG Y Y, et al.Effects of NaCl concentration and temperature on fibrillation, structure, and functional properties of soy protein isolate fibril dispersions[J].LWT, 2021, 149:111862.
[20] ANDERSEN C B, YAGI H, MANNO M, et al.Branching in amyloid fibril growth[J].Biophysical Journal, 2009, 96(4):1529-1536.
[21] OLUWAJUYITAN T D, ALUKO R E.Structural and functional properties of fava bean legumin and vicilin protein fractions[J].International Journal of Food Science &Technology, 2024, 59(9):6698-6716.
[22] YI J, HE Q Y, PENG G F, et al.Improved water solubility, chemical stability, antioxidant and anticancer activity of resveratrol via nanoencapsulation with pea protein nanofibrils[J].Food Chemistry, 2022, 377:131942.
[23] WANG K X, ZHANG J, FU Z Y, et al.Oleogels based on peanut protein isolate fibrils:Structural characterization dependent on induction time and suitability in marguerite biscuits[J].Food Hydrocolloids, 2024, 154:110106.
[24] YU Z C, LI N, LIU Y A, et al.Formation, structure and functional characteristics of amyloid fibrils formed based on soy protein isolates[J].International Journal of Biological Macromolecules, 2024, 254:127956.
[25] CAO Z C, WANG X S, ZHAO J W, et al.Elucidating the modulatory influence of Hofmeister divalent ions on the structural dynamics and rheological properties of soy protein amyloid fibrils[J].Food Hydrocolloids, 2024, 151:109871.
[26] LI T, WANG L, GENG H, et al.Formation, structural characteristics, foaming and emulsifying properties of rice glutelin fibrils[J].Food Chemistry, 2021, 354:129554.
[27] WANG R, WANG L H, WEN Q H, et al.Combination of pulsed electric field and pH shifting improves the solubility, emulsifying, foaming of commercial soy protein isolate[J].Food Hydrocolloids, 2023, 134:108049.
[28] XU D, ZHOU J T, SOON W L, et al.Food amyloid fibrils are safe nutrition ingredients based on in-vitro and in-vivo assessment[J].Nature Communications, 2023, 14:6806.
[29] ZHOU F Z, ZHANG L P, ZHENG M X, et al.Effects of calcium sulfate on soy protein isolate-based emulsion microgels[J].LWT, 2024, 205:116562.
[30] 刘丽莉, 段京瑶, 郭悦, 等.明胶和马铃薯淀粉对大豆分离蛋白凝胶3D打印性能的影响[J].食品与发酵工业, 2025, 51(13):253-260.LIU L L, DUAN J Y, GUO Y, et al.Effects of gelatin and potato starch on the 3D printing performance of soy protein isolate gels[J].Food and Fermentation Industries, 2025, 51(13):253-260.