牦牛乳是青藏高原地区特有的乳资源,年产量达150万t,具有高营养价值和独特的感官品质。其中,蛋白质含量约为5.3 g/100 mL,脂肪含量达5.04 g/100 mL,乳糖含量达5.5 g/100 mL,总固形物约为16.66 g/100 mL,显著高于黑白花牛乳[1]。研究表明,牦牛乳是生产干酪和酸奶的优质原料[2]。然而,除少部分牦牛乳被牧民直接饮用外,大部分牦牛乳被用于制作酥油和曲拉,附加值极低。随着乳品工业和营养科学的发展,乳成分的新功能被陆续发掘,乳源功能物质的开发与利用已成为乳品行业实现突破的新方向,功能基料的国产化研究也因此迫在眉睫。
酪蛋白占牛乳总蛋白的80%,绝大多数酪蛋白在牛乳中以特定方式聚集,与钙、磷、镁等矿物质共同构成胶束的形式,其粒径为40~300 nm[3]。研究表明,牦牛乳酪蛋白胶束含量(4.1 g/100 mL)亦高于黑白花牛乳[4]。牦牛乳酪蛋白胶束平均粒径为218.6 nm(黑白花牛乳178.5 nm),胶束中αs1-、αs2-、β-和κ-酪蛋白的相对含量分别为43%、12%、32%和13%;牦牛酪蛋白胶束的钙和磷浓度(分别为26.0、19.9 mmol/L)高于奶牛酪蛋白胶束(分别为23.0、11.9 mmol/L)[5]。目前,酪蛋白胶束的制备方法包括酸沉淀法、膜分离法、超速离心法、酶解法[6]及色谱层析分离法[7]等,每种方法优缺点各异。酸沉淀法通过添加酸(如醋酸、乳酸或磷酸等)降低溶液的pH值至等电点,使酪蛋白分子聚集并形成胶束沉淀,该方法操作简便,成本低廉,可能对其他物质(如钙)含量造成影响;膜分离法通过控制膜的孔径选择性地分离溶液中的不同组分,达到分离胶束的目的,具有高选择性和高效性,但膜污染、设备投资和膜材料成本是其主要的局限性;超速离心能够在短时间内通过高速旋转将酪蛋白胶束与其他小分子物质(如乳糖、脂肪、矿物质等)分离开来,能够实现高效纯化,且能避免化学试剂污染,得到的酪蛋白胶束更接近于天然状态;酶解法利用特定的蛋白酶在特定条件下对酪蛋白进行水解,产生具有一定生物活性的小分子肽或胶束结构,所制备的酪蛋白胶束具有功能性高的优点,然而,酶解法的工艺控制较为复杂,成本较高,且难以把控最终产物的质量;色谱层析通过酪蛋白胶束与色谱介质之间的相互作用(如吸附、亲水性、疏水性等),实现对酪蛋白胶束的高效分离,此方法较为灵活,可以根据酪蛋白胶束的性质(如大小、表面电荷、疏水性等)选择不同的色谱柱以达成分离目的;但是在实际应用中,其对成本、时间和设备的要求较高,使其存在一定局限性。
本文通过酸沉法和超速离心法分离和制备牦牛乳酪蛋白胶束,以黑白花牛乳酪蛋白为对照,并采用凯氏定氮法、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)法、透射电镜成像法等方法系统地研究了其中蛋白质、水分、灰分、矿物质、单体组成、胶束的平均粒径、二级结构、三级结构及微观结构,研究结果为酪蛋白产品开发及牦牛乳功能基料化提供思路和参考。
1 材料与方法
1.1 试验材料
牦牛乳混合乳样采自甘肃省天祝藏族自治县抓喜秀龙镇,低温(≤4 ℃)2 h内运回实验室;黑白花牛乳采自甘肃农业大学奶牛场,低温(≤4 ℃)2 h内运回实验室。
K2HPO4(分析纯),天津市光复科技发展有限公司;三羟甲基氨基甲烷(Tris,分析纯)、β-巯基乙醇(色谱纯)、三氟乙酸(色谱纯),上海源叶生物科技有限公司;叠氮钠(分析纯),天津市科密欧化学试剂有限公司;柠檬酸钾(分析纯)、柠檬酸钠(分析纯),上海亨代劳生物有限公司;硫酸钾(分析纯),环球上清北京科技有限公司;MgCl2(分析纯),天津市光复科技发展有限公司;KOH(分析纯),天津市大陆化学试剂厂;冰醋酸(分析纯),山东普惠化学科技有限公司;乙腈(色谱纯),上海吉智生化科技有限公司;尿素(色谱纯),美国 Sigma-Aldrich 公司。
0.5 mol/L醋酸缓冲液:取约30.04 g的冰乙酸(分子质量约60.05 g/mol)和约41.02 g的乙酸钠(分子质量约82.03 g/mol)。将冰乙酸和乙酸钠分别溶解在少量蒸馏水中,混合后定容至1 L。
乳模拟液(simulated milk ultrafiltrate,SMUF)[5]:称取1.58 g KH2PO4、1.20 g柠檬酸钾一水合物、1.79 g二水合柠檬酸钠、0.18 g K2SO4、1.32 g CaCl2·2H2O、0.65 g MgCl2·6H2O、0.30 g K2CO3和0.60 g KCl于1 L超纯水中,将溶液转移至1 L容量瓶中定容。用KOH调节pH值至6.6。
1.2 试验方法
1.2.1 酪蛋白胶束的制备
采集的原料乳中分别加入0.2 g/L的叠氮钠和0.2 g/L的胰蛋白酶抑制剂。并于4 000×g离心脱脂20 min,再用3层纱布过滤3次,弃去上层脂肪,该步骤重复3次,得到脱脂牛乳。
1.2.1.1 酸沉淀法
参照PTI EK SIRO
EK SIRO I
I 等[8]的方法并略作修改,采用0.5 mol/L醋酸缓冲液将脱脂乳pH值调节至4.6,静置20 min,于20 ℃,4 000×g离心20 min,弃去上清液,再用适量蒸馏水洗涤沉淀并于4 000×g离心20 min,得到酸沉酪蛋白胶束(Casein A)。
等[8]的方法并略作修改,采用0.5 mol/L醋酸缓冲液将脱脂乳pH值调节至4.6,静置20 min,于20 ℃,4 000×g离心20 min,弃去上清液,再用适量蒸馏水洗涤沉淀并于4 000×g离心20 min,得到酸沉酪蛋白胶束(Casein A)。
1.2.1.2 超速离心法
参照李启明[9]的方法,取脱脂乳于20 ℃,100 000×g离心1 h,取下层沉淀,即得酪蛋白胶束(Casein U)。
1.2.2 酪蛋白胶束溶液的配制
参照ZHANG等[5]的方法,称取2.8 g酪蛋白胶束,置于SMUF中,于室温在磁力搅拌器上持续溶解24 h,即得酪蛋白胶束溶液。
1.2.3 酪蛋白胶束的理化性质
1.2.3.1 胶束的得率
记录称取原料乳的质量,以及用2种方法制备后得到的胶束的质量。得率计算如公式(1)所示:
得率![]()
(1)
式中:m0,离心前乳样的质量,g;m1,离心后所得产物的质量,g。
1.2.3.2 胶束的组成
1)水分含量:依据GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中的方法测定。
2)蛋白含量:采用凯氏定氮法,转化系数6.25。
3)灰分:依据GB 5009.4—2010《食品安全国家标准 食品中灰分的测定》中的方法测定。
4)酪蛋白单体占比
参照MA等[10]的方法,准确移取1.75 g样品,溶于4 mL缓冲液[含8 mol/L尿素,165 mmol/L Tris,44 mmol/L柠檬酸钠和0.3%(体积分数)巯基乙醇]中,溶液经0.45 μm膜过滤,备用。
高效液相色谱仪配备C18(150 mm×4.6 mm, 300Å pores, 5 μm particles)色谱柱。流动相A为:V(乙腈)∶V(水)∶V(三氟乙酸)=100∶899∶1;B为V(乙腈)∶V(水)∶V(三氟乙酸)=899∶100∶1。紫外检测器为波长220 nm,进样量50 μL。以柱温为25 ℃进行线性洗脱。梯度洗脱程序具体条件如下:初始阶段(0~13 min)以0.5 mL/min的恒定流速进行洗脱,流动相B的比例由20%线性增加至31.3%;随后维持31.3%的B相比例3 min(13~16 min);继而以相同流速在3 min内(16~19 min)将B相比例提升至34.7%,并保持3 min(19~22 min);之后在2 min内(22~24 min)将B相比例调整至36%,并稳定维持5 min(24~29 min);随后在2 min内(29~31 min)将B相比例升至38.2%,保持5 min(31~36 min);继而用2 min(36~38 min)将B相比例提升至40.8%,稳定2 min(38~40 min);最终在6 min内(40~46 min)完成B相比例从40.8%至46%的线性递增,整个洗脱过程始终保持0.5 mL/min的恒定流速。对照标准品出峰时间,计算各组份峰面积及单体占比。
1.2.4 酪蛋白胶束的平均粒径及电势
参照张光地[11]的方法,采用去离子水将酪蛋白胶束溶液稀释100倍,粒度仪设置波长为450 nm,散射角度为85°,测量模式为动态光散射(dynamic light scattering,DLS),于室温下测量,采用纳米粒度仪检测纳米粒子的zeta-电位。
1.2.5 酪蛋白胶束的结构
1.2.5.1 二级结构
参照孙一健等[12]的方法,采用FTIR设备测定。扫描波数范围:4 000~400 cm-1,分辨率:4 cm-1。将采集到的时间域数据进行傅里叶变换,得到红外光谱图。利用Amide I(1 600~1 700 cm-1)和Amide II(1 500~1 600 cm-1)区域的吸收峰来分析蛋白质的二级结构。使用Peakfit 4.12软件对二级结构的相对占比进行分析。
1.2.5.2 三级结构
参照张光地[11]的方法,准确移取1.0 mL酪蛋白胶束溶液并加入9.0 mL去离子水稀释。再加入200 μL荧光试剂8-苯胺基1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)(8.0×10-3mol/L),静置3 min后进行荧光光谱扫描。扫描波段设置为400~650 nm,狭缝设置为5.0 nm。
1.2.6 酪蛋白胶束的微观结构
参照CHEN等[13]的方法,利用透射电子显微镜观察酪蛋白胶束的形态。将1滴稀释100倍的酪蛋白胶束溶液滴在带碳膜的铜载网上,静置5 min 后用滤纸吸走多余的样液,于室温下继续干燥10 min。再将1滴10 g/L的阴性染色剂磷钨酸滴在铜网上,5 min后用滤纸吸走多余的样液,并于室温下干燥 10 min。利用透射电子显微镜,在不同放大倍数下观察酪蛋白胶束的整体和个体形态。
1.2.7 数据分析
试验重复3次,使用SPSS 27.0.1进行方差分析和显著性分析,P<0.05具有显著性差异。使用 Origin 8.5软件作图。
2 结果与分析
2.1 酪蛋白胶束的理化性质
2.1.1 酪蛋白胶束的组成
酸沉法和超速离心法制备的酪蛋白胶束得率和组成见表1,由表1可知,超速离心法制备胶束的得率高于酸沉淀法,这可能是由于pH降低,H+置换酪蛋白胶束中Ca2+,当胶束内钙桥损失殆尽后,胶束崩解,最终沉降物中蛋白质含量降低[14]。另外,牦牛乳酪蛋白含量显著高于黑白花牛乳黑白花含量。U-casein中水分含量高于A-casein,这也反过来印证超速离心法得到天然的酪蛋白胶束,水合能力更强[15]。与此同时,U-casein中蛋白质含量高于A-casein,也表明pH值达到4.6时,酪蛋白胶束崩解,部分游离的蛋白质随上层清液弃去[16]。显而易见,当 pH值从6.8降至4.6时,Ca3(HPO4)2从酪蛋白胶束中释放出来,U-casein中矿物质含量高于A-casein中,尤其以Ca差异最显著。
表1 酪蛋白胶束的组分
Table 1 Components of casein micelles

组别得率/(g/100 mL)水分含量/%蛋白质含量/%灰分含量/%矿物质含量/(mg/L)CaKNaMgPA-Cow8.17±0.50d57.86±1.37b34.41±3.88b3.82±0.85a1 042.54±4.21d445.36±10.45b142.82±1.01c164.89±2.93c1 483.26±10.69dU-Cow11.92±0.76b58.52±2.02a38.92±1.17ab3.88±0.31a1 175.05±1.71c477.14±9.03a149.34±1.23b171.07±7.30c1 549.92±13.66cA-Yak9.81±0.15c57.20±1.50b36.07±2.50ab3.65±0.44a1 276.35±2.35b453.13±5.11b206.37±0.69a192.66±8.13b1 607.66±9.37bU-Yak13.14±0.15a59.18±0.44a39.95±1.83a3.28±0.24a1 488.63±2.21a487.57±8.77a206.82±0.85a206.07±2.19a1 683.06±12.32a
注:表中数据为“平均数±标准差”。a~d中不同的字母表示差异显著(P<0.05)。
2.1.2 酪蛋白胶束中单体占比
由图1可知,酸沉淀法和超速离心法制备的酪蛋白胶束αs1-、αs2-、β-和κ-酪蛋白的占比约为4∶1∶4∶1,符合理论值。
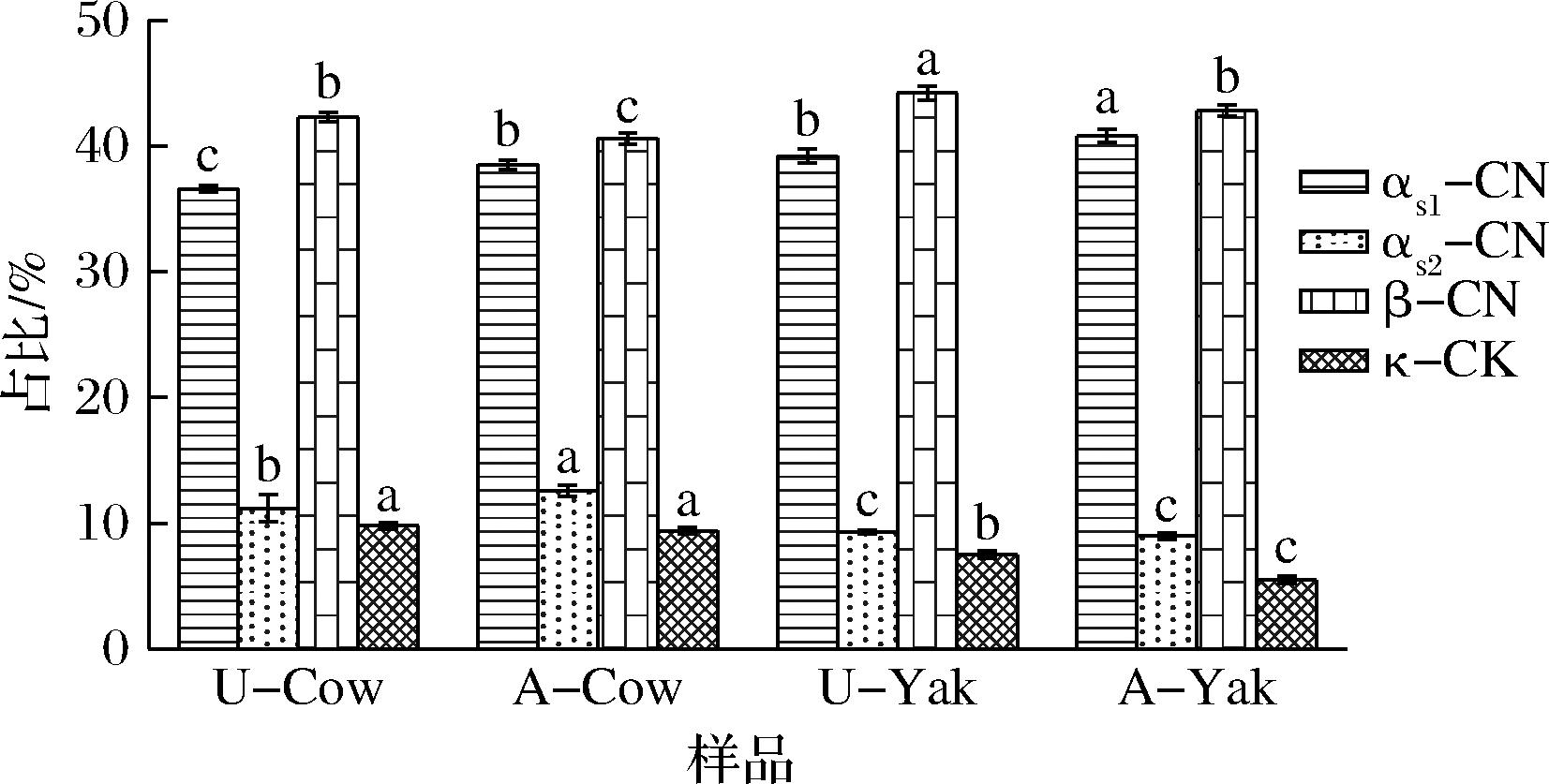
图1 牦牛乳和黑白花牛乳4种酪蛋白在胶束中所占比例
Fig.1 Yak milk and Holstein cow’s milk casein proportion in micelles
注:a~d中不同的字母表示差异显著(P<0.05)。
2种分离方法对于αs2-CN和κ-CN含量在统计学上并无显著性影响,对于αs1-CN和β-CN影响明显:U-casein中β-CN含量显著高于A-casein,而A-casein中αs1-CN含量则显著高于U-casein。根据HOLT等[17]的研究,κ-CN主要分布在胶束表面,β-CN和αs-CN主要分布在胶束内部。在进行酸沉淀的过程中,随着pH值降至4.6,胶束内部结构发生崩解,造成酪蛋白单体流失。同时由于β-CN的疏水性高于αs1-CN[18],稳定性更高,更加难以溶于上层清液,故可更完整地保存于胶束中。与黑白花牛乳酪蛋白胶束相比,牦牛乳酪蛋白胶束中αs1-和β-CN的比例更高,但是αs2-和κ-CN的比例更低。
2.1.3 酪蛋白胶束的平均粒径及zeta-电位
酸沉淀和超速离心法得到的酪蛋白胶束的平均粒径和zeta-电位如图2、图3所示,由图2可知,牦牛乳酪蛋白胶束的平均粒径(约190 nm)显著大于黑白花牛乳(约120 nm),这与LI等[19]研究的结果相符。与此同时,酸沉淀得到的酪蛋白胶束平均粒径要大于超速离心法得到的胶束(约3~6 nm),这首先是因为酸沉淀过程中伴随的钙磷酸盐变化。随着pH降低,胶束中的钙磷酸盐开始溶解,Ca2+从胶束中释放。Ca2+在维持胶束完整性方面起关键作用,胶束的内部结构被破坏,并发生重组,结构重组导致胶束膨胀或解体,形成新的、更大的聚集体[16]。其次,pH降低导致酪蛋白分子间的静电排斥力减弱,复溶后的酪蛋白胶束处于蓬松状态。超速离心法主要依赖于离心力分离不同组分,其过程保持了胶束的天然状态,对于磷酸盐影响不大,使胶束结构相对稳定。
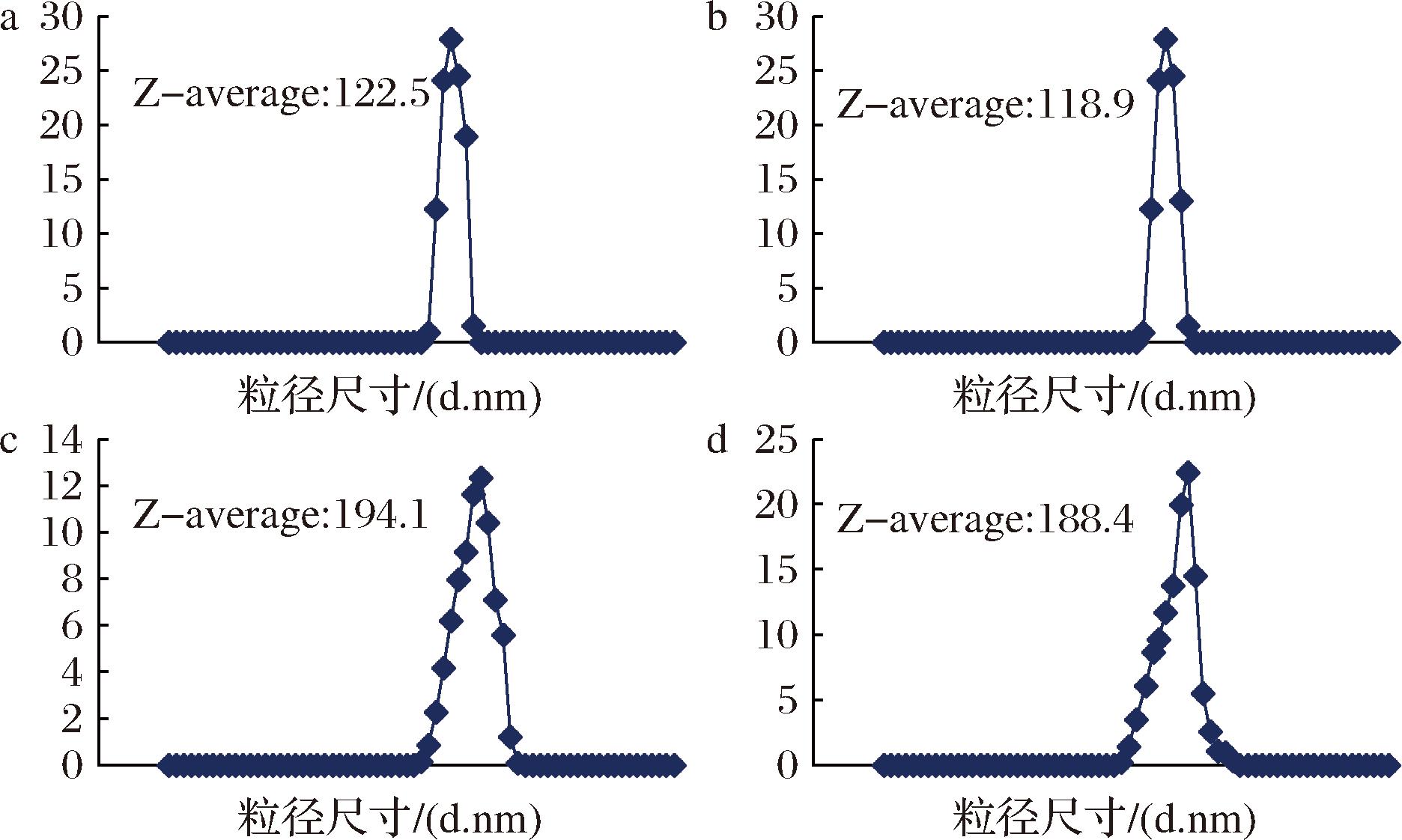
a-A-Cow;b-U-Cow;c-A-Yak;d-U-Yak
图2 酪蛋白胶束的平均粒径
Fig.2 Average particle size of casein micelles
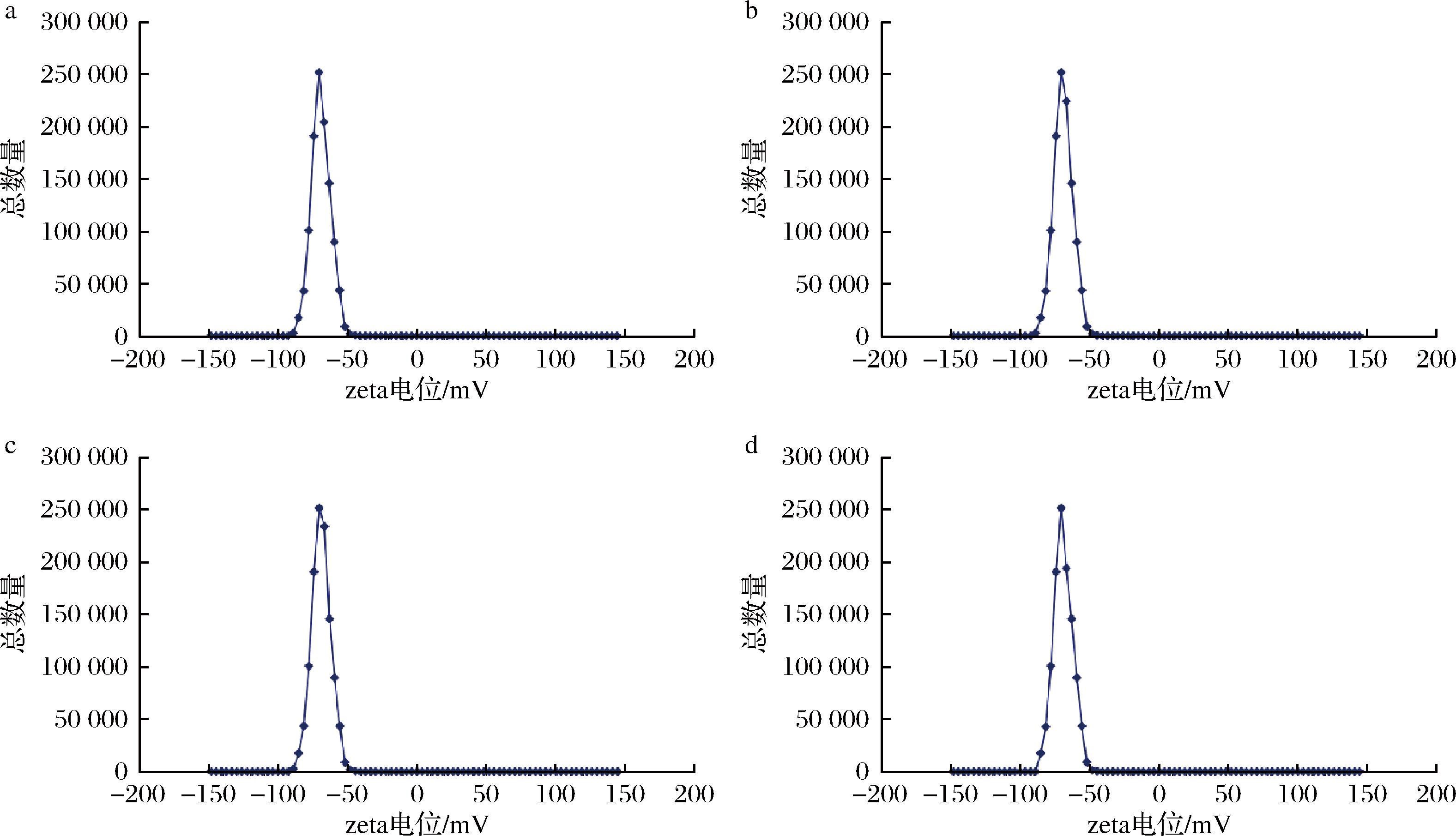
a-A-Cow;b-U-Cow;c-A-Yak;d-U-Yak
图3 酪蛋白胶束的zeta-电位
Fig.3 Zeta-potentials of casein micelles
Zeta-电位图(图3)也表明,酸沉淀法得到的胶束表面所带负电荷相对较少,这与刘晶晶等[20]研究结果相符,在pH持续下降时,胶束表面负电荷数量呈减少趋势。Zeta电位(正或负)越高,体系越稳定,即溶解或分散可以抵抗聚集。反之,越倾向于凝结或凝聚。即超速离心法得到的酪蛋白胶束体系更加稳定,与MCMAHON等[16]研究结果相符。
此外,由表2可知,牦牛乳的酪蛋白胶束具有更多的负电荷,这可能与牦牛乳中不同类型的酪蛋白亚型有关,牦牛乳酪蛋白胶束中的酪蛋白含有更多的磷酸基团(磷酸化酪蛋白),影响其表面电荷,表现出更强的静电斥力,这与李启明[9]的研究结果相符。
表2 酪蛋白胶束的zeta-电位表
Table 2 Table of zeta-potentials of casein micelles
样品A-CowU-CowA-YakU-Yak电位-9.45-10.54-10.27-11.08
2.2 酪蛋白胶束的二级和三级结构
2.2.1 二级结构
如图4所示,超速离心法得到的酪蛋白胶束的吸收峰强度明显高于酸沉淀法所得胶束。酪蛋白胶束在400~1 700 cm-1处有多个吸收峰,酰胺A带(3 200~3 400 cm-1)代表N—H和O—H的伸缩振动。酪蛋白胶束的红外光谱在酰胺I带(1 670~1 600 cm-1)有特征峰,研究表明,C![]() O 伸缩振动吸收峰位于1 600~1 700 cm-1的酰胺I带,峰面积受蛋白质二级结构的组成影响,因此使用该处波数计算蛋白质二级结构的组成[21]。酰胺I带中各子峰对应的二级结构分别为:1 657~1 651 cm-1为α-螺旋,1 634~1 608 cm-1为β-折叠,1 670~1 667 cm-1为β-转角,1 691~1 686 cm-1为β-折叠,1 650~1 640 cm-1为无规则卷曲[22]。使用Peakfit 4.12软件对1 600~1 700 cm-1波数区域吸收峰进行基线校正并使用高斯二阶导数拟合,发现此区域主要的二级结构是β-折叠与β-转角结构,以及少量的α-螺旋和无规则卷曲结构,与杨敏等[23]的研究结果相符。
O 伸缩振动吸收峰位于1 600~1 700 cm-1的酰胺I带,峰面积受蛋白质二级结构的组成影响,因此使用该处波数计算蛋白质二级结构的组成[21]。酰胺I带中各子峰对应的二级结构分别为:1 657~1 651 cm-1为α-螺旋,1 634~1 608 cm-1为β-折叠,1 670~1 667 cm-1为β-转角,1 691~1 686 cm-1为β-折叠,1 650~1 640 cm-1为无规则卷曲[22]。使用Peakfit 4.12软件对1 600~1 700 cm-1波数区域吸收峰进行基线校正并使用高斯二阶导数拟合,发现此区域主要的二级结构是β-折叠与β-转角结构,以及少量的α-螺旋和无规则卷曲结构,与杨敏等[23]的研究结果相符。
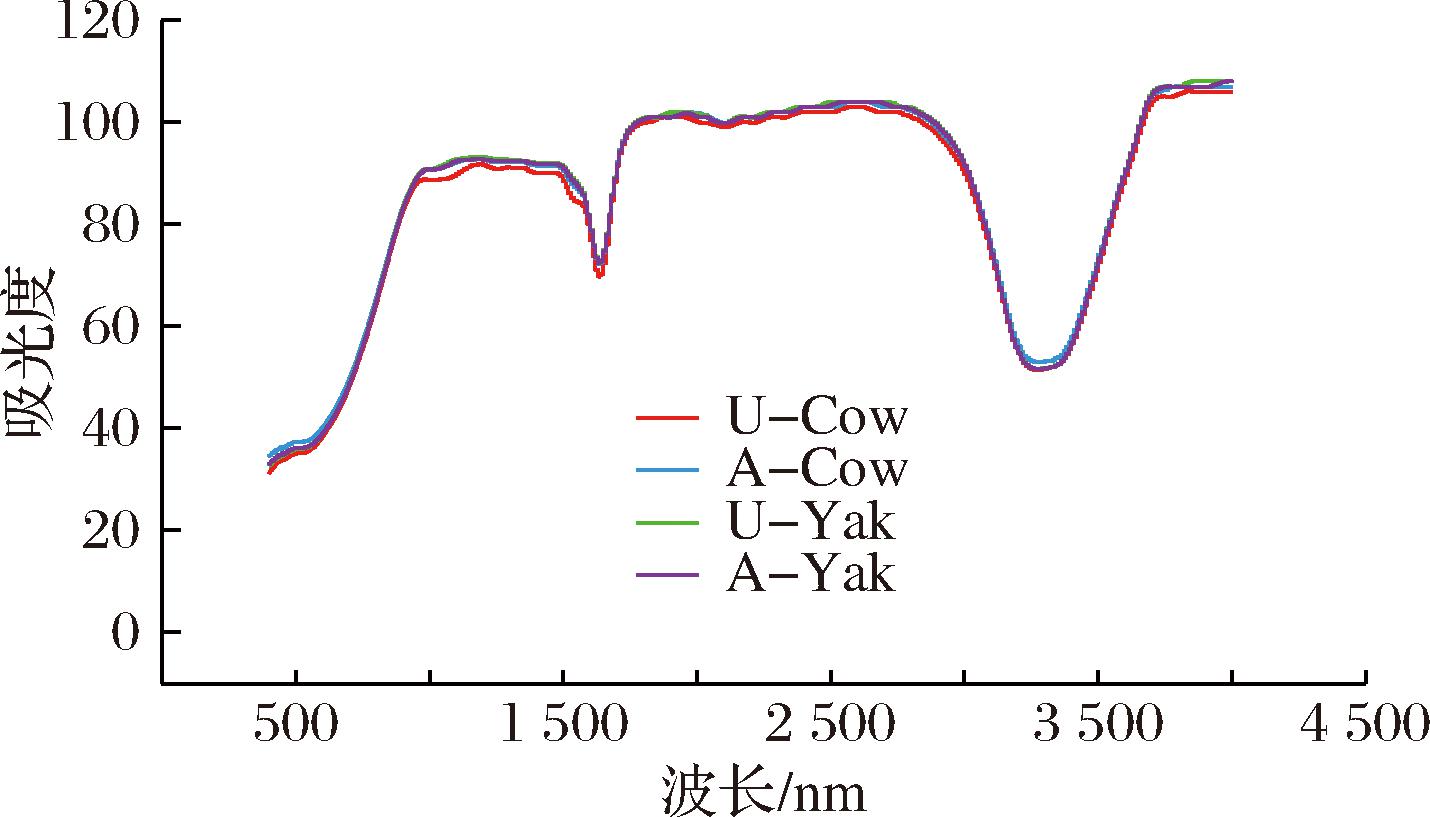
图4 酪蛋白胶束的FTIR图
Fig.4 FTIR spectra of casein micelles
如图5所示,酸沉淀法得到的酪蛋白胶束有更多无规则卷曲(A-Cow:12.6%;A-Yak:8.9%),但超速离心法得到的胶束β-折叠的占比显著更高(U-Cow:42.4%;U-Yak:45.0%)。α-螺旋含量低,且未见统计学差异。以上结果与杨敏等[23]的研究结果相符。这可能是超速离心得到的酪蛋白胶束中Ca2+的含量更高,促进了酪蛋白中β-折叠结构的形成。

图5 酪蛋白胶束的二级结构占比
Fig.5 Secondary structure share of casein micelles
2.2.2 三级结构
如图6所示,超速离心法所得的胶束λmax为365 nm,而酸沉淀法所得的胶束λmax在355~360 nm,这可能是由于蛋白质分子部分解折叠,蛋白质表面更多非极性基团暴露于周围的水环境,更高的λmax值也表明蛋白质更加亲水。荧光强度低说明游离的色氨酸少。根据LIU等[24]研究,酸沉淀得到的胶束其三级结构更蓬松,这是因为内部结构发生了崩塌,酪蛋白胶束的疏水基团更多地暴露在外,而内部结构的变化会导致色氨酸残基的隐藏,从而使荧光强度下降。综上所述,酪蛋白胶束的表面疏水性和荧光强度呈负相关。
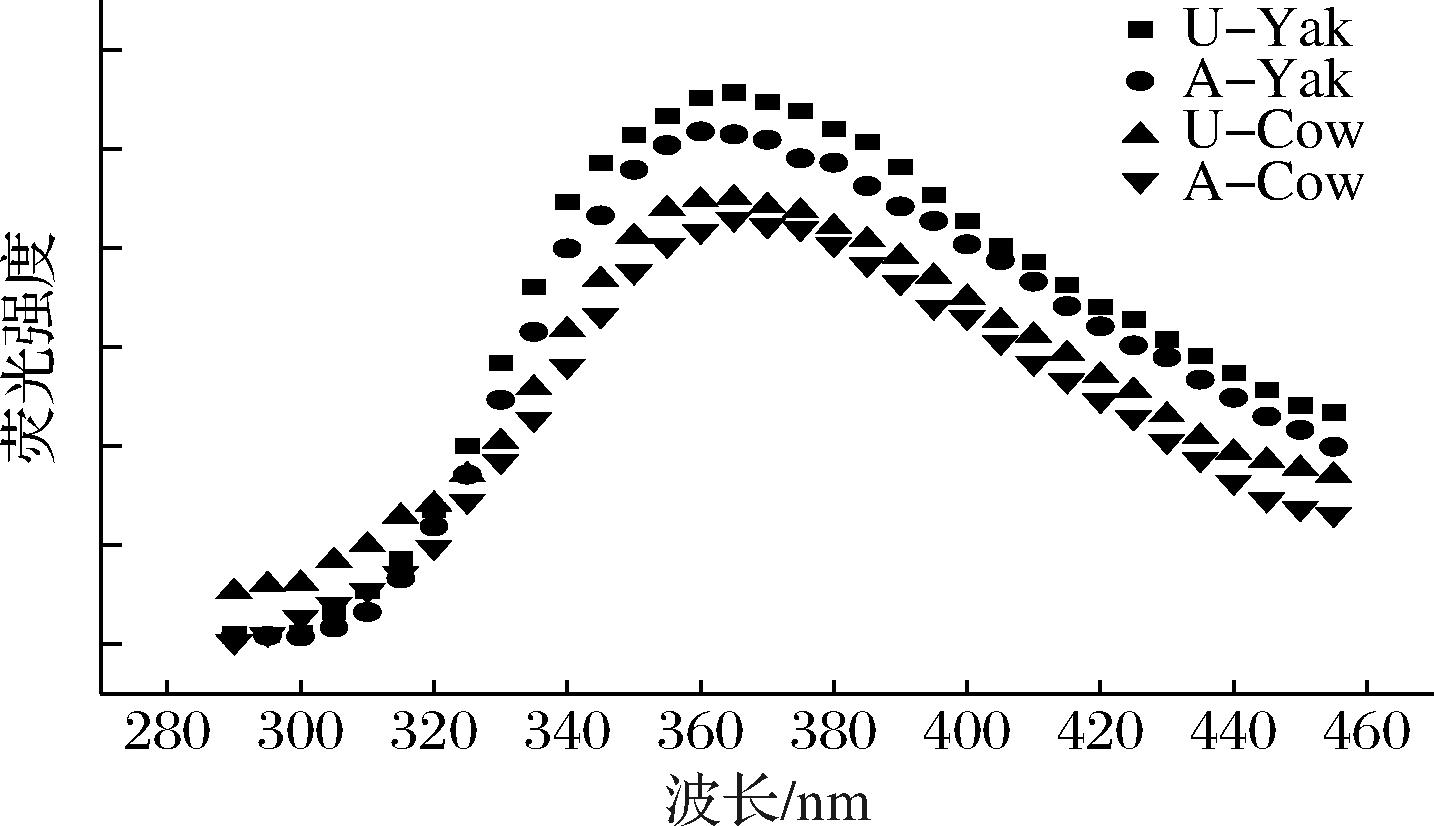
图6 酪蛋白胶束的荧光光谱图
Fig.6 Fluorescence spectrogram of casein micelles
2.2.3 不同分离方法制备酪蛋白的胶束的微观结构
如图7所示,展示了胶束个体(放大50 000倍)和胶束聚集(放大7 000倍)的透射电镜图像。牦牛乳酪蛋白胶束略大于黑白花牛乳酪蛋白胶束,这与粒径仪测定的结果一致。另一方面,超速离心法得到的酪蛋白胶束颜色略深,酸沉淀法得到的酪蛋白胶束颜色整体较浅,处于较小的放大倍数时,胶束之间的界限不清晰,这是超速离心法的钙含量更高所致。在聚集状态方面,无论放大倍数如何,酸沉淀得到的酪蛋白胶束都更容易聚集,且胶束团簇间的距离更小,而相比之下,超速离心的酪蛋白胶束分散性相对更优。

a1、a2-U-Cow;b1、b2-A-Cow;c1、c2-U-Yak;d1、d2-A-Yak
图7 酪蛋白胶束的透射电镜(transmission electron microscopy,TEM)图像
Fig.7 Transmission electron microscopy (TEM) images of casein micelles
3 结论与讨论
实验结果表明,U-Yak较之A-Yak有更高的水分含量,蛋白含量以及矿物质含量,同时β-CN的含量也显著更高(约2%~3%)。A-Yak的平均粒径大于U-Yak(约3~6 nm),ζ-电位图则表明,A-Yak表面所带负电荷相对较少。此外,U-Yak与A-Yak二级结构差异主要体现在β-折叠(U-Yak 45.0%,A-Yak 43.7%)和β-转角(U-Yak 47.6%,A-Yak 46.7%),这与内源荧光结果共同反映出U-Yak有更加稳定和完整的结构。
就试验结果而言,规避了化学试剂引入和极端pH影响的超速离心法得到的酪蛋白胶束更加稳定,而稳定的结构有利于保留酪蛋白胶束的原始组装态,这可能说明由超速离心得到的酪蛋白胶束其结构更接近天然态。这一技术能有效分离出酪蛋白,较大程度地保留其在牛乳中固有的功能性,为牦牛乳酪蛋白胶束后续的相关研究提供了参考。
[1] LI H M, MA Y, LI Q M, et al.The chemical composition and nitrogen distribution of Chinese yak (maiwa) milk[J].International Journal of Molecular Sciences, 2011, 12(8):4885-4895.
[2] WU X H, LUO Z, YU L, et al.A survey on composition and microbiota of fresh and fermented yak milk at different Tibetan altitudes[J].Dairy Science &Technology, 2009, 89(2):201-209.
[3] ANEMA S G.Effect of pH at pressure treatment on the acid gelation of skim milk[J].Innovative Food Science &Emerging Technologies, 2010, 11(2):265-273.
[4] DEGEN A A.Sheep and goat milk in pastoral societies[J].Small Ruminant Research, 2007, 68(1-2):7-19.
[5] ZHANG Y, LI Y, WANG P J, et al.Rennet-induced coagulation properties of yak casein micelles:A comparison with cow casein micelles[J].Food Research International, 2017, 102:25-31.
[6] SHERYL A F, SETIADI.Improving the texture of cheese product from cow’s milk through the coagulation process using a combination of papain and transglutaminase enzyme[J].International Conference on Trends in Material Science and Inventive Materials:Ictmim 2020, 2020, 2259:040003.
[7] MOHSIN A Z, SUKOR R, SELAMAT J, et al.A highly selective two-way purification method using liquid chromatography for isolating α(S2)-casein from goat milk of five different breeds[J].Journal of Chromatography.B, Analytical Technologies in the Biomedical and Life Sciences, 2020, 1160:122380.
[8] PTI EK SIRO
EK SIRO I
I A.Characterization of casein fractions-comparison of commercial casein and casein extracted from cow’s milk[J].Chemical and Biochemical Engineering Quarterly Journal, 2017, 30(4):501-509.
A.Characterization of casein fractions-comparison of commercial casein and casein extracted from cow’s milk[J].Chemical and Biochemical Engineering Quarterly Journal, 2017, 30(4):501-509.
[9] 李启明. 乳成分和乳蛋白的多态性对牦牛乳热稳定性的作用[D].哈尔滨:哈尔滨工业大学, 2015.LI Q M.Role of polymorphisms of milk components and milk proteins on thermal stability of yak milk[D].Harbin:Harbin Institute of Technology, 2015.
[10] MA L, YANG Y X, CHEN J T, et al.A rapid analytical method of major milk proteins by reversed-phase high-performance liquid chromatography[J].Animal Science Journal, 2017, 88(10):1623-1628.
[11] 张光地. 牦牛乳酪蛋白胶束结构及其单体分离工艺研究[D].兰州:甘肃农业大学, 2018.ZHANG G D.Study on the structure of yak milk casein micelles and its monomer separation process[D].Lanzhou:Gansu Agricultural University, 2018.
[12] 孙一健, 王继芬, 张震.基于红外光谱的食用植物油种类鉴别[J].中国油脂, 2023, 48(1):120-124.SUN Y J, WANG J F, ZHANG Z.Identification of edible vegetable oils based on infrared spectrum[J].China Oils and Fats, 2023, 48(1):120-124.
[13] CHEN N N, LIN L Z, SUN W Z, et al.Stable and pH-sensitive protein nanogels made by self-assembly of heat denatured soy protein[J].Journal of Agricultural and Food Chemistry, 2014, 62(39):9553-9561.
[14] 叶晶莹, 吴帆, 张兆月, 等.酪蛋白胶束结构特性及其在递送领域应用的研究进展[J].食品科学, 2025, 46(12):379-390.YE J Y, WU F, ZHANG Z Y, et al.Research progress on structural properties of casein micelles and their application in delivery systems[J].Food Science, 2025, 46(12):379-390.
[15] DALGLEISH D G, CORREDIG M.The structure of the casein micelle of milk and its changes during processing[J].Annual Review of Food Science and Technology, 2012, 3:449-467.
[16] MCMAHON D J, DU H, MCMANUS W R, et al.Microstructural changes in casein supramolecules during acidification of skim milk[J].Journal of Dairy Science, 2009, 92(12):5854-5867.
[17] HOLT C, CARVER J A, ECROYD H, et al.Invited review:Caseins and the casein micelle:Their biological functions, structures, and behavior in foods 1[J].Journal of Dairy Science, 2013, 96(10):6127-6146.
[18] FOX P F.Advanced Dairy Chemistry[M].Berlin:Kluwer Academic Pub, 1995:43-85.
[19] LI Q M, MA Y, HE S H, et al.Effect of pH on heat stability of yak milk protein[J].International Dairy Journal, 2014, 35(1):102-105.
[20] 刘晶晶, 张薇, 吴锦涛, 等.酪蛋白结构特性及应用研究进展[J].食品研究与开发, 2023, 44(1):197-201.LIU J J, ZHANG W, WU J T, et al.Structural properties and application of casein:A review[J].Food Research and Development, 2023, 44(1):197-201.
[21] BEAUCHEMIN R, N’SOUKPOÉ-KOSSI C N, THOMAS T J, et al.Polyamine analogues bind human serum albumin[J].Biomacromolecules, 2007, 8(10):3177-3183.
[22] KANAKIS C D, HASNI I, BOURASSA P, et al.Milk β-lactoglobulin complexes with tea polyphenols[J].Food Chemistry, 2011, 127(3):1046-1055.
[23] 杨敏, 梁琪, 毕阳, 等.琥珀酰化修饰改善牦牛乳酪蛋白胶束结构及疏水性[J].农业工程学报, 2013, 29(10):287-292.YANG M, LIANG Q, BI Y, et al.Succinylation improves structure and hydrophobicity of yak casein micelles[J].Transactions of the Chinese Society of Agricultural Engineering, 2013, 29(10):287-292.
[24] LIU Y, GUO R.pH-dependent structures and properties of casein micelles[J].Biophysical Chemistry, 2008, 136(2-3):67-73.