华贵栉孔扇贝(Chlamys ndoilis),亦称南澳金贝,主要分布于日本、韩国以及中国沿海地区。在我国,其养殖区域主要集中于南海海域。根据《中国渔业统计年鉴》(2023年)的数据,我国海水养殖扇贝的总产量已达185万t,其中广东省的产量为11万t。华贵栉孔扇贝凭借抗逆性强、生长速率快以及养殖效益高等显著优势,已成为我国南方海域扇贝养殖的主导品种。华贵栉孔扇贝以闭壳肌为主要可食用部分,其肉质鲜美且营养丰富,干制品被列为“海八珍”之一,亦是粤菜中的高档食材,深受消费者青睐。然而,尽管华贵栉孔扇贝在养殖产量方面具备一定优势,但在加工过程中,除闭壳肌外,外套膜和性腺等副产物通常未被有效利用。这种处理方式不仅造成了资源的浪费,还可能对环境产生污染。因此,为推动华贵栉孔扇贝产业的可持续发展,对其营养价值展开系统、全面的评估显得至关重要。
在扇贝营养成分方面,大多研究报道聚焦于不同品种[1]、壳色[2]、季节[3]、贝龄[4]等因素对扇贝营养组成的影响机制。不同品种因遗传差异,其蛋白质、脂肪等营养成分的含量和组成差别较大;壳色变化关联体内色素合成代谢途径,影响营养积累;季节更替改变生存环境,致使营养成分随季节波动;贝龄增长时,扇贝营养物质的积累和分配呈现阶段性变化。从水产养殖与加工实际应用来看,研究雌雄扇贝营养成分差异意义重大。雌雄扇贝在生长周期、能量分配等方面差异显著[5]。在繁殖期,雌性扇贝为促进卵巢发育,会在性腺积累更多能量和营养,如脂肪及特定氨基酸,用于生殖细胞发育和胚胎早期生长,这使该时期雌性性腺营养成分与雄性差异显著。雄性扇贝则着重维持精巢功能,能量利用和营养积累方式不同,生殖相关组织的营养成分变化独特。雌雄扇贝个体大小和质量差异亦影响其加工和产品开发环节。在去壳、分级等预处理流程中,需依据雌雄扇贝的不同规格采用不同设备和操作,以此保障加工效率和产品质量。产品开发时,消费者对产品规格、口感、营养需求多样,了解雌雄差异有助于定制产品。针对追求高蛋白低脂肪产品的消费者,可利用雄性扇贝特定部位的营养特性设计产品;针对注重特殊营养补充的消费者,依据雌性扇贝的营养优势开发产品,进而提升产品市场竞争力,提高经济价值。
基于上述背景,本研究旨在系统地对比华贵栉孔扇贝不同性别及可食部位之间的营养成分差异,深入揭示其在性别和部位层面上独特的营养价值特征,为华贵栉孔扇贝的精深加工工艺优化、新产品开发以及产品附加值的提升提供基础数据。
1 材料与方法
1.1 材料与试剂
华贵栉孔扇贝于2024年7月购自广东省湛江市霞山工农市场,采样个体的壳长为(7.27±0.46) cm、壳宽为(2.40±0.41) cm、壳高为(5.60±0.62) cm。
甲醇、正己烷(色谱纯),美国Supelco公司;37种脂肪酸甲酯混标、十一烷酸标准品,上海阿拉丁生化科技股份有限公司;混合氨基酸标准品、色氨酸(Trp)标准品,美国Sigma-Aldrich公司;质量分数为14%的BF3-CH3OH 溶液(优级纯),上海源叶生物科技有限公司;其他分析试剂均为国产分析纯。
1.2 仪器与设备
DHG-9035A电热恒温鼓风干燥箱,上海一恒科学仪器有限公司;FineBox-6100马弗炉,浙江泛泰仪器有限公司;CCA-1111旋转蒸发仪,上海爱朗仪器有限公司;B-811索氏萃取仪、B-324自动凯氏定氮仪,瑞士BUCHI公司;LA8080氨基酸分析仪,日本HITACHI公司;TQ8050NX气相色谱-质谱联用仪、LC-20A高效液相色谱仪,日本Shimadzu 公司;HVT56-MuitiwavPRO41微波消解仪,美国Anton Paar公司;7900电感耦合等离子体质谱仪、725电感耦合等离子体发射光谱仪,美国Agilent公司。
1.3 实验方法
1.3.1 样品预处理
华贵栉孔扇贝用蒸馏水清洗干净后用滤纸吸干表面水分,按雌雄分成2组,以性腺颜色进行区分,乳白色为雄性,橘红色为雌性。每组分割成5种不同的组织,包括性腺、贝柱、裙边、内脏、腮,随机抽取20个分别进行称重(n=20),并记录样品的各部位质量和比例。将雌、雄性的不可食用部位去除(腮、内脏),可食部位(性腺、贝柱、裙边)用组织粉碎机搅碎至糜状、混匀,一部分进行分装好后立即贮存在-80 ℃中备用待测。
1.3.2 不同组织部位湿重占比
雌、雄性华贵栉孔扇贝不同组织部位(性腺、贝柱、裙边、内脏、腮)湿重占比按公式(1)计算:
组织部位湿重占比![]()
(1)
1.3.3 常规营养成分的测定
水分含量测定参考GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中直接干燥法;蛋白质含量测定参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中凯氏定氮法;脂肪含量测定参考GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中索氏提取法;灰分含量参考GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》中高温炉灼烧法(550 ℃);总糖含量测定参考GB/T 9695.31—2008《肉制品 总糖含量测定》中分光光度法。
1.3.4 氨基酸的测定
氨基酸的测定采用 GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》中盐酸水解法,使用氨基酸分析仪测定氨基酸组成及含量。Trp因酸水解而被破坏,故采用GB 5009.294—2023《食品安全国家标准 食品中色氨酸的测定》中碱水解-液相色谱法,使用高效液相色谱仪进行测定。
1.3.5 脂肪酸的测定
脂质的提取方法、脂肪酸甲酯的制备方法、色谱条件和脂肪酸含量计算公式均参考郑小善等[6]的方法。样品经过甲酯化后,利用气相色谱-质谱联用仪自带质谱库NIST和FFNSC定性,结合内标十一烷酸标准品和37种脂肪酸甲酯标准品进行分析,根据出峰时间定性、峰面积定量来测定脂肪酸含量。
1.3.6 矿物质的测定
矿物质元素参考GB 5009.268—2025《食品安全国家标准 食品中多元素的测定》,中电感耦合等离子体质谱法(inductively coupled plasma-mass spectrometry,ICP-MS法),使用电感耦合等离子体质谱仪进行矿物质元素测定。
1.3.7 氨基酸营养评价
基于联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)/世界卫生组织( World Health Organization,WHO)(1973)氨基酸参考模式和全鸡蛋蛋白质氨基酸组成,氨基酸评分(amino acid score,AAS)反映必需氨基酸(essential amino acid,EAA)与参考模式的符合度、化学评分(chemistry score,CS)评估氨基酸组成与理想模式的接近程度,必需氨基酸指数(essential amino acid index,EAAI)则用于综合评价EAA的整体平衡性,AAS、CS、EAAI分别按公式(2)~公式(4)计算:
(2)
(3)
(4)
式中:n为比较的EAA个数,a、b、c、……、h为样品组织蛋白质的EAA含量,mg/g;A、B、C、……、H为全鸡蛋蛋白质的EAA含量,mg/g。
1.4 数据处理与分析
除了样品预处理分析时,取样量n=20外,其他指标每个样品平行重复取样3次进行测定,采用Excel 2019软件进行数据统计,结果使用“平均值±标准差”表示,使用SPSS 25.0软件进行显著性差异分析,采用独立样本T检验进行2组间比较;方差分析后采用Duncan法进行组间差异检验,P<0.05表示有显著性差异,P>0.05表示无显著性差异。使用Origin 2024软件作图。
2 结果与分析
2.1 主要规格分析
本研究对比分析了雌、雄华贵栉孔扇贝不同部位的质量及其比例(表1),发现在绝对质量方面,雌性个体的性腺和贝柱部位湿重均显著高于雄性(P<0.05),而裙边质量在雌雄间无统计学差异(P>0.05)。从相对比例来看,雌性性腺占全脏器质量的百分比(12.59%)较雄性(9.54%)高出3.05%,这一结果表明雌性个体的性腺发育更为充分,反映了雌性扇贝在生殖过程中的特殊生理需求,即需要为生殖系统储备更多的能量物质以维持繁殖期的生理活动。综合分析表明,雌性扇贝在性腺发育上具有显著优势,揭示其营养价值可能高于雄性,尤其是在储能性营养成分的积累上。从产业应用角度出发,扇贝的性腺和贝柱在加工过程中可能具有更高的经济价值,可开发为即食刺身、干贝瑶柱、C22∶6n3[二十二碳六烯酸(docosahexaenoic acid,DHA)]/C20∶5n3[二十碳五烯酸(eicosapentaenoic acid,EPA)]微胶囊等高值化产品,而其他组织部位则更适用于副产品的深加工或特定用途的加工工艺,例如可通过复合酶解技术转化为海鲜调味基料、抗菌肽等产品,从而实现资源的最大化利用。
表1 雌、雄华贵栉孔扇贝肉不同部位的质量与比例
Table 1 Mass and proportion of different edible parts in female and male C.nobilis meat
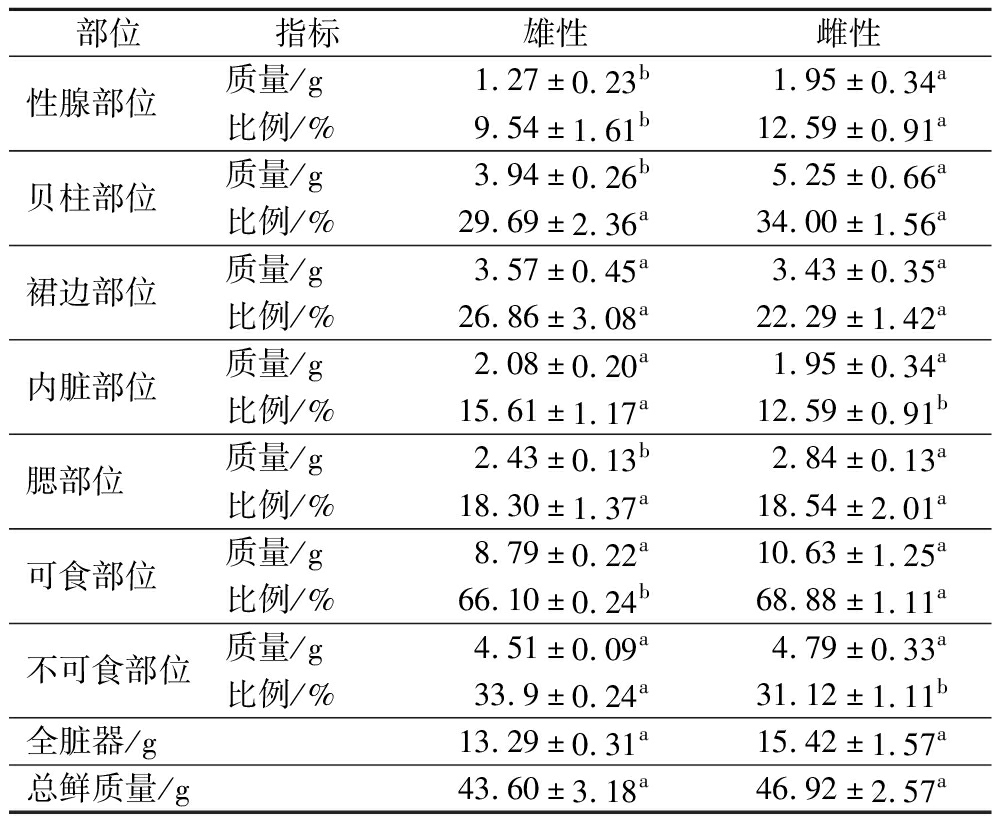
部位指标雄性雌性性腺部位质量/g1.27±0.23b1.95±0.34a比例/%9.54±1.61b12.59±0.91a贝柱部位质量/g3.94±0.26b5.25±0.66a比例/%29.69±2.36a34.00±1.56a裙边部位质量/g3.57±0.45a3.43±0.35a比例/%26.86±3.08a22.29±1.42a内脏部位质量/g2.08±0.20a1.95±0.34a比例/%15.61±1.17a12.59±0.91b腮部位质量/g2.43±0.13b2.84±0.13a比例/%18.30±1.37a18.54±2.01a可食部位质量/g8.79±0.22a10.63±1.25a比例/%66.10±0.24b68.88±1.11a不可食部位质量/g4.51±0.09a4.79±0.33a比例/%33.9±0.24a31.12±1.11b全脏器/g13.29±0.31a15.42±1.57a总鲜质量/g43.60±3.18a46.92±2.57a
注:全脏器由可食部位与不可食部位构成,总鲜质量为包含外壳在内的完整个体质量。同行不同字母表示组间有显著性差异(P<0.05),相同字母表示组间无显著性差异(P>0.05)(下同)。
然而,本研究的样本采集仅限于单一季节和地点,这可能对华贵栉孔扇贝营养成分的全面评估产生一定影响。已有研究表明,贝类的营养成分会明显受到季节性和地域性变化的影响[7]。因此,未来研究应扩大样本范围,涵盖不同季节和产地,进一步评估环境因素对各部位营养成分的影响,以提升研究结果的科学性和可靠性。
2.2 基本营养成分
如图1所示,水分含量在不同部位间存在显著差异(P<0.05),其分布在79.12%~86.30%,具体表现为裙边>性腺>贝柱。从灰分含量来看,雄性性腺的灰分含量最高(10.37%),显著高于其他组织部位,这表明雄性性腺中富含更多的无机离子。粗蛋白质含量以裙边部位最高,推测与其部位富含结缔组织和纤维蛋白以维持形态结构和代谢功能有关。雄性性腺的粗蛋白质含量次之,这与其部位需要大量的蛋白质参与精子的形成、贮存及相关酶促反应有关[8]。此外,蛋白质与无机离子之间的协同作用也是一个关键因素。基于雄性性腺较高的灰分含量,可以推测其主要矿质元素通过调节蛋白质合成相关酶的活性,从而影响蛋白质代谢的效率。相比之下,雌性性腺的粗蛋白质含量最低(73.79%)。在总糖含量方面,贝柱的总糖含量最高,雌雄个体间不存在显著差异(P>0.05),其次为性腺部位,雌性个体总糖含量显著高于雄性。糖原作为扇贝主要的能量储备[9],其分布与运动、生殖器官的能量需求密切相关,这一结果反映了性腺和贝柱在能量分配上的优先性,且雌性性腺在能量储备方面高于雄性,表明雌性在繁殖等生理活动中的能量需求较高。粗脂肪含量则以雌性性腺最高(6.69%),显著高于其他部位,这一结果与雌性性腺在繁殖期需要积累大量脂质以维持能量代谢的生理特性相一致[10]。
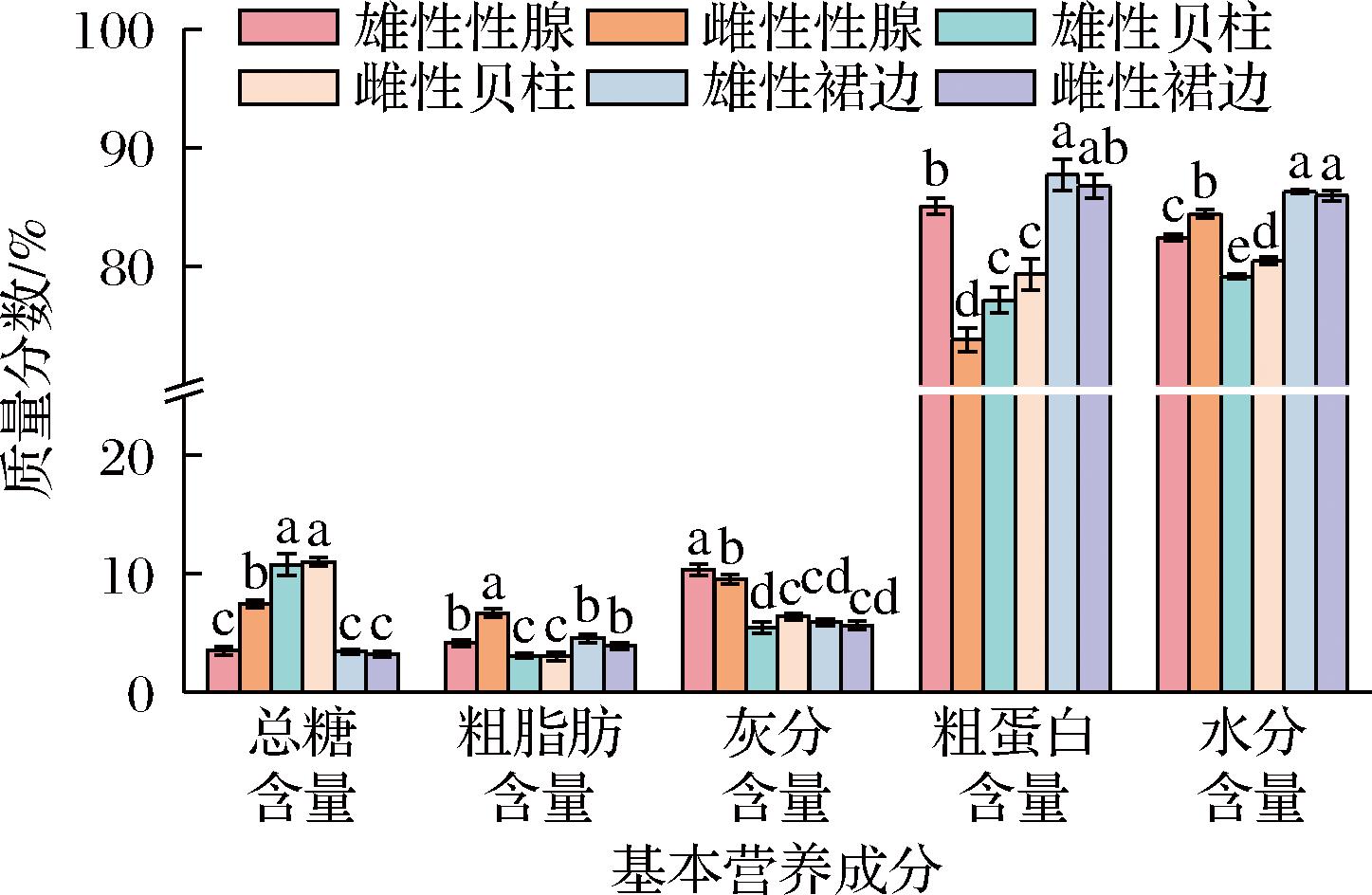
图1 雌、雄华贵栉孔扇贝肉不同可食部位的基本营养成分
Fig.1 Basic nutrients in different edible parts of female and male C.nobilis meat
注:除水分含量外,其他指标均以干基计;不同字母表示组间有显著性差异(P<0.05)(下同)。
贝类的营养价值主要由其组织中蛋白质和脂肪的含量决定。本研究表明,华贵栉孔扇贝不同部位的粗蛋白质含量在73.79%~87.73%,显著高于大珠母贝(71.19%)[11]、青蛤(54.17%)[12]、文蛤(66.69%)[13]等贝类(数据经过干湿基换算,下同)。粗脂肪含量在3.05%~6.69%,低于青蛤(8.39%),但与美洲帘蛤相近(6.32%)[13],体现出华贵栉孔扇贝高蛋白低脂肪的特点。这些差异可能与物种特性、生态环境以及代谢模式等因素密切相关。例如,华贵栉孔扇贝可能具有较高的代谢需求,促使其体内合成和贮存更多的蛋白质来支持生长、运动及繁殖等功能,而青蛤等埋栖性贝类由于运动需求较低,导致其蛋白质含量相对较少。此外,已有研究表明,饵料种类对贝类的发育状况具有显著影响[14],这可能导致脂肪含量存在种间差异。因此,未来研究需结合物种代谢特性、环境适应性及生态位分化等多维度因素,进一步探讨这些差异的成因及其生物学意义。
2.3 蛋白质的氨基酸组成与营养评价
氨基酸组成是评价贝类蛋白质营养价值的重要指标[15]。由表2可知,雌、雄华贵栉孔扇贝不同部位的蛋白质中均检测出18种氨基酸,包括9种EAA,2种半必需氨基酸(semi-essential amino acids,SEAA)和7种非必需氨基酸(nonessential amino acid,NEAA)。在对比单个组织部位的氨基酸组成发现,雄性性腺部位中甘氨酸(Gly)含量最高,而其他组织部位中均为谷氨酸(Glu)含量最高,半胱氨酸(Cys)含量在各部位中均最低。这一组成特点与岩扇贝、虾夷扇贝、海湾扇贝等贝类一致[1]。Glu在神经系统中发挥重要作用,同时也是参与脑组织生化代谢及多种生理活性物质合成的关键氨基酸[16]。Gly作为一种神经递质,能够调节神经元活动,并在基因表达调控、蛋白质构象及活性等生物学功能中发挥重要作用。
表2 雌、雄华贵栉孔扇贝肉不同可食部位粗蛋白中氨基酸组成与含量
Table 2 Amino acid composition and contents in crude proteins from different edible parts of female and male C.nobilis meat
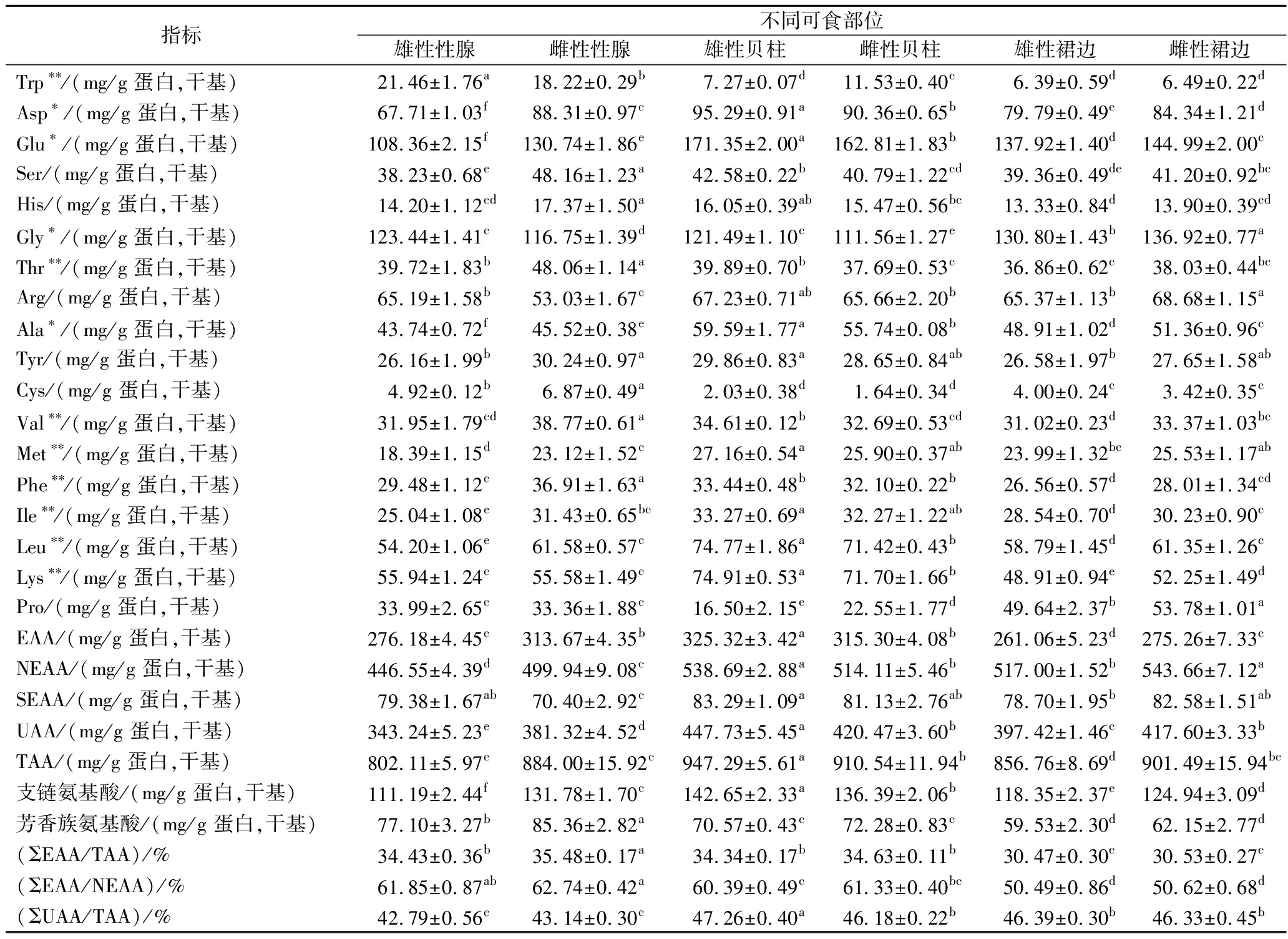
指标不同可食部位雄性性腺雌性性腺雄性贝柱雌性贝柱雄性裙边雌性裙边Trp∗∗/(mg/g 蛋白,干基)21.46±1.76a18.22±0.29b 7.27±0.07d11.53±0.40c 6.39±0.59d6.49±0.22dAsp∗/(mg/g 蛋白,干基)67.71±1.03f88.31±0.97c95.29±0.91a90.36±0.65b79.79±0.49e84.34±1.21dGlu∗/(mg/g 蛋白,干基)108.36±2.15f130.74±1.86e171.35±2.00a162.81±1.83b137.92±1.40d144.99±2.00cSer/(mg/g 蛋白,干基)38.23±0.68e48.16±1.23a42.58±0.22b40.79±1.22cd39.36±0.49de41.20±0.92bcHis/(mg/g 蛋白,干基)14.20±1.12cd17.37±1.50a16.05±0.39ab15.47±0.56bc13.33±0.84d13.90±0.39cdGly∗/(mg/g 蛋白,干基)123.44±1.41c116.75±1.39d121.49±1.10c111.56±1.27e130.80±1.43b136.92±0.77aThr∗∗/(mg/g 蛋白,干基)39.72±1.83b48.06±1.14a39.89±0.70b37.69±0.53c36.86±0.62c38.03±0.44bcArg/(mg/g 蛋白,干基)65.19±1.58b53.03±1.67c67.23±0.71ab65.66±2.20b65.37±1.13b68.68±1.15aAla∗/(mg/g 蛋白,干基)43.74±0.72f45.52±0.38e59.59±1.77a55.74±0.08b48.91±1.02d51.36±0.96cTyr/(mg/g 蛋白,干基)26.16±1.99b30.24±0.97a29.86±0.83a28.65±0.84ab26.58±1.97b27.65±1.58abCys/(mg/g 蛋白,干基)4.92±0.12b6.87±0.49a2.03±0.38d1.64±0.34d4.00±0.24c3.42±0.35cVal∗∗/(mg/g 蛋白,干基)31.95±1.79cd38.77±0.61a34.61±0.12b32.69±0.53cd31.02±0.23d33.37±1.03bcMet∗∗/(mg/g 蛋白,干基)18.39±1.15d23.12±1.52c27.16±0.54a25.90±0.37ab23.99±1.32bc25.53±1.17abPhe∗∗/(mg/g 蛋白,干基)29.48±1.12c36.91±1.63a33.44±0.48b32.10±0.22b26.56±0.57d28.01±1.34cdIle∗∗/(mg/g 蛋白,干基)25.04±1.08e31.43±0.65bc33.27±0.69a32.27±1.22ab28.54±0.70d30.23±0.90cLeu∗∗/(mg/g 蛋白,干基)54.20±1.06e61.58±0.57c74.77±1.86a71.42±0.43b58.79±1.45d61.35±1.26cLys∗∗/(mg/g 蛋白,干基)55.94±1.24c55.58±1.49c74.91±0.53a71.70±1.66b48.91±0.94e52.25±1.49dPro/(mg/g 蛋白,干基)33.99±2.65c33.36±1.88c16.50±2.15e22.55±1.77d49.64±2.37b53.78±1.01aEAA/(mg/g 蛋白,干基)276.18±4.45c313.67±4.35b325.32±3.42a315.30±4.08b261.06±5.23d275.26±7.33cNEAA/(mg/g 蛋白,干基)446.55±4.39d499.94±9.08c538.69±2.88a514.11±5.46b517.00±1.52b543.66±7.12aSEAA/(mg/g 蛋白,干基)79.38±1.67ab70.40±2.92c83.29±1.09a81.13±2.76ab78.70±1.95b82.58±1.51abUAA/(mg/g 蛋白,干基)343.24±5.23e381.32±4.52d447.73±5.45a420.47±3.60b397.42±1.46c417.60±3.33bTAA/(mg/g 蛋白,干基)802.11±5.97e884.00±15.92c947.29±5.61a910.54±11.94b856.76±8.69d901.49±15.94bc支链氨基酸/(mg/g 蛋白,干基)111.19±2.44f131.78±1.70c142.65±2.33a136.39±2.06b118.35±2.37e124.94±3.09d芳香族氨基酸/(mg/g 蛋白,干基)77.10±3.27b85.36±2.82a70.57±0.43c72.28±0.83c59.53±2.30d62.15±2.77d(ΣEAA/TAA)/%34.43±0.36b35.48±0.17a34.34±0.17b34.63±0.11b30.47±0.30c30.53±0.27c(ΣEAA/NEAA)/%61.85±0.87ab62.74±0.42a60.39±0.49c61.33±0.40bc50.49±0.86d50.62±0.68d(ΣUAA/TAA)/%42.79±0.56c43.14±0.30c47.26±0.40a46.18±0.22b46.39±0.30b46.33±0.45b
注:*表示 UAA,**表示EAA。
本研究发现,华贵栉孔扇贝不同组织部位的蛋白质结合态鲜味氨基酸(umami amino acid,UAA)Glu、Gly、Asp和Ala差异显著(P<0.05)。其中,雄性贝柱中UAA含量最高(447.73 mg/g),显著高于其他组织,而雄性性腺含量最低(343.24 mg/g)。这一差异表明,贝柱部位的蛋白质可能蕴含更为丰富的鲜味前体物质,而性腺部位的鲜味特征可能较弱。从生物学功能角度分析,贝柱作为扇贝的主要运动器官,其较高的UAA含量具有重要生理意义。这些氨基酸(如Glu和Gly)属于兴奋性神经递质,参与神经传导和肌肉收缩的生理过程,为扇贝高效的运动功能及环境感知能力提供了物质基础,这可能是该部位UAA富集的重要原因。此外,华贵栉孔扇贝贝柱部位的UAA含量显著高于斑纹小贻贝(358.15 mg/g)[17]、熊本牡蛎(298.89 mg/g)[18]等双壳类物种,提示其在UAA的合成与代谢方面可能具有独特的生理和遗传背景。需要说明的是,本研究检测的结合态UAA主要反映不同组织部位蛋白的营养组成特征,而实际呈味作用主要与游离氨基酸及其呈味阈值相关,虽然结合态氨基酸数据揭示其可能具有特殊的风味物质基础,但要准确评估实际呈味效果仍需结合游离氨基酸分析。
从EAA组成与含量来看,雄性贝柱的EAA含量最高(325.32 mg/g),显著高于其他部位。而雄性和雌性裙边的EAA含量最低,分别为261.06 mg/g和275.26 mg/g。根据FAO/WHO的理想模式,优质蛋白的EAA占总氨基酸(total amino acid,TAA)的比例(ΣEAA/TAA)应接近40%,EAA占NEAA的比例(ΣEAA/NEAA)应高于60%。由表2可知,尽管华贵栉孔扇贝不同可食部位ΣEAA/TAA均未达到40%,但其性腺和贝柱部位的ΣEAA/NEAA均高于60%,符合FAO/WHO提出的氨基酸组成标准,而裙边部位并不属于传统营养学的优质蛋白。
基于FAO/WHO氨基酸评分标准模式及全鸡蛋蛋白质标准模式对华贵栉孔扇贝雌、雄不同部位的EAA进行营养评价(表3),结果显示性腺部位的主要限制性氨基酸为Val、Ile和Met+Cys,贝柱部位为Trp、Val和Met+Cys,裙边部位为Trp和Val。在食品加工过程中,可通过针对性添加这些限制性氨基酸,进一步提升华贵栉孔扇贝的营养价值,确保膳食营养平衡。
表3 雌、雄华贵栉孔扇贝肉不同可食部位蛋白质中EAA组成评价
Table 3 Evaluation of the essential amino acid composition in proteins from different edible parts of female and male C.nobilis meat

类型评分指标EAA种类TrpThrValIleLeuLysMet+CysPhe+TyrFAO/WHO标准含量/(mg/g)10.0040.0050.0040.0070.0055.0035.0060.00鸡蛋蛋白标准含量/(mg/g)17.0047.0066.0054.0086.0070.0057.0093.00雄性性腺含量/(mg/g)21.4639.7231.9525.0454.2055.9423.3155.64AAS2.150.990.640.630.771.020.670.93CS1.260.850.480.460.630.800.410.60EAAI64.38雌性性腺含量/(mg/g)18.2248.0638.7731.4361.5855.5829.9967.15AAS1.821.200.780.790.881.010.861.12CS1.071.020.590.580.720.790.530.72EAAI73.03雄性贝柱含量/(mg/g)7.2739.8934.6133.2774.7774.9129.1963.30AAS0.731.000.690.831.071.360.831.06CS0.430.850.520.620.871.070.510.68EAAI66.45
续表3

类型评分指标EAA种类TrpThrValIleLeuLysMet+CysPhe+Tyr雌性贝柱含量/(mg/g)11.5337.6932.6932.2771.4271.7027.5460.75AAS1.150.940.650.811.021.300.791.01CS0.680.800.500.600.831.020.480.65EAAI67.52雄性裙边含量/(mg/g)6.3936.8631.0228.5458.7948.9127.9953.14AAS0.640.920.620.710.840.890.800.89CS0.380.780.470.530.680.700.490.57EAAI56.10雌性裙边含量/(mg/g)6.4938.0333.3730.2361.3552.2528.9555.66AAS0.650.950.670.760.880.950.830.93CS0.380.810.510.560.710.750.510.60EAAI58.73
EAAI是评价食物中EAA组成与标准蛋白质相似程度的重要指标[19],本研究中,雌性性腺的EAAI值最高(73.03),显著高于其他部位及徐闻大珠母贝(45.53)[11],而雄性裙边的EAAI值最低(56.10)。这一结果表明,雌性性腺的EAA组成更为均衡,营养价值较高,能够被人体高效吸收利用。综上所述,华贵栉孔扇贝的性腺和贝柱部位展现出较高的营养价值和开发潜力,相较而言,裙边部位需通过深加工等途径进一步提升其经济价值。
2.4 脂肪酸组成与含量
脂肪酸是人体所需的重要营养物质,其种类和含量也是评价水产品营养价值的关键指标之一[20]。由表4可知,华贵栉孔扇贝雌、雄不同可食部位检测出16~20种脂肪酸,包括6~8种饱和脂肪酸(saturated fatty acid,SFA)、3~4种单不饱和脂肪酸(monounsaturated fatty acid,MUFA)和7~8种多不饱和脂肪酸(polyunsaturated fatty acid,PUFA),其脂肪酸含量分布呈现为∑PUFA>∑SFA>∑MUFA,与岩扇贝相同[1],体现出海洋双壳类软体动物在脂肪酸代谢与贮存上的共性特征。在SFA组成中,性腺部位以C14∶0、C16∶0和C18∶0为主,这与海水鱼类的脂肪酸组成特征相一致[21];MUFA则以C18∶1为主;在PUFA中,EPA和DHA为主要成分。进一步分析发现,不同组织的脂肪酸种类有所差异。在本研究中,C20∶0在雌性贝柱中未检测到;C22∶0仅在雌性性腺中出现;C16∶1仅在雄性性腺、雌性性腺和雄性贝柱中检测到,且含量存在显著性差异(P<0.05)。这些分布差异反映了生物体在适应生存环境、维持生理功能及促进生殖过程中对脂肪酸合成与代谢的调节作用。例如,C22∶0仅在雌性性腺中存在,这类脂肪酸可能在细胞膜稳定性、激素合成及生殖细胞发育中扮演重要角色。
表4 雌、雄华贵栉孔扇贝肉不同可食部位中脂肪酸组成及含量
Table 4 Fatty acid composition and contents in different edible parts of female and male C.nobilis meat

指标不同可食部位雄性性腺雌性性腺雄性贝柱雌性贝柱雄性裙边雌性裙边C14∶0/(mg/100 g,干基)49.69±2.35b294.80±0.69a12.65±0.33d9.17±0.20e23.22±0.56c25.32±0.80cC15∶0/(mg/100 g,干基)15.15±0.67b69.32±1.27a6.52±0.28d4.41±0.20e11.47±0.31c12.20±0.39cC16∶0/(mg/100 g,干基)267.70±2.25b1 311.99±1.39a160.93±0.41f176.32±0.96e226.57±0.96d241.24±3.42cC17∶0/(mg/100 g,干基)32.34±3.01b189.17±2.88a19.57±1.27d17.09±0.54d25.17±0.89c28.54±2.50bcC18∶0/(mg/100 g,干基)155.99±1.72d576.24±4.77a119.96±6.99e111.39±0.77f200.23±2.01c215.12±3.55bC19∶0/(mg/100 g,干基)4.11±0.17b18.79±0.49a2.22±0.12de1.39±0.18e2.79±0.29cd3.78±0.29bcC20∶0/(mg/100 g,干基)4.72±0.40b40.30±0.80a1.66±0.18cND2.76±0.14d1.85±0.17cC22∶0/(mg/100 g,干基)ND15.68±1.54NDNDNDNDΣSFA/(mg/100 g,干基)529.70±5.20b2 516.29±10.51a323.52±5.47d319.78±1.37d492.21±1.48c528.05±5.54bC16∶1/(mg/100 g,干基)88.14±1.83b641.64±2.29a33.19±2.15cNDNDNDC18∶1n9c/(mg/100 g,干基)65.85±3.95b365.06±1.22a53.21±1.17d42.69±0.79e51.79±2.55d58.44±2.36cC18∶1n9t/(mg/100 g,干基)38.92±3.96b223.95±3.03a29.32±1.82c23.33±1.16d39.85±1.39b41.77±2.56bC20∶1(mg/100 g,干基)11.81±1.18b71.02±0.85a9.76±0.93b4.51±0.26c5.15±0.19c5.41±0.08cΣMUFA/(mg/100 g,干基)201.79±6.41b1 301.66±4.95a125.49±2.88c70.53±1.84e96.80±4.33d105.62±6.24dC18∶3n3/(mg/100 g,干基)13.10±1.50b142.70±1.99a7.13±0.19c4.91±0.17d3.43±0.13d3.45±0.16dC18∶3n6/(mg/100 g,干基)4.11±0.12c36.71±0.28a2.49±0.25dND13.10±0.90bND
续表4
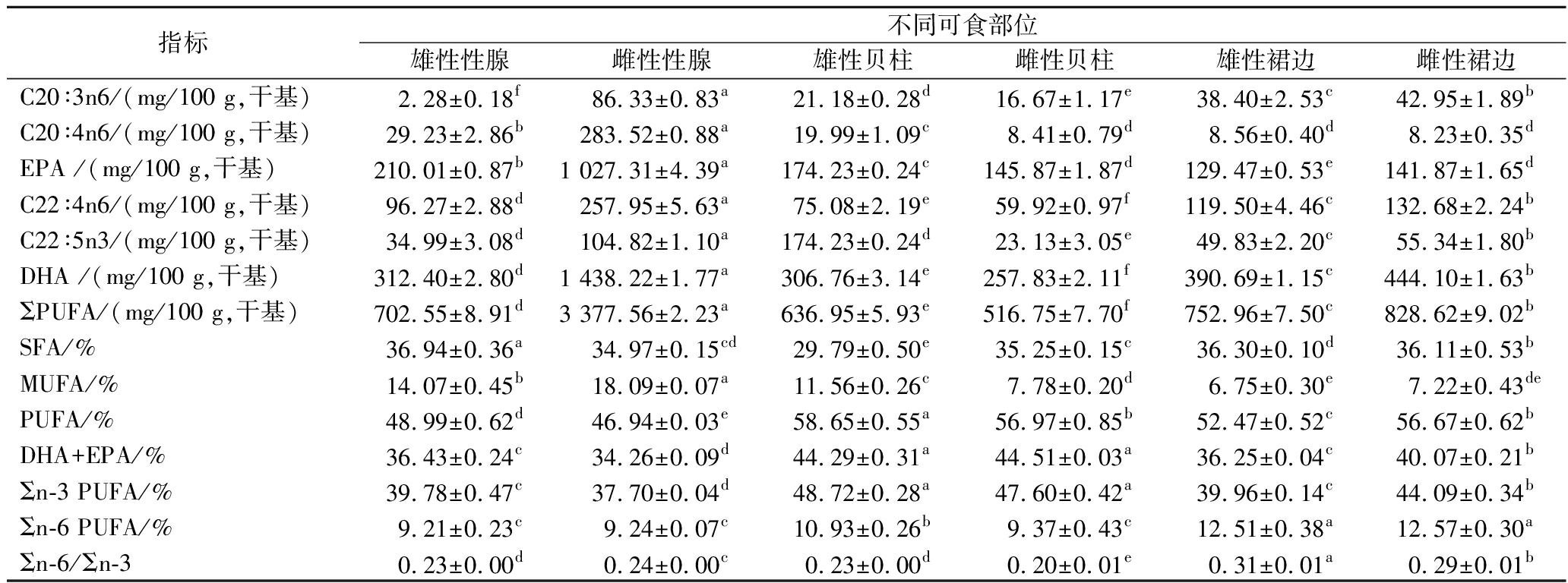
指标不同可食部位雄性性腺雌性性腺雄性贝柱雌性贝柱雄性裙边雌性裙边C20∶3n6/(mg/100 g,干基)2.28±0.18f86.33±0.83a21.18±0.28d16.67±1.17e38.40±2.53c42.95±1.89bC20∶4n6/(mg/100 g,干基)29.23±2.86b283.52±0.88a19.99±1.09c8.41±0.79d8.56±0.40d8.23±0.35dEPA /(mg/100 g,干基)210.01±0.87b1 027.31±4.39a174.23±0.24c145.87±1.87d129.47±0.53e141.87±1.65dC22∶4n6/(mg/100 g,干基)96.27±2.88d257.95±5.63a75.08±2.19e59.92±0.97f119.50±4.46c132.68±2.24bC22∶5n3/(mg/100 g,干基)34.99±3.08d104.82±1.10a174.23±0.24d23.13±3.05e49.83±2.20c55.34±1.80bDHA /(mg/100 g,干基)312.40±2.80d1 438.22±1.77a306.76±3.14e257.83±2.11f390.69±1.15c444.10±1.63bΣPUFA/(mg/100 g,干基)702.55±8.91d3 377.56±2.23a636.95±5.93e516.75±7.70f752.96±7.50c828.62±9.02bSFA/%36.94±0.36a34.97±0.15cd29.79±0.50e35.25±0.15c36.30±0.10d36.11±0.53bMUFA/%14.07±0.45b18.09±0.07a11.56±0.26c7.78±0.20d6.75±0.30e7.22±0.43dePUFA/%48.99±0.62d46.94±0.03e58.65±0.55a56.97±0.85b52.47±0.52c56.67±0.62bDHA+EPA/%36.43±0.24c34.26±0.09d44.29±0.31a44.51±0.03a36.25±0.04c40.07±0.21bΣn-3 PUFA/%39.78±0.47c37.70±0.04d48.72±0.28a47.60±0.42a39.96±0.14c44.09±0.34bΣn-6 PUFA/%9.21±0.23c9.24±0.07c10.93±0.26b9.37±0.43c12.51±0.38a12.57±0.30aΣn-6/Σn-30.23±0.00d0.24±0.00c0.23±0.00d0.20±0.01e0.31±0.01a0.29±0.01b
注:ND为未检出;%为某脂肪酸占总脂肪酸的百分比。
在脂肪酸的绝对含量方面,雌性性腺的PUFA含量最高,达到3 377.56 mg/100 g,占总脂肪酸的46.94%,其绝对含量是其他部位的4~7倍。XU等[10]的研究表明,雌性扇贝在配子生成及繁殖过程中需要大量脂质能量,这进一步验证了雌性性腺PUFA含量高的现象。PUFA主要分为n-3系列和n-6系列,其中∑n-6 PUFA与∑n-3 PUFA的比值是评价脂肪酸营养价值的重要指标。现代人膳食中n-6 PUFA的摄入量远超人体需求,而n-3 PUFA的摄入量则普遍不足,这种不均衡将会引发多种现代疾病。华贵栉孔扇贝不同部位的∑n-6 PUFA/∑n-3 PUFA比值为0.20~0.31,远低于英国卫生部推荐的最大安全上限(4.0)[22],表明其脂肪酸组成符合食品健康要求,具有较高的营养价值。
DHA和EPA作为重要的PUFA,在防治心血管疾病、预防糖尿病以及抗癌等方面具有显著的生理活性[23]。就脂肪酸的相对比例而言,雄性贝柱的PUFA占总脂肪酸的58.65%,其中DHA+EPA的比例高达44.29%,显著高于性腺和裙边部位,且远高于野生大麻哈鱼(20.32%)[24]、大围网箱大黄鱼(18.39%)[25]等经济鱼类。因此,雄性贝柱在脂肪酸组成上不仅PUFA比例占优势,而且DHA和EPA分布更为均衡。基于这些差异,消费者可以根据个人需求选择合适的食物搭配,以实现健康饮食。
2.5 主要矿物质元素含量
矿物质元素作为必需营养素,通过参与机体代谢过程和酶促反应,在维持渗透压、酸碱平衡及组织结构等方面发挥重要作用。如表5所示,在微量元素方面,性腺和裙边最主要的矿物质元素是Fe,Fe是合成血红蛋白和肌红蛋白的关键元素,在造血功能中起核心作用。其中,雄性性腺的Fe含量最高(200.17 mg/kg,干基),不仅显著高于同个体其他组织部位(P<0.05),且较岩扇贝(34.71 mg/kg)[1]等贝类亦呈现显著富集特征。研究表明,性腺中的Fe参与睾丸激素的合成,在精子产生过程中发挥重要作用[8]。因此,雄性性腺对Fe的高需求与生殖过程中的高代谢活性有关,尤其是在精子生成和激素合成方面。贝柱部位最主要的矿物质元素是Zn,Zn是多种酶系统的组成部分,参与蛋白质合成、细胞分裂和免疫调节等重要生理过程。尤其在生长发育、蛋白质合成及生殖过程中具有重要作用。其中,雌性性腺Zn含量最高(136.04 mg/kg),显著高于岩扇贝(98.50 mg/kg)[1]。此外,Se作为人体和动物生命过程中必需的微量元素,具有促进发育、抗氧化、增强繁殖能力及解毒等多种生理功能。雌性裙边中的Se含量(0.57 mg/kg)显著高于其他部位,且远高于DB61/T 556—2018《富硒含硒食品与相关产品硒含量标准》水产制品富硒标准(≥0.15 mg/kg)。
表5 雌、雄华贵栉孔扇贝肉不同可食部位中常量及微量元素含量(干基)
Table 5 Macro and trace elements in edible parts of male and female C.nobilis meat (dry basis)
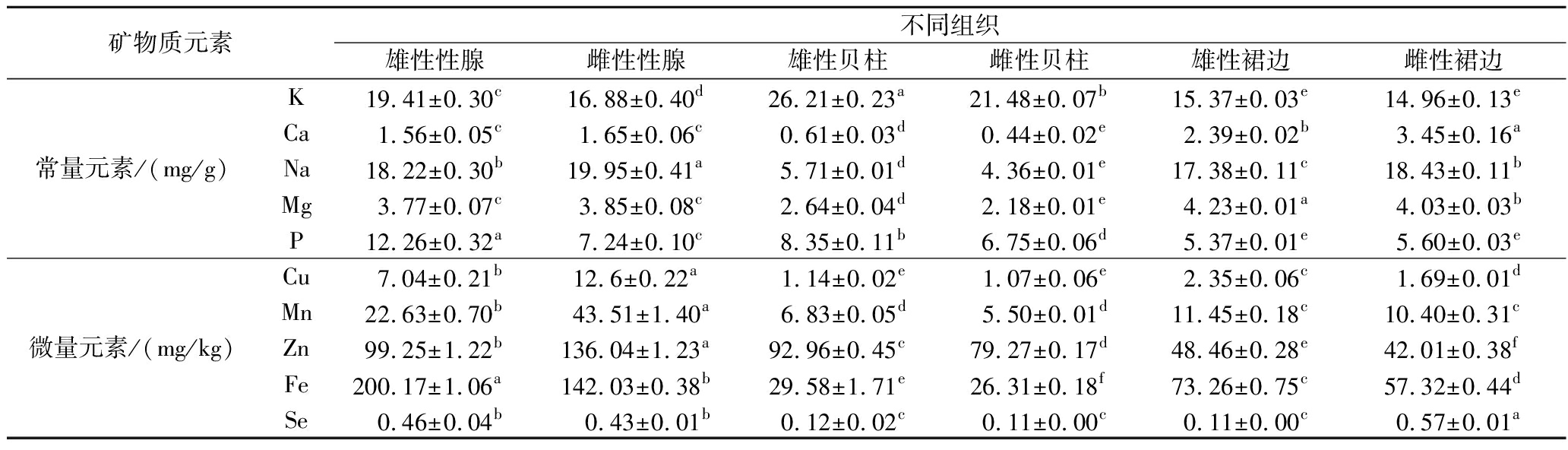
矿物质元素不同组织雄性性腺雌性性腺雄性贝柱雌性贝柱雄性裙边雌性裙边常量元素/(mg/g)K19.41±0.30c16.88±0.40d26.21±0.23a21.48±0.07b15.37±0.03e14.96±0.13eCa1.56±0.05c1.65±0.06c0.61±0.03d0.44±0.02e2.39±0.02b3.45±0.16aNa18.22±0.30b19.95±0.41a5.71±0.01d4.36±0.01e17.38±0.11c18.43±0.11bMg3.77±0.07c3.85±0.08c2.64±0.04d2.18±0.01e4.23±0.01a4.03±0.03bP12.26±0.32a7.24±0.10c8.35±0.11b6.75±0.06d5.37±0.01e5.60±0.03e微量元素/(mg/kg)Cu7.04±0.21b12.6±0.22a1.14±0.02e1.07±0.06e2.35±0.06c1.69±0.01dMn22.63±0.70b43.51±1.40a6.83±0.05d5.50±0.01d11.45±0.18c10.40±0.31cZn99.25±1.22b136.04±1.23a92.96±0.45c79.27±0.17d48.46±0.28e42.01±0.38fFe200.17±1.06a142.03±0.38b29.58±1.71e26.31±0.18f73.26±0.75c57.32±0.44dSe0.46±0.04b0.43±0.01b0.12±0.02c0.11±0.00c0.11±0.00c0.57±0.01a
以上研究表明,华贵栉孔扇贝不同组织部位中矿物质元素含量存在显著差异。性腺部位富含Fe和Zn,雄性贝柱Zn含量也较高,雌性裙边Se含量丰富。消费者可以根据自身营养需求,选择食用不同部位的产品以满足人体对不同矿物质元素的需求。
3 结论
本研究对不同性别及部位的华贵栉孔扇贝营养成分展开分析,测定了常规营养成分、氨基酸、脂肪酸及矿物质元素含量,结果显示:华贵栉孔扇贝整体营养价值高,不同部位各具特色。雌性性腺富含PUFA(3 377.56 mg/100 g)和优质蛋白(EAAI指数73.03),而雄性性腺以丰富的蛋白含量和铁元素为特征,体现生殖功能的性别适应性差异;贝柱TAA含量丰富,具有食品加工优势;裙边富含Se元素(0.57 mg/kg),在功能性产品开发中潜力显著。基于此,建议对其采取按性别或部位加工和全资源利用的策略,通过定向提取性腺营养素、开发贝柱和裙边精深加工产品,提升原料利用率和附加值。本研究明确了华贵栉孔扇贝营养成分的分布规律,为其资源开发提供了科学依据。
[1] 曹善茂, 王昊, 陈炜, 等.岩扇贝闭壳肌营养成分的分析及与中国3种扇贝的比较[J].大连海洋大学学报, 2016, 31(5):544-550.CAO S M, WANG H, CHEN W, et al.Analysis, evaluation and comparison of nutritive composition in rock scallop Crassadoma gigantean with three Chinese scallops[J].Journal of Dalian Ocean University, 2016, 31(5):544-550.
[2] HE C, YE T, ZENG J X, et al.Nutrient comparisons among the noble scallops Chlamys nobilis with three different shell colours to provide advices for consumers to choose high-quality food[J].Frontiers in Marine Science, 2024, 11:1395339.
[3] WU Z X, HU X P, ZHOU D Y, et al.Seasonal variation of proximate composition and lipid nutritional value of two species of scallops (Chlamys farreri and Patinopecten yessoensis))[J].European Journal of Lipid Science and Technology, 2019, 121(7):1800493.
[4] 宋冬茹, 彭吉星, 卢龙飞, 等.栉孔扇贝全生长周期营养品质变化与环境因子相关性分析[J].水产科学, 2024, 43(3):341-351.SONG D R, PENG J X, LU L F, et al.Changes in nutrient quality and correlationship between scallop Chlamys farreri and environmental factors in whole culture period[J].Fisheries Science, 2024, 43(3):341-351.
[5] VENUGOPAL V, GOPAKUMAR K.Shellfish:Nutritive value, health benefits, and consumer safety[J].Comprehensive Reviews in Food Science and Food Safety, 2017, 16(6):1219-1242.
[6] 郑小善, 吉宏武, 张泽伟, 等.热风干制前后凡纳滨对虾中脂质及其脂肪酸组成变化[J].食品工业科技, 2022, 43(10):87-93.ZHENG X S, JI H W, ZHANG Z W, et al.Changes of lipid and fatty acid composition in shrimps(Litopenaeus vannamei) before and after hot-air-drying[J].Science and Technology of Food Industry, 2022, 43(10):87-93.
[7] REKSTEN A M, WIECH M, AAKRE I, et al.Exploring the nutrient composition of various shellfish available in Norway and their role in providing key nutrients[J].Journal of Food Composition and Analysis, 2024, 128:106003.
[8] SUQUET M, GOURTAY C, DONVAL A, et al.The quality of great scallop (Pecten maximus) sperm after thawing[J].General and Comparative Endocrinology, 2016, 229:127-131.
[9] 马占飞, 薛素燕, 李加琦, 等.海州湾不同养殖区紫贻贝的营养特征及其影响因素[J].渔业科学进展, 2023, 44(3):154-162.MA Z F, XUE S Y, LI J Q, et al.Factors influencing the nutritional characteristics of Mytilus galloprovincialis from different culture areas in the Haizhou Bay[J].Progress in Fishery Sciences, 2023, 44(3):154-162.
[10] XU R Y, PAN L Q, YANG Y Y, et al.Temporal transcriptome analysis in female scallop Chlamys farreri:First molecular insights into the disturbing mechanism on lipid metabolism of reproductive-stage dependence under benzo [a] pyrene exposure[J].Science of the Total Environment, 2020, 746:142032.
[11] 张钰伟, 杨静茹, 温为庚, 等.3个大珠母贝养殖群体生物学特征及肌肉营养成分分析[J].南方农业学报, 2024, 55(5):1530-1539.ZHANG Y W, YANG J R, WEN W G, et al.Biological characteristics and muscle nutrition components analysis of three cultured populations of Pinctada maxima[J].Journal of Southern Agriculture, 2024, 55(5):1530-1539.
[12] 魏敏, 吴雨晨, 陈东, 等.青蛤不同壳色个体间的生长及营养差异[J].水产学报, 2022, 46(8):1458-1465.WEI M, WU Y C, CHEN D, et al.Growth and nutritional differences between two shell-color clams(Cyclina sinensis)[J].Journal of Fisheries of China, 2022, 46(8):1458-1465.
[13] 陈素华, 陈爱华, 吴杨平, 等.文蛤与美洲帘蛤的营养组成及风味成分比较分析[J].水产科学, 2023, 42(6):966-976.CHEN S H, CHEN A H, WU Y P, et al.Comparison of nutrient compositions and flavor substances between hard clam Meretrix meretrix and northern quahog Mercenaria mercenaria[J].Fisheries Science, 2023, 42(6):966-976.
[14] 冯森磊, 梁夏菲, 徐晔, 等.不同饵料对两种帘蛤科贝类生长性能的影响研究[J].海洋科学, 2021, 45(12):47-54.FENG S L, LIANG X F, XU Y, et al.Effects of distinct feed categories on the growth performance of two Venerdia species[J].Marine Sciences, 2021, 45(12):47-54.
[15] 徐依琳, 汤云瑜, 叶洪丽, 等.不同地区养殖暗纹东方鲀肌肉的营养成分分析和品质评价[J].食品与发酵工业, 2025, 51(14):364-371.XU Y L, TANG Y Y, YE H L, et al.Nutrient composition analysis and quality evaluation of muscle of Takifugu obscurus cultured in different areas[J].Food and Fermentation Industries, 2025, 51(14):364-371.
[16] 赵娟, 孙玉林, 温倩钰, 等.蓝斑背肛海兔不同组织的营养成分分析及评价[J].食品与发酵工业, 2023, 49(16):125-130.ZHAO J, SUN Y L, WEN Q Y, et al.Analysis and evaluation of nutritional components in different tissues of Notarchus leachii cirrosus Stimpson[J].Food and Fermentation Industries, 2023, 49(16):125-130.
[17] 马晓杰, 左晨霞, 关纯安, 等.斑纹小贻贝的营养成分分析与评价[J].海洋通报, 2024, 43(3):346-352.MA X J, ZUO C X, GUAN C A, et al.Analysis and evaluation of the nutrient content of Mytella strigata[J].Marine Science Bulletin, 2024, 43(3):346-352.
[18] 王允茹, 蔡秋杏, 张晨晓, 等.北部湾海区三种常见牡蛎的蛋白质及氨基酸营养分析与评价[J].食品工业科技, 2022, 43(7):310-316.WANG Y R, CAI Q X, ZHANG C X, et al.Analysis and evaluation of protein and amino acid nutrition of three common oysters in Beibu Gulf[J].Science and Technology of Food Industry, 2022, 43(7):310-316.
[19] SHI L F, HAO G X, CHEN J, et al.Nutritional evaluation of Japanese abalone (Haliotis discus hannai Ino) muscle:Mineral content, amino acid profile and protein digestibility[J].Food Research International, 2020, 129:108876.
[20] 廖月琴, 吴盈茹, 杜琪, 等.新鲜与风干带鱼肌肉品质及营养成分分析与评价[J].食品与发酵工业, 2023, 49(1):185-191.LIAO Y Q, WU Y R, DU Q, et al.Analysis and evaluation of fresh and air-dried hairtail muscle quality and nutritional components[J].Food and Fermentation Industries, 2023, 49(1):185-191.
[21] MURILLO E, RAO K S, DURANT A A.The lipid content and fatty acid composition of four eastern central Pacific native fish species[J].Journal of Food Composition and Analysis, 2014, 33(1):1-5.
[22] 邹朝阳, 赵峰, 王志, 等.大菱鲆不同部位营养与质构品质分析评价[J].渔业科学进展, 2019, 40(6):186-195.ZOU Z Y, ZHAO F, WANG Z, et al.Analysis and evaluation of nutrition and texture quality in different parts of turbot(Scophthalmus maximus)[J].Progress in Fishery Sciences, 2019, 40(6):186-195.
[23] AHMED I, JAN K, FATMA S, et al.Muscle proximate composition of various food fish species and their nutritional significance:A review[J].Journal of Animal Physiology and Animal Nutrition, 2022, 106(3):690-719.
[24] 王继隆, 刘伟, 李培伦, 等.野生和养殖大麻哈鱼肌肉营养成分与品质评价[J].广东海洋大学学报, 2019, 39(2):126-132.WANG J L, LIU W, LI P L, et al.Evaluation of nutritive quality and nutrient components in the muscles of wild and farmed chum salmon(Oncorhynchus keta)[J].Journal of Guangdong Ocean University, 2019, 39(2):126-132.
[25] 张艳霞, 谢成民, 周纷, 等.两种养殖模式大黄鱼肌肉营养价值评价及主体风味物质差异性分析[J].食品科学, 2020, 41(8):220-227.ZHANG Y X, XIE C M, ZHOU F, et al.Evaluation of muscle nutritional value and differences in main flavor substances of pseudosciaena crocea in two cultivation modes[J].Food Science, 2020, 41(8):220-227.