随着消费者对食品质量要求的提升,肉类产品的风味改良已成为食品科学研究的重要方向之一。羊肉富含蛋白质、维生素和微量元素,且具有肉质细嫩、易消化、低脂肪和低胆固醇等优点,深受消费者的喜爱[1],但羊肉过重的“膻味”是导致羊肉消费量不足的主要原因。肌原纤维蛋白(myofibrillar protein,MP)是肉类中含量最丰富的蛋白质,约占肌肉蛋白总量的50%~55%。是风味调控的关键载体,其结构特性直接影响挥发性风味物质(如醛类、酮类、呋喃类)的吸附与释放,从而直接影响羊肉的风味感知[2]。醛类化合物因其低感官阈值和高挥发性,在羊肉特征风味形成中起着至关重要的作用,通常呈现出青草、油脂和橙皮味[3],与羊肉膻味感知密切相关。而低浓度的1-辛烯-3-酮(蘑菇清香和血鲜味)和高浓度的2-戊基呋喃(烤香和焦糖香)能在一定程度上掩盖膻味,促进湖羊肉的肉香味,对湖羊肉的香味具有积极贡献[4]。
超声作为一种高效、环保的非热加工技术,在肉类加工中展现出显著优势,包括去除异味物质[5],促进良好风味形成[6]以及维持肉品物理性质等。超声通过空化效应产生的机械剪切力和微射流作用,能够显著改变蛋白的二级结构、三级结构和微观结构,进而改变其粒径、浊度、电位等结构性质[7]。这些结构变化进一步影响其表面疏水性、内源荧光性、巯基含量等理化性质,最终决定蛋白的溶解性、凝胶特性、乳化性等功能性质[8]。目前,关于超声对风味影响的研究多集中于通过改变脂肪氧化程度或途径来增强风味物质的形成[9],而关于超声如何改变MP结构进而影响其与风味物质结合的研究则相对有限。
基于此,本论文通过测定粒径分布、电位、浊度、溶解度、分子间作用力、二级结构及巯基含量等指标,系统探究了超声辅助低温漂洗(ultrasound-assisted low-temperature washing,USW)对湖羊肉MP结构的影响。在此基础上,进一步分析MP结构变化如何影响其与己醛、十一醛、(E,E)-2,4-癸二烯醛、1-辛烯-3-酮和2-戊基呋喃等主要风味物质的结合能力。研究结果有助于揭示超声辅助漂洗技术改善羊肉风味特征的作用机制,为其在湖羊肉加工中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
湖羊肉购自浙江湖州德清小张鲜肉店,购买后30 min内放入冷却箱(0~4 ℃)中送至实验室。随机挑选9根12月龄的雌性湖羊的肋骨,去骨取肉。沿垂直肌纤维方向分割成10 cm×5 cm的小块,置于4 ℃冰箱冷却,1 h内完成清洗处理。
PBS,杭州吉工生物科技有限公司;标准牛血清白蛋白(bovine serum albumin,BSA),上海泰坦科技股份有限公司;NaCl、Na2HPO4、CuSO4·5H2O、酒石酸钠钾、尿素、β-巯基乙醇、KBr、EDTA、甘氨酸、三羟甲基氨基甲烷[Tris(hydroxymethyl)aminomethane,Tris]、5,5-二硫代双(2-硝基苯甲酸)[5,5′-Dithiobis-(2-nitrobenzoic acid),DTNB]、己醛、十一醛、(E,E)-2,4-癸二烯醛、1-辛烯-3-酮、2-戊基呋喃,上海麦克林有限公司。
1.2 仪器与设备
T 25 digital ULTRA-TURRAX高速均质机,德国IKA均质机;PTY-124/223电子天平,华志(福建)电子科技有限公司;FST-R0-22超纯水机,上海富诗特环保科技有限公司;Bechman高速冷冻台式离心机,日立(中国)有限公司;Nicolet 6700傅里叶变换红外光谱仪,布鲁克(北京)科技有限公司;ZSU3100动态激光粒度分析仪,英国Malvern公司;S—4700(Ⅱ)扫描电镜,蔡司集团;SB-400DTYF超声清洗机,宁波赛克生物技术有限公司;Trace 1300气相色谱仪,赛默飞世尔科技公司。
1.3 实验方法
1.3.1 样品处理
湖羊肉样品随机分为3组进行处理:对照样品不清洗,在4 ℃下储存,记为CON组;低温漂洗(low-temperature washing,LTW)组样品按照1∶4的肉水比例,在(4±1.0) ℃条件下,置于纯水中清洗15 min;USW组样品在肉水比1∶4、(4±1.0) ℃条件下,采用33 kHz、400 W的超声清洗15 min。
1.3.2 肌原纤维蛋白提取
参照赵冰等[10]的研究并稍作修改,简言之,采用PBS提取法,称取切碎的10.00 g羊肉样品置于100 mL离心管中,按料液比1∶4(g∶mL)加入PBS,振荡使之充分混合。将样品置于冰浴中,使用8 000 r/min均质30 s,间歇30 s,总处理时间为1 min。匀浆液通过80目三层折叠纱布过滤以去除结缔组织,滤液随后在4 ℃下以8 000 r/min离心10 min,收集沉淀。上述提取过程(加入提取液—离心—倾析上清液—保留沉淀)重复4次,以获得初始沉淀。
将初始沉淀与4倍体积并在4 ℃预冷的0.1 mol/L NaCl溶液混合,按相同离心条件处理2次,最终收集的沉淀即为MP。所得MPs样品置于4 ℃冷藏,并于48 h内使用。
1.3.3 平均粒径、zeta-电位的测定
将1.3.2节制备的MP用磷酸盐缓冲液(20 mmol/L Na2HPO4、0.6 mol/L NaCl,pH 7.0,下同)稀释至质量浓度为1 mg/mL,振摇,确保样品均匀,利用动态激光粒度仪进行粒径和zeta-电位测定。温度设置25 ℃,平衡时间10 s。平均测量时间约120 s。所有样品测量3次。
1.3.4 浊度及溶解度的测定
将不同处理组的MP样品用磷酸盐缓冲液稀释至质量浓度2 mg/mL。用于浊度测定时,样品在600 nm处使用酶标仪测定吸光度,浊度以吸光度表示,每个样品测定3次,取平均值作为结果。用于溶解度测定时,取5 mL稀释后的MP溶液,在10 000 r/min下离心10 min,收集上清液,通过Biuret法测定离心前后上清液中的蛋白质浓度,并以其百分比表示溶解度。
标准曲线的测定:将12支试管分为2组,分别加入不同体积的标准BSA溶液(0、0.2、0.4、0.6、0.8、1.0 mL),用纯水补足至1 mL。然后加入4 mL双缩脲试剂,混匀后在室温下静置30 min。测量其在540 nm波长处的吸光度,并以未加蛋白溶液的试管作为空白对照。根据蛋白质含量与吸光度绘制标准曲线。
1.3.5 分子间作用力的测定
参照以往的研究[11]方法并稍作修改。具体而言,将MP样品用pH 6.0的磷酸盐缓冲液稀释至15 mg/mL,混匀后,取5 mL稀释液分别加入20 mL含不同成分的反应液(S1:0.05 mol/L NaCl,S2:0.6 mol/L NaCl,S3:0.6 mol/L NaCl+1.5 mol/L尿素,S4:0.6 mol/L NaCl+8 mol/L尿素,S5:0.6 mol/L NaCl+8 mol/L尿素+0.05 mol/L β-巯基乙醇)。均质30 s后,在4 ℃下孵育90 min。孵育后,样品在4 ℃下以5 000 r/min离心8 min,测定上清液中蛋白质含量。通过溶液中蛋白质的溶解度计算离子键(S2与S1的差值)、氢键(S3与S2的差值)、疏水相互作用(S4与S3的差值)和二硫键(S5与S4的差值)的贡献。
1.3.6 傅里叶变换红外光谱测定
准确称量冻干肌原纤维蛋白粉末2 mg、KBr 200 mg,并用玛瑙研钵对混合物进行充分研磨至均匀,利用傅里叶变换红外光谱分析仪对样品进行扫描,红外扫描范围为4 000~400 cm-1。利用OMINC和Peakfit 4.12软件分析各峰及面积,分析蛋白二级结构变化。
1.3.7 总巯基及游离巯基测定
参考PAN等[12]的方法精确称取30 mg冻干MP粉末,分别溶于10 mL缓冲液1和缓冲液2中。缓冲液1的配方为每升溶液含1.17 g EDTA、6.9 g甘氨酸和1.04 g Tris;缓冲液2为每升缓冲液1中加入480.48 g尿素。溶解后,加入0.1 mL Ellman试剂,避光条件下于25 ℃振荡1 h。随后,以5 000 r/min离心10 min,收集上清液并测定其在412 nm处的吸光度。实验重复3次,按照公式(1)计算巯基含量:
巯基含量![]()
(1)
式中:A412,上清液在412 nm处的吸光值;D,稀释倍数;C,蛋白质量浓度,mg/mL;73.53=106/1.36×104,1.36×104是TNBA的摩尔消光系数。
1.3.8 微观结构观察
参考薛紫曦等[13]的方法,并稍作修改。将不同处理组的样品真空冷冻干燥后,进行相同程度的破碎处理。随后,将处理后的样品均匀粘贴在导电胶上。对样品进行喷金处理后,将样品置于扫描电镜样品室中,在加速电压为5.00 kV的条件下进行观察,获取200倍和1 000倍的微观结构图像。
1.3.9 风味物质结合能力测定
将筛选出的5种湖羊特征风味化合物,己醛、(E,E)-2,4-癸二烯醛、十一醛、1-辛烯-3-酮和2-戊基呋喃,添加到棕色容量瓶中,用少量甲醇溶解,再用蒸馏水定容至800 mg/kg,制成风味储备液,于4 ℃冰箱保存。
根据方婕等[14]的方法并稍作调整,将不同处理的肌原纤维蛋白进行溶解并稀释至质量浓度为4 mg/mL,空白对照组使用相同浓度的磷酸盐缓冲溶液。取5 mL样品溶液加入顶空瓶中,分别加入200 μL各风味储备液,密封后在涡旋振荡器上振荡30 s,随后在4 ℃下冷藏吸附12 h。冷藏吸附后的样品置于30 ℃下平衡30 min,再在60 ℃下使用萃取针顶空吸附,持续30 min。
色谱条件:萃取头在250 ℃下解析5 min,1∶1分流进样,载气为He,通过DB-5MS毛细管柱对风味成分进行分离。GC升温程序:柱温初始35 ℃下保持3 min,随后以3 ℃/min升温至40 ℃,再以8 ℃/min升温至240 ℃并保持10 min。质谱分析条件:离子源温度250 ℃,采用正离子模式,扫描质量范围为29~400 m/z。
肌原纤维蛋白吸附能力的计算参考刘士健[15]的方法,按公式(2)进行计算:
肌原纤维蛋白吸附能力![]()
(2)
式中:SC,空白对照组检测到的风味物质响应面积;SS,存在肌原纤维蛋白的实验条件下,风味物质与蛋白结合后的响应面积。
1.3.10 分子对接
本研究中的肌原纤维蛋白结构从PDB数据库中获得,选取的种属为绵羊,蛋白的PDB ID为6YSY。5种特征风味化合物的3D分子结构从PubChem数据库获得,并使用MMFF94力场进行能量最小化处理。分子对接使用AutoDock Vina 1.2.3进行[16]。在对接之前,使用PyMol 2.5.5对受体蛋白进行预处理,包括去除水分子、盐离子以及小分子。随后设置对接盒子,使整个蛋白结构被充分包裹。所有处理后的受体蛋白及小分子均使用ADFRsuite 1.0转换为PDBQT格式,作为对接输入文件。在对接过程中,全局搜索精度被设置为32,其他参数保持默认值。系统输出的得分最高的对接构象被认为是最可能的结合构象。最后,使用PyMOL软件对对接结果进行可视化分析,以观察和分析风味物质与蛋白之间的结合模式[17]。
1.4 数据处理与分析
所有数据进行3次重复的独立试验并以“平均值±标准差”来表示。使用SPSS 22.0软件对数据进行统计分析,通过Origin 2024进行绘图。并通过单因素方差分析和邓肯检验分析平均值之间的显著性差异(P<0.05)。
2 结果与分析
2.1 不同漂洗处理对肌原纤维蛋白粒径和zeta-电位的影响
粒径和电位的测定反映了蛋白质的稳定性和分散状态。如图1所示,在漂洗处理后,肌原纤维蛋白粒径显著增加,由(266.7±1.27) nm增加至(282.4±1.72) nm,而超声进一步加剧了粒径增加现象,使粒径增加至(355.6±1.10) nm。这可能是由于超声处理通过机械力和空化作用打开蛋白质结构,使疏水区域和反应性基团暴露出来。这些变化促进蛋白质之间形成非共价键和氢键,从而可能进一步增强聚集效应,导致粒径增加[18]。
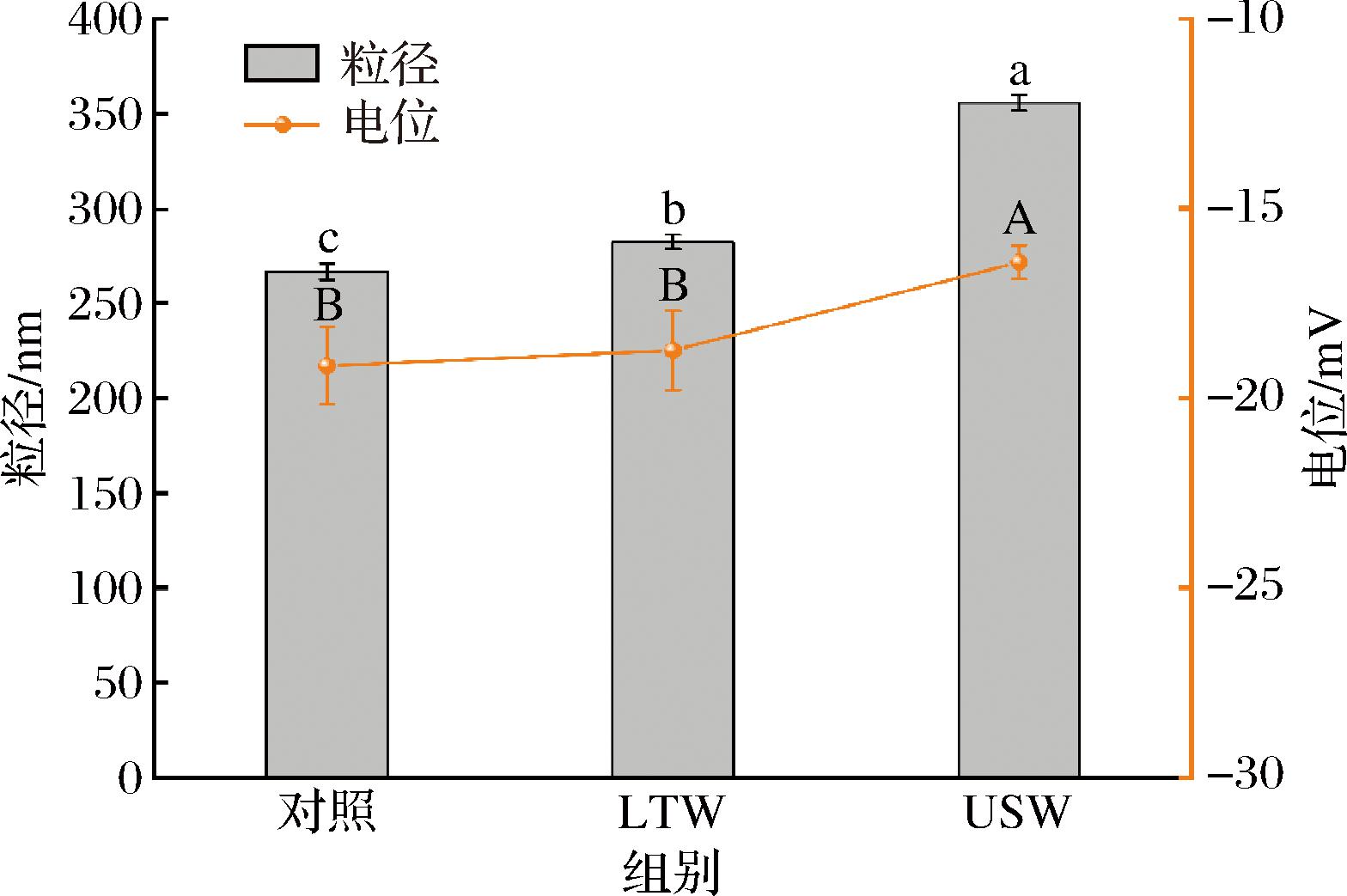
图1 不同漂洗处理对肌原纤维蛋白粒径和zeta-电位的影响
Fig.1 Effect of different washing treatments on myofibrillar protein particle size and zeta-potential
注:不同字母表示差异显著(P<0.05)(下同)。
Zeta-电位可以反映溶液中颗粒的表面电荷特性,并描述颗粒之间的静电相互作用,zeta-电位的绝对值越大,蛋白质与水的相互作用就越强[19]。由结果可知,LTW组的电位与对照组并无显著性差异,而USW组电位的绝对值显著减小至(16.62±0.445) mV。这可能是一些负电荷基团被部分隐藏或因疏水相互作用而不易接触溶液时,蛋白质表面的电荷分布会发生变化,导致zeta-电位绝对值的减小[20]。
2.2 不同漂洗处理对肌原纤维蛋白浊度和溶解度的影响
浊度是反映蛋白质聚集程度的指标,浊度的增加表明肌原纤维蛋白颗粒的聚集程度增加[21]。如图2所示,LTW组和USW组的肌原纤维蛋白的浊度分别为0.185±0.002和0.190±0.003,较对照组的0.176±0.003显著增加。这可能是由于肌原纤维蛋白的粒径增大,从而导致的浊度上升。浊度的上升这一趋势与粒径增大、zeta-电位绝对值下降一致,反映了超声会影响蛋白质的结构。在溶解度上,对照组(65.24±0.33)%显著高于LTW组(54.75±0.64)%和USW组(55.31±0.23)%,可能是由于对照组较小的粒径分布与较低的浊度,使其分散体系更稳定,同时较高的zeta-电位绝对值通过增强静电稳定作用抑制了蛋白聚集,所以肌原纤维蛋白能保持较好的分散性和溶解度。
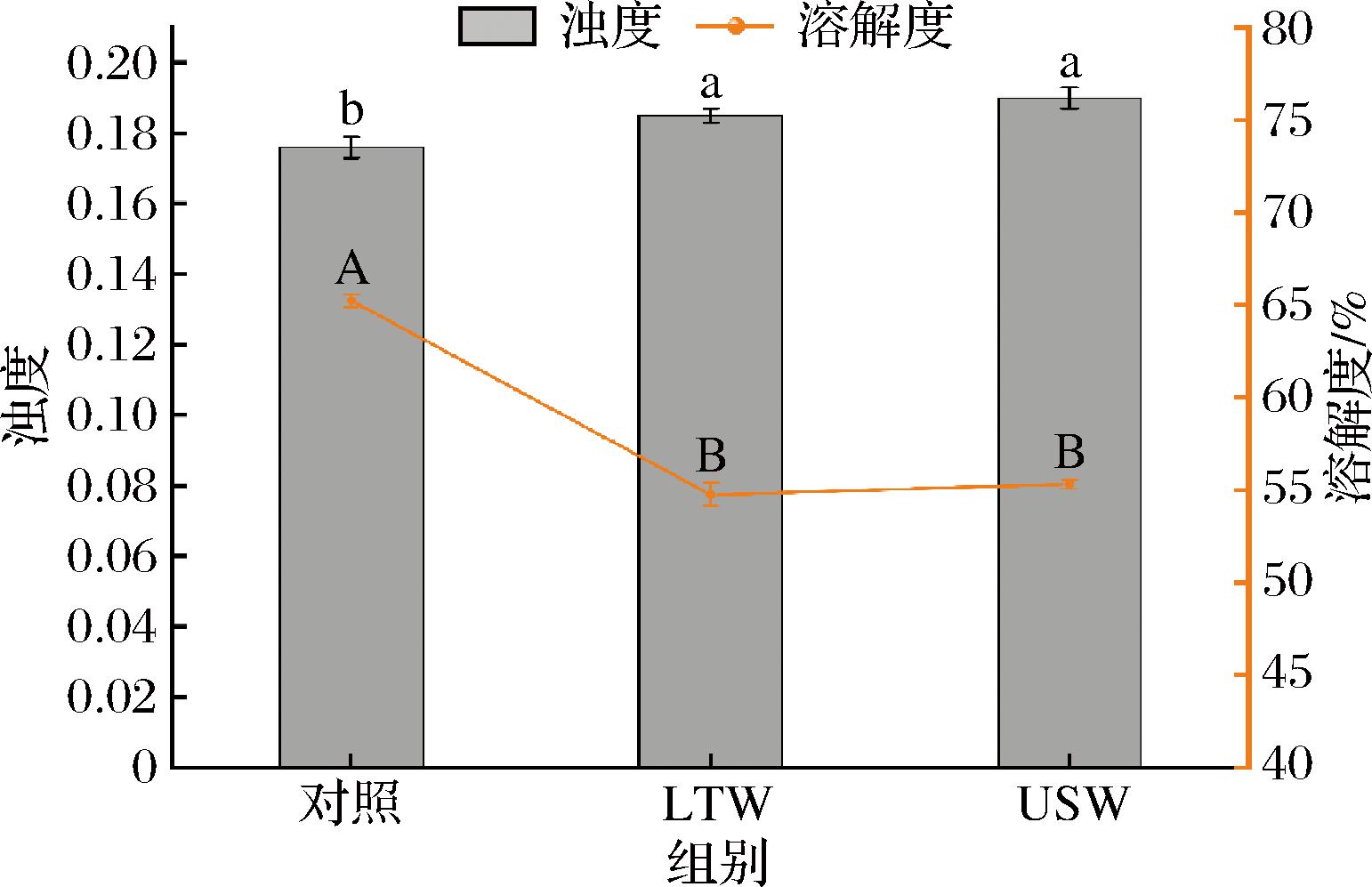
图2 不同漂洗处理对肌原纤维蛋白浑浊度和溶解度的影响
Fig.2 Effect of different washing treatments on myofibrillar protein turbidity and solubility
2.3 不同漂洗处理对肌原纤维蛋白分子间作用力的影响
分子间作用力决定了蛋白质的空间构象及其功能。氢键和离子键对蛋白质的二级和三级结构至关重要,而疏水作用力和二硫键则有助于维持蛋白质的稳定性和功能性。如图3所示,与对照组和LTW组相比,USW组的离子键[(0.69±0.01) mg/mL]、氢键[(0.43±0.01) mg/mL]、[疏水作用(0.33±0.03) mg/mL]和二硫键[(2.37±0.02) mg/mL]都显著增强。这是因为超声能通过高频震荡力破坏蛋白质的空间结构,促使蛋白质解聚并重新折叠,或使蛋白质的疏水区域可能暴露出来,导致这些区域的极性基团(如氨基和羧基)之间形成更多的氢键和离子键[22];还可能使蛋白质部分解聚,令原本被二硫键稳定的二级结构部分解构,从而暴露更多的游离巯基,促进了蛋白质中半胱氨酸残基之间的形成二硫键[23]。
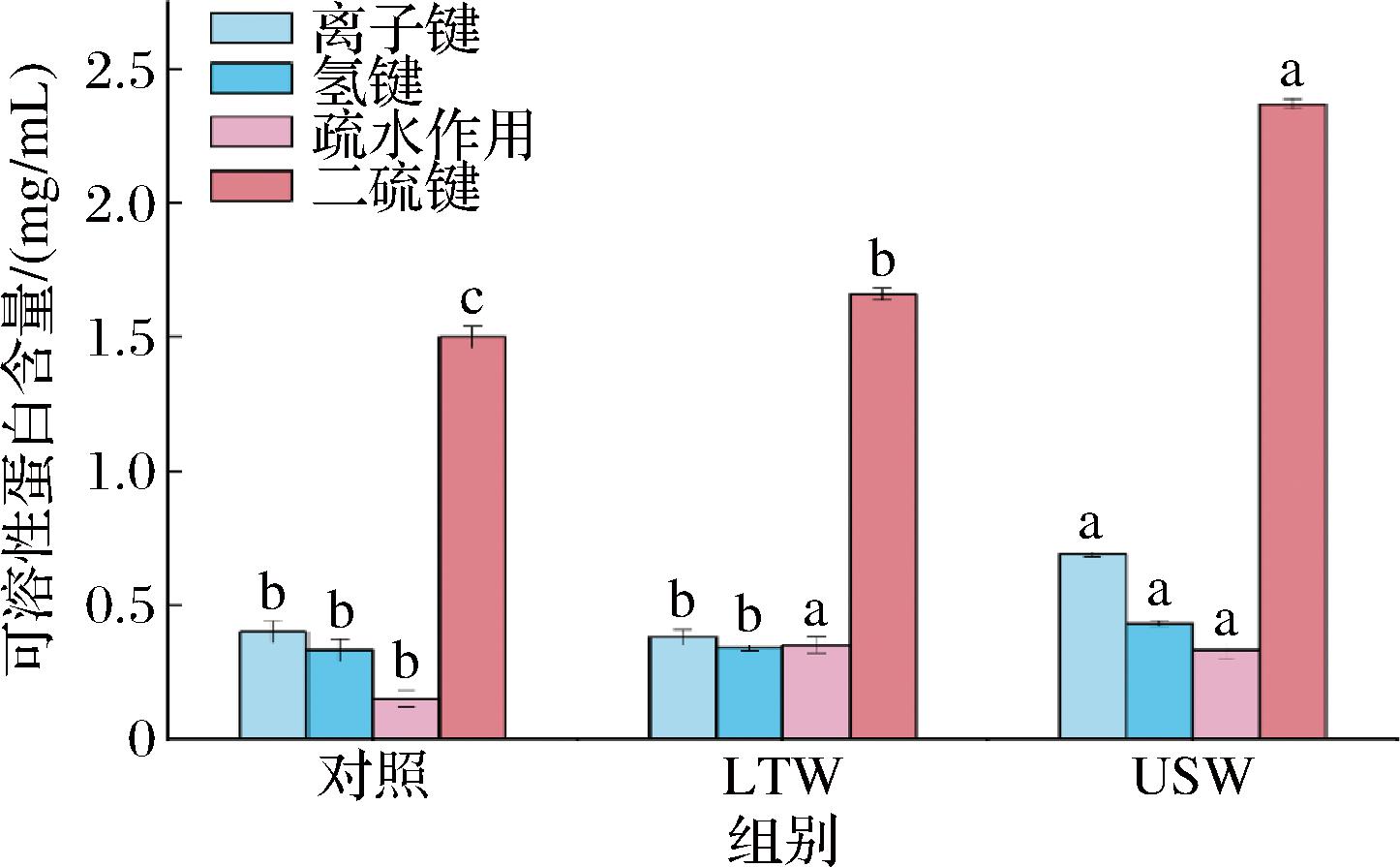
图3 不同漂洗处理对肌原纤维蛋白分子间作用力的影响
Fig.3 Effect of different washing treatments on intermolecular forces of myofibrillar fibrillar proteins
2.4 游离巯基和总巯基的影响
巯基是与蛋白质功能特性密切相关的官能团之一,其中游离巯基是蛋白质中包含半胱氨酸残基的活性基团,它在蛋白质的结构和功能中具有重要作用,总巯基包括游离巯基和已形成二硫键的巯基[24]。如图4所示,LTW组游离巯基含量[(23.87±0.15) μmol/g]显著增多,但总巯基含量[(36.67±0.19) μmol/g]无显著变化,这表明低温漂洗可能通过改变蛋白质的分子间相互作用(如疏水作用)暴露出更多的游离巯基,但未显著破坏二硫键或导致二硫键的断裂,因此总巯基变化不大。而USW组游离巯基含量[(28.16±0.13) μmol/g]和总巯基含量[(46.05±0.08) μmol/g]都显著增多,这可能是由于超声能够展开蛋白质分子并暴露内部的—SH基团,从而导致游离巯基增加[24]。同时还可能促使蛋白质结构的某些变化(如重新折叠或解聚),这些变化有可能在新的位置形成更多的二硫键,进而增加总巯基的含量。
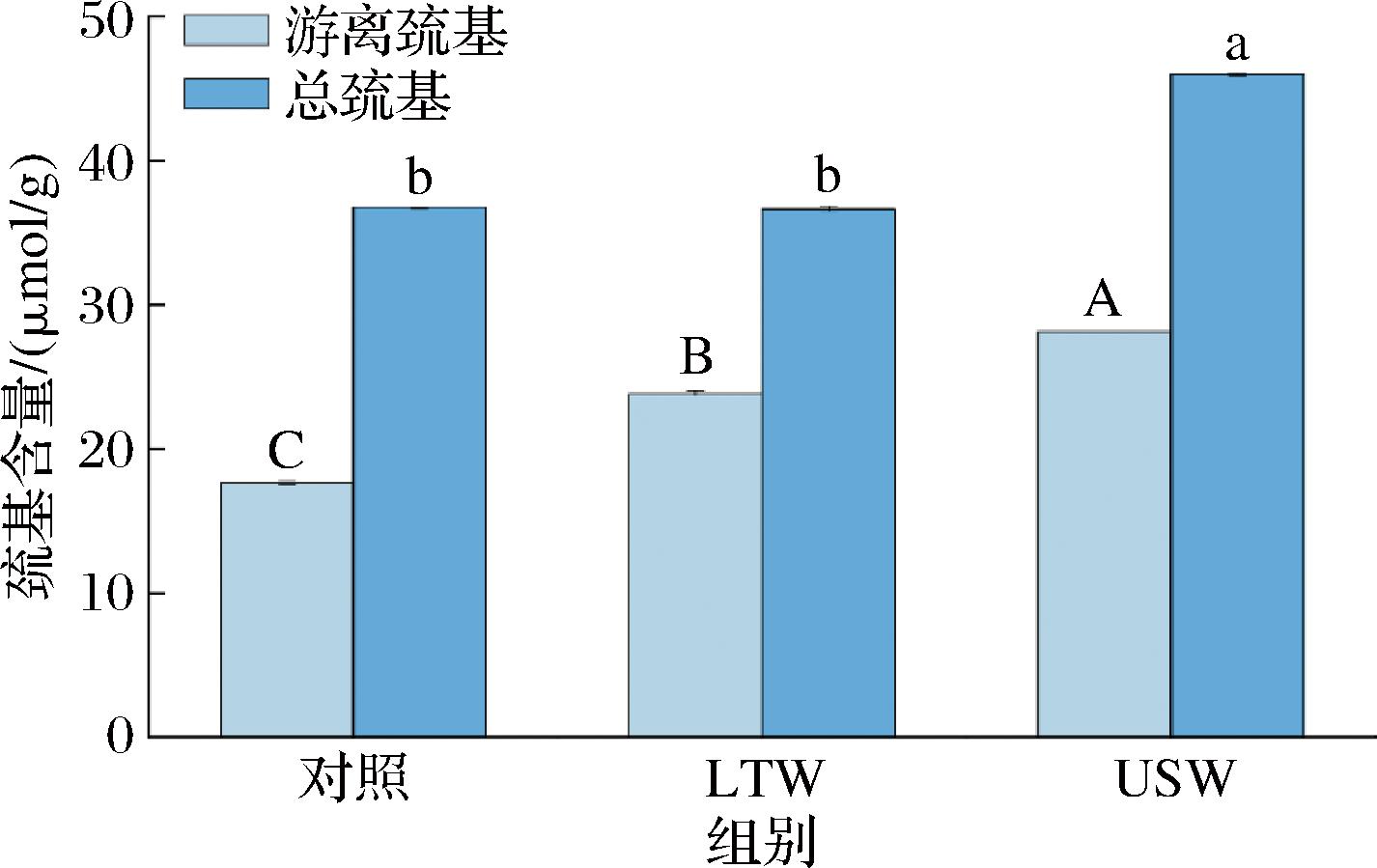
图4 不同漂洗处理对肌原纤维蛋白游离巯基和总巯基的影响
Fig.4 Effect of different washing treatments on free and total sulfhydryl groups of myofibrillar fibrillar proteins
2.5 不同漂洗处理对肌原纤维蛋白二级结构的影响
傅里叶变换红外光谱可以用来检测分子带中的特定振动吸收模式和分子结构的修饰,不同的结构形式将对应于不同的吸收峰[25],如图5-a所示。根据红外谱图,吸收峰的位置和形状没有太大变化,表明超声处理没有导致肌原纤维蛋白官能团的彻底破坏或形成[23]。其中,3 289 cm-1这一峰通常归因于蛋白质中的N—H伸缩振动(氨基酸中的氨基氢或氨基肽键的振动),它反映了蛋白质中氢键的存在[22];2 924 cm-1这一峰通常与C—H伸缩振动相关,代表蛋白质中的疏水性基团(如甲基、亚甲基等)之间的相互作用;1 650 cm-1这一峰通常对应于α-螺旋结构中的C![]() O伸缩振动(肽键的伸缩振动);1 544 cm-1这一峰通常与N—H弯曲振动相关。经过漂洗后,LTW组的峰位的微小变化表明,低温漂洗虽引起一定变化,但并未显著改变蛋白质的氨基氢和疏水基团的相互作用,也未能显著破坏或重组蛋白质的二级结构。经过超声波处理后,USW组在3 296 cm-1处观察到明显的红移现象,这表明超声波处理可能加强了蛋白质中的氢键,或改变了氨基氢的化学环境,对肌原纤维蛋白的结构产生显著影响,NI等[26]的研究同样证明,超声处理会使MP的酰胺A带中观察到明显的红移现象。在1 652、1 541 cm-1处的变化与LTW组相似,但红移现象更为明显,意味着超声可能增强了蛋白质中的氢键和疏水相互作用,导致蛋白质二级结构的变化。
O伸缩振动(肽键的伸缩振动);1 544 cm-1这一峰通常与N—H弯曲振动相关。经过漂洗后,LTW组的峰位的微小变化表明,低温漂洗虽引起一定变化,但并未显著改变蛋白质的氨基氢和疏水基团的相互作用,也未能显著破坏或重组蛋白质的二级结构。经过超声波处理后,USW组在3 296 cm-1处观察到明显的红移现象,这表明超声波处理可能加强了蛋白质中的氢键,或改变了氨基氢的化学环境,对肌原纤维蛋白的结构产生显著影响,NI等[26]的研究同样证明,超声处理会使MP的酰胺A带中观察到明显的红移现象。在1 652、1 541 cm-1处的变化与LTW组相似,但红移现象更为明显,意味着超声可能增强了蛋白质中的氢键和疏水相互作用,导致蛋白质二级结构的变化。
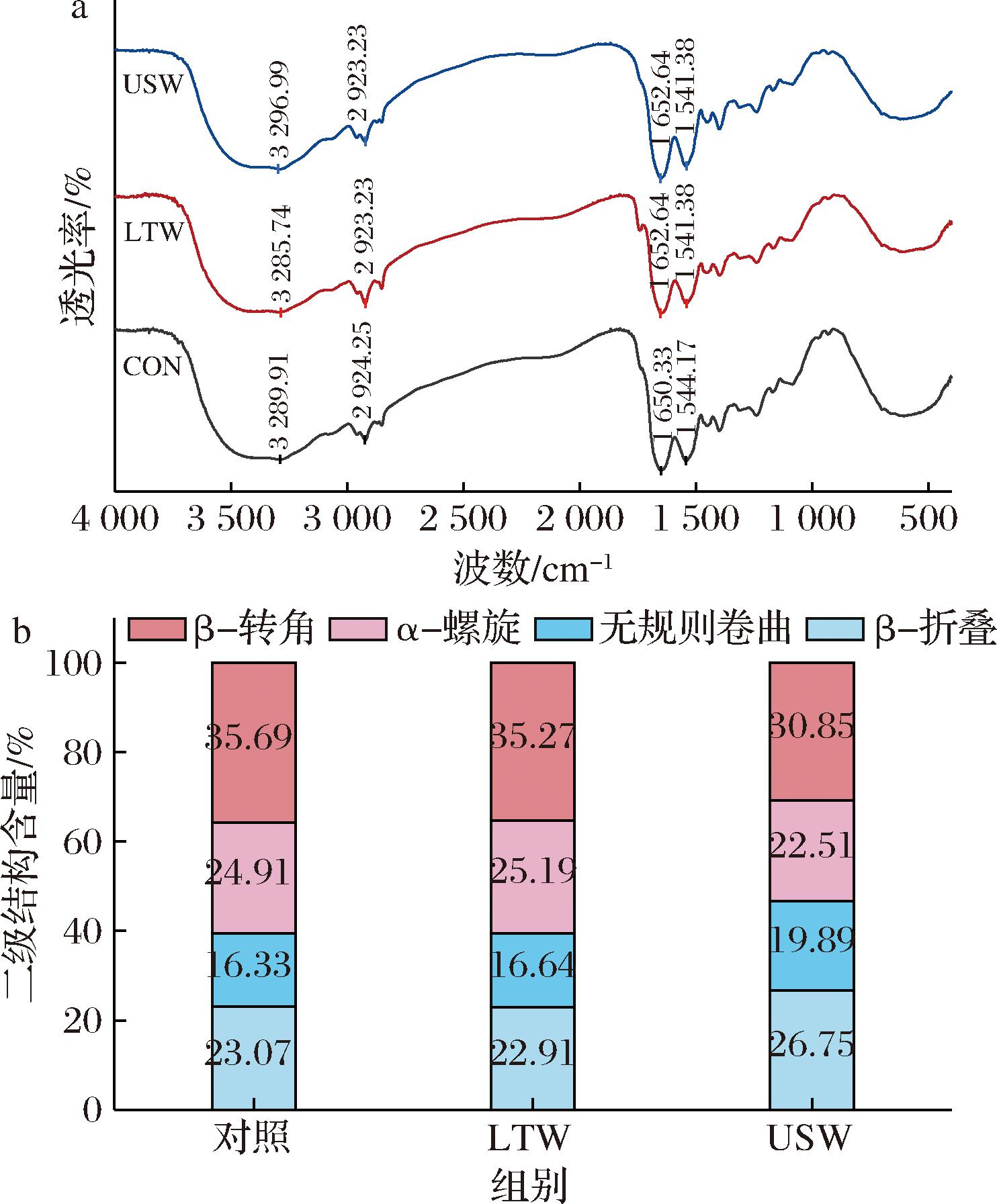
a-红外光谱;b-二级结构含量
图5 不同漂洗处理对肌原纤维蛋白二级结构的影响
Fig.5 Effect of different washing treatments on the secondary structure of myofibrillar fibrillar proteins
傅里叶变换红外光谱通常还用于研究蛋白质的二级结构,包括α-螺旋、β-折叠、β-转角、无规则卷曲的变化。其中,α-螺旋和β-折叠代表有序结构,而β-转角、无规则卷曲则代表无序结构[24]。由图5-b可知,与对照组相比,LTW组在二级结构上无显著变化,说明低温清洗较为温和,并未显著改变肌原纤维蛋白的二级结构。但经过超声波处理后,α-螺旋含量从24.91%显著下降至22.51%,β-转角的含量从35.69%显著降低到30.85%。相反的是,无规则卷曲和β-折叠的含量显著上升,这表明超声处理倾向于使蛋白质从有序结构转变为松散结构,从而增加其柔韧性和开放性[27]。
2.6 不同漂洗处理对肌原纤维蛋白微观结构的影响
扫描电镜可以用来观测肌原纤维蛋白的微观结构,图6分别为不同漂洗处理组在放大200倍和1 000倍时肌原纤维蛋白的图像。未经超声处理的肌原纤维蛋白表面平滑,无明显颗粒状结构。而经过超声处理后,蛋白表面的光滑度发生了变化,表面变得更加不规则且粗糙,出现凹凸不平的形态,这可能是由于超声的机械力会导致蛋白质链的部分折叠、聚集或者解聚。此结果与杨庭轩[27]的研究结果一致,牛肉的肌原纤维蛋白在超声后,表面粗糙度显著增加。

a-CON组;b-LTW组; c-USW组
图6 不同漂洗处理对肌原纤维蛋白微观结构的影响
Fig.6 Effect of different washing treatments on the microstructure of myofibrillar fibrillar proteins
2.7 风味物质吸附能力结果
蛋白质对挥发性风味物质的吸附作用在食品风味的形成中起着至关重要的作用。肌原纤维蛋白的结构变化直接影响其对风味物质的吸附能力。且不同风味化合物与蛋白质的结合能力则存在显著差异,这主要与风味物质的化学结构密切相关,每种风味物质都具有特定的吸附位点,这决定了其与蛋白质的亲和性[28]。图7中展示了5种风味物质与肌原纤维蛋白结合的实验结果,包括己醛、十一醛、(E,E)-2,4-癸二烯醛、1-辛烯-3-酮以及2-戊基呋喃。与对照组相比,USW组对己醛、十一醛、(E,E)-2,4-癸二烯醛的吸附能力显著增强,分别提高28.83%、40.14%、21.08%。LTW组和USW组对1-辛烯-3-酮的吸附能力分别为(63.35±4.59)%、(61.35±3.92)%,显著高于CON组(34.24±4.75)%。一方面,超声处理通过改变蛋白质的二级结构,导致其结构松散并呈现不规则变化,尤其是α-螺旋和β-转角的减少,以及无规则卷曲的增加。这样的结构变化暴露了更多的疏水区域和氨基酸残基,进而增强了蛋白质与醛类物质之间的疏水相互作用。此外,醛酮类物质通常通过与蛋白质表面疏水基团、氨基或巯基的相互作用形成稳定复合物,超声处理提高了蛋白质的表面活性,从而增强了分子间的结合力,促进了更多醛类分子的结合。另一方面,超声还可能通过促进蛋白质分子重新排列和构象变化,暴露更多的巯基(—SH),从而为蛋白质与醛酮类物质之间的亲核反应提供更多机会,进一步增强了其吸附能力。吸附能力的增强降低具有青草风味醛类的感知浓度,从而降低膻味。风味化合物的风味特征与其释放量和感知阈值有关,超声降低1-辛烯-3-酮被感知的浓度,从而使高浓度下刺激的金属味被感知为低浓度下温和的血鲜味[29]。图7-e的结果表明,与CON组相比,LTW组和USW组对2-戊基呋喃的吸附能力显著下降约9%,这意味着更多的2-戊基呋喃可能会因游离而被感知,从而为湖羊肉提供更多的肉香味或焦糖风味。
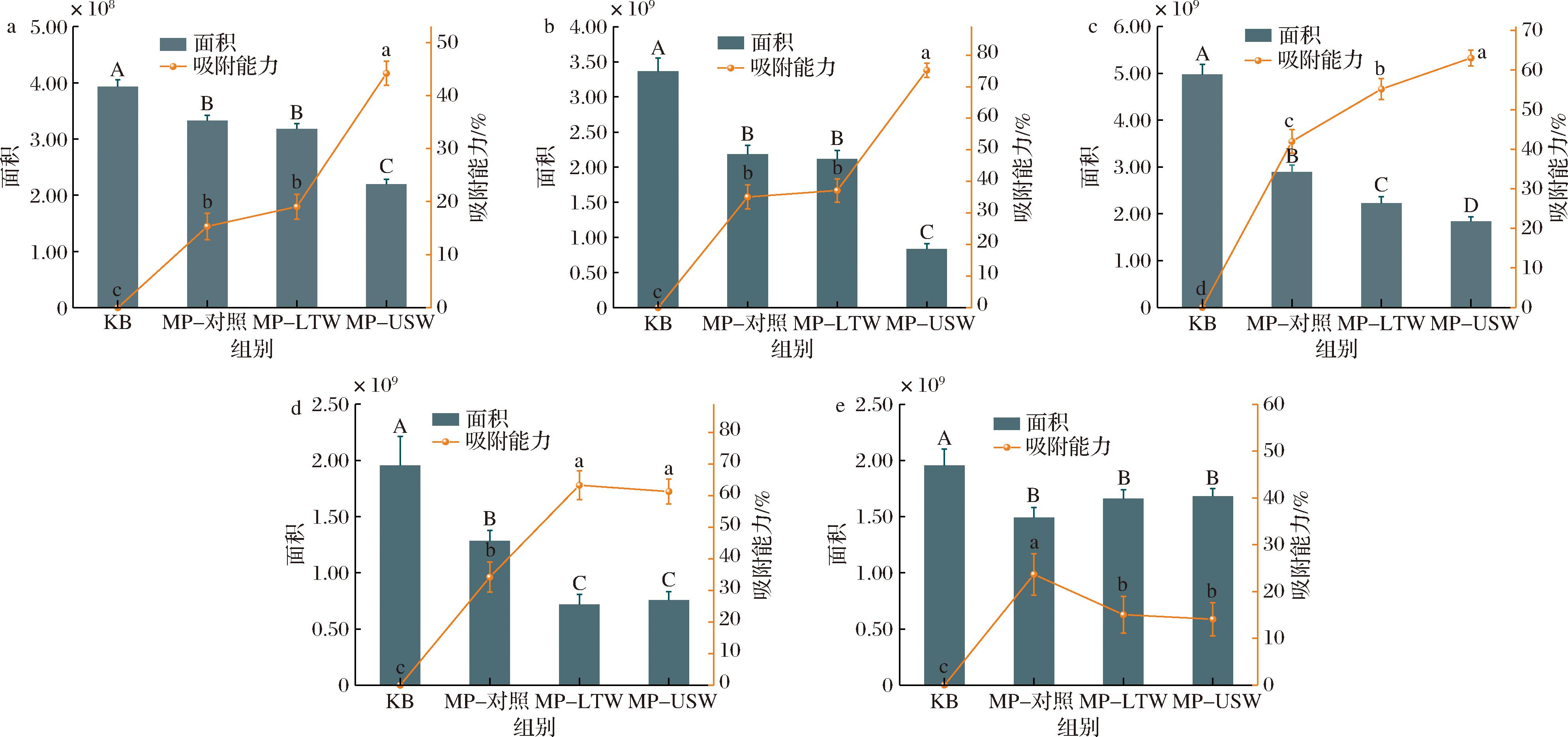
a-己醛;b-十一醛;c- (E,E)-2,4-癸二烯醛;d-1-辛烯-3-酮;e-2-戊基呋喃
图7 不同肌原纤维蛋白对5种风味物质的吸附能力
Fig.7 Adsorption capacity of different myofibrillar proteins with five flavor compounds
2.8 分子对接模拟结果
如图8所示,己醛通过氢键作用与肌原纤维蛋白中的ALA-466残基形成稳定结合。此外,己醛与蛋白质中的TYR-269、ASN-657、PHE-654、LEU-658、THR-484、ILE-465等疏水性氨基酸残基发生疏水相互作用。尤其是TYR-269和ILE-465,它们的芳香族侧链和疏水性侧链为己醛提供了理想的结合环境。氢键和疏水作用共同促进了己醛与肌原纤维蛋白的紧密结合,从而对肉类的风味和结构产生重要影响。图8-b展示了十一醛与肌原纤维蛋白上的LEU-270形成氢键作用,这种氢键作用强化了小分子与蛋白质的结合紧密性。同时,十一醛通过疏水作用与蛋白质中的THR-484、ASN-657、TYR-269、ILE-465、PHE-654、LEU-658等氨基酸残基相互作用,促进了两者的结合。图8-c展示了(E,E)-2,4-癸二烯醛与肌原纤维蛋白中的LEU-270、PHE-654、ILE-481、THR-484、ILE-465、ALA-466、TYR-269等氨基酸残基通过疏水作用紧密结合,带有共轭双键的(E,E)-2,4-癸二烯醛通过π-π共振相互作用,提高蛋白质和小分子结合的稳定性[29]。如图8-d所示,1-辛烯-3-酮与肌原纤维蛋白中的ALA-466形成氢键作用,同时还通过疏水性相互作用与蛋白质上的ILE-481、THR-484、LEU-658、LEU-661、TYR-269等氨基酸残基相互作用。图8-e展示了2-戊基呋喃与肌原纤维蛋白中的ILE-481、ALA-466、ILE-465、TYR-269、LEU-661、ASN-657、LEU-658、PHE-654、THR-484等氨基酸残基通过疏水作用进一步巩固了小分子与蛋白质的相互作用。这些相互作用不仅增强了风味分子的结合能力,还对肉类的口感和风味特性产生了重要影响[30]。总的来说,图8的分子对接模拟揭示了不同风味物质与肌原纤维蛋白之间的多种结合模式,氢键和疏水作用是促使风味分子与蛋白质结合的重要相互作用力[31],这些相互作用显著增强了风味物质与蛋白质的结合稳定性,进一步影响了肉类的风味及整体感官体验。
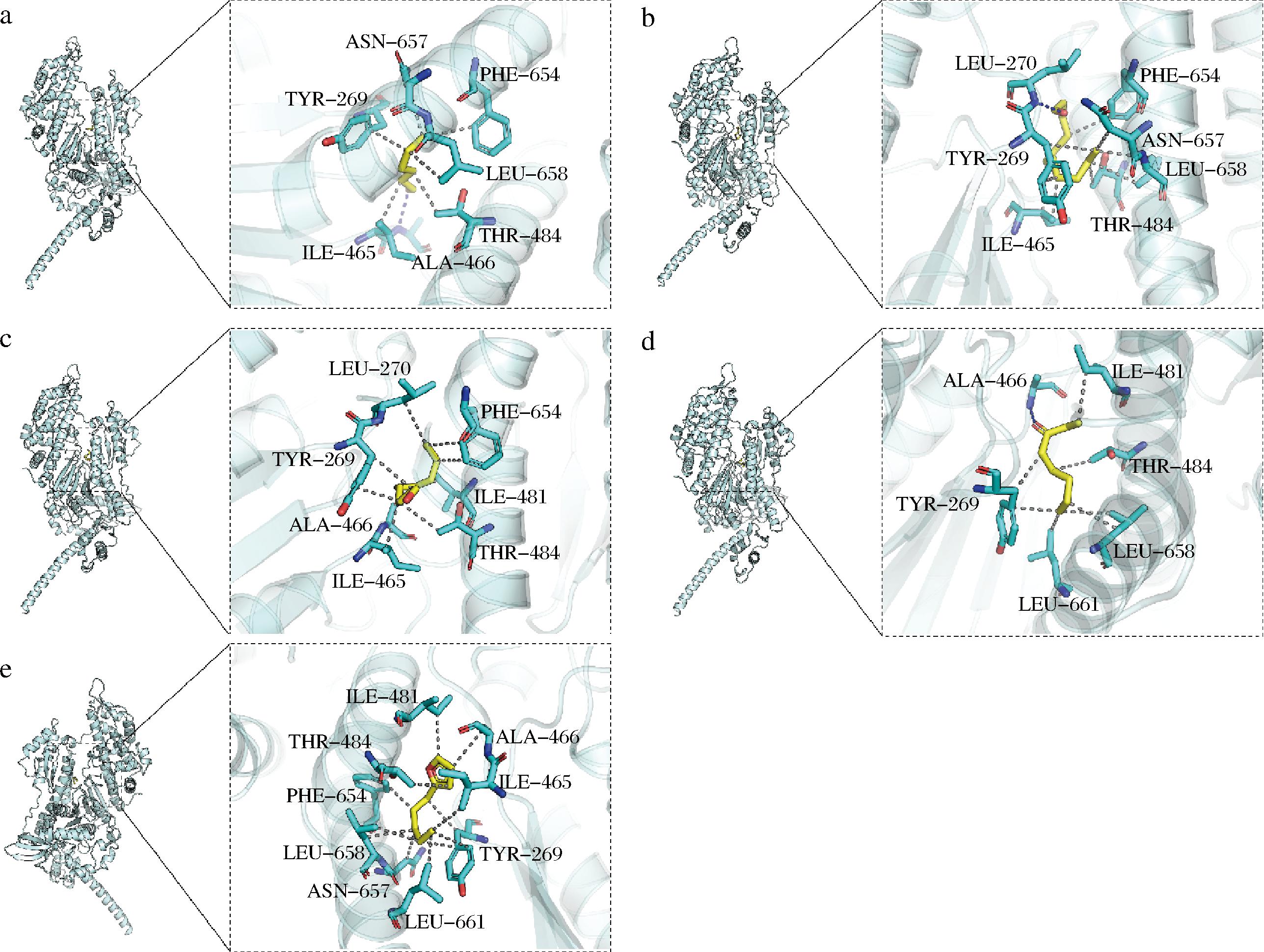
a-己醛;b-十一醛;c-(E,E)-2,4-癸二烯醛;d-1-辛烯-3-酮;e-2-戊基呋喃
图8 分子对接模拟结果
Fig.8 Molecular docking simulation results
注:图中黄色棍体为不同风味物质小分子,青色卡通为肌原纤维蛋白蛋白,蓝色线表示氢键作用力,灰色虚线表示疏水作用力。
在该复合物中,风味物质与肌原纤维蛋白的结合亲和力评分如表1所示,所有评分均小于0。研究表明,当结合亲和力为负值时,表明风味物质与肌原纤维蛋白之间存在结合的潜力,且数值越小,结合的可能性越大[32]。2-戊基呋喃(-6.017 kcal/mol)的结合能力最强,其次是十一醛(-5.849 kcal/mol)、(E,E)-2,4-癸二烯醛(-5.787 kcal/mol)和1-辛烯-3-醇,而己醛(-4.821 kcal/mol)结合最弱。虽然分子对接是一种基于静态模型的模拟方法,其计算结果受评分函数和力场的影响,但结果仍能提供一定参考。从结果可以看出,风味物质的官能团结构对其与蛋白质的结合能力具有重要影响。例如,含有共轭双键的(E,E)-2,4-癸二烯醛可能通过π-π堆积作用或氢键增强其与蛋白质的结合;而2-戊基呋喃的氧杂环结构则可能提供更强的极性或空间互补性,从而增强其结合能力[33]。此外,在相同官能团的基础上,碳链长度也会影响结合能力。例如,长链醛类(如十一醛)比短链醛类(如己醛)表现出更强的结合能力,可能是由于长链分子能够通过增强的疏水相互作用与蛋白质形成更紧密的结合,而短链醛类通常由于较小的分子尺寸和较弱的疏水性,表现出较低的结合能力[32]。
表1 肌原纤维蛋白与风味物质对接结合能
Table 1 Docking binding energies of myofibrillar proteins and flavor substances
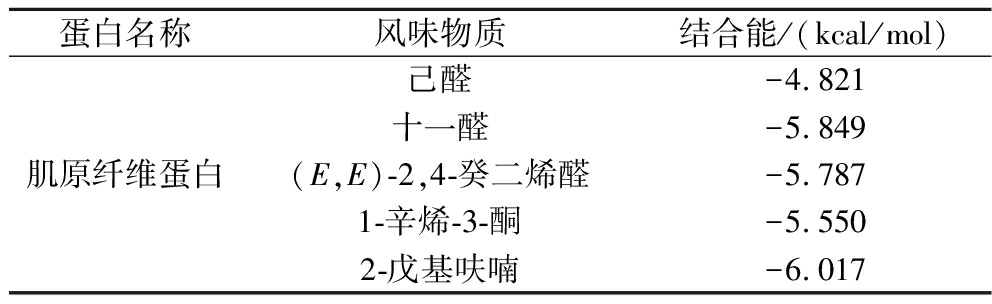
蛋白名称风味物质结合能/(kcal/mol)肌原纤维蛋白己醛-4.821十一醛-5.849(E,E)-2,4-癸二烯醛-5.7871-辛烯-3-酮-5.5502-戊基呋喃-6.017
3 结论
本研究通过分析MP粒径分布、溶解特性、分子间作用力及二级结构等关键指标,揭示了USW显著增强了MP分子间作用力(包括离子键、氢键、疏水作用及二硫键)的形成。同时促进蛋白质分子展开,增加巯基含量,进而改变其空间结构和理化性质。这些结构变化显著影响了MP与5种风味物质(己醛、十一醛、(E,E)-2,4-癸二烯醛、1-辛烯-3-酮和2-戊基呋喃)的结合能力,并通过分子对接模拟探究MP与风味物质结合机制。本文深入研究超声如何影响MP进而调控其与风味物质结合能力,并通过分子对接模拟进一步研究其结合机制。本研究结果为改善羊肉风味和优化肉类加工技术提供了新思路,有利于肉类工业的可持续发展。
[1] 施海娜, 张金霞, 卢曾奎, 等.萨湖羊、南湖羊与湖羊肉质特性比较研究[J].中国畜牧兽医, 2024, 51(12):5335-5347.SHI H N, ZHANG J X, LU Z K, et al.Comparative study on meat quality characteristics of Suffolk × hu and southdown × hu and hu sheep[J].China Animal Husbandry &Veterinary Medicine, 2024, 51(12):5335-5347.
[2] 高永芳. 基于不同交联模式调控低盐肌原纤维蛋白凝胶化机制研究[D].杨凌:西北农林科技大学,2024.GAO Y F.Study on the mechanism of regulating gelation of low-salt myofibrillar protein gelation based on different cross-linking patterns[D].Yangling:Northwest A&F University, 2024.
[3] WU Q R, ZANG M W, WANG S W, et al.Changes in flavors profiles of stewed bone-in lamb loin during cooking by DHS/GC-MS combined with electronic bionic systems[J].Food Bioscience, 2023, 53:102767.
[4] QIU Y, HU X Y, PANG Y T, et al.Identification of characteristic flavor compounds in steamed and baked Hu sheep mutton[J].Food Research International, 2025, 201:115599.
[5] XU L, XIA Q, CAO J X, et al.Ultrasonic effects on the headspace volatilome and protein isolate microstructure of duck liver, as well as their potential correlation mechanism[J].Ultrasonics Sonochemistry, 2021, 71:105358.
[6] 陈春梅. 超声波辅助炖煮羊肉汤的工艺优化及风味分析[D].扬州:扬州大学, 2021.CHEN C M.Optimization of the technology and flavor analysis of the stewied sheepmeat soup with ultrasonic-assisted[D].Yangzhou:Yangzhou University, 2021.
[7] SUN Q X, KONG B H, OUYANG Z, et al.Tracking protein aggregation behaviour and emulsifying properties induced by structural alterations in common carp (Cyprinus carpio) myofibrillar protein during long-term frozen storage[J].International Journal of Biological Macromolecules, 2024, 264:130171.
[8] XIE Y K, CHEN D, CAO J X, et al.Synergistic effects of high-intensity ultrasound combined with L-lysine for the treatment of porcine myofibrillar protein regarding solubility and flavour adsorption capacity[J].Foods, 2024, 13(4):629.
[9] ZHANG J, ZHANG Y Q, WANG Y, et al.Influences of ultrasonic-assisted frying on the flavor characteristics of fried meatballs[J].Innovative Food Science &Emerging Technologies, 2020, 62:102365.
[10] 赵冰, 张顺亮, 李素, 等.脂肪氧化对肌原纤维蛋白氧化及其结构和功能性质的影响[J].食品科学, 2018, 39(5):40-46.ZHAO B, ZHANG S L, LI S, et al.Effect of lipid oxidation on myofibrillar protein oxidation, structure and functional characteristics[J].Food Science, 2018, 39(5):40-46.
[11] JIANG J, XIONG Y L.Extreme pH treatments enhance the structure-reinforcement role of soy protein isolate and its emulsions in pork myofibrillar protein gels in the presence of microbial transglutaminase[J].Meat Science, 2013, 93(3):469-476.
[12] PAN J F, LIAN H L, JIA H, et al.Ultrasound treatment modified the functional mode of gallic acid on properties of fish myofibrillar protein[J].Food Chemistry, 2020, 320:126637.
[13] 薛紫曦, 王胜男, 杨慧, 等.大豆种皮多糖对蛋白乳液凝胶特性及微观结构的影响[J].食品科学技术学报, 2024, 42(4):164-172.XUE Z X, WANG S N, YANG H, et al.Effect of soybean hull polysaccharide on properties and microstructure of protein emulsion gel[J].Journal of Food Science and Technology, 2024, 42(4):164-172.
[14] 方婕, 罗毅皓, 孙万成.离子强度和加热对藏羊肉肌原纤维蛋白特性及结合风味能力的研究[J].食品与发酵工业, 2024, 50(24):221-228.FANG J, LUO Y H, SUN W C.Effects of ionic strength and heating on the characteristics and flavor binding ability of Tibetan mutton myofibrillar protein[J].Food and Fermentation Industries, 2024, 50(24):221-228.
[15] 刘士健. 壳聚糖与盐溶蛋白对风味化合物吸附能力及其凝胶特性研究[D].重庆:西南大学,2008.LIU S J.Effects of chitosan and salt-soluble meat protein on binding ability of volatile compounds and gel property[D].Chongqing:Southwest University, 2008.
[16] EBERHARDT J, SANTOS-MARTINS D, TILLACK A F, et al.AutoDock vina 1.2.0:New docking methods, expanded force field, and Python bindings[J].Journal of Chemical Information and Modeling, 2021, 61(8):3891-3898.
[17] LIU R, ZHANG Y, XU Y Z, et al.Molecular docking simulation reveals the lipase-substrate binding mechanism in the enzymatic synthesis of diacylglycerol-enriched vegetable oils[J].Food Chemistry, 2025, 474:143236.
[18] KANG Z L, SHANG X Y, LI Y P, et al.Effect of ultrasound-assisted sodium bicarbonate treatment on aggregation and conformation of reduced-salt pork myofibrillar protein[J].Molecules, 2022, 27(21):7493.
[19] YI J H, ZHU Z B, MCCLEMENTS D J, et al.Influence of aqueous phase emulsifiers on lipid oxidation in water-in-walnut oil emulsions[J].Journal of Agricultural and Food Chemistry, 2014, 62(9):2104-2111.
[20] CAO H W, SUN R L, SHI J R, et al.Effect of ultrasonic on the structure and quality characteristics of quinoa protein oxidation aggregates[J].Ultrasonics Sonochemistry, 2021, 77:105685.
[21] SALEEM R, HASNAIN A U, AHMAD R.Changes in some biochemical indices of stability of broiler chicken actomyosin at different levels of sodium bicarbonate in presence and absence of sodium chloride[J].International Journal of Food Properties, 2015, 18(6):1373-1384.
[22] WANG R X, LI Y Q, SUN G J, et al.The improvement and mechanism of gelation properties of mung bean protein treated by ultrasound[J].LWT, 2023, 182:114811.
[23] XUE H, TU Y G, ZHANG G W, et al.Mechanism of ultrasound and tea polyphenol assisted ultrasound modification of egg white protein gel[J].Ultrasonics Sonochemistry, 2021, 81:105857.
[24] 王进英, 冶梓芩, 马金鸽, 等.超声改性对菜籽分离蛋白和亚麻分离蛋白品质特性的影响[J].食品与发酵工业, 2025,51(19):199-206.WANG J Y, YE Z Q, MA J G, et al.Effects of ultrasound modification on quality properties of canola protein isolate and flaxseed protein isolate[J].Food and Fermentation Industries,2025,51(19):199-206.
[25] GOPIKAJAYAPRAKASH, CHAWLA P, SRIDHAR K, et al.Interactions of legume phenols-rice protein concentrate towards improving vegan food quality:Development of a protein-phenols enriched fruit smoothie[J].Food Research International, 2023, 171:113075.
[26] NI X X, CHEN C C, LI R X, et al.Effects of ultrasonic treatment on the structure and functional characteristics of myofibrillar proteins from black soldier fly[J].International Journal of Biological Macromolecules, 2024, 278:135057.
[27] 杨庭轩. 在不同烹饪熟度下多频超声处理对牛肉肌原纤维蛋白功能及结构特性影响研究[D].扬州:扬州大学,2024.YANG T X.The effect of multi-frequency ultrasonication treatment on the functional and structural properties of beef myofibrillar proteins with different degree of cooking doneness[D].Yangzhou:Yangzhou University, 2024.
[28] 高子武, 王恒鹏, 吴鹏, 等.肌原纤维蛋白对挥发性风味物质吸附作用研究进展[J].肉类研究, 2020, 34(9):105-112.GAO Z W, WANG H P, WU P, et al.Recent progress in research on the adsorption of myofibrillar proteins for volatile flavor compounds[J].Meat Research, 2020, 34(9):105-112.
[29] LUBRAN M B, LAWLESS H T, LAVIN E, et al.Identification of metallic-smelling 1-octen-3-one and 1-nonen-3-one from solutions of ferrous sulfate[J].Journal of Agricultural and Food Chemistry, 2005, 53(21):8325-8327.
[30] YIN X Y, GAO M K, WANG H T, et al.Probing the interaction between selected furan derivatives and porcine myofibrillar proteins by spectroscopic and molecular docking approaches[J].Food Chemistry, 2022, 397:133776.
[31] ZHAO J H, JIANG C Y, LEI M J, et al.Investigation the antioxidant mechanisms of Capsaicinoids on myofibrillar protein based on multispectral and molecular docking[J].Food Chemistry, 2025, 472:142992.
[32] WANG H T, ZHU J M, ZHANG H W, et al.Understanding interactions among aldehyde compounds and porcine myofibrillar proteins by spectroscopy and molecular dynamics simulations[J].Journal of Molecular Liquids, 2022, 349:118190.
[33] ZHANG B, PENG J, PAN L Q, et al.Exploration of molecular interaction between different plant proteins and 2-pentylfuran:Based on multiple spectroscopy and molecular docking[J].Journal of the Science of Food and Agriculture, 2023, 103(11):5332-5341.