骨质疏松症是一类常见的的代谢性骨病,主要的发病特征为骨微结构破坏和骨量减少[1-2]。该病与年龄增长、钙吸收下降、维生素D缺乏以及绝经后激素变化等多种因素有关[3]。在所有骨质疏松症类型中,原发性骨质疏松症是最常见的类型之一[4]。其中,在原发性骨质疏松症里,绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)又是较为常见且严重的类型[5]。骨质疏松症严重影响了中老年人,尤其是绝经后女性的生活质量[6]。因此,防治骨质疏松症,特别是PMOP,已成为公共卫生领域的重点关注问题[7]。
膳食钙摄入不足是我国中老年人群的普遍问题[8]。而维生素D和维生素K2在促进钙的吸收和利用方面发挥着积极的作用,它们能够帮助钙在骨骼中沉积,从而提升骨密度(bone mineral density,BMD)。因此,提高钙的摄入量及其生物利用率可有效促进中老年人群的骨骼健康。骨碎补作为一种传统的中药材,在治疗骨质疏松症方面具有非常独特的应用价值。前期研究已表明,添加骨碎补的功能性奶粉对生长期大鼠骨骼发育具有积极作用,然而其对去卵巢大鼠骨骼健康的影响尚未完全明确。
在前期生长期大鼠的研究基础之上,参考《保健食品功能检验与评价方法(2023年版)》第二部分功能学检验方法中第十条有助于提升骨密度检验方法的方案二,旨在进一步探讨在奶粉中添加骨碎补及钙+维生素D+维生素K2对去卵巢大鼠骨骼健康产生的影响以及潜在作用机制,为骨碎补在功能性奶粉中的应用提供坚实的科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 受试物
受试奶粉由内蒙古伊利实业集团股份有限公司提供,每100 g该奶粉中含钙360~840 mg,维生素D 16~24 μg,维生素K2 80~120 μg,骨碎补提取物0.8~1.2 g(其中柚皮苷含量9.6~14.4 mg)。
1.1.2 实验动物
本研究共选用30只由北京维通利华实验动物技术有限公司[许可证号为SCXK(京)2021-0011]提供的3月龄大小的SPF级雌性SD大鼠,体重均约300 g。大鼠均饲养在四川大学华西公共卫生学院,许可证号为SYXK(川)2023-0011的SPF级动物房。饲养环境情况如下:明暗以12 h为1个交替周期;室内温湿度分别控制在20~26 ℃、40%~70%;不限制大鼠饮水和摄食。本研究使用的AIN-93M饲料及在此基础上改良的低钙纯化饲料,均由江苏美迪森生物医药有限公司提供。AIN-93M饲料参照美国营养学会AIN-93M饲料配方[9]并用玉米油替换了大豆油。本研究严格遵循四川大学华西第四医院/华西公共卫生学院伦理委员会所制定的伦理学相关标准,且本研究已获得该伦理委员会的批准认可,批件号为:Gwll2023002。
1.1.3 实验动物分组及处理
30只大鼠先进行1周的适应性喂养,之后按照体重随机分为去卵巢(ovariectomized,OVX)对照组、OVX+奶粉组和假手术组,每组10只。奶粉组的干预剂量设定为人体推荐量的5倍,经换算为4.167 g/kg bw。分组完成后,切除OVX+奶粉组和OVX对照组大鼠的双侧卵巢;假手术组大鼠则只按照相同操作切除卵巢周围的脂肪组织,大小与卵巢相似。术后1周,OVX+奶粉组经口灌胃受试奶粉、假手术组和OVX对照组则只给予去离子水,灌胃量均按照每100 g体重对应1 mL的标准执行,连续灌胃90 d。
1.1.4 实验试剂
抗酒石酸碱性磷酸酶(tartrate-resistant alkaline phosphatase,TRAP)染色试剂盒,武汉塞维尔生物科技有限公司;质量分数4%的多聚甲醛溶液,Biosharp公司;反转录试剂盒,美国Vazyme公司。
1.2 仪器与设备
Agilent 5100电感耦合等离子体发射光谱仪,美国Agilent公司;Discovery QDR双能X射线骨密度仪,美国Hologic公司;SkyScan1276 Micro-CT仪,德国Bruker公司;RT-6100全自动酶标仪,美国杜雷公司;ContrAA700原子吸收分光光度仪,德国耶拿分析仪器有限公司;Pannoramic250数字切片扫描仪,匈牙利3DHISTECH公司;T-100PCR扩增仪、CFX96实时荧光定量PCR仪,美国BioRad公司。
1.3 实验方法
1.3.1 体重和一般情况
灌胃期间,每7 d测量1次大鼠体重并记录实验开始时大鼠的初始体重以及实验结束时的空腹体重,每天对大鼠皮肤毛色等一般状况进行观察。
1.3.2 骨密度和骨钙测定
利用双能X射线骨密度仪对大鼠右侧股骨中点与远心端的骨密度进行测量。再运用原子吸收技术测定经湿法消化处理后的股骨骨钙含量。
1.3.3 钙代谢实验
在处死大鼠前,从3个组中共选取24只大鼠进行3 d钙代谢实验,每组随机选取8只。24只大鼠进行单独饲养,记录每只大鼠3 d内饲料的消耗量,并计算饲料消耗量的平均值。同时,收集每只大鼠3 d内的尿液和粪便排出量,并分别计算两者排出量的均值。利用原子吸收法测定粪便、尿液和饲料中的钙含量,钙储留率和钙表观吸收率的计算如公式(1)和公式(2)所示:
钙储留率![]()
(1)
钙表观吸收率![]()
(2)
1.3.4 Micro-CT检测
大鼠处死后,迅速取下其左侧股骨和第4腰椎,并将骨骼表面附着的肌肉及软组织剔除干净,然后用质量分数为4%的多聚甲醛溶液进行固定,并放置在4 ℃冰箱保存。2 d后,从3组中随机选取15只大鼠,每组5只,进行Micro-CT扫描,扫描其股骨远端和L4腰椎并进行三维重建,参数除了BMD外,还包括骨表面积组织体积比(bone surface area to tissue volume,BS/TV)、骨表面积骨体积比(bone surface area to bone volume,BS/BV)、骨小梁模型因子(trabecular bone pattern factor,Tb.Pf)、骨体积分数(bone volume fraction,BV/TV)、结构模型指数(structural model index,SMI)、骨小梁分离度(trabecular bone separation degree,Tb.Sp)、骨小梁厚度(trabeculae thickness,Tb.Th)和骨小梁数目(trabeculae number,Tb.N)。
1.3.5 骨代谢关键蛋白免疫组化分析
每组取5个腰椎切片进行免疫组化分析。对血管内皮生长因子(vascular endothelial growth factor,VEGF)、核因子-κB受体活化因子配体(receptor activator of nuclear factor-κ B ligand,RANKL)以及血管内皮标志物CD31的蛋白表达进行检测。在添加常规和骨组织抗原修复液进行抗原修复之前,先将骨组织的石蜡切片进行脱蜡和水化操作。使用牛血清白蛋白BSA封闭液进行血清封闭。将按一定比例配制好的一抗[VEGF,1∶100;RANKL,1∶100;CD31,1∶1 000]滴加在切片上,4 ℃孵育过夜。经过PBS漂洗后,滴加辣根过氧化物酶标记的二抗(1∶100)在室温下孵育。随后进行显色、苏木精复染,再经过常规脱水、二甲苯透明处理,最后封片,通过显微镜镜检并进行图像采集分析。
1.3.6 骨健康关键通路基因表达水平检测
参考文献[10]的方法,取已经将肌肉和软组织剔除干净的大鼠右侧胫骨,每组3个样本。先经过液氮速冻,随后存放在-80 ℃冰箱。通过逆转录合成cDNA模板,进行实时荧光定量PCR检测,以β-actin为内参,计算胫骨中的Wnt3a、β-catenin、RUNX2、LEF-1的mRNA相对表达量。引物序列见表1。
表1 引物序列
Table 1 Primer sequences

引物名称引物序列Wnt3aF:GAGTCTCGTGGCTGGGTGGAR:GGGCTCGCAGAAGTTAGGβ-cateninF:GGAAAGCAAGCTCATCATTCTR:AGTGCCTGCATCCCACCARUNX2F:GGAACCAAGAAGGCACAGACAGR:TGTCTGCCTGGGATCTGTAATCTLEF-1F:GGCATGAGGTGGTCAGACAAAR:CTCGGGATGGGTGGAGAAAGβ-actinF:TGCTATGTTGCCCTAGACTTCGR:GTTGGCATAGAGGTCTTTACGG
1.4 数据处理
运用R软件和GraphPad Prism 8.0.1进行统计分析,结果以“平均数±标准差”表示。若数据服从正态分布且方差齐,则先后运用单因素方差(One-way ANOVA)分析和LSD检验进行整体比较和两两比较;方差不齐的数据用Tamhane的多重比较方法进行分析。
2 结果分析
2.1 大鼠体重及一般情况
灌胃期间,所有大鼠一般状态良好。相较于OVX对照组大鼠,OVX+奶粉组大鼠更活泼好动。各组大鼠体重在灌胃期间均稳定增长,见图1。其中,假手术组大鼠体重变化相对较小,而OVX+奶粉组大鼠体重增长幅度最大。从灌胃第7天起,与假手术组相比,OVX+奶粉组与OVX对照组大鼠的体重均出现显著的增高(P<0.01),但与OVX对照组相比,OVX+奶粉组大鼠的体重增加无显著差异。
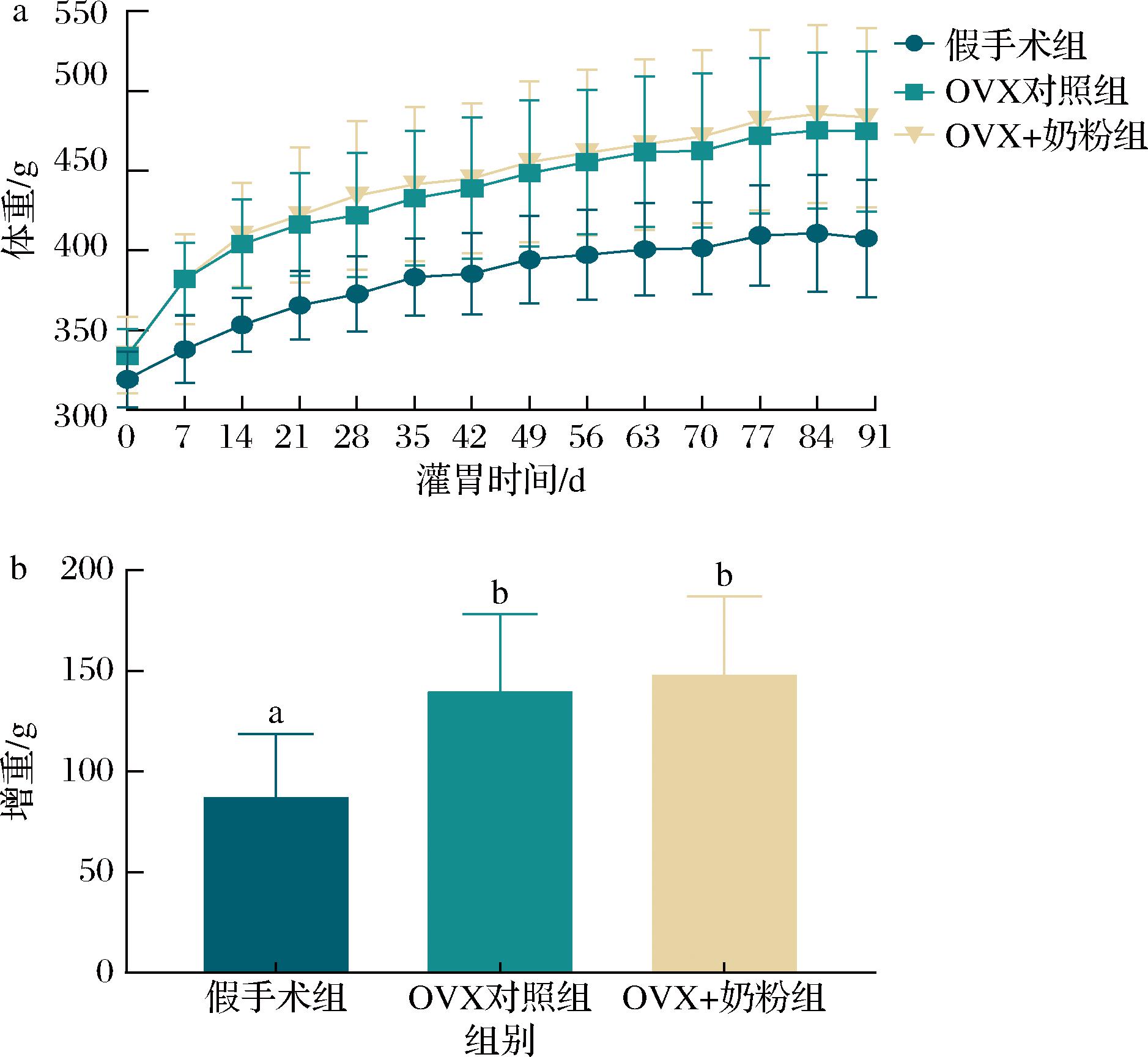
a-各组大鼠体重增长曲线;b-各组大鼠的增重情况
图1 各组大鼠体重增长结果(n=10)
Fig.1 Weight gain results of rats in each group (n=10)
注:不同字母表示组间差异有统计学意义(P<0.05)(下同)。
2.2 骨密度和骨钙
图2展示了不同干预模式下大鼠股骨矿物质代谢指标的变化情况。假手术组的股骨远心端骨密度显著高于OVX+奶粉组和OVX对照组(P<0.01),OVX+奶粉组与OVX对照组的股骨远心端和中点骨密度存在显著差异(P<0.05);假手术组和OVX+奶粉组的骨钙含量显著高于OVX对照组(P<0.01)。这表明该配方奶粉能有效改善OVX大鼠的骨质流失状况,对维持骨组织结构完整性具有积极作用。
a-股骨远心端骨密度;b-股骨中点骨密度;c-骨钙含量
图2 各组大鼠股骨骨密度与骨钙含量(n=10)
Fig.2 Femoral bone mineral density and bone calcium content in each group (n=10)
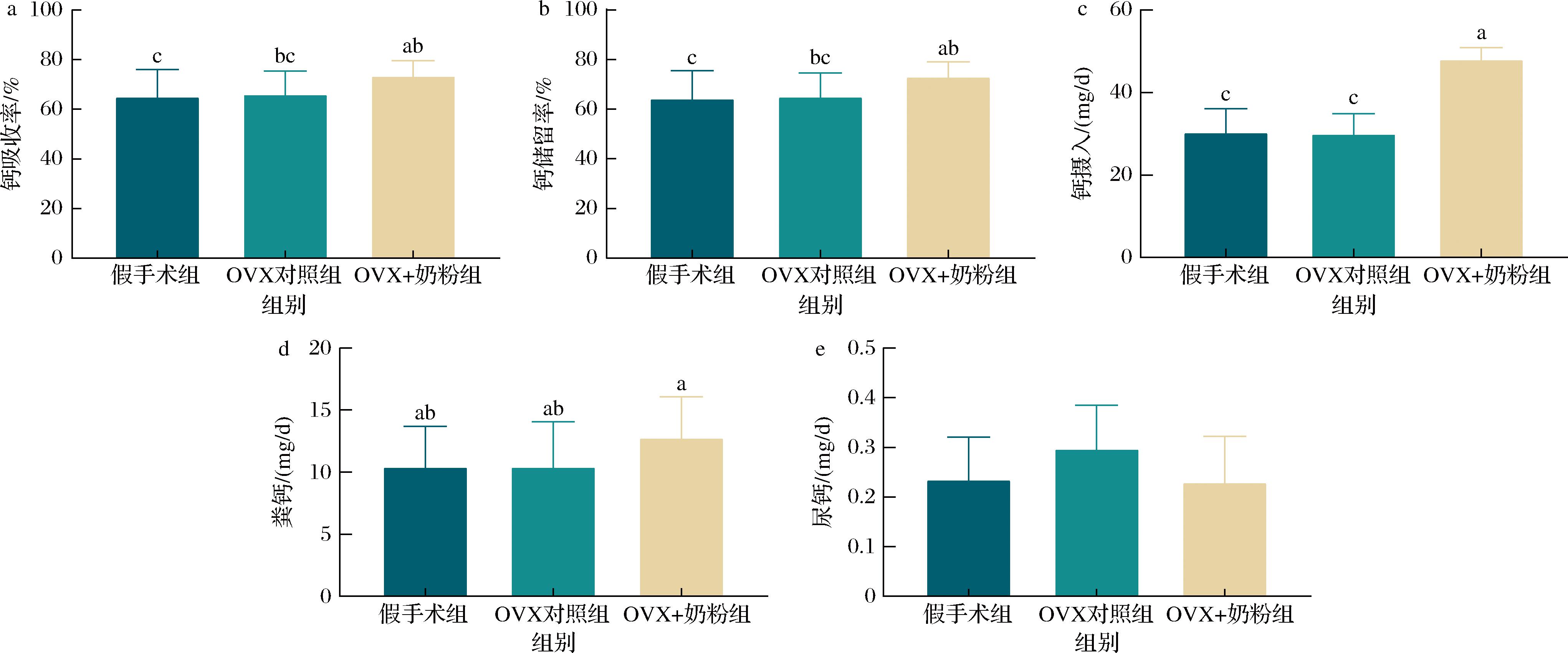
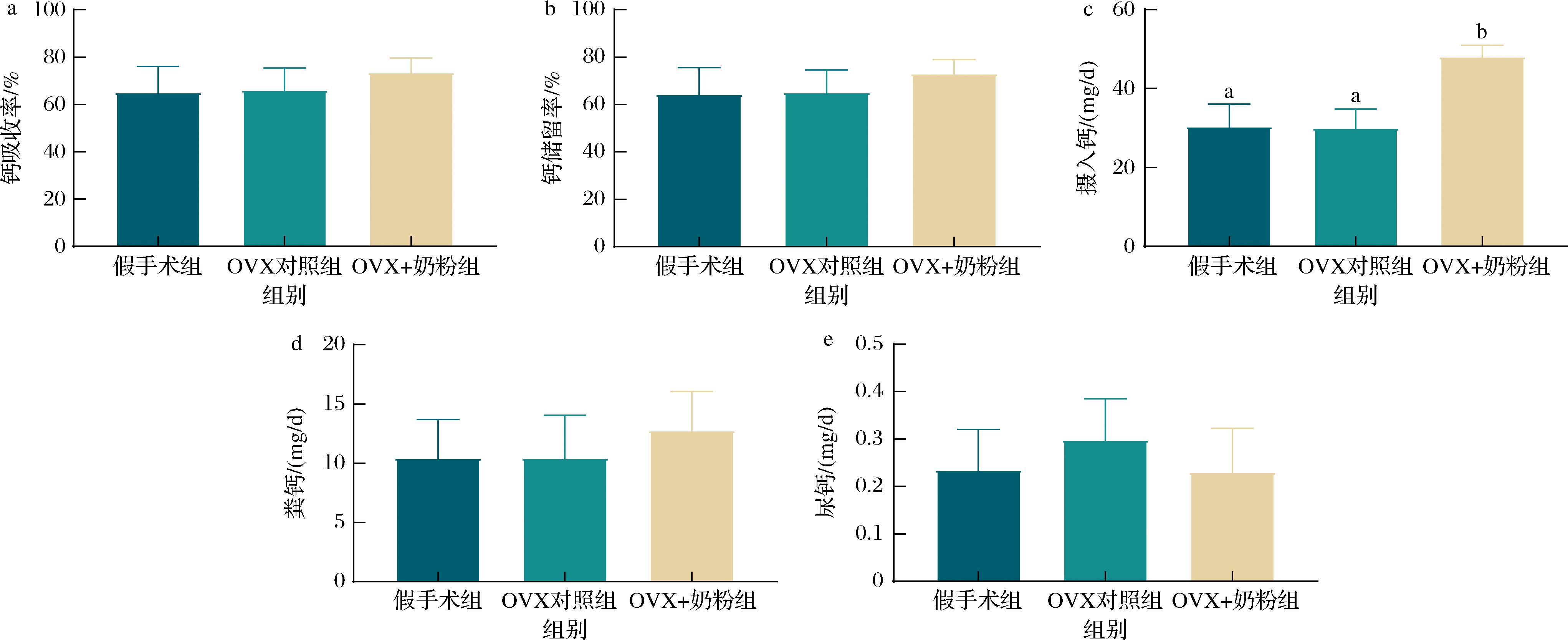
a-大鼠钙吸收率;b-钙储留率;c-摄入钙;d-粪钙;e-尿钙
图3 各组大鼠钙代谢结果(n=8)
Fig.3 Calcium metabolism results of rats in each group (n=8)
2.3 钙代谢实验
图3揭示了大鼠钙代谢参数的干预效应特征。OVX+奶粉组的日均摄入钙较假手术组和OVX对照组均有显著升高(P<0.01);OVX+奶粉组的钙吸收率、钙储留率和粪钙水平较OVX对照组有所升高,但差异并不显著。各组大鼠的尿钙排泄量均维持在0.2~0.3 mg/d之间,差异无统计学意义。
2.4 Micro-CT检测
各组大鼠Micro-CT结果如表2和图4所示。
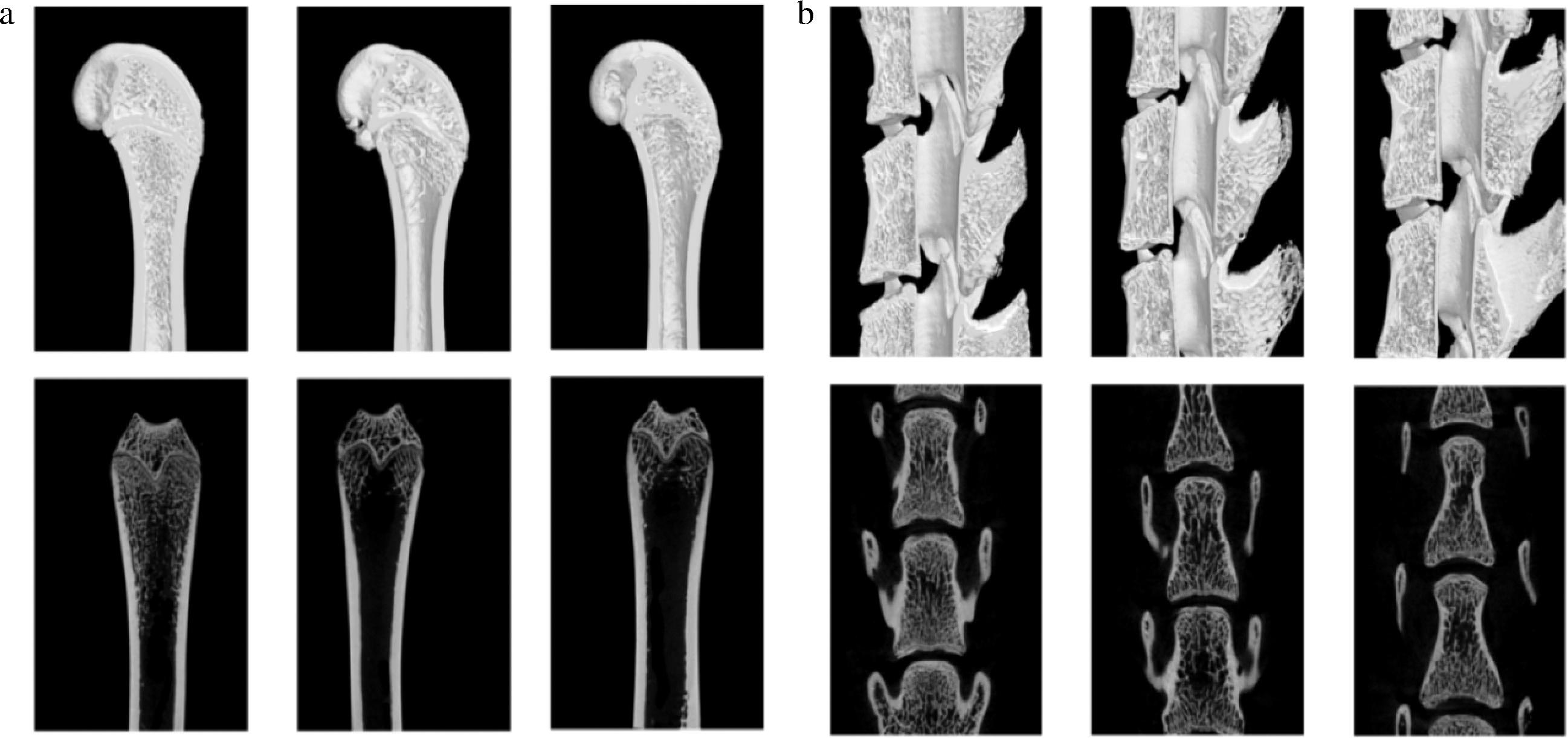
a-股骨;b-腰椎
图4 各组大鼠Micro-CT典型示意图
Fig.4 Typical schematic diagram of Micro-CT in each group of rats
注:第一行为股骨矢状位3D重建图,第二行为股骨纵切面扫描图。
表2 各组大鼠Micro-CT结果(n=5)
Table 2 Micro-CT results of rats in each group (n=5)
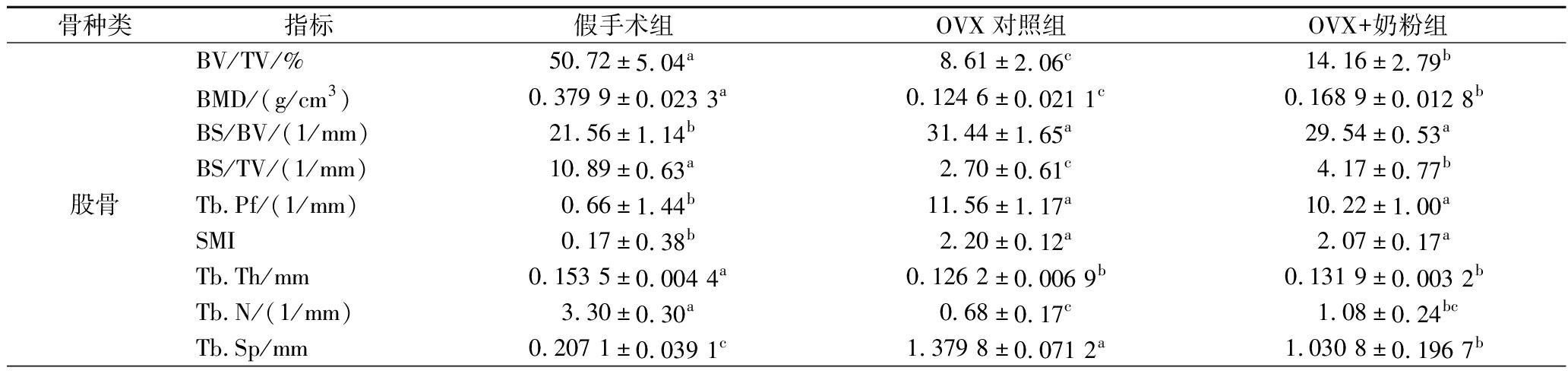
骨种类指标假手术组OVX对照组OVX+奶粉组股骨BV/TV/%50.72±5.04a8.61±2.06c14.16±2.79bBMD/(g/cm3)0.379 9±0.023 3a0.124 6±0.021 1c0.168 9±0.012 8bBS/BV/(1/mm)21.56±1.14b31.44±1.65a29.54±0.53aBS/TV/(1/mm)10.89±0.63a2.70±0.61c4.17±0.77bTb.Pf/(1/mm)0.66±1.44b11.56±1.17a10.22±1.00aSMI0.17±0.38b2.20±0.12a2.07±0.17aTb.Th/mm0.153 5±0.004 4a0.126 2±0.006 9b0.131 9±0.003 2bTb.N/(1/mm)3.30±0.30a0.68±0.17c1.08±0.24bcTb.Sp/mm0.207 1±0.039 1c1.379 8±0.071 2a1.030 8±0.196 7b
续表2
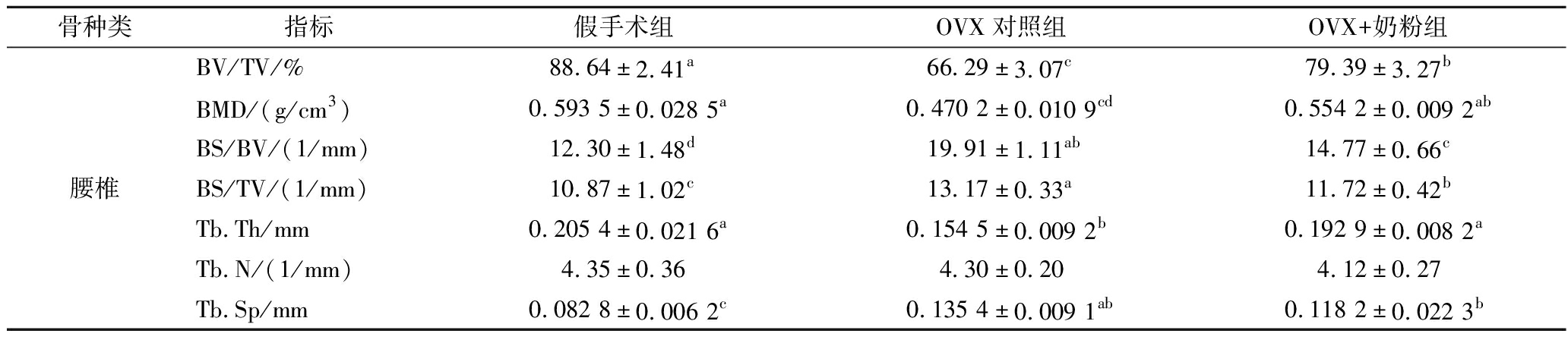
骨种类指标假手术组OVX对照组OVX+奶粉组腰椎BV/TV/%88.64±2.41a66.29±3.07c79.39±3.27bBMD/(g/cm3)0.593 5±0.028 5a0.470 2±0.010 9cd0.554 2±0.009 2abBS/BV/(1/mm)12.30±1.48d19.91±1.11ab14.77±0.66cBS/TV/(1/mm)10.87±1.02c13.17±0.33a11.72±0.42bTb.Th/mm0.205 4±0.021 6a0.154 5±0.009 2b0.192 9±0.008 2aTb.N/(1/mm)4.35±0.364.30±0.204.12±0.27Tb.Sp/mm0.082 8±0.006 2c0.135 4±0.009 1ab0.118 2±0.022 3b
注:不同字母表示组间差异有统计学意义(P<0.05)。
2.4.1 股骨Micro-CT
与假手术组相比,OVX+奶粉组和OVX对照组的BV/TV、BMD、BS/TV、Tb.Th和Tb.N均呈现明显下降趋势(P<0.01),而BS/BV、Tb.Pf、Tb.Sp和SMI均显著升高(P<0.01)。与OVX对照组相比,OVX+奶粉组的BV/TV、BMD和BS/TV显著升高(P<0.05),而Tb.Sp显著降低(P<0.05)。此外,假手术组的骨小梁数量较多且排列致密,OVX对照组的骨小梁数量明显减少,相比OVX对照组OVX+奶粉组的骨小梁数量有所增加。
2.4.2 腰椎Micro-CT
与假手术组相比,OVX对照组的BMD、Tb.Th显著下降(P<0.01);与OVX对照组相比,OVX+奶粉组的BS/TV和BS/BV也显著降低(P<0.01),而BV/TV、BMD和Tb.Th显著升高(P<0.01);与假手术组相比,OVX对照组的BS/BV、BS/TV和Tb.Sp值均显著升高(P<0.05),而BV/TV值均显著降低(P<0.05)。假手术组的骨小梁明显更加致密,而OVX+奶粉组和OVX对照组的骨小梁分布呈现不同程度的稀疏,不过OVX+奶粉组的骨小梁分离情况相较于OVX对照组有所改善。该结果表明,奶粉有助于改善去卵巢手术引起的骨量流失,增加骨小梁厚度,减少骨小梁分离度。
2.5 骨代谢关键蛋白免疫组化结果
各组大鼠腰椎VEGF、RANKL和CD31蛋白表达结果如表3和图5所示。

a-假手术组VEGF蛋白表达;b-OVX对照组VEGF蛋白表达;c-OVX+奶粉组VEGF蛋白表达;d-假手术组RANKL蛋白表达;e-OVX对照组RANKL蛋白表达;f-OVX+奶粉组RANKL蛋白表达;g-假手术组CD31蛋白表达;h-OVX对照组CD31蛋白表达;i-OVX+奶粉组CD31蛋白表达
图5 各组大鼠腰椎免疫组化蛋白表达典型示意图(40×)
Fig.5 Typical schematic diagram of lumbar immunohistochemical protein expression of rats in each group (40×)
注:苏木素染细胞核为蓝色,VEGF、RANKL和CD31显出的阳性表达为棕黄色(绿色箭头)。
表3 各组大鼠腰椎免疫组化蛋白表达结果(n=5)
Table 3 Results of immunohistochemical protein expressions in the lumbar spine of rats in each group (n=5)
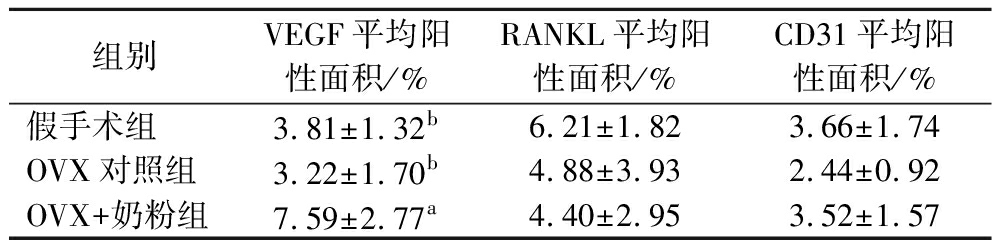
组别VEGF平均阳性面积/%RANKL平均阳性面积/%CD31平均阳性面积/%假手术组3.81±1.32b6.21±1.823.66±1.74OVX对照组3.22±1.70b4.88±3.932.44±0.92OVX+奶粉组7.59±2.77a4.40±2.953.52±1.57
注:不同字母表示组间差异有统计学意义(P<0.01)。
假手术组、OVX对照组和OVX+奶粉组的VEGF平均阳性面积分别为(3.81±1.32)%、(3.22±1.70)%和(7.59±2.77)%;RANKL平均阳性面积分别为(6.21±1.82)%、(4.88±3.93)%和(4.40±2.95)%;CD31平均阳性面积分别为(3.66±1.74)%、(2.44±0.92)%和(3.52±1.57)%。与OVX对照组相比,OVX+奶粉组的VEGF蛋白表达水平显著升高(P<0.01),而RANKL蛋白的表达水平虽有下降趋势,但差异无统计学意义。
2.6 骨健康关键通路基因表达水平检测结果
图6为各组大鼠各目的基因表达水平检测结果。与OVX对照组相比,OVX+奶粉组大鼠胫骨β-catenin、RUNX2和LEF-1的表达水平均显著升高(P<0.05或0.01),但Wnt3a的表达水平虽较OVX对照组有所升高,但差异无统计学意义。
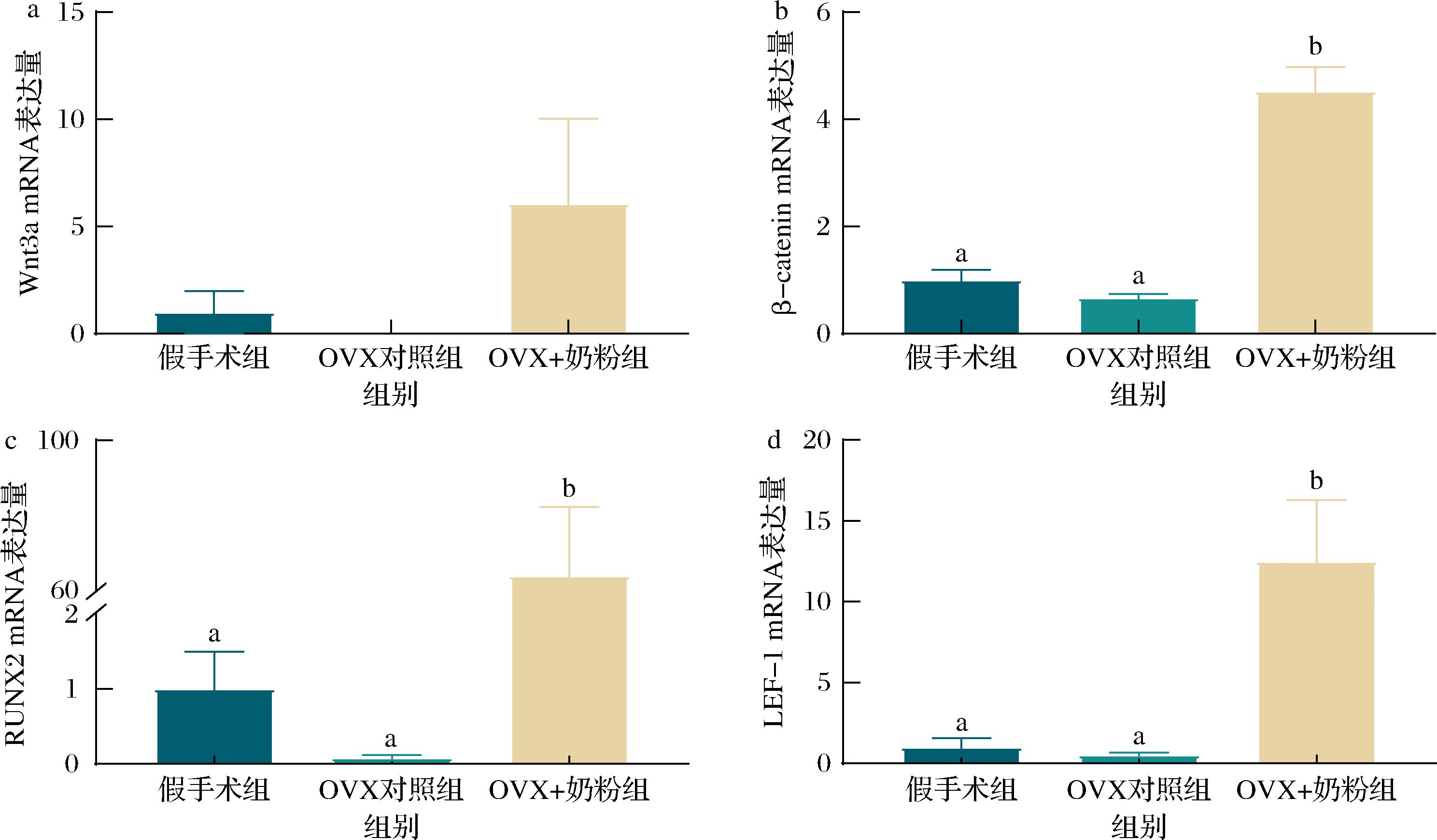
a-Wnt3a mRNA表达量;b-β-catenin mRNA表达量;c-RUNX2 mRNA表达量;d-LEF-1 mRNA表达量
图6 各目的基因的表达水平(n=3)
Fig.6 Expression levels of each target gene (n=3)
3 讨论
本研究在前期对生长期大鼠的研究基础上,进一步探讨了功能性奶粉对中老年去卵巢大鼠骨骼健康的影响。研究显示,功能性奶粉可显著改善去卵巢大鼠的骨密度、骨钙含量及骨微结构。这些研究结果表明,含骨碎补提取物的奶粉有益于中老年人群的骨骼健康,为骨碎补在功能性奶粉领域的应用提供了有力的实验支撑。
骨钙含量是反映骨骼矿物质储备状况的关键指标,可用于评估骨骼健康状态;骨密度则体现了骨骼的坚硬程度,不仅是诊断骨质疏松症的主要参数,也是衡量干预措施对骨健康改善效果的重要指标[11]。中老年人常由于钙摄入不足,导致骨钙流失,骨密度降低[12],因此也更易发生骨质疏松症[13]。摄入足够的钙有助于维持骨密度,对降低骨质疏松症的发生几率有积极的作用[14]。在本研究中,OVX对照组的远心端和中点骨密度及骨钙含量均显著低于OVX+奶粉组,这充分说明该奶粉能够有效提升去卵巢大鼠的骨密度和骨钙含量。这与CHEN等[15-17]研究结果一致。钙代谢结果显示,与OVX对照组相比,OVX+奶粉组的钙吸收率和储留率均呈现出不同程度地提高,表明该奶粉对于去卵巢大鼠对钙的吸收和利用有一定的促进功效。因其可精准、全方位、立体地测量骨微结构,Micro-CT当下已经被广泛应用于评价骨微结构[18]。在本研究中,OVX对照组大鼠的股骨和腰椎BV/TV、BMD、Tb.Th以及股骨Tb.N均显著低于假手术组,而股骨和腰椎BS/BV、Tb.Sp以及股骨Tb.Pf、SMI等指标均显著高于假手术组,结合典型示意图可知,摘除卵巢对股骨和腰椎的骨微结构有明显破坏作用,这与RIGGS等[19]研究结果一致。对比OVX对照组和OVX+奶粉组,发现后者的股骨和腰椎BV/TV、BMD以及腰椎Tb.Th等指标上显著升高,结合典型示意图可知,奶粉可显著改善去卵巢导致的股骨和腰椎的骨微结构受损。
RANKL是诱使破骨细胞分化的关键因子,能促进破骨细胞的分化、成熟进而增强骨吸收。研究表明,血浆钙浓度下降,甲状旁腺素分泌增加,可刺激成骨细胞中RANKL的释放;反之,当血浆钙浓度升高,则可抑制RANKL的释放[20]。VEGF是调节血管生成的重要生长因子,在骨再生中发挥重要作用[21]。本研究结果表明,与OVX对照组相比,OVX+奶粉组RANKL蛋白表达水平有下降趋势,但无统计学差异,OVX+奶粉组VEGF蛋白表达量显著升高,提示奶粉可能通过调节VEGF的表达,对去卵巢引起的骨质疏松发挥一定的改善作用。
大量研究表明,骨碎补能推动成骨细胞分化,从而改善雌激素缺乏引起的骨质流失[22-23],这依赖于骨碎补能激活Wnt/β-catenin这条关键信号通路。Wnt/β-catenin信号通路可通过直接调节成骨细胞活性和间接作用于破骨细胞活性来维持骨量平衡[24]。Wnt3a是主要的Wnt配体之一,在体内可激活β-catenin,积累的β-catenin转移到细胞核中后与T细胞因子4或LEF-1结合,进一步激活下游靶基因,例如RUNX2的转录[25-26]。有研究指出,缺乏雌激素会导致成骨细胞中Wnt/β-catenin信号通路的表达降低[27]。张莉丽等[23]的研究显示,与假手术组相比,OVX大鼠的Wnt3a、β-catenin和RUNX2 的mRNA表达均显著降低,但OVX+雌激素组的表达水平均较OVX大鼠有显著升高。而本研究结果显示,与OVX对照组相比,OVX+奶粉组大鼠的Wnt3a的mRNA表达虽较OVX对照组有所上升,但差异无统计学意义;但β-catenin、RUNX2和LEF-1 mRNA表达均较OVX对照组有显著升高。表明该奶粉可能通过调控Wnt/β-catenin信号通路而发挥促进骨健康的作用。
在本研究中,各组RANKL蛋白与Wnt3a基因的表达水平并未呈现出统计学差异,这可能与剂量和干预时长有关,也可能受到大鼠个体差异、饲养条件及样本量等因素的影响。未来,我们将进一步通过增加样本量、优化实验设计和改进检测方法等方式,进一步探究该功能性奶粉与骨质疏松之间的关系,以更准确地评估奶粉对骨质疏松的潜在干预效果。同时,也会综合考虑其他骨代谢相关指标,全面评价奶粉对去卵巢大鼠骨健康的影响。
综上所述,该功能性奶粉对中老年去卵巢大鼠骨骼健康有积极作用,包括促进大鼠对钙的吸收利用,增加骨密度和骨钙含量,改善去卵巢导致的骨微结构破坏,其机制可能与Wnt/β-catenin信号通路有关。该功能性奶粉的应用可为中老年女性骨质疏松症的预防和治疗提供新的营养干预策略。
[1] 赵一凡, 苏巧, 解亮.H型血管在骨—血管偶联稳态维持作用的研究现状[J].中国矫形外科杂志, 2024, 32(22):2072-2076.ZHAO Y F, SU Q, XIE L.Research progress on type H vessels in coupling angiogenesis and osteogenesis in bone homeostasis and diseases[J].Orthopedic Journal of China, 2024, 32(22):2072-2076.
[2] COMPSTON J E, MCCLUNG M R, LESLIE W D.Osteoporosis[J].The Lancet, 2019, 393(10169):364-376.
[3] 廖源, 黄夏荣, 周彤, 等.针刺治疗骨质疏松症的临床与机制研究进展[J].中医康复, 2024, 15(12):18-23.LIAO Y, HUANG X R, ZHOU T, et al.Research progress on clinical application and mechanisms of acupuncture therapy in osteoporosis[J].Traditional Chinese Medicine Rehabilitation, 2024, 15(12):18-23.
[4] 向积伟, 周兴茂, 简绍锋, 等.由微循环运用中医药防治骨质疏松症的研究进展[J].中国骨质疏松杂志, 2024, 30(11):1693-1698.XIANG J W, ZHOU X M, JIAN S F, et al.Research progress on the application of traditional Chinese medicine in the prevention and treatment of osteoporosis based on microcirculation[J].Chinese Journal of Osteoporosis, 2024, 30(11):1693-1698.
[5] 中华医学会骨质疏松和骨矿盐疾病分会. 原发性骨质疏松症诊疗指南(2022)[J].中华骨质疏松和骨矿盐疾病杂志, 2022, 15(6):573-611.Chinese Medical Association Osteoporosis and Bone Mineral Salt Diseases Branch.Guidelines for the diagnosis and treatment of primary osteoporosis(2022)[J].Chinese Journal of Osteoporosis and Bone Mineral Research, 2022, 15(6):573-611.
[6] 王文驰, 夏天, 武瑞骐, 等.女贞子活性成分防治骨质疏松症的分子机制[J].中国组织工程研究, 2025, 29(18):3856-3867.WANG W C, XIA T, WU R Q, et al.Molecular mechanism of active ingredients of Ligustri Lucidi Fructus against osteoporosis[J].Chinese Journal of Tissue Engineering Research, 2025, 29(18):3856-3867.
[7] 黄志强, 马梓宸, 席琛, 等.中医药治疗绝经后骨质疏松症临床疗效研究[J].中国骨质疏松杂志, 2024, 30(11):1653-1660;1672.HUANG Z Q, MA Z C, XI C, et al.Research progress in the clinical efficacy of traditional Chinese medicine on the treatment of postmenopausal osteoporosis[J].Chinese Journal of Osteoporosis, 2024, 30(11):1653-1660;1672.
[8] SANTIAGO-ORTIZ J L, SCHAFFER D V.Adeno-associated virus (AAV) vectors in cancer gene therapy[J].Journal of Controlled Release, 2016, 240:287-301.
[9] REEVES P G, NIELSEN F H, FAHEY G C.AIN-93 purified diets for laboratory rodents:Final report of the American institute of nutrition ad hoc writing committee on the reformulation of the AIN-76A rodent diet[J].The Journal of Nutrition, 1993, 123(11):1939-1951.
[10] CHEN C J, HUANG L D, CHEN Y Y, et al.Hydrolyzed egg yolk peptide prevented osteoporosis by regulating Wnt/β-catenin signaling pathway in ovariectomized rats[J].Scientific Reports, 2024, 14:10227.
[11] FONSECA H, MOREIRA-GONÇALVES D, CORIOLANO H A, et al.Bone quality:The determinants of bone strength and fragility[J].Sports Medicine, 2014, 44(1):37-53.
[12] 刘娟. 老年骨质疏松症的防治[J].人人健康, 2024(4):66.LIU J.Prevention and treatment of osteoporosis in the elderly[J].Health for Everyone, 2024(4):66.
[13] 吴建新, 谢文涛.阿法骨化醇软胶囊联合注射用唑来膦酸治疗老年骨质疏松性骨折术后患者的效果[J].临床合理用药, 2024, 17(33):128-131.WU J X, XIE W T.Effect of alfacalcidol soft capsule combined with zoledronic acid for injection on elderly patients with osteoporotic fracture after operation[J].Chinese Journal of Clinical Rational Drug Use, 2024, 17(33):128-131.
[14] 徐蕊, 石燕楠, 周喆, 等.类风湿关节炎患者发生骨质疏松的危险因素分析及风险预测模型建立[J].南通大学学报(医学版), 2024, 44(2):140-144.XU R, SHI Y N, ZHOU Z, et al.Analysis of risk factors and establishment of a risk prediction model for osteoporosis in rheumatoid arthritis patients[J].Journal of Nantong University (Medical Sciences), 2024, 44(2):140-144.
[15] CHEN Y J, XIAO Y M, XIE B, et al.Effect of milk powder supplementation with different calcium contents on bone mineral density of postmenopausal women in northern China:A randomized controlled double-blind trial[J].Calcified Tissue International, 2016, 98(1):60-66.
[16] REYES-GARCIA R, MENDOZA N, PALACIOS S, et al.Effects of daily intake of calcium and vitamin D-enriched milk in healthy postmenopausal women:A randomized, controlled, double-blind nutritional study[J].Journal of Women’s Health, 2018, 27(5):561-568.
[17] 陈学生, 张洪钦, 陈秋琴, 等.骨碎补总黄酮对卵巢去势大鼠骨质疏松的干预作用[J].中国当代医药, 2021, 28(10):4-7;241.CHEN X S, ZHANG H Q, CHEN Q Q, et al.Intervention effect of Rhizoma Drynariae total flavone on osteoporosis in ovariectomized rats[J].China Modern Medicine, 2021, 28(10):4-7;241.
[18] 闫文斌, 李琦, 郑泉, 等.维生素D联合金天格胶囊对骨质疏松大鼠骨钙素、血管再生及微量元素的影响[J].中国老年学杂志, 2024, 44(19):4722-4727.YAN W B, LI Q, ZHENG Q, et al.Vitamin D combined with Jintiange capsule on osteocalcin, angiogenesis and trace elements in osteoporosis rats[J].Chinese Journal of Gerontology, 2024, 44(19):4722-4727.
[19] RIGGS B L, KHOSLA S, ATKINSON E J, et al.Evidence that type I osteoporosis results from enhanced responsiveness of bone to estrogen deficiency[J].Osteoporosis International, 2003, 14(9):728-733.
[20] 蒋宁宁. 基于Wnt/β-catenin通路和OPG/RANKL/RANK轴研究二甲双胍联合骨碎补总黄酮抗骨质疏松作用[D].吉林:吉林大学, 2023.JIANG N N.The role of Wnt/β-catenin pathway and OPG/RANKL/RANKaxis in the anti-osteoporosis mechanism of metformin combined with total flavonoids of Rhizoma Drynariae[D].Jilin:Jilin University, 2023.
[21] PAN Z F, HE Q, ZENG J X, et al.Naringenin protects against iron overload-induced osteoarthritis by suppressing oxidative stress[J].Phytomedicine, 2022, 105:154330.
[22] HU Y M, MU P Y, MA X, et al.Rhizoma drynariae total flavonoids combined with calcium carbonate ameliorates bone loss in experimentally induced osteoporosis in rats via the regulation of Wnt3a/β-catenin pathway[J].Journal of Orthopaedic Surgery and Research, 2021, 16(1):702.
[23] 张莉丽, 张布衣, 余阳.骨碎补总黄酮上调骨质疏松症模型大鼠Wnt/LRP-5/β-catenin通路表达的研究[J].中国骨质疏松杂志, 2023, 29(6):807-811.ZHANG L L, ZHANG B Y, YU Y.Up-regulation of Wnt/LRP-5/β-catenin signaling pathway related gene expression in osteoporosis model rats by total flavonoids of rhizoma drynariae[J].Chinese Journal of Osteoporosis, 2023, 29(6):807-811.
[24] DUAN P P, BONEWALD L F.The role of the Wnt/β-catenin signaling pathway in formation and maintenance of bone and teeth[J].International Journal of Biochemistry &Cell Biology, 2016, 77(Pt A):23-29.
[25] LI S Y, ZHOU H L, HU C, et al.Total flavonoids of rhizoma drynariae promotes differentiation of osteoblasts and growth of bone graft in induced membrane partly by activating Wnt/β-catenin signaling pathway[J].Frontiers in Pharmacology, 2021, 12:675470.
[26] 张帆, 梁清洋, 韩超, 等.Wnt/β-catenin信号通路调控成骨细胞、破骨细胞在骨质疏松中的作用探讨[J].中国骨质疏松杂志, 2021, 27(10):1540-1544.ZHANG F, LIANG Q Y, HAN C, et al.Role of Wnt/β-catenin signaling in the regulation of osteoblasts and osteoclasts in osteoporosis[J].Chinese Journal of Osteoporosis, 2021, 27(10):1540-1544.
[27] GAO Y H, HUANG E Y, ZHANG H M, et al.Crosstalk between Wnt/β-catenin and estrogen receptor signaling synergistically promotes osteogenic differentiation of mesenchymal progenitor cells[J].PLoS One, 2013, 8(12):e82436.