风干猪肉是指鲜、冻猪肉经食盐等辅料腌制后,置于低温通风处晾干(多在冬季)而成的腌腊生肉制品,因其风味独特、营养丰富和携带方便深受消费者喜爱[1]。与其他发酵肉制品一样,传统风干猪肉产于中国南方各地,其生产主要以家庭自制或作坊生产,加工周期一般可达数月,全凭人们经验进行操作,又因各地气候和风干程度不同,最终导致制成成品风干猪肉品质参差不齐,甚至存在食品安全问题。王丹等[2]发现以风干、腌制+风干、腌制3种方式制作而成的腊肉中生物胺含量和种类存在显著差异(P<0.05),其中腌制+风干样品的组胺含量最高,有个别样品的组胺含量高达402.73 mg/kg。本实验室前期调查发现,全国不同地区风干猪肉样品中生物胺含量较高,具有食品安全隐患。
为提高传统发酵肉制品品质和安全性,目前,采用人工接种功能性微生物并进行控制发酵,可以保证产品的品质稳定,有效缩短发酵肉制品的生产周期,同时提高产品的安全质量。王俊钢等[3]将从风干牛肉中筛选的3株产蛋白酶乳酸菌分别接种于风干牛肉中,并将生产周期缩短为16 d,结果发现3株产蛋白酶乳酸菌均能显著改善产品色泽和质构,抑制大肠菌群繁殖和生物胺形成,提高其安全性。杨海荣[4]发现接种的产蛋白酶葡萄球菌可通过增加必需氨基酸、产鲜氨基酸含量和挥发性风味物质的种类来改善香肠品质。相关研究发现产脂肪酶能力强的乳酸菌与产脂肪酶能力中、弱的乳酸菌和脂肪分解酶相比,能显著提高香肠中不饱和脂肪酸含量,改善香肠脂肪特性[5]。研究表明,产蛋白酶及脂肪酶的菌株所分泌的酶类可与肉源内源酶协同作用于蛋白质与脂质基质,通过酶解作用促进小分子肽、游离氨基酸及挥发性风味物质等代谢产物的生成,从而显著改善肉制品的质构特性与风味特征[6]。此外,作为肉制品发酵体系中的核心功能菌群,乳酸菌可通过产酸作用降低基质pH,有效缩短发酵周期,葡萄球菌具有硝酸盐还原能力,对发酵肉制品形成稳定的色泽具有关键调控作用。彭健斌[7]将肉葡萄球菌、戊糖片球菌(兼具蛋白酶与脂肪酶活性)与植物乳植杆菌(蛋白酶活性)进行单菌或复配菌剂接种发现,所有接菌组羊肉脯的膻味特征脂肪酸含量均较对照组显著降低,同时产品色泽、质构及挥发性风味物质多样性均得到优化,其中三菌复配组在品质改善效果上显著优于单菌组。复配发酵剂与单一发酵剂相比更能发挥各菌种的功能,形成优势互补,进一步改善产品品质和提高其安全性和稳定性。但是目前有关多株产蛋白酶、脂肪酶菌株混合发酵对风干猪肉品质的影响研究少见文献报道。
本研究将植物乳植杆菌L11、乳酸片球菌L478、木糖葡萄球菌S34和木糖葡萄球菌S36按照不同比例接种发酵风干猪肉,测定其微生物、感官品质、理化指标、挥发性物质和生物胺含量,探究产蛋白酶、脂肪酶乳酸菌和葡萄球菌混合发酵对风干猪肉品质的影响,为今后生产中人工接种混菌发酵剂生产发酵肉制品提供理论依据。
1 材料与方法
1.1 材料与试剂
植物乳植杆菌L11(简称L11)、乳酸片球菌L478(简称L478)、木糖葡萄球菌S34(简称S34)和木糖葡萄球菌S36(简称S36),均由实验室前期从风干猪肉中筛选得到,以L11∶L478∶S34∶S36=2∶1∶1∶1的体积比为前期实验得到的产蛋白酶和脂肪酶能力最优复配比例(产蛋白酶、脂肪酶活力为8.64、5.70 U/mL);新鲜五花猪肉、食盐,四川省雅安市浙联优选超市;NaCl、乙腈、丙酮等,成都浩搏优科技有限公司;生物胺标准品、丹磺酰氯等,美国Sigma公司。
1.2 仪器与设备
LHS-250SC恒温恒湿箱,上海有丰科学仪器有限公司;PHS-3DW pH计,绍兴上虞长光仪器有限公司;SC-80色差仪,北京康光仪器有限公司;TA.XPlus物性分析仪,超技仪器有限公司;Ultimate 3000液相色谱仪,美国Thermo Fisher Scientific公司;Agilent 7890A/5975气相色谱-质谱联用仪,安捷伦科技有限公司。
1.3 实验方法
1.3.1 风干猪肉的制作工艺
1.3.1.1 工艺配方
30 kg新鲜五花猪肉,食盐2.3%(质量分数)。
1.3.1.2 工艺流程及操作要点
原料肉修整→添加配料→真空滚揉→接种发酵剂→腌制→成熟→干燥→成品
操作要点:原料肉:选择肥瘦比约为6∶4新鲜五花猪肉,修整为长10~12 cm,宽3~5 cm,高2~3 cm,质量70~80 g,清洗并沥干;配料添加:翻炒食盐,冷却后均匀地涂抹于肉表面;滚揉:将涂抹好食盐的肉置于真空滚揉机中静止1 h后滚揉5 h(滚揉1 min,停5 min),让盐分被肉充分吸收;接种发酵剂:将处理好的菌液(接种量107 CFU/g)均匀涂抹于肉的表面;腌制:温度4 ℃,腌制3 d,每24 h翻动1次;成熟:温度13 ℃,相对湿度55%,成熟9 d;干燥:温度50 ℃,干燥5 h;成品:真空包装后置于-40 ℃冰箱保存。
1.3.2 实验分组及取样点
不接种对照组(CK组);L11+L478+S34+S36组(L11∶L478∶S34∶S36=2∶1∶1∶1,体积比);L11+L478组(L11∶L478=2∶1,体积比);S34+S36组(S34∶S36=1∶1,体积比)。选取风干猪肉加工过程中的7个工艺点(原料肉、滚揉结束、腌制结束、成熟3 d、成熟6 d、成熟结束、干燥结束)进行测定。
1.3.3 微生物测定
参照GB 4789.35—2023《食品安全国家标准 食品微生物学检验 乳酸菌检验》测定乳酸菌数;参照GB 4789.10—2016《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》测定葡萄球菌数,将Baird-Paker琼脂培养基替换成甘露醇高盐琼脂培养基。
1.3.4 感官品质测定
1.3.4.1 感官评定
将制作好的风干猪肉于沸水中煮45 min,4组样品切成片状置于盘中并随机编号,邀请食品学院有感官评定经验的20名同学(男女各10名)从色泽、气味、滋味和质地4个方面进行感官评分,感官评分标准如表1所示。
表1 风干猪肉感官评分标准
Table 1 Sensory evaluation standard of air-dried pork
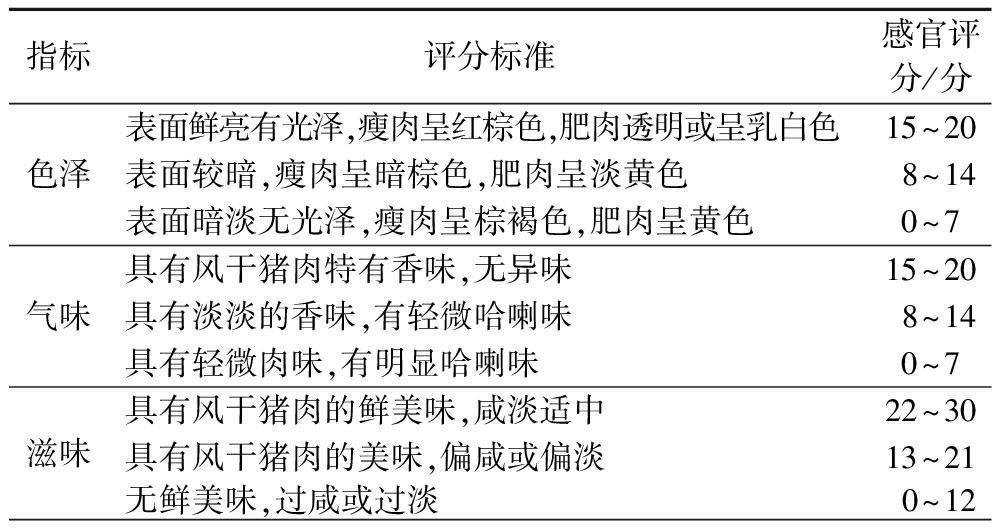
指标评分标准感官评分/分色泽表面鲜亮有光泽,瘦肉呈红棕色,肥肉透明或呈乳白色15~20表面较暗,瘦肉呈暗棕色,肥肉呈淡黄色8~14表面暗淡无光泽,瘦肉呈棕褐色,肥肉呈黄色0~7气味具有风干猪肉特有香味,无异味15~20具有淡淡的香味,有轻微哈喇味8~14具有轻微肉味,有明显哈喇味0~7滋味具有风干猪肉的鲜美味,咸淡适中22~30具有风干猪肉的美味,偏咸或偏淡13~21无鲜美味,过咸或过淡0~12
续表1

指标评分标准感官评分/分质地表面干爽,咀嚼性好,硬度适中22~30表面较干爽,不易咀嚼,组织较硬或较软13~21表面较黏,咀嚼性差,组织过软或过硬0~12总分100
1.3.4.2 色差测定
取样品的瘦肉、肥肉和皮3个部位,用色差仪测定其亮度(L*)值,红色度(a*),黄色度(b*)。
1.3.4.3 质构测定
参照张楠[8]的方法略作修改。取样品中心的瘦肉和肥肉2个部位(2 cm×2 cm×1 cm),沿垂直于样品肌纤维方向使用P/36R探头进行测定。
1.3.5 理化指标测定
1.3.5.1 水分活度(water activity,Aw)的测定
参照GB 5009.238—2016《食品安全国家标准 食品水分活度的测定》测定Aw。
1.3.5.2 pH值的测定
参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》测定pH值。
1.3.5.3 蛋白质降解指数的测定
总氮参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》进行测定;非蛋白氮参照LI等[9]方法略作修改,取5.00 g风干猪肉样品,加入45 mL蒸馏水,在4 ℃下1 000 r/min离心20 min,再用定量滤纸过滤上清液2次,再在4 ℃下1 000 r/min离心10 min,定量滤纸过滤上清液,取10 mL滤液用凯氏定氮法进行测定;蛋白质降解指数为非蛋白氮含量和总氮含量的比值。
1.3.5.4 肌浆蛋白和肌原纤维蛋白的测定
参照SUN等[10]的SDS-PAGE法对样品进行测定。
1.3.5.5 过氧化值的测定
参照GB 5009.227—2023《食品安全国家标准 食品中过氧化值的测定》进行测定。
1.3.5.6 硫代巴比妥酸值的测定
参照GB 5009.181—22016《食品安全国家标准 食品中丙二醛的测定》进行测定。
1.3.5.7 脂肪酸的测定
参照GB 5009.168—2016《食品安全国家标准 食品中脂肪酸的测定》进行测定。
1.3.5.8 挥发性物质的测定
参照罗玉龙等[11]的方法略作修改。萃取:取5.00 g绞碎样品置于25 mL样品瓶,加10 μL 0.1 μg/μL的2-甲基-3-庚酮溶液混合,萃取头老化后插入样品瓶距离样品1 cm处,60 ℃条件下吸附30 min后取出,并插入GC进样口,250 ℃条件解下吸附4 min。GC-MS条件:VF-WAXms色谱柱(30 mm×0.25 mm,0.25 μm),载气为He,载气流速1.0 mL/min,进样品和接口温度250 ℃,升温程序:初始温度40 ℃,保持5 min;2 ℃/min升温到80 ℃,保持1 min;4 ℃/min升温到200 ℃,保持5 min;不分流进样,离子源温度250 ℃,传输线温度250 ℃,质量扫描范围m/z 30~450;溶剂延迟3 min。定性定量分析:将测得物质的质谱图在NIST11谱库中的质谱进行对比,选择匹配度>80的图谱进行分析得到风味物质,采用内标法进行挥发性物质的相对含量的计算。
1.3.5.9 生物胺的测定
参照GB 5009.208—2016《食品安全国家标准 食品中生物胺的测定》中液相色谱法测定。
1.3.6 数据处理
待测样品均平行测定3次,使用“平均值±标准差”表示。所得数据用SPSS 27进行统计学分析,Origin 2021进行绘图。
2 结果与分析
2.1 微生物菌群变化
由图1-a可知,4组风干猪肉的乳酸菌在前期均快速增长,在成熟第6天达到最高值。原料肉到成熟第6天L11+L478+S34+S36组增长幅度(28.24%)高于L11+L478组(27.35%)、对照组(26.11%)和S34+S36组(25.75%),之后开始下降,可能是后期营养物质被消耗、菌株产酸和干燥时温度的升高等形成的环境不利于乳酸菌的生长。干燥结束后,L11+L478+S34+S36组乳酸菌数(6.91 lg CFU/g)显著高于L11+L478组(6.83 lg CFU/g)、对照组(6.71 lg CFU/g)和S34+S36组(6.59 lg CFU/g)(P<0.05)。葡萄球菌是风干猪肉的主要微生物之一[12],作为发酵肉制品形成风味的主要菌株,通过产生蛋白酶和脂肪酶促进小分子有机物生成来增加香味。由图1-b可知,葡萄球菌数均呈先升高后下降的趋势,在干燥结束后,对照组(5.50 lg CFU/g)显著低于L11+L478+S34+S36组(5.98 lg CFU/g)、S34+S36组(5.91 lg CFU/g)和L11+L478组(5.71 lg CFU/g)(P<0.05),表明接种的葡萄球菌能适应风干猪肉的加工过程并生长良好。
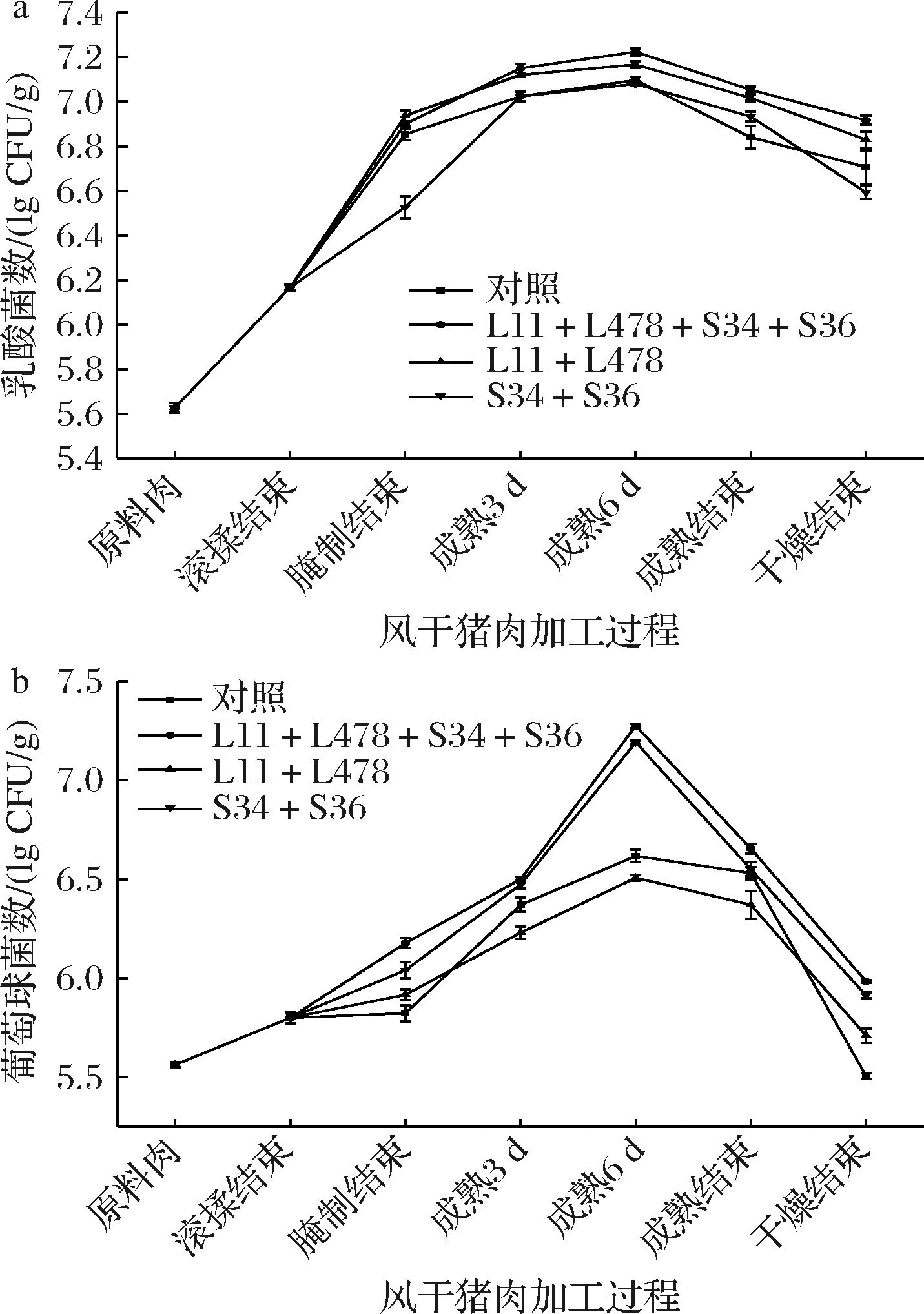
a-乳酸菌;b-葡萄球菌
图1 风干猪肉加工过程中乳酸菌、葡萄球菌的变化
Fig.1 Changes of lactic acid bacteria and Staphylococcusin air-dried pork during processing
2.2 感官品质测定结果
2.2.1 感官评定结果
如表2所示,4组均具有风干猪肉本身的良好色泽,CK组得分最低(P>0.05);L11+L478+S34+S36组的气味评分显著高于其他3组(P<0.05),L11+L478+S34+S36组、L11+L478组和S34+S36组的滋味和质地评分均显著高于对照组(P<0.05),L11+L478+S34+S36组风干猪肉更具有风干猪肉特有香味、咸淡适宜和咀嚼性好等特性;L11+L478+S34+S36组总分(86.45分)最高,其次为S34+S36组(80.65分)和L11+L478组(79.65分),对照组(74.45分)总分最低(P<0.05),说明乳酸菌和葡萄球菌复配接种的效果优于乳酸菌复配接种和葡萄球菌复配接种。
表2 感官评分结果表
Table 2 Sensory score results sheet
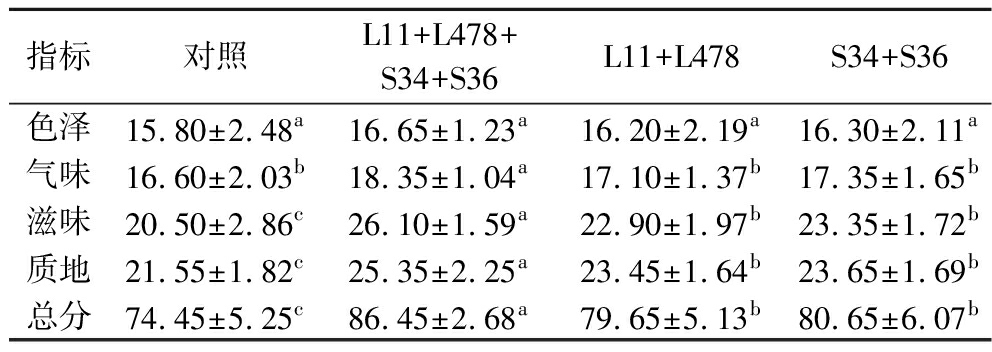
指标对照L11+L478+S34+S36L11+L478S34+S36色泽15.80±2.48a16.65±1.23a16.20±2.19a16.30±2.11a气味16.60±2.03b18.35±1.04a17.10±1.37b17.35±1.65b滋味20.50±2.86c26.10±1.59a22.90±1.97b23.35±1.72b质地21.55±1.82c25.35±2.25a23.45±1.64b23.65±1.69b总分74.45±5.25c86.45±2.68a79.65±5.13b80.65±6.07b
注:同行不同字母表示不同组别差异显著(P<0.05)(下同)。
2.2.2 色差仪测定结果
如图2所示,L11+L478+S34+S36组瘦肉和皮的L*值分别为46.22和36.67,显著高于L11+L478组(43.03、36.01)、S34+S36组(43.48、35.36)和对照组(41.20、34.93)(P<0.05),L11+L478+S34+S36组(76.25)、L11+L478组(74.61)和S34+S36组(75.61)风干猪肉中肥肉的L*值显著高于对照组(69.58)(P<0.05);L11+L478+S34+S36组瘦肉的a*值(16.78)显著高于L11+L478组(15.71)、S34+S36组(15.27)和对照组(14.60)(P<0.05),表现出更鲜艳的红棕色;在b*值中,3个接菌组风干猪肉的皮呈现明亮的黄色,对照组皮的值(14.60)显著低于L11+L478+S34+S36组皮的值(15.00)、L11+L478组(14.41)和S34+S36组(14.78)(P<0.05)。乳酸菌和葡萄球菌复配接种能提高风干猪肉整体的亮度、瘦肉的红润度和皮的黄度,提高了风干猪肉色泽稳定性。
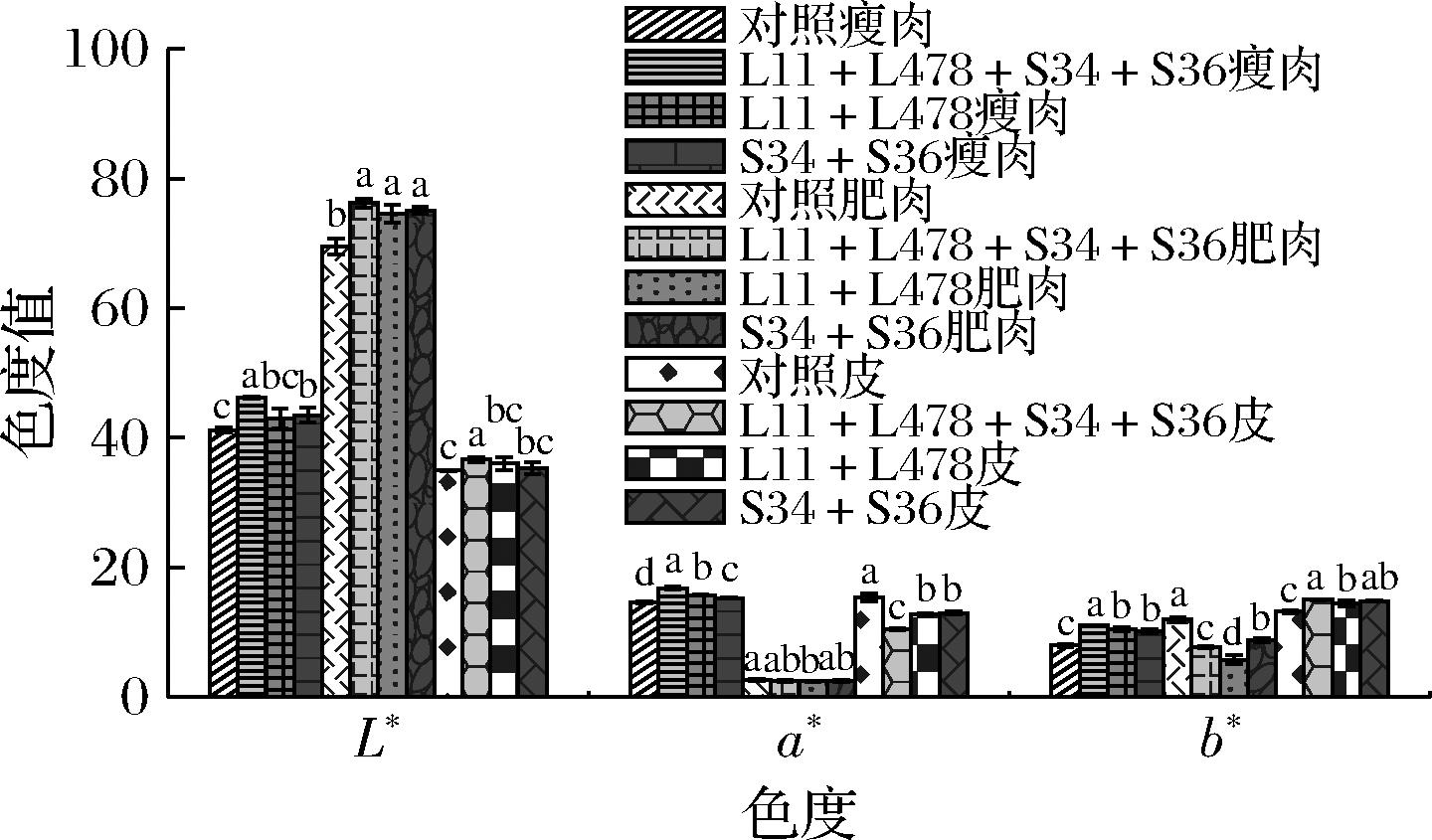
图2 风干猪肉的色度值
Fig.2 Chromaticity value of air-dried pork
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2.3 质构测定结果
如表3所示,在黏结性和恢复性方面,4组风干猪肉的瘦肉和肥肉均无显著差异(P>0.05),可能是原料肉和加工工艺相同所致;在硬度、黏性和咀嚼性指标中,L11+L478+S34+S36组瘦肉和肥肉均显著低于对照组(P<0.05),与刘世琳[13]的研究结果相似,可能是乳酸菌和葡萄球菌协同作用产生蛋白酶促进肌原纤维蛋白降解,进而改变组织紧密结构;在弹性指标中,对照组瘦肉略高于3个接菌组,但无显著差异(P>0.05),但4组风干猪肉中肥肉的弹性存在显著差异(P<0.05),对照组最高。乳酸菌和葡萄球菌复配接种可显著改善瘦肉和肥肉的硬度、黏性和咀嚼性,而乳酸菌复配和葡萄球菌复配仅能改善部分特定组织指标(乳酸菌复配主要作用于风干猪肉中瘦肉硬度、黏性和咀嚼性,葡萄球菌复配着重改善风干猪肉的硬度和其肥肉的弹性),表明乳酸菌和葡萄球菌复配对风干猪肉质构改善效果优于乳酸菌复配和葡萄球菌复配。
表3 风干瘦肉中瘦肉的质构特性结果
Table 3 Results of texture characteristics of fat meat in air-dried lean meat

质构对照L11+L478+S34+S36L11+L478S34+S36瘦肉弹性/%0.59±0a0.49±0.06a0.50±0.07a0.56±0.10a硬度/N12 594.71±569.14a7 566.87±432.09c7 958.90±144.26c11 507.91±468.46b黏结性0.51±0.01a0.51±0.02a0.53±0.06a0.55±0.05a黏性/N6 448.44±441.00a3 878.24±391.30b4 251.72±446.06b6 294.57±442.45a咀嚼性/J3 819.01±248.37a1 900.25±76.49b2 118.81±120.63b3 541.63±737.86a恢复性/%0.22±0.02a0.22±0.03a0.22±0.03a0.22±0.02a肥肉弹性/%0.61±0.03a0.46±0.08b0.46±0.07b0.46±0.10b硬度/N5 054.96±116.94a3 263.52±172.77d4 181.20±165.62c4 450.15±90.24b黏结性0.53±0.03a0.57±0.06a0.53±0.10a0.50±0.05a黏性/N2 655.81±201.56a1 860.42±178.73b2 226.65±449.26ab2 242.10±245.46ab咀嚼性/J1 624.10±204.80a872.73±239.30b1 019.57±281.53a1 024.69±112.74a恢复性/%0.23±0.01a0.25±0.01a0.24±0.01a0.24±0.02a
2.3 理化指标测定结果
2.3.1 Aw和pH值的测定结果
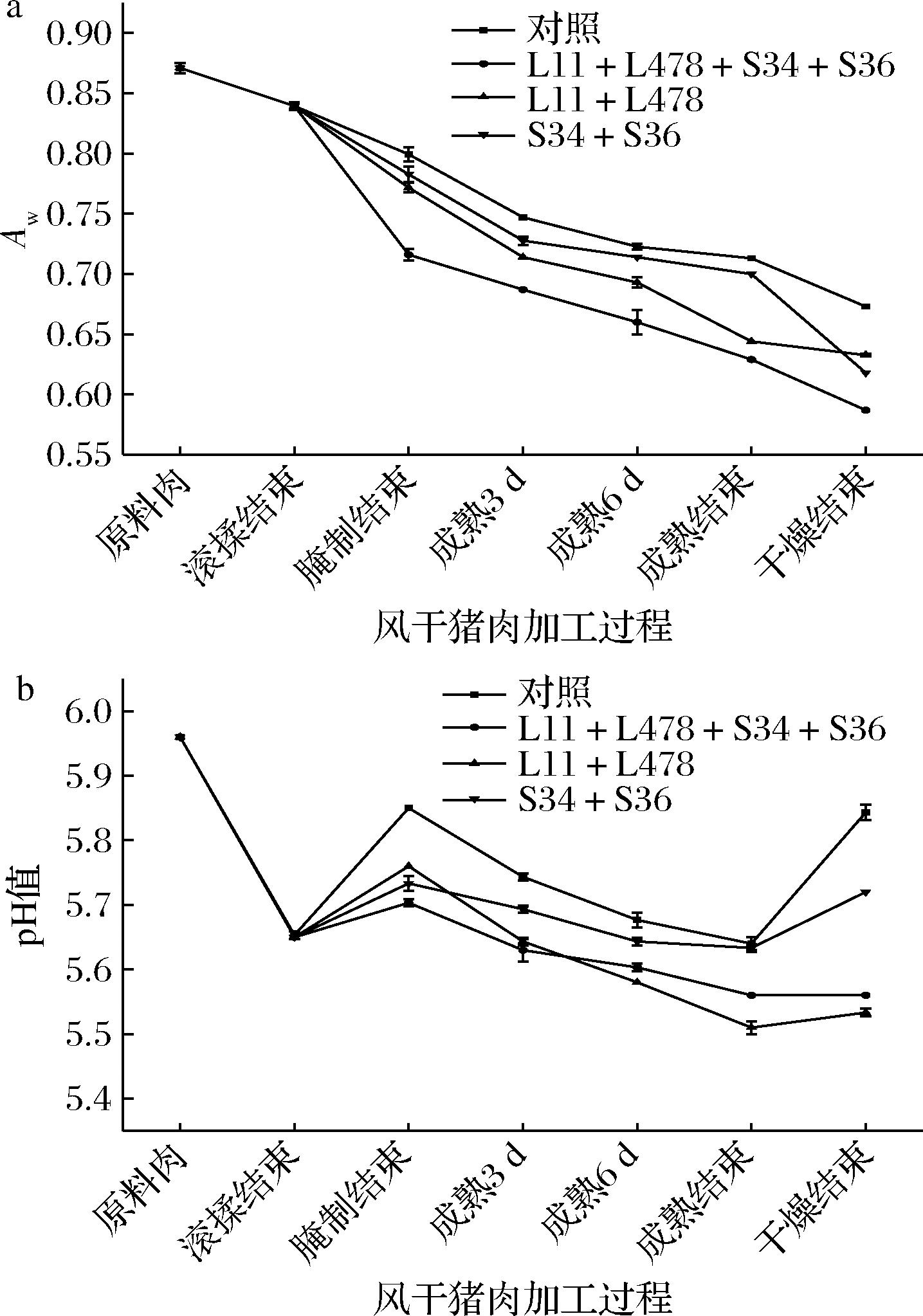
从图3-a可看出在风干猪肉加工过程中Aw呈下降趋势,腌制期间加入的食盐充分侵入风干猪肉组织结构中,Aw下降明显且4组风干猪肉样品间出现显著差异,能抑制有害微生物的生长,预防风干猪肉腐败变质和延长其货架期。干燥结束时,对照组Aw(0.67)显著高于L11+L478+S34+S36组(0.59)、L11+L478组(0.63)和S34+S36组(0.62)(P<0.05),风干猪肉Aw低,自由水含量更少,更不宜长菌发霉。风干猪肉加工过程中pH值变化如图3-b所示,腌制结束时pH值均增加,与杨腊梅等[14]研究结果一致,可能是蛋白质在内源、外源蛋白酶的作用下产生碱性物质,还可能是滚揉后促进食盐与肉的接触形成大量呈碱性的多聚磷酸盐。乳酸菌快速生长利用碳水化合物产酸增多导致风干猪肉成熟期间pH值快速下降。成熟结束达到最低值后升高,可能是在微生物作用下氨基酸降解产物和氨的积累增多。干燥结束时,对照组风干猪肉的pH值(5.84)显著高于L11+L478+S34+S36组(5.56)、L11+L478组(5.53)和S34+S36组(5.72)(P<0.05)。乳酸菌与葡萄球菌复配接种于风干猪肉中,保证体系具有较低的pH范围,从而能延缓食品腐败变质。
a-Aw;b-pH值
图3 风干猪肉加工过程中Aw、pH值的变化
Fig.3 Changes of water activity and pH value during the processing of air-dried pork
2.3.2 蛋白质降解指数的测定结果
蛋白质降解指数可看出蛋白质降解情况,如图4所示,在风干猪肉加工过程中蛋白质降解指数呈升高趋势,说明在加工期间风干猪肉样品中蛋白质降解程度在逐渐增强,这与刘雨萱[15]的研究结果一致。对照组风干猪肉样品的蛋白质降解指数在风干猪肉加工过程中一直低于3个接菌组,在干燥结束时,L11+L478+S34+S36组风干猪肉样品的蛋白质降解指数(11.22)显著高于L11+L478组(9.75)和S34+S36组(8.45)(P<0.05),CK组最低(7.35),说明接种的产蛋白酶、脂肪酶乳酸菌和葡萄球菌能在一定程度上促进蛋白质的降解。
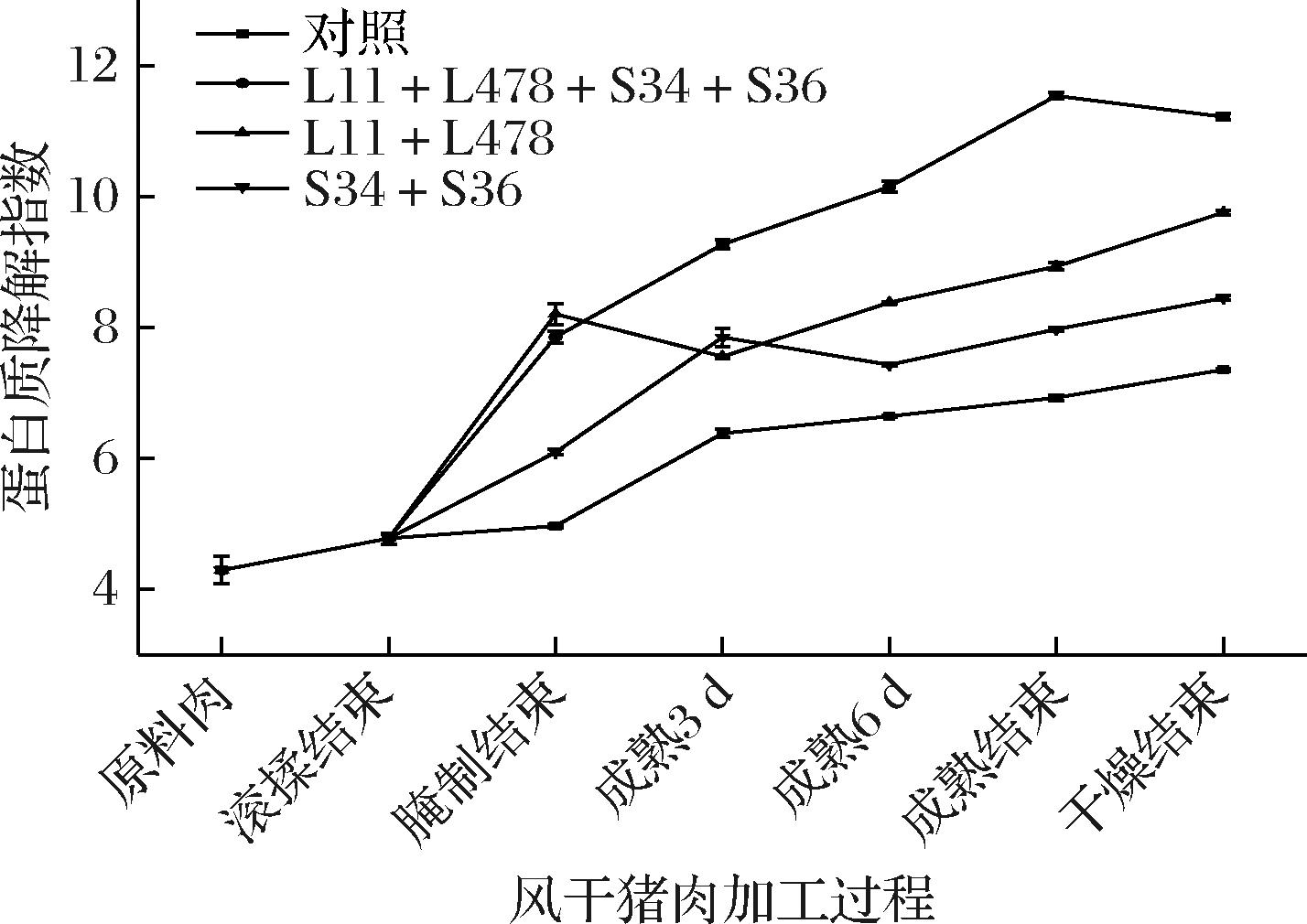
图4 风干猪肉加工过程中蛋白质降解指数的变化
Fig.4 Changes of protein degradation number during the processing of air-dried pork
2.3.3 肌浆蛋白和肌原纤维蛋白的测定结果
如图5-a~图5-d所示,4组风干猪肉中s1(200 kDa)、s2(150 kDa)和s3(120 kDa)条带的颜色在加工过程中均呈现加速变浅趋势,在干燥结束时3个条带均消失,4组风干猪肉的降解速度一致。在成熟结束时,L11+L478+S34+S36组s1和s2条带颜色最浅,降解幅度最大;其次是L11+L478组和S34+S36组,对照组s1和s2条带颜色最深,降解幅度最小。在成熟期间,对照组分子质量在25~30 kDa的条带颜色均深于3个接菌组。4组风干猪肉中s4(25 kDa)以下的条带颜色都有逐渐加深的趋势,降解可能作为风味物质或其前体的更小分子质量的蛋白片段。结果表明,接种发酵能在一定程度上提高风干猪肉肌浆蛋白的降解程度。如图5-e~图5-h所示,4组风干猪肉的m1条带(肌球蛋白重链,200 kDa)、m2条带(肌动蛋白,45 kDa)、m3条带(原肌球蛋白,40 kDa)、m4条带(肌钙蛋白,37 kDa)和m5条带(肌球蛋白轻链,25 kDa)均有不同程度的变化,对照组风干猪肉中m1条带呈现变浅加深消失趋势,而3个接菌组m1条带的颜色均呈变浅趋势,L11+L478+S34+S36组m1条带在成熟结束时消失,其降解速度最快,对照组的m1条带在成熟结束时的颜色深于L11+L478组和S34+S36组,降解速度最慢;对照组的m2条带在成熟期间的颜色最深在干燥时变浅,降解幅度最小,L11+L478+S34+S36组、L11+L478组和S34+S36组的m2条带颜色均呈变浅趋势,干燥结束时L11+L478+S34+S36组m2条带颜色最浅,降解幅度最大;对照组风干猪肉的m3和m4条带在腌制和成熟期期间颜色变深到干燥结束时才变浅,3个接菌组风干猪肉的m3和m4条带颜色在成熟期间逐渐加深;4组风干猪肉的m5条带颜色均呈变浅趋势,变化不明显,4组分子质量为15 kDa以下的条带颜色整体呈现加深趋势,可能与接种菌株产生的蛋白酶促进肌原纤维蛋白降解有关,说明接种发酵能促进风干猪肉中蛋白质的降解。

M-Marker,1-原料肉,2-滚揉结束,3-腌制结束,4-成熟3 d,5-成熟6 d,6-成熟结束,7-干燥结束;s1-(200 kDa),s2-(150 kDa),s3-(120 kDa),s4-(25 kDa);m1-肌球蛋白重链(200 kDa),m2-肌动蛋白(45 kDa),m3-原肌球蛋白(40 kDa),m4-肌钙蛋白(37 kDa),m5-肌球蛋白轻链(25 kDa)。a-对照组肌浆蛋白;b-L11+L478+S34+S36组肌浆蛋白;c-L11+L478组肌浆蛋白;d-S34+S36组肌浆蛋白;e-CK组肌原纤维蛋白;f-L11+L478+S34+S36组肌原纤维蛋白;g-L11+L478组肌原纤维蛋白;h-S34+S36组肌原纤维蛋白
图5 风干猪肉肌浆蛋白和肌原纤维蛋白降解变化
Fig.5 Degradation of sarcoplasmic protein and myofibrillar protein in air-dried pork
2.3.4 过氧化值的测定结果
过氧化值是氧化初始阶段的指标,可反映风干猪肉氧化程度。由图6可知,在风干猪肉加工过程中,4组风干猪肉样品的过氧化值均呈升高趋势。在加工期间,对照组风干猪肉样品的过氧化值一直显著高于3个接菌组(P<0.05),说明发酵菌株能抑制脂质初级产物的积累。在干燥结束时,L11+L478+S34+S36组风干猪肉样品的过氧化值(0.010 3 g/100 g)最低,其次为L11+L4786组(0.011 0 g/100 g)和S34+S36组(0.011 4 g/100 g),对照组最高(0.013 9 g/100 g),说明乳酸菌和葡萄球菌复配发酵可通过抑制初级氧化产物的积累,有效延缓风干猪肉脂质氧化进程,从而提升其氧化稳定性。这与王吉[16]在发酵香肠中研究结果一致,接菌组香肠的过氧化值值低于自然发酵组,说明发酵菌株对脂质氧化有一定抑制作用。
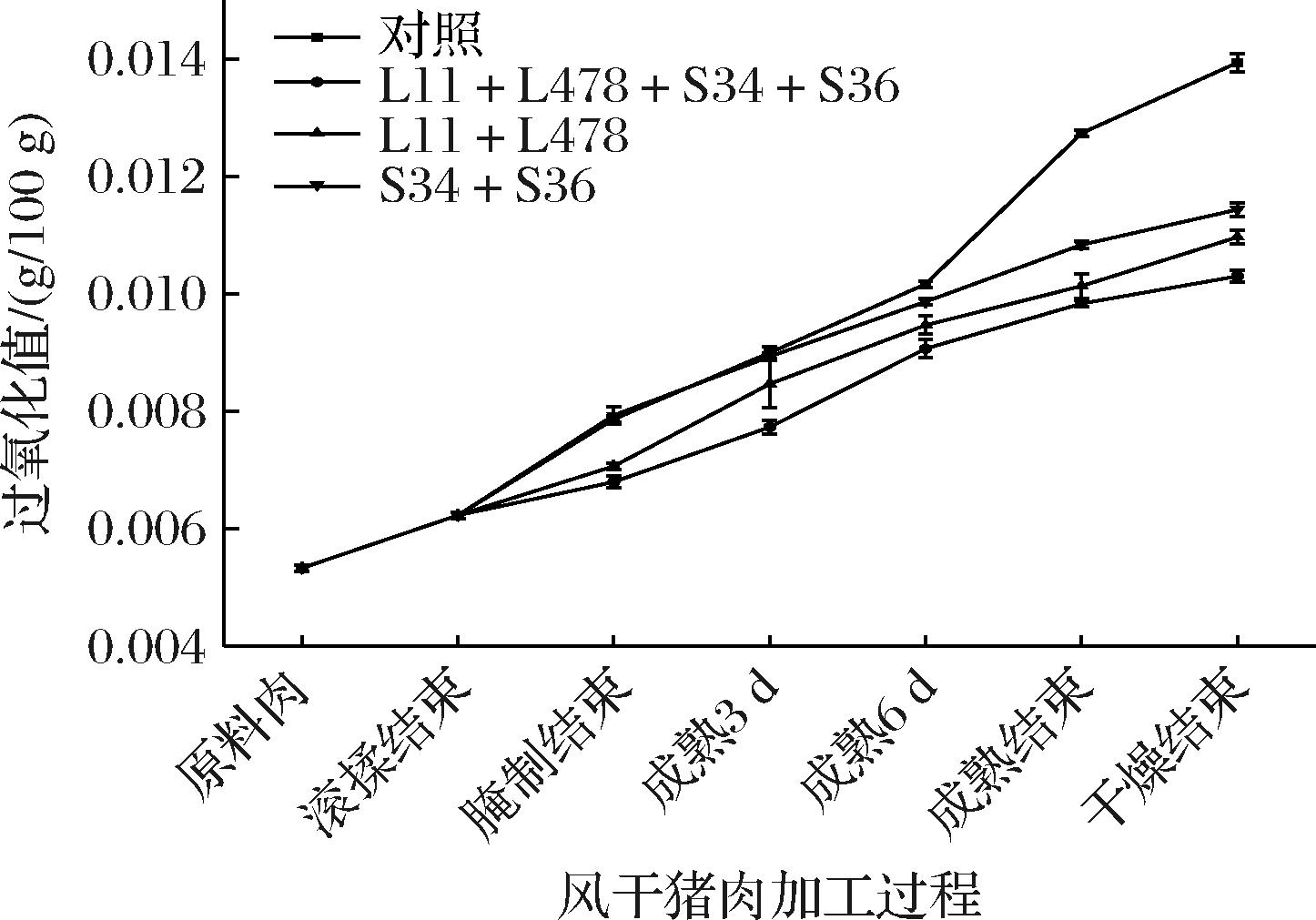
图6 风干猪肉加工过程中过氧化值的变化
Fig.6 Changes of peroxide value in air-dried pork during processing
2.3.5 硫代巴比妥酸值的测定结果
硫代巴比妥酸值表示脂质氧化的初级氧化产物,能衡量风干猪肉脂质氧化的程度。如图7所示,4组风干猪肉样品的硫代巴比妥酸值都呈先升高后下降再升高的趋势。在成熟期间下降可能是次级氧化产物醛类物质与风干猪肉中的物质反应,消耗醛类物质产生其他物质[17]。在干燥结束时,对照组风干猪肉样品的硫代巴比妥酸值(0.65 mg/kg)显著高于3个接菌组(P<0.05),且L11+L478+S34+S36组(0.38 mg/kg)最低,说明接种发酵能在一定程度上防止风干猪肉脂质过度氧化。
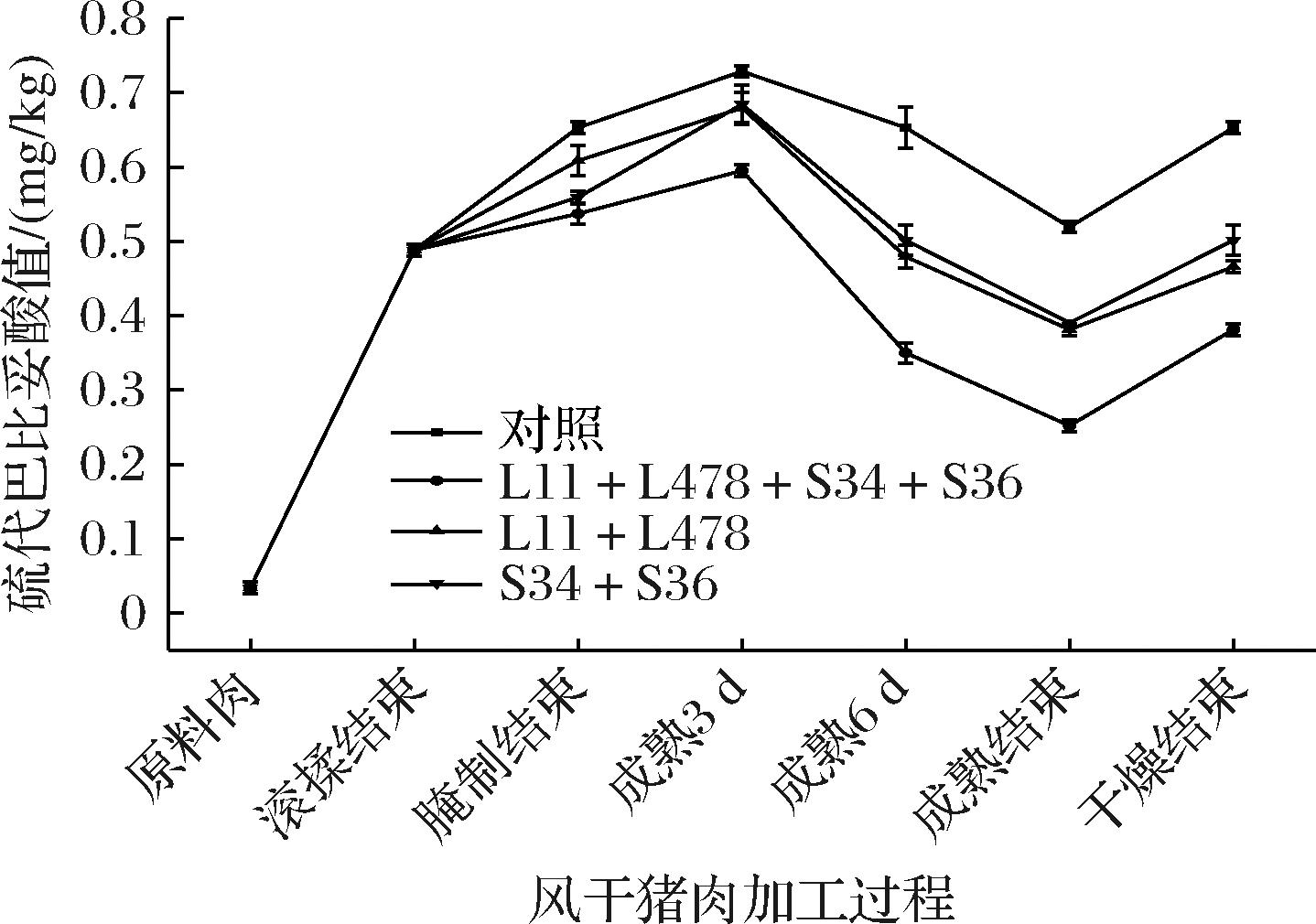
图7 风干猪肉加工过程中硫代巴比妥酸值的变化
Fig.7 Changes of thiobarbituric acid value in air-dried pork during processing
2.3.6 游离脂肪酸的测定结果
游离脂肪酸可分为饱和脂肪酸(saturated fatty acid, SFA)和不饱和脂肪酸,由脂肪氧化及在特定环境和酶作用下水解产生,在发酵肉制品中作为重要的风味物质前体,对产品的风味形成起关键作用[18]。干燥结束时游离脂肪酸的含量如表4所示,检测出11种SFA,肉豆蔻酸(C14∶0)和硬脂酸(C18∶0)为主要SFA,在对照组中的含量均显著高于3个接菌组(P<0.05),L11+L478+S34+S36组、L11+L478组和S34+S36组SFA总量分别为3.05、3.38、3.43 g/100 g,均显著低于对照组(4.25 g/100 g)(P<0.05),张开屏等[5]将产脂肪酶乳酸菌接种于羊肉香肠中得到相似结果,可能是乳酸菌和葡萄球菌产生的脂肪酶促进脂肪水解。油酸(C18∶1)是典型的单不饱和脂肪酸(monounsaturated fatty acid, MUFA),对人体具有抗炎、调节免疫和降压降糖等益处[19],在4组风干猪肉中占比最大,L11+L478+S34+S36组含量(4.13 g/100 g)显著高于L11+L478组(3.82 g/100 g)、S34+S36组(3.73 g/100 g)和对照组(3.35 g/100 g)(P<0.05);多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)与MUFA一样有益于人体健康,在L11+L478+S34+S36组MUFA和PUFA总量(5.02、3.50 g/100 g)均为最高,其中MUFA总量显著高于其他3组(P<0.05)。L11+L478+S34+S36组MUFA和PUFA总量与对照组相比分别增加23.95%和40.00%,其次是L11+L478组和S34+S36组,分别增加15.56%和37.60%、13.33%和36.40%,表明接种发酵可通过调控脂肪水解进程,优化脂肪酸组成,从而影响风干猪肉的风味特性。
表4 风干猪肉加工结束后游离脂肪酸的含量 单位:g/100 g Table 4 Free fatty acid content of air-dried pork after processing

脂肪酸对照L11+L478+S34+S36L11+L478S34+S36C6∶00.01±0.00a0.01±0.00a0.01±0.00a0.01±0.00aC8∶00.02±0.00a0.02±0.00a0.02±0.00a0.02±0.00aC10∶00.03±0.00a0.03±0.00a0.03±0.00a0.03±0.00aC12∶00.03±0.00a0.03±0.00a0.03±0.00a0.03±0.00aC14∶00.19±0.00a0.16±0.00c0.17±0.00b0.14±0.00dC15∶00.01±0.00a0.01±0.00a0.01±0.00a0.01±0.00aC16∶02.50±0.30a1.68±0.30b1.92±0.30ab2.03±0.17abC16∶10.65±0.00d0.84±0.00a0.80±0.00c0.82±0.00bC17∶00.04±0.00a0.03±0.00d0.03±0.00c0.03±0.00bC18∶01.36±0.04a1.03±0.00d1.10±0.00b1.06±0.00cC18∶13.35±0.00d4.13±0.06a3.82±0.00b3.73±0.00cC18∶22.27±0.00c3.24±0.00a3.19±0.00b3.16±0.00bcC18∶30.05±0.00c0.07±0.00a0.06±0.00b0.06±0.00bC18∶30.05±0.00c0.06±0.00a0.06±0.00b0.06±0.00bC20∶00.03±0.00a0.03±0.00a0.03±0.00a0.03±0.00aC20∶30.04±0.00b0.05±0.24a0.05±0.00a0.04±0.00bC20∶40.08±0.00b0.09±0.00a0.09±0.00a0.09±0.00aC22∶00.02±0.00a0.02±0.00a0.02±0.00a0.02±0.00aC22∶10.05±0.00b0.06±0.00a0.06±0.00a0.06±0.00aSFA4.25±0.35a3.05±0.30b3.38±0.30b3.43±0.17bMUFA4.05±0.00c5.02±0.06a4.68±0.00b4.59±0.00bPUFA2.50±0.00b3.50±0.10a3.44±0.00a3.41±0.00a
2.3.7 挥发性物质的测定结果
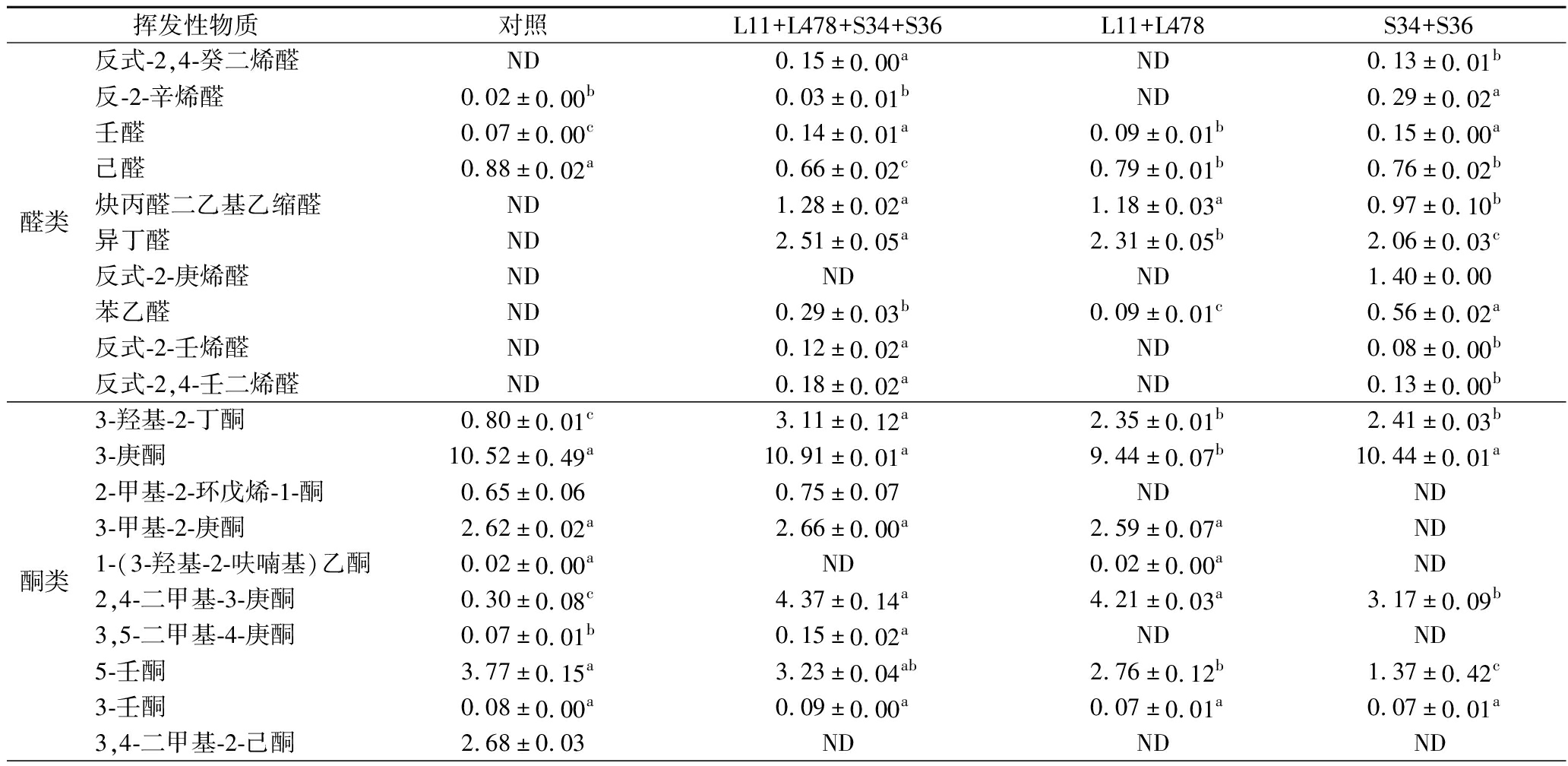
挥发性物质主要由碳水化合物代谢、氨基酸代谢和脂质氧化代谢产生[20]。如表5所示,L11+L478+S34+S36组共检测出30种挥发性物质,其中包括醛类、醇类、酮类、酯类和酸类,其次是S34+S36组(21种)和L11+L478组(20种),对照组(19种)最少,表明接种发酵能有效增加风干猪肉中挥发性物质的种类。
表5 风干猪肉中挥发性物质的含量 单位:μg/kg Table 5 Content of volatile substances in air-dried pork
挥发性物质对照L11+L478+S34+S36L11+L478S34+S36醛类反式-2,4-癸二烯醛ND0.15±0.00aND0.13±0.01b反-2-辛烯醛0.02±0.00b0.03±0.01bND0.29±0.02a壬醛0.07±0.00c0.14±0.01a0.09±0.01b0.15±0.00a己醛0.88±0.02a0.66±0.02c0.79±0.01b0.76±0.02b炔丙醛二乙基乙缩醛ND1.28±0.02a1.18±0.03a0.97±0.10b异丁醛ND2.51±0.05a2.31±0.05b2.06±0.03c反式-2-庚烯醛NDNDND1.40±0.00苯乙醛ND0.29±0.03b0.09±0.01c0.56±0.02a反式-2-壬烯醛ND0.12±0.02aND0.08±0.00b反式-2,4-壬二烯醛ND0.18±0.02aND0.13±0.00b酮类3-羟基-2-丁酮0.80±0.01c3.11±0.12a2.35±0.01b2.41±0.03b3-庚酮10.52±0.49a10.91±0.01a9.44±0.07b10.44±0.01a2-甲基-2-环戊烯-1-酮0.65±0.060.75±0.07NDND3-甲基-2-庚酮2.62±0.02a2.66±0.00a2.59±0.07aND1-(3-羟基-2-呋喃基)乙酮0.02±0.00aND0.02±0.00aND2,4-二甲基-3-庚酮0.30±0.08c4.37±0.14a4.21±0.03a3.17±0.09b3,5-二甲基-4-庚酮0.07±0.01b0.15±0.02aNDND5-壬酮3.77±0.15a3.23±0.04ab2.76±0.12b1.37±0.42c3-壬酮0.08±0.00a0.09±0.00a0.07±0.01a0.07±0.01a3,4-二甲基-2-己酮2.68±0.03NDNDND
续表5
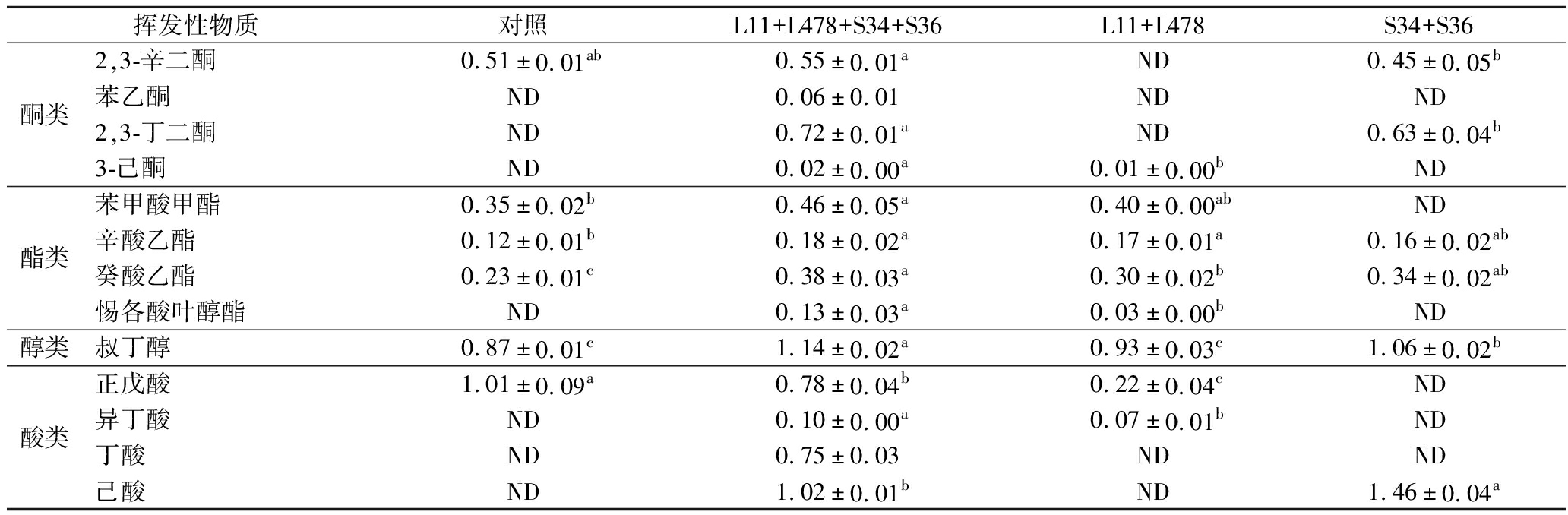
挥发性物质对照L11+L478+S34+S36L11+L478S34+S36酮类2,3-辛二酮0.51±0.01ab0.55±0.01aND0.45±0.05b苯乙酮ND0.06±0.01NDND2,3-丁二酮ND0.72±0.01aND0.63±0.04b3-己酮ND0.02±0.00a0.01±0.00bND酯类苯甲酸甲酯0.35±0.02b0.46±0.05a0.40±0.00abND辛酸乙酯0.12±0.01b0.18±0.02a0.17±0.01a0.16±0.02ab癸酸乙酯0.23±0.01c0.38±0.03a0.30±0.02b0.34±0.02ab惕各酸叶醇酯ND0.13±0.03a0.03±0.00bND醇类叔丁醇0.87±0.01c1.14±0.02a0.93±0.03c1.06±0.02b酸类正戊酸1.01±0.09a0.78±0.04b0.22±0.04cND异丁酸ND0.10±0.00a0.07±0.01bND丁酸ND0.75±0.03NDND己酸ND1.02±0.01bND1.46±0.04a
注:ND表示未检测到。
醛类主要由脂肪酸氧化产生,具有较低气味阈值,是发酵肉制品的关键风味化合物[21]。具有青草味的己醛可反映脂质氧化程度,在4组风干猪肉中对照组己醛含量(0.88 μg/kg)显著高于3个接菌组(P<0.05),L11+L478+S34+S36组、L11+L478组和S34+S36组相比对照组分别降低25%、10%和13%,说明接种发酵能抑制风干猪肉脂质氧化,且复配接种乳酸菌和葡萄球菌效果最佳。对照组中呈果香和脂肪香的壬醛含量显著低于3个接菌组(P<0.05),同样呈果香和脂肪香的苯乙醛未检测出,而3个接菌组都检测出苯乙醛,表明接种发酵能促进风干猪肉风味物质形成。酮类物质主要由不饱和脂肪酸氧化降解产生,气味阈值较低,赋香能力较强,具有果香、奶香、脂肪香和花香等气味。L11+L478+S34+S36组共检测出12种酮类物质,具有花香和杏仁香气的苯乙酮仅在L11+L478+S34+S36组被检测到,呈奶香味的2,3-辛二酮和具有乳香和果香味的3-羟基-2-丁酮含量均最高,其中3-羟基-2-丁酮含量显著高于其他3组(P<0.05),其中L11+L478组未检测出2,3-辛二酮,可能是在乳酸菌的作用下转化成其他物质[22]。具有良好酯类、水果和酒香气味的酯类,其气味阈值较低,并对促进风干猪肉风味有显著贡献[23],L11+L478+S34+S36组检测出的4种酯类化合物含量均为最高;醇类具有芳香味,其气味阈值较高,只检测出叔丁醇,对照组中的含量(0.87 μg/kg)显著低于L11+L478+S34+S36组(1.14 μg/kg)、S34+S36组(1.06 μg/kg)(P<0.05);酸类与醇类一样可酯化成酯类,可提供酸味和香味,L11+L478+S34+S36组中检测出酸性物质最多,表明乳酸菌和葡萄球菌复配接种更能丰富风干猪肉风味。
2.3.8 生物胺的测定结果
在发酵肉制品中,生物胺的形成机制为:内源酶和外源酶首先降解蛋白质生成游离氨基酸,这些氨基酸在微生物作用下,通过脱羧反应或转氨/胺化作用形成生物胺并释放CO2,人们若食用含生物胺超标的食品会对其产生毒害作用[24]。由图8可看出,4组风干猪肉的总生物胺含量在加工过程中均呈升高趋势,从滚揉后升高速度加快,对照组在干燥后总生物胺含量最高(245.62 mg/kg),依次是S34+S36组(213.83 mg/kg)、L11+L478组(205.74 mg/kg)和L11+L478+S34+S36组(200.47 mg/kg)(P<0.05)。乳酸菌与葡萄球菌复配接种于风干猪肉中,可显著抑制加工过程中生物胺的积累,从而能有效降低风干猪肉的安全风险。
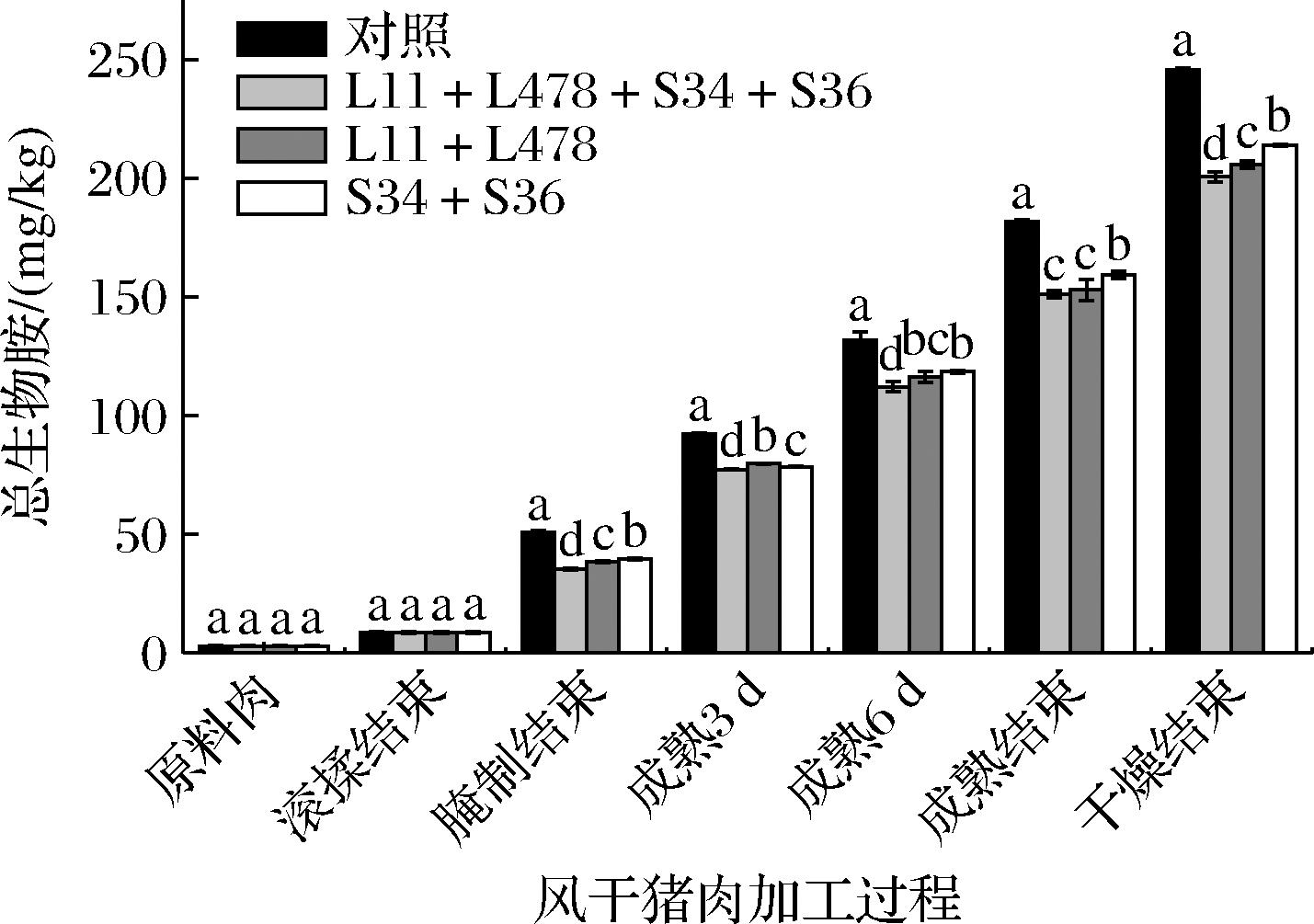
图8 风干猪肉加工过程中总生物胺含量的变化
Fig.8 Changes of total biogenic amines content in air-dried pork during processing
3 结论
本研究将前期从风干猪肉筛选得到的具有蛋白酶和脂肪酶活力的L11、L478、S34和S36以混菌发酵剂(L11∶L478∶S34∶S36=2∶1∶1∶1、L11∶L478=2∶1、S34∶S36=1∶1)的形式接种于风干猪肉中,以不接菌为对照组,进行相关指标的分析,结果表明,相比于乳酸菌复配发酵、葡萄球菌复配发酵和自然发酵,乳酸菌和葡萄球菌复配发酵更能增加风干猪肉中优势菌种(乳酸菌和葡萄球菌)数量,降低其Aw和pH,利于贮藏,显著改善风干猪肉的气味、滋味、色泽和质构。接种的菌株均具有产酶性能,可促进风干猪肉中脂肪和蛋白质降解,抑制其脂质氧化,乳酸菌和葡萄球菌复配组风干猪肉的MUFA和PUFA含量均高于其他3个组,其挥发性物质种类和含量增多,风干猪肉风味得到丰富,其生物胺总量也显著低于其他3个组(P<0.05),结果说明相比于乳酸菌复配发酵和葡萄球菌复配发酵,乳酸菌和葡萄球菌复配发酵更能改善风干猪肉食用品质,提高风干猪肉的整体接受度和食用安全性。
本研究将风干猪肉的生产周期缩短为14 d,采用多菌株复合发酵生产风干猪肉,以不接菌的风干猪肉作为对照组,探究多菌株复合与接种发酵对风干猪肉品质和食用安全性的作用,实验结果表明人工接种和控制发酵条件可以提高产品的质量和食用安全性。
[1] WU J Y, GUAN R F, CAO G Z, et al.Antioxidant and antimicrobial effects of catechin liposomes on Chinese dried pork[J].Journal of Food Protection, 2018, 81(5):827-834.
[2] 王丹, 孙学颖, 刘建林, 等.腌腊肉制品生物胺含量及其品质的分析比较[J].食品研究与开发, 2022, 43(3):79-86.WANG D, SUN X Y, LIU J L, et al.Analysis and qualitative comparison of biogenic amines in cured meat[J].Food Research and Development, 2022, 43(3):79-86.
[3] 王俊钢, 李宇辉, 蒲顺昌, 等.不同产蛋白酶乳酸菌对风干牛肉品质影响及安全性评价[J].食品与生物技术学报, 2023, 42(12):72-81.WANG J G, LI Y H, PU S C, et al.Effects of different protease-producing lactic acid bacteria on quality and safety of dried beef[J].Journal of Food Science and Biotechnology, 2023, 42(12):72-81.
[4] 杨海荣. 葡萄球菌产蛋白酶条件优化及粗酶液对香肠品质的影响[D].扬州:扬州大学, 2009.YANG H R.Optimization of protease production conditions by Staphylococcus and the effect of crude enzyme solution on the quality of sausage[D].Yangzhou:Yangzhou University, 2009.
[5] 张开屏, 田建军, 景智波, 等.产脂肪酶乳酸菌对羊肉发酵香肠脂肪酸的影响[J].农业工程学报, 2020, 36(12):310-320.ZHANG K P, TIAN J J, JING Z B, et al.Influences of lactic acid bacteria producing lipase on fatty acids of mutton fermented sausage[J].Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(12):310-320.
[6] CORRAL S, SALVADOR A, BELLOCH C, et al.Improvement the aroma of reduced fat and salt fermented sausages by Debaromyces hansenii inoculation[J].Food Control, 2015, 47:526-535.
[7] 彭健斌. 发酵羊肉脯工艺优化及货架期预测研究[D].杭州:浙江大学, 2021.PENG J B.Study on the process optimization and shelf life prediction of fermented mutton jerky[D].Hangzhou:Zhejiang University, 2021.
[8] 张楠. 川味香肠中组胺降解菌的筛选鉴定及其对组氨酸脱羧酶基因表达的影响[D].雅安:四川农业大学, 2018.ZHANG N.Screening, identification and influence on histidine decarboxylase gene expression of histamine degrading bacteriums in sichuan-style sausage[D].Ya’an:Sichuan Agricultural University, 2018.
[9] LI B B, XU Y, LI J, et al.Effect of oxidized lipids stored under different temperatures on muscle protein oxidation in Sichuan-style sausages during ripening[J].Meat Science, 2019, 147:144-154.
[10] SUN F D, HU Y Y, YIN X Y, et al.Production, purification and biochemical characterization of the microbial protease produced by Lactobacillus fermentum R6 isolated from Harbin dry sausages[J].Process Biochemistry, 2020, 89:37-45.
[11] 罗玉龙, 赵丽华, 王柏辉, 等.苏尼特羊不同部位肌肉挥发性风味成分和脂肪酸分析[J].食品科学, 2017, 38(4):165-169.LUO Y L, ZHAO L H, WANG B H, et al.Analysis of volatile components and fatty acid composition in muscles from different anatomical locations of sunite sheep[J].Food Science, 2017, 38 (4):165-169.
[12] 蒋云露, 王猛, 常伟, 等.传统风吹肉加工过程中的微生物演替及优势菌群分析[J].食品科学, 2015, 36(7):111-116.JIANG Y L, WANG M, CHANG W, et al.Microbial community succession and dominant microbial population during the processing stages of traditional air-dried meat[J].Food Science, 2015, 36(7):111-116.
[13] 刘世琳. 不同产蛋白酶乳酸菌对风干牛肉蛋白质的影响[D].石河子:石河子大学, 2021.LIU S L.Effects of different protease-producing lactic acid bacteria on the protein of air-dried beef[D].Shihezi:Shihezi University, 2021.
[14] 杨腊梅, 郭自宏, 洪祥雨, 等.乳酸菌和葡萄球菌接种发酵对四川酱肉品质的影响[J].食品与发酵工业, 2025, 51(2):126-132.YANG L M, GUO Z H, HONG X Y, et al.Effect of lactic acid bacteria and Staphylococcus inoculation and fermentation on quality of Sichuan sauce meat[J].Food and Fermentation Industries, 2025, 51(2):126-132.
[15] 刘雨萱. 传统四川腊肉中生物胺减除菌株的筛选及初步应用[D].雅安:四川农业大学, 2022.LIU Y X.Screening and preliminary application of biogenic amine-reducing strains in traditional Sichuan bacon[D].Ya’an:Sichuan Agricultural University, 2022.
[16] 王吉. 脂质降解菌株的筛选及在发酵香肠中的应用[D].太原:山西农业大学, 2022.WANG J.Screening of lipid-degrading bacteria and their application in fermented sausages[D].Taiyuan:Shanxi Agricultural University, 2022
[17] GRANVOGL M, SCHIEBERLE P.Thermally generated 3-aminopropionamide as a transient intermediate in the formation of acrylamide[J].Journal of Agricultural and Food Chemistry, 2006, 54(16):5933-5938.
[18] 高寒. 气液微萃取技术联用GC-MS检测牛肉中游离脂肪酸[D].延边:延边大学, 2022.GAO H.Determination of free fatty acids in beef by gas-liquid microexraction combined with GC-MS[D].Yanbian:Yanbian University, 2022.
[19] LIU Y, SHEN N, XIN H W, et al.Unsaturated fatty acids in natural edible resources, a systematic review of classification, resources, biosynthesis, biological activities and application[J].Food Bioscience, 2023, 53:102790.
[20] SHAO X F, WANG H H, SONG X Y, et al.Effects of different mixed starter cultures on microbial communities, taste and aroma compounds of traditional Chinese fermented sausages[J].Food Chemistry:X, 2024, 21:101225.
[21] GUO B R, WU Q, JIANG C C, et al.Inoculation of Yarrowia lipolytica promotes the growth of lactic acid bacteria, Debaryomyces udenii and the formation of ethyl esters in sour meat[J].Food Microbiology, 2024, 119:104447.
[22] 毛永强, 贠建民, 赵风云, 等.二次接种时间对腊肉挥发性风味的影响[J].食品科学, 2022, 43(2):285-293.MAO Y Q, YUN J M, ZHAO F Y, et al.Effect of second inoculation time on the volatile flavor of fermented dry-cured meat[J].Food Science, 2022, 43(2):285-293.
[23] 封莉, 邓绍林, 黄明, 等.脂肪酶对中式香肠脂肪降解、氧化和风味的影响[J].食品科学, 2015, 36(1):51-58.FENG L, DENG S L, HUANG M, et al.Effect of palatase on lipid hydrolysis, lipid oxidation and sensory attributes of Chinese sausage[J].Food Science, 2015, 36(1):51-58.
[24] QIN S, ZENG X M, JIANG M, et al.Genomic and biogenic amine-reducing characterization of Lactiplantibacillus planatraum JB1 isolated from fermented dry sausage[J].Food Control, 2023, 154:109971.