糖代谢异常是威胁人类健康的突出问题。我国因糖代谢异常导致的肥胖超重者近3亿,糖尿病患者及糖耐量受损者近2.5亿。淀粉占人体总能量摄入的55%~70%,淀粉消化导致血糖上升,是引发糖代谢异常症状的重要因素[1]。天然慢消化谷物原料中的膳食纤维具有调节肠道菌群、改善糖脂代谢及降低结肠癌风险等益生元效应,但其中的粗纤维组分食用后会加重肠道炎症症状,对于肠道功能受损人群来说适用性有限。相比之下,抗性淀粉(resistant starch,RS)兼具谷物膳食纤维的优势,且能避免粗纤维对肠道炎症的加重现象。Ⅲ型抗性淀粉(type Ⅲ resistant starch,RS3)又叫重结晶型RS,作为一种新型的膳食纤维,可以有效控制糖代谢异常症状,在控制人体体重、降脂、预防糖尿病等方面发挥有益作用[2]。
当前食品工业中,通常使用高直链淀粉制备RS。但由于其产量有限且成本较高,限制了其在工业规模上的应用。因此,本研究选择使用成本相对较低、产量较高的蜡质玉米淀粉(waxy corn starch, WCS)作为替代原料,经乙醇诱导后制备RS3。WCS是一种因体外消化特性和成本效益等而被广泛使用的谷物原料[3]。然而,WCS的低RS含量值以及不耐热性限制了其在食品中的应用。通过压热处理(heat-moisture treatment,HMT)、溶剂诱导或酶解脱支等制备方法得到的RS3,因其被改善的消化特性、耐热性以及较平稳的餐后血糖反应,为食品工业提供了新的原料选择[4]。KHAN等[5]对玉米粉进行酶法改性制备RS3并应用于饼干,并观察到其在适口性和色泽参数上的显著差异,使得饼干的脆度和口感得到改善。目前,DENG等[6]使用乙醇改变淀粉重结晶体系的溶剂条件,发现在有机溶剂诱导下产物中有序的单螺旋结构发生改变。得出乙醇具有诱导直链淀粉结晶结构形成、提高产物结晶度的作用,从而有利于提高RS3产物抗消化性。FANG等[7]研究发现,不同压热温度对淀粉样品体外消化结果、热稳定性等都有显著影响。
营养棒是一种即食方便产品,它不仅能充饥,还含有优质营养(如蛋白质、碳水化合物、脂肪)[8],并可以提供不同的生理功能(如补充能量、膳食纤维,促进消化等)[9],在消费市场上占据较大空间。并因其携带方便,可以通过改变原料满足不同使用者的功能需求[10],成为广泛使用的功能性代餐食品[11]。
本研究以WCS为原料,通过对其进行脱支、乙醇诱导结晶及HMT,筛选出高抗性、高耐热性的HMT-RS3,最后以小麦粉和WCS为原料制备得到的HMT-RS3为主要成分,制作营养棒,并在感官、质构、体外消化等方面进行对比分析,为之后在食品应用中提供参考。
1 材料与方法
1.1 实验材料
WCS(支链含量95%以上),山东福洋生物有限公司;支链淀粉酶微生物[来源于枯草芽孢杆菌(E2412)]、淀粉葡萄糖苷酶[来源于黑曲霉(260 U/mL,A7095,EC 3.2.1.3)]、胰脂肪酶[来源于猪胰腺(8 USP,P7545,EC 232-468-9)],Sigma-Aldrich公司;葡萄糖检测试剂盒、直链淀粉含量试剂盒,北京利德曼生化股份有限公司;小麦粉,金象牌食品有限公司;食盐,中国盐业股份有限公司;鸡蛋,市售;其他所有试剂和化学品均为分析级。
1.2 实验设备
SP-10002型电子天平,五鑫衡器有限公司;HH-4J型恒温磁力搅拌水浴锅,常州恩培仪器制造有限公司;HH-1S型数显恒温油浴锅,常州荣华仪器制造有限公司;Arium comfort Ⅱ型超纯水仪,德国赛多利斯公司;FD-1B-80型真空冷冻干燥机,杭州川一实验仪器有限公司;PHSJ-3F型pH计,上海仪电科学仪器有限公司;ZD-88型全温段培养摇床,常州恒德仪器制造有限公司;TDL-5C型低温台式大容量离心机,上海安亭科学仪器厂;TMS-Pro型质构仪,美国FTC公司;D8 ADVANCE型X射线衍射仪,德国Bruker公司。
1.3 实验方法
1.3.1 脱支蜡质玉米淀粉(debranched waxy corn starch, DWS)制备
准确称取80.0 g WCS分散于800 mL醋酸-醋酸钠缓冲液(pH 5.2,0.1 mol/L)中,置于1 000 mL锥形瓶中,然后将锥形瓶在100 ℃的恒温油浴锅中,以300 r/min的搅拌速度持续加热并搅拌30 min,以完成淀粉的糊化过程。糊化结束后,将含有淀粉糊化液的锥形瓶进行冷水浴,冷却至58 ℃后,转移到恒温水浴锅中保持58 ℃。随后加入5 mL普鲁兰酶,以300 r/min的搅拌速度混匀,且在58 ℃下密封保温反应1、2、4、8、12、24 h。酶解后为了完全终止反应并使酶灭活,将含有酶解液的锥形瓶转移至沸水浴锅中加热40 min。然后趁热将锥形瓶中的混合物以4 500 r/min的转速离心10 min,以获得透明的脱支淀粉酶解液,将酶解液真空冷冻干燥,得到不同脱支时间DWS,收集备用。
1.3.2 高抗性RS3制备
将1.3.1节制得的脱支淀粉酶解液置于4 ℃冰箱中重结晶24 h,重结晶完成后,将混合液以4 500 r/min的转速离心10 min,收集沉淀并真空冷冻干燥。称取5.0 g DWS于500 mL锥形瓶中,加入100 mL去离子水,将锥形瓶置于100 ℃沸水浴中,以300 r/min搅拌15 min,以完成淀粉的糊化过程。将无水乙醇按照乙醇-水体积比为4∶2加入糊化液中,随后转移至4 ℃冰箱中重结晶24 h。重结晶完成后,将混合液以4 500 r/min的转速离心10 min,收集沉淀。将沉淀真空冷冻干燥,得到RS3,收集淀粉粉末备用。分别称取2.0 g DWS和RS3淀粉粉末,添加去离子水使体系水分含量为30%,随后在室温下密封放置6 h以上,使样品达到平衡状态。将平衡后的样品置于高压灭菌锅内保持120 ℃压热5 min,随后将样品置于40 ℃电热恒温鼓风干燥箱内烘干12 h,过100目筛,分别得到压热脱支蜡质玉米淀粉(HMT-DWS)和耐热型重结晶抗性淀粉(HMT-RS3)。
1.3.3 直链淀粉含量分析
脱支淀粉的直链淀粉含量使用Megazyme直链淀粉/支链淀粉K-AMYL试剂盒测定。主要测试步骤为:准确称取20~25 mg淀粉样品置于10 mL的离心管中,加入1 mL二甲基亚砜并涡旋混匀。随后将离心管置于沸水加热15 min,确保样品中没有结块。将离心管置于室温下保存5 min,加入5 mL 95%(体积分数)乙醇水溶液涡旋混匀,再加入4 mL无水乙醇颠倒混匀。将离心管在室温下静置15 min以上。在3 400 r/min下离心5 min,收集沉淀,并在薄纸上放置10 min。确保乙醇全部挥发。得到的沉淀物用于测定直链淀粉含量。将沉淀物置于50 mL离心管中加入2 mL二甲基亚砜并在沸水浴中加热15 min,加热结束后立即加入伴刀豆凝集素A溶剂(Con A溶剂)定容至25 mL,此为溶液A。随后将1 mL溶液A置于5 mL离心管中,加入0.5 mL Con A溶液,离心管在室温下放置1 h后,以14 000 r/min离心10 min,将1 mL上清液转移至15 mL的离心管中。加入3 mL 100 mmol/L pH 4.5的乙酸钠缓冲液,将溶液pH值降低至5左右。混匀内容物,并将离心管置于沸水浴中加热5 min,随后将离心管置于40 ℃恒温水浴锅中平衡5 min。加入0.1 mL淀粉葡糖苷酶/α-淀粉酶混合物,在40 ℃下孵育30 min。在3 400 r/min下离心5 min。然后在1 mL上清液的中加入4 mL葡萄糖氧化酶-过氧化物酶(glucose oxidase-peroxidase,GOPOD)试剂。在40 ℃下孵育20 min。测定在510 nm处的吸光度。同时将0.5 mL溶液A与4 mL 100 mmol/L pH 4.5的乙酸钠缓冲液混合均匀。加入0.1 mL淀粉葡萄糖苷酶/α-淀粉酶混合物,在40 ℃下孵育10 min。向离心管中转移1 mL溶液,并添加4 mL GOPOD试剂,混合均匀。在40 ℃下孵育20 min,测定在510 nm处的吸光度,此为总淀粉吸光度。根据吸光度值计算直链淀粉含量(%),计算如公式(1)所示:
直链淀粉含量![]()
(1)
式中:66.8为稀释因子。
1.3.4 微观结构分析
通过扫描电镜观察WCS、DWS、HMT-DWS和HMT-RS3的表面形貌,将淀粉样品粉末均匀分散,并固定在预先黏有导电胶的样品台上,将固定好样品的样品台置于真空喷金仪中,进行喷金处理,在5 kV加速电压下观察样品的颗粒形貌差异。
1.3.5 体外消化分析
根据ENGLYST等[12]的测定方法略有修改,对样品进行蒸煮稳定性测试。具体如下:准确称取0.30 g淀粉样品、0.025 g瓜尔胶以及5颗3.5 mm玻璃珠加入50 mL的离心管中,随后加入7.5 mL去离子水,将样品于沸水浴蒸煮10 min,每2 min涡旋混匀一次,然后继续沸水浴2 min,结束后加入2.5 mL醋酸缓冲溶液,涡旋混合均匀。将混合物置于37 ℃、转速160 r/min的气浴恒温振荡器中预热10 min,之后再加入2.5 mL混合酶溶液,混匀置于37 ℃振荡器中继续反应。在反应进行到20 min和120 min时,分别取0.125 mL酶解液置于含有5 mL体积分数为66%约乙醇的10 mL离心管中,迅速涡旋混匀,以3 400 r/min离心10 min,得到上清液。采用GOPOD法测定在每个时间点释放的葡萄糖含量,操作条件如下:从每个离心管中分别取3份上清液,每份10 μL,置于酶标板中,再加入200 μL葡萄糖测定试剂,放置于37 ℃气浴恒温振荡器中反应30 min。随后将酶标板转移至酶标仪中,测定上清液在510 nm处的吸光值。根据吸光值计算20 min和120 min时淀粉样品被消化生成的葡萄糖含量G20和G120。计算如公式(2)~公式(4)所示:
RDS/%=0.9×G20×100
(2)
SDS/%=0.9×(G120-G20)×100
(3)
RS/%=100-RDS-SDS
(4)
式中:0.9,葡萄糖中淀粉的化学计量常数;RDS(rapidly digestible starch),快消化淀粉(20 min内消化);SDS(slowly digestible starch),慢消化淀粉(20~120 min内消化);RS,抗性淀粉(120 min后未消化)。
1.3.6 营养棒制备
参照文献[13-14]的方法制备营养棒,具体方法如下:2.0 g黄油置于容器中加热熔化后加入7.0 g鸡蛋液搅拌均匀,随后加入0.05 g食盐和12.0 g小麦粉混合均匀制成面团,将21.05 g面团装入矩形模具中,并用刮刀刮平,随后在150 ℃烤箱烤制20 min获得营养棒。为了得到不同RS3添加量的营养棒,分别用0、1.0、2.0、3.0、4.0和5.0 g RS3替代相同质量的小麦粉,在相同条件下制备含有不同RS3添加量的营养棒,用于感官评价、质构特性和消化特性分析。
1.3.7 感官评价分析
营养棒的感官特性采用9分制评分法进行主观评估,范围从1(非常不喜欢)到9(非常喜欢)。挑选10名经过感官属性相关培训的人员,样本在盲测条件下食用,参与者在开始测试前和2次测试之间,用纯净水进行漱口。采用IMTIAZ等[15]的评定方法,并加以修改,营养棒制备后冷却30 min进行感官测试。按照表1的评分标准对其色泽、口感、气味、结构和总体接受度5个方面进行综合评定。
表1 营养棒感官评价标准
Table 1 Sensory evaluation of nutrition bars

感官指标评分标准评分色泽色泽均匀, 无焦边7~9色泽基本均匀, 有少许焦边4~6色泽不均匀、暗淡, 颜色过白或颜色过深1~3口感酥脆细腻, 不黏牙, 咸甜度适宜7~9略酥脆, 稍有黏牙, 咸甜度较适宜4~6过于松散或过硬, 只酥不脆或不酥不脆, 黏牙, 咸甜味不足或过重1~3气味整体香味适宜, 无异味7~9香味略淡或略重, 无明显异味4~6无香味或味道过于浓郁,有异味1~3结构外形完整,无变形,内部组织细腻, 断面细致均匀7~9外形完整, 少许变形,内部组织较为粗糙, 断面无层次4~6外形残缺散落,内部组织粗糙, 质地松垮易散1~3总体接受度质量好,可以接受7~9质量一般,勉强接受4~6质量差,不能接受1~3
1.3.8 营养棒质构特性分析
使用质构仪的全质构(texture profile analysis,TPA)模式测定营养棒硬度、脆度、咀嚼性等,参考吴悦洲等[16]的方法并稍做修改。选用圆柱形探头(直径35 mm),在TPA模式下对样品进行测试。测前、测时和测后速度均为60 mm/min;触发力0.2 N;量程100 N;高度15 mm;压缩形变30%。每个样品平行测定3次。
1.3.9 营养棒消化特性分析
营养棒的的体外消化特性测定方法同1.3.5节。
1.3.10 数据处理与分析
所有实验测试至少重复3次,结果用“平均值±标准差”表示。数据采用SPSS 27.0软件的单因素方差分析(ANOVA)和Duncan’s多重比较方法进行显著性分析(P<0.05)。
2 结果与分析
2.1 脱支淀粉直链淀粉含量分析
通过对WCS进行不同脱支时间处理,测得脱支产物的直链淀粉含量如表2所示。原WCS直链淀粉含量仅为9.83%,随着对其脱支时间的增加,直链淀粉含量也不断增加至93.58%,且在12 h之后趋于平稳(92.92%),这一结果与MIAO等[17]对WCS进行支链淀粉酶脱支后结果一致,直链淀粉含量在脱支12 h后基本保持不变。
表2 不同脱支时间直链淀粉含量 单位:%
Table 2 Effect of debranching time on amylose content
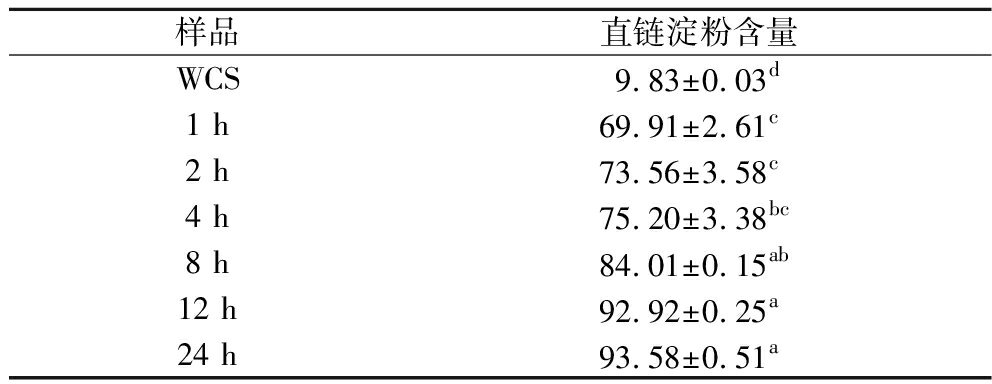
样品直链淀粉含量WCS9.83±0.03d1 h69.91±2.61c2 h73.56±3.58c4 h75.20±3.38bc8 h84.01±0.15ab12 h92.92±0.25a24 h93.58±0.51a
注:同一列不同字母代表差异性显著(P<0.05)(下同)。
2.2 微观结构分析
如图1所示,WCS呈现规则多边形,表面光滑致密,粒径分布均匀,具有天然淀粉的典型层状结构,这与XU等[18]观察WCS的表面形貌特征一致。而对WCS进行酶解脱支之后的DWS颗粒为无序团聚体,这可能是由于短直链淀粉分子排列无序,形成了无序结构。对DWS进行HMT后得到的样品改变了淀粉表面的致密度,未对样品的结构产生显著影响。对DWS进行乙醇诱导后进行HMT的样品横截面显示为明显的平行四边形,产物呈现为典型的淀粉单斜晶系生长特征[19]。双螺旋堆积紧密,最终形成具有长程有序特征的晶层结构[20]。

a-WCS;b-DWS;c-HMT-DWS;d-HMT-RS3
图1 WCS、DWS、HMT-DWS和HMT-RS3的扫描电镜图
Fig.1 Scanning electron micrographs of WCS, DWS, HMT-DWS and HMT-RS3
2.3 体外消化特性分析
淀粉的消化性主要取决于淀粉分子与淀粉酶的接触面积等,而接触面积与淀粉颗粒的形态特征密切相关。如表3所示,煮制后的WCS、DWS、HMT-DWS和HMT-RS3在RDS、SDS及RS含量上呈现显著差异。其中,WCS表现出显著的快速消化特性,其RDS含量高达63.36%,而RS含量仅为20.88%。类似地,ZHOU等[21]制备的脱支淀粉在未经其他处理的情况下,RS含量为21.16%。相比之下,经过重结晶处理的WCS的RS含量提升至24.28%,RDS含量为75.62%,尽管其抗消化性与WCS无显著差异,但RDS含量显著增加。结合微观结构分析可知,酶解脱支处理导致淀粉颗粒破裂,表面变得粗糙且部分结构松散,这种物理结构的变化加速了淀粉与酶的接触,从而使得RDS含量显著提高。进一步对重结晶后的WCS进行HMT后,其RDS含量降低至46.43%,而RS含量提升至39.72%。HMT通过使淀粉颗粒膨胀并形成致密的网络结构,显著增加了颗粒表面的致密度,从而阻碍了酶与淀粉分子的接触,导致RS含量显著提升。值得注意的是,经过乙醇诱导并结合HMT后得到的HMT-RS3表现出最高的RS含量(72.78%)。这是因为乙醇诱导处理促使RS形成了更为紧密的单斜晶系淀粉结晶结构,这种高度有序的结晶结构显著降低了淀粉对消化酶的接触性,从而显著提高了RS含量。ZHANG等[22]通过乙醇对DWS进行连续分馏,发现产物中RS含量最高可达58.6%。结果表明,通过乙醇溶剂调节DWS的重结晶环境,并结合HMT,可以显著改变淀粉的消化特性,从而赋予产品优异的膳食纤维特性。
表3 WCS和DWS、HMT-DWS和HMT-RS3的RDS、SDS 和 RS含量 单位:%
Table 3 RDS,SDS and RS contents of WCS,DWS,HMT-DWS,HMT-RS3
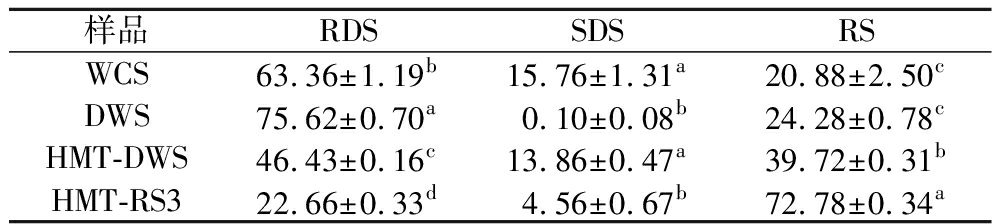
样品RDSSDSRSWCS63.36±1.19b15.76±1.31a20.88±2.50cDWS75.62±0.70a0.10±0.08b24.28±0.78cHMT-DWS46.43±0.16c13.86±0.47a39.72±0.31bHMT-RS322.66±0.33d4.56±0.67b72.78±0.34a
综上所述,淀粉颗粒的表面形貌对其抗消化能力具有显著影响。通过调控淀粉颗粒的物理结构和结晶特性,可以有效调控淀粉的消化行为,为开发功能性淀粉产品提供了理论依据。
2.4 HMT-RS3对营养棒感官特性的影响
感官评价可以直观地描述和判断食品质量,通过看、嗅、尝3个感官来判断食品的各项指标。如表4所示,HMT-RS3添加比例<9∶3时,RS的添加对营养棒的质构特性没有显著性影响。小麦粉∶RS3比例为9∶3时的营养棒在口感(6.92)以及结构(8.08)方面都高于对照组6.50、7.83(HMT-RS3添加比例为12∶0)。但当添加比例大于9∶3以后会对产品的口感和结构产生负面影响。同样的,在色泽以及气味也观察到了同样的趋势。HMT-RS3添加比例为9∶3时的总体可接受性得分为7.50,高于其他样品,表明此比例下消费者的总体接受度较高。类似地,BABU等[23]的研究结果表明,适量添加RS不会对面包感官产生负面影响,且会提高产品的口感和气味。
表4 不同小麦粉与HMT-RS3比例制备的营养棒的感官评分
Table 4 Sensory evaluation of nutrition bars prepared with different wheat flour and HMT-RS3 ratios
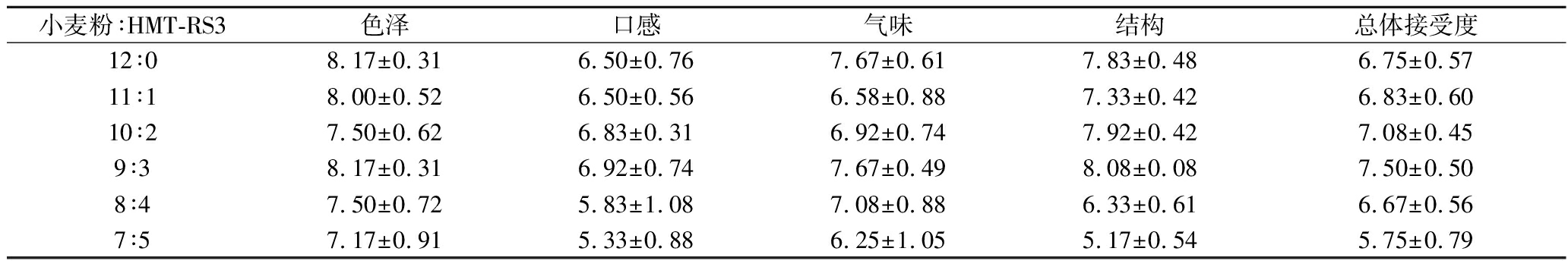
小麦粉∶HMT-RS3色泽口感气味结构总体接受度12∶08.17±0.316.50±0.767.67±0.617.83±0.486.75±0.5711∶18.00±0.526.50±0.566.58±0.887.33±0.426.83±0.6010∶27.50±0.626.83±0.316.92±0.747.92±0.427.08±0.459∶38.17±0.316.92±0.747.67±0.498.08±0.087.50±0.508∶47.50±0.725.83±1.087.08±0.886.33±0.616.67±0.567∶57.17±0.915.33±0.886.25±1.055.17±0.545.75±0.79
2.5 HMT-RS3对营养棒质构特性的影响
营养棒的硬度、内聚性、弹性、胶黏性、咀嚼性等质构特性是评价其质构品质的重要参数[24]。如表5所示,HMT-RS3的的添加对营养棒的硬度产生了影响,相较于对照样品,随着RS3添加量的增加,硬度并无显著性影响,但当小麦粉∶HMT-RS3比例达到7∶5时,硬度显著增加至35.84 N,影响咀嚼口感。类似地,MIYAZAKI等[25]研究了湿热处理的玉米淀粉对面团和面包特性的影响,研究表明,用压热处理过的玉米淀粉烘焙出的面包的大小和面包屑质地都有所增加,硬度没有明显差异。也有研究者发现面制品的硬度随着蜡质玉米淀粉的加入发生改变,当蜡质玉米淀粉含量为10%~15%对面包屑的质地特性具有积极影响,与对照组相比,降低了硬度和咀嚼性[26]。同样的,在本研究中发现,当HMT-RS3比例为9∶3时,营养棒的咀嚼性最低为14.71 mJ,而随着RS3的添加量的增加,咀嚼性增加至27.10 mJ。其次,不同比例下,营养棒的内聚性和弹性并无显著性差异。其中,HMT-RS3添加比例大于8∶4时,营养棒的质构特性不佳,硬度、胶黏性、咀嚼性都变差。BAIXAULI等[27]用较高含量的RS(20 g)制作的松饼的硬度、弹性、胶黏性和咀嚼性都有所下降。
表5 不同小麦粉与HMT-RS3比例制备的营养棒的质构特性
Table 5 Textural properties of nutrition bars prepared with different wheat flour and HMT-RS3 ratios
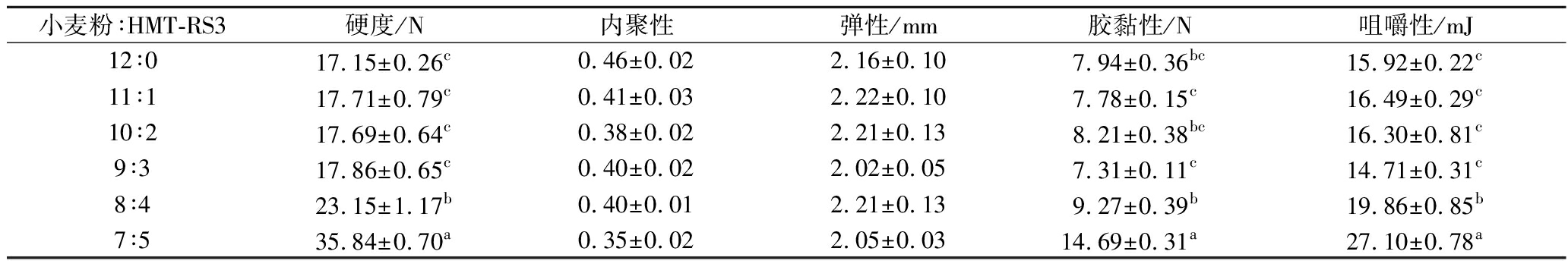
小麦粉∶HMT-RS3硬度/N内聚性弹性/mm胶黏性/N咀嚼性/mJ12∶017.15±0.26c0.46±0.022.16±0.107.94±0.36bc15.92±0.22c11∶117.71±0.79c0.41±0.032.22±0.107.78±0.15c16.49±0.29c10∶217.69±0.64c0.38±0.022.21±0.138.21±0.38bc16.30±0.81c9∶317.86±0.65c0.40±0.022.02±0.057.31±0.11c14.71±0.31c8∶423.15±1.17b0.40±0.012.21±0.139.27±0.39b19.86±0.85b7∶535.84±0.70a0.35±0.022.05±0.0314.69±0.31a27.10±0.78a
因此,HMT-RS3适宜的添加并不会改变产品的质构特性,这表明RS在食品加工具有很好的应用前景。
2.6 HMT-RS3对营养棒体外消化特性的影响
如表6所示,当HMT-RS3添加比例由12∶0提升至7∶5时,营养棒中碳水化合物的抗消化组分含量由42.84%增加到76.84%。其中,9∶3比例下,抗消化组分含量达 69.01%,且对质构特性及感官品质未产生明显的负面影响。继续提高 HMT-RS3 比例虽可进一步增加抗消化碳水化合物的比例,但造成质构特性劣变与感官品质下降。总体结果表明,9∶3添加比例可在不对质构与感官品质产生负面影响的前提下实现碳水化合物的抗消化组分含量最大化。CERVINI等[28]在无麸质饼干配方中使用退火白高粱淀粉有助于生产出具有慢消化淀粉特性的食品,而且可以在不严重影响食品感官和质构的情况下实现这一目标。LAGUNA等[29]得出研究结果,RS含量高的淀粉具有开发出富含纤维的饼干的良好潜力。
表6 不同小麦粉与HMT-RS3比例制备的营养棒RDS、SDS和RS含量 单位:%
Table 6 RDS,SDS, and RS contents of nutrition bars prepared from different wheat flour and HMT-RS3 ratios
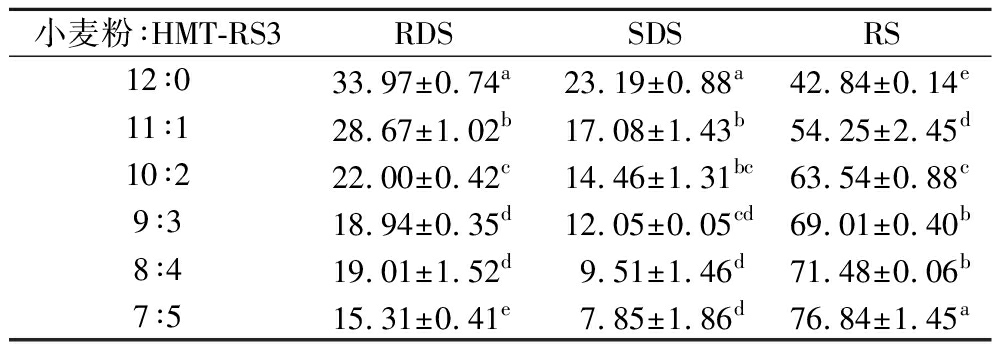
小麦粉∶HMT-RS3RDSSDSRS12∶033.97±0.74a23.19±0.88a42.84±0.14e11∶128.67±1.02b17.08±1.43b54.25±2.45d10∶222.00±0.42c14.46±1.31bc63.54±0.88c9∶318.94±0.35d12.05±0.05cd69.01±0.40b8∶419.01±1.52d9.51±1.46d71.48±0.06b7∶515.31±0.41e7.85±1.86d76.84±1.45a
3 结论与讨论
本研究成功通过乙醇诱导和HMT制备了高RS含量的HMT-RS3,并将其应用于营养棒的开发。实验结果表明,WCS经过脱支处理后,其直链淀粉含量显著提高,且在12 h后趋于稳定。通过乙醇诱导和HMT,HMT-RS3的RS含量达到72.78%,显著高于未经处理的WCS。在营养棒应用中,当HMT-RS3的添加比例为9∶3时,营养棒的感官特性和质构特性表现最佳,营养棒碳水化合物的抗消化组分含量达到69.01%,且对硬度、胶黏性和咀嚼性无显著负面影响。这表明乙醇诱导的HMT-RS3在营养棒中具有良好的应用前景,可作为优质膳食纤维来源,同时不影响产品的感官和质构品质。研究结果为RS3在功能性食品中的应用提供了技术依据,之后还需进一步探究RS3在不同食品基中的稳定性及贮藏期对其功能特性的影响,以拓宽其产业潜力。
[1] LUDWIG D S, HU F B, TAPPY L, et al.Dietary carbohydrates:Role of quality and quantity in chronic disease[J].BMJ, 2018, 361:k2340.
[2] CHEN X H, WANG Z R, WANG D, et al.Effects of resistant starch Ⅲ on the serum lipid levels and gut microbiota of Kunming mice under high-fat diet[J].Food Science and Human Wellness, 2023, 12(2):575-583.
[3] MURRAY B S, PHISARNCHANANAN N.The effect of nanoparticles on the phase separation of waxy corn starch+locust bean gum or guar gum[J].Food Hydrocolloids, 2014, 42:92-99.
[4] LU Z H, BELANGER N, DONNER E, et al.Debranching of pea starch using pullulanase and ultrasonication synergistically to enhance slowly digestible and resistant starch[J].Food Chemistry, 2018, 268:533-541.
[5] KHAN A, SIDDIQUI S, RAHMAN U U, et al.Physicochemical properties of enzymatically prepared resistant starch from maize flour and its use in cookies formulation[J].International Journal of Food Properties, 2020, 23(1):549-569.
[6] DENG C Y, ZHANG T T, ZHANG X M, et al.Multiscale structure and precipitation mechanism of debranched starch precipitated by different alcohols[J].International Journal of Biological Macromolecules, 2023, 241:124562.
[7] FANG G H, LIU K, GAO Q Y.Effects of heat-moisture treatment on the digestibility and physicochemical properties of waxy and normal potato starches[J].Foods, 2023, 12(1):68.
[8] IZZO M T, NINESS K R.Formulating nutrition bars with inulin and oligofructose[J].Cereal Foods World, 2001, 46:102-106.
[9] MALEKI G, SHADORDIZADEH T, MOZAFARI M R, et al.Physicochemical and nutritional characteristics of nutrition bar fortified with cowpea protein[J].Journal of Food Measurement and Characterization, 2023, 17(2):2010-2015.
[10] PALAZZOLO G.Cereal bars:They’re not just for breakfast anymore[J].Cereal Foods World, 2003, 48(2):70-72.
[11] AYAD A A, WILLIAMS L L, GAD EL-RAB D A, et al.A review of the chemical composition, nutritional and health benefits of dates for their potential use in energy nutrition bars for athletes[J].Cogent Food &Agriculture, 2020, 6(1):1809309.
[12] ENGLYST H N, KINGMAN S M, CUMMINGS J H.Classification and measurement of nutritionally important starch fractions[J].European Journal of Clinical Nutrition, 1992, 46(2):S33-S50.
[13] ALJALOUDI R, AL-DABBAS M M, HAMAD H J, et al.Development and characterization of high-energy protein bars with enhanced antioxidant, chemical, nutritional, physical, and sensory properties[J].Foods, 2024, 13(2):259.
[14] YOU X Y, DING Y, BU Q Y, et al.Nutritional, textural, and sensory attributes of protein bars formulated with mycoproteins[J].Foods, 2024, 13(5):671.
[15] IMTIAZ S R, KUHN-SHERLOCK B, CAMPBELL M.Effect of dairy protein blends on texture of high protein bars[J].Journal of Texture Studies, 2012, 43(4):275-286.
[16] 吴悦洲, 叶霞, 黄妙如, 等.金柚幼果膳食纤维提取优化及其在蛋白棒中的应用[J].食品与生物技术学报, 2022, 41(4):38-44.WU Y Z, YE X, HUANG M R, et al.Optimization of dietary fiber extraction from juvenile fruit of golden pomelo and its application in protein bar[J].Journal of Food Science and Biotechnology, 2022, 41(4):38-44.
[17] MIAO M, JIANG B, ZHANG T.Effect of pullulanase debranching and recrystallization on structure and digestibility of waxy maize starch[J].Carbohydrate Polymers, 2009, 76(2):214-221.
[18] XU J C, CHEN L, GUO X B, et al.Understanding the multi-scale structure and digestibility of different waxy maize starches[J].International Journal of Biological Macromolecules, 2020, 144:252-258.
[19] BULÉON A, VÉRON SE G, PUTAUX J L.Self-association and crystallization of amylose[J].Australian Journal of Chemistry, 2007, 60(10):706.
SE G, PUTAUX J L.Self-association and crystallization of amylose[J].Australian Journal of Chemistry, 2007, 60(10):706.
[20] MONTESANTI N, LANCELON-PIN C, POTOCKI-VERONESE G, et al.A-amylose single crystals:Influence of amylose concentration, crystallization temperature and surface induction on the crystal morphology[J].Cellulose, 2023, 30(13):8459-8473.
[21] ZHOU L Y, ZHENG X Y, YAN J H, et al.Preparation of debranched starch with high thermal stability and crystallinity using a novel thermal cycling treatment[J].Carbohydrate Polymers, 2024, 345:122583.
[22] ZHANG Y, XING B F, KONG D G, et al.Improvement of in vitro digestibility and thermostability of debranched waxy maize starch by sequential ethanol fractionation[J].International Journal of Biological Macromolecules, 2024, 254:127895.
[23] BABU A S, PARIMALAVALLI R.Impact of the addition of RS-Ⅲ prepared from sweet potato starch on the quality of bread[J].Journal of Food Measurement and Characterization, 2017, 11(3):956-964.
[24] 罗丽华,穆慧玲,杨昌林,等.蛋白棒的质构分析与感官评价研究[J].农业机械, 2012 (21):89-92.LUO L H, MU H L, YANG C L, et al.Texture analysis and sensory evaluation of protein bars[J].Farm Machinery, 2012 (21):89-92.
[25] MIYAZAKI M, MORITA N.Effect of heat-moisture treated maize starch on the properties of dough and bread[J].Food Research International, 2005, 38(4):369-376.
[26] WITCZAK M, KORUS J, ZIOBRO R, et al.Waxy starch as dough component and anti-staling agent in gluten-free bread[J].LWT, 2019, 99:476-482.
[27] BAIXAULI R, SANZ T, SALVADOR A, et al.Muffins with resistant starch:Baking performance in relation to the rheological properties of the batter[J].Journal of Cereal Science, 2008, 47(3):502-509.
[28] CERVINI M, FRUSTACE A, GARRIDO G D, et al.Nutritional, physical and sensory characteristics of gluten-free biscuits incorporated with a novel resistant starch ingredient[J].Heliyon, 2021, 7(3):e06562.
[29] LAGUNA L, SALVADOR A, SANZ T, et al.Performance of a resistant starch rich ingredient in the baking and eating quality of short-dough biscuits[J].LWT - Food Science and Technology, 2011, 44(3):737-746.