果蔬是人类膳食结构中不可或缺的重要组成部分,它富含维生素、矿物质、膳食纤维以及抗氧化物质等多种营养成分,对维持人体健康发挥关键作用。然而,果蔬采后极易受到微生物侵染,同时受自身生理代谢进程的影响,易发生腐烂变质、营养成分损失以及品质下降等问题。这些问题不仅造成巨大的经济损失,还可能引发食品安全隐患[1]。传统的果蔬保鲜手段主要包括低温冷藏、气调贮藏以及化学保鲜剂等。然而,低温冷藏面临能耗过高的难题,气调贮藏需要复杂的设备,化学保鲜剂又存在残留风险,对人体健康和生态环境造成潜藏威胁。
近年来,等离子体活化水(plasma-activated water,PAW)在果蔬减菌保鲜领域展现出了较好的应用前景,它是指通过对水(或其他液体)施加气体放电等离子体处理后产生的一种富含活性物质的液体。其灭菌原理主要是利用等离子体放电产生的活性氧/氮基团(reactive oxygen/nitrogen species,ROS/RNS)所具有的强氧化性,氧化并破坏微生物的细胞膜、蛋白质、DNA等生物大分子,导致细胞结构与功能受损[2]。PAW具有杀菌效果显著、作用均匀、绿色环保、流动性及渗透性能良好等优点。脉冲电场(pulsed electric field,PEF)技术通过施加高强度脉冲电场,使细胞两侧产生跨膜电位差,当跨膜电位差超过一定阈值时,细胞膜会出现穿孔现象[3],进而导致细胞内含物(如离子、蛋白质、核酸等)泄漏,破坏细胞正常的生理功能。PEF杀菌效率较高,处理后食品升温幅度小,能较好地保持食品的营养成分、色泽、风味和质地。
然而,在实际生产应用中,单一灭菌技术往往存在一定的局限性。以PAW为例,其活性成分的含量与性质会随时间推移而发生变化。若制备后未能及时使用,或贮存条件未能达到理想状态,其杀菌能力将逐渐下降,进而对保鲜效果的持续性与可靠性产生不利影响。而单一的PEF处理则面临能量损耗较大、杀菌效果受多种因素影响等问题。现有研究表明,PEF或 PAW与其他杀菌保鲜技术的联合应用,在食品保鲜领域表现出了巨大潜力。例如,SANZ-PUIG等[4]研究发现,PEF与天然抗菌剂联合使用时,前者能够显著提高微生物细胞膜的通透性,促进天然抗菌剂更容易进入细胞,从而提高其杀菌效果。ROYINTARAT等[5]研究发现,PAW 与超声波联合处理,能够显著提高PAW在食品中的穿透深度和杀菌效果。
从PAW和PEF杀菌机理推测,如果PAW与PEF联合应用,可能会增强PAW的杀菌效果,这在体外菌液体系中已被证实[6]。然而,目前关于PAW-PEF联合处理对果蔬的杀菌保鲜作用研究还未见报道。本研究以蓝莓为对象,对其进行单一PEF处理、PAW处理以及PAW-PEF联合处理,旨在探究 PAW-PEF 联合处理对蓝莓的杀菌保鲜效果,以期提供一种新的果蔬减菌保鲜方案。
1 材料与方法
1.1 材料与试剂
实验试剂:实验所用大肠埃希氏菌(Escherichia coli,菌种编号CGMCC1.90)来源于中国科学院微生物研究所(北京);实验所用蓝莓购自浙江省湖州市德清县秋山市场;NaCl、FeCl3、酚酞指示剂、红菲咯啉、NA培养基、LB肉汤培养基,杭州邦易化工有限公司;无水乙醇、HCl、抗坏血酸、KCl、邻苯二甲酸氢钾、乙酸钠,国药集团化学试剂有限公司;NaOH、H3PO4,杭州吉工生物科技有限公司;三氯乙酸、PCA培养基,杭州双木化工有限公司;所有试剂均为分析级。
1.2 仪器与设备
CTP-2000KP低温等离子体发生器,南京苏曼等离子体有限公司;DTPEF-1503高压脉冲电场灭菌实验机(pulsed electric field sterilizer),大连鼎通科技发展有限公司;TA-XT Plus-C质构仪,英国Stable Micro Systems公司;NR20XE精密色差仪,杭州彩谱科技有限公司;TU-1900双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;HX-4拍打式均质机,上海沪析实业有限公司;SCB-VF2A 超净工作台,苏州西班泰克净化设备有限公司;HYJD 超纯水仪,杭州永洁达净化科技有限公司;AR213电子精密天平,上海力衡仪器仪表有限公司;ZHWY-200B 恒温振荡摇床,上海智城分析仪器制造有限公司;LRH-250F 生化培养箱,上海一恒科学仪器有限公司;CR21-GⅡ高速冷冻离心机,日本日立公司;IMJ-54A 高压灭菌锅,上海施都凯仪器设备有限公司。
1.3 实验方法
1.3.1 样品准备
将经过活化后的E.coli在NA平板上划线培养。采用无菌接种环挑取单个菌落,接种于20 mL的LB肉汤液体培养基中,在37 ℃、150 r/min下振荡培养12 h。培养结束后的菌悬液浓度约为108~109 CFU/mL,再在无菌生理盐水(质量分数为0.90%)中进行连续梯度稀释,得到浓度约为104 CFU/mL 的E.coli悬液。
参考GAN等[7]的方法进行细菌的接种,并稍作修改。挑选大小颜色相近,且无机械损伤与腐烂的蓝莓,清洗干净后将其浸泡在体积分数为75%的乙醇溶液中1 min,进行表面消毒,随后用无菌水冲洗5次,去除残留乙醇,随后将蓝莓置于超净台上干燥 20 min。再将蓝莓果实浸没于浓度约为104 CFU/mL 的E.coli菌液中接种,浸泡20 min后取出样品,置于超净工作台中约30 min,室温风干,以使菌液更好地附着在样品上,整个接种过程在无菌环境下进行。
1.3.2 蓝莓的PAW-PEF联合处理
图1为PAW-PEF联合处理蓝莓的设备结构示意图。其中,PAW的制备基于气-液界面电晕放电(corona discharge, CD)技术,该装置主体为柱状树脂有机玻璃反应器(高:200 mm,直径:100 mm),将直径<1 mm的不锈钢针状阳极通过固定装置垂直安装于反应器内腔,上下电极分别与高压等离子体发生器连接并接地。将体积为100 mL的纯水泵入反应器中后,调节不锈钢针状阳极与液面之间的距离,在反应器中进行电晕放电。图1中所用的PEF设备(长76.7 cm,宽69.5 cm,高169.3 cm)配有高压输出转换装置,可将输入的AC220V电压转换为脉冲电场所需的高电压。通过设备上方的控制面板可以精确设置脉冲的电压、频率和占空比。当PEF发生器将高压脉冲施加到杯壁厚度为1.5 mm的电极杯(高14.5 cm,直径5.0 cm)内的电极上时,电极之间会形成高强度PEF。
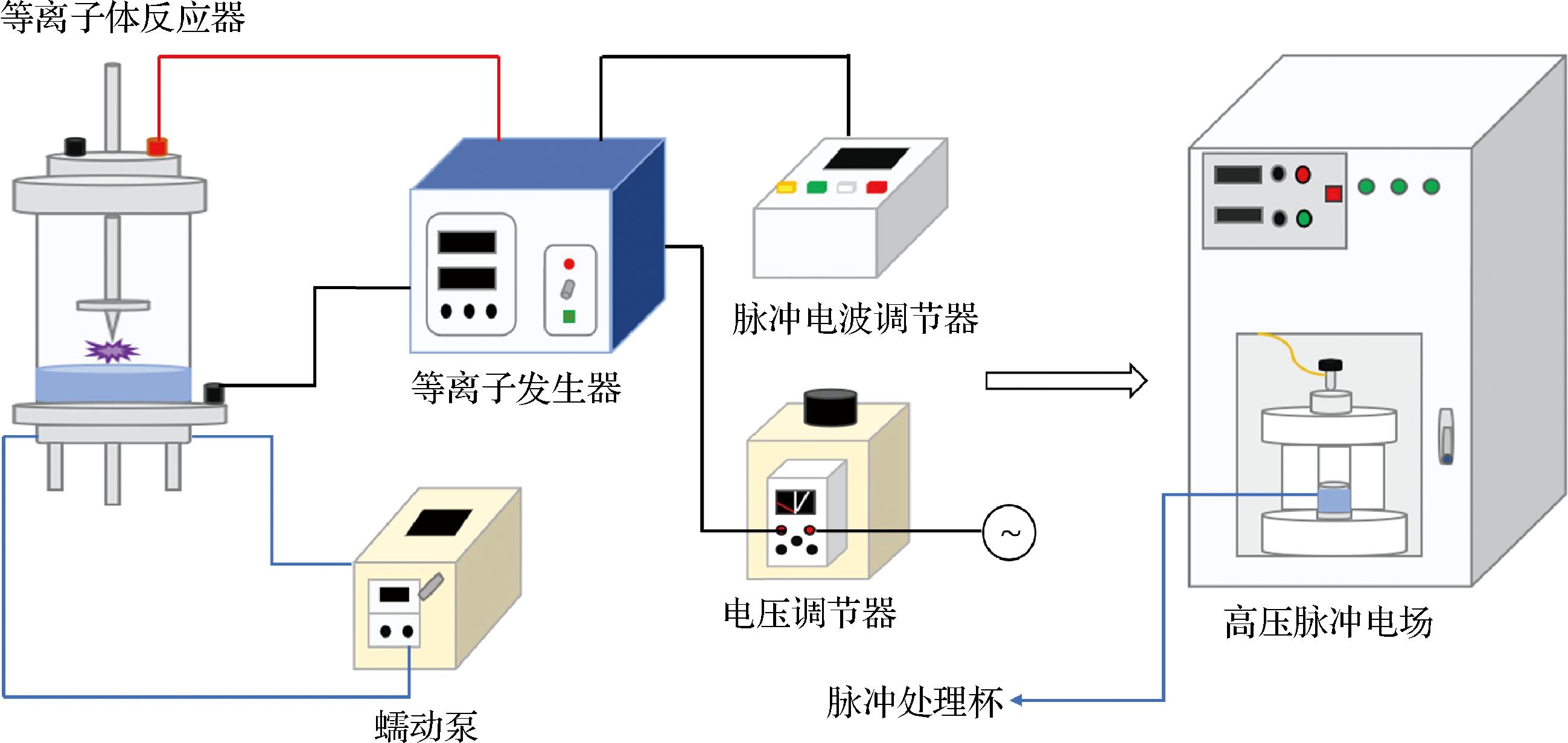
图1 PAW-PEF 联合处理的设备结构示意图
Fig.1 Schematic diagram of the equipment structure for PAW-PEF co-treatment
对接种后的蓝莓样品分别进行PEF、PAW、PAW-PEF联合处理。PAW处理方法为称取约200 g蓝莓样品,浸泡于预先制备的250 mL PAW中,确保样品与PAW充分接触。于室温条件下静置30 min。PEF处理方法为随机选取4~5颗蓝莓,均匀地放置于处理杯的电极间,避免果实间相互重叠,以确保电场分布的均匀性。随后,分别加入20 mL PAW或无菌生理盐水(质量分数0.90%),使液体完全浸没样品,将电极杯放置于处理室中,连接电极并确认电路连接稳定,进行脉冲处理。PEF处理参数设定如下:处理时间80 s,电场强度25 kV/cm,频率700 Hz,脉冲占空比34.9%。PAW-PEF联合处理方法如下:首先按照上述PAW处理方法对蓝莓样品进行处理,随后以PAW为介质,按照上述PEF处理参数进行处理。单一PEF处理则是以无菌生理盐水为介质,按照上述PEF处理参数进行处理。以未处理的蓝莓样品作为对照组。处理后的样品置于超净工作台中晾干,并分别用12 cm × 18 cm的无菌均质袋分装。分装后将所有样品均于4 ℃条件下贮藏待分析。
1.3.3 测定项目与方法
1.3.3.1 菌落总数的测定
菌落总数的测定参照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》并稍作修改。称取5 g蓝莓样品,加入至45 mL无菌生理盐水(质量分数为0.85%)中,再用均质器拍打2 min后,使得蓝莓充分破碎并与生理盐水混合均匀,得到1∶10的样品匀液,随后按照10倍梯度进行稀释。吸取100 μL稀释液于PCA平板涂布,将涂布后的平板放入37 ℃恒温培养箱中,培养(48±2)h后进行菌落计数。实验结果表示为lg CFU/g,每组进行3次重复实验。
1.3.3.2 蓝莓表观形态及表皮色度的测定
参考史洁莹等[8]的方法并做适当修改。贮藏的第0、1、2、4、6天,从每个贮藏组中随机选取 5 颗蓝莓,使用精密色差仪测量果实表面的颜色参数,包括L*、a*、b*,分别表示亮度、红绿值、黄蓝值。每个果实测量3个不同部位(顶部、中部、底部),取平均值作为该果实的颜色参数值。色度(C*)按公式(1)计算:
(1)
同时,在贮藏的第0、1、2、4、6天对样品拍照记录,观察蓝莓表观形态的变化。
1.3.3.3 失重率的测定
使用称重法进行失重率分析,失重率按公式(2)进行计算:
失重率![]()
(2)
式中:m0,蓝莓的初始质量,g;mt,蓝莓贮藏后的质量,g。
1.3.3.4 硬度测定
参考KIM等[9]的方法并做适当修改。从每个贮藏组中随机选取10颗蓝莓,使用质构仪测量果实的硬度。选用柱形探头P/2N(直径2 mm),设置参数为:测前速度1.00 mm/s,测中速度1.00 mm/s,测后速度5.00 mm/s,位移10.00 mm,触发力5.0 g。将质构仪的探头垂直于果实正上方,缓慢施加压力,直到探头刺入果实中心部位至一定深度,测定每组10颗蓝莓硬度值,单位为g。
1.3.3.5 可滴定酸(titratable acid,TA)含量的测定
参考刘敏等[10]的方法测定蓝莓样品中的TA含量,并做适当修改。从每个贮藏组中称取5 g蓝莓匀浆样品转移至100 mL容量瓶中,加入50 mL蒸馏水,摇匀,静置30 min后,在5 000 r/min下离心10 min。取20 mL上清液于锥形瓶中,加入2滴质量分数为1%的酚酞指示剂,摇匀。利用邻苯二甲酸氢钾对配制好的0.1 mol/L NaOH溶液浓度进行标定,随后装入碱式滴定管中,排尽气泡,记录初始读数。然后用NaOH溶液滴定上清液,边滴边摇动锥形瓶,直至溶液初显粉色且30 s内不褪色,即为滴定终点(pH=8.1~8.3)。对蒸馏水进行滴定,作为空白对照。
根据NaOH溶液的消耗量,计算样品中TA含量,以质量分数表示,计算如公式(3)所示:
TA含量![]()
(3)
式中:V,样品提取液总体积,mL;c,NaOH滴定溶液的浓度,mol/L;V1,滴定试液时消耗NaOH滴定溶液的体积,mL;V0,空白试验时消耗NaOH滴定溶液的体积,mL;f,酸的换算系数,按柠檬酸=0.064换算[8];Vs,滴定时所取滤液体积,mL;m,样品质量,g。
1.3.3.6 花青素含量的测定
蓝莓果实中花青素的含量采用pH示差法[11]测定。称取20 g蓝莓匀浆样品加入100 mL 体积分数为60%的乙醇(含体积分数0.2%的HCl溶液),在避光条件下将样品置于40 ℃水浴浸提30 min,随后在功率100 W及水浴温度60 ℃的条件下超声,避光提取50 min,以加速花青素的溶出。在4 ℃、6 000 r/min下离心10 min,取1 mL上清液,分别用0.025 mol/L KCl缓冲液(pH=1.0)和 0.4 mol/L乙酸钠(pH=4.5)稀释样品,稀释倍数设为15.3倍[12]。使用紫外分光光度计分别测定稀释后样品在520 nm和700 nm处的吸光度。花青素含量以矢车菊素-3-O-葡萄糖苷当量表示,计算如公式(4)所示:
花青素含量![]()
(4)
式中:ΔA=(A520-A700)(pH=1.0)-(A520-A700)(pH=4.5);M,矢车菊素-3-O-葡萄糖苷的分子质量,449.2 g/mol;DF,稀释倍数;V,提取液总体积,mL;ε,摩尔吸光系数,26 900 L/(mol· cm);L,比色皿厚度,1 cm;m,样品质量,g。
1.3.3.7 抗坏血酸含量的测定
参考分光光度法[13]并稍作修改,采用4,7 -二苯基-1,10 -菲咯啉(bathophenanthroline,BP)比色法测定蓝莓中的抗坏血酸含量。称取10 g经均质器拍打破碎的蓝莓果肉样品,在冰浴条件下加入 20 mL质量分数为 5%的TCA溶液制成匀浆,再使用相同浓度的TCA溶液定容至100 mL。混合液反应10 min后在8 000 r/min下离心 10 min,收集上清液。取1 mL上清液加入1 mL TCA溶液(质量分数为 5%)和1 mL无水乙醇混合均匀,再依次加入体积分数为0.4%的磷酸-乙醇溶液0.5 mL、5 g/L的BP-乙醇溶液1 mL和0.3 g/L的FeCl3-乙醇溶液0.5 mL,混合均匀后在30 ℃水浴中反应60 min。于534 nm下测量吸光度值,结果以mg/100 g表示,计算如公式(5)所示:
抗坏血酸含量![]()
(5)
式中:m1,根据标准曲线求得抗坏血酸的质量,μg;Vs,测定时所用样品中提取液体积,mL;V,样品提取液总体积,mL;m2,样品质量,g。
1.3.4 数据分析
采用Excel 2019对数据进行整理,采用SPSS Statistics 26对数据进行单因素方差分析(analysis of variance,ANOVA),P值采用Duncan法多重比较,P<0.05表示差异显著。使用Origin 2021绘图。每个实验进行3次重复。
2 结果与分析
2.1 PAW-PEF联合处理对蓝莓的杀菌保鲜作用
由图2所示,随着贮藏时间的延长,样品中菌落总数呈现持续上升的趋势。贮藏第0天时,对照组的初始菌落总数为(4.91±0.07) lg CFU/g,单一PEF处理、单一PAW处理及PAW-PEF联合处理可分别降低(0.63±0.13)、(0.48±0.08)、(1.28±0.06) lg CFU/g,各处理组的菌落总数均显著低于对照组(P<0.05)。由图中还可看出,在相同的贮藏时间下,相较于单一PEF和单一PAW处理组,PAW-PEF联合处理组的菌落总数最少,减菌效果最好。贮藏时间延长至第4天时,对照组的菌落总数为(8.02±0.06) lg CFU/g,单一PEF处理、单一PAW处理及PAW-PEF联合处理组的菌落总数分别较对照组降低(0.56±0.13)、(0.67±0.11)、(1.20±0.11) lg CFU/g。贮藏第6天时,对照组的菌落总数增加至(8.55±0.08) lg CFU/g,单一PEF处理、单一PAW处理及PAW-PEF联合处理组分别较对照组降低(0.59±0.09)、(0.37±0.17)、(1.22±0.22) lg CFU/g。由此可知,PAW-PEF联合处理显著抑制了蓝莓贮藏期间微生物的增殖,且其效果明显优于单一PAW或单一PEF处理。
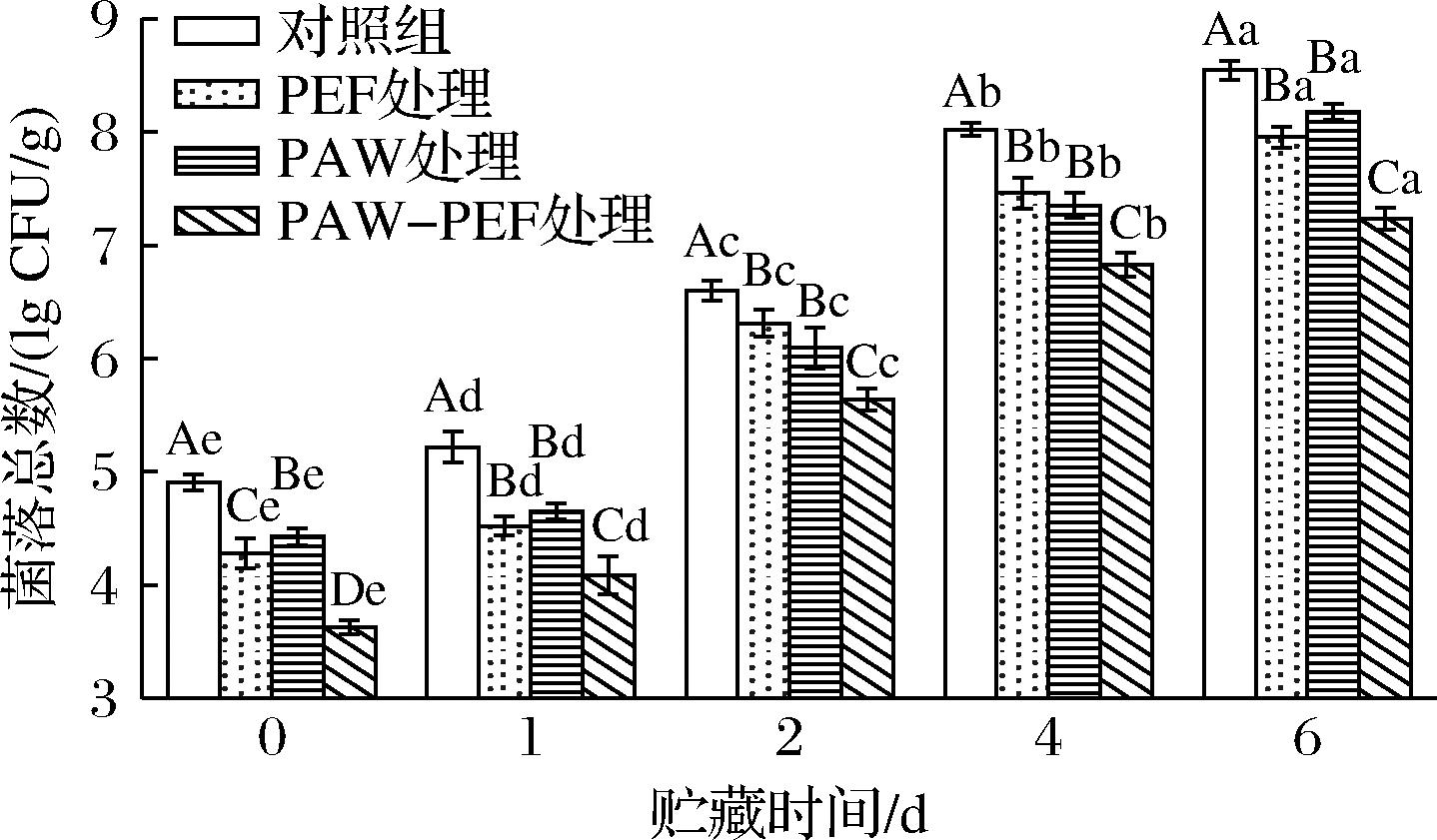
图2 PAW-PEF联合处理对贮藏期间蓝莓菌落总数的影响
Fig.2 Effect of PAW-PEF co-treatment on the total colony counts in blueberries during storage
注:不同小写字母表示同一处理组不同贮藏天数的显著性差异,不同大写字母表示同一贮藏天数不同处理组别的显著性差异,均有统计学意义(P<0.05)(下同)。
2.2 PAW-PEF联合处理对蓝莓表观形态的影响
如图3所示,在贮藏第0天时,新鲜蓝莓果实形状饱满,无明显变形、干瘪或软烂现象,果实整体较为紧实,外表无皱缩和腐烂现象。对照组果实在第1天时果皮出现皱缩现象,果肉颜色加深,而从贮藏第2天开始,单一PEF处理组和单一PAW处理组蓝莓开始出现部分塌陷或变形现象,果实的饱满度降低。当贮藏时间延长至4、6 d时,对照组果肉颜色加深,腐烂情况加重,果实出现严重的软烂现象。单一PEF处理组和单一PAW处理组中的多数蓝莓外观形态已经受到严重破坏,有明显的腐烂迹象。这是由于细胞结构被大量破坏,细胞内的水分和营养物质大量流失,导致果实无法维持原有的形状和硬度。PAW-PEF联合处理组的果实直至第4天时才出现轻微皱缩现象,且色泽无明显变化,大部分果实形态饱满。这可能是由于PAW-PEF联合处理对蓝莓表面起到了一定的清洁和杀菌作用,减少了微生物对蓝莓表皮的侵蚀,同时可能也在一定程度上抑制了蓝莓自身的氧化反应,有助于保持色泽。

图3 对照组与不同处理组蓝莓果实在贮藏期间表观形态变化
Fig.3 Changes in the morphology of blueberries in the control group and different treatment groups during storage
2.3 PAW-PEF联合处理对蓝莓表皮色度的影响
如表1所示,贮藏0~6 d内,各贮藏组的L*值逐渐下降,说明蓝莓果实表皮的亮度逐渐降低。贮藏至第6天时,对照组、单一PEF处理、单一PAW处理及PAW-PEF联合处理样品的L*值分别由第0天的初始值分别下降了33.83%、29.94%、22.39%及19.92%,PAW-PEF联合处理优于单独处理,能够更有效地延缓蓝莓表皮色泽变暗,保持蓝莓果实表皮亮度。基于a*和b*值计算得色度值C*,C*值反映了蓝莓表皮颜色的鲜艳程度,a*和C*值随贮藏时间的变动不大,b*值整体上呈增大的趋势,表明果实表皮逐渐从亮蓝色转变为深蓝色。
表1 PAW-PEF联合处理对贮藏期间蓝莓色泽的影响
Table 1 Effect of PAW-PEF co-treatment on the color of blueberries during storage

处理方式贮藏时间/dL∗a∗b∗C∗对照组076.908±1.314b0.762±0.208a-1.570±0.217a1.750±0.265a173.067±0.828b0.929±0.291ab-1.460±0.576b1.733±0.636a264.252±1.023d0.825±0.275bc-1.285±0.342ab1.540±0.382ab458.520±5.806b0.860±0.416a-0.766±0.234a1.184±0.366a650.888±2.940d1.099±0.596a-0.930±0.698b1.523±0.729aPEF处理077.473±0.736b0.656±0.105ab-1.263±0.301a1.437±0.226a173.447±0.577b1.071±0.376a-1.240±0.502b1.661±0.550a266.413±1.120c1.001±0.316ab-1.509±0.321b1.839±0.274a460.041±1.086b0.795±0.327ab-0.969±0.314a1.293±0.281a654.277±1.467c1.118±0.153a-0.242±0.269a1.169±0.150abPAW处理078.238±4.220b0.408±0.143c-1.677±0.681a1.734±0.672a173.846±1.424b0.936±0.340ab-1.245±0.499b1.560±0.597a269.157±0.853b1.169±0.076a-1.370±0.061ab1.801±0.093a466.598±0.915a0.413±0.258b-1.194±0.164a1.279±0.209a660.723±2.508b0.251±0.179b-0.849±0.222b0.905±0.196bPAW-PEF处理082.181±0.442a0.507±0.071bc-1.814±0.209a1.886±0.192a176.367±0.442a0.579±0.076b-0.325±0.101a0.666±0.106b271.685±1.915a0.672±0.127c-1.045±0.229a1.256±0.165b467.714±0.611a0.628±0.162ab-1.360±0.889a1.529±0.837a665.808±0.881a0.516±0.056b-1.055±0.298b1.179±0.278ab
注:同一列中不同小写字母表示同一贮藏时间下不同处理组别之间差异显著(P<0.05)。
2.4 PAW-PEF联合处理对蓝莓失重率的影响
MANNOZZI等[14]研究指出,果实内水分向外环境的迁移是导致水果重量减轻的主要原因。从图4可以发现,对照组和处理组的失重率在贮藏期间均呈逐渐上升的趋势,且相较于对照组、单一PEF和单一PAW处理组,PAW-PEF联合处理组失重率的上升速度最慢。贮藏第1天时,对照组样品的失重率为1.07%,单一PEF处理、单一PAW处理及PAW-PEF联合处理的失重率分别为0.70%、0.87%、0.52%。贮藏至第6天时,处理组与对照组的失重率差异显著(P < 0.05),其中,单一PEF处理、单一PAW处理及PAW-PEF联合处理的失重率分别为4.34%、4.79%及3.10%,对照组样品的失重率增加至5.26%,分别是单一PEF处理、单一PAW处理及PAW-PEF联合处理组的1.21、1.10、1.69倍。上述结果表明,在相同的贮藏时间下,PAW-PEF联合处理组的质量损失最少,表明PAW-PEF联合处理比单独处理能够更有效地减少蓝莓果实水分的流失,延缓贮藏过程中蓝莓的质量损失。
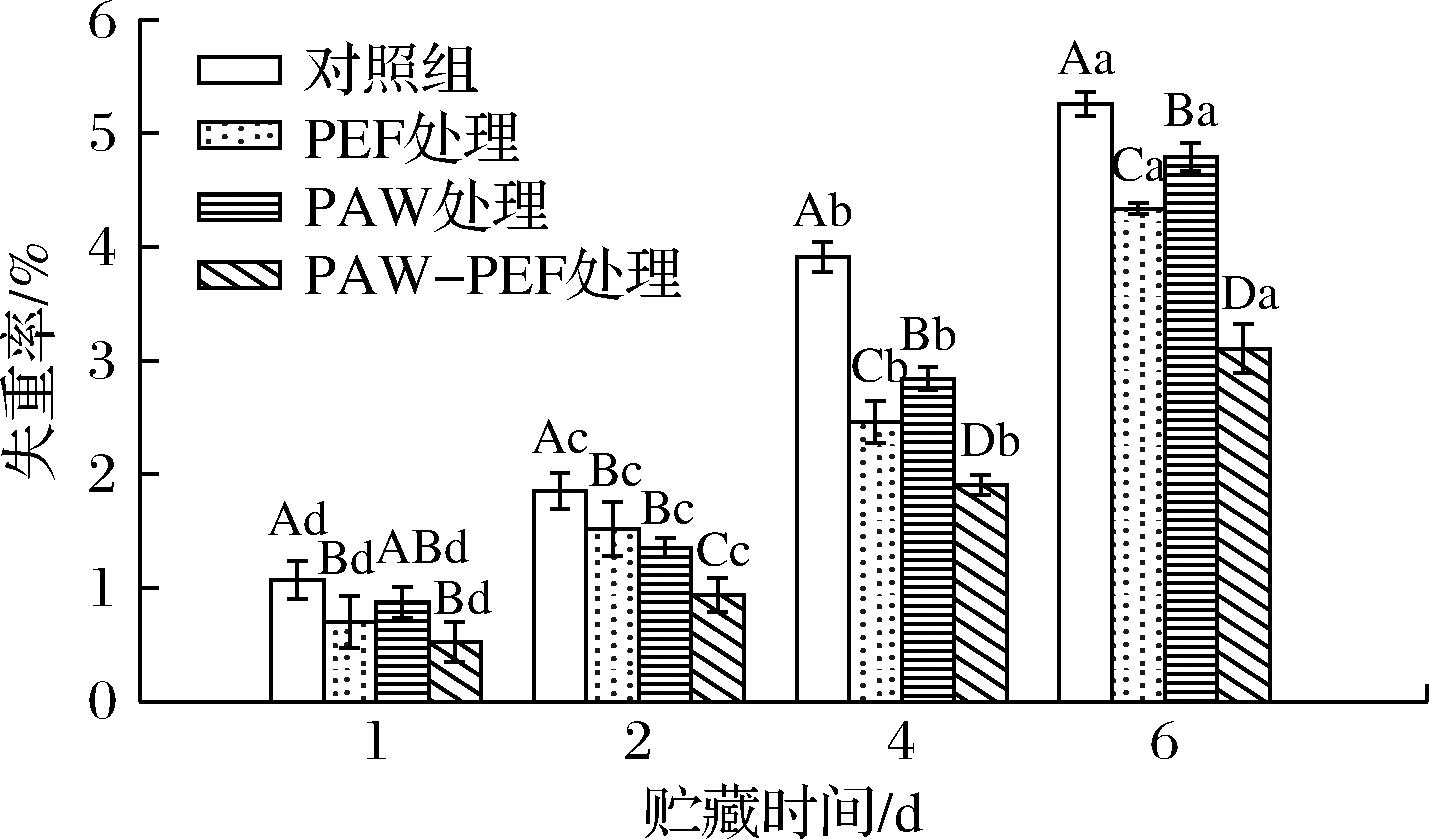
图4 PAW-PEF联合处理对贮藏期间蓝莓失重率的影响
Fig.4 Effect of PAW-PEF co-treatment on the weight loss rate of blueberries during storage
2.5 PAW-PEF联合处理对蓝莓硬度的影响
硬度是浆果重要的感官属性,并与品质密切相关。贮藏期间蓝莓中果胶和纤维素等大分子物质的降解会导致果实硬度降低[15]。图5显示了PAW-PEF联合处理对蓝莓在贮藏期间硬度的影响。由图可知,随着贮藏时间的延长,蓝莓的硬度值逐渐降低,且与对照组、单一PEF处理和单一PAW处理相比,PAW-PEF联合处理组蓝莓硬度的下降趋势更为平缓。在贮藏0 d时,对照组与处理组样品硬度无显著变化(P>0.05),其中对照组样品的硬度值为69.72 g,单一PEF处理、单一PAW处理及PAW-PEF联合处理的硬度值分别为73.43、71.30、75.55 g。贮藏时间为1~6 d,对照组、单一PEF处理、单一PAW处理及PAW-PEF联合处理组的硬度值分别由64.73、70.56、67.01、73.31 g降至38.24、46.52、50.14、58.01 g,分别下降了40.92%、34.06%、25.18%及20.87%。可见相较于单独处理组,PAW-PEF联合处理组样品的硬度值下降率最低。这可能是由于联合处理可显著减少附着在蓝莓表面的微生物含量,抑制了细菌的生长繁殖,延缓了蓝莓的过度软化。且结合贮藏期间蓝莓失重率的变化来看,PAW-PEF联合处理有助于减少果实内容物外渗和水分蒸发,保持果实内部的水分和营养成分,从而更好地保持果实硬度。
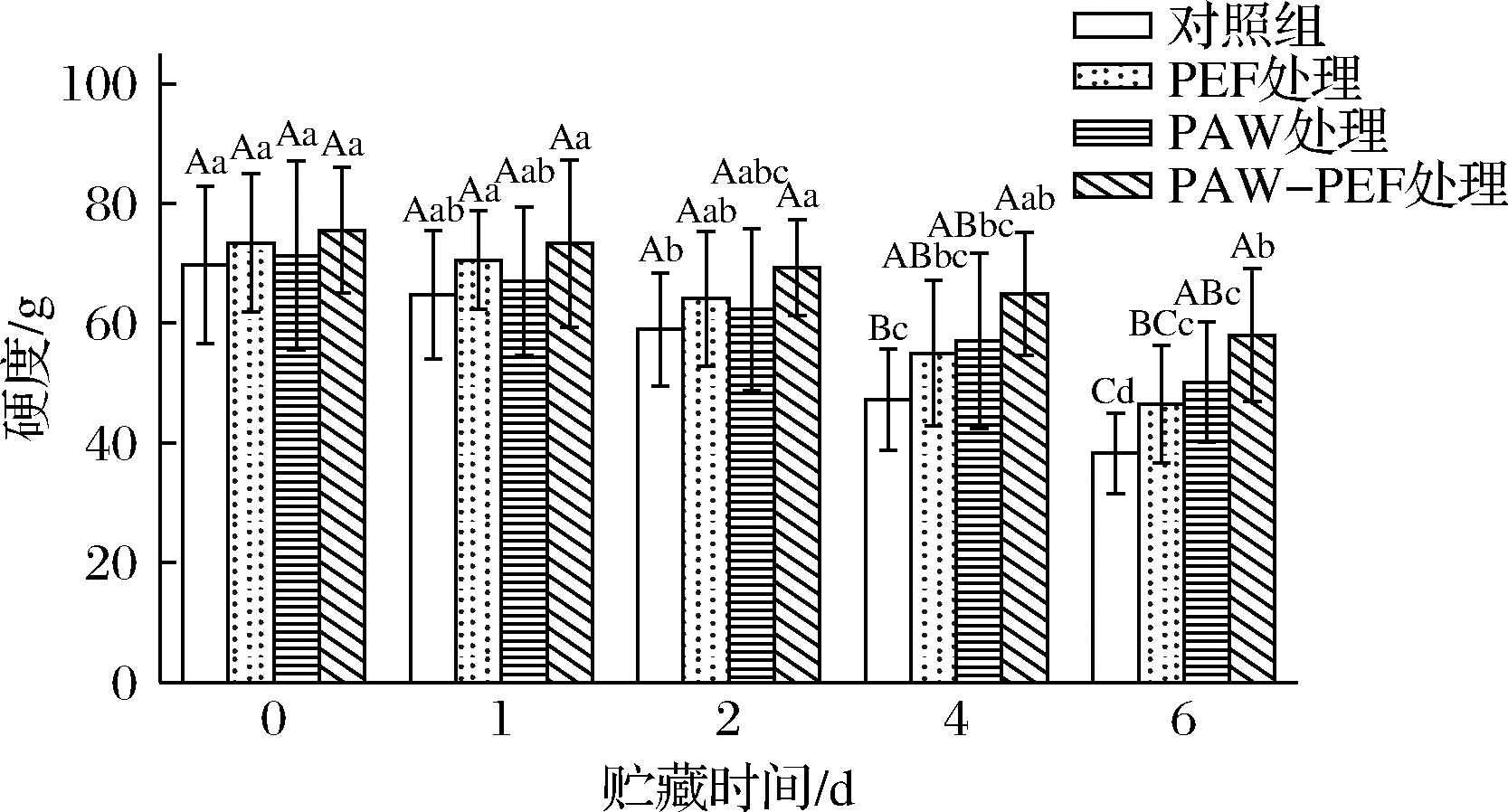
图5 PAW-PEF联合处理对贮藏期间蓝莓硬度的影响
Fig.5 Effect of PAW-PEF co-treatment on the hardness of blueberries during stoage
2.6 PAW-PEF联合处理对蓝莓TA含量的影响
TA是指在化学分析中,能用标准碱液滴定测定出的具有酸性物质的总量,在水果中通常包括柠檬酸、苹果酸等多种有机酸。TA通过与糖类物质共同构成特定糖酸比来决定水果的风味口感,也可作为判断水果成熟度的参考依据,同时可参与水果细胞内代谢调节的生理过程,在维持细胞酸碱平衡中发挥重要作用[16]。
如图6所示,蓝莓样品的TA含量在贮藏过程中整体上呈逐渐降低的趋势。相较于处理组,对照组样品的TA含量显著下降。这一现象是由贮藏过程中,蓝莓果实的呼吸作用分解体内的有机物,有机酸被不断消耗所致[17],且E.coli侵染可能会刺激蓝莓的呼吸作用,加快有机酸作为呼吸底物的消耗。贮藏第0天时,对照组、单一PEF处理、单一PAW处理及PAW-PEF联合处理样品中的TA含量分别为0.77%、0.88%、0.83%及0.85%,与对照组相比,处理组样品的TA含量稍有上升。这可能归因于以下原因:一方面,PAW中的活性成分能够调节果实内的代谢过程,促进有机酸的合成和积累[7]。另一方面,PEF处理增强了果实细胞的渗透性,使细胞膜通透性改变[18],可能会促进液泡中有机酸的释放,使得可滴定酸含量增加。
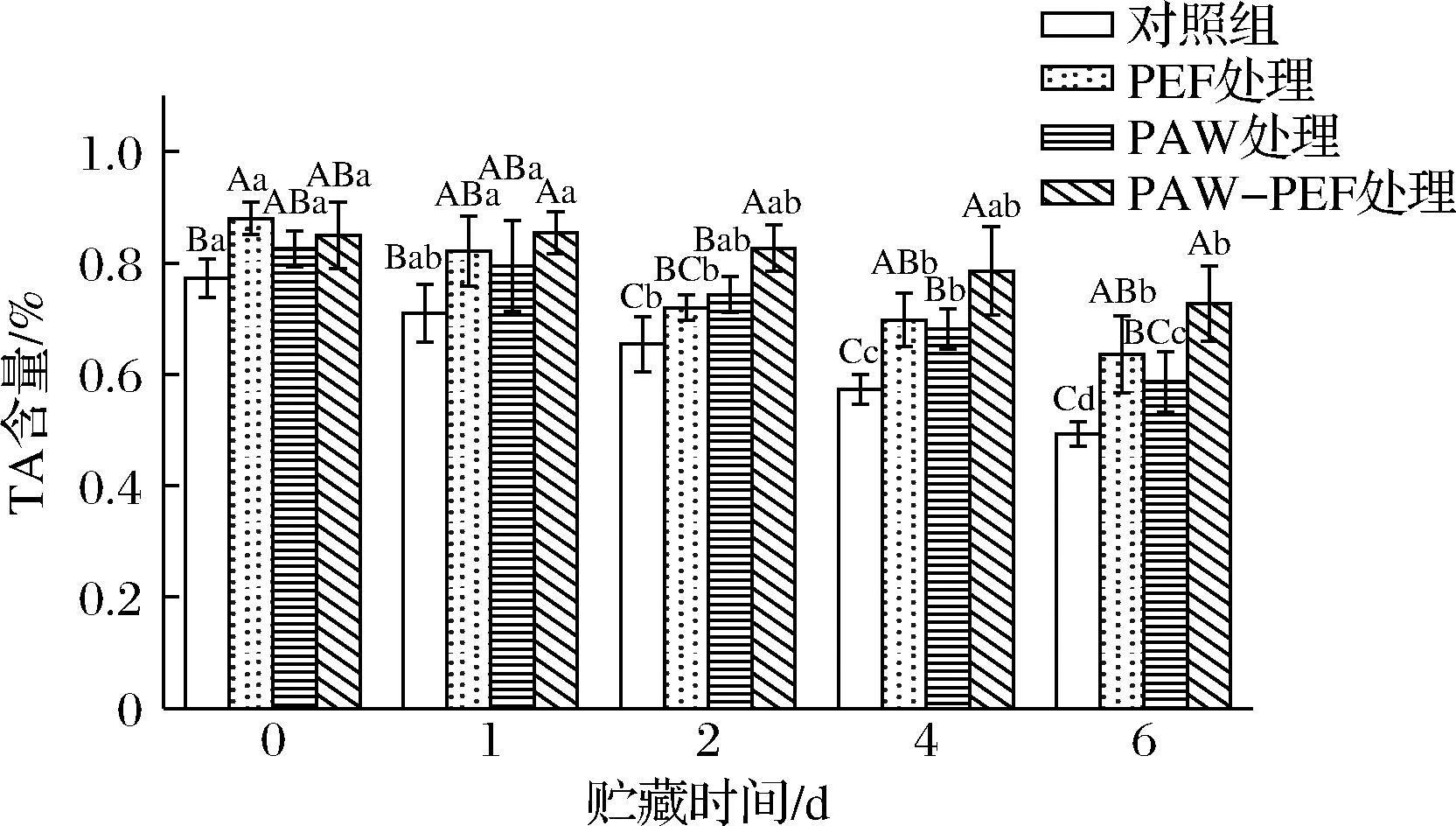
图6 PAW-PEF联合处理对贮藏期间蓝莓TA含量的影响
Fig.6 Effect of PAW-PEF co-treatment on the contents of TA in blueberries during storage
贮藏时间延长至第6天时,对照组样品的TA含量降至0.49%,单一PEF处理、单一PAW处理及PAW-PEF联合处理组的TA含量分别为0.64%、0.59%和0.72%,均高于对照组,且PAW-PEF联合处理组的TA含量最高。这表明在贮藏期间,PAW-PEF联合处理能更有效地延缓TA含量的下降。这可能是因为PAW和PEF处理能够通过抑制与呼吸作用相关的酶活性,调节果实内部的代谢活动,从而降低蓝莓的呼吸强度,减少有机酸的消耗[19-20]。此外,PAW-PEF联合处理的抑菌作用可有效抑制蓝莓表面微生物的生长,减少因微生物代谢活动而导致的有机酸分解,从而有助于维持TA含量和蓝莓品质。
2.7 PAW-PEF联合处理对蓝莓花青素含量的影响
作为蓝莓所含的黄酮类水溶性色素,花青素具有抗氧化、免疫调节及抗炎等生理功效。如图7所示,花青素的含量随着贮藏时间的延长,整体上呈逐渐下降的趋势。贮藏第0天时,对照组的花青素含量为(129.55±3.09) mg/100 g,单一PEF处理、单一PAW处理及PAW-PEF联合处理组的花青素含量分别为(132.04±9.70)、(135.84±4.75)、(140.35±1.94) mg/100 g,可见单一PEF处理和PAW处理可使蓝莓中花青素含量有所上升,且相较于单独处理,PAW-PEF联合处理使得样品花青素含量增加得最多。产生此现象的原因可能是PAW中的ROS/RNS能够诱导植物细胞内的抗氧化防御系统,促进花青素的合成[21]。而 PEF 处理改变了细胞膜通透性,使得细胞内物质运输和代谢加速,可能促使合成花青素的底物更易到达作用位点,同时也可能激活了细胞内与花青素合成相关的酶活性[22]。因此,二者联合作用,可能从细胞内环境调节和物质代谢途径加速两方面共同促进了花青素的合成与积累。
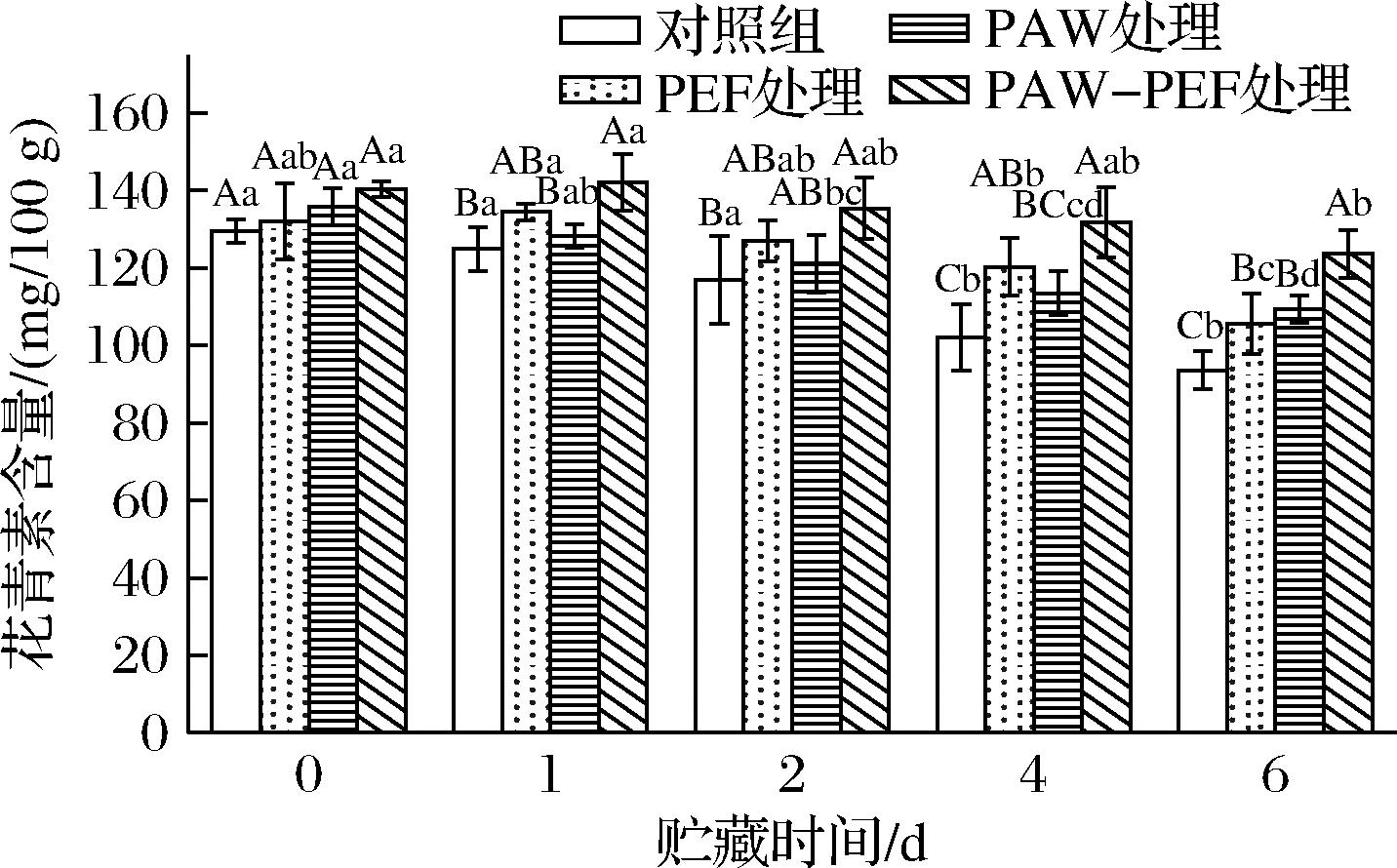
图7 PAW-PEF联合处理对贮藏期间蓝莓花青素含量的影响
Fig.7 Effect of PAW-PEF co-treatment on contents of anthocyanin in blueberries during storage
贮藏至第6天时,对照组和处理组样品的花青素含量差异显著(P<0.05),对照组的花青素含量为(93.65±4.91) mg/100 g,相比第0天下降了27.71%,单一PEF处理、单一PAW处理及PAW-PEF联合处理组的花青素含量分别为(105.62±7.83)、(109.35±3.51)、(123.66±6.19)mg/100 g,相较于初始值,分别下降了20.00%、19.50%及11.89%。表明PAW-PEF联合处理能够在一定程度上延缓贮藏过程中蓝莓花青素含量的降低。相比单独处理,可以更有效地抑制蓝莓花青素的降解。
2.8 PAW-PEF联合处理对蓝莓抗坏血酸含量的影响
抗坏血酸作为新鲜水果的重要营养指标,具有热不稳定性,对各类加工及贮存环境极为敏感。作为抗氧化剂,抗坏血酸在多种ROS的生成过程中扮演重要角色,能够保护植物自身免受损伤。PAW-PEF联合处理对蓝莓贮藏期间抗坏血酸含量的影响如图8所示。结果显示,随着贮藏时间的延长,E.coli在蓝莓中持续生长繁殖,蓝莓果实逐渐衰老腐败,抗坏血酸含量整体上呈现逐渐降低的趋势,这说明抗坏血酸在贮藏期间不断地被消耗。贮藏初期(0 d),对照组的初始抗坏血酸含量为(17.55±0.51) mg/100 g。单一PEF处理、单一PAW处理及PAW-PEF联合处理的抗坏血酸含量分别为(18.50±0.73)、(18.10±1.04)、(18.90±1.22) mg/100 g。处理组样品的抗坏血酸含量高于对照组,其中,PAW-PEF联合处理组的抗坏血酸含量上升得最多。图8中还可以观察到,在整个贮藏期间,对照组样品的抗坏血酸含量显著下降,且相较于单一PEF和单一PAW处理,PAW-PEF联合处理组样品的抗坏血酸含量的下降速度更为缓慢。
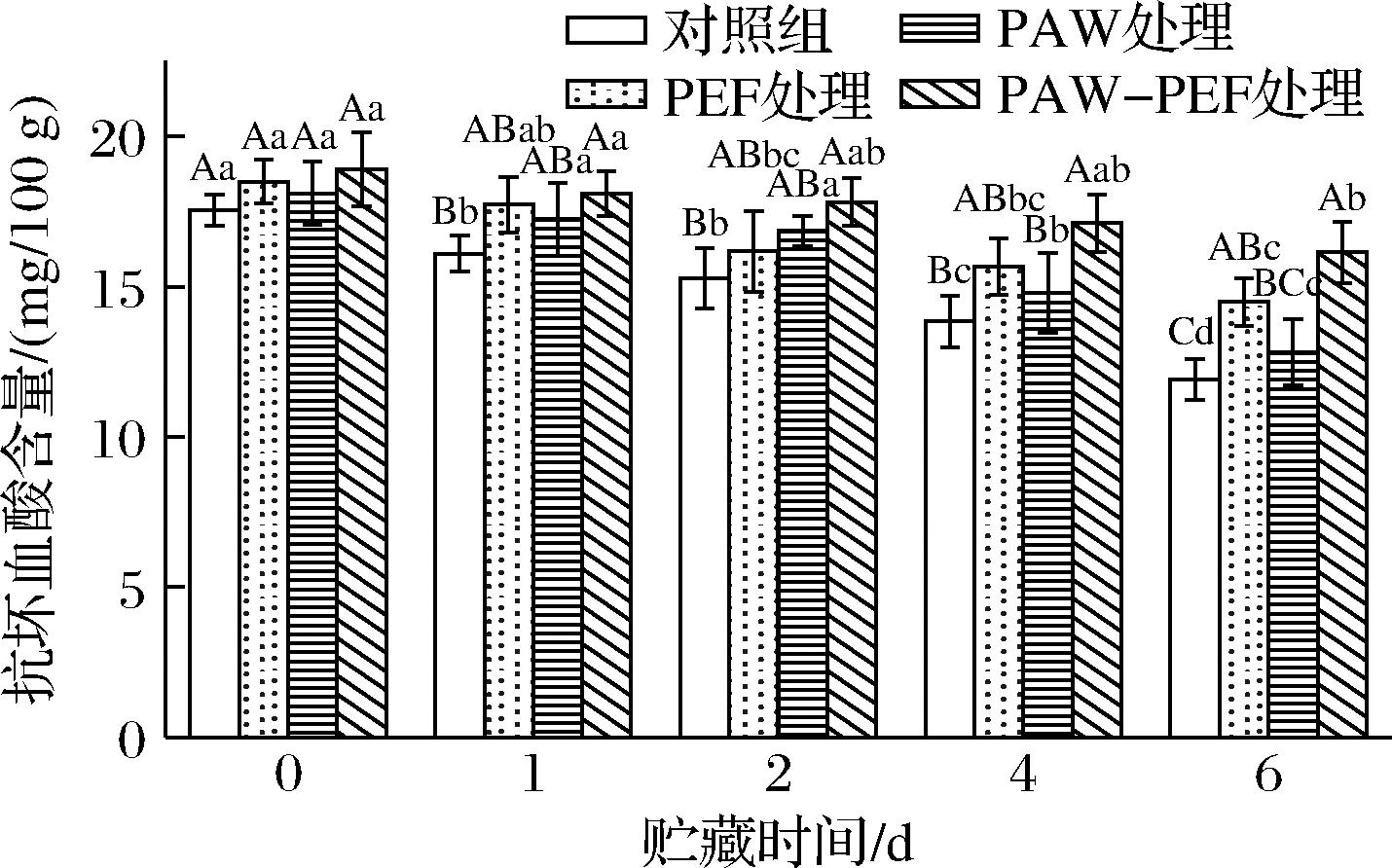
图8 PAW-PEF联合处理对贮藏期间蓝莓抗坏血酸含量的影响
Fig.8 Effect of PAW-PEF co-treatment on the contents of ascorbic acid in blueberries during storage
上述现象产生的原因可能在于PAW中的ROS和RNS具有强氧化性,诱导植物组织产生氧化应激反应,这种应激反应会激活植物自身的抗氧化防御系统,增加抗氧化酶(如超氧化物歧化酶、过氧化氢酶)的活性[23],并提高脱氢抗坏血酸酶的活性,促进抗坏血酸的合成[24]。此外,PEF处理可能通过影响细胞代谢活动,诱导抗氧化物质合成[25]。并且PEF处理产生的细胞膜穿孔效应可能增强了PAW中活性物质的细胞渗透性,促进细胞内外物质交换,从而增强PAW的作用效果。
贮藏至第6天时,对照组样品的抗坏血酸含量为(11.91±0.68)(mg/100 g),相较于初始值,下降了32.14%,单一PEF处理、单一PAW处理及PAW-PEF联合处理的抗坏血酸含量分别为(14.50±0.79)、(12.81±1.10)、(16.14±1.02) mg/100 g,分别为对照组的1.22、1.08、1.36倍,且相较于第0天,抗坏血酸含量分别下降了21.63%、29.22%及14.62%。上述结果表明,在贮藏期间,PAW-PEF联合处理能够有效地延缓蓝莓果实中抗坏血酸的降解,减少抗坏血酸的氧化损失,其效果优于单一处理。
3 结论与讨论
本研究探索了PAW-PEF 联合处理对蓝莓在4 ℃冷藏期间的抑菌保鲜作用。结果显示,PAW-PEF 联合处理能有效抑制蓝莓在贮藏期间的微生物增殖和质量损失,维持蓝莓的表观形态、亮度和硬度,延缓TA、花青素、抗坏血酸等营养功效成分的降解。本论文研究成果充分表明,PAW-PEF联合处理是一种具有广阔应用前景的蓝莓杀菌保鲜技术,为该技术在其他果蔬的保鲜应用提供了借鉴和指导。
[1] 高海生, 赵希艳, 李润丰.果蔬采后处理与贮藏保鲜技术研究进展[J].农业工程学报, 2007(2):273-278.GAO H S, ZHAO X Y, LI R F.Review of postharvest treatment and preservation technologies of fruit and vegetable[J].Transactions of the Chinese Society of Agricultural Engineering, 2007(2):273-278.
[2] WANG Q Y, SALVI D.Recent progress in the application of plasma-activated water (PAW) for food decontamination[J].Current Opinion in Food Science, 2021, 42:51-60.
[3] YAN Z Y, YIN L, HAO C J, et al.Synergistic effect of pulsed electric fields and temperature on the inactivation of microorganisms[J].AMB Express, 2021, 11(1):47.
[4] SANZ-PUIG M, SANTOS-CARVALHO L, CUNHA L M, et al.Effect of pulsed electric fields (PEF) combined with natural antimicrobial by-products against S.Typhimurium[J].Innovative Food Science &Emerging Technologies, 2016, 37:322-328.
[5] ROYINTARAT T, CHOI E H, BOONYAWAN D, et al.Chemical-free and synergistic interaction of ultrasound combined with plasma-activated water (PAW) to enhance microbial inactivation in chicken meat and skin[J].Scientific Reports, 2020, 10:1559.
[6] MENTHEOUR R, MACHALA Z.Coupled antibacterial effects of plasma-activated water and pulsed electric field[J].Frontiers in Physics, 2022, 10:895813.
[7] GAN Z L, ZHANG Y Y, GAO W M, et al.Effects of nonthermal plasma-activated water on the microbial sterilization and storage quality of blueberry[J].Food Bioscience, 2022, 49:101857.
[8] 史洁莹, 牟燕萍, 陆周欣, 等.壳聚糖-植物精油纳米乳液保鲜垫的制备及其在蓝莓保鲜中的应用[J].食品工业科技, 2025,46(15):354-366.SHI J Y, MOU Y P, LU Z X, et al.Preparation and application of chitosan-essential oil nanoemulsion preservation pads for blueberry preservation[J].Science and Technology of Food Industry, 2025,46(15):354-366.
[9] KIM E, RYU J H, KIM H.Inactivation of Salmonella Newport on blueberries by treatment with chlorine dioxide gas and its effect on blueberry qualities[J].Food Bioscience, 2023, 53:102704.
[10] 刘敏, 张岚, 王丹, 等.壳聚糖/藜麦蛋白/柑橘精油复合膜对圣女果保鲜效果的影响[J].中国食品添加剂, 2023, 34(8):230-237.LIU M, ZHANG L, WANG D, et al.Effects of chitosan/quinoa protein/citrus essential oil composite film on the preservation of cherry tomatoes[J].China Food Additives, 2023, 34(8):230-237.
[11] XIE J, SAMEEN D E, XIAO Z K, et al.Protecting anthocyanins of postharvest blueberries through konjac glucomannan/low-acyl gellan gum coatings contained thymol microcapsule during low-temperature storage[J].Food Chemistry, 2025, 463:141347.
[12] 王贝, 侯益明.pH示差法测定花青素含量的方法研究[J].山东化工, 2021, 50(21):94-96.WANG B, HOU Y M.Study on the method of determining anthocyanin content by pH-differential method[J].Shandong Chemical Industry, 2021, 50(21):94-96.
[13] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.CAO J K, JIANG W B, ZHAO Y M.Experiment Guidance of Postharvest Physiology and Biochemistry of Fruits and Vegetables[M].Beijing:China Light Industry Press, 2007.
[14] MANNOZZI C, CECCHINI J P, TYLEWICZ U, et al.Study on the efficacy of edible coatings on quality of blueberry fruits during shelf-life[J].LWT, 2017, 85:440-444.
[15] CHEN H J, CAO S F, FANG X J, et al.Changes in fruit firmness, cell wall composition and cell wall degrading enzymes in postharvest blueberries during storage[J].Scientia Horticulturae, 2015, 188:44-48.
[16] ZHANG H X, ZHAO Q Y, LAN T, et al.Comparative analysis of physicochemical characteristics, nutritional and functional components and antioxidant capacity of fifteen kiwifruit (Actinidia) cultivars-comparative analysis of fifteen kiwifruit (Actinidia) cultivars[J].Foods, 2020, 9(9):1267.
[17] HAARD N F.Postharvest physiology and biochemistry of fruits and vegetables[J].Journal of Chemical Education, 1984, 61(4):277.
[18] LLAVATA B, CLEMENTE G, BON J, et al.Pulsed electric field (PEF) pretreatment impact on the freezing and ultrasound-assisted atmospheric freeze-drying of butternut squash and yellow turnip[J].Journal of Food Engineering, 2025, 395:112543.
[19] NEMATI V, SADEGHI A, MOZAFARPOUR R.Plasma-activated water and microbubble as postharvest technology:Effects on Escherichia coli O157:H7 reduction, functional and storage quality of romaine lettuce[J].Journal of Agriculture and Food Research, 2024, 17:101259.
[20] DELLAROSA N, TAPPI S, RAGNI L, et al.Metabolic response of fresh-cut apples induced by pulsed electric fields[J].Innovative Food Science &Emerging Technologies, 2016, 38:356-364.
[21] JAN K C, GAVAHIAN M.Cold plasma at various voltage, gas flow rate, and time assisted extraction of blue pea flower:Quantitative UPLC-ESI/MS/MS analysis of bioactive compounds, phenolics, and anthocyanin content[J].Innovative Food Science &Emerging Technologies, 2024, 98:103837.
[22] KARIMI SANI I, MEHRNOOSH F, RASUL N H, et al.Pulsed electric field-assisted extraction of natural colorants;principles and applications[J].Food Bioscience, 2024, 61:104746.
[23] 蔡梦, 田立鹏, 李春爱, 等.等离子体活化水对鲜切苹果品质及抗氧化酶活性的影响[J].兰州理工大学学报, 2023, 49(3):67-74.CAI M, TIAN L P, LI C A, et al.Effects of plasma activated water on the quality and antioxidant enzyme activities of fresh-cut apples[J].Journal of Lanzhou University of Technology, 2023, 49(3):67-74.
[24] 赵莹, 严龙飞, 严文静, 等.低温等离子体活化水与介质阻挡放电联合处理对草莓冷杀菌效果及品质的影响[J].食品科学, 2022, 43(17):105-116.ZHAO Y, YAN L F, YAN W J, et al.Effect of combined cold plasma-activated water and dielectric barrier discharge treatment on the sterilization and quality of strawberry[J].Food Science, 2022, 43(17):105-116.
[25] 张映曈, 张元元, 赵欢欢, 等.中强度脉冲电场对娃娃菜活性物质含量及抗氧化能力的影响[J].食品科学, 2021, 42(19):183-193.ZHANG Y T, ZHANG Y Y, ZHAO H H, et al.Effect of moderate intensity pulsed electric field on the contents of bioactive compounds and antioxidant capacity of baby cabbage (Brassica pekinensis L.var.gemmifera Zenk.)[J].Food Science, 2021, 42(19):183-193.