曲乃酒之骨。大曲是以小麦为主要原料,经破碎、加水润料、压成曲坯后,在开放式的环境下培养发酵、贮存而成[1]。大曲中微生物群落结构的演替和生长代谢塑造了多样化风味化合物及前体[2-5]。它们通过复杂的相互作用共同参与大曲的发酵过程,并产生多种香气化合物,如酯类、醇类、酸类、醛类等,赋予大曲不同的香气特征,对白酒品质和酒体风格有着重要影响。
大曲种类繁多,微生物组成的差异会导致大曲具有不同的标志性风味化合物。大曲发酵过程具有较高的发酵温度,细菌凭借其较强的环境适应能力和营养竞争力得以不断增殖,真菌的生长和繁殖更容易受到高温的影响而被抑制,因此,细菌比真菌具有更高的群落多样性。多项研究表明,细菌是大曲中的主要产香功能微生物群[6-9]。邓阿玲等[5]发现高温大曲细菌群落中Oceanobacillus、Virgibacillus、Kroppenstedtia等对癸酸乙酯、2-丙烯醛、苯甲醇、苄基醇等化合物的合成有积极贡献。侯小歌等[10]对比了不同原料中温大曲的风味组成和细菌群落结构,高品质小麦生产的大曲优势细菌属与挥发性风味化合物具有更强的正相关性,且不同大曲特征性风味化合物不同。
核心微生物是影响发酵食品的质量和风味的关键因素,目前已有研究对多种发酵食品中的核心微生物进行了初步探索。这些研究多集中在优势微生物属上,判定因素较为单一,例如,WOLFE等[11]将奶酪中平均丰度>1%的14个细菌属和10个真菌属判定为核心微生物群。在传统酒类酿造及多种发酵食品发酵过程中,核心微生物的判定通常以其与风味化合物的关联程度为依据。王秀秀等[12]将与18种重要的挥发性化合物相关的7个微生物属判定为板栗酒发酵期间的核心功能微生物。HUANG等[13]将相对丰度和频度较高的微生物与风味化合物进行相关性分析,揭示了不同时期决定陈皮风味特征的关键微生物种群。通过分析主导微生物(存在于60%的发酵阶段)与关键风味物质(气味活性值>1)的关联程度,3个细菌属被判定为泡椒发酵过程中的核心微生物[14]。尽管目前多数研究已经揭示了白酒酿造及大曲发酵过程中微生物群落的多样性和功能特征,但针对不同大曲中核心微生物的多维度系统研究较少。此外,核心微生物在风味代谢特性及其实际应用效果方面的验证也相对匮乏。
本研究以不同大曲为研究对象,采用顶空固相微萃取-气相色谱-质谱联用技术(headspace-solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)和高通量测序技术系统解析其挥发性风味化合物及微生物群落结构,通过多元统计分析和相关性分析分别判定了不同大曲中的特征香气化合物和核心微生物,并通过分离培养和固态发酵实验分析核心微生物的风味代谢特征。最后,将其组合应用至大曲制作中,探究其对大曲主体风味的调控作用。本研究对实现大曲风味定向调控、提升大曲品质具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 样本采集
本研究涉及的大曲样本包括基础大曲样本、强化大曲样本及其对应的对照曲样本,它们分别用于核心微生物的判别分析以及大曲风味的定向调控验证。
基础大曲样本:本研究中的3种基础大曲样本分别采集于贵州省和甘肃省的3个不同酒厂,其编号分别为WQ、BQ和JQ,它们具有不同感官风味特征。各选取3块新鲜出房曲作为平行样本,具体信息见表1。将大曲样本磨成细粉后取200 g分装至自封袋中,及时转移至-80 ℃冰箱保存。
表1 基础大曲样本信息表
Table 1 Basic Daqu sample information
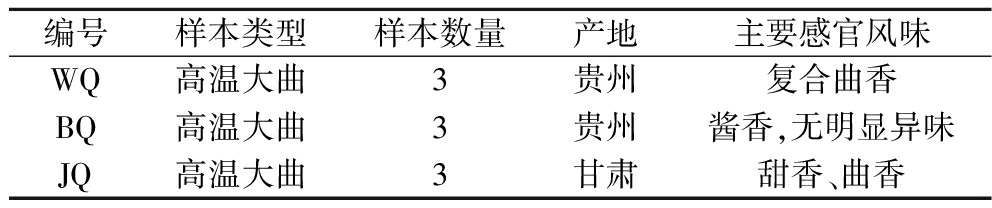
编号样本类型样本数量产地主要感官风味WQ高温大曲3贵州复合曲香BQ高温大曲3贵州酱香,无明显异味JQ高温大曲3甘肃甜香、曲香
强化大曲及对照大曲样本:将核心微生物组合应用至高温大曲生产中,制备强化大曲,同时采集相同批次、相同曲房的普通大曲作为对照。具体信息见表2,取样方式与基础大曲样本相同。
表2 强化曲及对照曲样本信息表
Table 2 Enhanced Daqu and control Daqu sample information
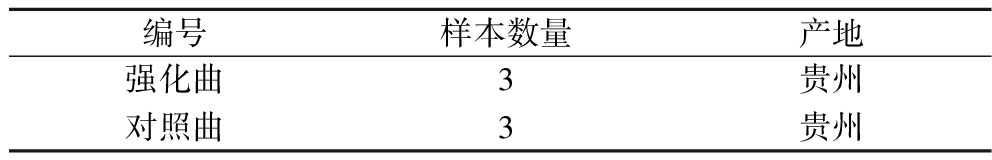
编号样本数量产地强化曲3贵州对照曲3贵州
1.1.2 实验试剂
乙醇、苯酚、酵母粉、蛋白胨、NaHPO4、Na2HPO4、十二烷基硫酸钠,国药集团化学试剂(北京)有限公司;饱和酚溶液、PBS片剂,生工生物工程(上海)股份有限公司;α-淀粉酶、糖化酶,上海源叶生物科技有限公司。
1.2 仪器与设备
GC 7890B气相色谱/MS 5975质谱、色谱柱DB-FFAP,美国Agilent公司;SPME自动进样系统,德国Gerstel公司;Mini-Beadbeater细胞破碎仪,Biospec公司;真空离心浓缩仪,Eppendorf公司;荧光酶标仪,苏州净化设备有限公司。
1.3 实验方法
1.3.1 核酸提取、测序及生物学分析
提取大曲的总DNA后进行高通量测序。DNA的具体提取方法参考ZHANG等[15]的方法。测定总DNA浓度后进行琼脂糖凝胶电泳检测,选择质量浓度>50 ng/μL且条带清晰的样本,置于-80 ℃冰箱保存备用。使用338F/806R引物扩增16S rRNA基因的V3~V4区域,ITS3/ITS4扩增真菌的ITS2区域。由南京基序智谷生物科技有限公司(中国南京)完成测序工作。
1.3.2 挥发性化合物含量测定
称取5 g大曲于20 mL超纯水中漩涡,振荡5 min后冰浴超声30 min。4 ℃冰箱放置12 h后,于8 000 r/min离心10 min,收集上清液备用。称取1.5 g NaCl于20 mL顶空瓶中,加入5 mL上清液,并以5 μL薄荷醇(100×10-6)作为内标,迅速用装有特氟龙垫片的盖子密封。挥发性化合物检测条件参照ZHANG等[15]的方法。
1.3.3 菌株的筛选及鉴定
称取10 g大曲于90 mL灭菌的去离子水中,于37 ℃条件下振荡培养30 min,静置后收集菌悬液。吸取菌悬液于LB固体培养基平板上涂布,放入培养箱培养24 h。根据不同菌落形态进行纯化和鉴定。
1.3.4 菌株固态模拟发酵实验
小麦固体培养基的制备:将小麦作为原料,粉碎后加入去离子水润粮过夜,加入高温淀粉酶,121 ℃灭菌20 min。温度降为60 ℃时,在无菌条件下加入糖化酶,搅拌混匀后置于60 ℃烘箱处理2 h,分装置于牛皮纸袋中备用。
菌株接种:将纯培养的菌体转接至LB液体培养基中振荡培养24 h。进行单培养及共培养时,将菌体浓度控制为106 CFU/mL,以5%的接种量接种至固体培养基,放置于55 ℃培养箱中静置发酵7 d。
采用HS-SPME-GC-MS的方法检测菌株在单培养以及共培养情况下的风味代谢情况,具体方法参考1.3.2节。
1.3.5 核心微生物在大曲中的应用
复合菌液的制备:在5 mL液体试管中制备单菌株的种子液,转接至三角瓶中进行扩大培养,以相同浓度将菌液混合。
强化大曲的制作:将小麦(色泽金黄、颗粒饱满、无霉变、无杂质、无农残)去尘处理并破碎。加入3%~4%的水,过夜润麦,加入38%~39%的水并添加复合菌液,同时加入7%~9%酒厂中曲香纯正的陈曲作母曲,拌料,过程中控制复合菌液添加量为5%,最终浓度为106CFU/mL。将制作的大曲压制成型,入房培养。
对照曲的制备:与强化曲在相同曲房同时进行制作,除拌料阶段不添加复合菌液外,其余操作步骤保持一致。
1.4 数据处理
使用Origin 2025绘制箱线图、热图、百分比堆积柱状图,利用SIMCA软件对风味化合物进行多元统计分析,Prism绘制柱状图,使用SPSS计算Spearman相关系数,利用Cytoscape和OmicStudio工具(omicstudio.cn/tool)分别绘制网络图、雷达图。
2 结果与分析
2.1 不同大曲特征香气物质的确定
前期研究发现,来自不同酒厂的3种大曲WQ、BQ和JQ具有不同的感官风味特征,WQ大曲具有较浓的复合曲香,BQ大曲具有酱香味且无明显异味,JQ大曲具有甜香和粮香。为进一步探究3种大曲中风味化合物的组成,通过HS-SPME-GC-MS在全部基础大曲样本中检测出134种挥发性化合物,通过Flavornet Home(http://www.flavornet.org/index.html)、Flavor DB(https://cosylab.iiitd.edu.in/flavordb/)数据库以及文献检索进行比对,结合风味描述和阈值明确挥发性物质对香气的贡献。共对比出81种香气化合物。三者具有不同的主体香气物质,且WQ和BQ香气化合物的含量明显高于JQ(图1)。吡嗪类物质是WQ和BQ大曲中的主要香气化合物,相对含量分别为2 228.42、1 264.83 μg/kg,分别占据总相对含量的55.73%、49.21%。WQ中其他丰度较高的物质为醇类化合物(16.28%),其次为芳香族化合物(9.62%)。BQ中其他丰度较高的化合物依次是醇类、醛类,分别占比18.01%、10.17%。JQ酯类化合物相对含量为927.72 μg/kg,占比66.30%,其次为醇类、吡嗪类,相对含量分别为196.64、95.17 μg/kg,占比14.05%、6.80%,这分别与邓阿玲等[5]和王高伟等[16]的研究结果相似。
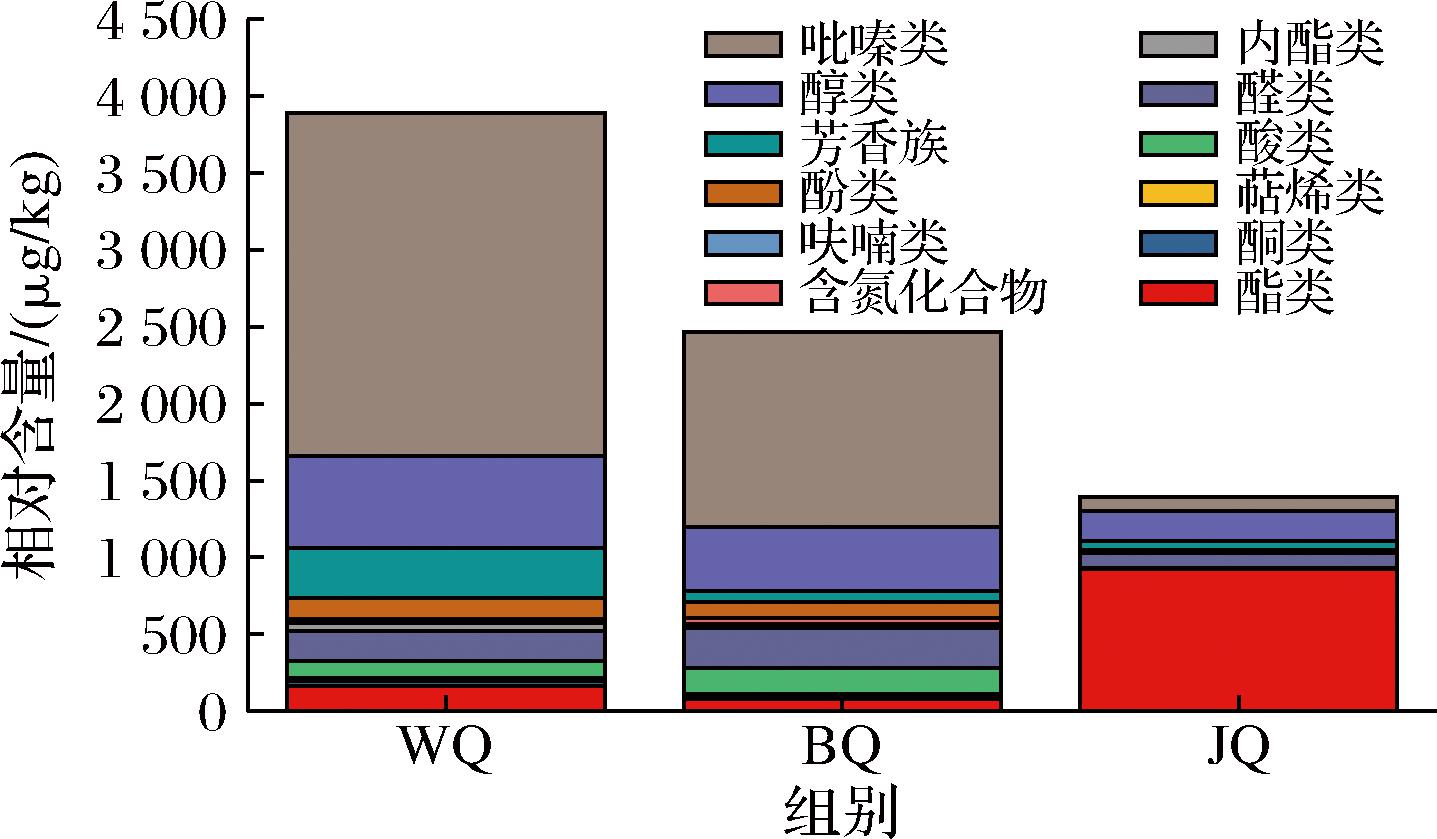
图1 不同大曲风味化合物浓度
Fig.1 Aroma compound concentrations of different Daqu
为初步了解不同大曲香气组分的差异,对已确定的81种风味化合物进行偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)。WQ、BQ和JQ明显聚为3类,它们香气组分之间存在较大的差异(图2)。通过变量投影重要性指标(variable importance in the projection,VIP)分析,发现共有31种香气化合物的VIP>1,这表明这些物质可以被认为是区分不同大曲样本的重要的香气化合物,具体信息如电子版增强出版附表1所示(https://doi.org/10.13995/j.cnki.11-1802/ts.042486,下同)。其中包含10种吡嗪类化合物,占全部特征香气化合物的48.39%,且在WQ、BQ中具有较高浓度,可以被视作区分不同主体风味大曲的重要风味物质类别。
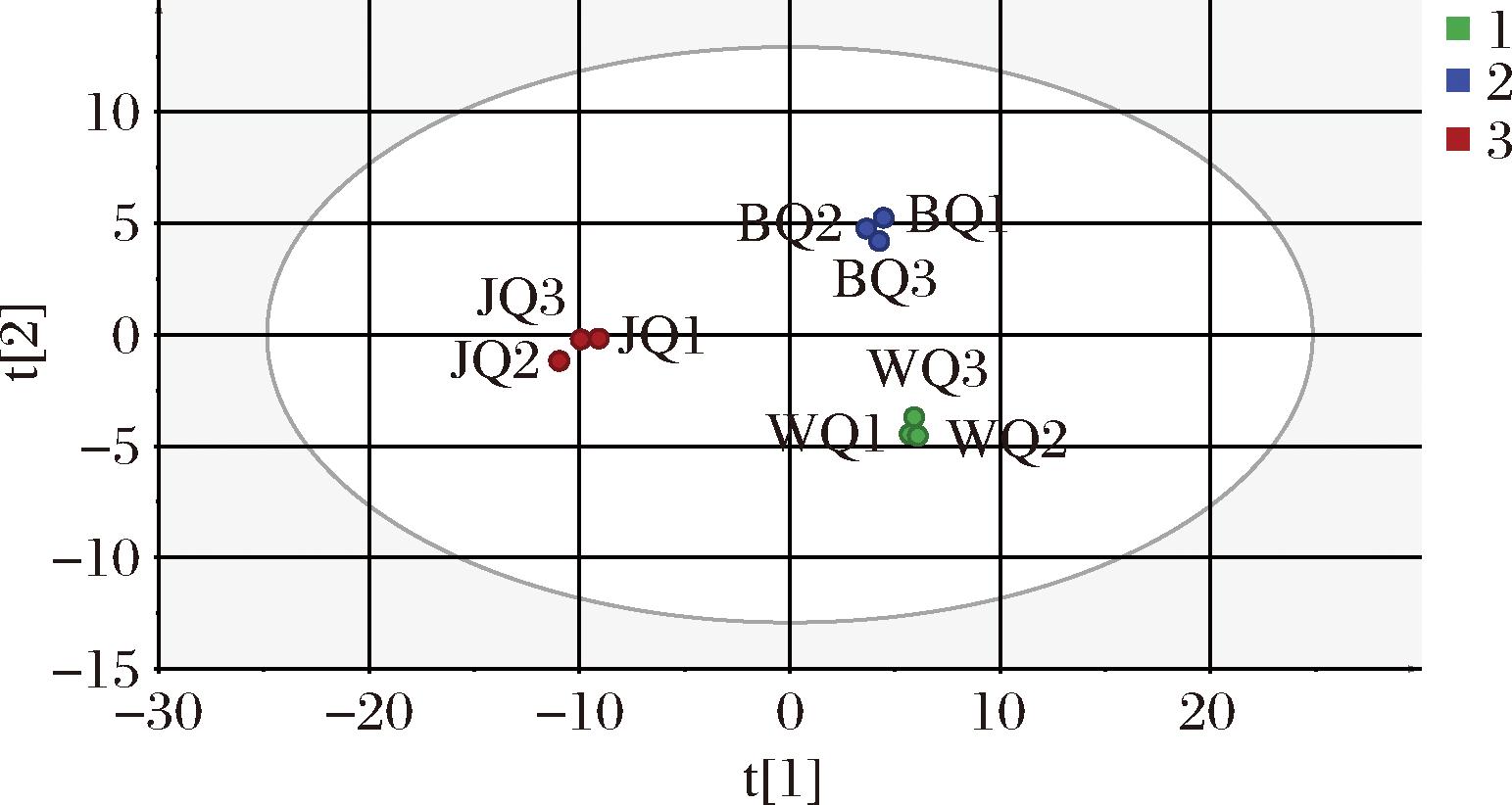
图2 不同大曲风味化合物的PLS-DA
Fig.2 PLS-DA of different Daqu aroma compounds
将这31种香气化合物绘制聚类热图,如图3所示。将大曲中相对含量较高的重要香气组分判定为其对应的特征香气化合物,不同的大曲中特征香气化合物的种类和含量具有较为明显的特征。将WQ中的特征香气组分最多,其中,2,3,5-三甲基吡嗪被认为是黑曲中含量较高的吡嗪类物质之一[17],是“酱香”的主要贡献者[18]。2,3-二甲基-5-乙基吡嗪、2,5-二甲基吡嗪、3-乙基-2,5-二甲基吡嗪和2,3-二甲基吡嗪等物质被较多研究认为可以为白酒风味贡献坚果香、烘焙香[19],同时对其他香气具有烘托叠加作用。异戊醇和苯酚被认为是酱香型高温大曲发酵过程中的差异物质[20],愈创木酚曾被报道过其可以为高品质中高温大曲构建木香香气[21]。同时,γ-壬内酯、异丁酸、芳樟醇、苯基丙酮和甲酸异戊酯等在WQ中具有较高的浓度。BQ的特征香气化合物中,三甲基丁基吡嗪、2-吡咯甲醛和可卡醛可以为大曲风味提供坚果、咖啡和可可香,2-甲基癸酸与大曲的酸腐味有关[22],苯乙醛对大曲的粮香具有重要贡献[23]。此外,2,3-二甲基-5-异丁基吡嗪、2,3-二甲基-5-异戊基吡嗪、2,5-二甲基-3-(3-甲基丁基)吡嗪以及3-辛醇具有青草香特征,它们在以往的相关研究中较少被提及。而孙细珍等[19]的香气缺失实验结果表明,吡嗪类物质也会对酱香白酒的青草香与花香存在一定的影响,因此,这些化合物可能在白酒风味形成中扮演重要角色。JQ浓度较高的差异香气化合物最少,只有正己醇和2,4-二叔丁基苯酚。其中,正己醇在以往研究中被发现其含量与发酵温度呈现负相关[24]。2,3-二甲基-5-乙基吡嗪和异戊酸被认为是大曲在高温发酵阶段的特征物质[24],他们分别存在于WQ和BQ的特征香气化合物中,这侧面反映出与其他2种样本相比,JQ的发酵温度相对较低。
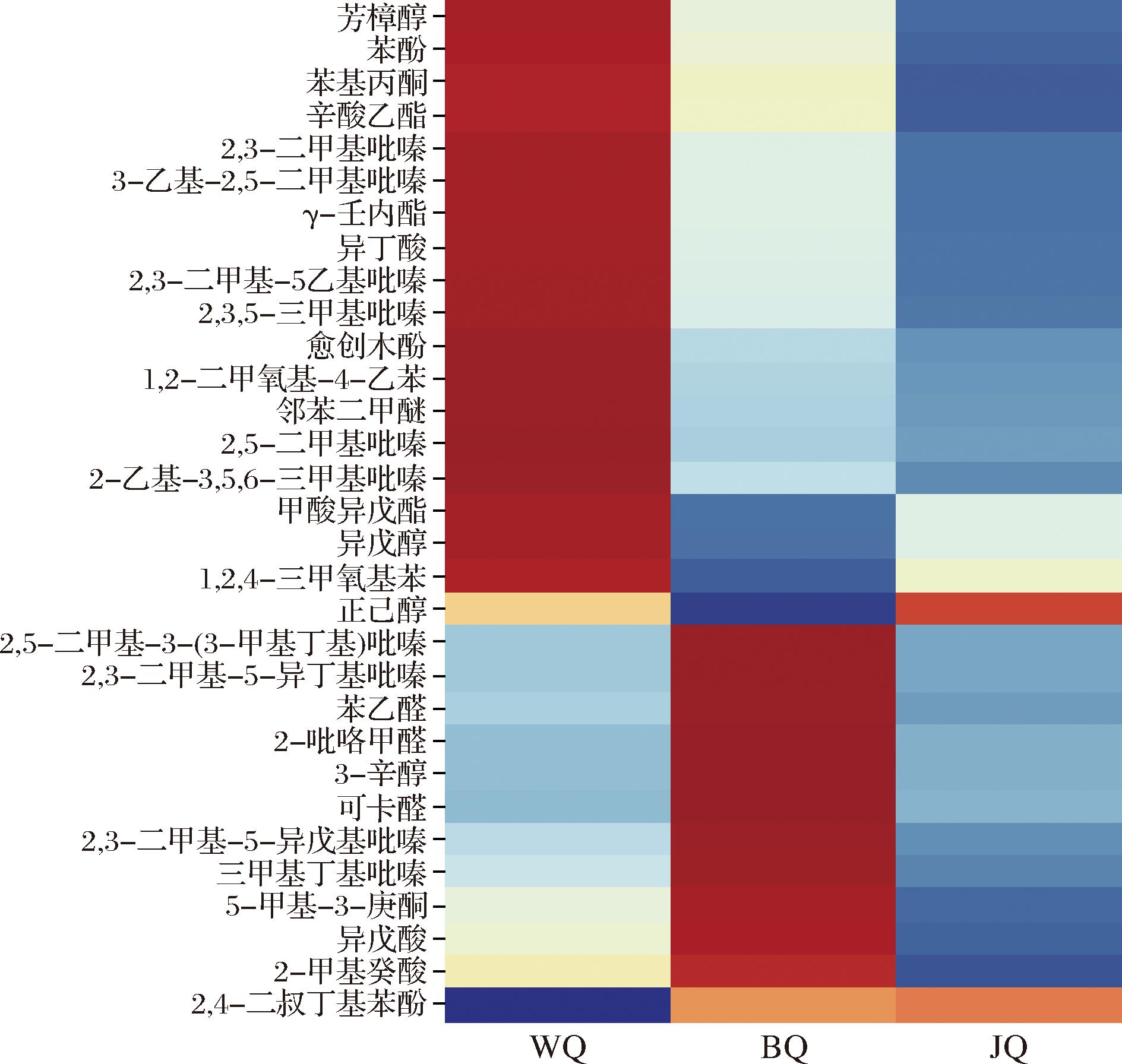
图3 不同大曲重要香气化合物组分热图和HCA聚类分析
Fig.3 Heat map and HCA cluster analysis of important aroma compounds in different Daqu
2.2 关键核心微生物的判定及筛选
2.2.1 不同大曲微生物群落结构分析
大曲的微生物群落结构与标志性化合物的形成显著相关[24]。从属水平对3种大曲细菌群落进行分析,测序结果显示,在所有样本中共检测到92个细菌属。本研究选取累计总平均相对丰度超过99%的15个属作为主要细菌属,其分布情况如图4-a所示。

a-不同大曲微生物群落结构;b-不同大曲细菌群落之间的相关性网络图;c-特征香气组分与细菌群落之间的相关性网络图;d-核心微生物的韦恩图
图4 核心微生物的判定
Fig.4 Determination of core microorganisms
WQ、BQ两种大曲中,克罗彭斯特菌属(Kroppenstedia)、枝芽胞杆菌属(Virgibacillus)、芽孢杆菌属(Bacillus)和糖多孢菌属(Saccharopolyspora)为优势菌属,平均相对丰度分别为11.98%和45.43%、35.88%和7.39%、16.52%和20.39%、6.46%和22.50%。同时两者群落结构存在一定差异,WQ中葡萄球菌属(Staphylococcus,10.62%)和海洋芽孢杆菌属(Oceanobacillus,5.25%)也占据一定丰度。DONG等[25]研究了不同高温大曲在成熟过程中菌群结构的变化,Kroppenstedia、Virgibacillus、Bacillus和Saccharopolyspora是黑色大曲的标志性细菌属,与本研究结果部分重合。JQ大曲中主要为热放线菌属(Thermoactinomyces,63.17%)、糖多孢菌属(Saccharopolyspora,17.02%)和明串珠菌属(Leuconostoc,9.89%),热放线菌属占据绝对优势。然而,马梦月等[26]的研究中,Bacillus在中高温大曲中占据较大丰度,这可能是由于制曲环境或原料差异引起的。
2.2.2 不同大曲细菌相关性分析
大曲中的微生物形成了复杂的生态相互作用网,塑造了大曲不同的风味。进一步分析不同大曲中细菌群落之间的相互作用,计算15个主要细菌属之间的Spearman相关系数(ρ),选择ρ>0.5和相关性呈显著性(P<0.05)的相关性点为有效相关关系(图4-b)。共有7个菌属与其他微生物具有较强的连接性(节点 >5条边),将其判定为3种大曲中的共现性微生物,具体信息见表3。
表3 不同大曲中共现性细菌
Table 3 Co-occurring bacteria of different Daqu
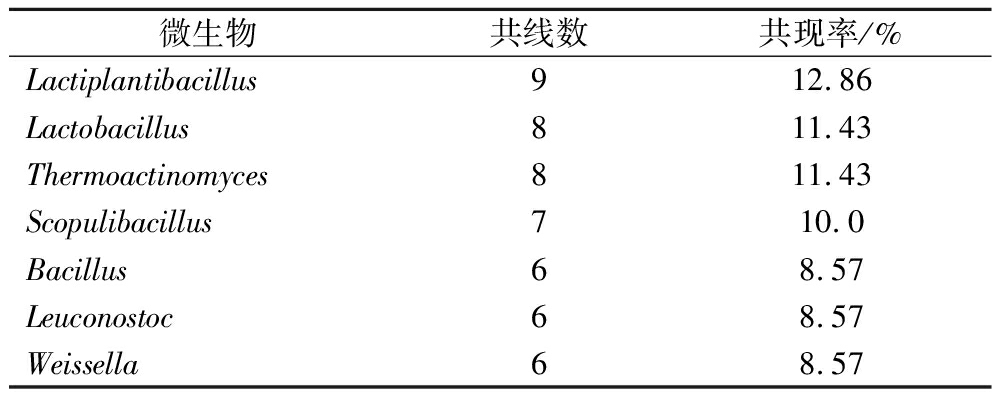
微生物共线数共现率/%Lactiplantibacillus912.86Lactobacillus811.43Thermoactinomyces811.43Scopulibacillus710.0Bacillus68.57Leuconostoc68.57Weissella68.57
在共现性细菌属中,Lactiplantibacillus与Lactobacillus、Leuconostoc、片球菌(Pediococcus)及Thermoactinomyces呈现正相关(P <0.05,ρ>0.5),乳杆菌属(Lactobacillus)与Leuconostoc、Thermoactinomyces及Weissella呈现正相关,Lactiplantibacillus、Thermoactinomyces和Lactobacillus都与Kroppenstedia、Bacillus及Scopulibacillus呈负相关(P<0.05,ρ>0.5)。Leuconostoc与Thermoactinomyces呈正相关,与Bacillus、Scopulibacillus呈负相关(P<0.05,ρ>0.5)。Scopulibacillus与糖单胞菌属(Saccharomonospora)、Bacillus呈显著正相关,与Weissella呈现负相关(P<0.05,ρ>0.5)。Bacillus还同Oceanobacillus、Lederbergia呈现正相关。其余非共现性微生物在微生物群体中也存在一定的网络地位。
2.2.3 特征香气组分与细菌群落的关联分析
通过计算特征香气化合物与主要微生物属之间的Spearman相关系数(ρ),选择ρ>0.5和P<0.05的正相关关系为有效数据进行可视化分析。由图4-c可知,7个细菌属与26种特征香气化合物(占全部差异物质的83.87%)呈显著的正相关,且它们均为WQ和BQ中的特征风味物质。其中,Bacillus、Virgibacillus、Oceanobacillus和Lederbergia都与15种特征化合物显著正相关(P<0.05,ρ>0.5),其中包括吡嗪类、芳香族化合物、酚类、内酯类、酯类、酸类和酮类化合物。共7种吡嗪类化合物与Bacillus显著相关,同时,这4个属都贡献了2-乙基-3,5,6-三甲基吡嗪、2,3-二甲基-5-乙基吡嗪、2,3,5-三甲基吡嗪、2,5-二甲基吡嗪、3-乙基-2,5-二甲基吡嗪和2,3-二甲基吡嗪。Kroppenstedtia与12种化合物显著正相关,Scopulibacillus和Saccharomonospora都与11种化合物显著正相关(P<0.05,ρ>0.5),包括吡嗪类、醇类、醛类、酸类和酮类化合物。这3个属都贡献了2,3-二甲基-5-异丁基吡嗪、三甲基丁基吡嗪、2,3-二甲基-5-异戊基吡嗪、2,5-二甲基-3-(3-甲基丁基)吡嗪、2-吡咯甲醛、可卡醛、苯乙醛、异戊酸和5-甲基-3-庚酮等重要化合物。结果表明,Bacillus、Virgibacillus、Oceanobacillus、Lederbergia、Kroppenstedtia、Scopulibacillus和Saccharomonospora对特征香气化合物的形成,尤其是WQ和BQ中的特征风味物质具有重要贡献,因此被认定为与特征香气组分密切相关的核心微生物群。
2.2.4 核心微生物的判定及筛选
本研究3种不同大曲中的主要细菌属为15个(图4-a),共现性微生物属为7个(表3),与特征香气化合物相关的微生物为7个(图4-c)。在以上3个不同类组中有2个共有的微生物属,为Scopulibacillus和Bacillus,将其判定为核心微生物(图4-d)。
基于本研究判定的核心微生物属Scopulibacillus和Bacillus,选择前期从高温大曲样本中筛选得到的嗜热大曲岩石芽孢杆菌(Scopulibacillus daqui)为实验菌株,同时通过稀释平板涂布的方式筛选大曲中的芽孢杆菌,对筛选得到的菌株进行固态发酵实验,选取香气明显且浓郁的菌株作为后续实验对象。经16S rRNA鉴定,并进行NCBI比对分析,它们分别是Bacillus amyloliquefaciens、Bacillus subtilis、Bacillus sonorensis,比对结果如表4所示。
表4 菌株比对信息
Table 4 Strain alignment information

描述最大得分总分覆盖率/%序列比对一致度/%Scopulibacillus daqui ZQ18-1 菌株16S核糖体RNA基因的部分序列1 7941 79410099.69Bacillus sonorensis MCCC1A07654 菌株16S核糖体RNA基因的部分序列1 8051 80510099.90Bacillus subtilis B-195 菌株16S核糖体RNA基因的部分序列1 6071 607100100.00Bacillus amyloliquefaciens CIFTMFBB7 菌株核糖体RNA基因部分序列1 6761 676100100.00
2.3 核心微生物的风味代谢特征
采用HS-SPME-GC-MS分析检测单一菌株固态发酵7 d后产物中的挥发性风味化合物,共有9种特征香气物质在模拟发酵产物中被检测到,分别是2,3-二甲基-5-乙基吡嗪、2,3,5-三甲基吡嗪、2,5-二甲基吡嗪、异戊醇、正己醇、2,4-二叔丁苯酚、苯酚、苯乙醛和异戊酸,各物质相对含量如附表2所示。
如图5所示,B.sonorensis的风味代谢能力最强,可以产生更多的酮类、芳香族化合物、萜烯类化合物、内酯类、醛类、呋喃类、醇类、吡嗪类和含硫化合物。3-羟基-2-丁酮和2,3-丁二醇被认为是吡嗪类化合物形成过程中重要的中间代谢产物[27],它们在B.sonorensis的发酵产物中的平均含量分别为1 432.56、1 870.00 μg/kg。2,3-丁二醇主要由丙酮酸经α-乙酰乳酸合成酶催化生成α-乙酰乳酸后,进一步通过一系列酶促反应产生[28],且3-羟基-2-丁酮可以由2,3-丁二醇经α-乙酰乳酸合成酶和α-乙酰乳酸脱羧酶等酶催化合成[29]。研究发现高温大曲中的芽孢杆菌在高温下能够发酵产生更多的2,3,5-三甲基吡嗪[30],其被认为是L-苏氨酸经L-苏氨酸脱氢酶催化合成的。B.sonorensis发酵产生的2,3,5-三甲基吡嗪分别为B.amyloliquefaciens和B.subtilis的5.37、7.79倍,这表明,B.sonorensis中吡嗪类及其前体物质合成相关的代谢途经更加活跃。4-乙烯基愈疮木酚在微生物中主要通过阿魏酸脱羧转化合成[31],有利于大曲的焦香风味[32]。B.amyloliquefaciens固态发酵产生的4-乙烯基愈疮木酚占据酚类化合物总含量的86.72%,为B.sonorensis和B.subtilis的1.61、9.84倍。酸类物质能增加白酒的后味、丰满酒体。B.subtilis产生酸类物质最多,2-甲基丁酸相对含量为47.24 μg/kg,具有干酪味[33]。S.daqui的风味代谢能力最弱。YAO等[34]从芝麻香型酒曲分离出的一株Scopulibacillus daqui能够耐受较高的发酵温度,温度是塑造大曲微生物群落的关键驱动因素[24],本研究中Scopulibacillus在细菌群落间的相互作用有着重要地位(2.2.2)。由此推测,Scopulibacillus在大曲发酵中可能通过介导微生物之间的相互作用而影响香气组分。

a-酮类;b-酯类;c-芳香族;d-酚类;e-醛类;f-酸类;g-萜烯类;h-内酯类;i-呋喃类;j-醇类;k-吡嗪类;l-含硫化合物
图5 菌株固态发酵代谢产生的各类风味化合物含量
Fig.5 Concentrations of various flavor compounds produced by solid-state fermentation metabolism of strains
2.4 核心微生物对大曲微生物群落和风味组成的影响
基于菌株的相互作用潜力及风味代谢能力,将S.daqui、B.amyloliquefaciens和B.sonorensis组合应用至大曲制作,通过高通量测序技术测定了强化曲及对照曲的细菌群落结构。如图6所示,细菌的绝对拷贝数变化显著,Scopulibacillus和Bacillus的绝对拷贝数分别为对照组的26.72倍和6.05倍。Saccharopolyspora、Pseudonocardiaceae_genus、Saccharomonospora和Kroppenstedtia的绝对拷贝数分别为对照组的11.89、13.65、15.38、30.84倍。在通过微生物干预进行大曲强化时,在发酵过程中对微生物间的相互作用起到重要的调节作用,通常会影响微生物群落的组成[35-36]。本研究中,Saccharopolyspora、Pseudonocardiaceae_genus和Bacillus在强化前后都保持一定的优势地位,强化曲中的平均相对丰度分别为58.27%、20.02%和11.38%,Scopulibacillus相对丰度为0.55%。同时,Saccharopolyspora、Pseudonocardiaceae_genus、Saccharomonospora和Kroppenstedtia等非核心微生物属的生物量也同样明显增加。这可能是因为核心微生物会促进大曲中微生物间的协同作用,或通过改变大曲发酵过程中的pH值、温度或可利用营养物质的组成,从而为其他微生物提供了更有利的生长条件,间接影响其生长速度。结果表明,核心微生物的添加提升了细菌的总生物量,同时保持细菌群落结构相对稳定。
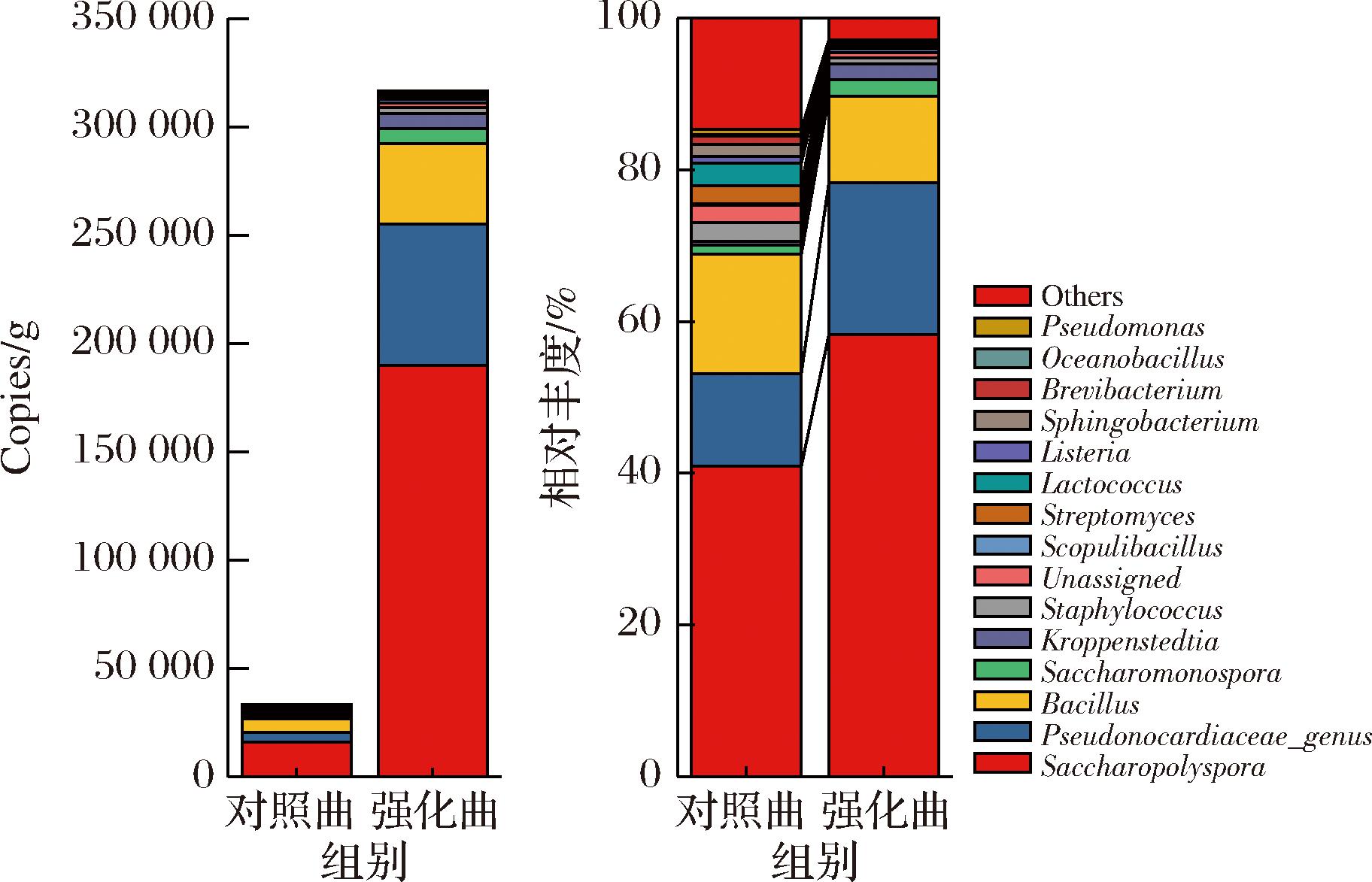
图6 大曲强化前后的细菌丰度
Fig.6 Bacterial abundance of Daqu before and after enhanced
如图7-a所示,强化前后大曲样本中共检测到80种香气化合物,各物质相对含量如附表3所示。在强化大曲中相对含量增加的化合物共有47种,占全部香气化合物的58.75%。吡嗪是大曲中重要的香气物质,可以提供烘焙、吐司、牛奶和坚果等香味,强化大曲中大多数吡嗪类化合物的含量明显提升,其中2,5-二甲基-3-戊基吡嗪、2-异丙基吡嗪、2,5-二甲基-3-丁基吡嗪、2,3,5-三甲基吡嗪和2,3,5,6-四甲基吡嗪的平均相对含量都显著高于对照组(P<0.05),分别为对照组的6.31、2.26、31.07、11.04、177.21倍。醇类化合物中,2,3-丁二醇和苯乙醇的平均相对含量是对照组的8.97、1.53倍(P<0.05)。一项研究表明,大曲中接种高产吡嗪的芽孢杆菌,吡嗪类物质的含量的显著提升与2,3-丁二醇增加有关[36]。有13种差异香气物质的含量得到明显提升,例如2,3-二甲基-5-乙基吡嗪(7.38倍)、2,5-二甲基吡嗪(1.67倍)、3-乙基-2,5-二甲基吡嗪(1.70倍)、3-辛醇(1.66倍)、异戊醇(1.40倍)、邻苯二甲醚(1.72倍)、苯酚(1.14倍)、苯乙醛(1.06倍)、异戊酸(1.08倍)、异丁酸(1.04倍)和苯基丙酮(1.27倍)。核心微生物的添加使大曲中多种吡嗪类化合物的含量明显提升,且相比于对照曲,强化大曲的风味化合物中出现了2,3-二甲基吡嗪(0.58 μg/kg),这和特征风味化合物与微生物间的相关性分析结果高度相似。

a-大曲强化后各风味化合物的变化倍数;b-大曲强化前后的风味强度差异
图7 大曲强化前后的风味变化
Fig.7 Changes of flavor of Daqu before and after enhanced
基于80种香气化合物的感官描述词对其进行不同分类,通过绘制雷达图,比较对照曲与强化曲的风味特征(图7-b)。两者在 “烟熏”“烟草”和“威士忌”等风味强度上基本一致。对照组中的 “干酪”和“花香”坐标轴最长,表明其主体风味为花香,且酸腐味较重。相比于对照组,强化大曲中香气更为丰富,其中“坚果”“烤肉”和“果香”具有更突出的风味表现,“杏仁”和“香草”的风味强度明显降低。以上数据表明,Scopulibacillus和Bacillus的引入改变了大曲的香气组成,增强了坚果、烤肉类及果香风味物质的生成,更体现了其在大曲风味形成中的核心作用。
3 结论
采用HS-SPME-GC-MS技术和高通量测序技术系统解析了3种大曲的挥发性风味化合物及微生物群落结构。结果表明,其香气组分和微生物群落存在显著差异,其中WQ和BQ以吡嗪类化合物为主,分别占总香气成分的55.73%和49.21%,而JQ以酯类化合物为主(66.30%)。WQ、BQ中Kroppenstedia、Virgibacillus、Bacillus、Saccharopolyspora为优势菌属,JQ中Thermoactinomyces是绝对优势属。通过PLS-DA,基于VIP确定了31种特征香气化合物,10种吡嗪类化合物对于区分不同主体风味的大曲具有重要作用。结合相关性分析,从3个维度判定了核心微生物为Scopulibacillus、Bacillus。通过分离培养并分析了不同菌株固态发酵的风味成分。其中,B.sonorensis的风味代谢能力最强,可以产生更多的酮类、醇类、吡嗪类化合物,有益于大曲及酒体风味。S.daqui的风味代谢能力最弱,但在微生物相互作用之间有着重要地位,对调节微生物结构、影响风味化合物组成具有重要作用。基于菌株的风味代谢特性将其组合应用至大曲制作中,大曲中吡嗪类物质的含量明显提升,促使大曲中坚果、烤肉类等风味的强度增加,体现了其在风味形成中的重要作用。
本研究有助于完善不同大曲中特征风味化合物及核心微生物的研究,在提升大曲品质、实现大曲风味定向调控方面具有重要意义。
[1] 邓杰, 张曼, 周杰, 等.2种浓香型白酒大曲中微生物群落结构及功能研究[J].食品科学技术学报, 2024, 42(4):75-85.DENG J, ZHANG M, ZHOU J, et al.Research on microbial community structure and function in 2 strong flavor Baijiu daqu[J].Journal of Food Science and Technology, 2024, 42(4):75-85.
[2] 余生玲, 杨岱霖, 郭辉祥, 等.黑褐色大曲对酱香型白酒风味的影响研究[J].酿酒科技, 2025(10):65-72.YU S L, YANG D L, GUO H X, et al.Influence of black daqu on the flavor of Jiangxiang Baijiu[J].Liquor-Making Science &Technology, 2025(10):65-72.
[3] 刘颖. 小麦品种对浓香型白酒大曲微生物菌群及风味物质形成的影响[D].雅安:四川农业大学, 2024.LIU Y.Effects of wheat varieties on microflora and flavor compounds formation in strong flavor Baijiu Daqu[D].Ya’an:Sichuan Agricultural University, 2024.
[4] 谭笑, 余佶, 雷鹏, 等.基于HS-SPME-GC-MS的不同生产月份馥郁香型白酒酿造用大曲挥发性成分分析[J].食品与机械, 2024, 40(8):40-48;69.TAN X, YU J, LEI P, et al.Analysis of volatile component in Daqu used for brewing Fuyu flavor Baijiu from different production months based on HS-SPME-GC-MS[J].Food &Machinery, 2024, 40(8):40-48;69.
[5] 邓阿玲, 唐杰, 朱楚天, 等.黑色高温大曲在固态发酵过程中的微生物群落及风味化合物演替驱动机制[J].食品科学, 2024, 45(23):102-112.DENG A L, TANG J, ZHU C T, et al.Driving mechanisms for microbial community succession and change of volatile flavor compounds during the solid-state fermentation of black high-temperature daqu[J].Food Science, 2024, 45(23):102-112.
[6] 楚京嬴, 吕嘉枥, 曹丹, 等.三种凤香型大曲中心区域细菌群落、理化特性及非靶向代谢物的差异性和相关性分析[J].陕西科技大学学报, 2024, 42(6):40-51.CHU J Y, LYU J L, CAO D, et al.Differential and correlation analysis of bacterial communities, physicochemical properties and untargeted metabolites in the central region of three kinds of Fengxiangxing Daqu[J].Journal of Shaanxi University of Science &Technology, 2024, 42(6):40-51.
[7] 刘瑶, 田新惠, 马超, 等.基于PacBio测序解析浓香型白酒酒醅发酵过程中细菌群落及其代谢特性变化[J].中国酿造, 2025, 44(1):80-84.LIU Y, TIAN X H, MA C, et al.Changes of bacterial community and its metabolic characteristic in fermentation process of strong-flavor Baijiu fermented grains based on PacBio sequencing[J].China Brewing, 2025, 44(1):80-84.
[8] 剧慧栋, 水小溪, 王宇, 等.3种不同香型大曲细菌群落与酒曲及白酒理化指标的相关性[J].食品安全质量检测学报, 2024, 15(20):288-296.JU H D, SHUI X X, WANG Y, et al.Correlation between bacterial community of 3 kinds of different flavor Daqu and physical and chemical indexes of Daqu and Baijiu[J].Journal of Food Safety &Quality, 2024, 15(20):288-296.
[9] 蒋力力, 田露琴, 尚煜豪, 等.不同种类高温大曲功能特性与成分差异比较[J].食品工业科技, 2025, 46(14):362-370.JIANG L L, TIAN L Q, SHANG Y H, et al.Comparison of functional characteristics and compositional differences of different high-temperature daqu[J].Science and Technology of Food Industry, 2025, 46(14):362-370.
[10] 侯小歌, 樊俊鹏, 郭福利, 等.小麦品种对浓香大曲细菌群落与挥发性风味化合物的影响[J].食品工业科技, 2024, 45(24):133-146.HOU X G, FAN J P, GUO F L, et al.Effects of wheat varieties on bacterial community and volatile flavor compounds in nongxiangxing daqu[J].Science and Technology of Food Industry, 2024, 45(24):133-146.
[11] WOLFE B E, BUTTON J E, SANTARELLI M, et al.Cheese rind communities provide tractable systems for in situ and in vitro studies of microbial diversity[J].Cell, 2014, 158(2):422-433.
[12] 王秀秀, 吕志远, 刘玉涛, 等.大曲微生物群落结构及其风味组分相关性研究[J].酿酒科技, 2025(2):31-38.WANG X X, LÜ Z Y, LIU Y T, et al.Correlation analysis of microbial community structure and flavor components of medium/high-temperature daqu[J].Liquor-Making Science &Technology, 2025(2):31-38.
[13] HUANG X, HONG M, MENG Q R, et al.The effects of core microorganism community on flavor compounds and active substances during the aging process of Citri Reticulatae Pericarpium[J].Food Research International, 2024, 191:114707.
[14] CHEN J, HUANG Y B, WANG X Y, et al.Revealing core functional microorganisms in the fermentation process of Qicaipaojiao (Capsicum annuum L.) based on microbial metabolic network[J].Food Research International, 2024, 187:114315.
[15] ZHANG H X, DU H, XU Y.Volatile organic compound-mediated antifungal activity of Pichia spp.and its effect on the metabolic profiles of fermentation communities[J].Applied and Environmental Microbiology, 2021, 87(9):e02992-20.
[16] 王高伟, 曹润洁, 陈双, 等.采用顶空固相微萃取结合全二维气相色谱飞行时间质谱解析不同等级中高温大曲的挥发性组分差异特征[J].食品与发酵工业, 2025, 51(2):285-292.WANG G W, CAO R J, CHEN S, et al.Analysis of volatile compounds differences in different grades medium-high temperature Daqu by headspace solid-phase microextraction with comprehensive two-dimensional gas chromatography time-of-flight mass spectrometry[J].Food and Fermentation Industries, 2025, 51(2):285-292.
[17] 陈心雨, 刘念, 王超凯, 等.高温大曲中美拉德反应的研究进展[J].食品与发酵科技, 2023, 59(6):109-112.CHEN X Y, LIU N, WANG C K, et al.Research progress of Maillard reaction in high temperature daqu[J].Food and Fermentation Science &Technology, 2023, 59(6):109-112.
[18] 王奕芳, 周容, 张明春, 等.白酒中重要的功能化合物吡嗪的研究进展[J].酿酒, 2018, 45(6):20-24.WANG Y F, ZHOU R, ZHANG M C, et al.Research progress in important function pyrazine compounds in Baijiu(Chinese liquor)[J].Liquor Making, 2018, 45(6):20-24.
[19] 孙细珍, 熊亚青, 倪兴婷, 等.吡嗪类化合物对酱香型白酒香气特征的影响分析[J].食品与发酵工业, 2025, 51(1):305-311.SUN X Z, XIONG Y Q, NI X T, et al.Analysis of the effect of pyrazine compounds on the aroma characteristics of Jiangxiangxing Baijiu[J].Food and Fermentation Industries, 2025, 51(1):305-311.
[20] 史凤, 马楷雨, 史改玲, 等.酱香型高温大曲发酵过程中风味物质分析[J].中国酿造, 2025, 44(1):52-59.SHI F, MA K Y, SHI G L, et al.Analysis of flavor compounds of sauce-flavor high-temperature Daqu during fermentation process[J].China Brewing, 2025, 44(1):52-59.
[21] 李霞, 高阳, 牛云蔚, 等.基于S-曲线法和OAV法研究食品中不同香韵相互作用[J].中国调味品, 2023, 48(5):87-91.LI X, GAO Y, NIU Y W, et al.Study on the interaction of different aroma notes in food based on S-curve method and OAV method[J].China Condiment, 2023, 48(5):87-91.
[22] 高传强. 芝麻香型白酒风味物质及其生物活性研究[D].武汉:湖北工业大学, 2017.GAO C Q.Study on flavor compounds and biological activity of sesame flavor liquor[D].Wuhan:Hubei University of Technology, 2017.
[23] HONG J X, CHEN L, ZHAO D R, et al.Multivariate analysis on the relationship between radical scavenging activities and phenolic compounds of Baijiu and its protective effect against LPS-induced inflammation in THP-1 cells[J].International Food Research Journal, 2022, 29(1):116-127.
[24] WU S L, DU H, XU Y.Daqu microbiota adaptability to altered temperature determines the formation of characteristic compounds[J].International Journal of Food Microbiology, 2023, 385:109995.
[25] DONG W W, YU X, WANG L Y, et al.Unveiling the microbiota of sauce-flavor Daqu and its relationships with flavors and color during maturation[J].Frontiers in Microbiology, 2024, 15:1345772.
[26] 马梦月, 郭壮, 李学思, 等.临沂和周口地区中高温大曲细菌群落结构与基因功能差异性研究[J].食品工业科技, 2024, 45(1):155-161.MA M Y, GUO Z, LI X S, et al.Research on the differences in bacteria community structure and gene function of medium-high temperature daqu in Linyi and Zhoukou areas[J].Science and Technology of Food Industry, 2024, 45(1):155-161.
[27] 胡智慧, 陈方, 郭雪峰, 等.白酒中健康因子2, 3, 5, 6-四甲基吡嗪形成机理的研究进展[J].中国酿造, 2024, 43(1):27-33.HU Z H, CHEN F, GUO X F, et al.Research progress on formation mechanism of health factor 2, 3, 5, 6-tetramethylpyrazine in Baijiu[J].China Brewing, 2024, 43(1):27-33.
[28] QI G F, KANG Y F, LI L, et al.Deletion of meso-2, 3-butanediol dehydrogenase gene bud C for enhanced D-2, 3-butanediol production in Bacillus licheniformis[J].Biotechnology for Biofuels, 2014, 7(1):16.
[29] XU Y Q, JIANG Y F, LI X T, et al.Systematic characterization of the metabolism of acetoin and its derivative ligustrazine in Bacillus subtilis under micro-oxygen conditions[J].Journal of Agricultural and Food Chemistry, 2018, 66(12):3179-3187.
[30] 刘续, 陆震鸣, 张晓娟, 等.高温大曲中大曲慢生芽孢杆菌的分离鉴定与特性分析[J].微生物学通报, 2025, 52(5):2189-2202.LIU X, LU Z M, ZHANG X J, et al.Isolation and characterization of Lentibacillus daqui from high-temperature daqu[J].Microbiology China, 2025, 52(5):2189-2202.
[31] GU W, LI X M, HUANG J W, et al.Cloning, sequencing, and overexpression in Escherichia coli of the Enterobacter sp.Px6-4 gene for ferulic acid decarboxylase[J].Applied Microbiology and Biotechnology, 2011, 89(6):1797-1805.
[32] 何宏魁, 吴浩, 刘智慧, 等.产4-乙烯基愈创木酚菌种的筛选及在浓香型白酒生产中的应用研究[J].酿酒科技, 2024(7):83-86.HE H K, WU H, LIU Z H, et al.Screening of 4-vinylguaiacol-producing strain and its application in the production of Nongxiang Baijiu[J].Liquor-Making Science &Technology, 2024(7):83-86.
[33] 李腾杰, 梁孙妍, 郭健衡, 等.特基拉芽孢杆菌XK29挥发物2-甲基丁酸对甘薯长喙壳菌的抑制作用研究[J].微生物学报, 2022, 62(12):5018-5028.LI T J, LIANG S Y, GUO J H, et al.Inhibitory effects of volatile 2-methylbutyric acid produced by Bacillus tequilensis XK29 on Ceratocystis fimbriata[J].Acta Microbiologica Sinica, 2022, 62(12):5018-5028.
[34] YAO S, ZHAI L, XIN C H, et al.Scopulibacillus daqui sp.nov., a thermophilic bacterium isolated from high temperature daqu[J].International Journal of Systematic and Evolutionary Microbiology, 2016, 66(11):4723-4728.
[35] ALI A, WU Y F, LI W W, et al.Biotechnological approaches for targeted strain screening and enhancement of Daqu for quality Baijiu production[J].Food Bioscience, 2024, 61:104885.
[36] ZHANG P P, LIU Y B, LI H D, et al.Bioturbation effect of high - Yield pyrazine strain on the microbial community and flavour metabolites of fortified Daqu[J].LWT, 2024, 208:116711.