肉类蛋白是人类饮食中不可缺少的一部分。肌原纤维蛋白(myofibrillar proteins,MP)是肉类蛋白质的主要成分,约占肌肉蛋白的55%~60%,一般用高离子强度缓冲液提取,是典型的盐溶性蛋白[1]。与植物蛋白相比,MP必需氨基酸含量高且具有低致敏性。与其他肉类蛋白相比,MP表现出良好的油水界面特性和吸附性[2]。近年来MP基乳液在营养物质递送[3]、鱼糜凝胶脂肪替代物[4]、易吞咽产品[5]和3D打印[6]等食品领域的开发应用,受到广泛关注。
众所周知,蛋白质分子结构变化与其功能属性密切相关。MP的功能属性主要取决于其内在结构(分子构象和氨基酸组成等)及外在条件(pH值、温度、离子强度等)。低离子强度时,MP乳液的乳化性低,易发生絮凝和聚集,而在过高离子强度溶液中,由于电荷屏蔽效应,会影响MP乳液的稳定性[7]。此外,MP乳液中油滴的氧化作用会对乳液带来负面影响。因此在加工和贮藏过程中,改善其油水界面性能尤为重要。
目前,改善MP油水界面特性的方法分为物理法和化学法[8-10]。例如,HOU等[8]发现超声空化效应可改善MP乳液的乳化活性(emulsifying activity index,EAI)和乳化稳定性(emulsifying stability index,ESI),处理10 min时ESI达到最大,而EAI则随处理时间的增加而增大。JIA等[9]在低离子强度(0.03 mol/L KCl溶液)下使用磷焦磷酸钠或三聚磷酸钠提升了MP乳液的稳定性,降低了液滴大小。而MP乳液在油水界面稳定性主要受MP结构、颗粒大小、浓度、界面膜厚度和界面扩散速度等影响[11-14]。SUN等[12]发现在MP微凝胶颗粒稳定性的Pickering乳液中,其界面稳定性机制在于MP微凝胶颗粒达到中等润湿性后,在界面上扩散更快,形成的乳液液滴更小。TANG等[13]认为MP相互作用增强,导致界面处蛋白快速聚集和重排是MP基乳液油水界面稳定的潜在原因。关于MP基乳液的研究近年来显著增加,但MP油水界面特性改善手段及MP在界面处的稳定机制还暂无深入和全面的总结。
因此,本文综述了不同改性方法对MP油水界面特性的改善作用和提升效果,重点介绍了MP乳液油水界面稳定的机理,主要针于MP及其复合物的Pickering乳液、乳液凝胶、纳米乳液3个方面进行阐述,并介绍了当前MP基乳液在食品中的应用,提出了MP乳液发展的不足,以期为开发更稳定和多功能应用的MP乳液提供参考。
1 MP油水界面特性改善方法
如表1所示,MP的油水界面特性主要通过改善EAI、ESI、吸附蛋白(adsorbed proteins,AP)、液滴大小、界面张力、絮凝指数(flocculation index,Fi)、聚集指数(coalescence index,Ci)和乳化指数(creaming index,CI)等。
表1 改性方法对肌原纤维蛋白油水界面特性的改善
Table 1 Effects of modification methods on the oil-water interfacial properties of myofibrillar protein
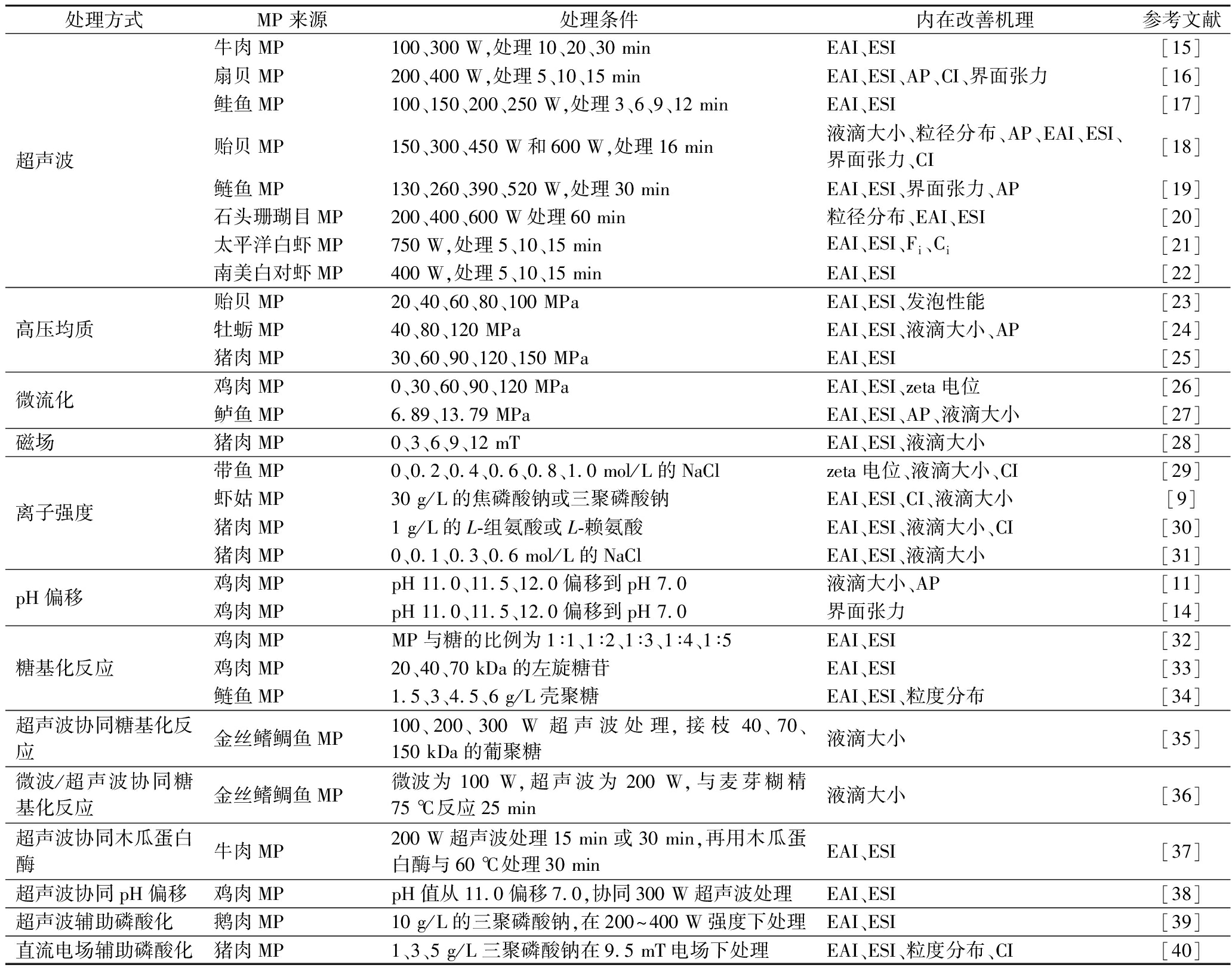
处理方式MP来源处理条件内在改善机理参考文献超声波牛肉MP100、300 W,处理10、20、30 minEAI、ESI[15]扇贝MP200、400 W,处理5、10、15 minEAI、ESI、AP、CI、界面张力[16]鲑鱼MP100、150、200、250 W,处理3、6、9、12 minEAI、ESI[17]贻贝MP150、300、450 W和600 W,处理16 min液滴大小、粒径分布、AP、EAI、ESI、界面张力、CI[18]鲢鱼MP130、260、390、520 W,处理30 minEAI、ESI、界面张力、AP[19]石头珊瑚目MP200、400、600 W处理60 min粒径分布、EAI、ESI[20]太平洋白虾MP750 W,处理5、10、15 minEAI、ESI、Fi、Ci[21]南美白对虾MP400 W,处理5、10、15 minEAI、ESI[22]高压均质贻贝MP20、40、60、80、100 MPaEAI、ESI、发泡性能[23]牡蛎MP40、80、120 MPaEAI、ESI、液滴大小、AP[24]猪肉MP30、60、90、120、150 MPaEAI、ESI[25]微流化鸡肉MP0、30、60、90、120 MPaEAI、ESI、zeta电位[26]鲈鱼MP6.89、13.79 MPaEAI、ESI、AP、液滴大小[27]磁场猪肉MP0、3、6、9、12 mTEAI、ESI、液滴大小[28]离子强度带鱼MP0、0.2、0.4、0.6、0.8、1.0 mol/L的NaClzeta电位、液滴大小、CI[29]虾姑MP30 g/L的焦磷酸钠或三聚磷酸钠EAI、ESI、CI、液滴大小[9]猪肉MP1 g/L的L-组氨酸或L-赖氨酸EAI、ESI、液滴大小、CI[30]猪肉MP0、0.1、0.3、0.6 mol/L的NaClEAI、ESI、液滴大小[31]pH偏移鸡肉MPpH 11.0、11.5、12.0偏移到pH 7.0液滴大小、AP[11]鸡肉MPpH 11.0、11.5、12.0偏移到pH 7.0界面张力[14]糖基化反应鸡肉MPMP与糖的比例为1∶1、1∶2、1∶3、1∶4、1∶5EAI、ESI[32]鸡肉MP20、40、70 kDa的左旋糖苷EAI、ESI[33]鲢鱼MP1.5、3、4.5、6 g/L壳聚糖EAI、ESI、粒度分布[34]超声波协同糖基化反应金丝鳍鲷鱼MP100、200、300 W超声波处理,接枝40、70、150 kDa的葡聚糖液滴大小[35]微波/超声波协同糖基化反应金丝鳍鲷鱼MP微波为100 W,超声波为200 W,与麦芽糊精75 ℃反应25 min液滴大小[36]超声波协同木瓜蛋白酶牛肉MP200 W超声波处理15 min或30 min,再用木瓜蛋白酶与60 ℃处理30 minEAI、ESI[37]超声波协同pH偏移鸡肉MPpH值从11.0偏移7.0,协同300 W超声波处理EAI、ESI[38]超声波辅助磷酸化鹅肉MP10 g/L的三聚磷酸钠,在200~400 W强度下处理EAI、ESI[39]直流电场辅助磷酸化猪肉MP1、3、5 g/L三聚磷酸钠在9.5 mT电场下处理EAI、ESI、粒度分布、CI[40]
1.1 物理法改性
物理法改性主要通过超声波、高压均质和微流化等方式改变蛋白质分子的构象和聚集程度,从而改善油水界面特性(图1)[22,25-26]。其优点在于廉价、绿色、安全性高和处理迅速等,受到食品工业的高度关注。

图1 物理与化学方法对肌原纤维蛋白油水界面特性改善机理
Fig.1 Improvement mechanism myofibrillar protein oil-water interface by physical and chemical methods
1.1.1 超声波处理
超声波可通过发射不同频率的机械波来改善食品特性,其强度范围可分为低强度(100 kHz~1 MHz,功率<1 W cm-2)和高强度(20~100 kHz,功率10~1 000 W cm-2)[16]。在超声波作用下,液体的微小气泡受到空化效应会迅速破裂,进而产生高剪切力[15]。空化效应可提高扩散速率、改变MP结构并降低乳液的絮凝和聚集。
AMIRI等[15]发现高强度超声波(100 W和300 W,处理10、20、30 min)增加了MP的EAI和ESI,因为高强度超声波增强了MP的表面疏水性,使MP在油水界面的吸附力增加。强界面吸附能力会促进强烈的界面相互作用(MP与MP、MP与水、MP与油滴),形成更小液滴,提升乳液稳定性[41]。YU等[16]处理扇贝MP时发现,随着超声波强度和时间的增加,乳液的AP逐渐增加,界面张力不断降低,这源于MP经超声波处理后,聚集程度降低,溶解度增加。超声波处理也会引起MP二级结构的变化,使α-螺旋向β-折叠转变,β-折叠的形成会促进MP与油滴间的界面吸附,有助于界面蛋白膜的形成[42]。超声波处理后,MP三级结构发生变化(疏水基团展开),暴露了芳香族氨基酸,有利于MP在油水界面扩散,MP疏水基团更接近油相,亲水基团更接近水相[19-20]。但过度超声波处理会导致MP内部氢键的重建,结构由无序向有序转变,同时原本暴露的氨基酸残基重新聚集,降低其溶解度[18]。DENG等[17]发现MP经200 W超声波处理超过9 min后,其表面疏水性降低,EAI和ESI均下降。
上述结果表明,超声空化效应提升了MP的溶解度和疏水性,减小了乳液尺寸,增大其表面积,而过度处理则会引发MP聚集,对乳液产生不利影响。
1.1.2 高压均质
高压均质(high-pressure homogenization,HPH)是一种非热加工技术,可快速促进分子运动,破坏分子间的疏水相互作用,阻碍MP聚集体的出现,使MP具有优异的油水界面特性[23-24]。LEE等[25]采用HPH(30、60、90、120、150 MPa)处理猪肉MP时发现,EAI和ESI随HPH压力的增加,呈先增加后降低的趋势,120 MPa时达到最大值(分别为90.97%和73.63%),而在低压(30、60 MPa)时,无法有效阻止MP聚集,并出现相分离,当压力超过60 MPa后,相分离速度减慢,乳液稳定性增大。这表明HPH可促进MP疏水基团暴露,增强分子运动,提升乳液稳定性。
1.1.3 微流化
微流化是一种新颖的生物大分子改性技术,主要应用于植物蛋白,在MP改性方面应用较少。HAN等[26]使用微流化技术(0~120 MPa)处理鸡肉MP时发现, 90 MPa时ESI达到最大值(62.5%)。微流化处理后,形成高静电斥力,增强MP表面疏水性,克服液滴间的相互吸引,剪切作用减小液滴,使MP在油水界面的迁移速率加快,增强了MP与水、MP与油的相互作用。但微流化的高压力可能会促进肌球蛋白过度展开的疏水基团通过疏水相互作用结合导致液滴聚集,MP向油水界面的吸附性降低,不利于扩散和界面重排[27]。
1.2 化学法改性
如图1所示,化学法改性主要有离子强度效应、pH偏移和糖基化。不同离子强度对MP溶解度影响不同,溶解度高有助于MP在油水界面稳定,pH偏移通过改善MP结构增加乳化性能,而糖基化则通过增加结合位点,阻止液滴絮凝,进而提升乳液稳定性。
1.2.1 离子强度效应
离子强度对MP的功能特性至关重要,可改变MP分子的结构和粒径大小,进一步改善乳液稳定性[29]。MP的溶解度呈现明显的离子强度依赖性,当NaCl浓度为0.6 mol/L时达到最大。此时MP结构展开,与水的接触面积增大,疏水性残基的暴露有助于油水界面的重排和结合[29]。但高离子强度下,小尺寸的MP乳液表面积大,易促进氧化物扩散到油相,造成脂质氧化,进而影响相邻蛋白质的性质[43]。
L-赖氨酸、L-组氨酸和L-精氨酸是典型的碱性氨基酸,低离子强度时分子表面的阳离子与MP之间可通过静电相互作用结合,可促进MP疏水结构暴露,从而提升MP的油水界面特性[30]。并且,疏水性增强后会降低肌球蛋白渗透所需的能量,并诱导肌球蛋白由刚性转变成柔性,MP吸附到界面后,形成具有黏弹性的界面膜,降低了界面张力[44]。此外,碱性氨基酸与MP在液滴表面存在竞争性吸附,可参与界面膜的形成,使MP乳化活性更高[45]。
1.2.2 pH偏移
pH偏移是一种改善油水界面特性的有效方法,通过将MP暴露于极端pH下,将其中和以获得熔融状态,使MP重新折叠,折叠后的MP比天然MP具有更快的扩散速率和更强的膨胀弹性行为[14]。MP由展开到重新折叠过程,分子构象改变,导致油水界面特性改变。LU等[11]在不同碱性pH(11.0、11.5、12.0)下处理鸡肉MP时发现,其乳液的AP大于天然MP乳液,这归因于pH变化引起了疏水区域变化,再次折叠后MP粒径变小,吸附在油水界面处的速度加快。再折叠后MP柔韧性降低,MP之间的相互作用增强,形成了更厚的蛋白膜使MP乳化性能更强。不同pH值下,MP溶解度受到影响,高溶解度的MP促进了界面膨胀,增强了水相与油相的结合性能。
1.2.3 糖基化反应
蛋白质糖基化反应是一种安全高效的修饰蛋白质油水界面特性的方法,其接枝的糖类具有空间位阻,可阻止乳液的聚集和絮凝,从而提高乳液稳定性。
不同糖类与MP之间发生糖基化反应后,对MP的改善效果不同。单糖比多糖改善MP油水界面特性更有效,而醛糖比酮糖效果则更显著。D-核糖与MP接枝程度高,使MP的结构变得无序,接枝后的复合物暴露出更多的结合位点,交联作用强,溶液中MP分布更加均匀[32]。且接枝后的糖类在水相中具有空间位阻,可阻止液滴间的聚集,分子质量更大的糖类空间位阻更多,与油水界面接触更广[33]。糖浓度的增加会减小混合物的粒径,糖类与MP之间结合更多,对MP起到良好的保护作用可有效阻止其聚集[34]。但糖含量低时,加热对MP保护作用不足,乳液稳定性提升不明显。
1.3 联合法改性
联合法改性一般是将2种及以上改性方式相结合,相比单一改性方法效果更佳。例如,超声波协同糖基化反应中,超声波主要起到提高MP扩散、吸收和加速重排及控制糖基化反应的作用,防止过度接枝使MP变性[35]。超声波还可协同微波技术共同改善糖基化反应,电磁波可到达空化效应难以到达的区域,超声波则有助于微波热量的消散[36]。此外,超声波处理可改善酶交联MP时间长、效率低的问题[37]。超声波通过其强大剪切力,诱导肌球蛋白解聚,抑制肌球蛋白的自组装行为,协同H2O2处理后可干扰巯基转化为二硫键,使MP乳液具有更高的稳定性[7]。
pH偏移可促进蛋白结构展开和重折叠,在MP展开阶段协同超声可增加其表面积,再经重折叠阶段可形成更致密的结构。但若在MP重折叠阶段使用超声波处理,则会抑制pH值的偏移。重折叠时各组分折叠速度不同,肌球蛋白尾部会先发生结合,大量蛋白质聚集形成松散的结构,最终形成不稳定的乳液[38]。
磷酸化通过增大电负性并引起MP结构展开,增强液滴之间的静电斥力,有效平衡界面张力,在低离子强度时,磷酸化对于MP的改善效果更为明显[9]。超声波辅助磷酸化处理可加速MP二级结构由有序向无序的转变,暴露更多疏水基团,提高MP的亲脂性,但过度的空化效应,会减弱磷酸化的效果,促使乳液聚集[39]。直流电磁场会促进焦磷酸四钠与MP结合生成更大的聚集体,并在界面处解离和吸附,形成新界面,以改善油水界面特性[40]。
2 MP基乳液油水界面稳定机理
2.1 Pickering乳液
MP具有两亲性,可作为Pickering乳液稳定剂(图2)。三相接触角(θ)常用来表征乳液在油水界面的润湿性,如果θ<90°,MP表现出亲水性;θ>90°,MP则更加疏水[32]。改性后的MP具有中等润湿性(θ接近90°),既具有良好的油水界面吸附性,形成的液滴更加均匀,又可形成位阻屏障阻止乳液的絮凝和聚集,以抗氧化和奥斯瓦尔德熟化[46]。Pickering乳液在油水界面稳定受到pH值的影响。当pH低于MP等电点时,蛋白质带正电,静电斥力导致MP形成聚集体,内部结构松散;pH大于等电点时,乳化过程中MP在界面处重新组装和交联,增强相邻吸附蛋白间的相互作用,以达到油水界面的稳定[47]。如表2所示,稳定Pikering乳液的颗粒可分为MP微凝胶、MP-多酚和MP-多糖。

图2 Pickering乳液油水界面稳定机理
Fig.2 Oil-water interface stabilization mechanism of Pickering emulsion
表2 不同肌原纤维蛋白乳液油水界面的稳定性机理
Table 2 Oil-water interface stabilization mechanism of different myofibrillar protein emulsion
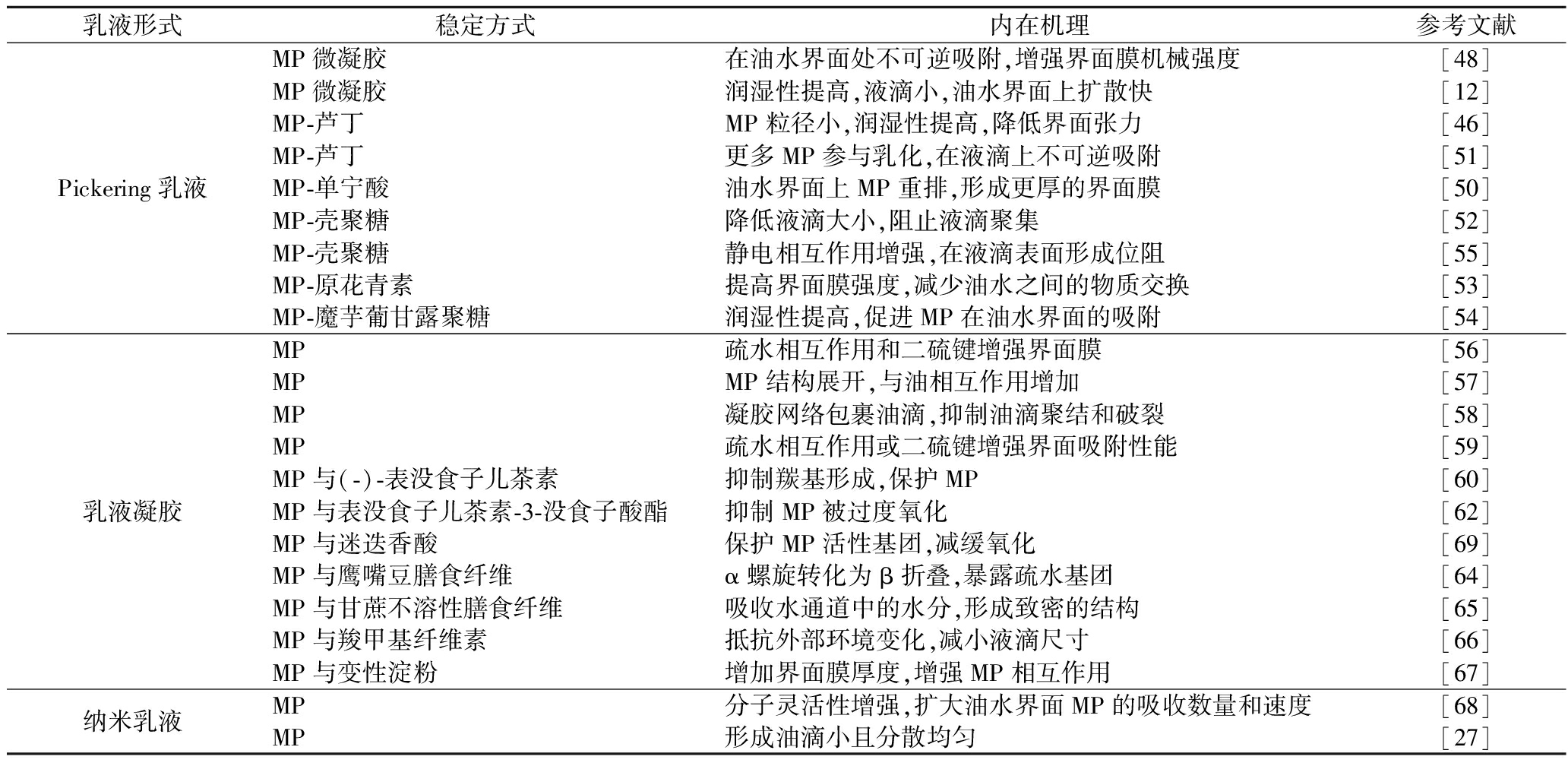
乳液形式稳定方式内在机理参考文献Pickering乳液MP微凝胶在油水界面处不可逆吸附,增强界面膜机械强度[48]MP微凝胶润湿性提高,液滴小,油水界面上扩散快[12]MP-芦丁MP粒径小,润湿性提高,降低界面张力[46]MP-芦丁更多MP参与乳化,在液滴上不可逆吸附[51]MP-单宁酸油水界面上MP重排,形成更厚的界面膜[50]MP-壳聚糖降低液滴大小,阻止液滴聚集[52]MP-壳聚糖静电相互作用增强,在液滴表面形成位阻[55]MP-原花青素提高界面膜强度,减少油水之间的物质交换[53]MP-魔芋葡甘露聚糖润湿性提高,促进MP在油水界面的吸附[54]乳液凝胶MP疏水相互作用和二硫键增强界面膜[56]MPMP结构展开,与油相互作用增加[57]MP凝胶网络包裹油滴,抑制油滴聚结和破裂[58]MP疏水相互作用或二硫键增强界面吸附性能[59]MP与(-)-表没食子儿茶素抑制羰基形成,保护MP[60]MP与表没食子儿茶素-3-没食子酸酯抑制MP被过度氧化[62]MP与迷迭香酸保护MP活性基团,减缓氧化[69]MP与鹰嘴豆膳食纤维α螺旋转化为β折叠,暴露疏水基团[64]MP与甘蔗不溶性膳食纤维吸收水通道中的水分,形成致密的结构[65]MP与羧甲基纤维素抵抗外部环境变化,减小液滴尺寸[66]MP与变性淀粉增加界面膜厚度,增强MP相互作用[67]纳米乳液MP分子灵活性增强,扩大油水界面MP的吸收数量和速度[68]MP形成油滴小且分散均匀[27]
2.1.1 单独MP稳定的Pickering乳液
MP微凝胶是对MP预热处理后的凝胶颗粒,可作为Pickering乳液的良好稳定剂,其同时具有颗粒状特性和凝胶状物质性能[13]。热处理后MP微凝胶疏水相互作用增强,可增加界面膜的机械强度。均质过程会使MP微凝胶破碎成小颗粒,小粒径的微凝胶可快速到达并锚定于油水界面,并发生不可逆吸附[48]。MP的Pickering乳液还受到颗粒浓度的影响。低浓度时乳化液滴的尺寸大,主要通过桥接絮凝共享一个蛋白质,形成的乳液稳定性差,当达到合适浓度后,MP接近中等润湿性,扩散到油水界面的阻力小,重排所需能量低[12,49]。且MP浓度提升后吸附蛋白增多,导致界面膜的厚度增加,有助于形成弹性的界面膜,更抗液滴团聚。MP单独作为Pickering乳化剂时通过简单处理可改善其在油水界面的稳定性,这与MP本身所具有的部分疏水结构的暴露和改善有关。
2.1.2 MP-多酚稳定的Pickering乳液
多酚具有良好的抗氧化能力,可通过共价(二硫键)或非共价作用(氢键和疏水相互作用等)改变MP的结构,使其达到油水界面稳定的效果[46]。例如,自身携带亲水性基团的单宁酸加入到MP溶液中会降低MP的表面疏水性,但其交联作用会促使界面上MP重排,形成更厚的界面保护膜,且单宁酸交联MP会形成更多二硫键,加固交联网络将油滴封锁[50]。油水比例会影响多酚与MP基乳液,过高的油相会阻碍多酚与MP的交联。芦丁与MP共价交联后,更多MP参与乳液形成,交联络合物在液滴表面发生不可逆吸附,但过多油相(φ=0.80)会导致油滴过大,界面处的MP吸附性差,难以形成紧密的保护膜,反而会降低乳液稳定性[51]。多酚可增加MP分子质量、促进其疏水基团暴露,其抗氧化作用对MP的Pickering乳液的稳定和贮藏有重要研究价值。
2.1.3 MP-多糖稳定的Pickering乳液
多糖和蛋白质之间可通过静电斥力、氢键等相互作用结合,主要受到内部因素(分子质量、多糖种类)与外部因素(pH、离子强度、反应温度与时间)的影响。多糖与MP复合物的油水界面稳定性机理可分为以下三个方面[52-53]:1)多糖与MP非共价作用结合,使MP更接近中等润湿性,并在油水界面处形成致密的保护膜;2)多糖与MP复合物形成的粗糙表面在油水界面处形成稳定的蛋白膜,可减少油水间的物质交换;3)高黏性的多糖有利于液滴分散成小液滴,阻止液滴之间的聚集。低质量浓度(2.5~5 g/L)魔芋葡甘露聚糖可促使MP内部疏水结构暴露,使MP达到中等润湿性,蛋白残基吸附在油滴表面形成保护膜,有效防止液滴的聚集和絮凝,高质量浓度(>10 g/L)时,魔芋葡甘露聚糖会竞争吸附在油水界面处,形成连续的水凝胶,减少了MP的吸附位点,降低乳液稳定性[54]。壳聚糖是带电多糖,可通过静电相互作用阻止MP聚集,促进油水界面稳定,也可通过两者形成的可溶性配合物在液滴表面形成额外位阻[55]。多糖因自身亲水能力及部分多糖携带的疏水性基团(乙酰基),可提高与MP共稳定的Pickering乳液稳定性。
2.2 乳液凝胶
乳液凝胶是通过不同方式(热处理和酶处理等)使乳液凝固,从液态转变为固态的凝胶型乳液。乳化时MP通过疏水相互作用等在油水界面达到稳定,加热后油滴以填充或作为共聚物与MP相互作用形成良好凝胶(图3)。而MP的凝胶化过程主要是加热时内部肌球蛋白解离,疏水基团暴露,肌球蛋白头部通过疏水相互作用相互吸引进而形成连续的凝胶。此时,油滴在凝胶网络中的位置及MP乳液在水相中形成三维网状结构,是影响MP乳液凝胶的关键。如表2所示,MP乳液凝胶可分为单独MP、MP-多酚和MP-多糖稳定的乳液凝胶。
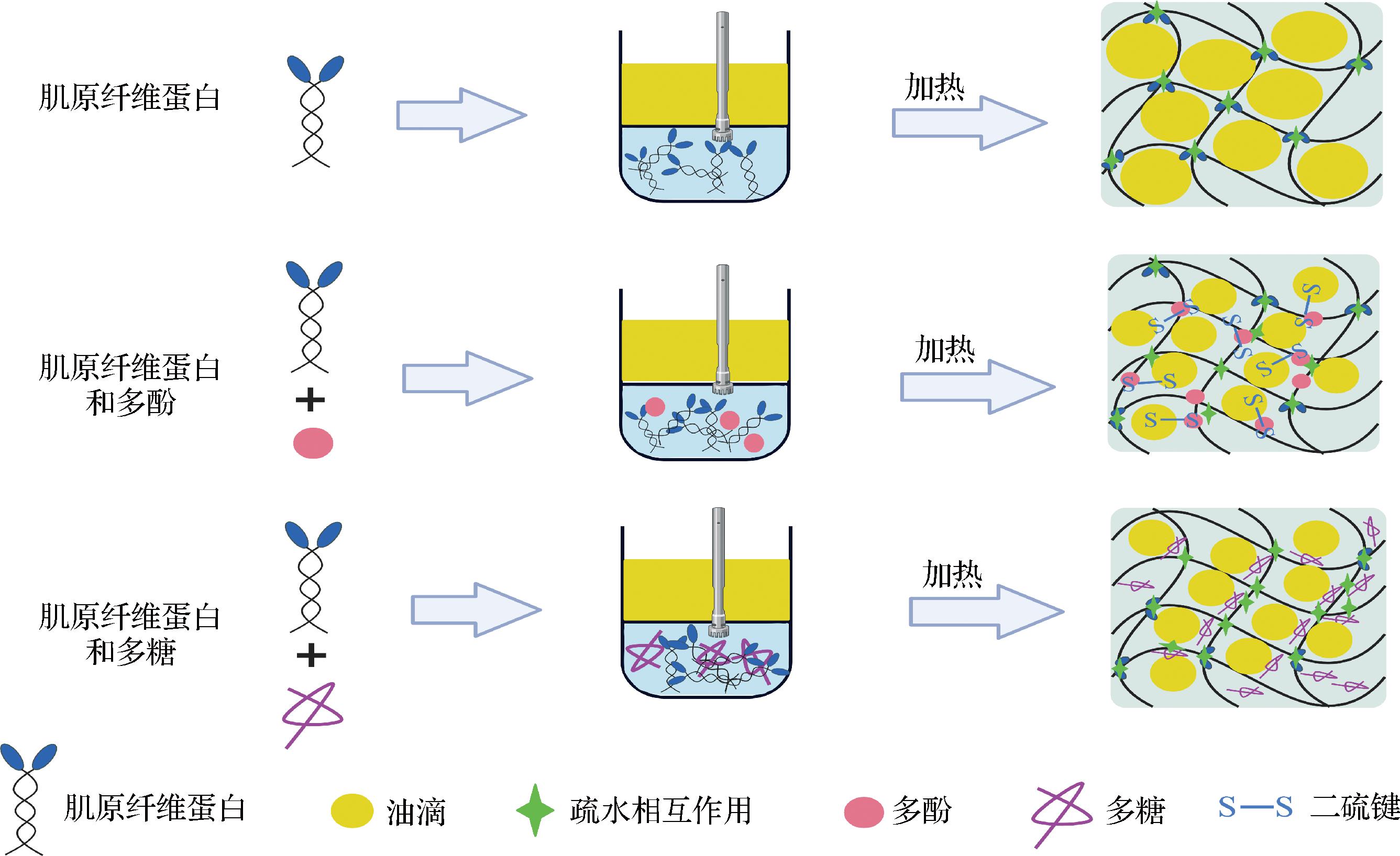
图3 乳液凝胶油水界面及凝胶结构稳定机理
Fig.3 Stabilization mechanism of emulsion gel oil-water interface and gel structure
2.2.1 单独MP稳定的乳液凝胶
单独MP乳液凝胶的稳定性主要受到2个方面影响。一是油脂浓度与界面处的性质。油脂浓度低时,空间位阻弱,稳定性低;油脂浓度饱和时,吸附在界面处的MP浓度增加,有利于MP与界面处相邻分子间的相互作用,形成较厚的蛋白膜,此时形成的乳液凝胶系统稳定[56]。且适度油脂氧化,可促进MP在界面处展开,导致蛋白与油脂的相互作用增强,有利于后续加热时交联网络的形成[57]。二是乳液中MP的浓度。乳化时,吸附到油水界面处的MP会降低界面张力;加热时界面处肌球蛋白头部结合,形成的连续凝胶结构不易分离。但低浓度时MP体系不稳定,易发生桥接絮凝,导致油水分离;达到合适浓度后,界面处MP的相互作用强,易包裹油滴,乳液凝胶的稳定性高;浓度过高的MP乳化时会在液滴周围出现大量MP,加热后过度交联会降低乳液凝胶的黏弹性[58]。天然MP含有巯基结构,热处理过程中可转化为二硫键,在油水界面处形成稳定的蛋白膜,可有效阻止乳液凝胶中油滴的迁移。此外,热处理过程中疏水作用会引起MP聚集降低膜厚度,而填充的油滴会通过排斥作用促使连续相中的MP含量增加,增大膜的刚性[59]。
2.2.2 MP-多酚稳定的乳液凝胶
MP乳液在肉类加工过程中易受自由基攻击,促使蛋白质和脂质发生氧化,导致硫醇的损失和羰基的形成,进而影响MP乳液凝胶的品质[60]。丙二醛是脂质氧化产生的醛类,可诱导MP的氧化和席夫碱的形成,低浓度可修饰MP侧链。而高浓度会诱导MP过度聚集,导致乳液的油相分离,吸附在油水界面的蛋白质也随之分离,形成过度紧密的非三维网状结构[61]。多酚的抗氧化能力可延缓氧化物的产生,是天然的抑制剂。但多酚及其衍生物会通过共价与非共价相互作用影响MP的结构,甚至导致乳液凝胶劣化。表没食子儿茶素-3-没食子酸酯可与丙二醛形成丙二醛-多酚衍生物,有效抑制丙二醛对MP的过度交联,但随着多酚含量的增加,MP残基上的硫醇和氨基被修饰,油水界面处MP分子内的相互作用降低,易发生液滴的聚集[62]。此外,多酚可被氧化成奎宁,而奎宁可与MP的硫醇或氨基发生反应,2种复合物(鲲-巯基和鲲-氨基)阻断了界面蛋白和凝胶基质蛋白间的共价键,导致油滴发生迁移[63]。因此,低剂量多酚可保护MP活性基团,减缓氧化,高剂量多酚则会阻碍油滴与吸附蛋白和未吸附蛋白的交联。
2.2.3 MP-多糖稳定的乳液凝胶
多糖可提高MP乳液凝胶水和脂肪的结合能力。例如,鹰嘴豆膳食纤维是一种不溶性膳食纤维,可与MP一起吸附在油水界面,形成更厚的蛋白膜,且自身羟基可促进MP的结构展开,增加MP疏水性,加热时形成致密的三维网络[64]。不溶性膳食纤维还可依靠自身特性,吸收乳液凝胶相互连通水通道中的水分,使MP乳液凝胶形成致密的三维网状结构[65]。羧甲基纤维素是一种阴离子多糖,可增加液滴表面的电荷数,增大排斥力,有效抑制MP从界面进入水溶液中,且可使油滴紧密排列在界面处[66]。此外,变性淀粉可增加界面蛋白膜密度,加强界面蛋白之间及界面蛋白与连续相聚合物之间的疏水相互作用[67]。因此MP-多糖乳液凝胶的稳定性可能是通过界面处吸附蛋白膜的形成或是MP疏水结构的改善,也有可能是多糖自身的特性改善了三维网络结构。
2.3 MP纳米乳液
纳米乳液粒径小,比表面积大,相比微米级乳液具有更强的动力学稳定性(图4)。高压均质产生的能量不易消散,常用于制备纳米乳液。MP在处理时经过强烈的剪切和空化,疏水基团暴露,使MP与油相之间发生更多相互作用,分子灵活性增强,扩大了油水界面蛋白质的吸收数量和速度,减少了油滴聚集[68]。而MP纳米乳液受制备条件的影响,过高能量的输入使得分子降解及形成的界面被破坏,MP在界面处吸附性差,而低能量更是无法制备出稳定的纳米乳液[27]。
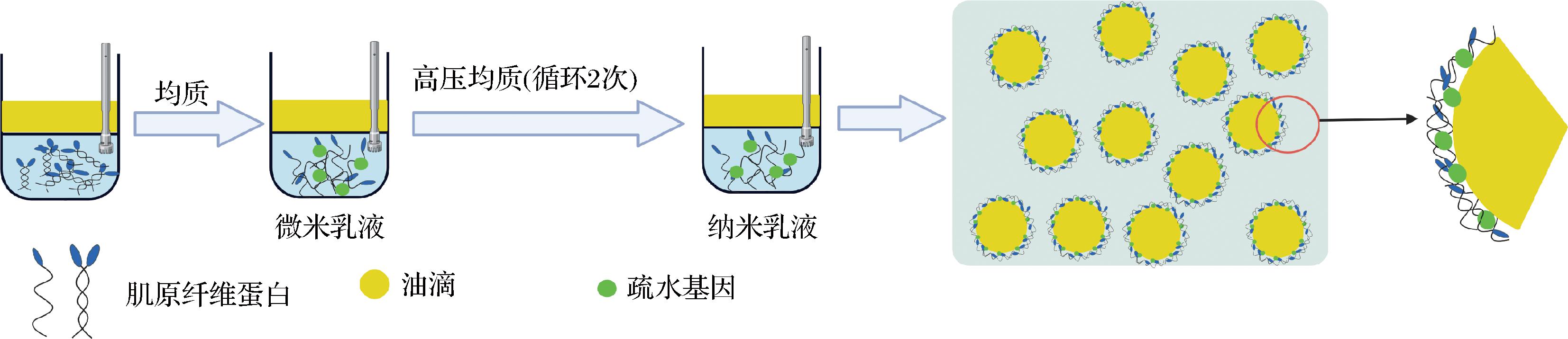
图4 纳米乳液油水界面稳定机理
Fig.4 Oil-water interface stabilization mechanism of nanoemulsion
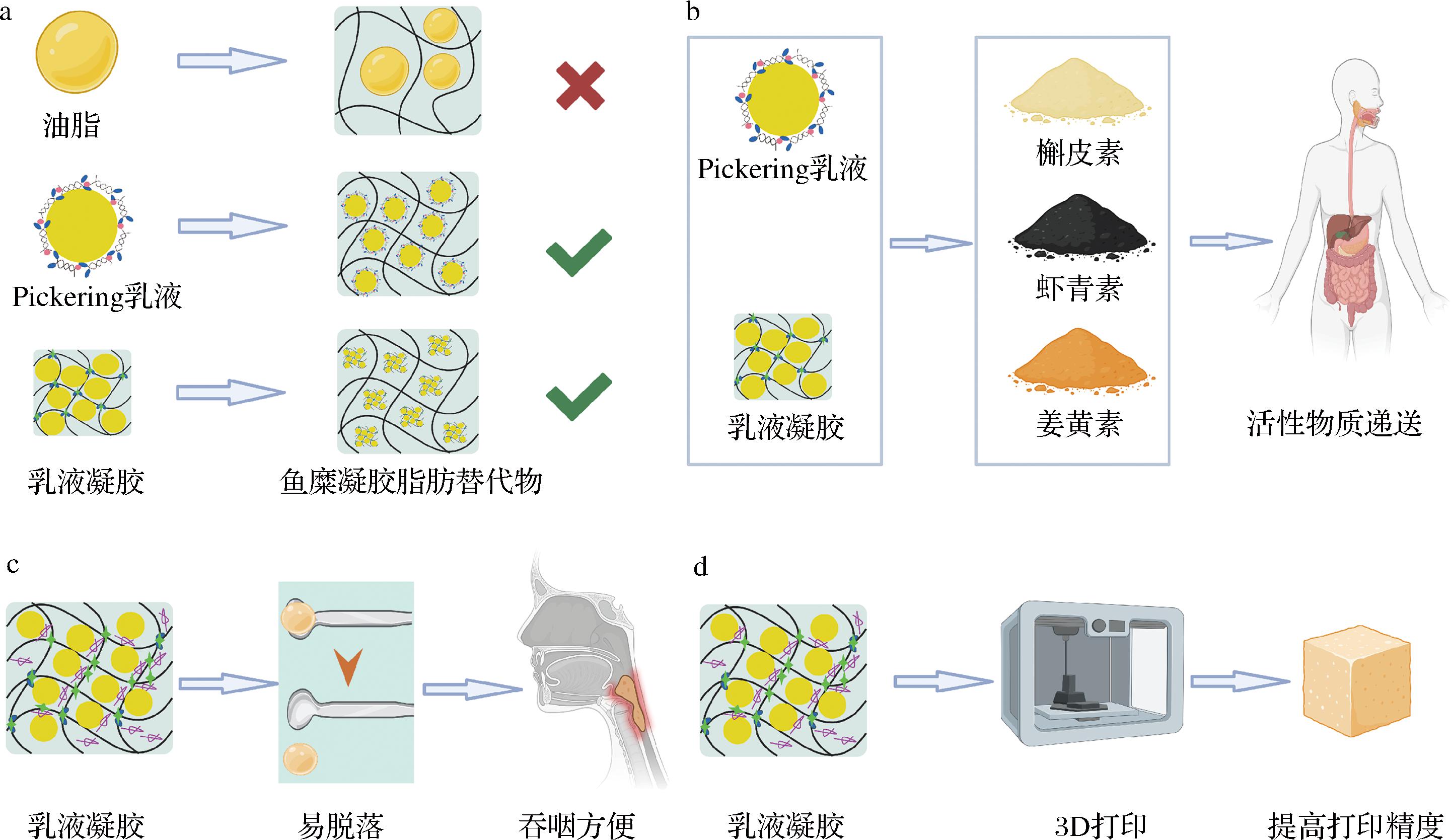
a-鱼糜凝胶脂肪替代物;b-生物活性物质递送;c-易吞咽食品;d-3D打印食品
图5 肌原纤维蛋白乳液在食品中的应用
Fig.5 Application of myofibrillar protein emulsions in food
3 MP基乳液的应用
3.1 鱼糜凝胶脂肪替代物
鱼糜制品由于其特殊质地和营养成分越来越受到欢迎,但为了提升鱼糜保存性,在鱼糜加工过程中,大量脂肪通过漂洗被除去,极大地降低了鱼糜制品的风味和营养成分。MP的高内相Pickering乳液具有稳定性好、不易氧化等优势,在补充鱼糜制品脂肪含量的同时,可增加体系内MP含量,增强蛋白之间交联程度[51]。MP乳液可均匀分布在凝胶基质中充当共聚物或填料,有助于形成致密的网络结构[4]。MP的乳液凝胶具有类固体的特点,也可用于鱼糜凝胶中的脂肪替代品,高脂质鱼糜制品由乳液凝胶中的MP和鱼糜中的MP共同乳化,进一步稳定了油相[58]。
3.2 生物活性物质递送
天然活性物质营养价值高,但其稳定性差和口服利用率低等缺点,限制了其在功能食品中的应用[70]。MP乳液可有效包封生物活性物质,保证其递送稳定性。例如,MP与壳聚糖的复合乳液存在界面层,可有效抵抗胃蛋白酶的酸性环境,有利于肠道靶向递送[3]。SHEN等[71]利用经超声改性的MP乳液在递送槲皮素时,发现槲皮素的生物可及性由38.23%提升至46.40%,且MP消化过程残留量高,肠道释放量随着时间的延长而减小。MP乳液的油水界面可形成致密保护膜以增大生物活性物质保留率,且乳液的稳固结构阻碍了油滴聚集,有利于脂肪酶进入乳液中分解脂肪,产生混合胶束,提高生物可及性[72]。
3.3 易吞咽食品
在肉类产品加工过程中,MP会通过热凝胶化形成坚硬质地,给吞咽障碍患者的食用带来困难。添加MP乳液,不但可赋予产品丰富的营养价值,还可改善产品质地。FEI等[5]使用MP、魔芋葡甘露聚糖和改性马铃薯淀粉混合制备的乳液凝胶具有自支撑能力且表面光滑,形成致密均匀的微观结构对凝胶有保护作用。CHEN等[73]发现,80 g/L的菊粉/魔芋葡甘露聚糖混合物可有效调节MP乳液凝胶的吞咽、感官和机械特性,可为吞咽困难患者提供方便。
3.4 3D打印食品
MP制备的高内相乳液具有半固体特性,有助于开发3D打印的可食用油墨。壳聚糖或海藻糖可增加MP乳液的流变特性,有利于形成黏弹性的界面膜,多糖与MP之间的非共价作用可有效防止液滴聚集,增强3D打印后冷冻贮存期间的稳定性且表现出优异的印刷精度和完整性[6,74]。此外,精氨酸-MP有良好的润湿性,形成的乳液具有“倒棱镜”形状,二者在油水界面处形成丝状结构使乳液更加稳定,是优秀的3D打印材料[75]。
4 结论与展望
针对MP乳液易絮凝和聚集的特点,本文综述了物理法、化学法及联合改性方法改善MP的油水界面特性。物理法主要通过空化和剪切效应改变MP构象,减少分子聚集;化学法则利用pH值、糖基化等手段改变MP结构,促使疏水基团暴露或通过接枝形成空间位阻,阻止乳液絮凝;联合改性法综合了物理法和化学法改性,相较于单一处理效果更加明显。重点介绍了MP及其复合物的Pickering乳液、乳液凝胶、纳米乳液的稳定机理。不同乳液的稳定机理有所差异:1)Pickering乳液主要受MP颗粒大小和浓度的影响,通过简单预处理,MP可在油水界面形成稳定结构,多酚可与MP之间交联形成二硫键,并改善MP疏水结构以增加其润湿性,多糖则通过与MP之间的非共价相互作用形成保护膜以改善MP在油水界面处的稳定效果;2)乳液凝胶主要通过改善MP疏水性在油水界面达到稳定,加热后油脂填充三维的凝胶结构中,限制了油脂迁移;3)纳米乳液是在制备时通过高压均质作用对乳液进行强力剪切,增强分子灵活性以达到界面稳定的效果。然而,MP基乳液的制备和表征仍具有挑战性:1)受自身分子质量限制,MP的纳米乳液开发难度大,未来可通过酶解等方法联合高压均质制备纳米乳液;2)新型物理技术(等离子体、高压脉冲)在MP油水界面特性改善应用较少。例如,等离子体通过活化作用引起MP侧链的化学修饰,可达到超声波难以处理到的区域,两者协同作用可在分子层面上实现更全面改性;3)MP微凝胶颗粒在油水界面受粒径和界面特性的影响,但其具体定量关系并不明确,吸附时界面处凝胶颗粒的数量与界面稳定性的关系尚需进一步探究。总之,改性后MP乳液以其优异的结构特性已在食品中应用,主要作为脂肪替代品、生物活性物质递送和3D打印等。解决MP乳液发展的挑战,未来MP基乳液有望在食品领域有更广泛的应用。
[1] LI S, LIN S Y, JIANG P F, et al.The interaction mechanism of different ionic polysaccharides with myofibrillar protein and its contribution to the heat-induced gels[J].Food Frontiers, 2024, 5(4):1613-1628.
[2] LIN L, XIONG Y L.Competitive adsorption and dilatational rheology of pork myofibrillar and sarcoplasmic proteins at the O/W emulsion interface[J].Food Hydrocolloids, 2021, 118:106816.
[3] HUANG M Y, XU Y J, XU L N, et al.The evaluation of mixed-layer emulsions stabilized by myofibrillar protein-chitosan complex for delivering astaxanthin:Fabrication, characterization, stability and in vitro digestibility[J].Food Chemistry, 2024, 440:138204.
[4] LIN M, CUI Y Q, SHI L F, et al.Characteristics of hairtail surimi gels treated with myofibrillar protein-stabilized Pickering emulsions[J].Journal of the Science of Food and Agriculture, 2024, 104(7):4251-4259.
[5] FEI S Y, LI Y, LIU K J, et al.Salmon protein gel enhancement for dysphagia diets:Konjac glucomannan and composite emulsions as texture modifiers[J].International Journal of Biological Macromolecules, 2024, 258:128805.
[6] HONG Z H, KONG Y Q, CHEN J L, et al.Collaborative stabilizing effect of trehalose and myofibrillar protein on high internal phase emulsions:Improved freeze-thaw stability and 3D printability[J].Food Chemistry, 2025, 469:142564.
[7] ZHAO S Q, ZHAO Y B, LIU H T, et al.Combined effects of high-intensity ultrasound treatment and hydrogen peroxide addition on the thermal stabilities of myofibrillar protein emulsions at low ionic strengths[J].Ultrasonics Sonochemistry, 2024, 104:106841.
[8] HOU Y C, REN X E, HUANG Y C, et al.Effects of hydrodynamic cavitation on physicochemical structure and emulsifying properties of tilapia (Oreochromis niloticus) myofibrillar protein[J].Frontiers in Nutrition, 2023, 10:1116100.
[9] JIA B B, CHEN J Y, YANG G R, et al.Improvement of solubility, gelation and emulsifying properties of myofibrillar protein from Mantis shrimp (Oratosquilla oratoria) by phosphorylation modification under low ionic strength of KCl[J].Food Chemistry, 2023, 403:134497.
[10] 李可, 王艳秋, 张怡雪, 等.低钠条件下超声处理对鸡肉肌原纤维蛋白乳液稳定性的影响[J].食品科学, 2023, 44(9):58-65.LI K, WANG Y Q, ZHANG Y X, et al.Effect of ultrasound treatment on the emulsion stability of chicken myofibrillar protein under low NaCl condition[J].Food Science, 2023, 44(9):58-65.
[11] LU J M, ZHANG W Y, ZHAO X, et al.Comparison of the interfacial properties of native and refolded myofibrillar proteins subjected to pH-shifting[J].Food Chemistry, 2022, 380:131734.
[12] SUN Y, MA L, FU Y, et al.Fabrication and characterization of myofibrillar microgel particles as novel Pickering stabilizers:Effect of particle size and wettability on emulsifying capacity[J].LWT, 2021, 151:112002.
[13] TANG M, SUN Y, FENG X, et al.Regulation mechanism of ionic strength on the ultra-high freeze-thaw stability of myofibrillar protein microgel emulsions[J].Food Chemistry, 2023, 419:136044.
[14] LU J M, XU X L, ZHAO X.Interfacial rheology of alkali pH-shifted myofibrillar protein at O/W interface and impact of Tween 20 displacement[J].Food Hydrocolloids, 2022, 124:107275.
[15] AMIRI A, SHARIFIAN P, SOLTANIZADEH N.Application of ultrasound treatment for improving the physicochemical, functional and rheological properties of myofibrillar proteins[J].International Journal of Biological Macromolecules, 2018, 111:139-147.
[16] YU C P, SUN S, LI S H, et al.Scallops as a new source of food protein:High-intensity ultrasonication improved stability of oil-in-water emulsion stabilised by myofibrillar protein[J].International Journal of Food Science &Technology, 2022, 57(2):1173-1185.
[17] DENG X R, MA Y G, LEI Y D, et al.Ultrasonic structural modification of myofibrillar proteins from Coregonus peled improves emulsification properties[J].Ultrasonics Sonochemistry, 2021, 76:105659.
[18] YU C P, LI S H, SUN S, et al.Modification of emulsifying properties of mussel myofibrillar proteins by high-intensity ultrasonication treatment and the stability of O/W emulsion[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2022, 641:128511.
[19] HONG Z H, KONG Y Q, GUO R T, et al.Stabilizing effect of silver carp myofibrillar protein modified by high intensity ultrasound on high internal phase emulsions:Protein denaturation, interfacial adsorption and reconfiguration[J].International Journal of Biological Macromolecules, 2024, 265:130896.
[20] DENG X H, NI X X, HAN J H, et al.High-intensity ultrasound modified the functional properties of Neosalanx taihuensis myofibrillar protein and improved its emulsion stability[J].Ultrasonics Sonochemistry, 2023, 97:106458.
[21] RAJASEKARAN B, SINGH A, PONNUSAMY A, et al.Ultrasound treated fish myofibrillar protein:Physicochemical properties and its stabilizing effect on shrimp oil-in-water emulsion[J].Ultrasonics Sonochemistry, 2023, 98:106513.
[22] LI J, DAI Z C, CHEN Z H, et al.Improved gelling and emulsifying properties of myofibrillar protein from frozen shrimp (Litopenaeus vannamei) by high-intensity ultrasound[J].Food Hydrocolloids, 2023, 135:108188.
[23] YU C P, WU F, CHA Y, et al.Effects of high-pressure homogenization on functional properties and structure of mussel (Mytilus edulis) myofibrillar proteins[J].International Journal of Biological Macromolecules, 2018, 118:741-746.
[24] WU F, SHI X J, ZOU H N, et al.Effects of high-pressure homogenization on physicochemical, rheological and emulsifying properties of myofibrillar protein[J].Journal of Food Engineering, 2019, 263:272-279.
[25] LEE M H, IN YONG H, KIM Y J, et al.High-pressure induced structural modification of porcine myofibrillar protein and its relation to rheological and emulsifying properties[J].Meat Science, 2023, 196:109032.
[26] HAN K Y, FENG X, YANG Y L, et al.Changes in the physicochemical, structural and emulsifying properties of chicken myofibrillar protein via microfluidization[J].Innovative Food Science &Emerging Technologies, 2023, 83:103236.
[27] RAJASEKARAN B, SINGH A, NILSUWAN K, et al.Shrimp oil nanoemulsions prepared by microfluidization and ultrasonication:Characteristics and stability[J].RSC Advances, 2024, 14(9):6135-6145.
[28] JIANG J J, YANG K, GONG H H, et al.The conformational modification of myofibrillar protein by magnetic field improves its emulsification properties[J].International Journal of Biological Macromolecules, 2024, 277:134114.
[29] REN Z Y, CUI Y Q, WANG Y Q, et al.Effect of ionic strength on the structural properties and emulsion characteristics of myofibrillar proteins from hairtail (Trichiurus haumela)[J].Food Research International, 2022, 157:111248.
[30] GUO X Y, GAO F, ZHANG Y W, et al.Effect of l-histidine and l-lysine on the properties of oil-in-water emulsions stabilized by porcine myofibrillar proteins at low/high ionic strength[J].LWT, 2021, 141:110883.
[31] LI Y X, ZHAO S Q, XIA X F, et al.Insights into the emulsifying effect and oxidation stability of myofibrillar protein-diacylglycerol emulsions containing catechin at different ionic strengths[J].Food Research International, 2024, 181:114144.
[32] WANG K, LI Y, ZHANG Y M, et al.Improving physicochemical properties of myofibrillar proteins from wooden breast of broiler by diverse glycation strategies[J].Food Chemistry, 2022, 382:132328.
[33] XU Y J, DONG M, TANG C B, et al.Glycation-induced structural modification of myofibrillar protein and its relation to emulsifying properties[J].LWT, 2020, 117:108664.
[34] CONG H H, WU Q M, ZHANG Z R, et al.Improvement of functional characteristics of Hypophthalmichthys molitrix protein by modification with chitosan oligosaccharide[J].Frontiers in Nutrition, 2023, 10:1140191.
[35] LI Z Y, ZHENG Y M, SUN Q, et al.Structural characteristics and emulsifying properties of myofibrillar protein-dextran conjugates induced by ultrasound Maillard reaction[J].Ultrasonics Sonochemistry, 2021, 72:105458.
[36] LI Z Y, ZHONG X M, LUAN C R, et al.Fabrication of high-preformance emulsifier from conjugating maltodextrin onto myofibrillar protein peptide with microwave- ultrasound synergy[J].Ultrasonics Sonochemistry, 2024, 104:106818.
[37] AMIRI A, SHARIFIAN P, MORAKABATI N, et al.Modification of functional, rheological and structural characteristics of myofibrillar proteins by high-intensity ultrasonic and papain treatment[J].Innovative Food Science &Emerging Technologies, 2021, 72:102748.
[38] WANG K, ZHANG Y M, SUN J X.Synergistic effect of high-intensity ultrasound and pH-shifting on the functionalities of chicken wooden breast myofibrillar protein:Reveal the mechanism of protein structure change[J].Lwt, 2023, 181:114743.
[39] ZHOU Y, SUN Y Y, PAN D D, et al.Ultrasound-assisted phosphorylation of goose myofibrillar proteins:Improving protein structure and functional properties[J].Journal of the Science of Food and Agriculture, 2023, 103(11):5412-5421.
[40] YANG K, CHI R S, JIANG J J, et al.Insight into the mechanisms of combining direct current magnetic field with phosphate in promoting emulsifying properties of myofibrillar protein[J].Food Chemistry, 2024, 447:138990.
[41] WANG H F, YANG Z, LIAO J, et al.Ultrasonication improved myofibrillar protein-stabilized emulsions:Oil/water interface adsorption behavior and rheological behavior[J].International Journal of Biological Macromolecules, 2025, 308(Pt 1):142390.
[42] KONG D W, HAN R W, YUAN M D, et al.Ultrasound combined with slightly acidic electrolyzed water thawing of mutton:Effects on physicochemical properties, oxidation and structure of myofibrillar protein[J].Ultrasonics Sonochemistry, 2023, 93:106309.
[43] ZHAO G M, YIN F, ZHU C Z, et al.Yield twice the result with half the effort:Effect of ionic strength on quality of myofibrillar protein micro-gel Pickering emulsion mediated by (-)-epigallocatechin-3-gallate[J].Lwt, 2025, 215:117195.
[44] GAO X, LI A X, ZHOU C L.L-arginine and L-lysine improve the emulsifying and dissolution properties of pale, soft, exudative-like chicken myofibrillar proteins by modifying their conformations[J].Food Chemistry, 2025, 463:141136.
[45] ZHU X X, LI L X, LI S Y, et al.L-arginine/L-lysine improves emulsion stability of chicken sausage by increasing electrostatic repulsion of emulsion droplet and decreasing the interfacial tension of soybean oil-water[J].Food Hydrocolloids, 2019, 89:492-502.
[46] LIU Z B, SHI W Z, ZHANG X H, et al.Construction of grass carp myofibrillar protein/rutin Pickering emulsion gel by one-step method and multi-scale analysis[J].Food Chemistry, 2025, 467:142272.
[47] ZHAO J Q, LI R R, SONG F T, et al.Myofibrillar protein aggregate evolution regulates interfacial adsorption behavior to maintain long-term stability of high internal phase Pickering emulsions[J].Food Hydrocolloids, 2025, 163:111039.
[48] ZHU C Z, TIAN Y D, LIU H, et al.Having their cake and eat it too:Effects of different cations in reduced-salt myofibrillar protein microgel Pickering emulsion under high-intensity ultrasound[J].LWT, 2024, 210:116856.
[49] ZHANG X H, LIU Z B, SHI W Z.Pickering emulsion stabilized by grass carp myofibrillar protein via one-step:Study on microstructure, processing stability and stabilization mechanism[J].Food Chemistry, 2024, 447:139014.
[50] PATIL U, GULZAR S, MA L K, et al.Pickering emulsion stabilized by fish myofibrillar proteins modified with tannic acid, as influenced by different drying methods[J].Foods, 2023, 12(7):1556.
[51] ZHANG X H, XIE W X, LIANG Q Q, et al.High inner phase emulsion of fish oil stabilized with rutin-grass carp (Ctenopharyngodon idella) myofibrillar protein:Application as a fat substitute in surimi gel[J].Food Hydrocolloids, 2023, 145:109115.
[52] 王明茹, 周莎莎, 杨晓溪, 等.肌原纤维蛋白-壳聚糖稳定的Pickering乳液负载白藜芦醇特性[J].食品研究与开发, 2024, 45(20):35-41.WANG M R, ZHOU S S, YANG X X, et al.Characteristics of resveratrol loaded Pickering emulsion stabilized by myofibrillar protein-chitosan[J].Food Research and Development, 2024, 45(20):35-41.
[53] ZHOU C F, ZHANG L J, ZAKY A A, et al.High internal phase Pickering emulsion by Spanish mackerel proteins-procyanidins:Application for stabilizing astaxanthin and surimi[J].Food Hydrocolloids, 2022, 133:107999.
[54] WANG S Y, LIU L G, BI S H, et al.Studies on stabilized mechanism of high internal phase Pickering emulsions from the collaboration of low dose konjac glucomannan and myofibrillar protein[J].Food Hydrocolloids, 2023, 143:108862.
[55] LANG Y M, WANG M R, ZHOU S S, et al.Fabrication, characterization and emulsifying properties of myofibrillar protein-chitosan complexes in acidic conditions[J].International Journal of Biological Macromolecules, 2024, 262:130000.
[56] YAO W J, HUANG X N, LI C, et al.Underlying the effect of soybean oil concentration on the gelling properties of myofibrillar protein-based emulsion gels:Perspective on interfacial adsorption, rheological properties and protein conformation[J].Food Hydrocolloids, 2025, 162:110935.
[57] CHANG J Y, LIU R, ZHENG B B, et al.Amelioration of myofibrillar protein emulsion gel properties by mildly oxidized sunflower oil[J].Food Chemistry, 2025, 467:142253.
[58] PEI Z S, WANG H B, XIA G H, et al.Emulsion gel stabilized by tilapia myofibrillar protein:Application in lipid-enhanced surimi preparation[J].Food Chemistry, 2023, 403:134424.
[59] CHEN B, LIU X Y, ZHOU K, et al.Differentiating the effects of hydrophobic interaction and disulfide bond on the myofibrillar protein emulsion gels at the high temperature and the protein interfacial properties[J].Food Chemistry, 2023, 412:135472.
[60] CHEN J Y, ZHANG K S, REN Y X, et al.Influence of sodium tripolyphosphate coupled with (-)-epigallocatechin on the in vitro digestibility and emulsion gel properties of myofibrillar protein under oxidative stress[J].Food &Function, 2020, 11(7):6407-6421.
[61] ZHOU F B, SUN W Z, ZHAO M M.Controlled formation of emulsion gels stabilized by salted myofibrillar protein under malondialdehyde (MDA)-induced oxidative stress[J].Journal of Agricultural and Food Chemistry, 2015, 63(14):3766-3777.
[62] LV Y Q, CHEN L, WU H Z, et al.(-)-Epigallocatechin-3-gallate-mediated formation of myofibrillar protein emulsion gels under malondialdehyde-induced oxidative stress[J].Food Chemistry, 2019, 285:139-146.
[63] FENG X C, CHEN L, LEI N, et al.Emulsifying properties of oxidatively stressed myofibrillar protein emulsion gels prepared with (-)-epigallocatechin-3-gallate and NaCl[J].Journal of Agricultural and Food Chemistry, 2017, 65(13):2816-2826.
[64] ZHAO D B, YAN S L, LIU J L, et al.Effect of chickpea dietary fiber on the emulsion gel properties of pork myofibrillar protein[J].Foods, 2023, 12(13):2597.
[65] ZHUANG X B, JIANG X P, ZHOU H Y, et al.The effect of insoluble dietary fiber on myofibrillar protein emulsion gels:Oil particle size and protein network microstructure[J].LWT, 2019, 101:534-542.
[66] ZHOU L, JIANG J Y, FENG F, et al.Effects of carboxymethyl cellulose on the emulsifying, gel and digestive properties of myofibrillar protein-soybean oil emulsion[J].Carbohydrate Polymers, 2023, 309:120679.
[67] DING Y X, SHEN Z W, DING Y J, et al.Effects of octenyl succinic anhydride (OSA) starches with different amylose content on freeze-thaw stability of myofibrillar protein emulsion gel:Double enhancement of interfacial film and network structure[J].Food Hydrocolloids, 2025, 163:111110.
[68] LEE J, XIONG Y L, CHOI M J.Effect of micro- and nano-sized emulsion fillers combined with trans-cinnamaldehyde on the physicochemical and rheological characteristics of myofibrillar protein gels[J].Food Hydrocolloids, 2023, 143:108865.
[69] WANG S X, ZHANG Y M, CHEN L, et al.Dose-dependent effects of rosmarinic acid on formation of oxidatively stressed myofibrillar protein emulsion gel at different NaCl concentrations[J].Food Chemistry, 2018, 243:50-57.
[70] CHEN Y F, LAN S Q, GAO X J, et al.Dual crosslinking approach of K+ and TGase to enhance the thermal stability and intestinal delivery efficiency of emulsion gels[J].Food Chemistry, 2025, 486:144365.
[71] SHEN S K, CHEN Y W, YU W T, et al.High internal phase Pickering emulsions stabilized by modified sturgeon myofibrillar protein for quercetin delivery[J].Food Hydrocolloids, 2023, 144:108926.
[72] ZHOU L, FENG F, ZHANG W G.Effects of pH on the emulsifying, gelation and curcumin delivery properties of myofibrillar protein and carboxymethyl cellulose emulsions[J].Food Bioscience, 2023, 53:102744.
[73] CHEN Q, WU Y Y, CAO L M, et al.Preparation and characterization of fish-derived protein gel as a potential dysphagia food:Co-mingling effects of inulin and konjac glucomannan mixtures[J].Food Chemistry, 2024, 460:140742.
[74] ZHANG F Y, WANG P, HUANG M Y, et al.Modulating the properties of myofibrillar proteins-stabilized high internal phase emulsions using chitosan for enhanced 3D-printed foods[J].Carbohydrate Polymers, 2024, 324:121540.
[75] FENG Z L, HE D X, LI C, et al.3D printed emulsion based on arginine-myofibrillar protein[J].Journal of Food Engineering, 2024, 375:112049.