食品安全是关系到国计民生的重要议题,生物毒素污染是食品安全的主要风险之一。生物毒素是天然存在的有毒物质,种类繁多,结构和作用机制复杂,影响神经系统、消化系统和免疫系统,具有肾毒性、肝毒性、免疫毒性、神经毒性和皮肤毒性等危害,可造成人体代谢过程和机体功能紊乱,对人类健康构成严重威胁[1]。随着人们生活方式和饮食习惯的改变,生物毒素引起的食源性中毒事件越来越多,为保障食品安全与人类健康,我国与国际组织建立了生物毒素的食品安全标准,规定了部分生物毒素的最大残留限量。面对生物毒素给食品安全与人类健康带来的重大隐患,建立准确高效的生物毒素残留检测方法,成为亟待攻克的关键难题。
生物毒素残留检测方法包括传统检测法、仪器检测法及生物传感分析法。传统检测方法包括小鼠生物测定法,基于实验动物评价和检测生物毒素,主要是针对亲脂性和麻痹性贝类毒素;该方法存在伦理问题、特异性差异、耗时且存在假阳性结果。仪器检测法包括色谱法、质谱法及光谱法,该方法适应范围广,结果准确,但需要大型精密的仪器设备、样品前处理较为复杂、操作需有专业性、难以满足大批量样品快速检测的需求及难以有效排除实际样品的基质干扰[2-3]。生物传感分析法包括酶联免疫吸附法和胶体金免疫层析法等,该类分析方法会出现假阳性结果及交叉反应,具有抗原抗体制备复杂且难以长期保存、识别元件不稳定及结果重复性差等缺点。
传感器具有简单快速、设备成本低、稳定性好和便携性好等优点,已成为广泛应用的生物毒素分析检测平台,但该方法存在识别元件不稳定及制备复杂等问题。分子印迹技术(molecular imprinting technique,MIT)及其仿生识别元件在抗体替代方面的最新进展为解决这些问题提供了新的思路。该技术具有构效预定性、识别特异性、性质稳定性、广泛实用性和制备简便性等诸多优点,是在空间结构上特异性识别目标分子的仿生识别技术,被广泛应用于传感器领域[4-5]。经MIT合成的分子印迹聚合物(molecular imprinted polymers,MIPs)以多种方式被固定在信号转换器表面,能够从复杂基质中特异性识别并结合目标物[6],具有稳定性好、特异性强、灵敏度高等优点[7]。MIT与传感器相结合能够建立针对食品样品中生物毒素的高灵敏度、高特异性和高通量的检测方法。本课题组基于仿生设计理念,结合MIT,提出了仿生印迹的概念,构建了仿生印迹传感器(biomimetic imprinting sensor,BIS),并分析了识别原理和机制[8-10]。
本文介绍了仿生印迹传感界面的构建,仿生印迹体系的构建与优选及不同种类BIS在植物毒素、动物毒素、微生物毒素及海洋毒素检测中的应用。本文旨在为食品中生物毒素的检测与研究提供理论依据,为今后制备新型生物毒素仿生印迹传感检测手段提供参考,为提高食品安全水平及保障公众健康提供技术支撑。
1 仿生印迹传感界面的构建方法
仿生印迹界面的构建是BIS最重要的部分,其性能直接影响检测结果,构建性能良好的仿生印迹界面是BIS的关键。其构建方法主要包括本体聚合法、沉淀聚合法、原位聚合法及电化学聚合法等。
本体聚合法制备过程简单,反应条件易于控制,但合成的聚合物为块状,需要研磨筛选,不仅耗时费力,还会对印迹位点造成破坏,导致模板分子不易洗脱,从而影响MIPs的性能。为克服本体聚合法的缺陷,研究人员开发了沉淀聚合法。
传统的沉淀聚合能够制备尺寸均一的纳米微球,吸附表面积大,不需要稳定剂或表面活性剂[11]。苏立强等[12]采用传统沉淀聚合法与可逆加成-断裂链转移沉淀聚合法分别制备木犀草素MIPs,测得吸附容量分别为29.06 mg/g和32.60 mg/g,选择木犀草素结构类似物为对照物,考察MIPs的吸附选择性。MIPs对木犀草素的吸附容量远大于对结构类似物的吸附容量,这是由于在MIPs的印迹孔穴仅与木犀草素相匹配。可逆加成-断裂链转移沉淀聚合法有效克服了传统沉淀聚合中自由基反应难以控制的弊端,形成的MIPs的粒径均一,具有较高的特异性及吸附容量等优点。然而,沉淀聚合法还需将合成的MIPs涂覆在电极表面,存在涂层厚度不均匀,结果重现性较差,且易受环境因素影响等问题。
与之相比,原位聚合法将聚合所需反应体系分散在溶剂中,直接涂附到电极或芯片表面形成仿生印迹聚合膜[13-14],能够弥补这些不足,展现出优异的应用潜力,具有快速简便、成膜速度快及稳定性良好的优点,避免了研磨与过筛的繁琐过程。YANG等[15]采用原位聚合法在不锈钢柱中以1, 3, 5-戊三羧酸代替高毒性和昂贵的模板分子软骨藻酸作为虚拟模板,4-乙烯基吡啶和乙二醇二甲基丙烯酸酯分别作为功能单体和交联剂合成MIPs,贻贝提取物的加标回收率为86.1%~91.1%,检测限为0.076 mg/L,印迹因子为3.77。但该方法形成的聚合膜厚度较难控制,容易形成扩散壁垒,导致传质受阻结果重现性较差[16]。
电化学聚合法能够通过调节扫描速率或聚合圈数等参数,改善MIPs的形态、厚度和导电性[17-18],从而使MIPs均匀地涂覆在导电基底表面,使印迹界面具有多个高亲和力结合位点[19]。JIANG等[20]在丙烯酰胺和N,N′-亚甲基双丙烯酰胺存在的条件下,以1,3,5-戊三羧酸为虚拟模板,采用电聚合法制备软骨藻酸仿生印迹电化学传感器。该传感器在1~600 nmol/L浓度范围内呈线性关系,检测限为0.31 nmol/L,加标回收率为89.71%~97.83%,相对标准偏差(relative standard deviation,RSD)<5.12%,将几种干扰物质分别加入到软骨藻酸溶液中,验证传感器的选择性,结果表明干扰物质对软骨藻酸的检测无明显影响,即使在干扰物质存在的条件下MIPs仍具有良好的选择性。电极重复使用5次后,峰值电流无明显变化,RSD为3.2%;传感器在4 ℃下贮存15 d后,响应电流为初始电流的91%,该传感器对软骨藻酸具有良好的灵敏度、重复性和稳定性,可用于实际样品中软骨藻酸的检测。电化学聚合法不仅提高了传感器的检测性能及灵敏度,还解决了电极表面聚合膜不均匀等问题。
上述仿生传感界面的构建方法仍存在不足之处,未来可借助自动化设备与智能算法,将多种构建方法协同使用,或引入具有独特尺寸效应和表面活性的纳米材料,如高导电性的碳纳米管、具有荧光特性的量子点、高孔隙率的金属有机框架或共价有机框架及高催化活性的纳米酶等[21-22],提高界面性能与检测精度。
2 仿生印迹体系的构建与优选
制备MIPs需模板分子、功能单体、引发剂、交联剂及致孔剂的共同参与,然而,功能单体或交联剂的种类及用量、反应时间与温度都会影响MIPs的识别性能,因此,仿生印迹体系的筛选对高活性MIPs的制备十分重要[23]。
2.1 模板分子
2.1.1 次级代谢物
食品在种植、收获、贮存和运输过程中易受到环境中细菌和真菌污染,在适宜的环境中,细菌或真菌生长和繁殖产生黄曲霉毒素、赭曲霉毒素、伏马霉素、棒曲霉素、玉米赤霉烯酮和棒曲霉毒素等次级代谢物,由于毒素具有生物活性和毒性,它们会迁移到食品中,在加工过程中并不能完全去除,存在痕量残留,可以直接或间接进入人体,具有致畸、致癌和致突变等多种毒性作用[24-25]。BIS对生物毒素的特异性识别是通过模拟生物毒素与受体的结合,从而快速检测生物毒素。ÇIMEN等[26]以丝状真菌代谢产物棒曲霉素为模板,构建棒曲霉素仿生印迹表面等离子共振纳米传感器,并用于苹果汁中棒曲霉素的检测。该传感器在最佳条件下,线性范围为0.5~750 nmol,检测限为0.011 nmol;比竞争性免疫分析法[27]检测限低近10倍。因此,深入研究生物毒素的毒性作用机制,确定毒素的代谢标志物和传感检测靶标,基于毒性作用的分子机制,仿生构建印迹体系,结合靶标的分子结构特征,搭建作用位点,是实现生物毒素高效识别的重要途径。
2.1.2 虚拟模板
由于生物毒素毒性大、含量低且价格昂贵,因此常采用与生物毒素结构相似的类似物,或与其结构片段重合的虚拟模板作为模板分子制备MIPs,检测食品中生物毒素的痕量残留[28]。YARYNKA等[29]以化学合成的环十二烷基-2, 4-二羟基苯甲酸酯为虚拟模板,使用分子模拟技术选择能够与虚拟模板形成最强相互作用的功能单体。以荧光传感器的响应值及结合能为指标,选择甲基丙烯酸磷酸乙二醇酯作为功能单体,制备银纳米颗粒嵌入的仿生印迹界面检测玉米赤霉烯酮。在最佳的实验条件下,将其结构类似物和其他真菌毒素作为干扰物,考察传感器的交叉反应性,结果表明传感器对干扰物的识别可忽略不计。电极在室温下贮存18个月后,传感器响应值仍然保持初始响应值的97.4%。该传感器成功用于检测玉米、小麦粉和玉米面中的玉米赤霉烯酮,加标回收率为98%~107%,RSD<12.8%。该传感器灵敏度高,选择性及稳定性好,线性范围宽。QI等[30]采用溶胶-凝胶聚合法,以莫能菌素为虚拟模板,制备雪卡毒素仿生印迹比率荧光传感器,该传感器在最优实验条件下,氨基酸和金属离子等干扰物对检测结果均无显著影响,该荧光传感器在复杂基质中具有较强的抗干扰能力,传感器被重复使用4次后,平均荧光猝灭效率仍达到75%左右。该方法对鳗鱼、鲈鱼和石斑鱼中的雪卡霉素表现出优异的检测性能,平均加标回收率为80%~91.33%,RSD<9.91%,所制备的传感器能够用于复杂样品中痕量雪卡霉素的测定,与LC-MS/MS[31]的方法相比(检测时间为20 min,检测限为0.055 ng/mL),利用虚拟模板印迹技术能够快速、高灵敏度和高选择性的定量检测雪卡霉素(检测时间为15 min,检测限为3.3×10-4 ng/mL)。莫能菌素与雪卡毒素的结构相似,印迹位点较多,该方法中虚拟模板不需要合成,能够减少时间消耗并降低成本。然而,虚拟模板的极性、溶解性或空间位阻与目标分子有时存在差异,导致MIPs的识别效率降低,可将其与纳米材料结合,进一步拓展虚拟模板在食品检测及生物医药等领域的应用,为生物毒素的快速准确定量检测提供新思路。
2.1.3 生物毒素特定片段
生物毒素不易获得、毒性强且相对分子质量较大,难以用作模板,片段印迹策略很好地解决这一难题。该方法选择目标物的特异性片段作为模板分子,降低了生物毒素作为模板分子在合成过程中的毒性和成本,为生物毒素仿生印迹提供可行的方法[32]。QI等[33]以L-亮氨酸为片段模板分子,碳量子点为增敏材料,采用溶胶-凝胶法制备微囊藻毒素仿生印迹荧光传感器。在最佳实验条件下,采用微囊藻毒素及其类似物研究该传感器的选择性。MIPs对微囊藻毒素的荧光猝灭比空白印迹聚合物(non-molecular imprinted polymers,NIPs)强,MIPs对其结构类似物未产生荧光猝灭,表明该传感器具有优异的特异性。同时,该传感器实现了水样中微囊藻毒素的检测,加标回收率为91.8%~100.7%,RSD<9.41%,线性范围为1~1 000 μg/L,检测限为0.009 3 μg/L。研究人员通过增加片段模板的数量,使其能够覆盖模板分子多个关键基团,增加识别性能,提高选择性与灵敏度。LI等[34]以戊基苯和L-精氨酸作为微囊藻毒素的片段模板,采用表面印迹技术合成锰掺杂硫化锌量子点MIPs,所建分析方法在0.002 5~0.017 5 nmol/L的浓度范围内呈良好的线性关系,可以实现对微囊藻毒素及同系物的特异性识别。微囊藻毒素溶液中存在更高浓度的金属离子、氨基酸和生物分子时,传感器对微囊藻毒素仍显示出良好的选择性。该方法可用于不同种类的水,鱼与虾粉中微囊藻毒素的靶向识别与高灵敏检测,加标回收率为90.8%~114.4%,RSD<8.4%。然而,片段模板相对分子质量较小,与功能单体的作用力较弱,且制备的MIPs对某些毒素的衍生物存在一定的交叉反应。使用多个片段模板作为模板分子,覆盖模板分子所有关键基团,不仅可以提高印迹位点的选择性和亲和力,也为食品中生物毒素的大规模检测提供了新思路。
2.2 新型功能单体的开发与筛选
筛选合适的功能单体是制备MIPs的关键步骤,功能单体与模板分子以非共价键或可逆共价键结合;结合力越强,形成的模板分子-功能单体复合物就越稳定。寻找合适的功能单体需要开展大量的实验,计算机分子模拟法[35]、紫外-可见分光光度法[36]、核磁共振法[37-38]及等温滴定量热法[39]等方法在筛选功能单体方面具有优势,因此常采用这些方法选择最佳的功能单体。HE等[40]分别以5种羧酸化合物作为虚拟模板,开发从海水中富集软骨藻酸的MIPs。研究发现使用柠檬酸作为模板分子时,MIPs对软骨藻酸的富集量最高,所得的回收率为91.5%~94.8%,RSD<5.0%。但该研究并没有考虑模板分子与功能单体之间的相互作用,导致MIPs的选择性较低。
通过筛选功能单体与优化聚合物的制备方式能够提高实验结果的准确性。AO等[41]采用分子模拟法筛选合适的功能单体,使用Hyperchem 8.0软件绘制软骨藻酸和功能单体的分子结构,通过分子力学方法优化软骨藻酸和单体之间的最低能量构象,并使用量子力学方法精细化计算结合能。以1, 3, 5-戊三羧酸和2-(三氟甲基)丙烯酸分别作为模板分子和功能单体,通过沉淀聚合法制备软骨藻酸MIPs,对海水和贝类的检测限为20 μg/L和50 μg/kg,理论预测与实验结果高度符合。这种方法有助于降低时间成本,减少试剂消耗,得到的模板分子-功能单体复合物具有更强的相互作用,可以增强结合位点的稳定性,提高MIPs的选择性。表1列出筛选功能单体其他方法,目前这些方法仍有不足,功能单体仍存在与模板分子的结合能力弱,水溶性差,未来应开发新型功能单体,获得更高的印迹效率,以更准确的检测生物毒素。
表1 功能单体的筛选方法
Table 1 Screening methods of functional monomers

方法优点缺点紫外-可见分光光度法操作简便、提供准确数据无法区分模板分子-功能单体复合物相互作用类型核磁共振法准确分析分子间相互作用结果分析复杂、聚合物溶剂环境不同、无法完全反映实际情况等温滴定量热法快速判断不同功能单体与模板分子的结合能力、实时监测试剂消耗量大、仪器设备操作复杂
2.3 交联剂
交联剂的用量和种类都会影响MIPs的印迹因子及选择性[42]。交联剂能够使功能单体固定在模板分子周围并形成三维网状结构,使MIPs具有足够的刚性。YOSHIMATSU等[43]在实验中,以二乙烯基苯作为交联剂时,以低收率获得多分散的MIPs颗粒,而三羟甲基丙烷三甲基丙烯酸酯作为交联剂时,以90%的高收率产生均匀的MIPs颗粒,MIPs纳米颗粒的尺寸和产量受交联剂种类的影响。MIPs合成方法不同所用交联剂种类也会有所差别。自由基聚合制备MIPs时常用的交联剂是二乙烯基苯、乙二醇二甲基丙烯酸酯和N,N′-亚甲基双丙烯酰胺等。电聚合不需加入交联剂,也可以在电极表面形成一层致密且不导电的聚合物薄膜。溶胶-凝胶法制备MIPs时采用硅酸四乙酯、γ-甲基丙烯酰氧基丙基三甲氧基硅烷等有机硅烷作为交联剂。尽管交联剂在聚合反应中起着关键作用,但目前所开发的交联剂种类有限、价格昂贵且功能单一,未来合成新型交联功能单体,如深共晶溶剂,其具有功能单体与交联剂的共同特点,通过优化结构和反应条件,能够形成更高的交联密度,提高MIPs的机械强度和稳定性。
2.4 引发剂与致孔剂
引发剂通过产生自由基来引发聚合过程,引发方式包括热引发、光引发和辐射引发,其中热引发是最常用的引发方式,常见的引发剂有偶氮二异丁腈和过氧化苯甲酰。偶氮二异丁腈的分解温度在50~70 ℃,然而对于生物大分子(如蛋白质)的分子印迹,聚合温度过高会使模板分子变性失活,影响MIPs的印迹效果。因此,开发适用于低温条件的印迹技术与引发体系十分迫切。偶氮二异庚腈具有分解温度低,引发速度快等优点,能够逐渐替代偶氮二异丁腈,此外,低温光引发聚合、可逆加成-断裂链转移聚合及原子转移自由基聚合因反应条件温和,适用于水相和有机相,逐渐成为低温印迹的新思路;这些试剂或方法为低温条件下MIPs的合成开辟了新途径[44]。
致孔剂为聚合过程中所有成分(模板分子、功能单体、交联剂和引发剂)提供介质环境。选择合适的致孔剂,能够获得具有良好孔隙结构和高比表面积的MIPs[45-46]。常用的致孔剂有甲醇、乙腈、丙酮或乙酸乙酯等,然而,它们大多为有机溶剂,毒性较高,危害环境及人体健康。因此,开发环境友好型致孔剂成为研究热点,其中,离子液体和低共熔溶剂深受研究者们关注。离子液体作为致孔剂和反应介质,能够增强聚合物孔隙率,并具有良好的机械稳定性[47];低共熔溶剂不仅具有离子液体的各方面优点,还具有成本低、毒性小、溶解性好和设计性强等优点[48]。新型致孔剂的开发为降低生产成本及减少环境污染提供了可能。未来应深入研究超临界流体和生物基溶剂作为致孔剂,进一步优化工艺条件及参数,提高MIPs性能。
3 BIS在食品生物毒素检测中的应用
3.1 BIS在植物毒素中的应用
植物毒素对人类健康构成严重危害,仿生印迹电化学传感器结合纳米材料,为植物毒素的高灵敏及高选择性检测提供了高效解决方案,推动了食品安全和环境监测领域的发展,具体应用见表2。仿生印迹电化学传感器由分子识别元件(即MIPs)和信号转换器组成,MIPs能够特异性识别目标物,使电极的电信号发生改变并转换成一个可处理的输出信号[49]。D’AURELIO等[50]将合成的MIPs纳米颗粒功能化后与金丝网印刷电极表面共价连接,构建检测可卡因的仿生印迹电导型传感器。该传感器在最佳实验条件下,对吗啡没有交叉反应性,对左旋咪唑的交叉反应可以忽略不计,该传感器线性范围较宽(0.30~147 nmol/L),检测限低至0.70 nmol/L,比荧光免疫分析法[51]的检测限低数倍,该传感器具有较好的选择性及灵敏度。
表2 不同种类纳米BIS在植物毒素检测中的应用
Table 2 Applications of different types of nano-BIS for detection of phytotoxins

植物毒素增敏材料传感器类型线性范围检测限回收率参考文献棉酚PMAA/SiO2质量传感器6.0~16.0 μg/L6.0 μg/L—[52]尼古丁PtNPs/GO电化学传感器0.01~0.5 μmol/L和0.5~100 μmol/L0.015 μmol/L97.5%~102.8%[53]α-茄碱CdS/Pdots光电化学传感器0.01~1 000 ng/mL6.5 pg/mL96.87%~102.69%[54]秋水仙碱GO电化学传感器5.0×10-8~2.0×10-5 mol/L1.5×10-8 mol/L94%[55]
注:PMAA-聚甲基丙烯酸; CdS/Pdots-硫化镉/聚合物点;—,未注明(下同)。
纳米材料的使用有助于在传感器表面形成更均匀的印迹结合位点,减少干扰并提高信号质量。氧化石墨烯(graphene oxide,GO)与金纳米粒子(gold nanoparticles,AuNPs)均是纳米材料,具有大比表面积、高稳定性、优异的电催化性能和显著的导电性,能够提高传感器的灵敏度。BAI等[56]以GO与AuNPs为增敏材料,共同修饰在玻碳电极(glassy carbon electrode,GCE)表面,增加电子转移速率;用紫外分光光度法研究了秋水仙碱(colchicine,Col)与不同功能单体在聚合过程中的相互作用,随着功能单体浓度的增加,只有甲基丙烯酸(methacrylic acid,MAA)的加入使聚合物的紫外吸收峰发生了明显的红移和减弱。由于Col的酰胺基与MAA的羧基能够形成氢键,并且形成的相互作用强于Col与其他功能单体,因此,以MAA为功能单体,采用原位聚合法合成MIPs,制备MIPs/GO/AuNPs/GCE,用于Col的电化学检测。在Col溶液中加入过量的干扰离子或共存物及同浓度的结构类似物,传感器对Col仍具有较高的选择性。在相同实验条件下,使用5个制备好的电极检测Col,传感器峰电流的RSD为2.7%,传感器在室温下放置50 d或重复使用60次后,其响应值仍保持初始响应值的91%以上,表明该传感器具有良好的选择性,重现性及稳定性。在最优实验条件下,该传感器成功用于药物和人血清中Col的测定,加标回收率为 97.5%~110.0%,RSD<3.1%,检测限(4.8 nmol/L)比传统电化学传感器检测限(0.015 μmol/L)低[57]。
增敏材料引入传感器领域提高了传感器的灵敏度、稳定性及选择性,为植物毒素现场实时监测奠定了良好的基础。但是,目前纳米材料价格昂贵、种类较少、制备工艺复杂且分散性差。通过纳米材料表面官能团修饰,可以增强纳米材料在传感器或其他领域中的性能表现。
3.2 BIS在动物毒素中的应用
动物毒素的结构复杂和含量低使得对其检测受到了限制,而仿生印迹光学传感器因其高灵敏度和高特异性,在动物毒素检测中展现出广阔的应用前景。光学传感器根据目标物与识别元件形成复合体时传感器表面的光学特性变化,检测目标物的含量[58-59]。仿生印迹光学传感器主要包括仿生印迹荧光、发光和表面等离子体共振传感器。仿生印迹荧光传感器是最常用的光学传感器,它有2种检测模式,一是使用带有荧光的功能单体形成荧光MIPs;二是将荧光材料与MIPs相结合,基于荧光“开启”或“关闭”对目标分子检测[60-61]。LING等[62]采用溶胶-凝胶法,以斑蝥素为模板,得到MIPs包覆的CdTe(CdTe@MIPs)和NIPs包覆的碳点(carbon dots,CDs)即CDs@NIPs。将CdTe@MIPs和CDs@NIPs集成在一起,构建基于CDs和CdTe的表面仿生印迹比率荧光传感器(图1),用于斑蝥素的灵敏检测,在人体血液样品中进行加标回收实验,回收率为96.12%~107.40%。与气相色谱质谱联用的方法相比(检测限为2.55 nmol/L,线性范围为10.92 nmol/L~1.6 μmol/L)[63],该方法检测限(0.15 nmol/L)更低,线性范围(0.5 nmol/L~1 μmol/L)更宽。上述研究成功研制了一种低成本、高灵敏度、高选择性、高准确度和稳定性的双发射仿生印迹比率荧光传感器。
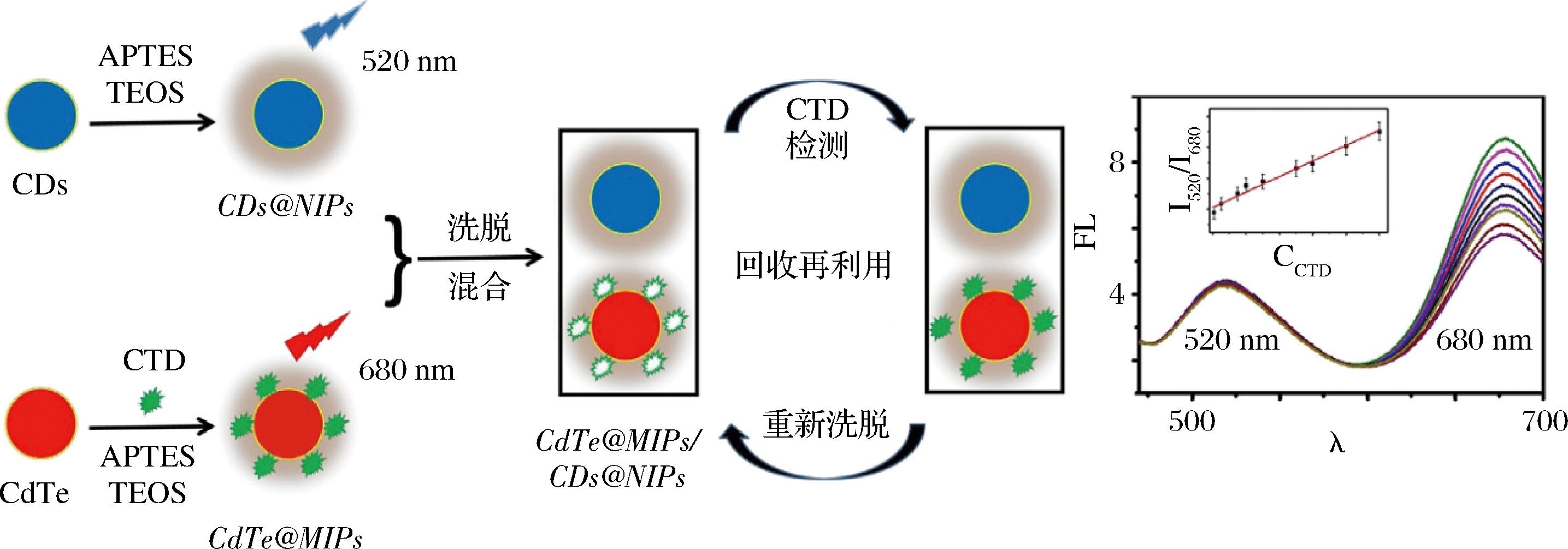
图1 斑蝥素CdTe@MIPs/CDs@NIPs传感器构建示意图[62]
Fig.1 Scheme for the fabrication of cantharidin CdTe@MIPs/CDs@NIPs sensor[62]
注:APTES-3-氨基丙基三乙氧基硅烷;TEOS-正硅酸乙酯;CTD-斑蝥素;CDs-碳点。
与单信号荧光印迹传感器相比,上述研究采用CDs和CdTe量子点作为双发射信号,能够消除环境干扰,提高灵敏度和准确度。然而,仿生印迹荧光传感器仍存在荧光基团寿命短,不能对多种食品污染物同时检测等缺点。通过优化探针尺寸、元素组成与合成方法,开发复合型仿生印迹荧光传感器,同时结合智能手机[64]构建可视化传感平台,进一步拓宽检测靶标,对推动食品安全快速检测技术的发展具有重要意义。
3.3 BIS在微生物毒素中的应用
微生物毒素是引发食源性疾病爆发的主要原因之一,为保障食品安全与人类健康,实现对微生物毒素准确高效检测迫在眉睫。其中,黄曲霉毒素为典型的微生物毒素,由黄曲霉菌产生,广泛存在于饲料和食品中,威胁动物和人类健康。表3对比了不同分析方法在黄曲霉毒素B1(aflatoxin B1,AFB1)检测中的应用,从检测时间、检测限、线性范围和回收率等方面进行分析,酶联免疫分析法特异性较好但检测时间较长;质谱及光谱法样品前处理复杂,存在基质效应;而传感检测方法对复杂食品基质前处理操作简单,对目标物具有特异性及快速响应的优点,更适用于现场快速检测需求。
表3 不同分析方法在黄曲霉毒素B1检测中的应用
Table 3 Application of different analytical methods for aflatoxin B1 detection
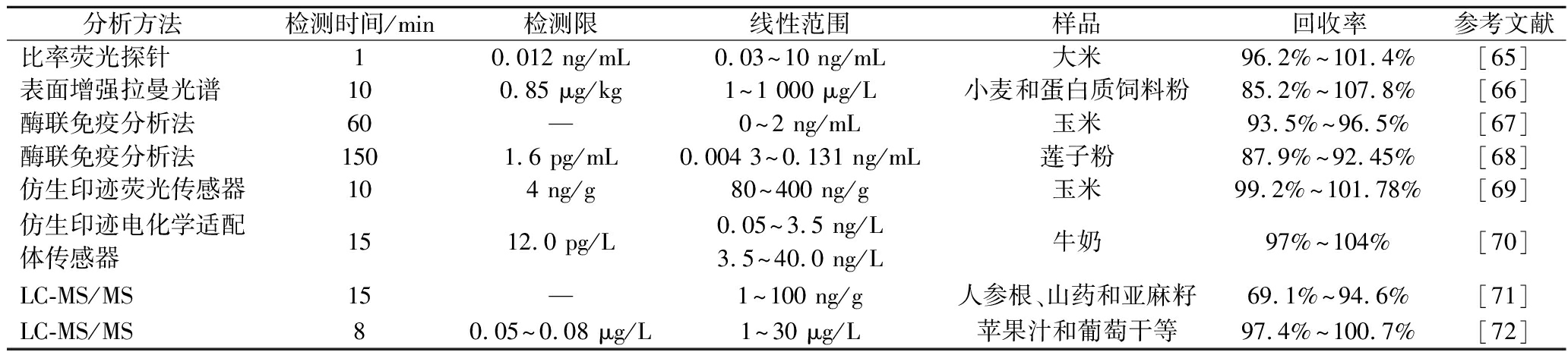
分析方法检测时间/min检测限线性范围样品回收率参考文献比率荧光探针10.012 ng/mL0.03~10 ng/mL大米96.2%~101.4%[65]表面增强拉曼光谱100.85 μg/kg1~1 000 μg/L小麦和蛋白质饲料粉85.2%~107.8%[66]酶联免疫分析法60—0~2 ng/mL玉米93.5%~96.5%[67]酶联免疫分析法1501.6 pg/mL0.004 3~0.131 ng/mL莲子粉87.9%~92.45%[68]仿生印迹荧光传感器104 ng/g80~400 ng/g玉米99.2%~101.78%[69]仿生印迹电化学适配体传感器1512.0 pg/L0.05~3.5 ng/L3.5~40.0 ng/L牛奶97%~104%[70]LC-MS/MS15—1~100 ng/g人参根、山药和亚麻籽69.1%~94.6%[71]LC-MS/MS80.05~0.08 μg/L1~30 μg/L苹果汁和葡萄干等97.4%~100.7%[72]
仿生印迹电化学、光电化学及适配体(aptamer,Apt)传感器因其具有选择性高,特异性好,快速简便等优点,在微生物毒素中应用广泛。WANG等[73]通过在电极表面分步修饰功能化多壁碳纳米管、金/铂双金属纳米粒子和仿生印迹聚合膜,构建AFB1仿生印迹电化学传感器。仿生印迹聚合膜中功能单体邻苯二胺的氨基和AFB1的氧原子之间形成了强的氢键相互作用,在电聚合的作用下AFB1嵌入聚邻苯二胺中,增加了电极表面印迹位点的数量,提高了该传感器的灵敏度。在最佳实验条件下,在AFB1溶液中加入10倍浓度的共存物和100倍浓度的干扰离子,传感器对AFB1的测定几乎没受干扰。传感器在相同条件下被重复使用5次后,RSD为2.3%;传感器在5 ℃环境中保存4周,峰电流降低了3.1%,表明该传感器具有良好的选择性、重复性及稳定性。传感器在1×10-10~1×10-5 mol/L范围内存在良好的线性关系,检测限为0.03 nmol/L,成功应用于鲜菜籽油中AFB1的检测,加标回收率为95.5%~111.1%,RSD<4.7%。
光电化学传感器具有稳定的光电化学信号、便携性和良好的特异性,能够减少其他物质的干扰,仿生印迹光电化学传感器的背景值远低于仿生印迹电化学传感器,具有较高的灵敏度。WANG等[74]利用具有高比表面积的ZnO作为光催化剂和表面印迹基底,用电化学聚合法在离子液体-氧化锌纳米棒阵列(ionic liquids-zinc oxide nanorod arrays,ILs-ZnO NRAs)上制备了AFB1印迹导电膜。由3,3′-二噻吩与3-噻吩羧酸构成的导电聚合膜,不仅具有良好的光敏效应,而且具有较大的比表面积和三维网状结构,可以负载更多的AFB1,促进MIPs与AFB1的相互作用。在最佳实验条件下,传感器分别对AFB1和其他干扰物质检测,结果表明,传感器仅对AFB1具有选择特异性。传感器在避光条件下放置2周后,传感器的光电流响应仅下降了4.8%。将传感器应用于实际样品花生与大米中AFB1的检测,加标回收率为93.5%~112.8%,RSD<5.3%。所获得的新型仿生印迹光电化学传感器表现出高选择性、灵敏度和稳定性,检测限为0.058 ng/mL。
然而,由于光激发信号与电化学信号转换效率低,应开发新型光电活性材料提高光电转换效率,或构建新型BIS,提高传感器的灵敏度。Apt具有高亲和力及生物相容性,是一种通过范德华力、氢键和疏水相互作用与目标物特异性结合的DNA或RNA分子。仿生印迹电化学适配体传感器将MIPs与Apt作为双识别元件,与信号转导元件集成在一起,具有成本低、灵敏度高、操作简单、易于小型化和实时在线监测等优点。ROUSHANI等[70]将Cu2O纳米立方体(Cu2O nanocubes,Cu2O NCs)修饰在GCE上,得到Cu2O NCs/GCE,Cu2O纳米立方体不仅具有吸附能力强、制备简单、成本低廉及毒性低的优点,还具有大的比表面积,可以增加Apt的附着位点,将AFB1-Apt滴涂在Cu2O NCs/GCE上后,在多巴胺缓冲溶液中电聚合,得到Apt [AFB1]/Cu2O NCs/GCE(图2),构建了一种具有双重识别信号放大的BIS用于检测牛奶中AFB1,加标回收率为97%~104%,RSD<1.34%。在相同的实验条件下,使用6个BIS分别检测AFB1,RSD为2.91%。将传感器保持在AFB1溶液中,每3 d检测1次,21 d后峰电流为初始电流值的88.99%。当用MIP-Apt检测干扰物质和AFB1的混合溶液时,干扰物质的存在对传感器电流响应的影响不显著;NIP-Apt对AFB1和干扰物质的电流响应几乎相同,表明MIP-Apt的印迹位点在空间结构上与AFB1高度互补,该传感器对AFB1具有良好的选择特异性,检测限为12.0 pg/L。该传感器具有较高的重现性、稳定性、特异性及灵敏度。
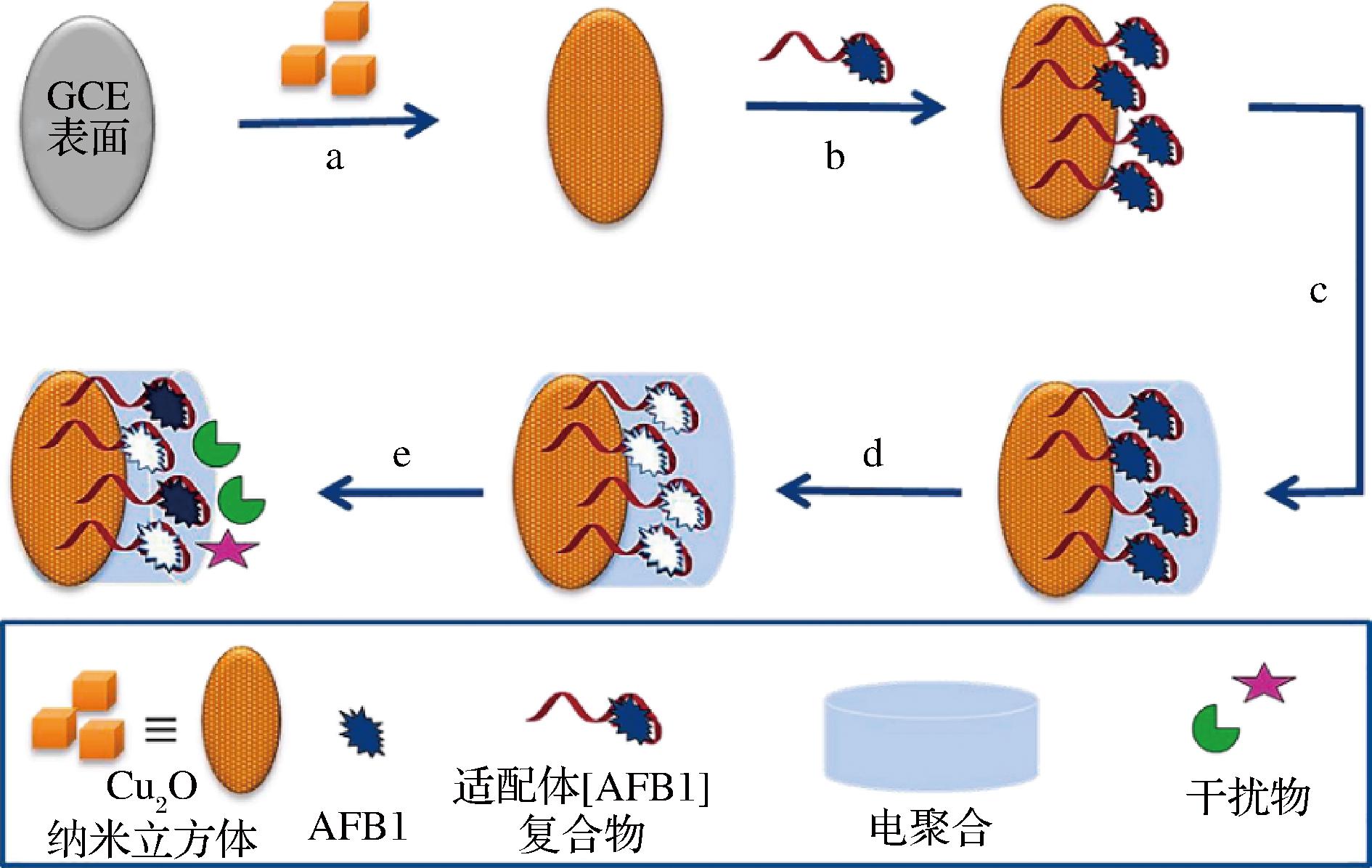
图2 黄曲霉毒素B1分子印迹适配体传感器构建示意图[70]
Fig.2 Scheme for the fabrication of AFB1 MIP-Apt sensor[70]
仿生印迹电化学适配体传感器凭借双识别元件,在检测生物毒素方面表现出优异性能并被广泛报道。然而,全球已知的生物毒素多达上千种,但适配体种类极为有限,未来应开发更多样化及更有效的适配体筛选方法,如基于芯片、氧化石墨烯和单壁碳纳米管辅助的适配体筛选方法;通过替换目标化合物的适配体序列,构建不同类型的传感器,有望为其他毒素的检测提供有效的技术手段。这一策略也将在分离、生物分子检测和环境监测等领域发挥重要作用。
3.4 BIS在海洋毒素中的应用
海洋毒素引发的食品安全事件频发,海洋生物毒素是海洋生物体内存在的一类高活性的特殊代谢成分,具有结构复杂及强毒性,为保障海洋食品安全,开发海洋毒素准确高效的检测技术刻不容缓。BIS在海洋毒素检测中的应用,见表4。组胺是细菌在鲭鱼腐败过程中产生的,虽不是由海洋生物产生的海洋毒素,但与海洋食品安全密切相关。AKHOUNDIAN等[75]以本体聚合法制备MIPs,将MIPs、纳米碳及石墨混合,涂在碳糊电极表面,成功构建了仿生印迹伏安传感器。该传感器的检测限为7.4×10-11 mol/L。该方法操作简便,成本低廉,但制备的MIPs存在粒径不均一,模板洗脱困难,印迹位点容易泄露等问题。
表4 不同种类纳米BIS在海洋毒素检测中的应用
Table 4 Applications of different types of nano-BIS for detection of marine toxins

海洋毒素增敏材料传感器类型线性范围检测限回收率参考文献软骨藻酸BCDs@SiO2和CdTe比例荧光传感器0.03~1 μmol/L18 nmol/L93%~108%[76]河豚毒素—电化学传感器5~25 μg/mL1.14 μg/mL81%~102.5%[77]石房蛤毒素Ti3C2Tx适配体传感器1~200 nmol/L0.03 nmol/L103%[78]雪卡毒素BCDs/RCDs@SiO2比率荧光传感器0.001~1 ng/mL3.3×10-4 ng/mL80%~91.33%[30]
注:BCDs-蓝色发光碳点。
表面印迹技术使仿生印迹识别位点位于MIPs的表面或固相基质的外层,辅以适当的纳米材料如二氧化硅或磁性纳米颗粒为载体,形成了更多的吸附位点[79-80]。该技术有利于脱除模板分子,解决了模板分子包埋过深不易洗脱等问题,有助于降低大分子印迹过程中的传质阻力[81-82]。LIU等[83]在光催化剂TiO2表面包覆多壁碳纳米管合成表面MIPs,TiO2与多壁碳纳米管复合后具有较高的比表面积和优异的光电活性,丰富了活性识别位点,开发了一种高灵敏度、高吸附容量和高选择性的仿生印迹光电化学传感器,用于检测微囊藻毒素(图3)。采用相对光电流比R(%)来评价选择性,将不添加共存物的微囊藻毒素的R(%)值设定为100%,在100倍的干扰物存在下,R(%)值均小于10%,且传感器用于实际水样检测时R(%)值仍小于15%,表明该传感器具有较好的选择性,也间接佐证了传感界面具有较强的空间选择性和位点特异性。传感器在10次循环后光电流响应仍保持稳定,这充分证明了传感器具有较高的专一性和稳定性。在实际水样检测时,该传感器能较好地抵抗复杂基质的干扰,加标回收率为96.4%~113%,RSD<9.1%,适用于多种环境废水中微囊藻毒素的测定。传感器在1.0 pmol/L~3.0 nmol/L的浓度范围内呈良好的线性关系,该方法检测限(0.4 pmol/L)比LC-MS/MS[84]低10倍(4 ng/L)。未来将仿生印迹传感技术与钙钛矿或黑磷纳米片等新型纳米材料或表面接枝共聚等新聚合技术结合,可有效解决仿生印迹传感技术的现存问题,为海洋食品安全保驾护航。

图3 微囊藻毒素仿生印迹光电化学传感器构建示意图[83]
Fig.3 Scheme for the fabrication of biomimetic imprinting photoelectrochemical sensor for microcystin[83]
注:MWCNTs-多壁碳纳米管;(C4H9O)4Ti-钛酸四丁酯;MI-TiO2@CNTs(with MC-LR)-微囊藻毒素分子印迹功能化的二氧化钛碳纳米管;MI-TiO2@CNTs-微囊藻毒素被去除后,分子印迹功能化的二氧化钛碳纳米管;TiO2NPs-二氧化钛纳米粒子;MC-LR-微囊藻毒。
4 结论与展望
本文主要介绍了仿生印迹传感界面的构建,阐述了仿生印迹体系的构建,包括模板分子的获取、新型功能单体的开发与筛选、交联剂种类与用量对聚合物性能的影响、引发剂与致孔剂的筛选与发展前景;讨论了仿生印迹传感器在植物毒素、动物毒素、微生物毒素及海洋毒素快速检测方面的研究进展及应用。
尽管BIS快速检测方法具有一定的优势,但在实际检测中仍存在一些问题:对BIS的研究仍局限于实验室阶段,尚未实现现场实时检测及商业化,未来可探索与智能手机或微流控芯片等智能分析平台结合,促进便携式传感器的发展;BIS在检测实际样品时因实际样品基质复杂常出现基质效应及交叉反应,未来应优化预处理过程或与磁性纳米材料相结合,结合化学计量学方法,提高传感器的灵敏度、特异性和稳健性;鉴于食品样品中多种生物毒素共存且基质复杂,未来可开发多模态BIS,以实现多种生物毒素同时检测。随着仿生印迹技术的发展,特别是智能化仿生印迹体系的构建,将进一步充实BIS的理论内涵与应用价值,为生物毒素的检测提供更加特异、准确和快捷的方法。
[1] BAGGIANI C, ANFOSSI L, GIOVANNOLI C.Molecular imprinted polymers as synthetic receptors for the analysis of myco- and phyco-toxins[J].The Analyst, 2008, 133(6):719-730.
[2] FANG L, JIA M X, ZHAO H P, et al.Molecularly imprinted polymer-based optical sensors for pesticides in foods:Recent advances and future trends[J].Trends in Food Science &Technology, 2021, 116:387-404.
[3] PELTOMAA R, BENITO-PE A E, MORENO-BONDI M C.Bioinspired recognition elements for mycotoxin sensors[J].Analytical and Bioanalytical Chemistry, 2018, 410(3):747-771.
A E, MORENO-BONDI M C.Bioinspired recognition elements for mycotoxin sensors[J].Analytical and Bioanalytical Chemistry, 2018, 410(3):747-771.
[4] ZHOU S H, LIU C, LIN J G, et al.Towards development of molecularly imprinted electrochemical sensors for food and drug safety:Progress and trends[J].Biosensors, 2022, 12(6):369.
[5] AHMAD O S, BEDWELL T S, ESEN C, et al.Molecularly imprinted polymers in electrochemical and optical sensors[J].Trends in Biotechnology, 2019, 37(3):294-309.
[6] 刘兵, 董培, 陈福全, 等.分子印迹聚合物在电化学传感器中的应用[J].武警医学院学报, 2005(6):536-538.LIU B, DONG P, CHEN F Q, et al.The application of molecular imprinted polymer in electrochemical sensor[J].Acta Academiae Medicinae CPAPF, 2005(6):536-538.
[7] 玄艺, 张宇, 黄晓宁, 等.分子印迹传感器在兽药残留分析领域研究进展[J].中国畜牧兽医, 2024, 51(1):427-433.XUAN Y, ZHANG Y, HUANG X N, et al.Research progress of molecular imprinting sensors in the field of veterinary drug residue analysis[J].China Animal Husbandry &Veterinary Medicine, 2024, 51(1):427-433.
[8] 李兆周, 韦玉花, 张孝冲, 等.仿生印迹亲和分析技术研究进展[J].分析化学, 2024, 52(6):763-777.LI Z Z, WEI Y H, ZHANG X C, et al.Research progress of biomimetic imprinting affinity analysis technique[J].Chinese Journal of Analytical Chemistry, 2024, 52(6):763-777.
[9] 李兆周, 郭津瑞, 王耀, 等.氨基糖苷类药物光电化学传感器的构建及应用研究进展[J].食品与发酵工业, 2024, 50(18):351-360.LI Z Z, GUO J R, WANG Y, et al.Research progress on construction and application of aminoglycosides optical and electrochemical sensors[J].Food and Fermentation Industries, 2024, 50(18):351-360.
[10] 于江晗, 李兆周, 陈秀金, 等.仿生印迹传感器在食品安全快速检测中的应用进展[J].食品与发酵工业, 2022, 48(24):327-336.YU J H, LI Z Z, CHEN X J, et al.Application progress of bionic imprinting sensor in the rapid detection of food safety[J].Food and Fermentation Industries, 2022, 48(24):327-336.
[11] RENKECZ T, HORVATH V.Preparation of molecularly imprinted microspheres by precipitation polymerization[J].Methods in Molecular Biology, 2017, 1575:341-352.
[12] 苏立强, 楚善明, 谢鹏, 等.可逆加成-断裂链转移沉淀聚合法制备木犀草素分子印迹聚合物及其表征[J].分析科学学报, 2019,35(1):100-104.SU L Q, CHU S M, XIE P, et al.Preparation of luteolin molecularly imprinted polymer by RAFT-precipitation polymerization and its characterization[J].Journal of Analytical Science, 2019, 35(1):100-104.
[13] 王晓通, 张晓彤, 谢晓程, 等.分子印迹技术在兽用抗生素残留分析中的应用进展[J].中国兽药杂志, 2021, 55(9):50-56.WANG X T, ZHANG X T, XIE X C, et al.Application progress of molecular imprinting technology in analysis of veterinary antibiotic residues[J].Chinese Journal of Veterinary Drug, 2021, 55(9):50-56.
[14] 刘艳丽, 李小军, 贺晓荣, 等.分子印迹电化学传感器制备及在蛋白质检测上的应用[J].化工进展, 2017, 36(7):2533-2539.LIU Y L, LI X J, HE X R, et al.The fabrication of molecularly imprinted electochemical sensor and its application in protein detection[J].Chemical Industry and Engineering Progress, 2017, 36(7):2533-2539.
[15] YANG F, WANG R R, NA G S, et al.Preparation and application of a molecularly imprinted monolith for specific recognition of domoic acid[J].Analytical and Bioanalytical Chemistry, 2018, 410(6):1845-1854.
[16] 李春涯, 王长发, 王成行, 等.分子印迹电化学传感器的研究进展[J].分析科学学报, 2006, 22(5):605-610.LI C Y, WANG C F, WANG C H, et al.Progress of electrochemical sensors based on molecularly imprinted polymers[J].Journal of Analytical Science, 2006, 22(5):605-610.
[17] SURYANARAYANAN V, WU C T, HO K C.Molecularly imprinted electrochemical sensors[J].Electroanalysis, 2010, 22(16):1795-1811.
[18] ZHENG X F, KHAOULANI S, KTARI N, et al.Towards clean and safe water:A review on the emerging role of imprinted polymer-based electrochemical sensors[J].Sensors, 2021, 21(13):4300.
[19] CUI F Y, ZHOU Z R, ZHOU H S.Molecularly imprinted polymers and surface imprinted polymers based electrochemical biosensor for infectious diseases[J].Sensors, 2020, 20(4):996.
[20] JIANG M N, TANG J Y, ZHOU N Y, et al.Rapid electrochemical detection of domoic acid based on polydopamine/reduced graphene oxide coupled with in situ imprinted polyacrylamide[J].Talanta, 2022, 236:122885.
[21] YANG S, GAO H F, TONG Y K, et al.Development of a ZnNiMOF@CNT-based MIP electrochemical sensor:Toward the selective detection of creatinine in urine and saliva[J].Electrochimica Acta, 2025, 514:145665.
[22] LI H F, XIE T, SHI D D, et al.Enhanced electrochemiluminescence of luminol at the gold nanoparticle/carbon nanotube/electropolymerised molecular imprinting composite membrane interface for selective recognition of triazophos[J].International Journal of Environmental Analytical Chemistry, 2016, 96(13):1300-1311.
[23] ZUO J L, MA P R, LI Z, et al.Application of molecularly imprinted polymers in plant natural products:Current progress and future perspectives[J].Macromolecular Materials and Engineering, 2023, 308(3):2200499.
[24] 苏楠, 马丽卿, 马永成, 等.棒曲霉素对人肝细胞L-02的毒性效应及作用机制[J].中国药理学与毒理学杂志, 2016, 30(7):741-746.SU N, MA L Q, MA Y C, et al.Toxicological effect and mechanism of patulin on human normal liver cells L-02[J].Chinese Journal of Pharmacology and Toxicology, 2016, 30(7):741-746.
[25] 汪淑雪, 王艳玲.基于适配体检测水果及其制品中棒曲霉素的研究进展[J].食品安全质量检测学报, 2024, 15(12):102-112.WANG S X, WANG Y L.Research progress on aptamer-based detection of patulin in fruits and their products[J].Journal of Food Safety &Quality, 2024, 15(12):102-112.
[26] ÇIMEN D, BERELI N, DENIZLI A.Patulin imprinted nanoparticles decorated surface plasmon resonance chips for patulin detection[J].Photonic Sensors, 2022, 12(2):117-129.
[27] L PEZ-PUERTOLLANO D, DUNCAN H, ABAD-SOMOVILLA A, et al.Competitive cytometry-based immunoassay for patulin determination in apple juice[J].Microchemical Journal, 2025, 212:113287.
PEZ-PUERTOLLANO D, DUNCAN H, ABAD-SOMOVILLA A, et al.Competitive cytometry-based immunoassay for patulin determination in apple juice[J].Microchemical Journal, 2025, 212:113287.
[28] 刘佳, 黄松, 王成龙, 等.虚拟模板分子印迹技术在食品检测中的应用[J].广东化工, 2024, 51(6):115-118.LIU J, HUANG S, WANG C L, et al.The applications of dummy-template molecularly imprinted technology in food inspection[J].Guangdong Chemical Industry, 2024, 51(6):115-118.
[29] YARYNKA D, CHEGEL V, PILETSKA E, et al.An enhanced fluorescent sensor system based on molecularly imprinted polymer chips with silver nanoparticles for highly-sensitive Zearalenone analysis[J].Analyst, 2023, 148(11):2633-2643.
[30] QI Z K, XIANG C, TIAN X G, et al.Facile synthesis of molecularly imprinted ratiometric fluorescence sensor for ciguatoxin P-CTX-3C detection in fish[J].Foods, 2022, 11(20):3239.
[31] SIBAT M, HERRENKNECHT C, DARIUS H T, et al.Detection of Pacific ciguatoxins using liquid chromatography coupled to either low or high resolution mass spectrometry (LC-MS/MS)[J].Journal of Chromatography A, 2018, 1571:16-28.
[32] 王艺晓, 李金花, 王莉燕, 等.片段/虚拟分子印迹聚合物的应用新进展[J].色谱, 2021, 39(2):134-141.WANG Y X, LI J H, WANG L Y, et al.Recent advances in applications of fragment/dummy molecularly imprinted polymers[J].Chinese Journal of Chromatography, 2021, 39(2):134-141.
[33] QI Z K, LU R Q, WANG S Y, et al.Selective fluorometric determination of microcystin-LR using a segment template molecularly imprinted by polymer-capped carbon quantum dots[J].Microchemical Journal, 2021, 161:105798.
[34] LI Y Y, YOU J Q, HE Y, et al.Two-fragment-dummy-template molecularly imprinted polymers Mn doped ZnS quantum dots based room-temperature phosphorescene probing for hepatotoxic homologues of microcystin[J].ChemistrySelect, 2020, 5(38):12028-12033.
[35] CHIANELLA I, LOTIERZO M, PILETSKY S A, et al.Rational design of a polymer specific for microcystin-LR using a computational approach[J].Analytical Chemistry, 2002, 74(6):1288-1293.
[36] LI H, XU M M, WANG S S, et al.Preparation, characterization and selective recognition for vanillic acid imprinted mesoporous silica polymers[J].Applied Surface Science, 2015, 328:649-657.
[37] TURNER N W, PILETSKA E V, KARIM K, et al.Effect of the solvent on recognition properties of molecularly imprinted polymer specific for ochratoxin A[J].Biosensors &Bioelectronics, 2004, 20(6):1060-1067.
[38] YU J S, WU X X, CAO H, et al.Mechanisms of Cd (Ⅱ) binding to GMP and UMP:A combined conductometry, isothermal titration calorimetry and NMR study[J].Chemical Papers, 2021, 75(5):2135-2157.
[39] ZHANG Z J, LIU J W.Molecularly imprinted polymers with DNA aptamer fragments as macromonomers[J].ACS Applied Materials &Interfaces, 2016, 8(10):6371-6378.
[40] HE X P, CHEN J L, WANG J T, et al.Multipoint recognition of domoic acid from seawater by dummy template molecularly imprinted solid-phase extraction coupled with high-performance liquid chromatography[J].Journal of Chromatography A, 2017, 1500:61-68.
[41] AO J J, GU J P, YUAN T, et al.Applying molecular modelling and experimental studies to develop molecularly imprinted polymer for domoic acid enrichment from both seawater and shellfish[J].Chemosphere, 2018, 199:98-106.
[42] VASAPOLLO G, DEL SOLE R, MERGOLA L, et al.Molecularly imprinted polymers:Present and future prospective[J].International Journal of Molecular Sciences, 2011, 12(9):5908-5945.
[43] YOSHIMATSU K, REIMHULT K, KROZER A, et al.Uniform molecularly imprinted microspheres and nanoparticles prepared by precipitation polymerization:The control of particle size suitable for different analytical applications[J].Analytica Chimica Acta, 2007, 584(1):112-121.
[44] 崔亚涵. 基于新型交联剂构筑分子印迹聚合物用于污染物分析[D].长春:吉林大学, 2022.CUI Y H.Fabrication of molecularly imprinted polymers based on novel cross-linkers for pollutant analysis[D].Changchun:Jilin University, 2022.
[45] SOUSA M D, BARBOSA C M.Molecularly imprinted polymers for controlling drug release.Part 1:synthesis and characterization[J].Quimica Nova, 2009, 32(6):1609-1619.
[46] 马春慧, 王晓静, 孙莉寒, 等.低共熔溶剂在分子印迹技术中的应用研究进展[J].林产化学与工业, 2022, 42(6):123-135.MA C H, WANG X J, SUN L H, et al.Application of deep eutectic solvents in molecular imprinting separation technology[J].Chemistry and Industry of Forest Products, 2022, 42(6):123-135.
[47] WANG J F, JIANG X Y, ZHANG H, et al.Preparation of a porous polymer monolithic column with an ionic liquid as a porogen and its applications for the separation of small molecules in high performance liquid chromatography[J].Analytical Methods, 2015, 7(18):7879-7888.
[48] LIU C J, HUANG H, QU X Y, et al.Designing deep eutectic solvents with crystalline features:A new-generation green crystallization-induced porogen[J].ACS Sustainable Chemistry &Engineering, 2023, 11(4):1472-1481.
[49] 刘兴元. 分子印迹农药电化学传感器的研究概述[J].思茅师范高等专科学校学报, 2008, 24(6):14-16.LIU X Y.The progress of the study on molecularly imprinted electrochemical sensor for pesticides determining[J].Journal of Simao Teacher’s College, 2008, 24(6):14-16.
[50] D’AURELIO R, CHIANELLA I, GOODE J A, et al.Molecularly imprinted nanoparticles based sensor for cocaine detection[J].Biosensors, 2020, 10(3):22.
[51] NAKAYAMA H, KENJJOU N, SHIGETOH N, et al.Fluorescence immunoassay for cocaine detection[J].Monoclonal Antibodies in Immunodiagnosis and Immunotherapy, 2016, 35(2):83-85.
[52] ZHAO C, WU D C.Rapid detection assay for the molecular imprinting of gossypol using a two-layer PMAA/SiO2 bulk structure with a piezoelectric imprinting sensor[J].Sensors and Actuators B:Chemical, 2013, 181:104-113.
[53] LI Y G, SHAO L J, LIU Q J, et al.Nicotine detection in tobacco samples via a molecularly imprinted polymers sensing platform[J].International Journal of Electrochemical Science, 2024, 19(7):100592.
[54] MAO L B, GAO M T, XUE X J, et al.Organic-inorganic nanoparticles molecularly imprinted photoelectrochemical sensor for α-solanine based on p-type polymer dots and n-CdS heterojunction[J].Analytica Chimica Acta, 2019, 1059:94-102.
[55] WANG F, ZHOU J, LIU Y, et al.Electrochemical oxidation behavior of colchicine on a graphene oxide-Nafion composite film modified glassy carbon electrode[J].Analyst, 2011, 136(19):3943-3949.
[56] BAI H P, WANG C Q, CHEN J, et al.Graphene@AuNPs modified molecularly imprinted electrochemical sensor for the determination of colchicine in pharmaceuticals and serum[J].Journal of Electroanalytical Chemistry, 2018, 816:7-13.
[57] ÖREN VAROL T, ANIK Ü.Fabrication of multi-walled carbon nanotube-metallic nanoparticle hybrid nanostructure based electrochemical platforms for sensitive and practical colchicine detection[J].New Journal of Chemistry, 2019, 43(34):13437-13446.
[58] SAYLAN Y, AKGÖNÜLLÜ S, YAVUZ H, et al.Molecularly imprinted polymer based sensors for medical applications[J].Sensors, 2019, 19(6):1279.
[59] 王青华, 邓健康, 齐善厚, 等.分子印迹光学传感器用于食品安全检测方面的研究进展[J].现代食品, 2020, 26(14):154-157.WANG Q H, DENG J K, QI S H, et al.Advances in molecular imprinted optical sensor for food safety detection[J].Modern Food, 2020, 26(14):154-157.
[60] HUANG X Z, XIA L, LI G K.Recent progress of molecularly imprinted optical sensors[J].Chemosensors, 2023, 11(3):168.
[61] LIU G Y, HUANG X D, LI L Y, et al.Recent advances and perspectives of molecularly imprinted polymer-based fluorescent sensors in food and environment analysis[J].Nanomaterials, 2019, 9(7):1030.
[62] LING J, ZHANG W Q, CHENG Z J, et al.High-sensitivity detection for cantharidin by ratiometric fluorescent sensor based on molecularly imprinted nanoparticles of quantum dots[J].Journal of Industrial and Engineering Chemistry, 2022, 112:358-365.
[63] DANG Y J, ZHU C Y.Determination of trace cantharidin in plasma and pharmacokinetic study in beagle dogs using gas chromatography-mass spectrometry[J].Journal of Analytical Toxicology, 2009, 33(7):384-388.
[64] WU Y S, QIN D M, LUO Z, et al.Construction of a smartphone-based electrochemiluminescence imaging device to guide the improvement of sensing performance via surface regulation[J].Sensors and Actuators B:Chemical, 2023, 389:133885.
[65] LI M, QIAN Z J, PENG C F, et al.Ultrafast ratiometric detection of aflatoxin B1 based on fluorescent β-CD@Cu nanoparticles and Pt(2+) ions[J].ACS Applied Bio Materials, 2022, 5(1):285-294.
[66] LIU S H, WEN B Y, LIN J S, et al.Rapid and quantitative detection of aflatoxin B1 in grain by portable Raman spectrometer[J].Applied Spectroscopy, 2020, 74(11):1365-1373.
[67] 高志存, 石露莎, 余舒宁, 等.酶联免疫吸附法与高效液相色谱法检测玉米中黄曲霉毒素B1的比较[J].云南畜牧兽医, 2023(6):10-12.GAO Z C, SHI L S, YU S N, et al.Comparison of enzyme-linked immunosorbent assay and high performance liquid chromatography in detecting aflatoxin B1 in corn[J].Yunnan Journal of Animal Science and Veterinary Medicine, 2023(6):10-12.
[68] ZHANG L, HUANG H Q, LIAO M Y, et al.Ultrasensitive colorimetric immunoassay for aflatoxin B1 detection in lotus seed powder based on enhanced catalysis of Au@Pt with in situ deposition of PtNPs[J].Food Chemistry:X, 2024, 24:102030.
[69] GUO P Q, YANG W, HU H, et al.Rapid detection of aflatoxin B(1) by dummy template molecularly imprinted polymer capped CdTe quantum dots[J].Analytical and Bioanalytical Chemistry, 2019, 411(12):2607-2617.
[70] ROUSHANI M, FAROKHI S, RAHMATI Z.Development of a dual-recognition strategy for the aflatoxin B1 detection based on a hybrid of aptamer-MIP using a Cu2O NCs/GCE[J].Microchemical Journal, 2022, 178:107328.
[71] CHO H D, SUH J H, FENG S, et al.Comprehensive analysis of multi-class mycotoxins in twenty different species of functional and medicinal herbs using liquid chromatography-tandem mass spectrometry[J].Food Control, 2019, 96:517-526.
[72] ALI ALSHARIF A M, CHOO Y M, TAN G H.Detection of five mycotoxins in different food matrices in the Malaysian market by using validated liquid chromatography electrospray ionization triple quadrupole mass spectrometry[J].Toxins, 2019, 11(4):196.
[73] WANG Z H, LI J S, XU L J, et al.Electrochemical sensor for determination of aflatoxin B1 based on multiwalled carbon nanotubes-supported Au/Pt bimetallic nanoparticles[J].Journal of Solid State Electrochemistry, 2014, 18(9):2487-2496.
[74] WANG C Y, WANG H, ZHANG M, et al.Molecularly imprinted photoelectrochemical sensor for aflatoxin B1 detection based on organic/inorganic hybrid nanorod arrays[J].Sensors and Actuators B:Chemical, 2021, 339:129900.
[75] AKHOUNDIAN M, RÜTER A, SHINDE S.Ultratrace detection of histamine using a molecularly-imprinted polymer-based voltammetric sensor[J].Sensors, 2017, 17(3):645.
[76] WANG L J, WEN L J, CHEN Y X, et al.Construction of ratiometric fluorescence sensor and test strip with smartphone based on molecularly imprinted dual-emission quantum dots for the selective and sensitive detection of domoic acid[J].Chemosphere, 2022, 304:135405.
[77] ROCHA P, REBELO P, PACHECO J G, et al.Electrochemical molecularly imprinted polymer sensor for simple and fast analysis of tetrodotoxin in seafood[J].Talanta, 2025, 282:127002.
[78] ULLAH N, CHEN W, NOUREEN B, et al.An electrochemical Ti3C2Tx aptasensor for sensitive and label-free detection of marine biological toxins[J].Sensors, 2021, 21(14):4938.
[79] 颜朦朦, 赵风年, 佘永新, 等.基于纳米材料的分子印迹技术研究进展[J].分析试验室, 2018, 37(5):607-613.YAN M M, ZHAO F N, SHE Y X, et al.Advance of molecularly imprinted technology based on nanomaterials[J].Chinese Journal of Analysis Laboratory, 2018, 37(5):607-613.
[80] 张攀, 姜丽艳, 马玖彤, 等.分子印迹技术在蛋白质翻译后修饰分析中的应用[J].分析化学, 2021, 49(1):24-33.ZHANG P, JIANG L Y, MA J T, et al.Application of molecular imprinting technology in post-translational modified protein enrichment[J].Chinese Journal of Analytical Chemistry, 2021, 49(1):24-33.
[81] 柯珍, 朱华, 钟世安, 等.分子印迹技术及其应用研究进展[J].化学研究与应用, 2018, 30(6):865-874.KE Z, ZHU H, ZHONG S A, et al.Molecular imprinting technique and its application research[J].Chemical Research and Application, 2018, 30(6):865-874.
[82] SAYLAN Y, YILMAZ F, ÖZGÜR E, et al.Molecular imprinting of macromolecules for sensor applications[J].Sensors, 2017, 17(4):898.
[83] LIU M C, DING X, YANG Q W, et al.A pM leveled photoelectrochemical sensor for microcystin-LR based on surface molecularly imprinted TiO2@CNTs nanostructure[J].Journal of Hazardous Materials, 2017, 331:309-320.
[84] 李秋霞, 蔡超海, 许桂兰.超快速液相色谱-串联质谱法快速检测生活饮用水中的微囊藻毒素-LR[J].中国卫生检验杂志, 2010,20(8):1875-1877.LI Q X, CAI C H, XU G L.Rapid detection of microcystin-LR in drinking water by ultra-fast liquid chromatography tandem mass spectrometry[J].Chinese Journal of Health Laboratory Technology, 2010, 20(8):1875-1877.