结肠炎包括溃疡性肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD),主要以慢性和反复炎症为特征,伴随着免疫功能障碍和肠道菌群结构改变,长期发作会增加罹患胃肠道癌症的风险[1]。结肠炎在西方国家中较为流行。然而,近年来随着生活节奏的加快,生活方式日益西方化,亚洲发病率和患病率也逐年增加,东亚地区UC发病率从0.95/1 000 000人增到12.2/1 000 000人,而CD发病率高达2.42/1 000 000人,结肠炎已成为全球性公共卫生问题,带来了巨大经济负担[2]。膳食作为抗炎代谢物的来源和影响肠道微生物群落稳态的手段,在结肠炎疾病管理中发挥重要作用。深入理解食物、肠道微生物和疾病的作用关系对于制订结肠炎膳食干预策略至关重要[3]。
宽柄芥(Brassica juncea var.latipa)是十字花科芸薹属芥菜类蔬菜的一个叶用芥菜变种,广泛种植于我国西南、华南和华中等地区,主要用于制作发酵蔬菜和腌渍蔬菜。芥菜等十字花科蔬菜不仅富含膳食纤维、有机酸、维生素和矿物质等营养成分,还具有硫代葡萄糖苷(简称硫苷)等天然活性成分。硫苷及其代谢产物是芥菜腌制菜的重要风味物质,并且具有抗炎、抗氧化等多种生理功能,也是缓解结肠炎的重要生物活性物质[4]。ZHAO等[5]研究发现西兰花、卷心菜等十字花科蔬菜对于结肠炎的缓解作用,而对于芥菜的功能活性挖掘较为薄弱,关于宽柄芥缓解结肠炎的研究目前尚无报道。因此,有必要对宽柄芥营养成分及其在缓解UC方面的潜在生理功能进行深入研究。
本研究通过测定膳食纤维、有机酸以及硫苷等活性物质含量,对宽柄芥的营养成分与活性物质进行初步评价。采用葡聚糖硫酸钠(dextran sodium sulfate,DSS)自由饮水法诱导小鼠UC模型,观察添加宽柄芥粉的饲料对小鼠体重、结肠长度等表观指标的影响,并分析宽柄芥干预对小鼠抗氧化水平、炎症因子、结肠组织病理、肠道屏障紧密连接蛋白及肠道菌群的调控作用,为功能性发酵蔬菜原料的评价及宽柄芥功能性产品的开发提供参考。
1 材料与方法
1.1 材料与试剂
宽柄芥冻干粉,四川省农业科学院农产品加工研究所;C57BL/6JNifdc小鼠(雄性,8周龄,SPF级),广东维通利华实验动物技术有限公司;小鼠纯化饲料,江苏省协同医药生物工程有限责任公司。
DSS(Mw 500 000),麦克林公司;粪隐血试剂盒、丙二醛含量(malondialdehyde,MDA)试剂盒、总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒,南京建成生物工程研究所;BCA蛋白浓度测定试剂盒,北京鼎国昌盛生物技术有限责任公司;IL-6、IL-10和TNF-α酶联免疫试剂盒,上海酶联生物科技有限公司。
1.2 仪器与设备
Synergy H1多功能酶标仪,美国Biotek公司;UV-2450紫外-可见分光光度计,日本岛津公司;Scientz-20F真空冷冻干燥机,宁波新芝冻干设备有限公司;BX53荧光正置显微镜,日本奥林巴斯公司。
1.3 实验方法
1.3.1 宽柄芥营养物质与活性成分分析
宽柄芥总糖含量测定采用3,5-二硝基水杨酸比色法[6]。总蛋白含量测定采用BCA蛋白定量试剂盒;总膳食纤维测定参考ASP等[7]的方法。总硫苷含量测定参考贺霞等[8]使用的氯化钯比色法;有机酸含量采用高效液相色谱方法测定[9]。
1.3.2 动物实验分组与处理
15只雄性C57BL/6JNifdc小鼠随机分为3组:空白组、模型组、干预组。在屏障环境适应1周后,干预组小鼠用添加了5%(质量分数)芥菜粉的纯化饲料喂养至结束,其他组饲喂对照纯化饲料,宏量营养素保持一致。从第14天开始,将模型组和干预组饮水换成含有25 g/L DSS饮用水,直至19 d实验结束(图1-a)。本研究动物实验经西南大学实验动物伦理审查委员会批准,伦理批准号为IACUC-20230103-01,实验操作符合欧盟指导手册(2010/63/EU)要求。
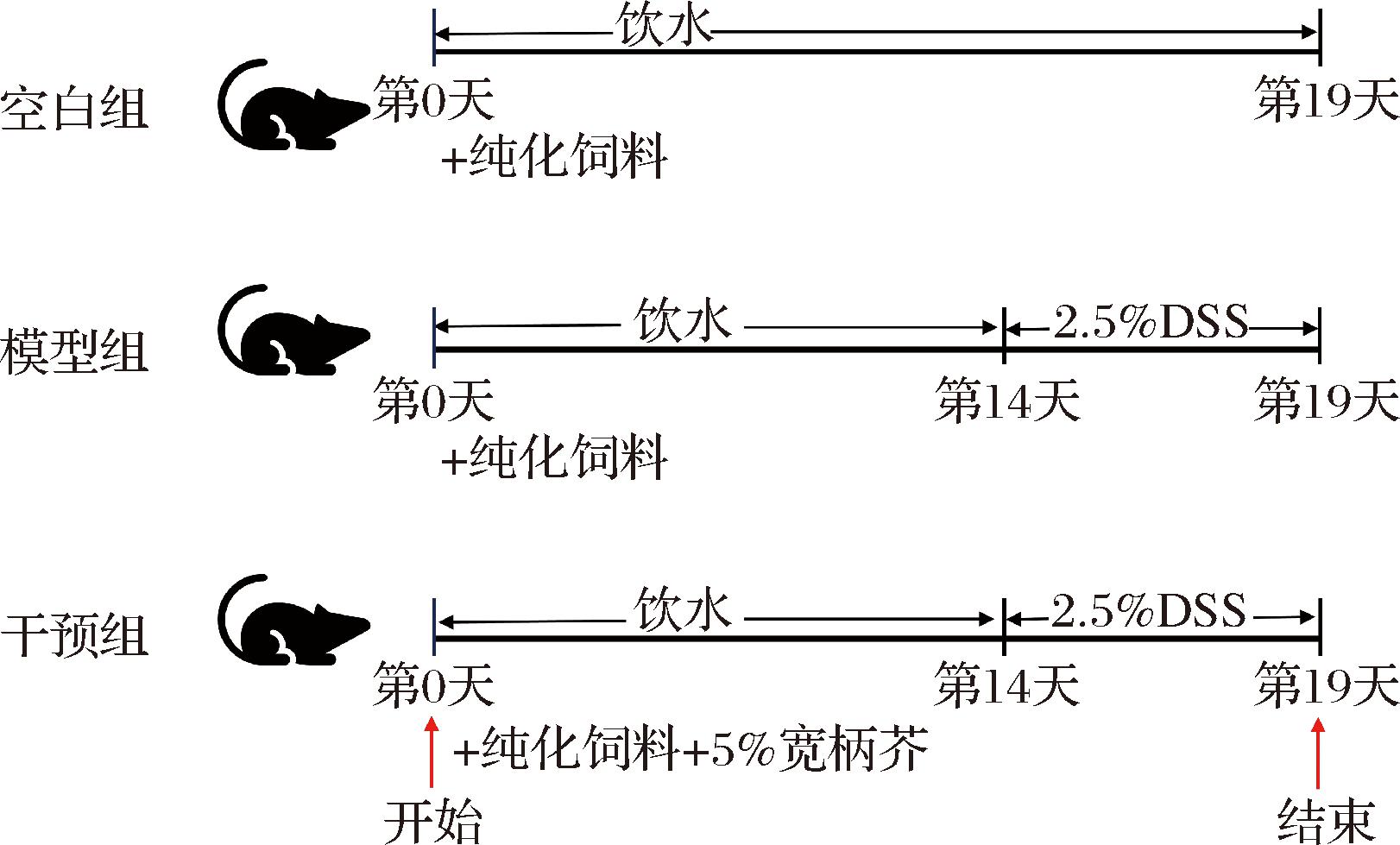
图1 动物实验设计
Fig.1 Animal experimental design
1.3.3 小鼠体重和脏器指数测定
在第0、7、14天以及DSS饮水期间每天记录小鼠体重。解剖小鼠后,摘取肝脏、肾脏和脾脏,用预冷生理盐水清洗后,滤纸吸干水分,称量脏器质量。脏器指数按照公式(1)计算:
脏器指数![]()
(1)
1.3.4 小鼠疾病活动指数(disease activity index, DAI)和结肠长度测定
通过监测小鼠体重、观察小鼠粪便形态、检测粪便隐血,进行DAI评价,标准如表1所示[10]。摘取结肠后,测量从盲肠末端到结肠肛门末端长度,记为结肠长度(cm)。
表1 DAI评分标准
Table 1 Scoring standard of DAI

计分体重下降粪便形态出血0无正常正常11%~5%25%~10%松散阳性310%~20%4>20%腹泻肉眼可见
1.3.5 小鼠肝组织抗氧化指标测定
按照试剂盒说明书测定小鼠肝脏MDA含量和T-AOC。
1.3.6 小鼠血清免疫因子测定
根据酶联免疫试剂盒说明书测定血清炎症因子IL-6、IL-10和TNF-α水平。
1.3.7 小鼠结肠组织病理学观察
参考ZOU等[11]描述方法,取距肛门1 cm处结肠约0.5 cm置于体积分数为4%多聚甲醛中固定,然后进行石蜡包埋、切片、脱蜡,苏木精-伊红(hematoxylin-eosin,HE)染色。另取切片,用阿利新蓝染液对结肠黏液层进行染色。最后在100倍光学显微镜下观察、拍照。
1.3.8 小鼠结肠组织免疫组化分析
参考文献[12]方法,并略作修改。将石蜡切片经脱蜡、在枸橼酸溶液(pH 6.0)中抗原修复、体积分数为3% H2O2溶液封闭去除内源性过氧化物酶后,滴加体积分数为5%山羊血清封闭1 h。接着,分别用兔源claudin-1抗体(1∶500,Invitrogen)、ZO-1抗体(1∶500,Abcam)和occludin抗体(1∶500,Abcam)进行一抗、二抗孵育后,利用DAB染液和苏木素复染,透明化处理后,封片,镜检,拍照。最后,使用软件Image-Pro Plus对染色强度进行分析。
1.3.9 小鼠肠道微生物多样性分析
参考ZHAO等[13]的方法,提取小鼠粪便微生物DNA,经纯度检测、琼脂凝胶电泳验证,使用引物338F(ACTCCTACGGGAGGCAGCAG)和806R(GGA-CTACHVGGGTWTCTAAT)进行16S rDNA V3~V4区PCR扩增。PCR扩增产物经回收、纯化、定量、建库,利用Illumina NextSeq 2000平台进行测序,测序结果使用QIIME软件包进行处理。最后在Majorbio Cloud Platform(https://www.majorbio.com)在线平台上进行了数据分析。
1.4 数据分析
所有试验至少重复3次,数据表示为“平均值±标准误”。利用软件SPSS 16进行单因素方差分析,多重比较采用Tukey方法。将P<0.05设为差异显著。应用Origin 2018软件进行绘图。肠道微生物多样性数据分析均在美吉生物云平台(https://cloud.majorbio.com)上进行,α多样性组间差异通过Kruskal-Wallis秩和检验进行分析,采用基于bray-curtis距离算法的主坐标分析检验样本间微生物群落结构的相似性,PERMANOVA非参数检验分析样本组间微生物群落结构差异,基于Spearman相关性进行结肠炎指标与肠道菌群的相关性网络图分析。
2 结果与分析
2.1 宽柄芥中营养物质与活性成分
叶用芥菜营养物质丰富,富含膳食纤维、有机酸、叶绿素、钾、钙等矿物元素。宽柄芥是一种鲜食和加工兼用的叶用芥菜品种,经测定分析其总糖含量为30.14 g/100 g,总蛋白含量与总膳食纤维含量分别为21.66%、19.39%(表2)。根据大约5.66 g新鲜芥菜可得1 g冻干芥菜的换算关系[14],测定结果与FAVELA-GONZ LEZ等[15]报道的新鲜芥菜中碳水化合物含量、蛋白含量与纤维含量为5.83%、4.00%、3.74%的结果相近。宽柄芥粉中总硫苷含量为9.73 μmol/g。黄惠萍[16]报道60份叶用芥菜资源总硫苷含量在1.202 3~30.731 0 μmol/g,宽柄芥总硫苷含量处于较高水平。硫苷在发酵过程中产生的异硫氰酸酯、硫氰酸酯以及睛类物质是发酵芥菜风味物质的重要组成部分,同时异硫氰酸酯具有重要的生理功能。宽柄芥中主要有机酸包括柠檬酸、苹果酸、琥珀酸和乙酸,而乳酸未检出。其中,柠檬酸含量仅为11.27 mg/g干重,而乙酸含量高达288.93 mg/g。
LEZ等[15]报道的新鲜芥菜中碳水化合物含量、蛋白含量与纤维含量为5.83%、4.00%、3.74%的结果相近。宽柄芥粉中总硫苷含量为9.73 μmol/g。黄惠萍[16]报道60份叶用芥菜资源总硫苷含量在1.202 3~30.731 0 μmol/g,宽柄芥总硫苷含量处于较高水平。硫苷在发酵过程中产生的异硫氰酸酯、硫氰酸酯以及睛类物质是发酵芥菜风味物质的重要组成部分,同时异硫氰酸酯具有重要的生理功能。宽柄芥中主要有机酸包括柠檬酸、苹果酸、琥珀酸和乙酸,而乳酸未检出。其中,柠檬酸含量仅为11.27 mg/g干重,而乙酸含量高达288.93 mg/g。
表2 宽柄芥的营养成分含量
Table 2 Contents of bioactive substances in leaf mustard

营养成分含量总糖/(g/100 g)30.14±0.12总蛋白/%21.66±1.04总膳食纤维/%19.39±0.30总硫苷/(μmol/g)9.73±0.14柠檬酸/(mg/g)11.27±0.13苹果酸/(mg/g)26.40±0.52琥珀酸/(mg/g)58.61±0.66乙酸/(mg/g)288.93±7.92乳酸/(mg/g)—
注:“—”表示未检出。
2.2 宽柄芥对DSS诱导结肠炎小鼠体重和脏器指数的影响
UC主要特点为浅表黏膜炎症,从直肠延伸至近端结肠,导致腹部不适和血样便秘,容易复发,严重影响患者生活质量。DSS诱导小鼠溃疡性结肠炎模型在发病过程中出现类似症状,如体重减轻、结肠长度缩短、腹泻甚至便血等[17]。在本研究0~14 d,添加或不添加宽柄芥的饲料饲喂期间,空白组、模型组和宽柄芥干预组的小鼠体重均正常增加,且组间无显著差异(图2-a)。在2.5% DSS饮水期间,模型组小鼠体重持续下降,第19天与第14天相比下降约8.02%,与文献中报道DSS造模期间小鼠出现明显体重下降5%~10%一致[16]。在实验结束时,DSS饮水组小鼠体重显著低于空白组小鼠(P<0.05)(图2-b)。通过在小鼠饲料中添加5%(质量分数)宽柄芥粉干预恢复了小鼠体重,且与空白组接近。
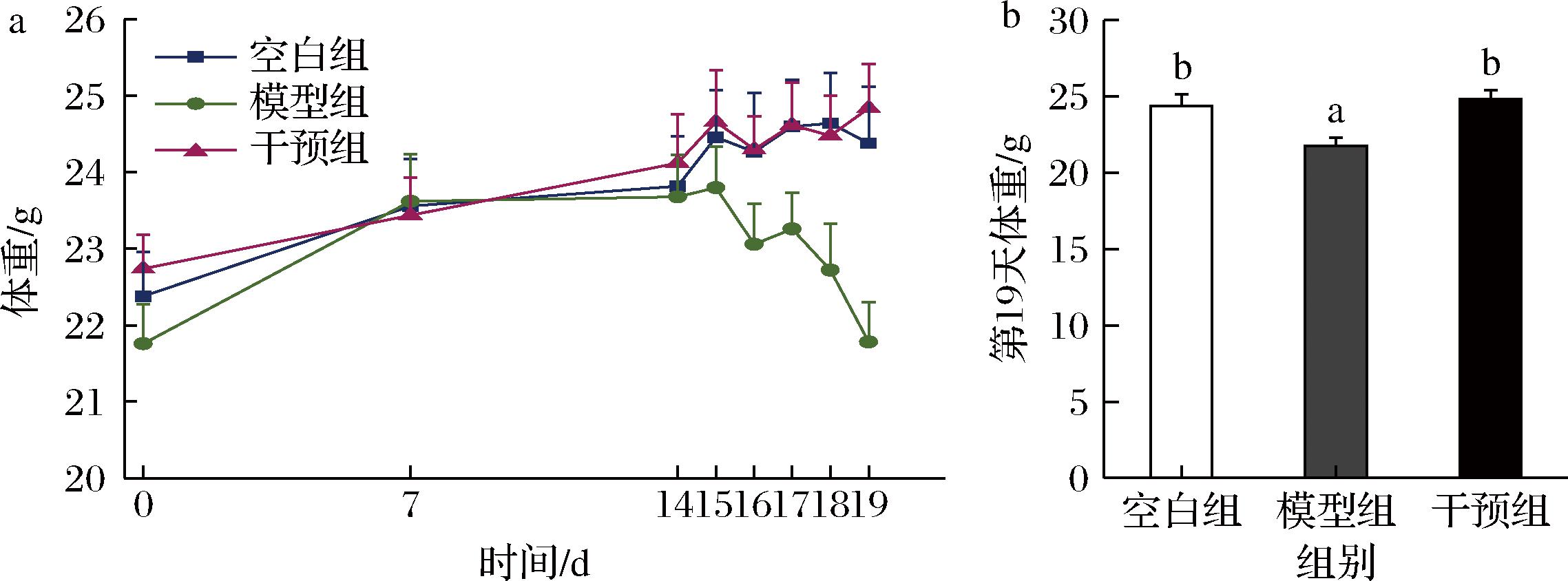
a-小鼠体重变化;b-第19天小鼠体重
图2 宽柄芥对小鼠体重的影响
Fig.2 Effects of leaf mustard treatment on the body weight
注:不同小写字母表示组间差异显著(P<0.05)(下同)。
结肠炎可能会累及患者脾脏、肝脏、肾脏积水肿大[11],这与本研究模型组小鼠肝脏和脾脏脏器指数均显著增加结果一致(表3)。相反,肾脏脏器指数显著下降。宽柄芥干预逆转了肝脏和脾脏脏器指数增大趋势,说明宽柄芥能够在一定程度上改善DSS诱导的结肠炎小鼠脾脏和肝脏炎症肿大。
表3 宽柄芥对小鼠脏器指数的影响
Table 3 Effects of leaf mustard on organ index

组别体重/g肝脏指数/%肾脏指数/%脾脏指数/%空白组24.38±0.74b3.45±0.16a1.20±0.05b0.26±0.02a模型组21.78±0.52a3.85±0.06b1.04±0.04a0.35±0.00b干预组24.84±1.29b3.34±0.04a0.99±0.01a0.24±0.02a
2.3 宽柄芥对DAI和结肠长度的影响
DAI综合反映了结肠炎导致的体重变化、粪便黏稠度和大便出血等症状,对于评估结肠炎严重程度具有重要意义,分值越高表明小鼠结肠组织受损程度越大,结肠炎越严重[11]。结肠具有吸收电解质和水,形成、贮存和排泄粪便等功能。如果结肠功能紊乱,就会影响代谢吸收,出现腹泻、便秘等症状。本研究中干预组DAI显著低于模型组小鼠(P<0.05)(图3-a)。模型组小鼠结肠长度要小于对照组,这主要是由于结肠肿胀和充血引起的[11]。而在宽柄芥喂养后,小鼠结肠长度要显著高于模型组(图3-b和图3-c),这说明宽柄芥可以减轻结肠炎小鼠结肠缩短的症状,保护小鼠结肠组织,但其作用机制有待进一步探讨。
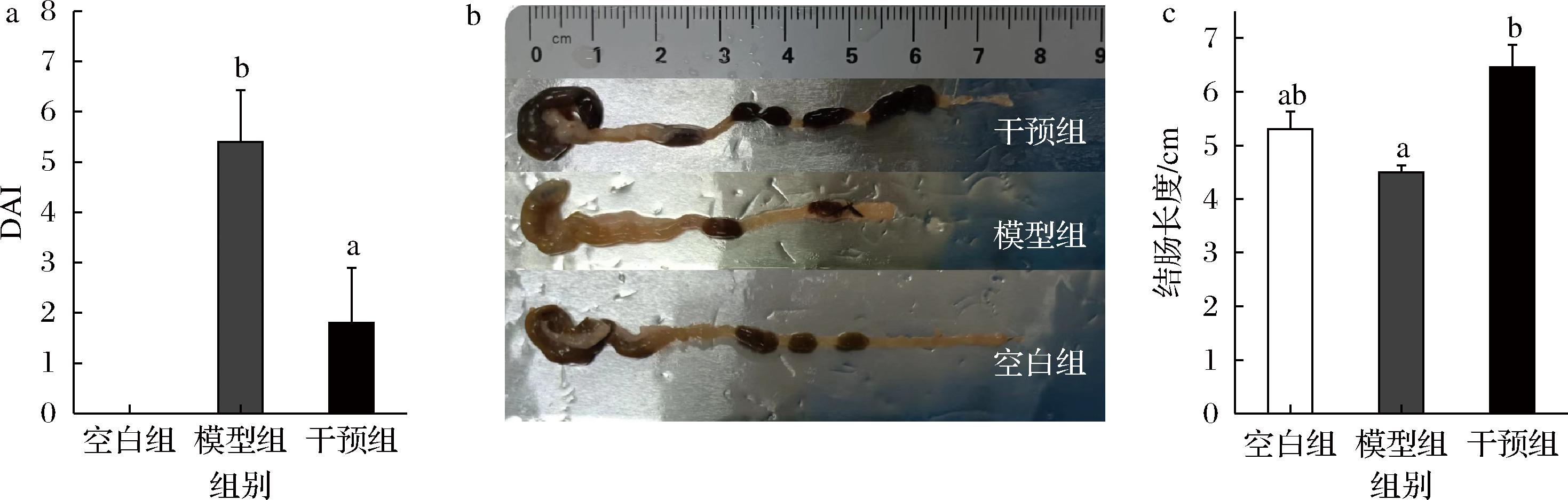
a-DAI;b-小鼠结肠照片;c-结肠长度
图3 宽柄芥对DAI和结肠长度的影响
Fig.3 Effects of leaf mustard on the DAI and colon length in DSS-induced colitis
2.4 宽柄芥对小鼠肝组织抗氧化水平的影响
结肠炎发病时,组织中活性氧自由基和抗氧化系统之间失衡,肠黏膜的活化免疫细胞释活性氧会破坏蛋白质、核酸等大分子物质,引起脂质氧化,产生MDA等有害物质,具体表现为UC患者血浆、血清、组织中MDA等脂质衍生物的含量增加,而抗氧化水平降低[18]。MDA由多不饱和脂肪酸的过氧化和花生四烯酸的代谢产生,已被广泛作为脂质过氧化标记物,间接反映细胞受损程度。小鼠肝脏抗氧化水平测定结果显示,DSS组小鼠肝脏MDA含量约增加了4倍(空白组:3.94 nmol/mg prot vs 模型组:15.70 nmol/mg prot),而宽柄芥干预将MDA含量恢复到和空白组接近水平(图4-a),这与萝卜硫素缓解大鼠溃疡性结肠炎结果相似[4]。肝脏总抗氧化能力与MDA结果一致(图4-b),DSS诱导降低总抗氧化水平,而宽柄芥干预显著提高了抗氧化水平(1.71 U/mg prot vs 3.75 U/mg prot,P<0.05),说明宽柄芥可以降低小鼠肝组织氧化应激水平,增强抗氧化能力。
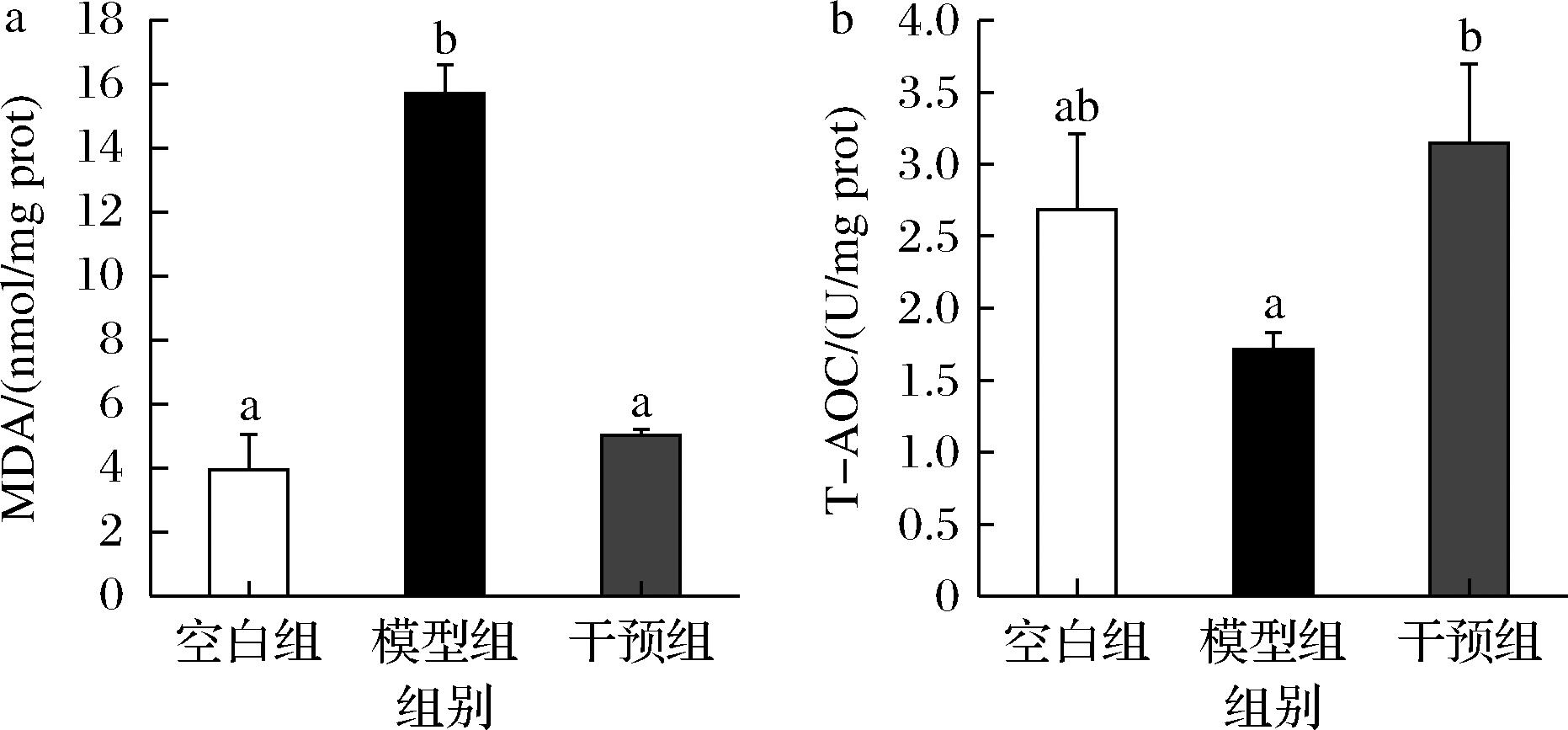
a-MDA;b-T-AOC
图4 宽柄芥对小鼠肝脏抗氧化水平的影响
Fig.4 Effects of leaf mustard on the hepatic antioxidative capacity in DSS-induced colitis
2.5 宽柄芥对小鼠血清细胞因子的影响
结肠炎患者炎症部会释放大量炎症因子。TNF-α和IL家族(如IL-6、IL-18等)由巨噬细胞、树突状细胞和上皮细胞产生,它们能够促进炎症过程,在结肠炎进展中起着关键作用[19]。其中IL-6与TNF-α是导致UC发病的重要促炎细胞因子,TNF-α通过TNF-α受体1(TNF-R1)调节上皮细胞凋亡、促炎细胞因子的产生[4]。IL-6和TNF-α等促炎因子表达增高会损害肠道通透性与上皮细胞紧密连接[10]。与对照组相比,经5 d DSS饮水后,模型组小鼠血清中TNF-α和IL-6水平上升,而干预组均呈现下降趋势(图5-a和图5-b),这表明宽柄芥抑制结肠炎小鼠血清促炎因子IL-6和TNF-α水平升高,通过调节炎症介质分泌改善机体炎症反应,从而缓解结肠炎症状。结果与WANG等[20]使用自泡菜分离泡状乳杆菌通过抑制IL-6和TNF-R1的产生缓解小鼠结肠炎结果一致。对于抗炎因子IL-10,DSS饮水诱导其水平升高,且干预组与其保持相近的水平(图5-c)。
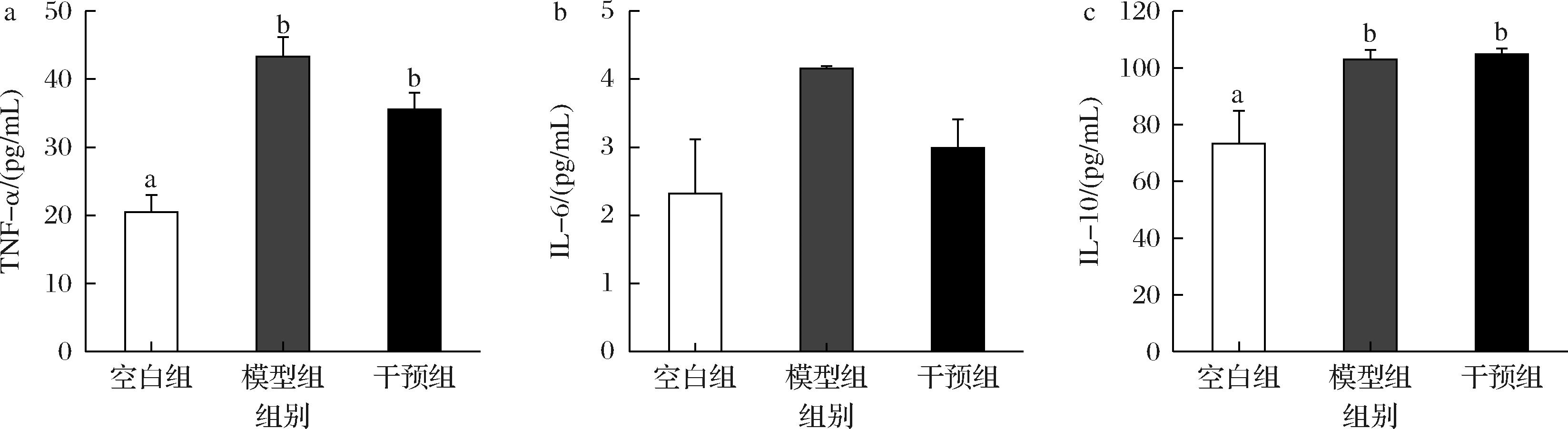
a-TNF-α;b-IL-6;c-IL-10
图5 宽柄芥对小鼠血清细胞因子水平的影响
Fig.5 Effects of leaf mustard administration on the levels of serum cytokines
2.6 宽柄芥对小鼠结肠组织病理的影响
肠道上皮屏障包括黏液层和细胞间紧密连接蛋白,是保护身体的第一道防线,防止各种微生物与抗原进入宿主。DSS诱导结肠炎的典型结肠组织病理特征包括黏蛋白和杯状细胞耗竭、肠上皮细胞侵蚀和溃疡,中性粒细胞流入固有层和黏膜下层等[21]。HE染色结果显示空白组小鼠结肠黏膜结构完整,隐窝结构完整,而模型组隐窝结构被破坏,杯状细胞数量减少,干预组小鼠结肠黏膜结构规则,隐窝和杯状细胞与空白组一致(图6-a~图6-c)。阿利新蓝染色结果显示,与空白组相比,模型组隐窝结构中杯状细胞减少甚至消失,结肠炎患者杯状细胞的数量越少,黏液蛋白分泌越少,导致黏液层被破坏[11],而干预组很好逆转这一趋势(图6-d~图6-f)。
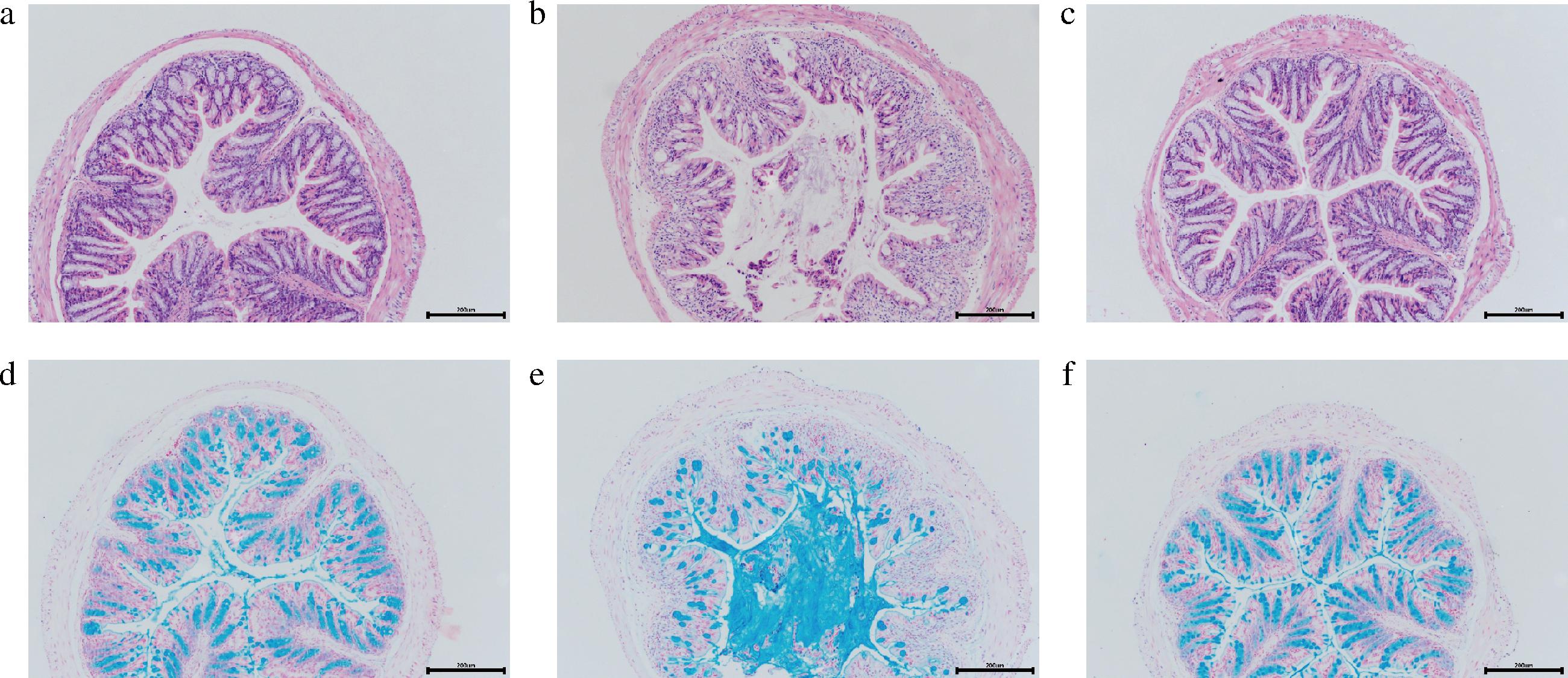
a,d-空白组;b,e-模型组;c,f-干预组
图6 小鼠结肠组织HE和阿利新蓝染色病理切片
Fig.6 Histological analysis of colon stained by HE and alcian blue
2.7 宽柄芥对小鼠结肠紧密连接蛋白的影响
紧密连接蛋白是肠道上皮细胞间连接的重要组成部分,直接参与细胞间的相互作用,并维持肠道通透性。如果这些蛋白表达异常,可能会导致肠道通透性增加,进而引发结肠炎等肠道炎症疾病[22]。通过免疫组化以及半定量分析研究了DSS饮水以及宽柄芥对小鼠结肠紧密连接蛋白的影响(图7和表4)。结果显示DSS饮水5 d导致claudin-1、occludin和ZO-1这3种蛋白表达量降低,其中claudin-1和occludin与空白组相比显著下降(P<0.05),提示肠上皮细胞渗透性增加。宽柄芥饲喂小鼠提高紧密连接蛋白的相对含量,说明在一定程度上缓解DSS对紧密连接蛋白的影响,降低肠道上皮渗透性,有利于维持肠道屏障功能。结肠组织切片病理观察与免疫组化分析结果显示,宽柄芥干预对结肠黏膜、隐窝和杯状细胞以及结肠紧密连接蛋白均有保护作用,维持肠道上皮屏障。
表4 免疫组化切片平均光密度分析结果
Table 4 Analysis results of immunohistochemistry slice average optical density
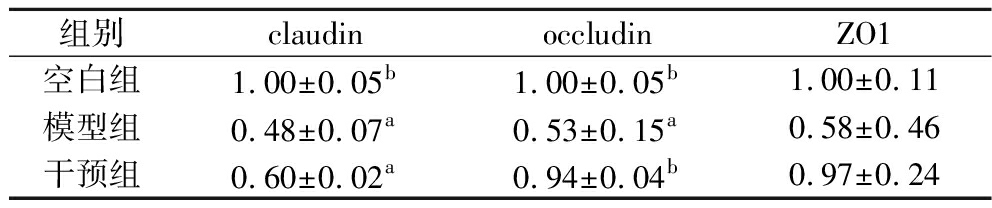
组别claudinoccludinZO1空白组1.00±0.05b1.00±0.05b1.00±0.11模型组0.48±0.07a0.53±0.15a0.58±0.46干预组0.60±0.02a0.94±0.04b0.97±0.24

图7 宽柄芥对小鼠结肠上皮细胞紧密连接蛋白的影响
Fig.7 Effects of leaf mustard on tight junction proteins in DSS-induced mice
2.8 宽柄芥对小鼠肠道微生物多样性的影响
肠道微生物菌群失调是结肠炎患者的特征之一,结肠炎患者的肠道菌群可见α和β多样性降低[5]。芥菜、西兰花等十字花科蔬菜可以通过调节肠道微生物群落结构缓解小鼠溃疡性结肠炎[23-24]。小鼠粪便菌群16S rRNA测序稀释曲线平滑,表明测序数据量足够大,可以揭示样品中的大部分微生物多样性信息[23](图8-a)。空白组、模型组和干预组共鉴定出990个扩增子序列变体(amplicon sequence variants,ASV),3组共有36个ASV,此外,空白组和干预组还有84个共有ASV,而模型组和其他2组分别有13个公有ASV(图8-b)。α多样性指数sobs表示微生物群落丰富度实际观测值,由图8-c可知,模型组sobs指数显著低于空白组和宽柄芥干预组(P<0.01),说明宽柄芥可以逆转DSS饮水导致的小鼠肠道菌群丰富度下降。β多样性结果显示空白组和模型组小鼠肠道微生物群落存在较大差异,与干预组差异较小,说明结肠炎小鼠肠道微生物菌群多样性减少,宽柄芥干预促进微生物群落向正常菌群改变(图8-d)。

a-稀释曲线;b-物种Venn图;c-sobs指数;d-ASV水平主坐标分析;e-门水平肠道菌群组成;f-属水平肠道菌群组成
图8 宽柄芥对小鼠肠道微生物的影响
Fig.8 Effects of leaf mustard on intestinal microbiota in DSS-induced mice
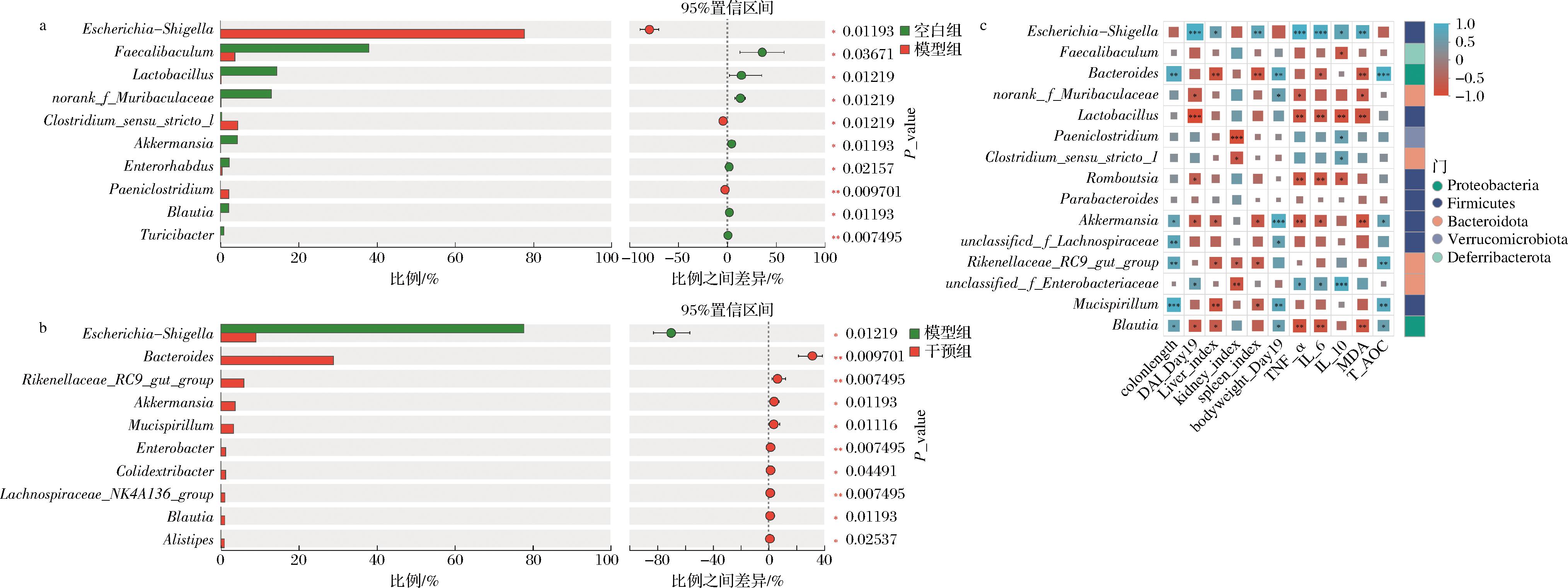
a-空白组和模型组属水平物种差异分析;b-模型组和宽柄芥组物种差异分析;c-结肠炎相关指标与肠道微生物spearman相关性分析
图9 小鼠肠道微生物物种差异及与结肠炎指标相关性分析
Fig.9 Characterization of distinct species and their correlation with colitis indexes
在门水平上,空白组小鼠肠道菌群主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)和放线菌门(Actinobacteria)组成(图8-e)。模型组主要以变形菌门(Proteobacteria)为主,Firmicutes、Bacteroidetes、Verrucomicrobiota和Actinobacteria等占比显著下降(P<0.01),这与其他报道中DSS对肠道菌群结构的影响相似,结肠炎发生时肠道菌群在门水平上以Firmicutes为主向Proteobacteria为主转变,Actinobacteria、Bacteroidetes、Verrucomicrobiota等现对丰度显著降低[25]。宽柄芥干预降低了Proteobacteria相对丰度,不同程度恢复Firmicutes和Verrucomicrobia占比,且Bacteroidetes和Deferribacterota相对丰度超过了空白组。
在属水平,与空白组相比,模型组有害菌志贺氏杆菌(Escherichia-Shigella)、梭状芽孢杆菌Clostridium_sensu_stricto_1(P<0.01)和拟孢菌(Paeniclostridium)(P<0.05)相对丰度显著上升,而Faccalibaculum,norank_f__Muribaculaceae(P<0.05)、Akkermansia、乳杆菌属(Lactobacillus)(P<0.01)占比显著下降(图8-f、图9-a),其中norank_f__Muribaculaceae可以抑制有害菌、减少肠道氧化应激;Akkermansia是一种重要的黏液降解肠道细菌,可以提高肠道黏液厚度;Lactobacillus可以产生乙酸盐和乳酸等短链脂肪酸,促进免疫细胞活化[10],提示DSS诱导结肠炎的发生发展与肠道菌群结构改变密切相关。宽柄芥干预组Escherichia-Shigella相对含量(P<0.01)显著下降,而有益菌Akkermansia恢复至与空白组相似的水平。此外,干预组的拟杆菌属(Bacteroides)、Rikenellaceae_RC9_gut_group、Mucispirillum(P<0.01)、norank_f__Muribaculaceae(P<0.05)相对丰度显著升高(图9-b)。以上表明宽柄芥干预可以促进肠道菌群有益菌增殖,抑制具有促炎作用的有害菌,维持肠道微生物多样性,改善肠道黏液厚度,降低肠道氧化应激,进而维持肠道屏障功能。
结肠炎相关指标与肠道菌群中相对丰度最高的15个属Spearman’s相关性分析显示,Escherichia-Shigella、unclassified_f_Enterobacteriaceae与炎症因子IL-6和TNF-α水平及DAI呈显著正相关。Lactobacillus、Akkermansia、Blautia等与炎症因子IL-6和TNF-α、MDA和DAI指数呈显著负相关,而Bacteroides、Akkermansia、Blautia、Mucispirillum与小鼠体重、结肠长度和T-AOC呈显著正相关,进一步说明在结肠炎小鼠模型中,肠道菌群结构与肠道氧化应激水平和炎症水平具有相关性,而宽柄芥干预通过恢复DSS饮水破坏的肠道菌群结构,从而改善了肠道氧化应激和炎症水平,保护了肠道屏障功能。
3 讨论
一项病例对照研究发现,蔬菜、维生素和视黄醇等的高水平摄入与UC发病率降低具有相关性,提示膳食策略是干预UC的潜在有效手段[3]。本研究通过给予2.5% DSS溶液诱导小鼠UC模型,在饲料中添加5%宽柄芥可以有效抑制DSS诱导的小鼠体重下降和结肠长度变短,并显著降低了DAI,表明宽柄芥在干预结肠炎方面具有良好的潜力。田艳[24]研究发现,新鲜叶芥乙醇提取物可以从小鼠体征、DAI和结肠组织病理学方面改善结肠炎症状,与本研究结果一致。富含萝卜硫苷和多糖的西兰花种子提取物,能有效逆转DSS模型小鼠体重下降、减轻结肠炎炎症,保护肠道屏障,其中硫苷和多糖被认为是缓解DSS诱导结肠炎症的重要成分[23]。此外,蔬菜膳食纤维同样有益肠道健康,单独使用芹菜膳食纤维可以缓解DSS诱导的结肠急性损伤,改善体重减轻[26]。因此,我们推测宽柄芥中含量丰富的膳食纤维和硫苷可能是其发挥抗氧化和抗炎的主要原因,在未来研究中有必要考察宽柄芥主要活性物质单独对结肠炎的作用,以期进一步探讨其机制。
宽柄芥干预后,小鼠肝组织MDA含量降至与空白组接近的水平,总抗氧化能力提高,说明抗氧化作用是宽柄芥缓解结肠炎症的机制之一。富含萝卜硫苷的西兰花芽提取物,可有效抑制幽门螺旋杆菌感染小鼠胃黏膜中脂质氧化反应[27]。此外,宽柄芥抑制了促炎因子水平上升,结肠组织HE染色和阿利新蓝染色显示模型组小鼠隐窝结构被破坏,杯状细胞数量减少,黏液层受损,而宽柄芥干预可以缓解溃疡性结肠炎小鼠结肠组织病理症状,改善杯状细胞减少,同时提高紧密连接蛋白claudin-1、occludin和ZO-1表达水平,说明宽柄芥摄入有利于维持肠道正常通透性,保护肠道屏障。小鼠粪便肠道菌群多样性分析结果进一步显示,宽柄芥可以使结肠炎模型小鼠肠道菌群多样性和群落组成与空白组接近,推测是宽柄芥中硫苷代谢产物及膳食纤维恢复了肠道微生物群落正常结构,促进了Akkermansia、Lactobacillus等有益菌的增殖,进而不仅降低了炎症水平,而且有利于维持肠道黏膜屏障功能,而宽柄芥抑制Escherichia-Shigella、unclassified_f_Enterobacteriaceae等有害菌的生长,起到相同作用。当然,上述肠道微生物在宽柄芥干预结肠炎过程的作用尚需进一步验证,宽柄芥发酵后对结肠炎作用效果是否能提高也值得研究。
4 结论
营养物质和活性成分分析显示,宽柄芥中硫苷和膳食纤维含量较高,且有机酸以乙酸和琥珀酸为主。通过饲料给予DSS诱导结肠炎小鼠宽柄芥粉可以缓解结肠炎小鼠症状,改善结肠形态损伤,增强结肠炎小鼠抗炎与抗氧化水平。宽柄芥干预减轻了结肠病理损伤,保护黏液层完整性,降低炎症水平,并提高紧密连接蛋白表达,增强肠道屏障功能,并且与调节结肠炎小鼠肠道微生物菌群结构的作用密切相关。这些结果表明,宽柄芥具有缓解结肠炎的潜力,为膳食补充宽柄芥干预结肠炎提供了理论依据。
[1] NG S C, SHI H Y, HAMIDI N, et al.Worldwide incidence and prevalence of inflammatory bowel disease in the 21 st century:A systematic review of population-based studies[J].The Lancet, 2018, 390(10114):2769-2778.
[2] ANIWAN S, SANTIAGO P, LOFTUS E V Jr, et al.The epidemiology of inflammatory bowel disease in Asia and Asian immigrants to Western countries[J].United European Gastroenterology Journal, 2022, 10(10):1063-1076.
[3] MIYAKE Y, TANAKA K, NAGATA C, et al.Dietary intake of vegetables, fruit, and antioxidants and risk of ulcerative colitis:A case-control study in Japan[J].Nutrition, 2021, 91-92:111378.
[4] KOTIPALLI R S S, TIRUNAVALLI S K, POTE A B, et al.Sinigrin attenuates the dextran sulfate sodium-induced colitis in mice by modulating the MAPK pathway[J].Inflammation, 2023, 46(3):787-807.
[5] ZHAO J C, ZHANG X Q, LI F H, et al.The effects of interventions with glucosinolates and their metabolites in cruciferous vegetables on inflammatory bowel disease:A review[J].Foods, 2024, 13(21):3507.
[6] 詹梦涛, 娄水珠, 刘仙花, 等.3,5-二硝基水杨酸法测定液体糖中总糖含量[J].云南民族大学学报(自然科学版), 2020, 29(4):317-321.ZHAN M T, LOU S Z, LIU X H, et al.Determination of the total sugar content in liquid sugar by 3,5-dinitrosalicylic acid method[J].Journal of Yunnan Minzu University (Natural Sciences Edition), 2020, 29(4):317-321.
[7] ASP N G, JOHANSSON C G, HALLMER H, et al.Rapid enzymatic assay of insoluble and soluble dietary fiber[J].Journal of Agricultural and Food Chemistry, 1983, 31(3):476-482.
[8] 贺霞, 张子轩, 张宇光, 等.青花菜总硫代葡萄糖苷提取工艺的优化[J].中国瓜菜, 2021, 34(4):62-67.HE X, ZHANG Z X, ZHANG Y G, et al.Optimization of extraction process of total glucosinolates from broccoli[J].China Cucurbits and Vegetables, 2021, 34(4):62-67.
[9] 欧敏, 潘宇, 陈路, 等.HPLC法测定广西不同产地八角茴香中4种有机酸的含量[J].广西中医药大学学报, 2024, 27(1):53-57.OU M, PAN Y, CHEN L, et al.Determination of four organic acids in star anise from different producing areas in Guangxi by HPLC[J].Journal of Guangxi University of Chinese Medicine, 2024, 27(1):53-57.
[10] HE C X, GAO M F, ZHANG X H, et al.The protective effect of sulforaphane on dextran sulfate sodium-induced colitis depends on gut microbial and Nrf2-related mechanism[J].Frontiers in Nutrition, 2022, 9:893344.
[11] ZOU W R, FU Z X, GUO X H, et al.Whey protein hydrolysate exerts anti-inflammatory effects to alleviate dextran sodium sulfate (DSS)-induced colitis via microbiome restoration[J].Nutrients, 2023, 15(20):4393.
[12] CHEN X, MA L, LIU X L, et al.Clostridium butyricum alleviates dextran sulfate sodium-induced experimental colitis and promotes intestinal lymphatic vessel regeneration in mice[J].Annals of Translational Medicine, 2022, 10(6):341.
[13] ZHAO J C, TAN Z W, ZHANG R Y, et al.Effects of brine- and NaCl- fermented carrots on lipid metabolism and gut microbiota in high-fat diet-fed mice[J].Journal of Functional Foods, 2023, 105:105564.
[14] 郭霄飞, 李艳婷, 倪育龙, 等.真空冷冻干燥技术加工黄花菜功能营养成分的分析[J].天津农业科学, 2022, 28(11):66-71.GUO X F, LI Y T, NI Y L, et al.Functional nutrients components analysis of daylily flower by vacuum freeze-dried technology processed[J].Tianjin Agricultural Sciences, 2022, 28(11):66-71.
[15] FAVELA-GONZ LEZ K M, HERN
LEZ K M, HERN NDEZ-ALMANZA A Y, DE LA FUENTE-SALCIDO N M.The value of bioactive compounds of cruciferous vegetables (Brassica) as antimicrobials and antioxidants:A review[J].Journal of Food Biochemistry, 2020, 44(10):e13414.
NDEZ-ALMANZA A Y, DE LA FUENTE-SALCIDO N M.The value of bioactive compounds of cruciferous vegetables (Brassica) as antimicrobials and antioxidants:A review[J].Journal of Food Biochemistry, 2020, 44(10):e13414.
[16] 黄惠萍. 叶用芥菜资源硫苷含量变化特征分析[D].长沙:湖南农业大学, 2022: 12.HUANG H P.Variation characteristics of glucosinolate contents in leaf mustard[D].Changsha:Hunan Agricultural University, 2022: 12.
[17] KATSANDEGWAZA B, HORSNELL W, SMITH K.Inflammatory bowel disease:A review of pre-clinical murine models of human disease[J].International Journal of Molecular Sciences, 2022, 23(16):9344.
[18] LEI L, ZHANG J N, DECKER E A, et al.Roles of lipid peroxidation-derived electrophiles in pathogenesis of colonic inflammation and colon cancer[J].Frontiers in Cell and Developmental Biology, 2021, 9:665591.
[19] TIAN Q Y, XU Z X, SUN Q, et al.Broccoli-derived glucoraphanin activates AMPK/PGC1α/NRF2 pathway and ameliorates dextran-sulphate-sodium-induced colitis in mice[J].Antioxidants, 2022, 11(12):2404.
[20] WANG X, LI D Y, MENG Z Y, et al.Latilactobacillus curvatus BYB3 isolated from kimchi alleviates dextran sulfate sodium (DSS)-induced colitis in mice by inhibiting IL-6 and TNF-R1 production[J].Journal of Microbiology and Biotechnology, 2022, 32(3):348-354.
[21] EICHELE D D, KHARBANDA K K.Dextran sodium sulfate colitis murine model:An indispensable tool for advancing our understanding of inflammatory bowel diseases pathogenesis[J].World Journal of Gastroenterology, 2017, 23(33):6016-6029.
[22] SO B R, KIM S, JANG S H, et al.Dietary protocatechuic acid redistributes tight junction proteins by targeting Rho-associated protein kinase to improve intestinal barrier function[J].Food &Function, 2023, 14(10):4777-4791.
[23] WU J Y, GUO W L, CUI S M, et al.Broccoli seed extract rich in polysaccharides and glucoraphanin ameliorates DSS-induced colitis via intestinal barrier protection and gut microbiota modulation in mice[J].Journal of the Science of Food and Agriculture, 2023, 103(4):1749-1760.
[24] 田艳. 华容大叶芥菜主要化学成分及其乙醇提取物抗结肠炎机理研究[D].长沙:湖南农业大学, 2020: 120.TIAN Y.Study on the main chemical components of Huarong large-leaf mustard and the anti-colitis mechanism of its ethanol extract[D].Changsha:Hunan Agricultural University, 2020: 120.
[25] YAN S, YANG B, ZHAO J C, et al.A ropy exopolysaccharide producing strain Bifidobacterium longum subsp.longum YS108R alleviates DSS-induced colitis by maintenance of the mucosal barrier and gut microbiota modulation[J].Food &Function, 2019, 10(3):1595-1608.
[26] WANG H, HUANG X J, XIA S K, et al.Celery soluble dietary fiber antagonizes flavonoids ameliorative effect on dextran-sodium-sulfate-induced colitis in mice[J].Journal of Advanced Research, 2023, 52:73-88.
[27] CHANG Y W, JANG J Y, KIM Y H, et al.The effects of broccoli sprout extract containing sulforaphane on lipid peroxidation and Helicobacter pylori infection in the gastric mucosa[J].Gut and Liver, 2015, 9(4):486-493.