大黄鱼(Larimichthys crocea),又名黄金龙、黄瓜鱼、黄花鱼,是我国海水养殖产量位居前列的重要海洋经济鱼类,2023年养殖产量达28万t[1]。大黄鱼因体色金黄、肉质鲜嫩、营养元素丰富而成为人们餐桌上的一道重要美食;大黄鱼通常以冰鲜鱼形式向海内外市场销售,近些年随着预制菜热潮的兴起以及人类生活节奏的不断加快,一些以黄鱼鲞、黄鱼柳、黄鱼羹等产品形式的预制菜开始进入市场,受到消费者的普遍青睐[2]。随着大黄鱼加工产量的不断提高,大量加工副产物随之产生,如含有硫酸软骨素(chondroitin sulfate, CS)的鱼骨等[3]。
CS是一类分子结构上发生了硫酸化的糖胺聚糖,通常由N-乙酰-D-半乳糖胺(N-acetyl-D-galactosamine, GalNAc)和D-葡萄糖醛酸(D-glucuronic acid, GlcUA)组成的双糖单位通过β-1,4糖苷键交替连接而成,而双糖单位的单糖则通过β-1,3糖苷键相连[4-5];根据分子结构上发生硫酸化的C位不同,CS又可分为CS-A、CS-B、CS-C、CS-D、CS-E、CS-K、CS-L和CS-M[6]。不同C位硫酸化修饰的CS广泛分布于多种动物的骨骼、软组织及软骨组织中,其分子结构的特异性差异导致其生物活性有所不同。包括调节脂质代谢、抗动脉粥样硬化、抗氧化应激、抗关节炎和抗肿瘤方面等活性功能[7-8]。
当前,我国商业化产品CS的提取来源主要包括猪牛鸡等陆源性动物以及鲨鱼等水源性动物的软骨组织,目前陆源性动物受到传染性疾病的威胁,其相应提取产物CS亦受到安全性质疑,而鲨鱼来源的CS由于各国政府近年来对种群的严格保护,正面临着来源明显不足的缺口[9]。由此,挖掘新的CS提取来源以及评估其相应的活性功能效果对该行业具有重要意义。我国大黄鱼养殖产量丰富,随着预制菜的不断深入发展,大量加工副产物鱼骨有望成为CS提取的新来源。
本研究以大黄鱼骨为原料制备CS,并表征其理化性质和结构特征,而后利用高脂血症斑马鱼模型评估其降血脂活性,以期为CS的提取来源提供新途径,同时为大黄鱼硫酸软骨素(large yellow croaker chondroitin sulfate, LCS)在降血脂方面的应用提供更多理论基础。
1 材料与方法
1.1 材料与试剂
大黄鱼骨粉由实验室自制;野生AB品系斑马鱼幼鱼购自国家水生生物种质资源库国家斑马鱼资源中心。碱性蛋白酶、苏木素、伊红,北京索莱宝科技有限公司;CS标品(纯度97%)、D-葡糖醛酸、NaClO,上海麦克林生化科技股份有限公司;牛血清白蛋白,碧云天生物技术有限公司;高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)、甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)含量测定试剂盒,南京建成生物工程研究所;3-氨基苯甲酸乙酯甲磺酸盐、氯仿、重水(D2O,99.9%),西格玛奥德里奇(上海)贸易有限公司;蛋黄粉,上海源叶生物科技有限公司;阿托伐他汀,MedChemexpress生物科技公司;DNA marker、逆转录试剂盒,苏州近岸蛋白质科技股份有限公司;其他普通试剂均为国产分析纯。
1.2 仪器与设备
UV-1780紫外-可见分光光度计,岛津仪器(苏州)有限公司;Nicolet iN 10 MX傅里叶变换显微红外光谱仪,赛默飞世尔科技公司;PL-GPC50凝胶渗透色谱仪,安捷伦科技(中国)有限公司;Avance NEO 600核磁共振波谱仪,布鲁克(北京)科技有限公司;SMZ800N体式荧光显微镜,尼康映像仪器销售(中国)有限公司;CMAX plus酶标仪,美谷分子仪器(上海)有限公司;KZ-Ⅲ研磨机,武汉赛维尔生物科技有限公司;JIDI-17RS微量高速冷冻离心机,广州吉迪仪器有限公司;X4实时荧光定量qPCR仪,鲲鹏基因(北京)科学仪器有限公司;KH-TS脱水机、KH-BL包埋机、KH-P2摊烤片机,湖北孝感阔海医疗科技有限公司;BX41正置光学显微镜,奥林巴斯(中国)有限公司;E31S PM成像系统,杭州图谱光电科技有限公司。
1.3 实验方法
1.3.1 LCS的制备
参考YANG等[10]的CS提取方法,将大黄鱼骨粉与质量分数为1%的NaOH溶液按照料液比1∶10(g∶mL)混合后,50 ℃下水浴搅拌4 h,离心(10 000 r/min,20 min)过滤取上清液,将溶液pH调至10.5,加入7%鱼骨粉质量的碱性蛋白酶(酶活力:200 000 U/g),45 ℃下酶解4.5 h后,100 ℃下灭酶活力10 min,冷却后离心(8 000 r/min,20 min)取上清液,并在上清液中加入4倍体积的无水乙醇静置18 h,最后取沉淀溶解于去离子水中测定CS提取率,剩余溶液采用截留分子质量为10 000 Da的透析袋进行透析处理,经冻干得到LCS。
1.3.2 LCS理化性质的测定
样品CS提取率与含量采用硫酸咔唑法测定[11],以CS标品为参照;蛋白含量采用考马斯亮蓝法测定[12],以牛血清白蛋白为标品;葡糖醛酸含量采用硫酸咔唑法测定[13],以D-葡糖醛酸为标品。
1.3.3 LCS的紫外光谱扫描
各取10 mg LCS、CS标品,去离子水溶解配制成质量浓度为1 mg/mL溶液,采用紫外-可见分光光度计在波长为190~400 nm内进行光谱扫描,以波长为横坐标、吸光度为纵坐标绘制紫外光谱图。
1.3.4 LCS的红外光谱扫描
取LCS、CS标品干燥至恒重,按照样品∶KBr=1∶100(质量比),将样品与KBr混合研磨成粉,而后压制成透明薄片,并于傅里叶变换红外光谱仪下进行扫描分析,扫描波数为4 000~400 cm-1。
1.3.5 LCS的分子质量分布测定
采用高效凝胶渗透色谱法测定,以CS标品为对照。色谱条件:色谱柱Agilent PL-GPC 50系列设备,包含PL aquagel-OH-mixed色谱柱(8 μm, 7.5 mm×300 mm)和折光指数检测设备。流动相为0.2 mol/L Na2SO4溶液(pH为5.0),流速为1 mL/min。配制质量浓度为0.1 mg/mL的样品溶液,按照每次注射体积为100 μL上机测定样品保留时间,最后采用GPC处理软件Breeze进行分子质量计算和绘制分子质量分布曲线。
1.3.6 LCS的核磁共振氢谱测定
取LCS和CS标品各15 mg,溶于0.6 mL D2O后冻干,重复3次,最终溶于0.6 mL D2O中,完全溶解后转移至5 mm核磁共振管中,于25 ℃下采用Bruker Avance NEO 600仪器进行核磁共振氢谱(1H nuclear magnetic resonance spectroscopy,1H-NMR)测定,频率600 MHz,扫描次数16次。
1.3.7 LCS的降血脂活性探究
1.3.7.1 实验试剂配制
Danieau’s缓冲液:NaCl(20.34 g),KCl(0.313 g),Ca(NO3)2·4H2O(0.85 g),MgSO4·7H2O(0.592 g),4-羟乙基哌嗪乙磺酸(7.12 g),称取上述药品至容量瓶中,定容至200 mL,调节pH至7.2后移至-80 ℃下保存,使用前稀释100倍,用于斑马鱼胚胎和幼鱼孵育。
10 mg/mL的LCS溶液配制:称取20 mg LCS溶于2 mL超纯水中,得到10 mg/mL的储备液,使用时再稀释成所需浓度。
0.01 g/mL蛋黄粉溶液:将20 g蛋黄粉溶于100 mL去离子水,得到0.2 g/mL的蛋黄粉溶液,使用时稀释至终质量浓度为0.01 g/mL。
1.3.7.2 LCS安全浓度摸索
1)选取斑马鱼进行配鱼,完成后随机挑选健康、无畸形、正常发育的胚胎,转移至Danieau’s缓冲液中,并在28.5 ℃培养箱中放置到所需发育阶段;
2)收取已发育胚胎,用质量分数为0.003%的NaClO溶液消毒后,挑选发育时期为4 hpf(受精后小时数)的胚胎,放入6孔板中,每孔数量20颗,并将胚胎浸泡在LCS溶液中;
3)共设置6组,包括空白对照组和5个质量浓度梯度LSC处理组(250、300、400、550、600 μg/mL),每组3个平行孔;
4)将6孔板置于28.5 ℃培养箱中暴露96 h,观察胚胎死亡情况,统计死亡个数;
5)测试结束时,空白对照组斑马鱼胚胎存活率≥90%,测试结果方为有效,并计算LCS半数致死浓度(LC50)。
1.3.7.3 高脂血症斑马鱼模型建立与LCS处理
模型建立过程中,采用不同质量浓度LCS同时处理斑马鱼幼鱼,具体操作方法:9∶00将5 dpf(受精后天数)的斑马鱼置于0.01 g/mL蛋黄粉培养基中,同时给予LCS,17∶00用0.01 g/mL蛋黄粉培养基洗脱幼鱼后,转移至含LCS的普通胚胎培养基,孵育过夜。在斑马鱼处于6 dpf时,重复与5 dpf相同的处理方式,此操作共重复4次;共设置6组实验组,包含空白对照组(CK)、高脂模型组(M)、低浓度LCS处理组(LCS-L)、中浓度LCS处理组(LCS-M)、高浓度LCS处理组(LCS-H)和阳性对照组(AT),每组斑马鱼数量为90尾。对照组中将0.01 g/mL蛋黄粉培养基更换为普通胚胎培养基,且不含LCS;M组培养基含有蛋黄粉但不含LCS;LCS-L、LCS-M、LCS-H组培养基含蛋黄粉,且低、中、高浓度分别设置为LC50的1/10、1/5、1/2;AT组培养基含蛋黄粉及质量浓度为11.6 μg/mL的阿托伐他汀,该质量浓度设定参照团体标准T/CNHFA 131—2023《斑马鱼模型用于保健食品辅助降血脂功能的筛查方法》。
1.3.7.4 体重和体长测定
随机选取各实验组斑马鱼,用PBS冲洗3遍,随后用0.16 mg/mL三卡因溶液麻醉处理,擦干斑马鱼表面水渍,而后以10尾为一单位进行称重并记录,每个实验组共测定3次体重(mg)。将麻醉后幼鱼放置在体式荧光显微镜下,测量并记录斑马鱼体长,即幼鱼吻端到尾鳍基部的距离(μm)。
1.3.7.5 油红O染色与苏木精-伊红染色
斑马鱼经LCS处理结束后禁食24 h,每组随机选取10尾,经0.16 mg/mL三卡因溶液麻醉处理后PBS冲洗3遍,而后置于0.04 g/mL多聚甲醛溶液中4 ℃下固定过夜。
油红O染色:从固定液中取出斑马鱼,用PBS冲洗2遍,后在体积分数为60%的异丙醇中孵育30 min,除去异丙醇,加入3 mg/mL油红O溶液,避光孵育3 h,去除油红O并用体积分数为60%异丙醇洗涤斑马鱼3 min,用PBS洗涤3次后,在显微镜下观察并拍照斑马鱼脂质积累情况。
苏木精-伊红(hematoxylin-eosin, HE)染色:从固定液中取出斑马鱼,并用体积分数分别为70%、95%和100%乙醇进行逐级脱水,而后进行石蜡包埋和切片(厚度4~5 μm),用HE染色后在显微镜下观察并拍照斑马鱼肝脏组织脂质积累情况。
1.3.7.6 斑马鱼生化指标测定
收集各实验组斑马鱼幼鱼进行组织匀浆(每组10尾为一平行),参照试剂盒中说明书测定斑马鱼中HDL-C、LDL-C、TG、TC含量。
1.3.7.7 脂质代谢相关基因表达量测定
参考Total RNA Kit试剂盒使用说明书提取斑马鱼样本总RNA,随后测定样本RNA浓度,并进行反转录合成cDNA,最后以β-actin为内参基因,采用实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction, qRT-PCR)技术检测斑马鱼样本中与脂质代谢相关基因(Srebf1、Acaca、Fasn、Pparg、Rora、Hmgcrb、Ldlr、Cyp7a1a)的mRNA相对表达水平,引物信息如表1所示。反应体系:上游引物0.5 μL,下游引物0.5 μL,2 × SYBR qPCR Mix 10 μL,cDNA模板1 μL,无菌水8 μL。反应条件:第一阶段95 ℃ 10 min;第二阶段95 ℃ 15 s,60 ℃ 30 s,40个循环;第三阶段95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s;热循环条件为,50 ℃ 15 s,72 ℃ 10 s,共45个循环。根据下机后样本中基因的CT值,采用公式F=2-ΔΔCT计算相应基因的相对表达量。
表1 引物序列和信息
Table 1 Primer sequence and information

引物名称正向引物序列(5′-3′)反向引物序列(5′-3′)β-actinGTATTGCTGACCGTATGCCTGCCTCATCGTATTCCTSrebf1ACTCTGAAACCGGACGTGACTACGGTTGATGGGCAGCTTTAcacaGATGGTGGCTGACGTTAACCAATCTCCCCATGGCTGCATFasnCCATTCTGGCTGCTTACTGGGAGCTTTGCACTCTTCCCACPpargGGCGCTTCAGTGTTCAGAAACAGCTCCTCCAGTTCCAGAGRoraCCAACAAGGGGTTTCTTCAGGATTAGACATGCGCCCGAACTTHmgcrbAATGGCAATACTGGGACCCAACAGCACATGATCTCCAGCTLdlrTGGCTATTTTTACCCTCAGAGACATGCTGAAGAACTGACCTCCGCyp7a1aGATCTTCCCAGCTCTGATCGGCAGAGTGTTGGCTTGTGAA
1.4 数据处理
采用SPSS 25对数据进行处理及显著性分析,实验结果以“平均值±标准差”表示,组间差异采用单因素方差分析进行比较,P<0.05表示差异显著,P<0.01表示差异极显著。采用Origin 2018绘制数据图,使用图像分析软件Image J对斑马鱼照片进行分析,并对油红O染色下的斑马鱼进行相对脂质含量的定量分析。
2 结果与分析
2.1 LCS理化性质分析
如表2所示,CS提取率<1%,左格格[14]以罗非鱼不同部位鱼骨(头、脊、鳍、尾)为原料提取CS,其提取率最高部位为鱼头(1.35%),最低部位为鱼脊(0.38%),与本研究结果相似。此外,本研究中样品CS含量可达到90%,葡糖醛酸含量接近CS含量的1/2,符合CS中二糖单位的单糖组成比例,且蛋白含量较低,说明样品纯化过程中透析效果良好。
表2 LCS理化指标测定结果 单位:%
Table 2 Determination results of physical and chemical indexes of LCS
指标CS提取率CS含量葡糖醛酸含量蛋白含量结果0.46±0.0192.59±1.6335.64±0.701.27±0.55
2.2 LCS的紫外光谱分析
如图1所示,以CS标品为对照,图中LCS与CS标品的紫外吸收光谱曲线趋势大体相似,在200~240 nm间均有糖类特征吸收峰,且峰型较为尖锐,无其他杂峰出现,相较于CS标品,LCS有轻微红移现象,据此可认为本研究制备的样品主要成分为CS;此外,LCS在波长240~280 nm间有明显的小吸收峰,说明样品中可能还含有极少量的核酸和小分子蛋白肽;叶琳弘[15]提取鱿鱼软骨CS用于降血脂研究,过程中鱿鱼软骨CS紫外光谱扫描结果同样显示在240~280 nm间出现小吸收峰。
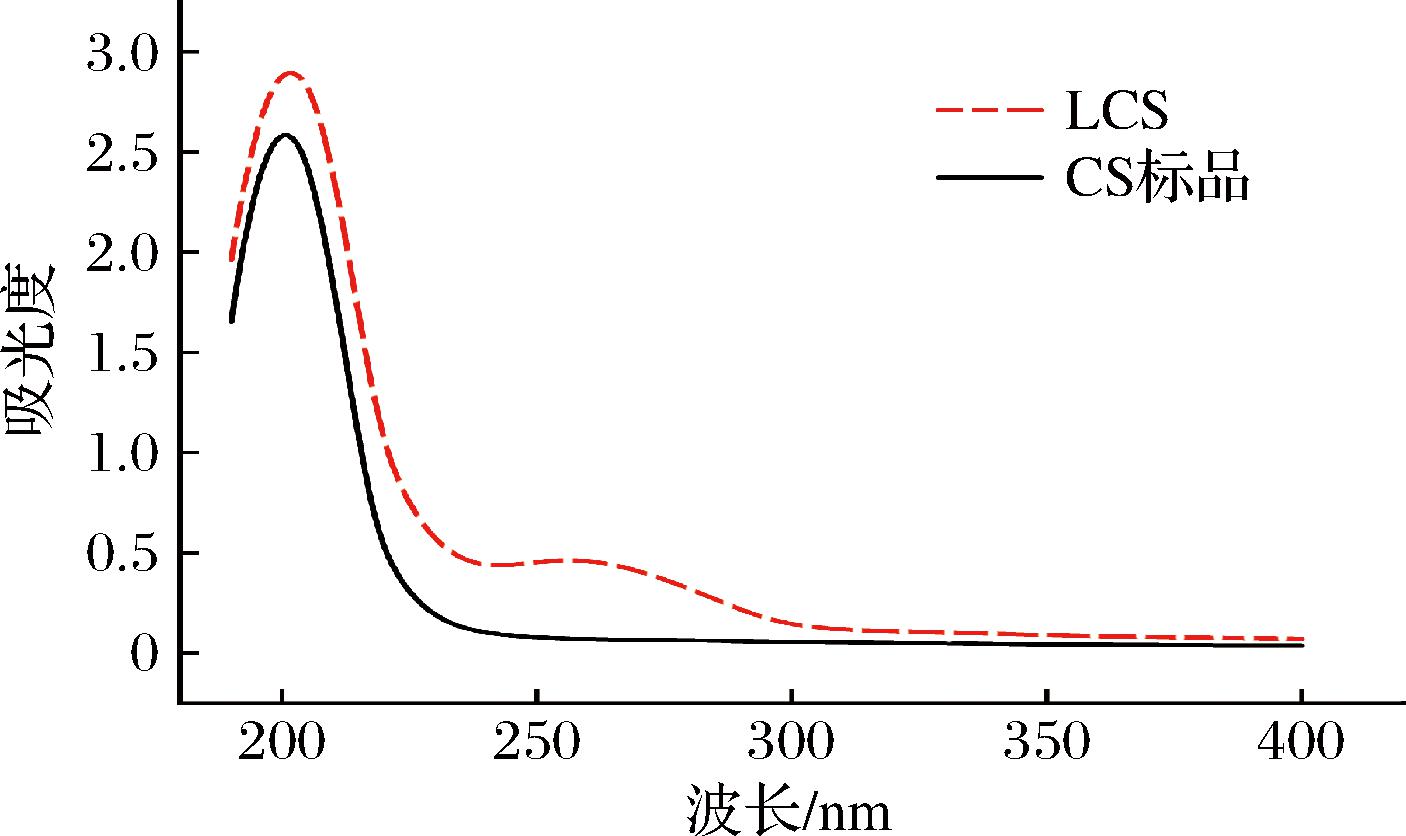
图1 LCS紫外吸收光谱图
Fig.1 Ultraviolet absorption spectrum of LCS
2.3 LCS的红外光谱分析
如图2所示,LCS特征吸收峰位置与CS标品相近,且光谱图总体趋势大体相似,说明本研究制备的LCS符合CS官能团组成的结构特征。
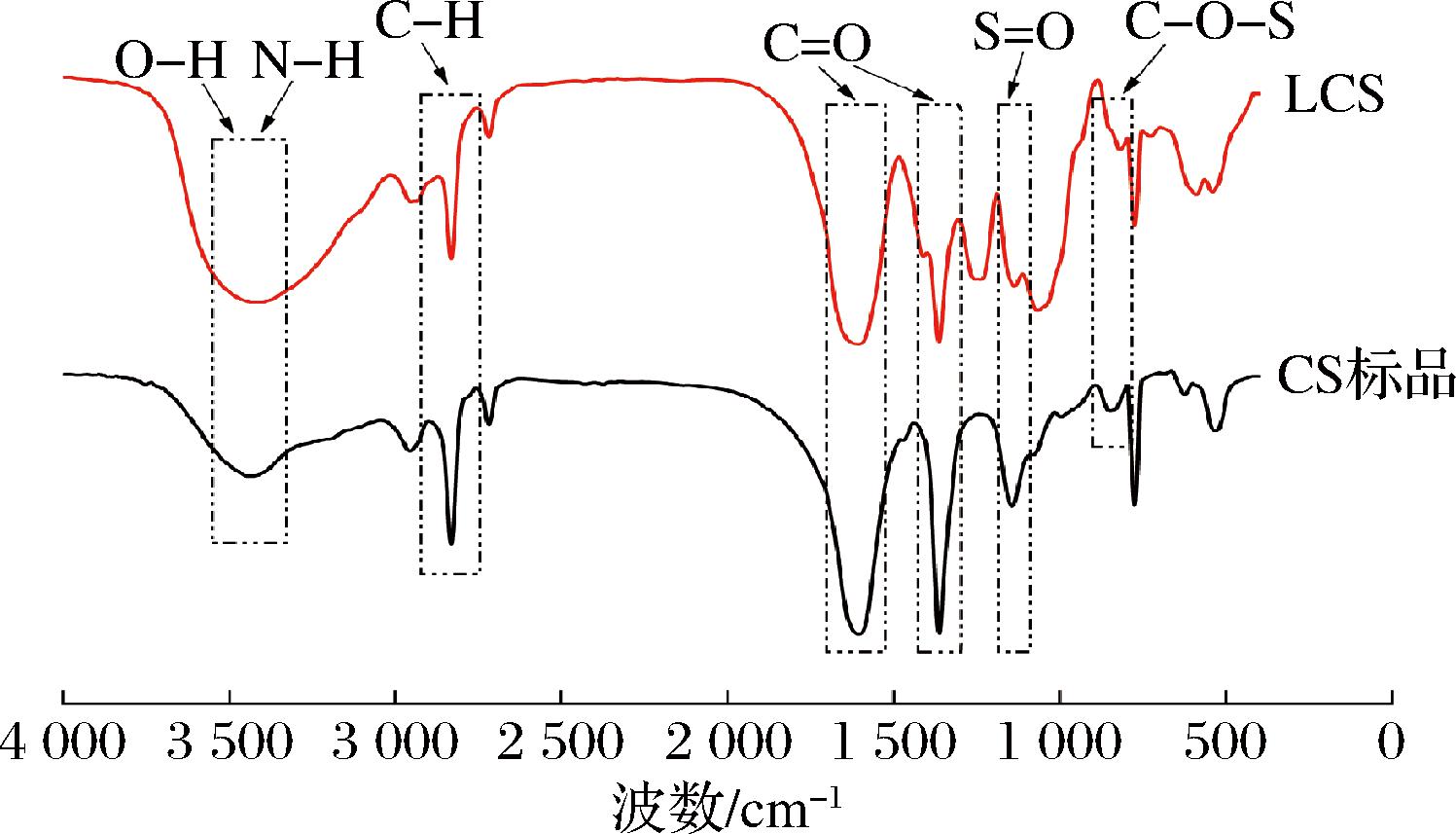
图2 LCS红外吸收光谱图
Fig.2 Infrared absorption spectrum of LCS
差异之处在于特征吸收峰的位点与强度有所不同,吸收峰具体位点如表3所示,在3 400 cm-1附近,LCS吸收峰强度明显大于CS标品,说明LCS含有较多O—H和N—H基团,而两者C—H和C![]() O基团的吸收强度则在2 950、1 600、1 360 cm-1上大体相近,但在S
O基团的吸收强度则在2 950、1 600、1 360 cm-1上大体相近,但在S![]() O和C—O—S的吸收强度上LCS明显小于CS标品,说明LCS的硫酸化程度低于CS标品,且两者的C—O—S吸收波数相差较远,说明LCS硫酸化的碳位点与CS标品存在差异。总体上,LCS吸收峰出现位置与强度均符合文献报道的CS官能团伸缩振动特征[16],表明本研究提取方法能够较为完整保持其CS天然结构。
O和C—O—S的吸收强度上LCS明显小于CS标品,说明LCS的硫酸化程度低于CS标品,且两者的C—O—S吸收波数相差较远,说明LCS硫酸化的碳位点与CS标品存在差异。总体上,LCS吸收峰出现位置与强度均符合文献报道的CS官能团伸缩振动特征[16],表明本研究提取方法能够较为完整保持其CS天然结构。
表3 LCS官能团组成分析
Table 3 Analysis of functional group of LCS
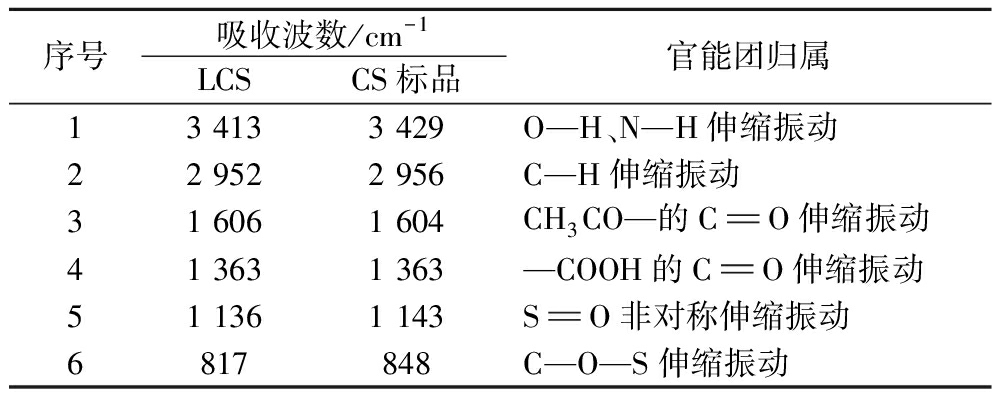
序号吸收波数/cm-1LCSCS标品官能团归属13 4133 429O—H、N—H伸缩振动22 9522 956C—H伸缩振动31 6061 604CH3CO—的CO伸缩振动41 3631 363—COOH的CO伸缩振动51 1361 143SO非对称伸缩振动6817848C—O—S伸缩振动
2.4 LCS的分子质量分布测定结果分析
如表4所示,尽管LCS的数均分子质量(Mn)、重均分子质量(Mw)、峰值分子质量(Mp)均小于CS标品,但都大于10 000 Da,说明LCS是作为一类大分子物质存在的糖类化合物。前期有学者报道了常见动物(如鲨鱼和鸡牛猪软骨)的Mw在14~70 kDa[7],此差异主要来源于提取工艺和原料的不同,LCS的Mw则分布在此范围的中游位置。多分散系数(Mw/Mn)常用于表征物质的分子质量分布广度,而LCS多分散系数则低于CS标品,结合2个样品的分子质量分布曲线(图3),可见LCS分子质量分布较窄且大小较为均一,而CS标品分子质量分布较宽且大小较不均一,说明大黄鱼骨在稀碱酶解提取法下能够得到分子质量较为均一的CS。
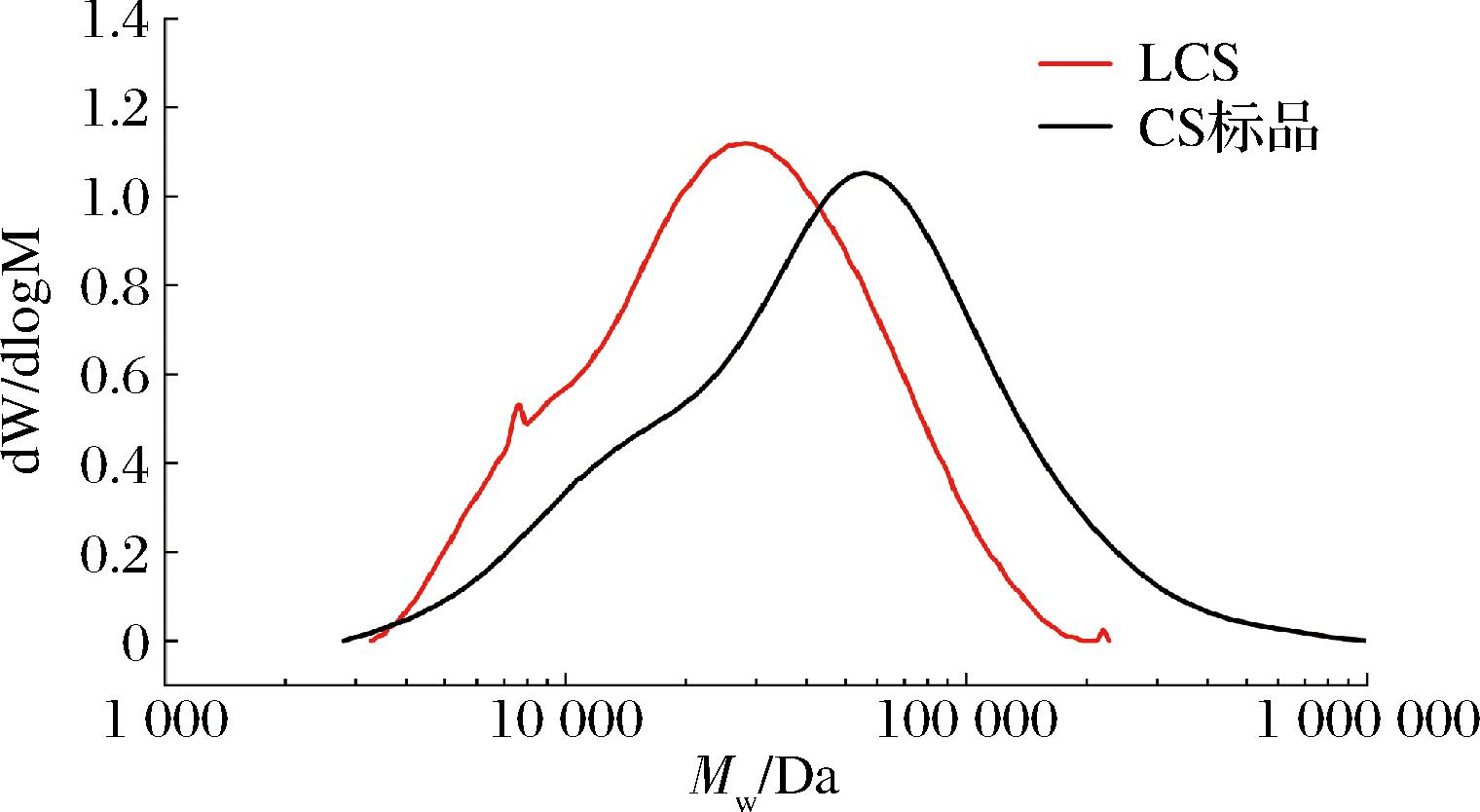
图3 LCS分子质量分布曲线图
Fig.3 Molecular weight distribution curve of LCS
注:dW/dlogM中W表示质量,M表示数均分子质量,微分形式dW/dlogM表示某一数均分子质量的高分子的物质的量。
表4 LCS分子质量测定结果
Table 4 Determination of molecular weight of LCS
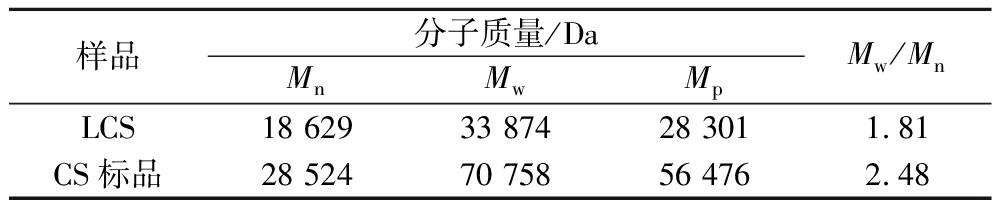
样品分子质量/DaMnMwMpMw/MnLCS18 62933 87428 3011.81CS标品28 52470 75856 4762.48
2.5 LCS的核磁共振氢谱测定结果分析
如图4所示,以CS标品为参照,LCS的所有H质子信号均出现在1.5~5.3 ppm化学位移范围内,符合CS的氢谱信号分布,说明LCS纯度较高。2个样品在1.9~2.1 ppm内均出现了2个近乎重叠的特征峰,文献表明此范围内出现的特征峰为GalNAc中与C-2相连的乙酰氨基甲基(GalNAc-CH3)的H质子信号,2个特征峰说明样品中单糖GalNAc存在2种及以上硫酸化取代方式[17-18]。总体上,LCS的氢谱图特征峰分布与CS标品相似,尤其是GalNAc-4SO4-H4和GalNAc-6SO4-H6的信号分布。LCS的GalNAc-4SO4-H4和GalNAc-6SO4-H6的信号特征峰均分别出现在4.72 ppm和4.19 ppm化学位移处,其中LCS的GalNAc-6SO4-H6信号强度与GalNAc-4SO4-H4相近,表明LCS在GalNAc的C-6和C-4上发生硫酸化的程度相当。
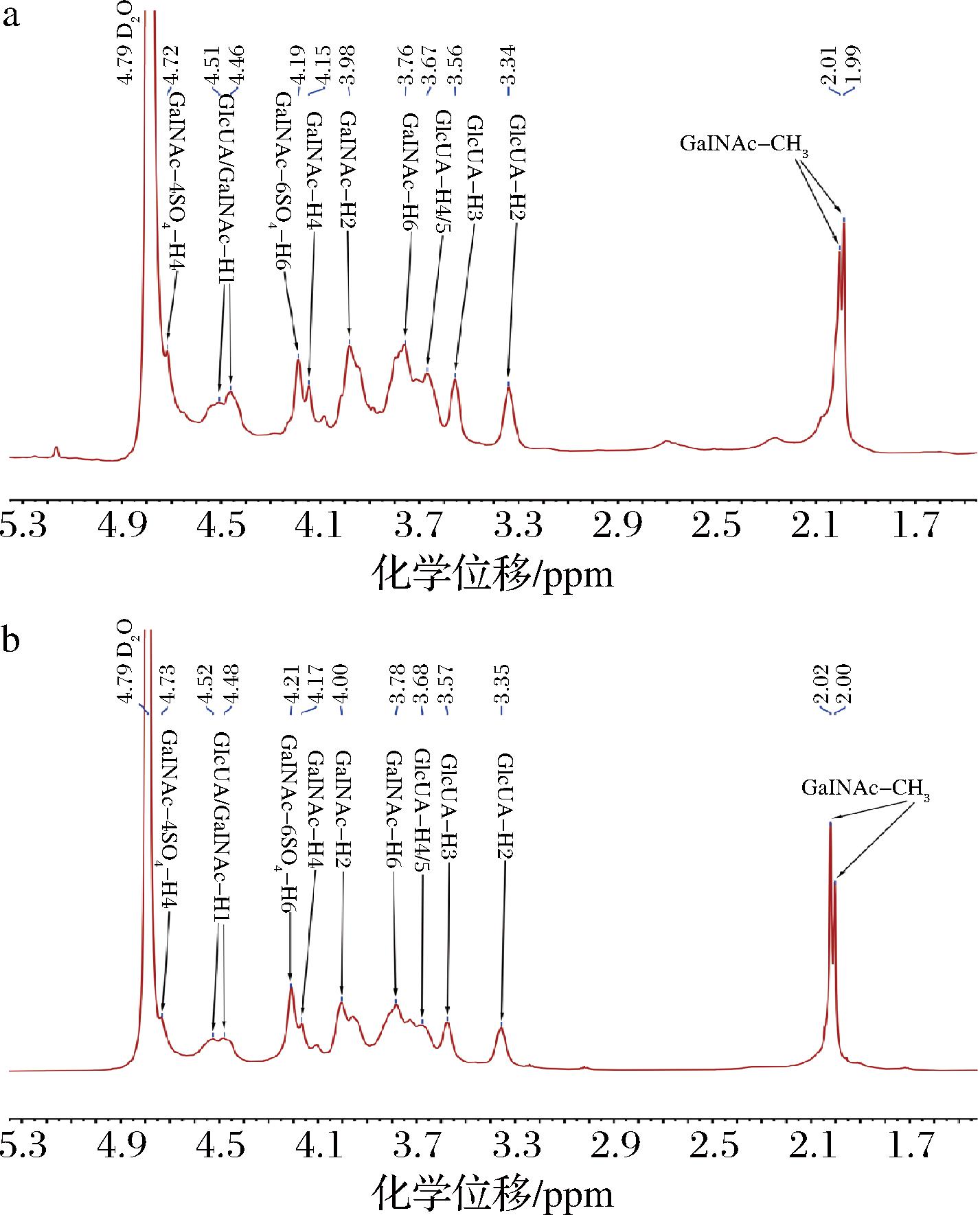
a-LCS;b-CS标品
图4 LCS核磁共振氢谱图
Fig.4 1H-NMR spectroscopy of LCS
2.6 LCS的安全浓度摸索结果分析
本研究中LCS的斑马鱼胚胎半数致死浓度(LC50)计算采用概率单位法,该方法是LC50的经典统计学方法,核心是将剂量与反应关系转换为线性模型,通过概率分布拟合求解致死浓度。如表5所示,每个质量浓度下胚胎个数均为20,随后对各LCS质量浓度取以10为底的对数值,根据胚胎死亡率计算概率单位值,当死亡率为50%时,概率单位值为5,各LCS质量浓度对数值与对应概率单位值经过线性拟合后得到回归方程,最后将方程代入概率单位值5,计算得到LCS的LC50,本研究重复进行3次LCS安全浓度摸索实验,3组数据的LC50平均值为429.17 μg/mL,最后取LC50=430 μg/mL。根据LC50的1/10、1/5、1/2确定LCS处理组中低、中、高质量浓度分为40、80、200 μg/mL。
表5 LCS LC50摸索实验结果
Table 5 Results of LC50 exploration of LCS
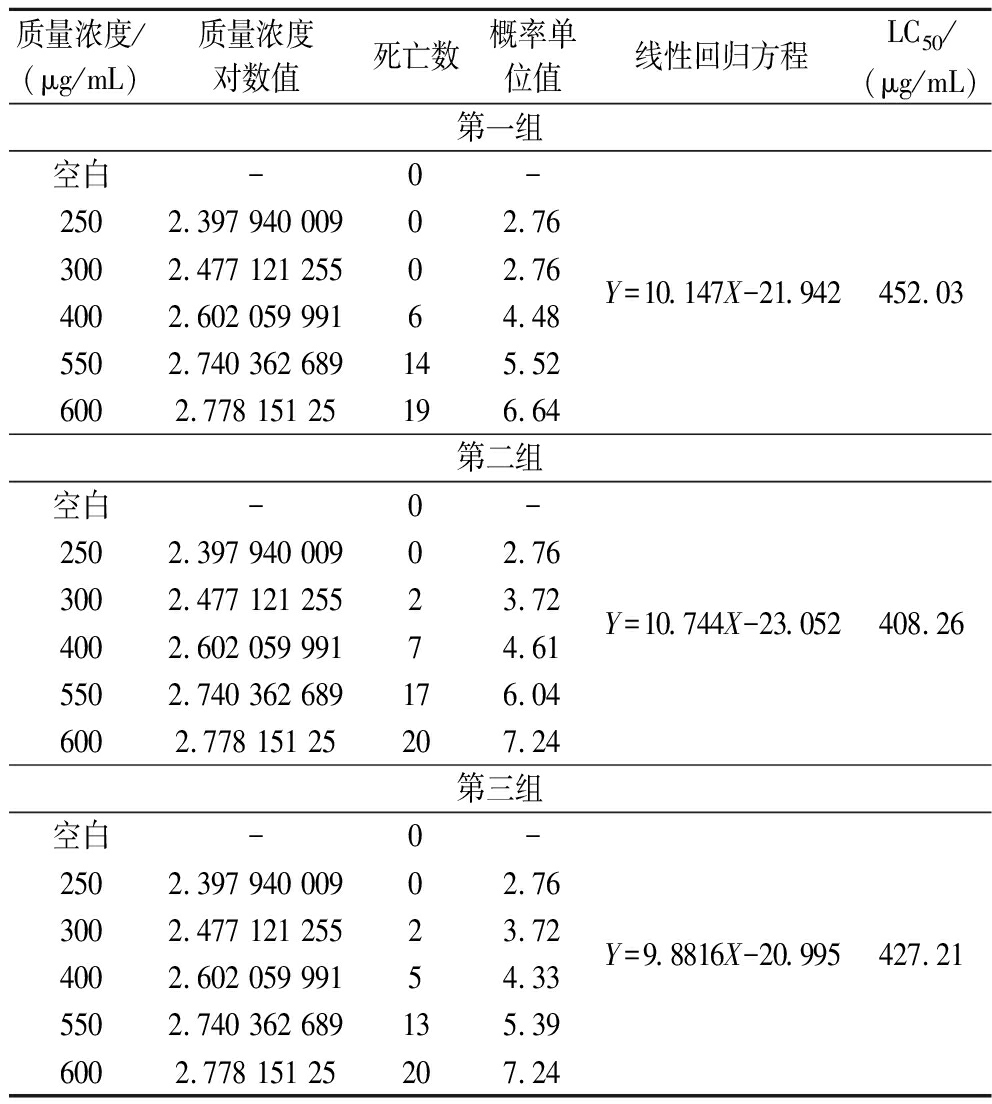
质量浓度/(μg/mL)质量浓度对数值死亡数概率单位值线性回归方程LC50/(μg/mL)第一组空白-0-2502.397 940 00902.763002.477 121 25502.764002.602 059 99164.485502.740 362 689145.526002.778 151 25196.64Y=10.147X-21.942452.03第二组空白-0-2502.397 940 00902.763002.477 121 25523.724002.602 059 99174.615502.740 362 689176.046002.778 151 25207.24Y=10.744X-23.052408.26第三组空白-0-2502.397 940 00902.763002.477 121 25523.724002.602 059 99154.335502.740 362 689135.396002.778 151 25207.24Y=9.8816X-20.995427.21
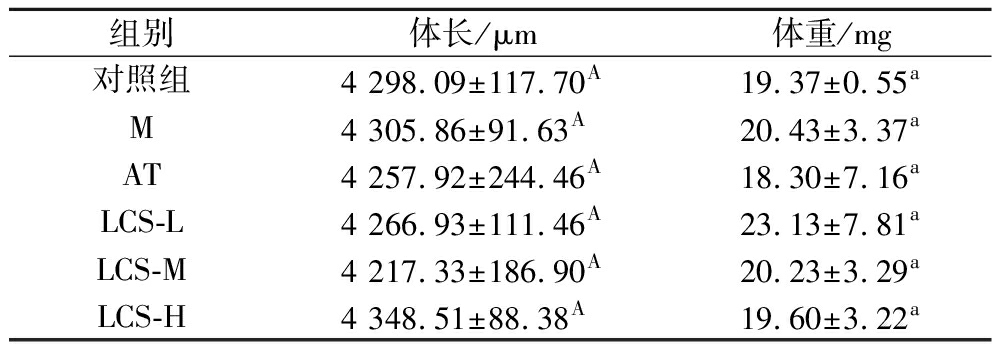
2.7 LCS对斑马鱼体长和体重的影响
斑马鱼幼鱼体长和体重统计结果如表6和图5所示。体长方面,相较于对照组和M组,LCS处理组和AT组斑马鱼均无显著性变化。体重方面,相较于对照组,斑马鱼经蛋黄粉喂养后,M组体重有所上升,但无显著性差异;与M组相比,AT组体重有所下降,而LCS处理组体重则呈现先上升后下降的趋势,但各组间均无显著性差异,这可能是由于本研究中所采用模型为斑马鱼幼鱼,且蛋黄粉喂养时间较短,斑马鱼尚处于幼龄状态,生长发育缓慢,因而蛋黄粉喂养诱导的高脂肥胖效果未体现在斑马鱼的体长和体重上,进而使得LCS的干预效果也未得到凸显,需进一步结合其他指标观察LCS对斑马鱼脂质代谢的影响。
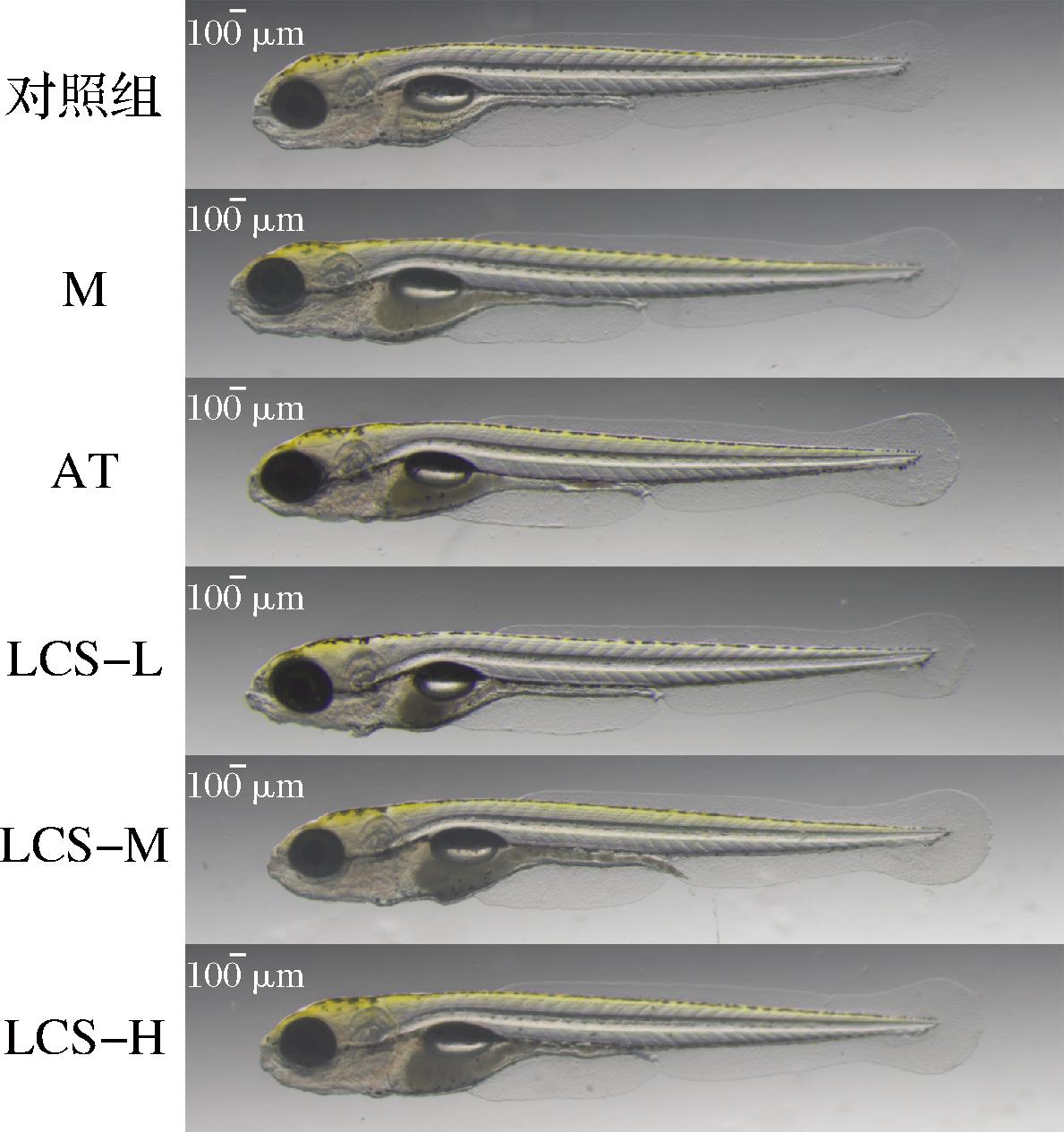
图5 各实验组斑马鱼幼鱼体长代表图
Fig.5 Representative graph of body length of juvenile zebrafish in each experimental group
表6 各实验组斑马鱼幼鱼体长和体重的统计结果
Table 6 Statistical results of body length and weight of juvenile zebrafish in each experimental group
组别体长/μm体重/mg对照组4 298.09±117.70A19.37±0.55aM4 305.86±91.63A20.43±3.37aAT4 257.92±244.46A18.30±7.16aLCS-L4 266.93±111.46A23.13±7.81aLCS-M4 217.33±186.90A20.23±3.29aLCS-H4 348.51±88.38A19.60±3.22a
注:同一列数据中不同大写字母表示各组间体长存在显著性差异(P<0.05),不同小写字母表示各组间体重存在显著性差异(P<0.05)。
2.8 LCS对斑马鱼体内脂质积累情况的影响
油红O是一种脂溶性偶氮染料,可与TG、胆固醇酯等中性脂肪结合,形成红色沉淀,本研究通过对斑马鱼幼鱼进行油红O染色,观察各实验组斑马鱼的脂质积累情况。如表7和图6所示,M组相对脂质含量极显著大于对照组(P<0.01),M组中红色面积明显增大,说明蛋黄粉喂养成功诱导斑马鱼形成高脂血症。AT组中,斑马鱼经阿托伐他汀干预后,相对脂质含量显著降低(P<0.05),红色沉淀明显变淡,表明阿托伐他汀降血脂效果显著。阿托伐他汀是继辛伐他汀之后的第三代他汀类药物,临床上常用于治疗原发性高胆固醇血症和饮食控制无效杂合子家族型高胆固醇血症,降血脂效果良好且长效[19-20]。不同质量浓度LCS处理组中,随着质量浓度的增大,红色沉淀逐渐变淡,相对脂质含量开始趋近于AT组,说明LCS具有显著降血脂作用,当干预质量浓度为80 μg/mL时,相对脂质含量最低,200 μg/mL时,LCS的作用效果与阿托伐他汀类似。
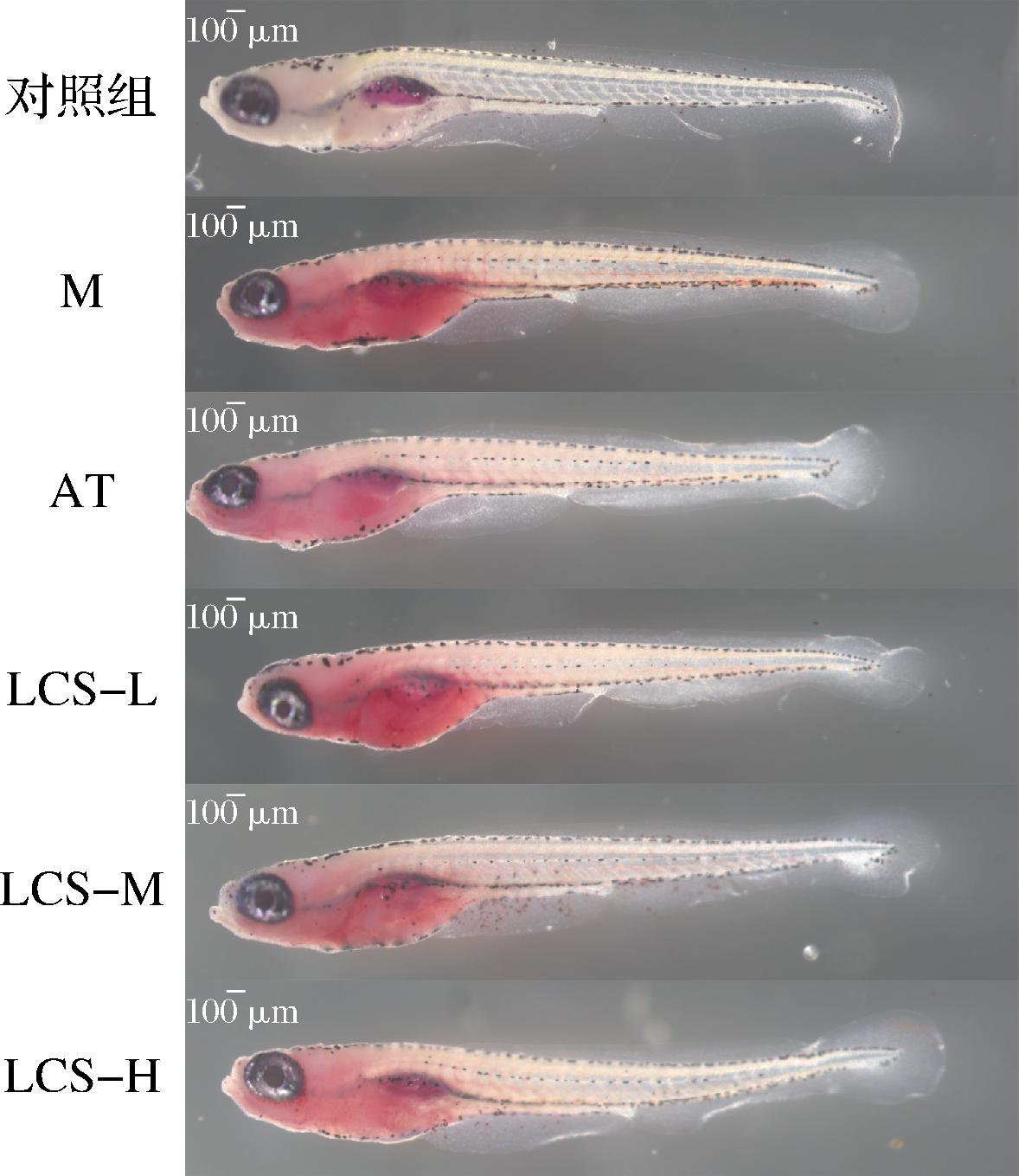
图6 各实验组斑马鱼幼鱼油红O染色结果
Fig.6 Oil red O staining results of juvenile zebrafish in each experimental group
表7 各实验组斑马鱼幼鱼相对脂质含量统计结果
Table 7 Statistical results of relative lipid content of juvenile zebrafish in each experimental group
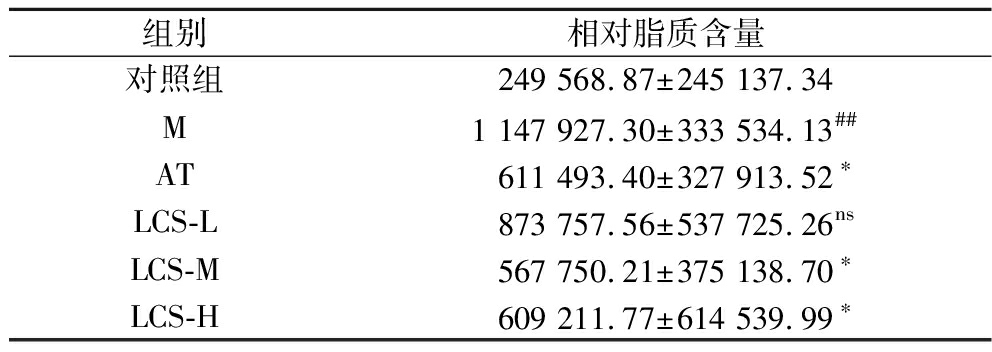
组别相对脂质含量对照组249 568.87±245 137.34M1 147 927.30±333 534.13##AT611 493.40±327 913.52∗LCS-L873 757.56±537 725.26nsLCS-M567 750.21±375 138.70∗LCS-H609 211.77±614 539.99∗
注:#表示与对照组相较呈显著性差异,*表示与M组相较呈显著性差异;ns表示与M组相较无显著性差异;#P<0.05,##P<0.01,*P<0.05,**P<0.01
2.9 LCS对斑马鱼肝脏组织形态的影响
高脂饮食促使动物肝脏形成明显的脂肪堆积,导致肝脏肿大,组织形态异常,HE染色可量化肝脏中脂肪变性程度,用于确定高脂血症模型造模成功与否,以及观察外源药物对肝脏组织形态的影响。如图7所示,相较于对照组,M组肝脏明显肿大,肝细胞形态松散,排列逐渐无规则化,脂肪空泡明显增多,再次说明蛋黄粉喂养成功诱导形成了高脂血症模型,而AT组中肝脏组织尽管有明显肿大,但脂肪空泡明显减少,肝细胞排列有序且形态正常;LCS处理组的肝脏HE染色结果与AT组相近,虽然肝脏有明显肿大,但与M组相比,随着LCS干预的质量浓度增大,肝细胞排列逐渐紧密,脂肪空白逐渐减少,组织形态趋于正常,结构相对清晰完整,说明LCS干预显著改善了高脂饮食导致的斑马鱼肝脏损伤和脂肪变性,具有良好的脂质代谢调节作用,且随着LCS干预的质量浓度提高而愈加明显。类似地,YU等[21]利用罗非鱼头CS喂养高脂饮食诱导的肥胖C57BL/6小鼠后,发现肥胖小鼠肝脏颜色逐渐由异常化的灰黄色向正常化的暗红色转变,脂滴数量显著减少,肝细胞形态结构逐渐恢复正常,这与本研究结果相似。
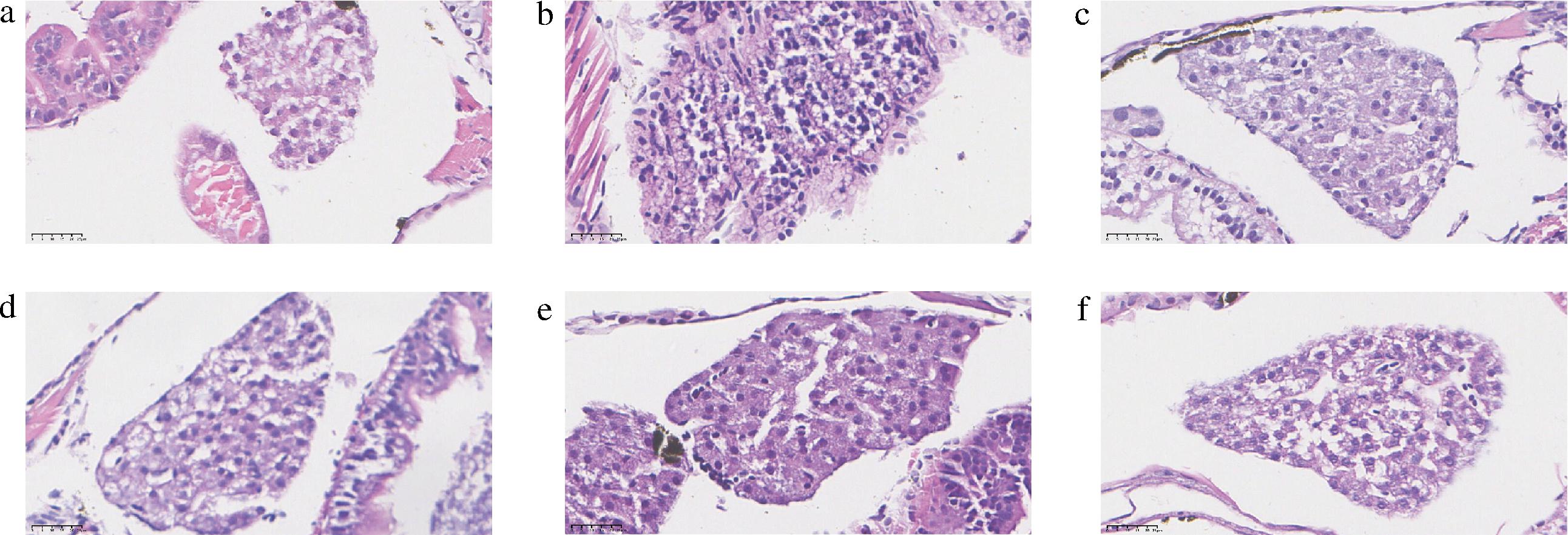
a-对照组;b-M;c-AT;d-LCS-L;e-LCS-M;f-LCS-H
图7 各实验组斑马鱼幼鱼肝脏HE染色结果
Fig.7 HE staining results of juvenile zebrafish liver in each experimental group
2.10 LCS对斑马鱼HDL-C、LDL-C、TG、TC含量的影响
HDL-C、LDL-C、TG、TC是表征机体脂质代谢是否异常的重要指标,如图8所示,相较于对照组,M组斑马鱼的HDL-C含量显著下降(P<0.05),而LDL-C、TG、TC含量显著上升(P<0.05),说明斑马鱼在高脂饮食干预下出现了明显的脂质代谢紊乱;HDL是参与机体转运分解胆固醇的重要载体,过程中通过摄取机体中游离胆固醇,经卵磷脂胆固醇酰基转移酶酯化为胆固醇酯,最后转运至肝脏中分解为胆汁酸排出体外,可见TC含量指标变化能够间接反映HDL-C的胆固醇转运效果,两者存在负反馈调节作用。相比M组,AT组斑马鱼经阿托伐他汀干预后,其体内HDL-C含量显著上升(P<0.05),而LDL-C、TG、TC含量呈现显著下降(P<0.05),阿托伐他汀作为临床中高效调节脂质代谢药使用,其调节机制在于竞争性结合3-羟基-3-甲基戊二酰辅酶A还原酶的催化位点,阻止机体肝脏合成胆固醇,由于机体胆固醇合成减少,促使LDL合成受限,而脂蛋白酯酶活性增强,导致机体中TG逐渐水解减少[22]。LCS处理组中,随着干预浓度增大,HDL-C含量显著提高并逐渐大于AT组,而LDL-C、TG、TC含量则呈逐渐下降趋势,当干预质量浓度为200 μg/mL时,LCS降血脂效果愈加趋近甚至优于阿托伐他汀。CS脂质代谢生化指标调节效果不仅体现在来源于海洋的动物上,同时在陆地来源的CS上也展现出良好的调节作用,XIONG等[23]利用从猪喉软骨提取的CS喂养高脂饮食大鼠后,发现不仅肝脏中TG和TC含量显著降低,血清中LDL-C、TG、TC含量均显著降低,而HDL-C显著升高。
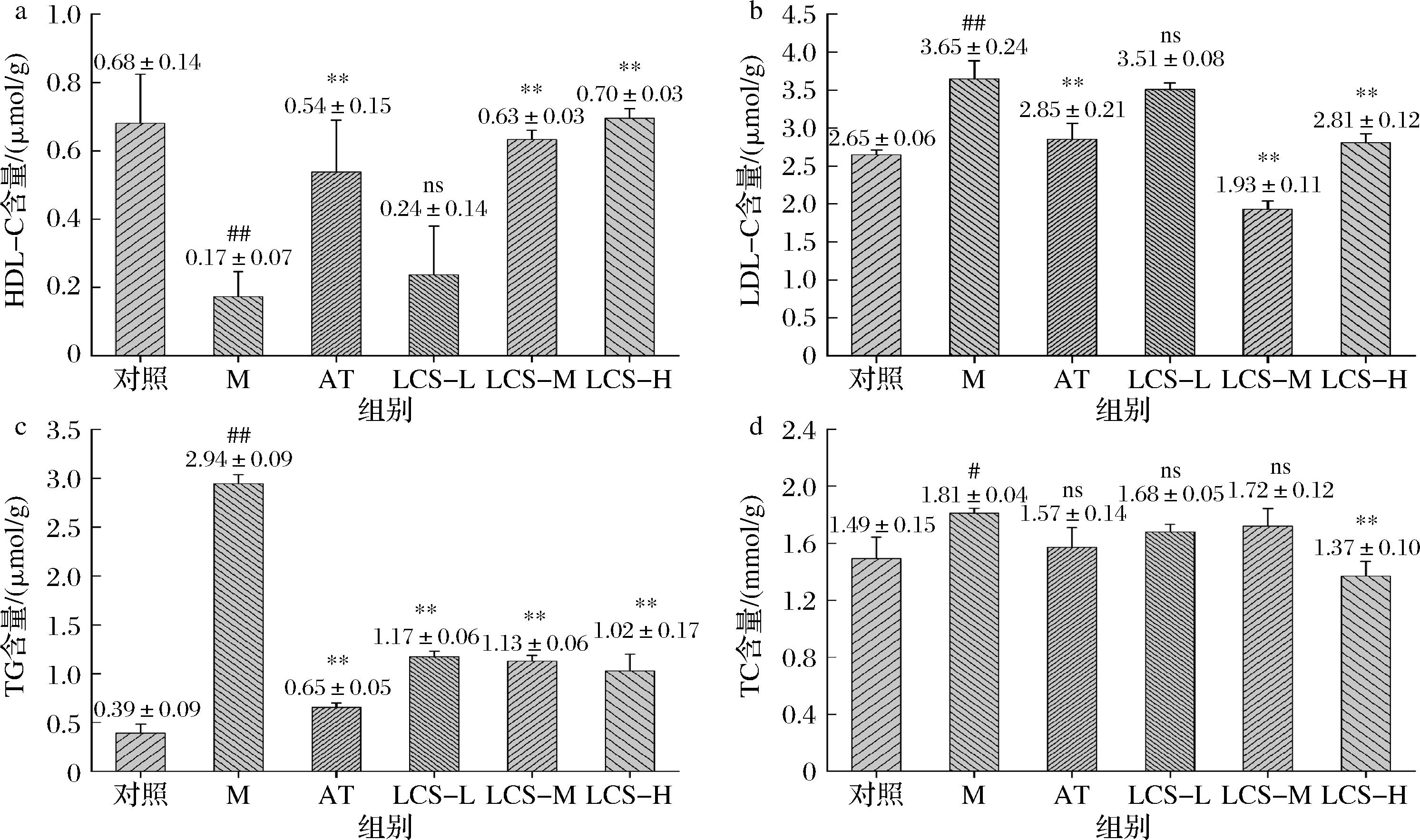
a-HDL-C含量;b-LDL-C含量;c-TG含量;d-TC含量
图8 各实验组斑马鱼幼鱼HDL-C、LDL-C、TG和TC含量测定结果
Fig.8 Determination results of HDL-C, LDL-C, TG, and TC in juvenile zebrafish of each experimental group
注:#表示与对照组相较呈显著性差异,*表示与M组相较呈显著性差异;ns表示与M组相较无显著性差异;#P<0.05,##P<0.01,*P<0.05,**P<0.01(下同)。
2.11 LCS对斑马鱼体内脂质代谢有关基因表达量的影响
本研究采用qRT-PCR技术测定了斑马鱼中与脂质代谢有关的基因相对表达量,包括Srebf1、Acaca、Fasn、Pparg、Rora、Hmgcrb、Ldlr、Cyp7a1a基因。Srebf1(固醇调节元件结合转录因子1)基因是调控内源性TG和胆固醇合成的关键因子,Srebf1的过度表达会持续激活脂质合成相关基因Acaca(乙酰辅酶A羧化酶)和Fasn(脂肪酸合成酶)的表达,尤其是在肝脏中,Acaca持续表达会促使细胞不断消耗ATP将乙酰辅酶A羧化为丙二酰辅酶A,这是脂肪酸合成的第一步,同时也是限速步骤,而脂肪酸合成所需底物恰好是丙二酰辅酶A和乙酰辅酶A,这2种底物在Fasn的作用下经过缩合还原后生成脂肪酸,为TG和胆固醇的合成提供原料[24]。如图9所示,相较于对照组,M组中Srebf1、Acaca、Fasn基因相对表达水平显著提升(P<0.05),说明斑马鱼经蛋黄粉喂养后利用其消化后的产物合成脂质的效果明显增强,导致M组整体脂质水平明显上升,最终表现在LDL-C、TG、TC含量显著提高,HDL-C含量显著降低。

a-Srebf1;b-Acaca;c-Fasn;d-Pparg;e-Rora;f-Hmgcrb;g-Ldlr;h-Cyp7a1a
图9 各实验组斑马鱼幼鱼Srebf1、Acaca、Fasn、Pparg、Rora、Hmgcrb、Ldlr、Cyp7a1a基因相对表达量测定结果
Fig.9 Determination results of relative expression of Srebf1, Acaca, Fasn, Pparg, Rora, Hmgcrb, Ldlr, and Cyp7a1a genes in juvenile zebrafish of each experimental group
注:ns表示与对照组相较无显著性差异。
Pparg(过氧化物酶体增殖物激活受体γ)基因的表达具有“双向调控”作用,一方面促进脂肪细胞增强摄取血液中的游离脂肪酸,并诱导TG合成基因表达,帮助脂肪细胞完成脂质贮存,另一方面则通过抑制Srebf1的活性减少脂肪酸合成,同时诱导线粒体中与脂肪酸β-氧化相关基因的表达,加速脂肪酸氧化分解供能[25]。与M组相比,AT组中Srebf1、Acaca、Fasn基因相对表达水平显著降低(P<0.05),而Pparg表达水平则显著上升(P<0.05),说明高脂血症斑马鱼在阿托伐他汀干预下脂质合成明显减少,同时提高了斑马鱼贮存脂质的能力,而后Pparg基因的高表达再通过负反馈调节抑制Srebf1、Acaca、Fasn的活性,最终达到降血脂的作用。Rora(维甲酸相关孤儿受体α)基因表达水平与Pparg基因相似,Rora活性提高能够促进脂肪组织氧化分解脂肪酸,为机体运动提供更多能量,同时可抑制肝脏中脂肪酸合成基因(如Fasn和Acaca)的表达,从而减少TG和胆固醇的合成[26];AT组斑马鱼在阿托伐他汀干预下,Rora基因表达水平有所提高,但与M组相比,无显著差异。相比阿托伐他汀,LCS则表现出差异化降血脂效果,主要呈现在不同干预浓度下的量效关系特征。
首先,在Srebf1、Acaca、Fasn基因表达水平上,相较于M组,经LCS干预后显著降低(P<0.05),但随着LCS干预质量浓度的增大而提高;一篇关于斑鳐软骨CS缓解肝损伤的研究结果显示[27],在脂多糖诱导的高脂血症小鼠中,斑鳐软骨CS能够显著降低Srebf1的表达水平,这与本研究结果相似,但该研究未涉及斑鳐CS在不同干预剂量上的基因表达水平比较,因而无法进一步与LCS对比降血脂作用。其次,Pparg基因表达水平尽管相较于M组有所降低,但随着LCS干预质量浓度增大而提高;而Rora基因表达水平在不同LCS干预质量浓度下,则呈现与Pparg基因相似的上升趋势。最后,推测Pparg和Rora基因表达水平的提高可能与Srebf1、Acaca、Fasn基因表达量上升有关,脂肪酸及其衍生物是Pparg和Rora的天然配体[28-29],Srebf1、Acaca、Fasn基因表达水平的上升导致机体产生大量脂肪酸及其衍生物,Pparg和Rora作为受体接收到该配体调控信号后发生高表达,加快机体脂肪酸的“燃烧”,达到缓解由于机体摄入过多脂质而导致的代谢紊乱。可见LCS产生的脂质代谢调控作用是通过代谢产物和信号通路的级联反应实现的,具有明显的整体协调性,此过程中LCS-L组体现出较为明显的降血脂活性。
Hmgcrb(3-羟基-3-甲基戊二酰辅酶A还原酶)基因是脂质代谢中胆固醇合成的限速步骤,Hmgcrb的表达能够促进HMG-CoA还原为甲羟戊酸,后经过多步反应合成异戊烯焦磷酸,最后缩合为胆固醇;此外,Hmgcrb基因还是他汀类药物的作用靶点,例如阿托伐他汀,由于其结构与HMG-CoA相似,能够竞争性结合Hmgcrb的催化位点,减少胆固醇合成。M组斑马鱼在蛋黄粉喂养下,Hmgcrb基因表达量相较于对照组显著提高,而AT组斑马鱼由于受到阿托伐他汀的干预,Hmgcrb基因表达水平显著降低;与此同时,高脂血症斑马鱼在LCS干预下,Hmgcrb基因表达量同样显著性下降,尤以LCS-L组最为明显。
Ldlr(低密度脂蛋白受体)和Cyp7a1a(胆固醇7α-羟化酶)基因的表达与机体胆固醇清除有着密切联系,Ldlr能够通过介导血液中LDL-C的内吞与降解,而Cyp7a1a能够催化胆固醇羟化为7α-羟基胆固醇,此为胆汁酸合成的第一步,Ldlr和Cyp7a1a基因对维持机体胆固醇正常水平具有重要调节作用[30-31]。相较于对照组,M组的Ldlr和Cyp7a1a基因相对表达量显著降低,结合与脂质合成有关的Srebf1、Acaca、Fasn基因表达结果,推断高脂饮食成功诱导斑马鱼形成脂质代谢紊乱。AT组在阿托伐他汀干预下,Cyp7a1a基因表达量显著上升,Ldlr基因表达量上升不显著;在LCS干预下,Ldlr基因表达量只有LCS-M组显著上升,而Cyp7a1a基因表达量则随着干预的质量浓度的增大而显著性提高。
综上所述,LCS的降血脂效果与干预的质量浓度存在特殊的量效关系,相较于M组,当干预的质量浓度为40 μg/mL时,通过抑制脂质合成基因Srebf1、Acaca、Fasn的表达,进而导致脂质贮存与分解基因Pparg和Rora的表达水平下降达到降血脂作用;在80 μg/mL时,尽管LCS的Srebf1、Acaca和Fasn基因表达的抑制作用有所减弱,但通过下调胆固醇合成基因Hmgcrb的表达和上调胆固醇降解基因Ldlr的表达实现降血脂目的;在200 μg/mL时,LCS的Srebf1、Acaca、Fasn和Hmgcrb基因表达的抑制效果最弱,但通过上调脂质储存与分解基因Pparg、Rora和Cyp7a1a的表达实现了降血脂作用。可见,LCS在不同干预的质量浓度下通过多靶点、差异化的基因调控机制达到降血脂效果,展现出可用于功能性食品和药物开发的潜力。例如,低中质量浓度(40、80 μg/mL)的LCS可应用于功能性饮品或膳食补充剂中,而高质量浓度(200 μg/mL)的LCS则更适合开发成降血脂胶囊或片剂应用于临床治疗。
3 结论
本研究采用稀碱酶解、乙醇沉淀和透析除杂等工艺制备LCS,经过理化性质测定和结构特征分析,LCS中CS含量可达到92.59%,葡糖醛酸与蛋白含量分别为35.64%和1.27%,红外光谱分析结果显示LCS官能团组成与CS标品相似,而3种分子质量Mn、Mw、Mp分别为18 629、33 874、28 301 Da,在硫酸化位点上C-6和C-4程度相当。通过建立高脂血症斑马鱼模型探究LCS的降血脂活性,油红O染色结果表明高脂饮食成功诱导斑马鱼形成高脂血症,且在LCS的不同干预质量浓度(40、80、200 μg/mL)下,相对脂质含量显著降低,肝脏组织逐渐由肿大形态趋于正常,肝细胞排列逐渐紧密,且斑马鱼中LDL-C、TG和TC含量显著降低,而HDL-C含量显著升高;通过测定斑马鱼中与脂质代谢有关的基因表达量,发现LCS是通过抑制脂质合成基因Srebf1、Acaca、Fasn、Hmgcrb的表达,同时促进脂质分解基因Pparg、Rora、Ldlr、Cyp7a1a的表达,实现在高脂血症斑马鱼中的降血脂作用。
综上,本研究以大黄鱼骨加工副产物为原料提取CS,有效提升了副产物利用价值,延伸了大黄鱼加工产业链,同时为CS的提取来源增添了新途径;针对LCS的降血脂作用探究,为LCS在健康食品中应用提供了理论依据。
[1] 农业农村部渔业渔政管理局. 2024 中国渔业统计年鉴[M].北京:中国农业出版社, 2024.Fishery Bureau of Ministry of Agriculture of the People’s Republic of China.China Fishery Statistical Yearbook[M].Beijing:China Agriculture Press, 2024.
[2] 刘梦遥. 清蒸大黄鱼加工工艺及其贮藏品质的研究[D].福州:福建农林大学, 2023.LIU M Y.Study on the steaming processing of Larimichthys crocea products and its quality changes during storage[D].Fuzhou:Fujian Agriculture and Forestry University, 2023.
[3] 窦鑫. 大黄鱼鱼肝油的酶法制取与脱腥研究[D].上海:上海海洋大学, 2022.DOU X.Enzymatic preparation and deodorization of large yellow croaker liver oil[D].Shanghai:Shanghai Ocean University, 2022.
[4] SHANG Q S, SHI J J, SONG G R, et al.Structural modulation of gut microbiota by chondroitin sulfate and its oligosaccharide[J].International Journal of Biological Macromolecules, 2016, 89:489-498.
[5] YUAN Q X, SHI X, MA H Q, et al.Recent progress in marine chondroitin sulfate, dermatan sulfate, and chondroitin sulfate/dermatan sulfate hybrid chains as potential functional foods and therapeutic agents[J].International Journal of Biological Macromolecules, 2024, 262:129969.
[6] MISHRA S, GANGULI M.Functions of, and replenishment strategies for, chondroitin sulfate in the human body[J].Drug Discovery Today, 2021, 26(5):1185-1199.
[7] 宋琳, 宋晓, 薛长湖, 等.海地瓜岩藻聚糖与硫酸软骨素双水相分离方法的研究[J].食品与发酵工业, 2023, 49(19):183-189.SONG L, SONG X, XUE C H, et al.Study on the PEG-salt aqueous two-phase method for the separation of sulfated fucan and chondroitin sulfate in Acaudina molpadioides[J].Food and Fermentation Industries, 2023, 49(19):183-189.
[8] SHEN Q S, GUO Y J, WANG K Y, et al.A review of chondroitin sulfate’s preparation, properties, functions, and applications[J].Molecules, 2023, 28(20):7093.
[9] 刘良禹, 汪静汶, 朱思洁, 等.超声辅助-碱-酶法提取鲟鱼硫酸软骨素工艺及其结构分析[J].食品科技, 2023, 48(10):108-116.LIU L Y, WANG J W, ZHU S J, et al.Ultrasonic assisted-alkaline-enzymatic extraction and structural analysis of chondroitin sulfate from sturgeon[J].Food Science and Technology, 2023, 48(10):108-116.
[10] YANG J, SHEN M Y, WU T, et al.Physicochemical, structural characterization, and antioxidant activities of chondroitin sulfate from Oreochromis niloticus bones[J].Food Science and Human Wellness, 2023, 12(4):1102-1108.
[11] 郑昕. 鸡胸软骨酶解物中硫酸软骨素含量测定及结构功能探究[D].广州:华南理工大学, 2021.ZHENG X.Determination of chondroitin sulfate in enzymatic hydrolysate of chicken breast cartilage and research on its structure and function[D].Guangzhou:South China University of Technology, 2021.
[12] 周畅. 鳐硫酸软骨素及其降解产物的结构表征和抗氧化活性研究[D].保定:河北农业大学, 2020.ZHOU C.Structural characterization and antioxidant activity of skate chondroitin sulfate and its degradation products[D].Baoding:Hebei Agricultural University, 2020.
[13] 任珍芸, 陈晓航, 王玺, 等.硫酸-咔唑微孔板法检测肺炎链球菌荚膜多糖中糖醛酸含量[J].微生物学免疫学进展, 2017, 45(2):36-41.REN Z Y, CHEN X H, WANG X, et al.Determination of uronic acid content in pneumococcal polysaccharide by sulfate-carbazole method in microplate[J].Progress in Microbiology and Immunology, 2017, 45(2):36-41.
[14] 左格格. 罗非鱼加工副产物不同部位硫酸软骨素的制备、结构表征及抗衰老活性[D].湛江:广东海洋大学, 2022.ZUO G G.Preparation, structural characterization and antiaging activity of chondroitin sulfate from different parts of tilapia by-product[D].Zhanjiang:Guangdong Ocean University, 2022.
[15] 叶琳弘. 鱿鱼软骨中硫酸软骨素的提取、纯化及降血脂活性的研究[D].福州:福建农林大学, 2015.YE L H.Studied on extraction, purification and hypolipidemic activity of chondroitin sulfate from cartilage of squid[D].Fuzhou:Fujian Agriculture and Forestry University, 2015.
[16] ZHOU C, MI S, LI J, et al.Purification, characterisation and antioxidant activities of chondroitin sulphate extracted from Raja porosa cartilage[J].Carbohydrate Polymers, 2020, 241:116306.
[17] MUCCI A, SCHENETTI L, VOLPI N.1H and13C nuclear magnetic resonance identification and characterization of components of chondroitin sulfates of various origin[J].Carbohydrate Polymers, 2000, 41(1):37-45.
[18] ABDALLAH M M, FERN NDEZ N, MATIAS A A, et al.Hyaluronic acid and chondroitin sulfate from marine and terrestrial sources:Extraction and purification methods[J].Carbohydrate Polymers, 2020, 243:116441.
NDEZ N, MATIAS A A, et al.Hyaluronic acid and chondroitin sulfate from marine and terrestrial sources:Extraction and purification methods[J].Carbohydrate Polymers, 2020, 243:116441.
[19] SUDUN, LIU S L, XIAO C, et al.Probiotic strains improve high-fat diet-induced hypercholesterolemia through modulating gut microbiota in ways different from atorvastatin[J].Food &Function, 2019, 10(9):6098-6109.
[20] 杨雯. 不同剂量阿托伐他汀在动脉粥样硬化性血管内皮功能保护中的应用效果分析[J].吉林医学, 2021, 42(2):411-413.YANG W.Effect analysis of different doses of atorvastatin in the protection of atherosclerotic vascular endothelial function[J].Jilin Medical Journal, 2021, 42(2):411-413.
[21] YU H, YI X Z, GAO X, et al.Tilapia-head chondroitin sulfate protects against nonalcoholic fatty liver disease via modulating the gut-liver axis in high-fat-diet-fed C57BL/6 mice[J].Foods, 2022, 11(7):922.
[22] 杜蕊, 李娜, 赵彩杰, 等.HMG-CoA还原酶抑制剂联合阿托伐他汀对冠心病大鼠的干预及降血脂作用[J].中国老年学杂志, 2023, 43(1):128-132.DU R, LI N, ZHAO C J, et al.Intervention of HMG-CoA reductase inhibitor combined with atorvastatin on coronary heart disease rats and its hypolipidemic effect[J].Chinese Journal of Gerontology, 2023, 43(1):128-132.
[23] XIONG S L, LI A L, JIN Z Y, et al.Effects of oral chondroitin sulfate on lipid and antioxidant metabolisms in rats fed a high-fat diet[J].Journal of Food Biochemistry, 2007, 31(3):356-369.
[24] AREGGER M, LAWSON K A, BILLMANN M, et al.Systematic mapping of genetic interactions for de novo fatty acid synthesis identifies C12orf49 as a regulator of lipid metabolism[J].Nature Metabolism, 2020, 2(6):499-513.
[25] YANG X F, SHANG D J.The role of peroxisome proliferator-activated receptor γ in lipid metabolism and inflammation in atherosclerosis[J].Cell Biology International, 2023, 47(9):1469-1487.
[26] LEE J M, KIM H, BAEK S H.Unraveling the physiological roles of retinoic acid receptor-related orphan receptor α[J].Experimental &Molecular Medicine, 2021, 53(9):1278-1286.
[27] SONG Y O, KIM M, WOO M, et al.Chondroitin sulfate-rich extract of skate cartilage attenuates lipopolysaccharide-induced liver damage in mice[J].Marine Drugs, 2017, 15(6):178.
[28] AKSOY M O, BILINSKA A, STACHOWIAK M, et al.Deciphering the role of the SREBF1 gene in the transcriptional regulation of porcine adipogenesis using CRISPR/Cas9 editing[J].International Journal of Molecular Sciences, 2024, 25(23):12677.
[29] RUIZ R, JIDEONWO V, AHN M, et al.Sterol regulatory element-binding protein-1 (SREBP-1) is required to regulate glycogen synthesis and gluconeogenic gene expression in mouse liver[J].Journal of Biological Chemistry, 2014, 289(9):5510-5517.
[30] ZHAO Y, PENG L, YANG L C, et al.Wedelolactone regulates lipid metabolism and improves hepatic steatosis partly by AMPK activation and up-regulation of expression of PPARα/LPL and LDLR[J].PLoS One, 2015, 10(7):e0132720.
[31] SONG J P, LU X Y, LIU D H, et al.Fucogalactan sulfate (FS) from Laminaria japonica regulates lipid metabolism in diet-induced humanized dyslipidemia mice via an intestinal FXR-FGF19-CYP7A1/CYP8B1 pathway[J].Journal of Agricultural and Food Chemistry, 2023, 71(38):14027-14037.