乳是人体重要的蛋白质来源,根据可消化必需氨基酸评分,乳蛋白相较于传统植物源蛋白和其他动物源蛋白具有更高的消化性和功能性[1]。乳蛋白主要由酪蛋白和乳清蛋白组成。从乳中分离出酪蛋白的溶解性较差,但通过酸化处理并与碳酸钠等碱性物质中和生成的酪蛋白酸钠,其水溶性显著提高,在食品行业中有更广泛的应用[2]。酪蛋白酸钠在pH值为4.6附近不易溶解,在胃酸条件下会形成絮凝,从而降低了蛋白的消化性[2]。然而,酪蛋白酸钠具有良好的钙稳定性,可以与Ca2+形成稳定的复合物,即使在胃酸条件下仍能保持较高的钙结合率。乳清蛋白则具有球形紧凑的结构,在胃消化过程中降解较少,但能够快速进入小肠完成消化吸收。乳清蛋白中的α-乳白蛋白(占总乳清蛋白的20%~50%)具备钙载体功能,但在胃酸条件下,其钙结合效率会显著降低[3]。酪蛋白酸钠和乳清蛋白经过胃肠道消化后,最终降解为氨基酸和肽类物质,其中部分肽段具有重要的生物学活性。例如,酪蛋白磷酸肽具有显著的促钙吸收作用,而乳清蛋白肽则表现出良好的抗氧化和抗炎活性[4]。
目前,关于酪蛋白和乳清蛋白复配物消化的相关研究主要集中在婴幼儿和成人群体。PHOSANAM等[5]在模拟婴儿体外消化条件下研究了不同比例酪蛋白与乳清蛋白的消化情况,发现当酪蛋白与乳清蛋白的比例为40∶60时,蛋白质消化率达到最高。MULET-CABERO等[6]在模拟成人体外消化条件下进行了类似研究,发现较高比例的酪蛋白在胃消化过程中会形成凝块,导致蛋白质消化速度减慢;在胃酸环境下,乳清蛋白无凝块形成,具有更快的胃排空和肠消化率。老年人由于身体机能衰退和营养获取渠道有限,普遍存在蛋白质摄入不足的问题。成年人和老年人每日蛋白质推荐摄入量分别为0.8 g/(kg·d)和0.8~1.2 g/(kg·d)[7];乳蛋白因其高生物利用率和必需氨基酸含量,被认为是老年人蛋白质补充的理想选择[8]。研究表明,酪蛋白的凝块特性会显著影响其胃排空速度和小肠消化速率,而乳清蛋白由于可溶性特点,能够更快进入小肠并被吸收[9]。研究还指出,乳清蛋白的快速消化特性,使其在运动后可迅速为肌肉补充所需的氨基酸,而酪蛋白则更适合在夜间使用以维持机体长时间的氨基酸供应[10]。这些特性使得两者在不同场景下具有不同的应用价值。现阶段对于老年人群的体外蛋白消化的研究,主要集中于不同人群的对比和单一蛋白的研究[11]。例如,WANG等[12]对酪蛋白体外消化的研究结果中显示,与婴儿和成人相比,老年人胃消化酪蛋白的过程中产生的凝块不易消失。MELCHIOR等[13]的研究主要关注了乳清蛋白在老年人和成人体外消化过程中的水解度差异。与成人相比,老年人对蛋白质的消化能力较弱,这可能与其消化酶和胃酸分泌减少等因素有关,且单一蛋白质的研究和应用存在一定的局限性,无法全面满足老年人复杂的营养需求。因此,我们采用复配蛋白进行老年人体外消化研究,评估消化情况及其消化产物的生物活性功能,从而更有针对性的满足老年人群的营养需求。
本研究以酪蛋白酸钠和乳清蛋白(C∶W)为原料,将不同比例的蛋白复配物(C∶W=10∶0、8∶2、6∶4、4∶6、2∶8、0∶10)分别进行老年人体外模拟胃肠消化,采用凝块拍照、电泳、原子吸收、高效液相体积排阻色谱、SIRT-1活性检测试剂盒等手段,比较蛋白复配物的消化性及消化产物的抗氧化和抗炎能力。本研究将为老年蛋白粉的开发提供依据。
1 材料与方法
1.1 材料与试剂
酪蛋白酸钠(91%蛋白)、乳清蛋白(78%蛋白)、乳矿物盐(26%钙),新西兰恒天然集团;胃蛋白酶(P6887)、胰蛋白酶(T1426)、胆盐、胃酶抑制素A、4-(2-氨乙基)苯磺酰氟盐酸盐[4-(2-aminoethyl)benzenesulfonyl fluoride hydrochloride,AEBSF]、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、邻苯二甲醛(O-phthalaldehyde,OPA)、三氯乙酸(纯度>99%)、DPPH(纯度>97%),美国Sigma公司;SIRT-1活性检测试剂盒(ab156065),美国Abcam公司。
1.2 仪器与设备
E2695高效液相色谱分析仪,美国Waters公司;ChemiDoc XRS+化学发光凝胶成像仪,美国Bio-rad公司;HWS-12型电热恒温水浴锅,上海一恒科学仪器有限公司;TS-200脱色摇床,海门市其林贝尔仪器制造有限公司;UV-2700紫外分光光度计,日本Shimadzu公司;ICAP TQ电感耦合等离子体质谱仪,德国赛默飞世尔科技有限公司;色谱柱(ZORBAX 300SB-C18;250 nm×4.6 nm, 5 μm),美国Agilent公司;TSK gel 2000SWXL色谱柱(300 mm×7.8 mm),日本TOSOH公司。
1.3 实验方法
1.3.1 待消化样品的制备
根据市售中老年蛋白粉产品的推荐食用方式,将酪蛋白酸钠和乳清蛋白分别溶解于超纯水中,至蛋白浓度达到60 g/L,然后在45 ℃水浴锅中搅拌30 min至完全溶解;将二者按10∶0、8∶2、6∶4、4∶6、2∶8 和0∶10的质量比进行复配,并分别加入乳矿物盐,至钙含量达到2.5 g/L。
1.3.2 老年人体外胃肠道消化
参考WANG等[12]建立的老年人体外消化模型,蛋白样品在37 ℃水浴锅中平衡一段时间后,与模拟胃液[6.9 mmol/L KCl、0.9 mmol/L KH2PO4、72.2 mmol/L NaCl、0.1 mmol/L MgCl2、0.5 mmol/L (NH4)2CO3、1 200 U/mL胃蛋白酶,pH 3.7]按1∶1等体积比混合,调pH值至3.7,分别在0、5、15、30、60、120、180 min不同时间点进行取样,并调pH值至7.0来终止胃消化反应;胃消化结束后,将胃消化物与模拟肠液(80 U/mL胰蛋白酶、13.4 mmol/L胆汁、6.8 mmol/L KCl、0.8 mmol/L KH2PO4、123.4 mmol/L NaCl、0.33 mmol/L MgCl2,pH 7.0)按1∶1等体积比混合,分别在0、0.5、5、15、30、60、120 min不同时间点取样,样品加入5.0 mmol/L AEBSF溶液来终止肠消化反应。
1.3.3 凝块形态分析
在消化实验过程中,分别在胃消化0、5、15、30、60、120、180 min时取出消化物并拍照。
1.3.4 凝块持水量测定
参考YE等[14]的方法,取胃消化0.5 min的胃液混合物,立即于100×g离心10 min,将收集的沉淀物在105 ℃下干燥至恒重;干燥前后的质量差与干燥前质量的百分比即为持水能力。
1.3.5 蛋白降解分析
采用SDS-PAGE测定蛋白降解率,参考GONG等[15]的方法,首先配制蛋白凝胶,先加入下层胶,即4%的浓缩胶,静置一段时间待下层胶凝固,然后加入上层12%的分离胶并插入电泳梳,待胶体凝固即制胶完成;将电泳梳拔出,在胶体形成的孔内加入10 μL样品(样品制备:样品稀释至2 mg/mL蛋白质量浓度,与含β-巯基乙醇的样品缓冲液混合,沸水浴5 min);上样完毕后,调节电压至120 V,开始电泳;电泳结束后,将凝胶取出用考马斯亮蓝R-250进行染色,染色结束后,用5%甲醇和7.5%(均为体积分数)冰醋酸混合液对凝胶进行脱色;使用Image Lab 3.0软件对电泳条带进行半定量分析,计算蛋白残留率。
1.3.6 游离氨基含量测定
参考BAVARO等[16]的方法,取消化物与62 g/L三氯乙酸(trichloroacetic acid,TCA)溶液等体积混合,于旋转培养器上旋转30 min,然后在10 000×g条件下离心30 min,收集上清液;取胃消化物所得的离心上清液,加水稀释15倍;取肠消化物的离心上清液,加水稀释7.5倍;取150 μL稀释液与3 mL OPA溶液混合,避光反应15 min,于340 nm波长下测定吸光度;采用0~10 mmol/L的亮氨酸溶液作为标准品。
1.3.7 多肽分子质量分布分析
参考ZHANG等[17]的方法,取消化物与8 mol/L尿素溶液和1.3%柠檬酸钠按体积等比例混合,采用0.45 μm尼龙膜过滤;采用TSKgel 2000SWXL色谱柱,流动相含乙腈、水和三氟乙酸,体积比为400∶600∶1,进样量50 μL,柱温30 ℃,流速0.5 mL/min,检测波长220 nm;分子质量标准品为细胞色素C(12 384 Da)、杆菌肽(1 422 Da)、Gly-Gly-Tyr-Arg(451 Da)和Gly-Gly-Gly(189 Da)。
1.3.8 钙生物利用度分析
参考WANG等[12]的方法,肠消化结束后,取消化物并分为2份,其中1份在10 kDa超滤管中离心(8 000×g,30 min)并取滤液;将2份消化物进行湿法消化,用原子吸收法测定未超滤消化物的钙含量为总钙和超滤消化物的钙含量为可溶性钙。按公式(1)计算钙生物利用度:
钙生物利用度![]()
(1)
1.3.9 抗氧化能力分析
1.3.9.1 DPPH自由基清除活性的测定
参考MU等[18]的方法,将2 mL样品与2 mL DPPH溶液混合,室温暗处培养30 min,在517 nm处测量吸光度;无水乙醇代替DPPH溶液作空白对照,蒸馏水代替样品作对照。按公式(2)计算:
DPPH自由基清除率![]()
(2)
式中:Ai、Aj和A0分别代表样品、空白和对照的吸光度。
1.3.9.2 ABTS阳离子自由基清除活性的测定
参考MU等[18]的方法,将0.1 mL样品与3.9 mL ABTS溶液混合,在室温下暗处培养10 min,然后在734 nm 波长处测定吸光度;以超纯水代替样品作为对照。按公式(3)计算:
ABTS阳离子自由基清除率![]()
(3)
式中:Ai和A0分别代表样品和空白的吸光度。
1.3.10 抗炎能力分析
参照SALEE等[19]的方法,使用SIRT-1活性检测试剂盒检测样品对SIRT-1酶活性的激活情况,使用微板荧光计测定样品荧光强度;通过计算样品与对照之间的荧光强度比来确定消化物的抗炎能力。
1.4 数据分析
采用 SPSS 20.0软件对数据进行统计分析,采用Duncan检验,P<0.05表示差异显著。
2 结果与分析
2.1 胃消化凝块形态的变化
不同比例酪蛋白酸钠与乳清蛋白胃消化物的凝块形态如图1所示。在胃消化过程中,除C∶W(0∶10)组外,其他5组均观察到了凝块,并且随着消化时间的延长,凝块逐渐被胃蛋白酶水解,大小逐渐减小。凝块尺寸大小顺序为:C∶W(2∶8) 图1 不同比例酪蛋白酸钠与乳清蛋白胃消化物中凝块的形态 不同比例酪蛋白酸钠与乳清蛋白胃消化物中凝块的持水量如图2所示。持水量指标反映了凝块结构是松散还是紧密,即持水量越高,凝块越松散[20];C∶W(10∶0)、C∶W(8∶2)和C∶W(6∶4)组形成的凝块中持水量几乎相同,显著低于C∶W(4∶6)和C∶W(2∶8)两组;C∶W(0∶10)组无凝块形成。凝块的持水量与其孔隙率、松散度等微观结构呈正相关。凝块持水量越大,其孔隙率和松散度越高,越有利于胃蛋白酶向凝块内部的扩散,从而促进蛋白的消化降解[21]。此外,凝块越小,其比表面积越大,也使得胃蛋白酶能更快地扩散进入凝块内部,加快消化进程。 图2 不同比例酪蛋白酸钠与乳清蛋白胃消化物中凝块的持水量 注:不同字母代表组间均值在P<0.05水平上具有显著性差异(下同)。 在老年人体外模拟胃消化的条件下,不同比例酪蛋白酸钠与乳清蛋白形成的凝块大小会受到蛋白组成的影响。酪蛋白酸钠的等电点与胃液pH接近,使其所带净电荷减少,形成凝块;而在此pH下,乳清蛋白不形成凝块。因此,随着乳清蛋白比例增加,凝块形成的尺寸降低且结构更加松散[22]。 在老年人体外模拟胃消化过程中,不同比例酪蛋白酸钠与乳清蛋白的蛋白质降解和残留率如图3所示。随消化时间延长,酪蛋白条带逐渐减弱,新条带出现并向下迁移,表明酪蛋白被胃蛋白酶逐渐水解,生成了一些多肽。乳清蛋白中的α-乳白蛋白条带强度没有显著变化,残留率保持在68%~76%。C∶W(10∶0)和C∶W(8∶2)组酪蛋白残留率降低较为平缓,180 min时分别剩余约40%和18%。C∶W(6∶4)、C∶W(4∶6)和C∶W(2∶8)组在前30 min内蛋白残留率迅速下降,随后缓慢降低,条带分别在120、30和5 min完全消失。5组样品的酪蛋白酸钠降解速率依次为:C∶W(10∶0) CN-酪蛋白;β-Lg-乳球蛋白;α-La-乳白蛋白。a~f-SDS-PAGE图;g-酪蛋白残留率;h-乳清蛋白残留率 图3 不同比例酪蛋白酸钠与乳清蛋白胃消化物的 SDS-PAGE 图及酪蛋白和乳清蛋白残留率 胃消化过程形成的凝块颗粒的大小是决定样品中酪蛋白酸钠降解的关键因素,如果凝块形成的颗粒大且致密,颗粒比表面积低,消化酶通过颗粒的扩散速度将被限制,由此酪蛋白酸钠降解缓慢[23]。有研究发现,在胃消化过程中酪蛋白酸钠的凝块颗粒逐渐变小且结构逐渐松散,从而增加胃酶对酪蛋白酸钠的作用,使其加速降解[24]。 在胃消化过程中,不同比例的酪蛋白酸钠和乳清蛋白产生的游离氨基含量如图4-a所示。蛋白在水解过程中肽键的断裂会导致α-氨基的释放,随着胃消化的进行,6组蛋白样品释放的游离氨基的含量均逐渐增加,表明蛋白水解程度不断提高。在胃消化初期(0~30 min),6组样品的游离氨基的释放速率很快;在胃消化中后期(30~180 min),6组的游离氨基继续释放,但整体释放速度慢于胃消化初期。在整个胃消化阶段,游离氨基含量从小到大依次为:C∶W(0∶10) a-游离氨基含量;b-多肽分子质量分布;c-游离氨基酸含量 图4 不同比例酪蛋白酸钠与乳清蛋白胃消化物中游离氨基含量、多肽分子质量分布及游离氨基酸含量 在胃消化结束时,不同比例的酪蛋白酸钠和乳清蛋白的多肽分子质量分布如图4-b所示。胃消化结束后(180 min),不同比例样品的多肽分子质量主要分布在<1、1~5、>5~10和>10 kDa 4个范围。不同比例的酪蛋白酸钠和乳清蛋白的多肽分子质量分布差异主要体现在1~5 kDa(占比16.2%~43.2%)和>10 kDa(占比30.2%~69.5%)的区间。胃消化结束时,1~5 kDa占比大小依次为:C∶W(0∶10) 在胃消化结束时,不同比例的酪蛋白酸钠和乳清蛋白的游离氨基酸含量如图4-c所示。游离氨基酸含量越高,表明蛋白降解程度更高。胃消化结束时,释放的游离氨基酸含量依次为:C∶W(0∶10) 在胃消化过程中,蛋白水解会产生游离氨基、小分子肽段和游离氨基酸。相比全酪蛋白酸钠,乳清蛋白较难被胃蛋白酶水解,这可能与乳清蛋白的空间结构特性有关。具体而言,乳清蛋白的分子质量较大,且其紧密的空间结构可能限制了胃蛋白酶对其内部关键水解位点的接近[25]。此外,乳清蛋白中可能含有某些特定的氨基酸序列或结构域,这些结构可能对胃蛋白酶的活性具有抑制作用[26]。 在肠消化过程中,不同比例酪蛋白酸钠与乳清蛋白产生的游离氨基含量如图5-a所示。随着肠消化的进行,6组蛋白样品的游离氨基含量均逐渐增加。最终,游离氨基含量从小到大依次为:C∶W(10∶0) a-游离氨基含量;b-多肽分子质量分布;c-游离氨基酸含量 图5 不同比例酪蛋白酸钠与乳清蛋白肠消化物中游离氨基含量、多肽分子质量分布及游离氨基酸含量 在肠消化结束时,不同比例酪蛋白酸钠与乳清蛋白的多肽分子质量分布如图5-b所示。肠消化结束后(120 min),不同比例样品的多肽分子质量主要分布在<0.5、0.5~1、>1~5和>5 kDa 4个范围。6组蛋白消化物中的多肽分子质量分布<0.5 kDa 的占比均最大(占比84.9%~94.0%),<0.5 kDa的占比大小依次为:C∶W(10∶0) 在肠消化结束时,不同比例酪蛋白酸钠与乳清蛋白的游离氨基酸含量如图5-c所示。肠消化结束时,游离氨基酸含量依次为:C∶W(10∶0) 在肠消化阶段,相较于高比例酪蛋白酸钠,高比例乳清蛋白的降解速度更快。蔡有余等[9]的研究表明,乳清蛋白在胃中迅速溶解,形成较小的乳凝块,这使得其能够更快地通过胃进入小肠,并在小肠中被快速水解为氨基酸和肽段。 随着年龄的增长,老年人的机体逐渐表现出一系列健康问题,包括骨质疏松、氧化应激和慢性炎症等。酪蛋白和乳清蛋白在消化降解过程中会产生具有生物学功能的肽段和氨基酸,它们能够促进钙的吸收、发挥抗氧化作用以及抑制炎症反应[27]。酪蛋白和乳清蛋白的配比使用,可为老年营养食品的功能性设计提供了科学支撑,多方面满足老年人的营养和健康需求。 不同比例的酪蛋白酸钠和乳清蛋白消化物的钙生物利用度情况如图6-a所示。6组的钙生物利用度都达到70%以上,且随着酪蛋白酸钠比例增加,钙生物利用度逐渐增加。相比于乳清蛋白,酪蛋白酸钠是磷酸化蛋白,它的钙结合能力更强[28]。 a-钙生物利用度;b-抗炎;c-ABTS阳离子自由基清除率;d-DPPH自由基清除率 图6 不同比例酪蛋白酸钠与乳清蛋白消化物的钙生物利用度、抗炎及抗氧化能力 不同比例的酪蛋白酸钠和乳清蛋白消化物的SIRT-1酶激活情况如图6-b所示。6组的SIRT-1酶活性都高于1,即SIRT-1酶为激活状态。根据文献报道[29],SIRT-1酶活性越强,抗炎能力越强。其中C∶W(10∶0)和C∶W(8∶2)组消化物刺激的SIRT-1酶活性显著高于其他4组,且C∶W(6∶4)、C∶W(4∶6)、C∶W(2∶8)和C∶W(0∶10)这4组对应的酶活性强度依次递减。研究发现,酪蛋白酸钠的胰蛋白酶消化物中存在氨基酸长肽DMPIQAFLLYQEPVLGPVR,可以通过抑制NF-κB通路而显示出抗炎的作用,乳清蛋白中的Asp-Tyr-Lys-Lys-Tyr和 Asp-Gln-Trp-Leu等多肽也具有抗炎活性[27]。 不同比例的酪蛋白酸钠和乳清蛋白消化物的抗氧化情况如图6-c和图6-d所示。6组的ABTS阳离子自由基和DPPH自由基清除率分别在79%和64%以上,表明6组消化物均有一定的抗氧化能力,且随着乳清蛋白比例增加,自由基清除率也随之增加。在胃肠消化过程中,蛋白被分解为一些具有抗氧化能力的氨基酸和小肽段,如色氨酸和丙氨酸-谷氨酰胺[30]。此外,有研究表明,乳清蛋白的色氨酸含量显著高于酪蛋白酸钠,这可能是其抗氧化能力更强的重要原因[31]。 酪蛋白和乳清蛋白在消化过程中被蛋白酶水解,可释放出具有抗炎症和抗氧化等多种生理功能的活性肽[32]。肽段的氨基酸序列对其生物活性有重要影响。例如,含有芳香族氨基酸(如酪氨酸)和脂肪族氨基酸残基(如亮氨酸)的肽段可通过促进自由基交换来增强抗氧化活性[33]。此外,某些肽段的C末端含有Tyr-Pro-Gly结构,这可进一步增强其抗氧化能力[33]。这些具有抗炎症和抗氧化功能的活性肽,可通过影响SIRT-1相关的信号通路(如NF-κB和MAPK)来实现其功能特性[34]。 本研究采用老年体外消化模型,研究了不同比例酪蛋白酸钠与乳清蛋白的消化情况及其消化产物的抗炎和抗氧化能力。结果表明,从消化情况来看,在胃消化阶段,酪蛋白比例越高,游离氨基释放速度越快;而在肠消化阶段,乳清蛋白比例越高,游离氨基释放速度越快。在生物活性功能方面,高比例酪蛋白酸钠的消化产物表现出更高的钙生物利用度和抗炎活性,而高比例乳清蛋白则表现出更强的抗氧化能力。研究发现,不同比例的酪蛋白酸钠与乳清蛋白显著影响了蛋白质的消化情况及其消化产物的功能特性。这些发现表明,通过调节酪蛋白酸钠与乳清蛋白的比例,可以针对性地优化蛋白消化特性和生物活性功能,从而开发出满足不同需求的老年蛋白粉产品,为老年人营养支持提供了新的依据。然而,体外模型与体内真实情况仍存在差异,如胃酸分泌水平、酶活性变化、胃排空时间、个体差异等,这些因素也可能影响消化过程、以及消化物的生物活性。未来可采用动物模型和老年人群进行验证,以增强结果的实践指导意义。 [1] KAROUI R, BOUAICHA I.A review on nutritional quality of animal and plant-based milk alternatives:A focus on protein[J].Frontiers in Nutrition, 2024, 11:1378556. [2] ANTONOV Y A, MOLDENAERS P, CARDINAELS R.Complexation of lysozyme with sodium caseinate and micellar casein in aqueous buffered solutions[J].Food Hydrocolloids, 2017, 62:102-118. [3] LIN L, OH H E, DEETH H C, et al.The effects of casein and whey proteins on the rheological properties of calcium-induced skim milk gels[J].International Dairy Journal, 2021, 113:104893. [4] MANSINHBHAI C H, SAKURE A, MAURYA R, et al.Significance of whey protein hydrolysate on anti-oxidative, ACE-inhibitory and anti-inflammatory activities and release of peptides with biofunctionality:An in vitro and in silico approach[J].Journal of Food Science and Technology, 2022, 59(7):2629-2642. [5] PHOSANAM A, CHANDRAPALA J, HUPPERTZ T, et al.In vitro digestion of infant formula model systems:Influence of casein to whey protein ratio[J].International Dairy Journal, 2021, 117:105008. [6] MULET-CABERO A I, TORCELLO-G [7] AGOSTONI C, BRESSON J L, FAIRWEATHER-TAIT S, et al. Scientific opinion on dietary reference values for protein[J]. EFSA Journal, 2010, 3(8): 1462. [8] ROGERI P S, ZANELLA R, MARTINS G L, et al.Strategies to prevent sarcopenia in the aging process:Role of protein intake and exercise[J].Nutrients, 2022, 14(1):52. [9] 蔡有余, 艾真, 孙海岚.活性乳清蛋白因子在恶性肿瘤治疗中的应用进展[J].中国肿瘤, 2015, 24(12):1026-1030.CAI Y Y, AI Z, SUN H L.Progress in application of whey protein concentrate in the treatment for malignancies[J].China Cancer, 2015, 24(12):1026-1030. [10] LEYH S M, WILLINGHAM B D, BAUR D A, et al.Pre-sleep protein in casein supplement or whole-food form has no impact on resting energy expenditure or hunger in women[J].The British Journal of Nutrition, 2018, 120(9):988-994. [11] LEE S, JO K, JEONG H G, et al.Understanding protein digestion in infants and the elderly:Current in vitro digestion models[J].Critical Reviews in Food Science and Nutrition, 2023, 63(7):975-992. [12] WANG K Y, LIU D S, TAO X M, et al.Decalcification strongly affects in vitro gastrointestinal digestion of bovine casein micelles under infant, adult and elderly conditions[J].Food Hydrocolloids, 2023, 139:108515. [13] MELCHIOR S, MORETTON M, ALONGI M, et al.Comparison of protein in vitro digestibility under adult and elderly conditions:The case study of wheat, pea, rice, and whey proteins[J].Food Research International, 2023, 163:112147. [14] YE A Q, LIU W L, CUI J, et al.Coagulation behaviour of milk under gastric digestion:Effect of pasteurization and ultra-high temperature treatment[J].Food Chemistry, 2019, 286:216-225. [15] GONG X, HUI X D, WU G, et al.In vitro digestion characteristics of cereal protein concentrates as assessed using a pepsin-pancreatin digestion model[J].Food Research International, 2022, 152:110715. [16] BAVARO S L, MAMONE G, PICARIELLO G, et al.Thermal or membrane processing for Infant Milk Formula:Effects on protein digestion and integrity of the intestinal barrier[J].Food Chemistry, 2021, 347:129019. [17] ZHANG J, LIU D S, XIE Y Q, et al.Gastrointestinal digestibility of micellar casein dispersions:Effects of caprine vs bovine origin, and partial colloidal calcium depletion using in vitro digestion models for the adults and elderly[J].Food Chemistry, 2023, 416:135865. [18] MU G Q, GAO Y, TUO Y F, et al.Assessing and comparing antioxidant activities of lactobacilli strains by using different chemical and cellular antioxidant methods[J].Journal of Dairy Science, 2018, 101(12):10792-10806. [19] SALEE N, CHAIYANA W, ANUCHAPREEDA S, et al.Co-extract of green tea and black rice:Incremental effect of antioxidant and anti-inflammatory properties and their freeze-dried double emulsion encapsulated powder[J].International Journal of Food Science &Technology, 2024, 59(10):7550-7559. [20] RAAK N, JAROS D, ROHM H.Acid-induced gelation of enzymatically cross-linked caseinates:Small and large deformation rheology in relation to water holding capacity and micro-rheological properties[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2021, 619:126468. [21] LI S Q, DIXIT Y, REIS M M, et al.Movements of moisture and acid in gastric milk clots during gastric digestion:Spatiotemporal mapping using hyperspectral imaging[J].Food Chemistry, 2024, 431:137094. [22] MENNAH-GOVELA Y A, BORNHORST G M.Breakdown mechanisms of whey protein gels during dynamic in vitro gastric digestion[J].Food &Function, 2021, 12(5):2112-2125. [23] HUPPERTZ T, LAMBERS T T.Influence of micellar calcium phosphate on in vitro gastric coagulation and digestion of milk proteins in infant formula model systems[J].International Dairy Journal, 2020, 107:104717. [24] WANG Y, BAI H S, WANG S J, et al.Casein phosphopeptide-calcium chelate:Preparation, calcium holding capacity and simulated digestion in vitro[J].Food Chemistry, 2023, 401:134218. [25] ABRAHAMSE E, THOMASSEN G G M, RENES I B, et al.Gastrointestinal protein hydrolysis kinetics:Opportunities for further infant formula improvement[J].Nutrients, 2022, 14(7):1512. [26] B [27] GAO J, GONG H, MAO X Y.Dipeptidyl peptidase-IV inhibitory activity and related molecular mechanism of bovine α-lactalbumin-derived peptides[J].Molecules, 2020, 25(13):3009. [28] KRISHNANKUTTY NAIR P, CORREDIG M.Sodium caseinate hinders chymosin-induced aggregation of caseins in concentrated milk:The role of soluble caseins and calcium ions[J].JDS Communications, 2021, 2(6):309-312. [29] MULERO M C, HUANG D B, NGUYEN H T, et al.DNA-binding affinity and transcriptional activity of the RelA homodimer of nuclear factor κB are not correlated[J].The Journal of Biological Chemistry, 2017, 292(46):18821-18830. [30] CUI L, YANG G, LU S Y, et al.Antioxidant peptides derived from hydrolyzed milk proteins by Lactobacillus strains:A BIOPEP-UWM database-based analysis[J].Food Research International, 2022, 156:111339. [31] WU Y L, YAN Y L, XIONG X, et al.Effect of different ratios of α-lactalbumin to β-casein in infant formula on true ileal digestibility and intestinal morphology of suckling piglets[J].Journal of Agricultural and Food Chemistry, 2025, 73(10):6144-6150. [32] KIM D Y, YOO J S, CHO Y A, et al.Biological potential of novel specific casein-derived peptides[J].Journal of Dairy Science and Biotechnology, 2021, 39(1):36-50. [33] ELFAHRI K.Anticarcinogenic peptides released from milk proteins by Lactobacillus strains [D].Victoria:Victoria University, 2018. [34] DINICOLANTONIO J J, MCCARTY M F, O’KEEFE J H.Nutraceutical activation of Sirt1:A review[J].Open Heart, 2022, 9(2):e002171.
Fig.1 Morphology of clot in gastric digesta of sodium caseinate and whey protein mixed at different ratios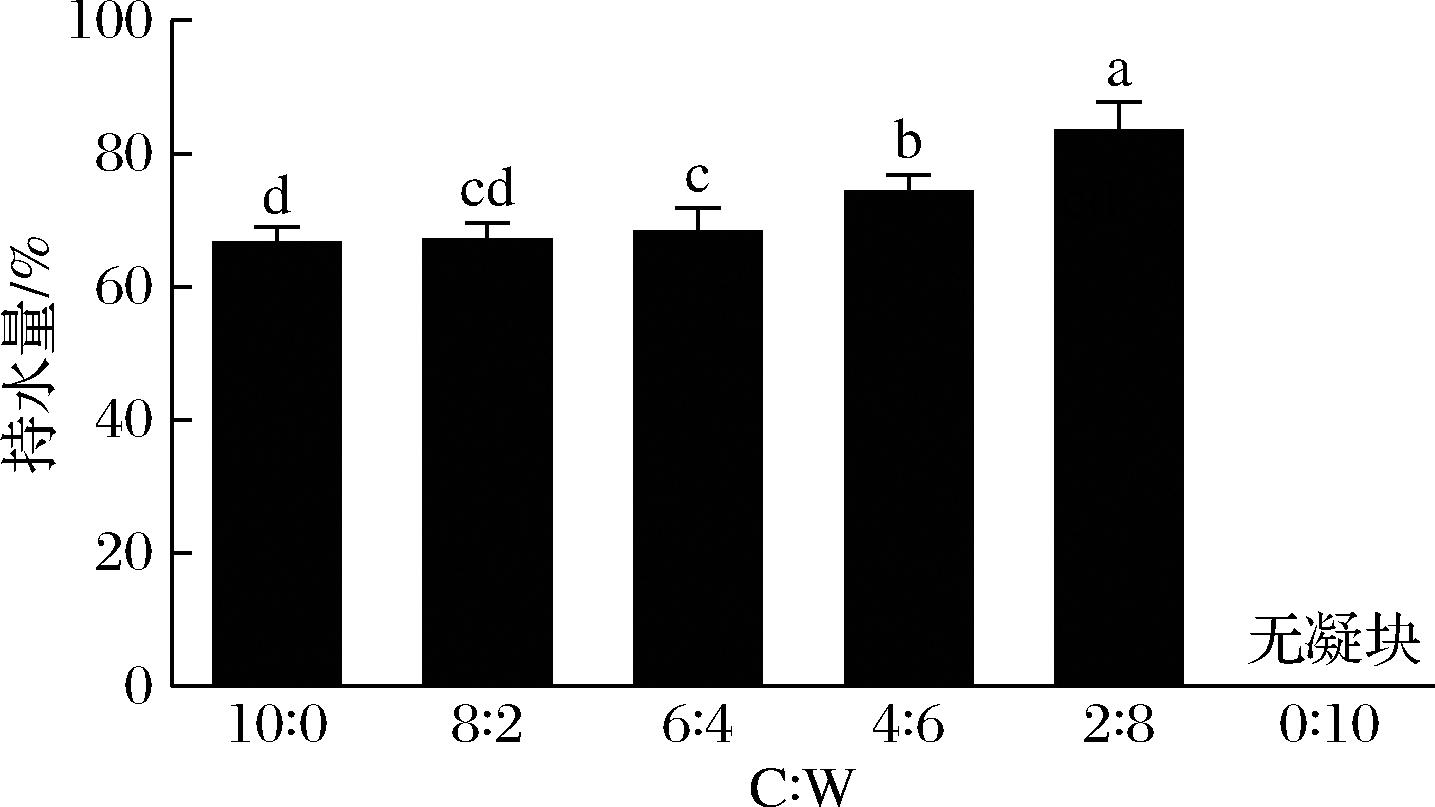
Fig.2 Water holding capacity of clots in gastric digesta of sodium caseinate and whey protein mixed at different ratios2.2 胃消化蛋白的降解
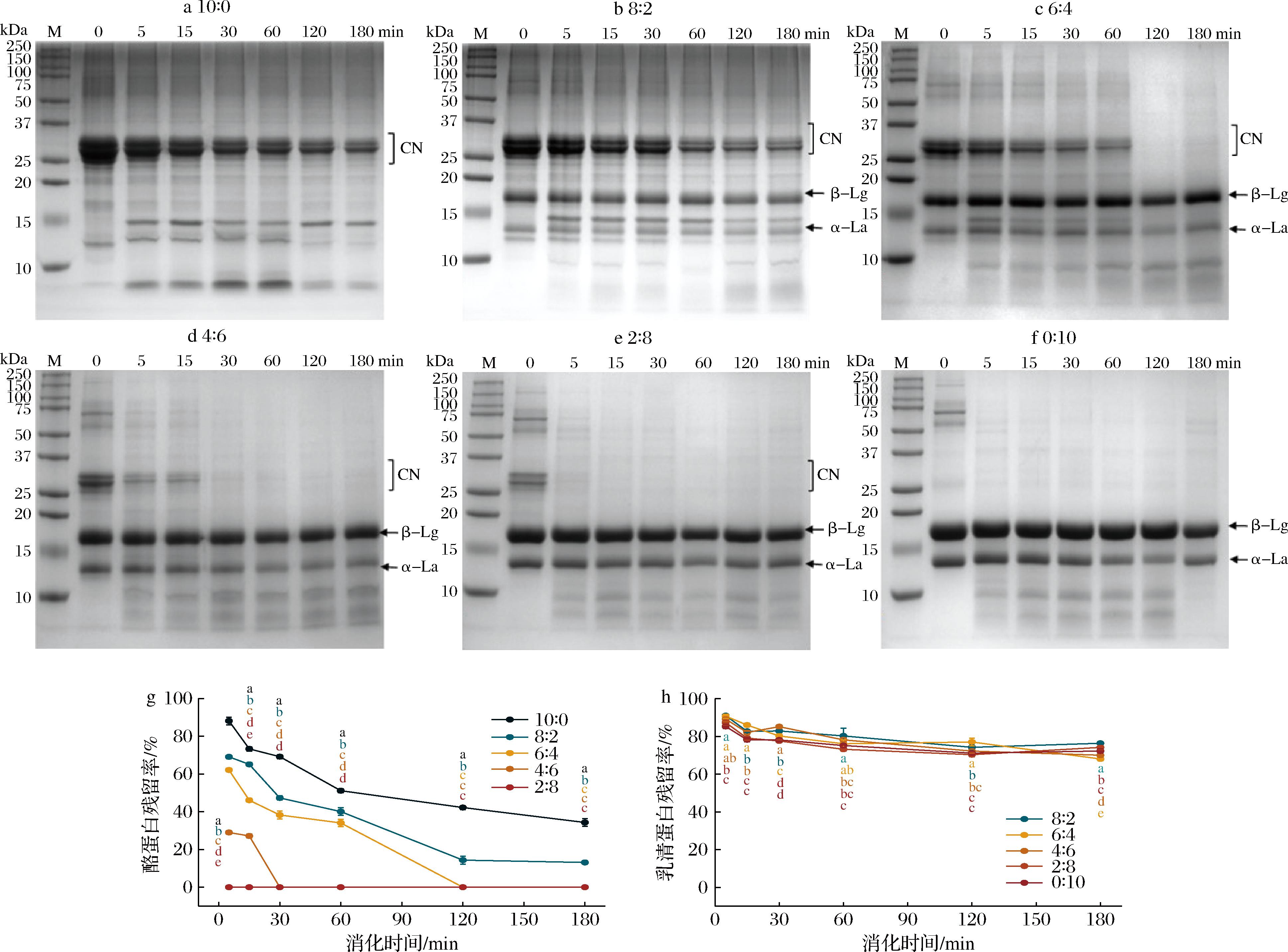
Fig.3 SDS-PAGE plots of gastric digesta of sodium caseinate and whey protein mixed at different ratios and percentage of remaining sodium caseinate and whey protein2.3 胃消化游离氨基、多肽分子质量分布和游离氨基酸的变化
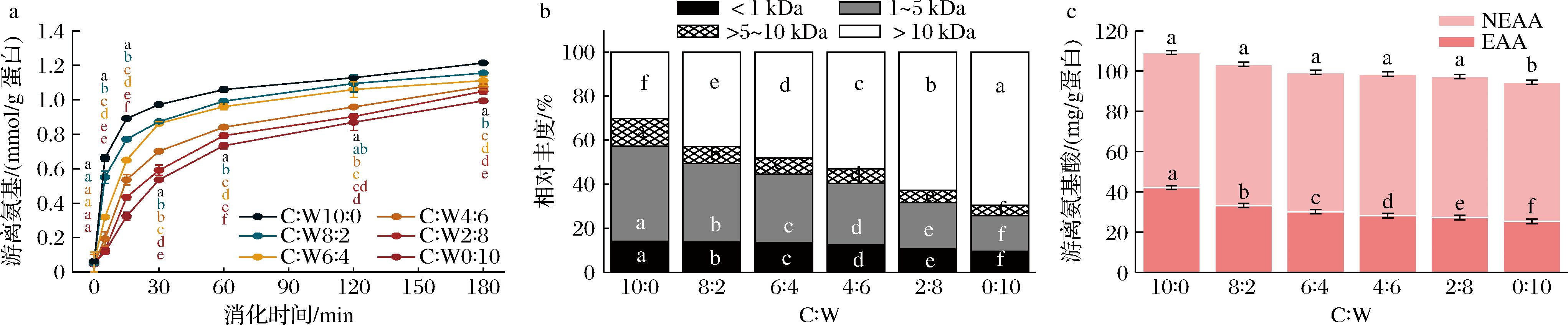
Fig.4 Free amino content, peptide molecular weight distribution and free amino acid content of gastric digesta of sodium caseinate and whey protein mixed at different ratios2.4 肠消化游离氨基、多肽分子质量分布和游离氨基酸的变化
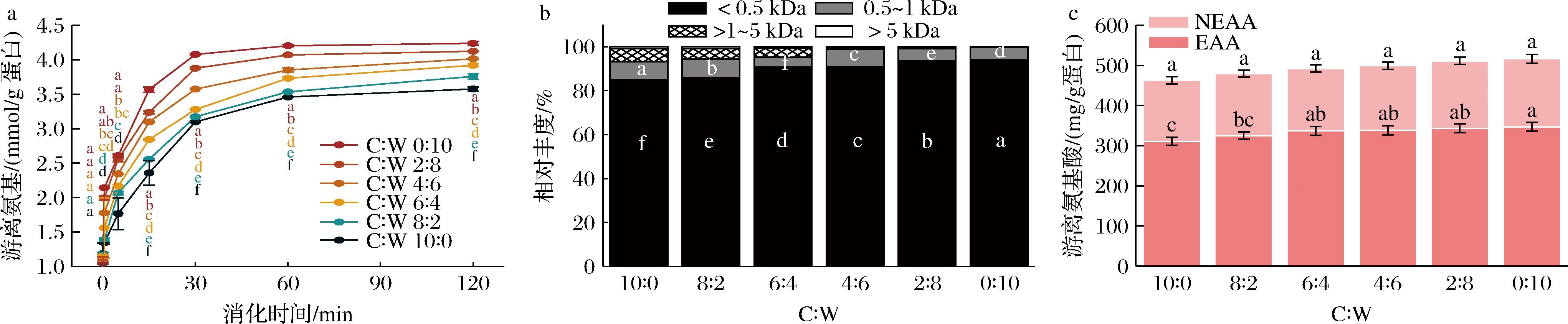
Fig.5 Free amino content, peptide molecular weight distribution and free amino acid content in intestinal digesta of sodium caseinate and whey protein mixed at different ratios2.5 消化物的钙生物利用度、抗炎能力和抗氧化能力
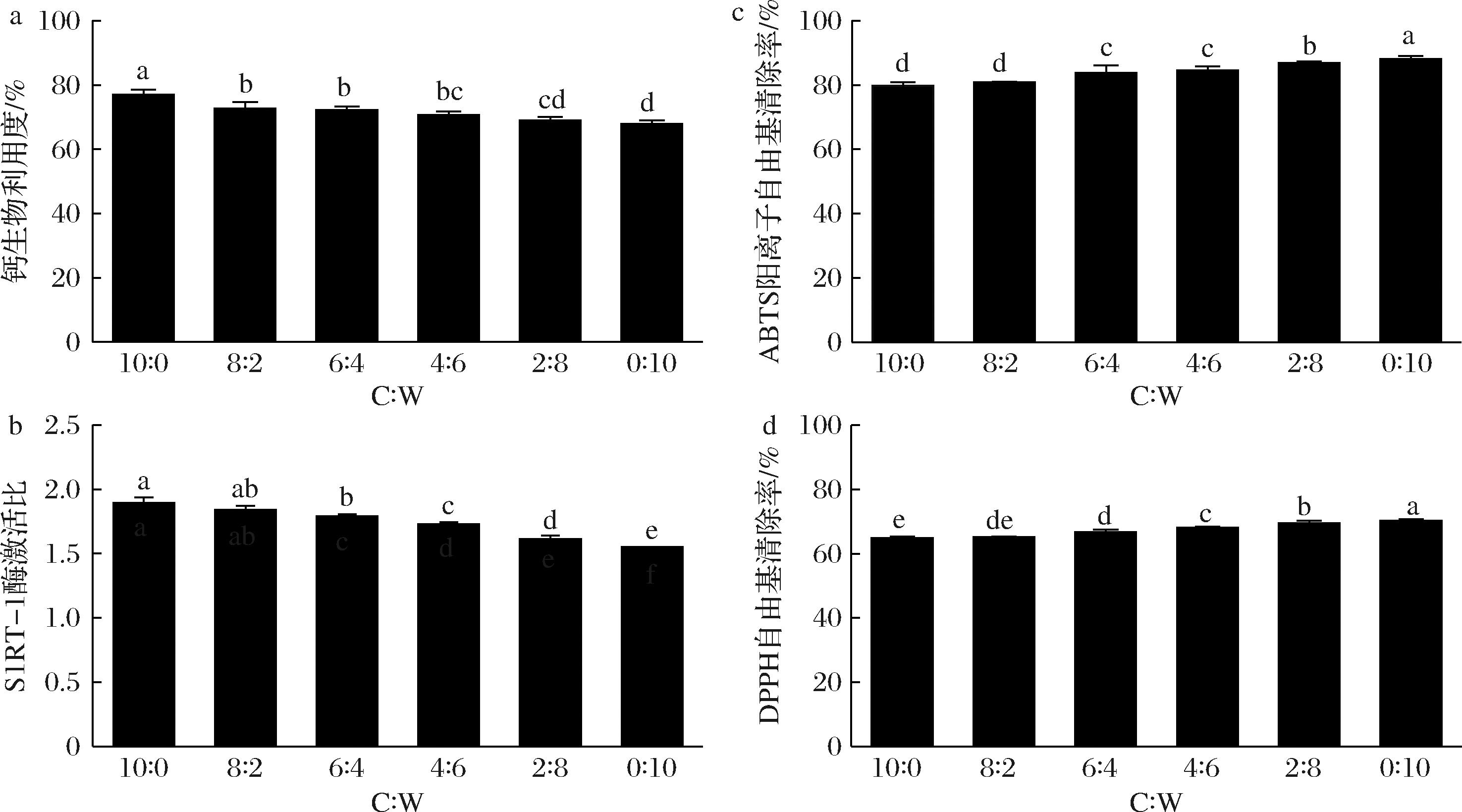
Fig.6 Calcium bioaccessibility, anti-inflammation and antioxidation capacity of digesta of sodium caseinate and whey protein mixed at different ratios3 结论与讨论
 MEZ A, SAHA S, et al.Impact of caseins and whey proteins ratio and lipid content on in vitro digestion and ex vivo absorption[J].Food Chemistry, 2020, 319:126514.
MEZ A, SAHA S, et al.Impact of caseins and whey proteins ratio and lipid content on in vitro digestion and ex vivo absorption[J].Food Chemistry, 2020, 319:126514. EZ J, FERN
EZ J, FERN NDEZ-FERN
NDEZ-FERN NDEZ A M, TIRONI V, et al.Identification and characterization of antioxidant peptides obtained from the bioaccessible fraction of α-lactalbumin hydrolysate[J].Journal of Food Science, 2021, 86(10):4479-4490.
NDEZ A M, TIRONI V, et al.Identification and characterization of antioxidant peptides obtained from the bioaccessible fraction of α-lactalbumin hydrolysate[J].Journal of Food Science, 2021, 86(10):4479-4490.