菊苣(Cichorium intybus L.),是菊科多年生草本植物,研究表明菊苣具有广泛的药理作用,包括抗炎、抗氧化、抗糖尿病、抗高血压、降血糖等作用[1],具有重要的药用价值,其功能性成分主要有生物碱、酚酸、倍半萜内酯、脂肪族化合物及其衍生物、挥发油、抗氧化剂等[2]。其提取物——菊苣多糖(Cichorium intybus polysaccharides, CIP)含有低聚糖和多糖,属于非消化性碳水化合物,作为一种膳食纤维[3],它是目前认知度最高、市场最大、发展领域最广的天然水溶性膳食纤维,在改善肠道内环境、缓解肥胖、预防肿瘤、促进矿物质吸收利用等方面发挥显著功效[4-5]。CIP作为益生元,具有促进维生素、微量元素的吸收以及调节肠道菌群、增强胃肠道功能等作用,在功能性食品和营养补充剂的开发中具有广泛的应用前景。
消化涉及通过机械和化学机制将大颗粒或不溶性食物分子分解成可被身体吸收的较小可溶性部分[6]。体外模型不仅可以整体模拟体内口腔、胃和小肠的消化以及大肠的发酵过程,而且具有价格低廉、简单通用、取样方便、结果可重现性好等优点,它们可预测物质组成、结构与消化特性之间的关系,可评价生物利用度和消化代谢产物对胃肠道健康的影响[7-8]。但当前CIP在功能乳品中的应用及其功能特性在消化过程中的变化需深入研究。本研究旨在利用体外消化-发酵模型系统评估CIP强化益生菌发酵乳的功能特性。该模型允许对消化过程及肠道微生物群的后续发酵进行控制和详细分析。
益生菌发酵乳因其对肠道健康的积极作用而受到广泛关注,益生菌在改善宿主肠道微生态平衡、提高宿主健康水平和健康状态等方面发挥有益作用[9]。CIP与发酵乳中益生菌间的相互作用及其对健康结果的综合影响尚未得到充分研究。本研究通过评估CIP强化益生菌发酵乳消化前后的抗氧化和降糖活性,发酵后代谢产物短链脂肪酸(short-chain fatty acids,SCFAs)及对肠道微生物群组成和多样性的影响,为开发具有增强健康益处的功能性乳制品提供新策略,还将为开发针对代谢健康和肠道微生物群调节的新型功能性食品提供科学依据,推动其在食品发酵产业中的广泛应用和发展[10]。
1 材料与方法
1.1 材料与试剂
CIP,纯度(90.5±0.02)%,L-半胱氨酸盐酸盐、氯化血红素、维生素C、维生素K1,上海如吉生物科技发展有限公司;牛奶,鞍钢实业集团乳业;商业复合型酸奶发酵剂YoFlex® YF-L812(Streptococcus thermophilus、Lactobacillus delbrueckii subsp. bulgaricus)用于益生菌发酵乳制备, 丹麦Chr. Hansen A/S;无水乙酸钠,MgSO4·7H2O,天津市大茂化学试剂厂;吐温80,北京鼎国昌盛生物技术有限责任公司;无水乙醇,国药集团化学试剂有限公司;NaCl、CaCl2、KCl、NaHCO3、K2HPO4、KH2PO4,沈阳市新化试剂厂;p-硝基苯基α-D-吡喃葡萄糖苷(p-nitrophenyl-α-D-glucopyranoside,p-NPG),上海源叶生物科技有限公司;α-淀粉酶、胃蛋白酶、胰蛋白酶、胆汁盐、胰酶,均为生物试剂,上海瑞永生物科技有限公司;刃天青、短链脂肪酸检测试剂盒,北京索莱宝科技有限公司。
1.2 仪器与设备
DH3600电热恒温培养箱,上海一恒科学仪器有限公司;BBS-DDC超净工作台,苏州安泰空气技术有限公司;UV-2550紫外分光光度计,日本岛津企业管理(中国)有限公司;1100高效液相色谱仪、7890A-5975C气相色谱-质谱联用仪,安捷伦科技(中国)有限公司;CR21N高速冷冻离心机,日立高新技术(上海)国际贸易有限公司;PHSJ-4F pH计,上海仪电科学仪器股份有限公司;TD5Z常温板式离心机,上海卢湘仪离心机仪器有限公司;Pico17常温微型离心机,赛默飞世尔科技(中国)有限公司;Tissuelyser-48组织研磨仪,上海净信实业发展有限公司;H-SWX-600BS恒温水浴锅,上海新苗医疗器械制造有限公司;IMAG-96P 96孔超强磁力板,康宁生命科学(吴江)有限公司;NanoMagBio S-96 96孔核酸提取仪,上海闪谱生物科技有限公司。
1.3 实验方法
1.3.1 CIP益生菌发酵乳的制备
本研究通过制备含质量分数0%(空白对照)、0.9%(低剂量组)和1.6%(高剂量组)CIP的益生菌发酵乳,探究其对发酵过程及产品特性的影响。向100 mL牛奶中分别添加对应比例CIP并混合均匀,经85 ℃巴氏灭菌10 min后冷却至42 ℃,接种1 g商业酸奶发酵剂充分混匀,于42 ℃恒温发酵8 h,最终在4 ℃条件下后熟24 h,制得不同浓度CIP的益生菌发酵乳样品,用于后续体外消化特性、抗氧化与降糖活性及肠道菌群调控作用的综合评估[11]。
1.3.2 CIP益生菌发酵乳体外消化处理
1.3.2.1 模拟胃消化
参考FANG等[12]的方法,配制胃液电解质溶液和模拟胃液(simulated gastric fluid, SGF),并进行胃液消化实验。取10 mL发酵乳样品与10 mL SGF混合,37 ℃、pH 2.0孵育。分别于0、0.5、1、1.5、2 h取样,100 ℃灭活5 min,10 000×g离心10 min,上清液与全残渣混合物在-20 ℃避光保存。
1.3.2.2 模拟肠消化
小肠液电解质溶液配制、模拟小肠液(simulated intestinal fluid,SIF)制备及小肠消化实验参考WU等[13]的方法,并稍作调整。取胃消化结束(2 h)灭活离心后的上清液10 mL,与10 mL SIF混合,37 ℃、pH 7.5孵育。分别于0、1、2、3、4 h取样,同法灭活离心,上清液与全残渣混合物在-20 ℃避光保存。
1.3.3 体外模拟胃肠道消化液的抗氧化特性测定
取1.3.2节中各时间点收集的体外模拟消化上清液,进行抗氧化特性测定
1.3.3.1 DPPH自由基清除能力的测定
根据TARANNUM等[14]的方法进行修改。配制成40 μg/mL DPPH溶液(无水乙醇作为溶剂),分别取2 mL 的CIP发酵乳消化液加入3 mL的DPPH溶液,静置30 min,在517 nm处测定吸光度,以维生素C(20 μg /mL)为阳性对照。DPPH自由基清除率按公式(1)计算:
清除率![]()
(1)
式中:A0,空白对照的吸光值;AX,加样品的吸光值;AX0,样品+无水乙醇(不含DPPH)组吸光值。
1.3.3.2 ABTS阳离子自由基清除能力的测定
根据ZHANG等[15]的方法进行修改。配制ABTS自由基工作液(水作为溶剂,使其在734 nm 下的吸光度为0.7±0.02,分别取2 mL CIP发酵乳消化液加入2 mL ABTS溶液中,避光静置10 min,在734 nm处测定吸光度,ABTS工作液与等体积消化液(不含ABTS)为空白对照组,以维生素C(20 μg /mL)为阳性对照。ABTS阳离子自由基清除率按公式(2)计算:
清除率![]()
(2)
式中:A0,空白对照的吸光值;AX,加样品的吸光值;AX0,消化液+无水乙醇(不含ABTS)组吸光值。
1.3.3.3 羟自由基(·OH)清除能力的测定
根据梁金月等[16]的方法进行修改。在避光条件下,分别取2 mL CIP消化液,各管分别加入0.1 mL 6 mmol/L FeSO4和0.1 mL 6 mmol/L的H2O2、1 mL 6 mmol/L水杨酸-乙醇溶液,摇匀后,37 ℃水浴60 min,在510 nm波长下测定各反应溶液的吸光度,以维生素C(20 μg/mL)为阳性对照。·OH清除率按公式(3)计算:
清除率![]()
(3)
式中:A0,空白对照的吸光值;AX,加样品的吸光值;AX0,不加显色剂 H2O2的吸光值。
1.3.4 体外模拟胃肠道消化液的降糖特性测定
取1.3.2节中各时间点收集的体外模拟消化上清液,进行降糖特性测定。
1.3.4.1 α-淀粉酶抑制活性测定
根据李景恩等[17]的方法进行修改。取1 mL 2 U/mL α-淀粉酶溶液分别与1 mL各时间点收集的体外模拟消化上清液,37 ℃水浴加热10 min后,加入1 mL 20 mg/mL 的淀粉溶液,37 ℃水浴加热10 min,反应结束后,立即沸水浴灭活酶5 min,冷却至室温后,立即加入1 mL 3,5-二硝基水杨酸溶液显色,在530 nm处测定吸光度,以阿卡波糖(1 mg /mL)作为阳性对照。α-淀粉酶抑制率按公式(4)计算:
抑制率![]()
(4)
式中:A1,含样品、淀粉和α-淀粉酶的吸光值;A2,含样品、淀粉不含α-淀粉酶的吸光值;A3,含缓冲液不含样品的吸光值;A4,仅缓冲液、淀粉不含α-淀粉酶和样品的吸光值。
1.3.4.2 α-葡萄糖苷酶抑制活性测定
根据张慧慧等[18]的方法进行修改。分别取50 μL各时间点收集的体外模拟消化上清液加到96孔板中后,加入50 μL 1 U/mL α-葡萄糖苷酶溶液 (pH 6.8, 0.1 mol/L PBS 配制) 37 ℃水浴10 min。后加入80 μL 5 mmol/L p-NPG,37 ℃水浴15 min,冰水浴5 min后加100 μL 0.1 mol/L Na2CO3终止反应,于405 nm处测定吸光度,以阿卡波糖(1 mg/mL)为阳性对照。α-葡萄糖苷酶抑制率按公式(5)计算:
抑制率![]()
(5)
式中:A1,样品、酶和p-NPG的吸光度;A2,含样品、p-NPG和缓冲液代替酶液的吸光度;A3,含酶、p-NPG和缓冲液代替样品的吸光度;A4,仅有缓冲液和p-NPG的吸光度。
1.3.5 CIP益生菌发酵乳体外发酵处理
1.3.5.1 粪便的采集及培养基的制备
本研究经辽宁大学伦理委员会批准(EC-2023-XZ-011),所有参与者签署知情同意书。10名年龄为20~25岁、至少3个月未服用抗生素的健康志愿者提供粪便样本。将每名志愿者的5 g新鲜粪便样本与50 mL 100 g/L改良无菌生理盐水(半胱氨酸-HCl 0.5 g/L和NaCl 9.0 g/L)混匀,将悬液经4 ℃、500×g离心5 min去除大颗粒残渣,取上清液作为粪便接种物(含细菌悬浮液)。
1.3.5.2 模拟大肠发酵
基础培养基的配制参考CHEN等[19]的方法并稍作调整。具体配方为:2 g蛋白胨、2 g酵母提取物、0.1 g NaCl、0.04 g K2HPO4、0.04 g KH2PO4、0.01 g MgSO4·7H2O、2 g NaHCO3、0.01 g CaCl2·6H2O、0.02 g氯化血红素、0.5 g L-半胱氨酸盐酸盐、0.5 g胆汁盐、1 mg刃天青、2 mL吐温-80、10 μL维生素K1和100 mL蒸馏水,混合后在121 ℃灭菌15 min。
本实验设置了6组发酵条件。WB组:2.0 mL 未消化质量分数0% CIP发酵乳;WL组:2.0 mL 未消化质量分数0.9% CIP发酵乳;WH组:2.0 mL 未消化质量分数1.6% CIP发酵乳;IB组:2.0 mL 模拟胃肠消化后质量分数0% CIP全残渣混合物;IL组:2.0 mL 模拟胃肠消化后质量分数0.9% CIP全残渣混合物;IH组:2.0 mL 模拟胃肠消化后质量分数1.6% CIP全残渣混合物。向各组加1 mL粪便接种物和7 mL基础培养基,37 ℃避光厌氧发酵24 h。分别于0、6、12、24 h取样,-80 ℃保存。每组各时间点设3个独立发酵瓶(生物学重复)。
1.3.6 体外发酵过程中理化指标的测定
1.3.6.1 体外发酵液pH的测定
采用pH计测量发酵0、6、12、24 h的样品的pH。
1.3.6.2 总SCFAs的测定
用试剂盒检测发酵0、6、12、24 h样品的SCFAs含量;使用配有安捷伦HP-INNOWAX色谱柱的Agilent 7890A-5975C气质联用仪研究发酵过程中SCFAs含量的变化情况。载气(N2)流速1.2 mL/min,分流比为5∶1,进样口温度和检测温度为250 ℃,加热程序在100 ℃下保持5 min后以8 ℃/min的速度加热至260 ℃,持续10 min。样品体积为2 μL。
1.3.7 微生物分析
采用OMEGA Soil DNA Kit (D5625-01) (Omega Bio-Tek, Norcross, GA, USA)提取核酸。对基于16S rRNA基因测序的肠道微生物区系进行了分析。发酵24 h样品提取微生物基因组DNA,利用正向引物338F(5\′-ACTCCTACGGGAGGCAGCA-3\′) 和反向引物806R(5\′-GGACTACHVGGGTWTCTAAT-3\′)对细菌16S rRNA基因V3-V4区域进行PCR。使用Quant-iT PicoGreen dsDNA Assay Kit进行定量[10]。单个定量步骤后,扩增子等量汇集,在上海派森诺生物技术有限公司的Illumina NovaSeq机器上利用NovaSeq 6000 SP Reagent Kit (500 cycles)进行2×250 bp的双端测序。使用QIIME2 2019.4版本,并根据官方教程 (https://docs.qiime2.org/2019.4/tutorials/)进行修改和完善,对微生物组生物学信息进行分析。原始序列数据使用 demux 插件进行解码处理,cutadapt 插件进行引物切除,然后使用DADA2插件对序列进行质量过滤、去噪、拼接和嵌合体去除等数据处理。对上述获得的序列按100%的序列相似度进行归并,生成特征性序列ASVs以及丰度数据表格。原始测序数据已上传至美国国家生物技术信息中心(national center for biotechnology information, NCBI)下属的序列读取归档数据库(sequence read archive, SRA),BioProject编号为 PRJNA1281288。
1.4 数据处理与分析
所有实验结果均进行3次平行实验(技术重复),结果以“平均值±标准误差”来表示。实验数据和图表采用Excel 2020、SPSS 22、Origin 2020 和 GraphPad Prism 9 软件进行处理、统计分析和制作。肠道菌群测序数据的统计分析如1.3.7节所述。
2 结果与分析
2.1 抗氧化特性分析
DPPH自由基、ABTS阳离子自由基和·OH的清除能力是评估食品抗氧化活性的关键指标,能够反映样品中抗氧化成分在体外消化过程中对自由基的清除能力及其稳定性[20]。如图1所示,高剂量和低剂量CIP均显著提高了其在各消化阶段的抗氧化活性,尤以低剂量组的效果更为突出。

a-胃消化阶段DPPH自由基清除率;b-肠消化阶段DPPH自由基清除率;c-胃消化阶段ABTS阳离子自由基清除率;d-肠消化阶段ABTS阳离子自由基清除率;e-胃消化阶段·OH清除率;f-肠消化阶段·OH清除率
图1 CIP发酵乳体外消化过程中抗氧化活性
Fig.1 Antioxidant activities of CIP-fermented milk during in vitro digestion
注: *表示组间差异显著(P<0.05);**表示组间差异极显著(P<0.01)(下同)。
在胃消化阶段,低剂量组的DPPH自由基、ABTS阳离子自由基及·OH清除率分别达到(51.2±1.7)%、(61.5±1.8)%和(46.2±1.2)%;在肠消化阶段,分别升高至(67.9±2.1)%、(76.0±2.3)%和(59.1±1.7)%。相比之下,高剂量组在所有消化阶段对3类自由基的清除能力均显著较低(P<0.05)。这可能归因于低浓度条件下多糖分子更易分散,受消化酶作用后可释放更多具有生物活性的低聚糖和还原性基团。已有研究表明,多糖清除自由基的能力主要来自于其羟基和羧基[21]。本研究结果与上述报道一致,强调了多糖结构降解过程与抗氧化能力之间的密切联系。从动态时间看,自由基清除能力在胃消化2 h达到初步高峰,进入肠道阶段后,在胰酶、胆盐与益生菌代谢产物的共同作用下,抗氧化能力进一步增强。·OH清除趋势亦与DPPH自由基和ABTS阳离子自由基相似,说明CIP的抗氧化性能受分子结构可及性影响显著,且在低剂量条件下表现出更优的生物活性释放效果。
2.2 降糖特性分析
CIP在食品中的添加量与血糖生成指数调控密切相关[22],其通过抑制α-淀粉酶和α-葡萄糖苷酶活性,减缓糖类的消化速率。如图2所示,在胃消化与肠消化阶段,低剂量组和高剂量组的酶抑制能力均呈逐渐增强趋势。尤其在肠消化后期,低剂量组对α-淀粉酶与α-葡萄糖苷酶的抑制率分别达到78.6%与77.8%,显著高于阳性对照组(P<0.05)。尽管高剂量组的酶抑制率显著高于对照组,但整体效果低于低剂量组及阳性对照组。该现象可能源于低剂量CIP在消化环境中具有更优的分散性和酶结合可及性,更有效地暴露功能基团,从而增强对关键消化酶的抑制作用。上述结果与WEN等[23]研究相符,表明多糖类天然成分通过抑制消化酶活性延缓淀粉分解。综上,CIP在低剂量条件下,于肠道消化后期表现出显著的酶抑制效应,突显其作为功能性降糖成分在食品中的应用潜力。
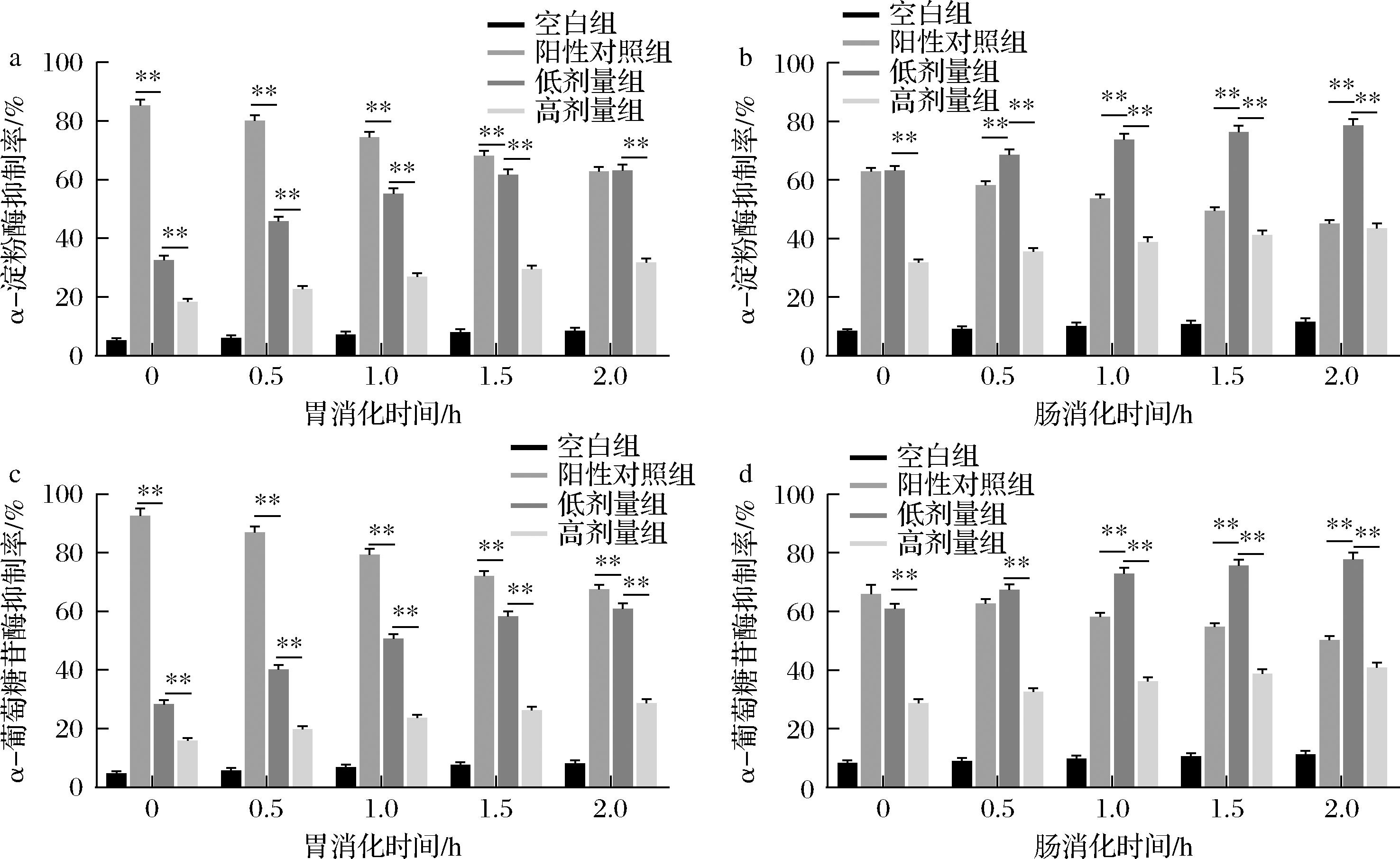
a-胃消化阶段α-淀粉酶抑制率;b-肠消化阶段α-淀粉酶抑制率;c-胃消化阶段α-葡萄糖苷酶抑制率;d-肠消化阶段α-葡萄糖苷酶抑制率
图2 CIP发酵乳体外模拟胃肠道消化过程中降糖特性的变化
Fig.2 Changes in α-amylase and α-glucosidase inhibitory activities of CIP fermented milk during simulated gastrointestinal digestion
2.3 体外发酵过程中理化指标的测定
SCFAs是微生物发酵膳食纤维的产物,是厌氧肠道菌群发酵膳食纤维、糖醇等的最终产物,SCFAs的含量变化还可以间接反映肠道微生物的活性。如图3所示,未消化组因发酵乳自带酸性,初始pH为(4.52±0.52),而消化组经胃肠处理后呈中性,初始pH为(7.02±0.07),随着发酵时间的延长,各组样品的pH值逐渐下降,与PUHLMANN等[24]研究结果一致。SCFAs含量逐步升高。添加CIP后,发酵产酸及SCFAs生成显著增强,未消化空白组(WB)在24 h时pH 为3.85,而低、高剂量CIP组(WL、WH)分别为3.25与3.06,降幅显著增加。结果表明,CIP 的加入加速了乳酸菌生长与代谢产酸过程,促进体系酸化;未消化空白组(WB)24 h时SCFAs为(38.0±2.5) mmol/L,而低、高剂量CIP组(WL、WH)分别达到(72.0±3.0)、(90.0±3.5) mmol/L,CIP添加使发酵乳在肠道环境中表现出更高的代谢潜能。在体外模拟消化体系中,SCFAs总量同样呈持续上升趋势。24 h时,已消化空白组(IB)为(45.0±3.0) mmol/L,而低、高剂量CIP 组(IL、IH)分别达到(85.0±4.5)、(88.0±5.0) mmol/L。CIP 添加使发酵乳在肠道环境中表现出更高的代谢潜能,可能通过为肠道菌群提供可发酵底物促进乙酸、丙酸及丁酸等SCFAs的合成。结果表明,CIP可显著促进肠道菌群产酸及SCFAs合成,经消化处理后底物利用率进一步提高,其发酵促进作用更加明显,显示出良好的益生潜力,与LU等[25]研究结果一致。在低剂量组中,24 h时IL相比未消化的WL提高了18.1%,显示消化显著提升其可发酵性。而在高剂量组中,IH反而略低于未消化的WH,呈2.2%的轻微下降,并不存在增幅。相比之下,高剂量组虽然整体产酸能力仍强,但消化后其SCFAs产量未超过对应未消化组,24 h低于WH组,这表明高剂量在消化后发酵效率有所下降,而低剂量对底物可利用性的提升更为明显。高剂量组效率减弱的原因可能涉及胃肠消化对部分活性菌群的影响、多糖结构改变导致的可利用性下降或代谢通路的调整[26]。CIP可提升底物的可发酵性,但其促发酵效果呈剂量依赖的差异:低剂量表现出更佳的SCFAs生成效率,而高剂量在消化后促进作用减弱,提示存在剂量优化空间。
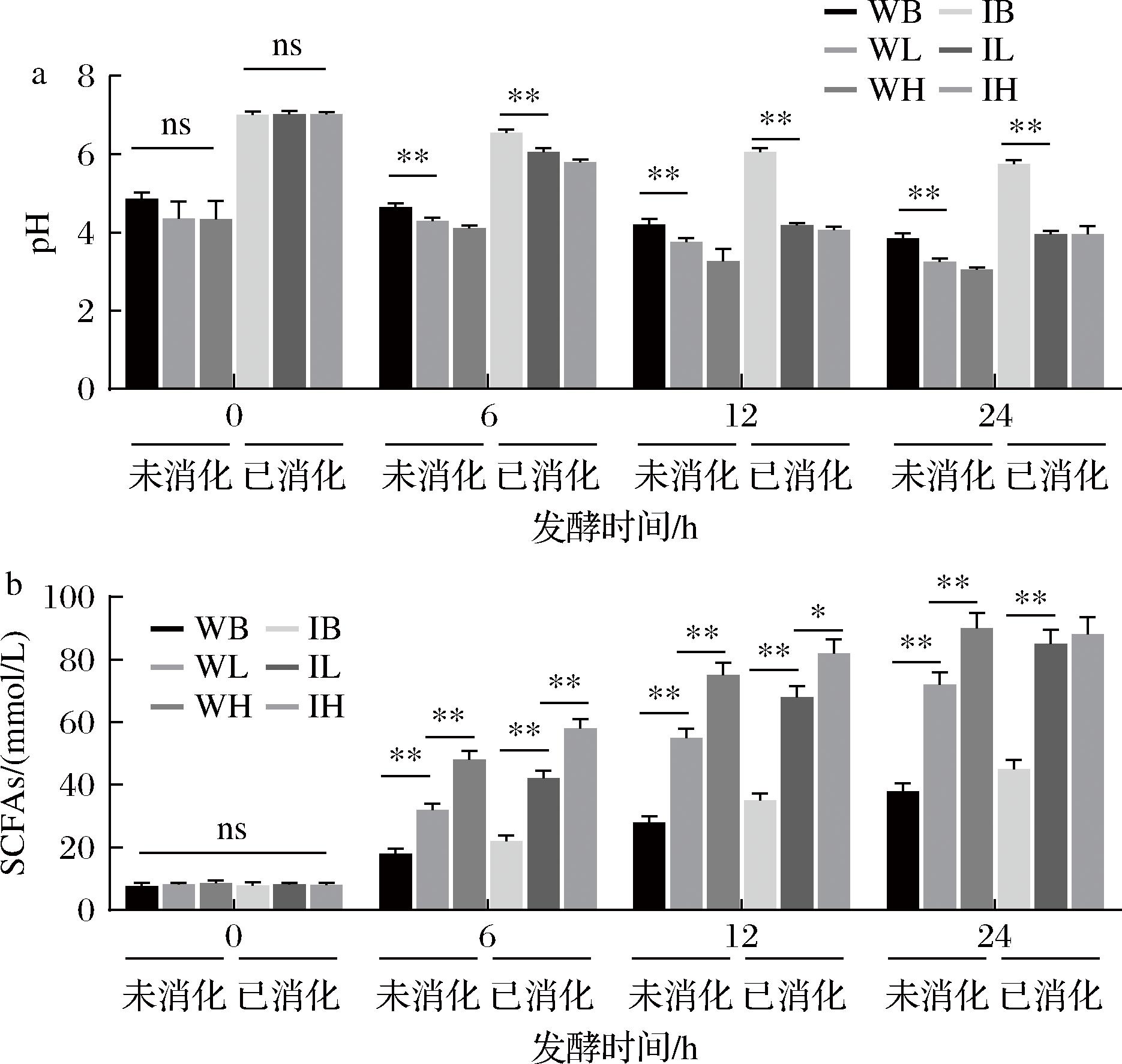
a-pH;b-总SCFAs含量
图3 发酵过程中pH与SCFAs动态变化
Fig.3 Dynamic changes in pH and SCFAs during in vitro fermentation
注:WB组为未消化空白组、WL为未消化低剂量组、WH为未消化高剂量组、IB为已消化空白组、IL为已消化低剂量组、IH为已消化高剂量组;ns表示组间无显著性差异(下同)。
2.4 体外发酵对肠道菌群 α、β 多样性的影响
如图4-a所示,各组样本的Good_coverage指数均高于99.92%,表明测序深度已充分覆盖群落物种的绝大多数,分析结果具代表性[27]。在Chao1指数方面,未消化样本中,随CIP添加量的增加,Chao1指数整体呈下降趋势,表明高剂量处理可能抑制了部分稀有菌种的生长,但各组间数据离散性减小,菌群组成趋于稳定。已消化样本中,低剂量组Chao1指数显著高于高剂量组,说明该剂量有助于维持较高的物种丰富度,促进常见益生菌属的生长。Shannon指数结果进一步支持上述结论,未消化组中,CIP的添加呈剂量依赖性地降低了菌群的多样性,推测原始菌群中部分敏感菌种受到多糖直接影响而减少。相较之下,已消化组低剂量组的Shannon指数最高,说明其在经历胃肠酶解与酸碱环境处理后,仍具备较强的群落多样性维持能力。Simpson指数分析结果显示,未消化组高剂量处理组的Simpson指数高于低剂量组,提示其群落优势菌占比增加、群落趋于单一。这可能与消化过程中CIP被部分降解,释放出具有益生元活性的低聚糖片段,从而激活常见益生菌属增殖有关。

a-α多样性指数;b-NMDS分析
图4 体外发酵对肠道菌群 α、β 多样性的影响
Fig.4 Effects of in vitro fermentation on α and β diversity of intestinal microbiota
图4-b为基于Bray-Curtis距离矩阵的非度量多维尺度分析(non-metric multidimensional scaling, NMDS)图,反映不同处理组间菌群结构的差异性与相似性[28]。点之间的距离代表菌群组成的差异程度,Stress=0.0821,说明图形拟合度良好,可有效用于群落结构差异的直观比较[29]。未消化组样本间的距离随多糖添加量升高而扩大,表明多糖含量对菌群结构的干预作用增强,可能通过选择性刺激或抑制特定微生物属导致菌群偏移。消化组中,低剂量组样本分布仍呈现较大结构多样性,说明其对菌群稳定性具有良好调节效果。综合α多样性与β多样性结果表明,低剂量CIP(质量分数0.9%)在体外消化及后续发酵过程中表现出更优的群落维持能力与调节作用,有助于维持肠道微生态平衡,为功能性发酵乳制品的配方优化提供理论依据。
2.5 发酵过程中肠道菌群组成多样性分析
2.5.1 肠道菌群分布及特异性分析
如图5所示,CIP的添加及体外消化处理均对菌群结构产生影响。6个处理组间共有62个操作分类单元(operational taxonomic units, OTUs),构成了样品的核心菌群。在未消化样品中,高剂量组(WH)特有OTUs 数量最多(169个),略高于空白组(WB,152个)和低剂量组(WL,145个),表明高浓度多糖在发酵阶段促进了部分菌株的选择性生长或代谢活化。经体外消化后,菌群结构明显重塑。低剂量组(IL)特有 OTUs数量显著增加(152个),明显高于消化对照组(IB,116个)与高剂量组(IH,12个),说明适量CIP在模拟胃肠环境下有助于维持群落多样性并促进新功能菌群形成。相反,高剂量消化组(IH)特有OTUs数量最少,提示过高多糖浓度可能增强选择性压力,导致特定菌群减少。综合来看,CIP的添加改变了肠道菌群OTUs的分布格局。低剂量处理可在维持核心菌群稳定的同时提升群落多样性和功能性,而高剂量添加则可能导致多样性下降与生态集中化效应。
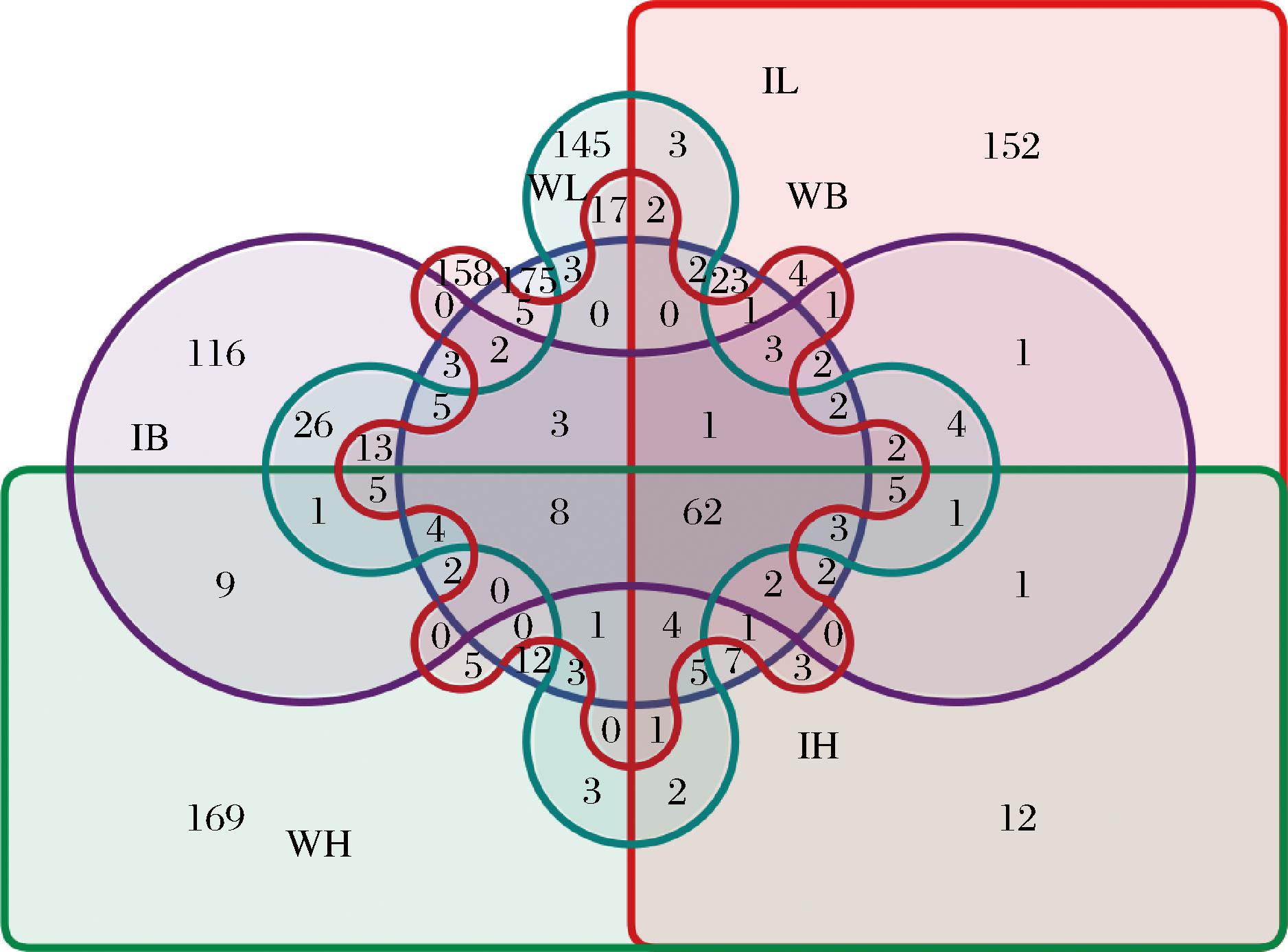
图5 肠道菌群OTUs分布及特异性分析Venn图
Fig.5 Venn diagram of distribution and specificity analysis of intestinal microbiota OTUs
2.5.2 肠道菌群结构组成分
如图6-a所示,整体上,厚壁菌门(Firmicutes)在所有组中均占主导地位,相对丰度均超过80%。在未消化组中,随着CIP添加量的增加,变形菌门(Proteobacteria)的相对丰度呈上升趋势,WH组中达到约15%,显著高于空白组WB(低于5%)。在已消化组中,该趋势更加明显,高剂量组(IH)Proteobacteria 丰度持续上升,表明其在模拟胃肠环境下更容易富集。放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)在各组中丰度较低,且未表现出明显的剂量相关变化。
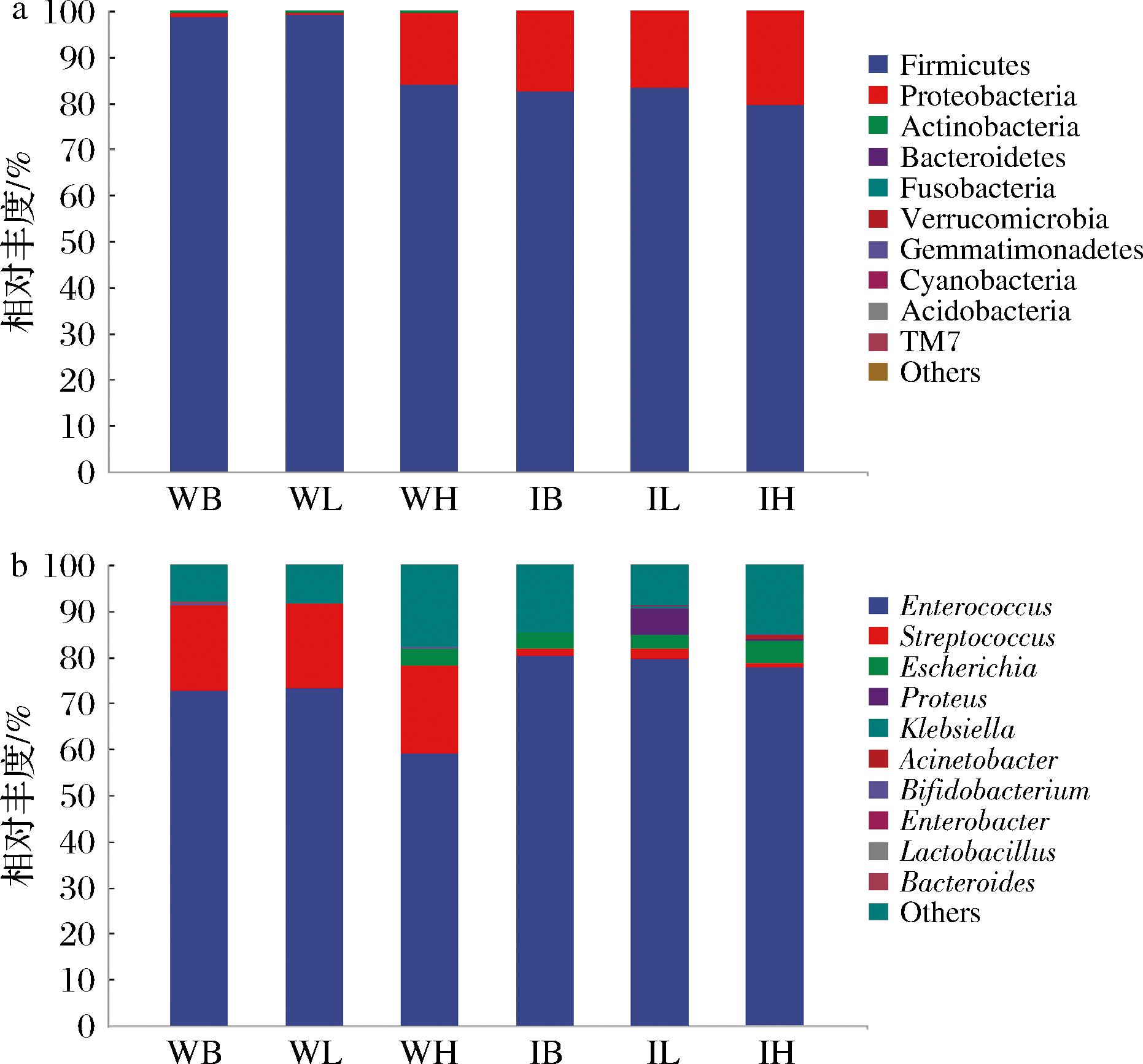
a-门水平;b-属水平
图6 肠道菌群门与属水平组成
Fig.6 Composition of gut microbiota at phylum and genus levels
注:仅显示相对丰度>1%的门属。
如图6-b 所示,未消化样品(WB、WL、WH)整体菌群组成稳定,主要以Enterococcus和Streptococcus为主。随着 CIP 浓度升高,后者比例略有上升,说明高浓度多糖可能促进部分嗜糖菌的生长。在模拟消化后样品中(IB、IL、IH),群落结构发生明显调整。低剂量组(IL)中,Proteus与Escherichia相对丰度出现一定上升,可能与多糖在消化过程中部分水解产生的可发酵底物和氨基酸代谢产物有关,为兼性厌氧菌提供了短期生长优势。与此同时,益生菌属(Lactobacillus与Bifidobacterium)仍保持一定比例,表明群落整体仍以有益菌为主导。高剂量组(IH)中菌群多样性略有下降,群落结构趋向集中,提示过量多糖可能导致选择性压力增加。
此现象反映了低剂量CIP在胃肠环境中能够释放更具选择性的益生元底物,调控菌群多样性与功能性,且在门、属2个水平均未造成显著“过度富集”或单一菌群偏移的现象。相比之下,高剂量组虽然促进了某些益生菌属的富集,但整体群落结构呈现多样性下降、优势菌属单一的趋势,提示高浓度CIP可能存在“过度干预”微生态稳态的风险,低剂量组可能更利于肠道稳态的维持。
2.6 肠道菌群物种组成成分分析
如图7-a所示,“是否消化”对肠道菌群结构具有显著影响。在已消化的3组中,低剂量组(IL)与空白组(IB)之间菌群结构相近,而高剂量组(IH)与其他2组差异较大,表明高剂量CIP可能引起菌群结构的重塑。在未消化组中,低剂量组(WL)同样与空白组(WB)聚类关系更近,而高剂量组(WH)则显示出较高的群落分化程度,推测多糖含量升高增强了对菌群多样性的调节效应[30]。右图展示了各组在属水平上相对丰度排名前十的微生物组成。整体来看,肠球菌属(Enterococcus)和链球菌属(Streptococcus)在各组中占比较高。已消化组的菌群丰度普遍优于未消化组,尤其是低剂量组(IL),其表现出较丰富的常见益生菌群,包括双歧杆菌属(Bifidobacterium)与埃希氏菌属(Escherichia)等。这可能归因于CIP在模拟消化过程中释放出更多低聚糖片段,为常见益生菌属提供了生长底物,同时抑制了部分致病菌属菌群稳态增殖。

a-Bray-Curtis距离层次聚类;b-属水平丰度热图(Z-score标准化)
图7 属水平菌群聚类与热图分析
Fig.7 Hierarchical clustering and heatmap analysis at genus level
注:热图中****表示极显著差异(P<0.0001)。
图7-b进一步通过属水平丰度聚类分析揭示了各处理组的微生态特征。未消化组中,随着CIP浓度升高,观察到乳酸杆菌属(Lactobacillus)、细小棒菌属(Parvibaculum)和凯氏杆菌属(Kaistobacter)丰度上升,而志贺氏菌属(Shigella)、阿克曼氏菌属(Akkermansia)、肠杆菌属(Enterobacter)、肠球菌属(Enterococcus)和法氏囊杆菌属(Phascolarctobacterium)则出现下降趋势。高剂量组(WH)中特别表现在埃希氏菌属(Escherichia)和韦荣氏球菌属(Veillonella)丰度增加,但嗜麦芽窄食单胞菌属(Stenotrophomonas)、代尔夫特菌属(Delftia)和多利亚菌属(Dorea)显著减少。在已消化组中,与空白组相比,细小棒菌属(Parvibaculum)、志贺氏菌属(Shigella)和克雷伯氏菌属(Klebsiella)显著下降,而漫游球菌属(Vagococcus)、法氏囊杆菌属(Phascolarctobacterium)、头状菌属(Cetobacterium)和布劳特氏菌属(Blautia)丰度升高。低剂量组(IL)中,凯氏杆菌属(Kaistobacter)、普拉梭菌属(Faecalibacterium)、奈瑟菌属(Neisseria)、法氏囊杆菌属(Phascolarctobacterium)和变形杆菌属(Proteus)呈显著升高趋势,而嗜血杆菌属(Haemophilus)、梭菌属(Clostridium)及韦荣氏球菌属(Veillonella)丰度下降。综上,未消化组高剂量CIP对肠道菌群重塑作用最为显著,但也伴随多样性下降;而在模拟消化后,低剂量CIP组通过释放小分子寡糖增强益生菌增殖,在维持微生物多样性与菌群稳态方面展现出更优效果。
3 结论
本研究结果表明,CIP在质量分数0.9%添加量下可显著提升益生菌发酵乳的抗氧化活性、降糖能力及肠道菌群调节效果。低剂量组在模拟胃肠消化过程中释放出更多可发酵低聚糖片段,增强对自由基的清除能力与关键消化酶的抑制效果,同时促进短链脂肪酸合成,维持较高的菌群多样性与益生菌丰度。相比之下,高剂量虽具一定的产酸能力,但易导致微生态结构失衡,说明其存在干预过度的风险。综合分析,CIP在低剂量下更具协同功能优势,为其在功能性发酵乳中的科学配方与应用剂量优化提供了理论支持,鉴于体外模型仍有局限,未来可结合动物实验与分子机制研究进一步验证其体内健康效应。菌群结构方面,低剂量组在消化后可显著提高双歧杆菌、乳酸杆菌与普拉梭菌等益生菌丰度,同时有效抑制志贺氏菌与变形杆菌属等潜在致病菌。此现象反映了低剂量CIP在胃肠环境中能够释放更具选择性的益生元底物,调控菌群多样性与功能性,且在门、属水平均未造成显著“过度富集”或单一菌群偏移的现象。
尽管本研究通过前期筛选初步确定质量分数0.9%的CIP具有最优的功能性表现,呈现出较为明确的剂量-效应平台趋势,但正式机制实验阶段仅设置质量分数0.9%和1.6% 2个代表性浓度,尚难以构建完整的剂量-反应关系模型。为进一步明晰其最适添加区间与效应阈值,建议后续研究采用更密集的浓度梯度设计,结合肠道菌群多样性、代谢产物谱及关键生理活性等多维响应指标,系统建立CIP“剂量-功能”综合评价体系。值得注意的是,尽管本研究明确了低剂量CIP在体外模型中的多重功能优势,但该模型无法完全反映人体真实的肠道环境,特别是肠上皮通透性、免疫因子及肠-肝轴等因素未被涵盖。因此,本研究结果需通过动物实验或临床研究进一步验证其在体内的作用机制和剂量反应关系。综上所述,CIP在低剂量(质量分数0.9%)下展现出优异的抗氧化、降糖及肠道菌群调节效果,为其在功能性发酵乳制品中的科学配方与剂量优化提供了理论依据,也为未来开发靶向代谢健康的益生元食品原料提供了重要参考。
[1] WANG Y, LIN Z J, ZHANG B, et al.Cichorium intybus L.promotes intestinal uric acid excretion by modulating ABCG2 in experimental hyperuricemia[J].Nutrition &Metabolism, 2017, 14:38.
[2] AKKERMAN R, LOGTENBERG M J, BEUKEMA M, et al.Chicory inulin enhances fermentation of 2′-fucosyllactose by infant fecal microbiota and differentially influences immature dendritic cell and T-cell cytokine responses under normal and Th2-polarizing conditions[J].Food &Function, 2021, 12(19):9018-9029.
[3] ZHANG H, ZHANG Y H, MU T, et al.Response of gut microbiota and ileal transcriptome to inulin intervention in HFD induced obese mice[J].International Journal of Biological Macromolecules, 2023, 225:861-872.
[4] 韩薇, 贺稚非, 谢兆华, 等.菊粉的功能特性及其在肉制品中的应用研究进展[J].食品与发酵工业, 2022, 48(16):311-317.HAN W, HE Z F, XIE Z H, et al.The functional analysis of inulin and its application in meat products[J].Food and Fermentation Industries, 2022, 48(16):311-317.
[5] PANG D J, HUANG C, CHEN M L, et al.Characterization of inulin-type fructan from Platycodon grandiflorus and study on its prebiotic and immunomodulating activity[J].Molecules, 2019, 24(7):1199.
[6] HOLLAND C, RYDEN P, EDWARDS C H, et al.Plant cell walls:Impact on nutrient bioaccessibility and digestibility[J].Foods, 2020, 9(2):201.
[7] JI H H, HU J L, ZUO S, et al.In vitro gastrointestinal digestion and fermentation models and their applications in food carbohydrates[J].Critical Reviews in Food Science and Nutrition, 2022, 62(19):5349-5371.
[8] 矫春娜, 张健, 刘芳, 等.体外模拟消化在水产品营养活性物质研究中的应用进展[J].食品工业科技, 2023, 44(8):421-428.JIAO C N, ZHANG J, LIU F, et al.Research progress on the application of in vitro digestion model in nutritional active substances of aquatic products[J].Science and Technology of Food Industry, 2023, 44(8):421-428.
[9] 唐曼玉, 王晚晴, 强敬雯, 等.益生菌与肠道菌群、免疫调节的相互作用与机制研究进展[J].食品工业科技, 2022, 43(16):486-493.TANG M Y, WANG W Q, QIANG J W, et al.Interaction and mechanism of probiotics with gut flora and immune regulation:A review[J].Science and Technology of Food Industry, 2022, 43(16):486-493.
[10] 张梦莹, 毕凯悦, 吴予涵, 等.基于体外消化酵解模型探究芜菁多糖的抗氧化活性及对肠道菌群的影响[J].食品工业科技, 2025, 46(13):106-116.ZHANG M Y, BI K Y, WU Y H, et al.Exploring the antioxidant activity and impact on gut microbiota of Brassica rapa L.polysaccharides based on an in vitro digestion and fermentation model[J].Science and Technology of Food Industry, 2025, 46(13):106-116.
[11] NEMATI V, MOZAFARPOUR R.Exopolysaccharides isolated from fermented milk-associated lactic acid bacteria and applied to produce functional value-added probiotic yogurt[J].LWT, 2024, 199:116116.
[12] FANG C C, CHEN G J, KAN J Q.Characterization and in vitro simulated gastrointestinal digestion and fermentation of Mentha haplocalyx polysaccharide[J].International Journal of Biological Macromolecules, 2022, 222:360-372.
[13] WU D T, LIU W, YUAN Q, et al.Dynamic variations in physicochemical characteristics of oolong tea polysaccharides during simulated digestion and fecal fermentation in vitro[J].Food Chemistry:X, 2022, 14:100288.
[14] TARANNUM N, HOSSAIN T J, ALI F, et al.Antioxidant, antimicrobial and emulsification properties of exopolysaccharides from lactic acid bacteria of bovine milk:Insights from biochemical and genomic analysis[J].LWT, 2023, 186:115263.
[15] ZHANG T J, HUANG D J, LIU X Y, et al.Antioxidant activity and semi-solid emulsification of a polysaccharide from coffee cherry peel[J].International Journal of Biological Macromolecules, 2023, 244:125207.
[16] 梁金月, 周洪鑫, 张雨晴, 等.金银花多酚和多糖同步提取工艺优化及其抗氧化活性研究[J].中国食品添加剂, 2024, 35(3):1-10.LIANG J Y, ZHOU H X, ZHANG Y Q, et al.Optimization of simultaneous extraction process of polyphenols and polysaccharides from Lonicera japonica Thunb.and their antioxidant activity[J].China Food Additives, 2024, 35(3):1-10.
[17] 李景恩, 董金娇, 谢美珍, 等.南酸枣多糖的体外抗氧化、降血糖与降血脂作用[J].食品研究与开发, 2024, 45(3):59-66.LI J E, DONG J J, XIE M Z, et al.The antioxidant, hypoglycemic and hypolipidemic effects of polysaccharides from Choerospondias axillaris in vitro[J].Food Research and Development, 2024, 45(3):59-66.
[18] 张慧慧, 李灿, 刘会平, 等.肉桂多糖的提取纯化及体外抗氧化和降血糖活性分析[J].食品工业科技, 2024, 45(7):15-24.ZHANG H H, LI C, LIU H P, et al.Extraction and purification of Cinnamomum cassia polysaccharides and its antioxidant and hypoglycemic activities in vitro[J].Science and Technology of Food Industry, 2024, 45(7):15-24.
[19] CHEN S G, LUAN L Q, ZHANG Y R, et al.A comparison study on polysaccharides extracted from Rosa sterilis S.D.Shi using different methods:Structural and in vitro fermentation characterizations[J].Food Chemistry, 2023, 17:100533.
[20] XIE L, YUAN Y Y, YANG F J, et al.Comparative analysis of antioxidant activities and chemical compositions in the extracts of different edible parts from Camellia tetracocca Zhang (C.tetracocca) with two distinct color characteristics[J].Food Chemistry:X, 2024, 22:101496.
[21] AI C, LIU S X, ZHAO Y Y, et al.Hybrid electrospinning of pullulan and citrus pectin to load astaxanthin:Preparation, characterization, and functional evaluation[J].Food Chemistry:X, 2024, 24:101990.
[22] ROBERFROID M.Inulin-Type Fructans:Functional Food Ingredients[M].Boca Raton:CRC Press, 2004.
[23] WEN J S, YU Q T, PAN L, et al.Effects of metformin supplementation in high-carbohydrate diets on growth performance, glucose metabolism, intestinal flora, and PI3K/AKT signaling pathway of hybrid grouper (Epinephelus fuscoguttatus♀ × Epinephelus lanceolatu♂)[J].Aquaculture Reports, 2024, 39:102508.
[24] PUHLMANN M L, VAN DE RAKT E, KEREZOUDI E N, et al.Analysis of the fermentation kinetics and gut microbiota modulatory effect of dried chicory root reveals the impact of the plant-cell matrix rationalizing its conversion in the distal colon[J].Microbiome Research Reports, 2024, 3(3):28.
[25] LU H X, LIU P, ZHANG X X, et al.Inulin and Lycium barbarum polysaccharides ameliorate diabetes by enhancing gut barrier via modulating gut microbiota and activating gut mucosal TLR2+ intraepithelial γδ T cells in rats[J].Journal of Functional Foods, 2021, 79:104407.
[26] PEI W H, LI M, WU J H, et al.Preparation, structural analysis, and intestinal probiotic properties of a novel oligosaccharide from enzymatic degradation of Huangshui polysaccharide[J].Journal of Agricultural and Food Chemistry, 2024, 72(1):313-325.
[27] YANG J K, LIANG J F, XIAO L M, et al.Vertical stratification of bacteria and the chemical compounds in crude oil-contaminated soil layers of the semi-deserted Dzungharian Basin[J].PLoS One, 2018, 13(9):e0203919.
[28] HE H, PENG M W, HOU Z N, et al.Organic substitution contrasting direct fertilizer reduction increases wheat productivity, soil quality, microbial diversity and network complexity[J].Environmental Technology &Innovation, 2024, 36:103784.
[29] KIRSCH J M, HRYCKOWIAN A J, DUERKOP B A.A metagenomics pipeline reveals insertion sequence-driven evolution of the microbiota[J].Cell Host &Microbe, 2024, 32(5):739-754.e4.
[30] KANWAL S, JOSEPH T P, OWUSU L, et al.A polysaccharide isolated from Dictyophora indusiata promotes recovery from antibiotic-driven intestinal dysbiosis and improves gut epithelial barrier function in a mouse model[J].Nutrients, 2018, 10(8):1003.