融合魏斯氏菌(Weissella confusa)是酱油、泡菜和豆豉等盐发酵食品中的优势乳酸菌,对食品发酵进程和风味形成至关重要[1-2]。作为酱油发酵体系中的优势菌种,融合魏斯氏菌合成的有机酸和胞外多糖对酱油甜味、酸味和香味具有一定的贡献[3-4]。当融合魏斯氏菌与米曲霉共同制曲酿造酱油时,可显著提高酱油中氨基酸态氮、总氮、还原糖的含量[5]。但在高盐食品发酵中,盐胁迫是多数微生物面临的生存挑战,可导致细胞壁细胞膜受损、发酵效率降低、蛋白质变性和DNA损伤等[6]。在高盐稀态酱油发酵中,魏斯氏菌的相对丰度从制曲阶段(0 g/L NaCl)的71.27%显著下降至酱醪盐发酵阶段(180 g/L NaCl)的15.96%,表明盐可能是其相对丰度降低的主要胁迫因子[7-8]。作为酱油发酵的关键风味菌,融合魏斯氏菌的存活与功能发挥受盐环境限制。因此,研究融合魏斯氏菌响应盐胁迫的机制,对优化高盐发酵食品的风味品质和发酵效率具有重要意义。
微生物的盐胁迫响应机制涉及细胞生理变化、基因表达调控和细胞代谢等复杂过程,其中代谢途径的动态调整是适应环境的核心[6,9]。微生物通过调控代谢途径维持细胞渗透平衡、保护关键酶活性并优化能量分配,从而适应盐胁迫环境[9-10]。代谢组学作为系统生物学的重要研究手段,能够分析细胞内小分子代谢物(通常分子质量<1 000 Da),为全面解析微生物的代谢动态变化提供了有力工具。多项研究通过非靶向代谢组学技术揭示了微生物响应盐胁迫的代谢特征。HE等[11]对嗜盐四联球菌的研究发现,盐胁迫诱导了细胞碳水化合物代谢、脂肪酸代谢和氨基酸代谢途径的变化,其中氨基酸类相容性溶质和信号分子显著积累。FENG等[12]对金黄色葡萄球菌的研究表明,该菌株主要通过调控信号响应、氨基酸代谢和碳水化合物代谢适应高盐环境。SÉVIN等[13]对14种微生物的系统研究发现,糖酵解、三羧酸循环、支链氨基酸代谢和血红素生物合成途径在盐耐受中发挥重要作用,且不同物种表现出特异性代谢模式。这些研究表明,非靶向代谢组学通过代谢物全面分析,能够揭示微生物在盐胁迫下的全局调控网络和物种特异性适应机制,为耐盐机理研究提供了重要技术支撑。
本研究以具有自主知识产权的融合魏斯氏菌JQ3为对象,该菌株分离于酱油厂生产中制曲阶段的样品,是一株能耐受高盐的潜在发酵菌剂[14]。前期研究发现该菌株在培养基饱和盐溶液(350 g/L NaCl)极限胁迫条件下,菌株的氨基酸代谢、碳水化合物代谢和核苷酸代谢显著变化[15],且不同盐浓度会导致菌株的菌体密度、活菌数和细胞形态存在显著差异[15-16]。这些结果提示,融合魏斯氏菌JQ3对不同盐环境的响应具有特异性。为探究融合魏斯氏菌JQ3在酱油发酵典型盐浓度(180 g/L NaCl)下的代谢适应机制,本研究采用液相色谱-质谱联用非靶向代谢组学技术,分析该菌株在180 g/L NaCl胁迫下的代谢变化,以揭示融合魏斯氏菌的耐盐机制,为酱油发酵微生物资源的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
融合魏斯氏菌(Weissella confusa)JQ3,中国普通微生物菌种保藏中心,保藏编号为CGMCC No.21637;MRS肉汤培养基、琼脂粉,广东环凯微生物科技有限公司;NaCl,福晨(天津)化学试剂有限公司;50%(体积分数)戊二醛、乙醇,天津市大茂化学试剂厂;叔丁醇,上海麦克林生化科技股份有限公司;甲醇、乙腈、甲酸(均为色谱纯),美国赛默飞世尔科技公司;Bradford蛋白浓度测定试剂盒(100T),北京索莱宝科技有限公司。
1.2 仪器与设备
Quatro S扫描电子显微镜、UHPLC-Q Exactive HF-X超高效液相色谱串联傅里叶变换质谱,美国赛默飞世尔科技公司;HSS T3色谱柱(1.8 μm, 2.1×100 mm),美国Waters公司;BioTek ELx800多功能酶标仪,美国伯腾仪器有限公司;ALLEGRA-64R冷冻高速离心机,美国贝克曼库尔特公司;Wonbio-96c型高通量组织破碎仪,上海万柏生物科技有限公司;ICON 100自动菌落计数仪,上海磐麦科技有限公司;LRH-150隔水式恒温培养箱,上海一恒科技有限公司;SW-CJ-1FD超净工作台,苏州安泰空气技术有限公司。
1.3 实验方法
1.3.1 NaCl胁迫对菌株生长的影响
将-80 ℃冷冻保藏的W.confusa JQ3按2%(体积分数)接种量接种于MRS液体培养基中,在37 ℃恒温培养箱中静置培养10 h,得到活化菌株。活化菌株再培养1代得到预培养物,用于后续实验。将预培养物以10%(体积分数)接种量接种至100 mL发酵培养基中,在37 ℃恒温培养箱中静置培养24 h。以添加终质量浓度为180 g/L NaCl的MRS发酵培养基为处理组,未添加NaCl的MRS发酵培养基为对照组。取菌株培养液测定600 nm处吸光值,分析NaCl对菌株菌体密度的影响。取菌株培养液梯度稀释后,涂布于MRS琼脂平板上,在37 ℃恒温培养箱中培养24 h,计算处理组和对照组活菌数(lg CFU/mL),分析NaCl对菌株活菌数的影响。
1.3.2 NaCl胁迫对菌株细胞形态的影响
处理组和对照组菌培养物于8 000×g离心90 s收集菌体,将菌体用2.5%(体积分数)戊二醛溶液在4 ℃下固定过夜,固定结束后,用不同体积分数的乙醇(30%、50%、70%、90%、95%、100%)进行梯度脱水,经叔丁醇置换乙醇后冷冻干燥和喷金处理,使用扫描电镜在80 000 倍放大倍数下观察细胞形态[12]。
1.3.3 NaCl胁迫对菌株胞外蛋白质的影响
菌株预培养物于8 000×g离心90 s收集菌体,将菌体悬浮至0、180 g/L NaCl的无菌水中,使细胞终浓度为1.0×108 CFU/mL,在37 ℃恒温培养箱中静置培养24 h,取1 mL菌培养液于8 000×g离心10 min,得到的上清液经0.22 μm滤膜过滤,通过试剂盒测定上清液蛋白质含量[15]。
1.3.4 菌株胞内代谢物的制备
处理组和对照组菌培养物于8 000×g离心10 min收集菌体。取100 mg菌体,加入800 μL 0.02 mg/mL L-2-氯苯丙氨酸(内标)的甲醇-水(4∶1,体积比)提取液,加入6 mm研磨珠,在-10 ℃、50 Hz冷冻组织研磨仪中研磨6 min,5 ℃、40 kHz超声波提取30 min。样品处理后静置30 min,于4 ℃、13 000×g离心15 min,取上清液经0.22 μm滤膜过滤后进行液相色谱串联质谱分析[15]。
1.3.5 液相色谱串联质谱分析
代谢物分析的仪器平台为超高效液相色谱串联傅里叶变换质谱UHPLC-Q Exactive HF-X系统。色谱条件:流动相A为乙腈-水(95∶5,体积比),流动相B为乙腈-异丙醇-水(47.5∶47.5∶5,体积比),流动相A和B中均添加0.1%(体积分数)甲酸,流速0.4 mL/min,柱温40 ℃,进样量3 μL。质谱条件:信号采集采用正负离子扫描模式,质量扫描范围m/z为70~1 050;电喷雾电离源,正离子电压3 500 V,负离子电压3 000 V,离子源加热温度450 ℃,循环碰撞能为20~60 V。
1.4 代谢物数据处理与分析
样品经液相色谱串联质谱分析的原始数据使用软件Progenesis QI 3.0处理,质谱数据与数据库比对得到代谢物信息,然后上传到美吉云平台(https://cloud.majorbio.com)进行分析。多元统计分析使用R语言ropls包(版本1.6.2)进行主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)。处理组与对照组间差异代谢物的筛选标准为:OPLS-DA模型得到的变量权重值(variable important in projection,VIP)>1,基于t检验计算显著性P值<0.05,差异倍数>1。使用R语言ropls包(版本1.6.2)绘制处理组与对照组差异代谢物火山图。差异代谢物通过京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库(http://www.genome.jp/kegg/)进行代谢通路注释,并使用Python软件包scipy(版本1.0.0)进行通路富集分析。
2 结果与分析
2.1 NaCl胁迫对菌株JQ3生长的影响
融合魏斯氏菌JQ3在无盐和有盐(180 g/L NaCl)培养条件下的生长情况如图1所示。菌体密度结果显示(图1-a):在培养起始阶段(0 h),2组的菌体密度OD600值均为0.178;培养24 h后,无盐组菌体密度显著提高至1.170,有盐组菌体密度保持不变,且2组菌体密度之间具有显著差异(P<0.05)。活菌数结果显示(图1-b):在培养起始阶段2组的活菌数均为107 CFU/mL;培养24 h后,无盐组活菌数提高至108 CFU/mL,有盐组活菌数保持不变,且2组活菌数之间具有显著差异(P<0.05)。结果表明:在180 g/L NaCl胁迫条件下,融合魏斯氏菌能存活,但其生长受到抑制。文献报道融合魏斯氏菌具有耐盐性,在10 g/L NaCl培养48 h后活菌数为108 CFU/mL,而在180 g/L NaCl培养条件下的活菌数下降至107 CFU/mL,表明其生长受到抑制,并且活菌数随着培养时间的延长而逐渐降低[4],本研究中的菌株JQ3在180 g/L NaCl培养条件下的活菌数也为107 CFU/mL,与文献报道的相同盐浓度下的活菌数相似。
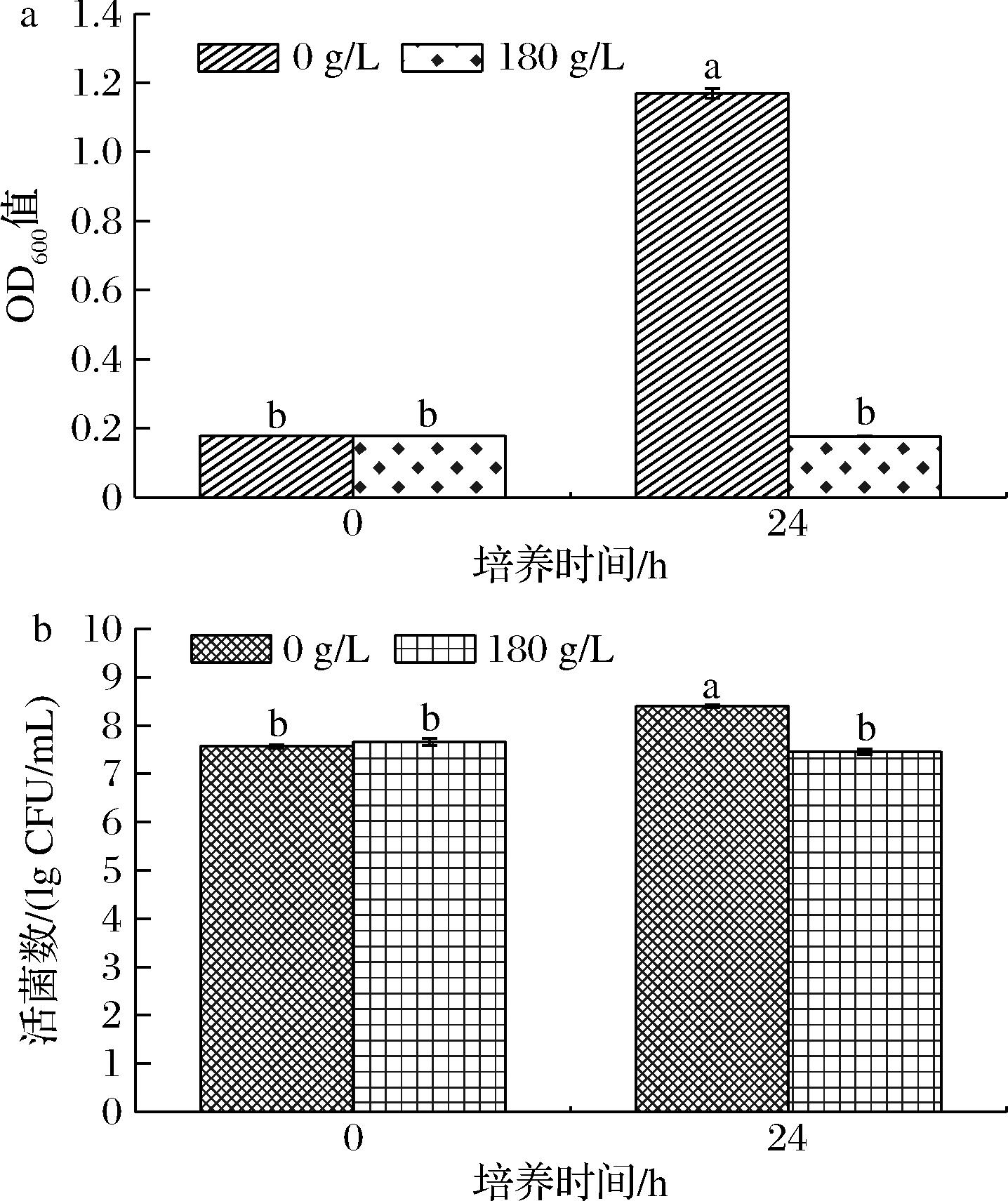
a-菌体密度;b-活菌数
图1 盐胁迫对融合魏斯氏菌JQ3生长的影响
Fig.1 Growth performance of W.confusa JQ3 under salt stress
注:不同小写字母表示差异显著(P<0.05)(下同)
2.2 NaCl胁迫对菌株JQ3细胞形态的影响
如图2所示,无盐条件下,细胞呈规则的短杆状或椭圆形、形态饱满,表面光滑、完整、破损较少(图2-a)。在180 g/L NaCl条件下,细胞凹陷变形、形态不规则,表面粗糙并伴有褶皱和颗粒物质(图2-b)。结果表明:180 g/L NaCl显著影响融合魏斯氏菌的细胞形态,高盐环境导致细胞表面皱缩和形态不规则。前期研究发现,融合魏斯氏菌在60 g/L NaCl条件下,细胞表面褶皱变形,但未出现颗粒物质;在350 g/L NaCl条件下,细胞表面变形出现孔洞[15-16],表明不同盐浓度胁迫下,融合魏斯氏菌细胞形态变化不同。已有研究证实,盐胁迫条件下,微生物细胞形态会发生不同程度变化,例如细胞伸长、细胞破裂、表面出现孔洞或褶皱,且细胞形态变化与盐胁迫浓度和时间有关[15,17-18],本研究结果与之相符。

a-添加0 g/L NaCl条件下培养24 h;b- 添加180 g/L NaCl条件下培养24 h
图2 盐胁迫下融合魏斯氏菌JQ3细胞形态的变化
Fig.2 Morphological changes of W.confusaJQ3 under salt stress
扫描电镜观察到NaCl对融合魏斯氏菌细胞形态造成了损伤,进一步测定受损后细胞蛋白质的变化情况。结果表明,在180 g/L NaCl胁迫条件下,胞外蛋白质含量为(1.970±0.048) μg/mL,显著高于无盐组(1.495±0.000) μg/mL(P<0.05),因此,存在部分细胞发生裂解的可能。
2.3 NaCl胁迫下菌株JQ3的代谢组学分析
2.3.1 代谢物的PCA和OPLS-DA
采用LC-MS非靶向代谢组学方法,分析融合魏斯氏菌在无盐和含180 g/L NaCl培养条件下的胞内代谢物差异。样品原始采样数据经预处理后,共鉴定出1 423个代谢物,其中阳离子模式下853个代谢物、阴离子模式下570个代谢物。采用多元统计分析方法,评价组内样本的相似性和组间样本的差异性,结果如图3所示。PCA结果显示:在阳离子模式下,第一和第二主成分累计贡献值为79.24%(图3-a);在阴离子模式下为82.30%(图3-b),表明无盐组和有盐组具有独特的代谢特征。OPLS-DA结果显示:无盐组和有盐组分离趋势明显(图3-c和图3-d),在阳离子模式下模型对X矩阵的解释率R2X为0.784,对Y矩阵的解释率R2Y为0.982,模型的预测能力Q2为0.936;在阴离子模式下,R2X为0.814,R2Y为0.989,Q2为0.916,各指标都接近于1,表明模型稳定可靠,能较好地预测无盐组和有盐组菌株JQ3胞内差异代谢物。多元统计分析结果表明:180 g/L NaCl胁迫引起融合魏斯氏菌胞内代谢物变化,分析模型可用于后续差异代谢物筛选研究。
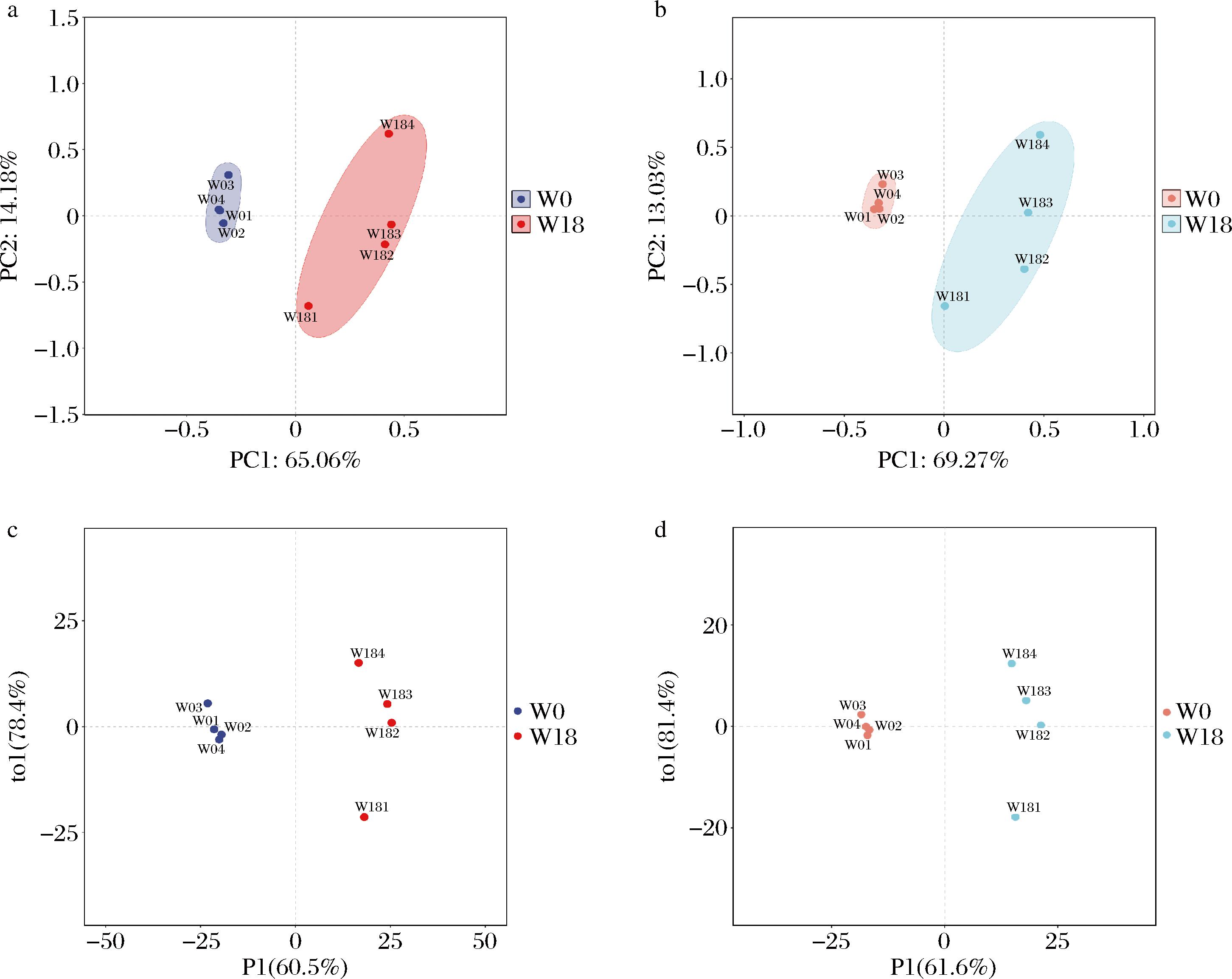
a-阳离子模式下PCA;b-阴离子模式下PCA;c-阳离子模式下OPLS-DA;d-阴离子模式下OPLS-DA
图3 盐胁迫下融合魏斯氏菌JQ3代谢轮廓分析
Fig.3 Metabolic profiling analysis of W.confusa JQ3 under salt stress
注:W0-无盐组;W18-有盐组(下同)。
2.3.2 差异代谢物筛选
以OPLS-DA模型的VIP>1、P<0.05、差异倍数>1为筛选标准,初步筛选出180 g/L NaCl胁迫条件下的差异代谢物,结果如图4所示。综合阳、阴离子2种扫描模式的分析结果发现,盐胁迫下共检测到545种差异代谢物,其中182种上调、363种下调。表明盐胁迫下,融合魏斯氏菌胞内代谢物发生改变,其差异代谢物的表达以下调为主。通过KEGG化合物分类,筛选的差异代谢物主要为碳水化合物、脂质、核酸和有机酸。
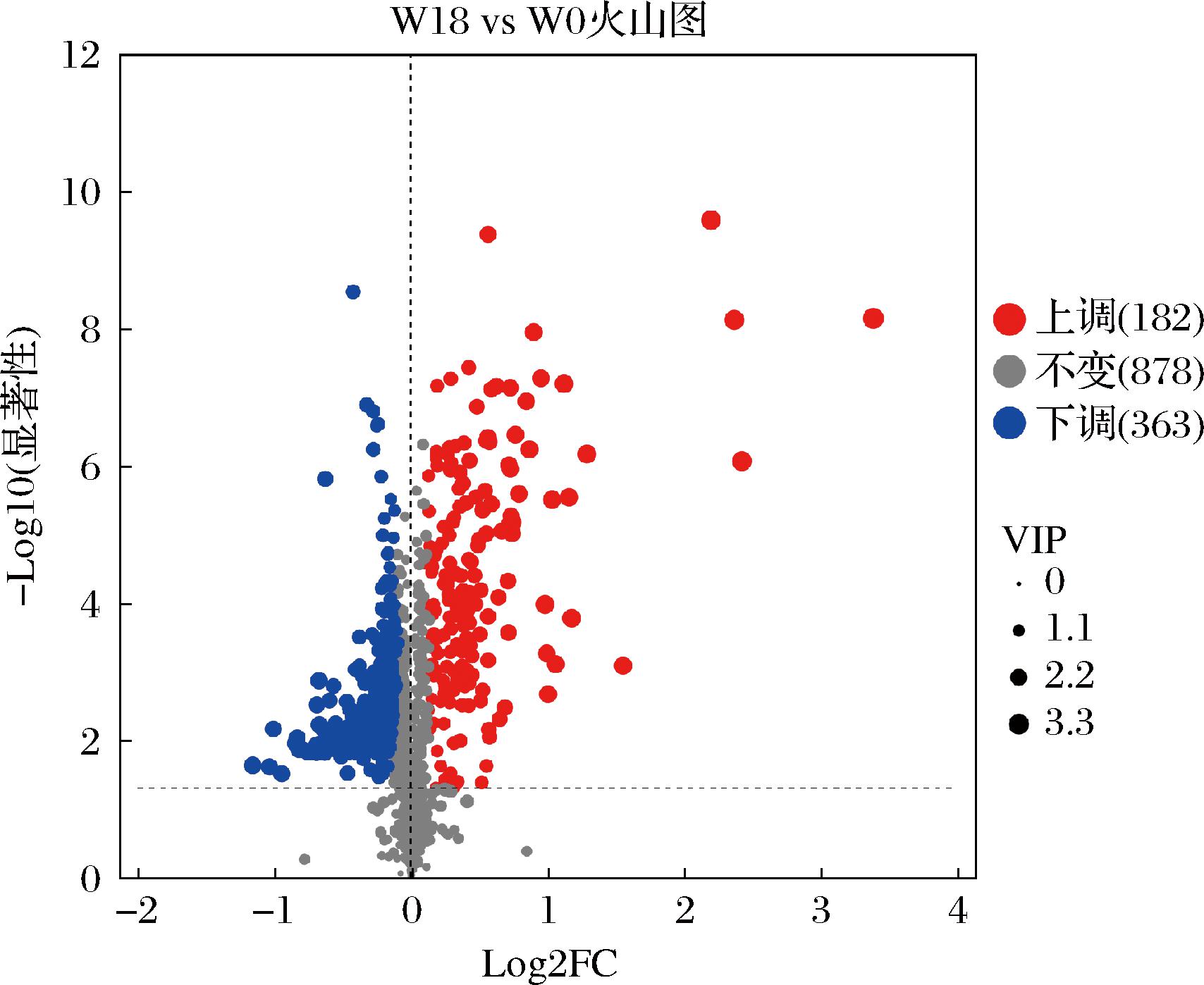
图4 无盐和有盐组间融合魏斯氏菌JQ3差异代谢物的火山图
Fig.4 Volcano plot of differential metabolites in W.confusaJQ3 between the NaCl-free and NaCl-treated groups
2.3.3 差异代谢物KEGG通路富集分析
为进一步分析盐胁迫下融合魏斯氏菌的代谢机制,对筛选的差异代谢物进行KEGG通路富集分析。结果显示,这些差异代谢物共富集到101条通路,其中14条通路显著富集(P<0.01)。由图5可知,显著富集的通路包括:碳水化合物代谢通路、脂质代谢通路、核苷酸代谢通路等。
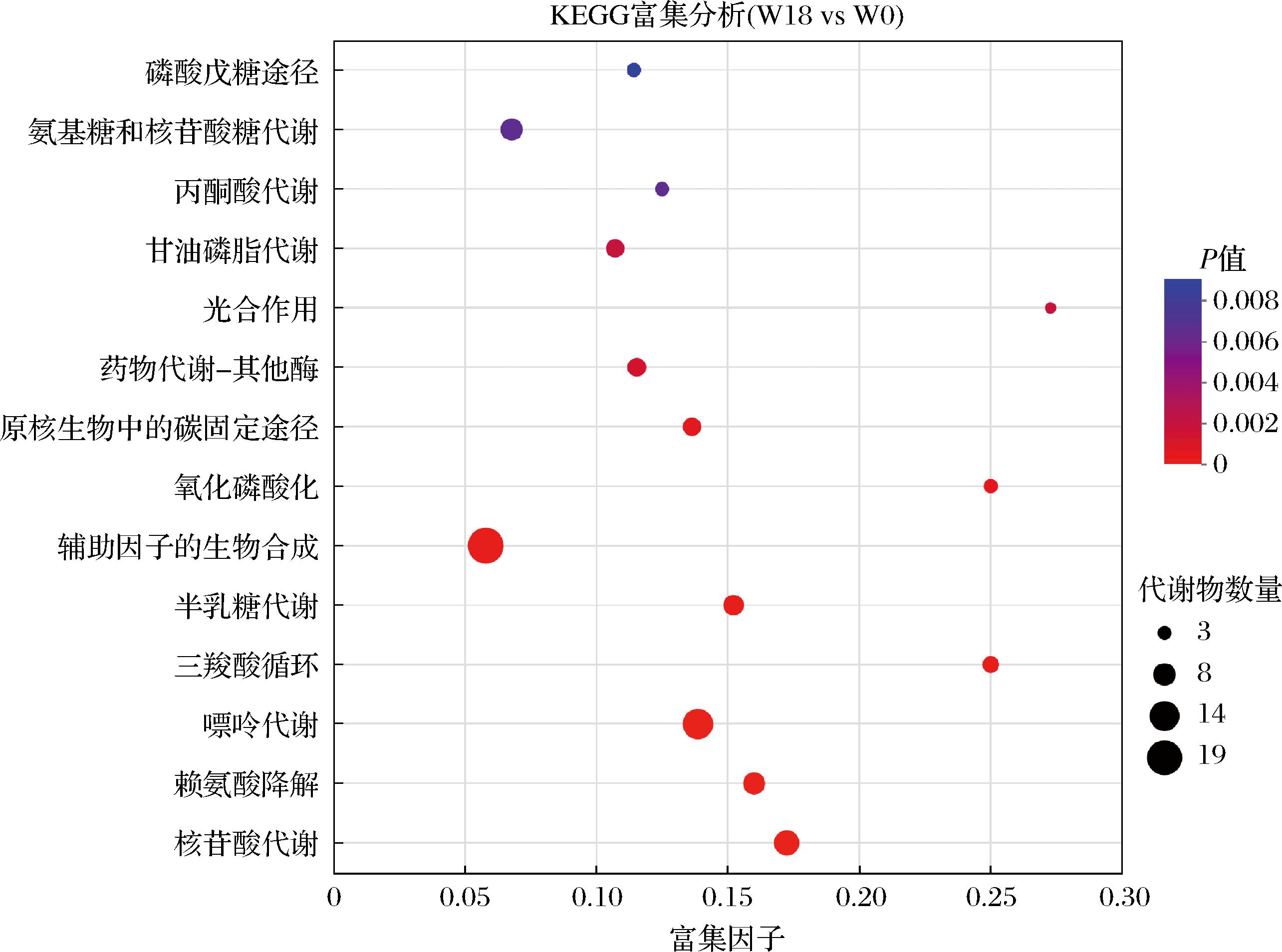
图5 盐胁迫下融合魏斯氏菌JQ3差异代谢物的KEGG通路富集分析气泡图
Fig.5 Bubble plot of the KEGG pathway enrichment analysis with the differential metabolites in W.confusa JQ3 under salt stress
碳水化合物代谢是微生物生存和能量代谢的核心,盐胁迫下其可通过调节能量代谢、合成相容性溶质及改变代谢途径增强微生物耐盐性[19]。融合魏斯氏菌为异型发酵乳酸菌,主要通过磷酸己糖和磷酸酮酶途径发酵糖类[2]。融合魏斯氏菌JQ3在180 g/L NaCl胁迫条件下,异型乳酸发酵、氨基糖和核苷酸糖代谢流增强,半乳糖代谢流减弱(图6)。在异型乳酸发酵途径中,葡萄糖酸-6-磷酸和磷酸烯醇丙酮酸上调;乙酰辅酶A下调(表1)。葡萄糖酸-6-磷酸是磷酸己糖途径的关键中间产物,该途径产生NADPH,用于提供还原力[20]。研究表明,盐胁迫会导致微生物细胞内活性氧水平升高,需要大量NADPH来维持氧化还原平衡[20-21],推测盐胁迫下菌株JQ3通过调控葡萄糖酸-6-磷酸上调增强NADPH供应,保护细胞免受氧化损伤,从而维持细胞结构和功能的完整性,避免细胞死亡。磷酸烯醇丙酮酸是异型乳酸发酵途径中生成乳酸的中间体,乙酰辅酶A是生成乙醇的中间体。菌株JQ3中磷酸烯醇丙酮酸上调,而乙酰辅酶A下调,推测菌株JQ3通过增强乳酸分支、降低乙醇分支的策略,减少乙醇代谢流的能量消耗,将能量和碳源重新分配给更为关键的抗胁迫生理过程,从而增强细胞的渗透压耐受能力,为其在胁迫环境中的生存提供条件。此外,盐胁迫下菌株的丙酮酸代谢流向了苹果酸。苹果酸参与细胞的能量代谢、氧化还原平衡和胞内环境稳态调节等过程,盐胁迫可以诱导多种植物中的苹果酸积累[22-23],但微生物中报道较少。本研究在盐胁迫下也观察到菌株JQ3的苹果酸上调,但其在微生物中抗盐胁迫的功能还需进一步验证。在氨基糖和核苷酸糖代谢途径中,尿苷二磷酸-N-乙酰氨基葡萄糖和尿苷二磷酸-N-乙酰基甘露糖胺上调(表1)。该代谢途径通过合成氨基糖和核苷酸糖,为微生物细胞壁、细胞膜和糖蛋白的构建提供前体物质[24]。其中,尿苷-N-乙酰氨基葡萄糖是肽聚糖合成的关键前体,对于维持细胞形态和渗透压稳定具有重要作用[25]。扫描电镜观察到盐胁迫下细胞形态发生变化,推测菌株通过增强氨基糖和核苷酸糖代谢,强化细胞结构完整性保障细胞在胁迫环境下的存活。在半乳糖代谢途径中,尿苷二磷酸葡萄糖和尿苷二磷酸半乳糖下调(表1)。这2种物质是糖基转移酶的活性底物,参与糖脂、糖蛋白和细胞壁多糖的合成[26-27],其下调表明菌株JQ3在盐胁迫下减少了某些糖基化过程的活性,将代谢资源更多地分配到关键的耐盐相关代谢途径中。
表1 盐胁迫下融合魏斯氏菌JQ3显著富集(P<0.01)的代谢通路中的差异代谢物
Table 1 Differential metabolites in W.confusa JQ3 under salt stress based on significantly enriched pathways (P<0.01)

注释通路代谢物保留时间/min质荷比VIP值P值差异倍数变化情况碳水化合物代谢葡萄糖酸-6-磷酸0.613 6257.007 01.196 0<0.0011.16上调磷酸烯醇丙酮酸0.764 7166.974 61.684 0<0.0011.32上调乙酰辅酶A3.439 4403.555 71.719 5<0.050.73下调苹果酸0.677 0133.013 51.553 6<0.0011.23上调尿苷二磷酸-N-乙酰氨基葡萄糖0.629 4606.074 71.243 9<0.0011.10上调尿苷二磷酸-N-乙酰基甘露糖胺0.627 7652.051 72.224 9<0.0011.48上调尿苷二磷酸葡萄糖0.629 4603.003 82.188 3<0.010.63下调尿苷二磷酸半乳糖0.621 5565.048 01.013 9<0.0010.94下调脂质代谢磷脂酸衍生物5.804 4725.457 21.685 1<0.0011.36上调胞苷二磷酸-二酰甘油衍生物0.666 7467.734 41.427 3<0.0011.26上调磷脂酰甘油磷酸酯衍生物4.545 6843.444 21.002 6<0.0011.08上调核苷酸代谢二磷酸脱氧鸟苷0.980 0428.035 81.773 8<0.0011.30上调二磷酸腺苷0.653 2426.022 41.637 9<0.0011.22上调三磷酸腺苷0.977 4505.988 42.414 4<0.0011.83上调黄嘌呤1.541 5151.025 51.064 4<0.050.87下调次黄嘌呤1.231 9137.045 61.037 6<0.050.90下调脱氧次黄苷0.892 8251.077 31.247 7<0.010.87下调
注:差异倍数为有盐组/无盐组;变化情况上调/下调表示有盐组相对于无盐组代谢物的相对丰度增加/降低。
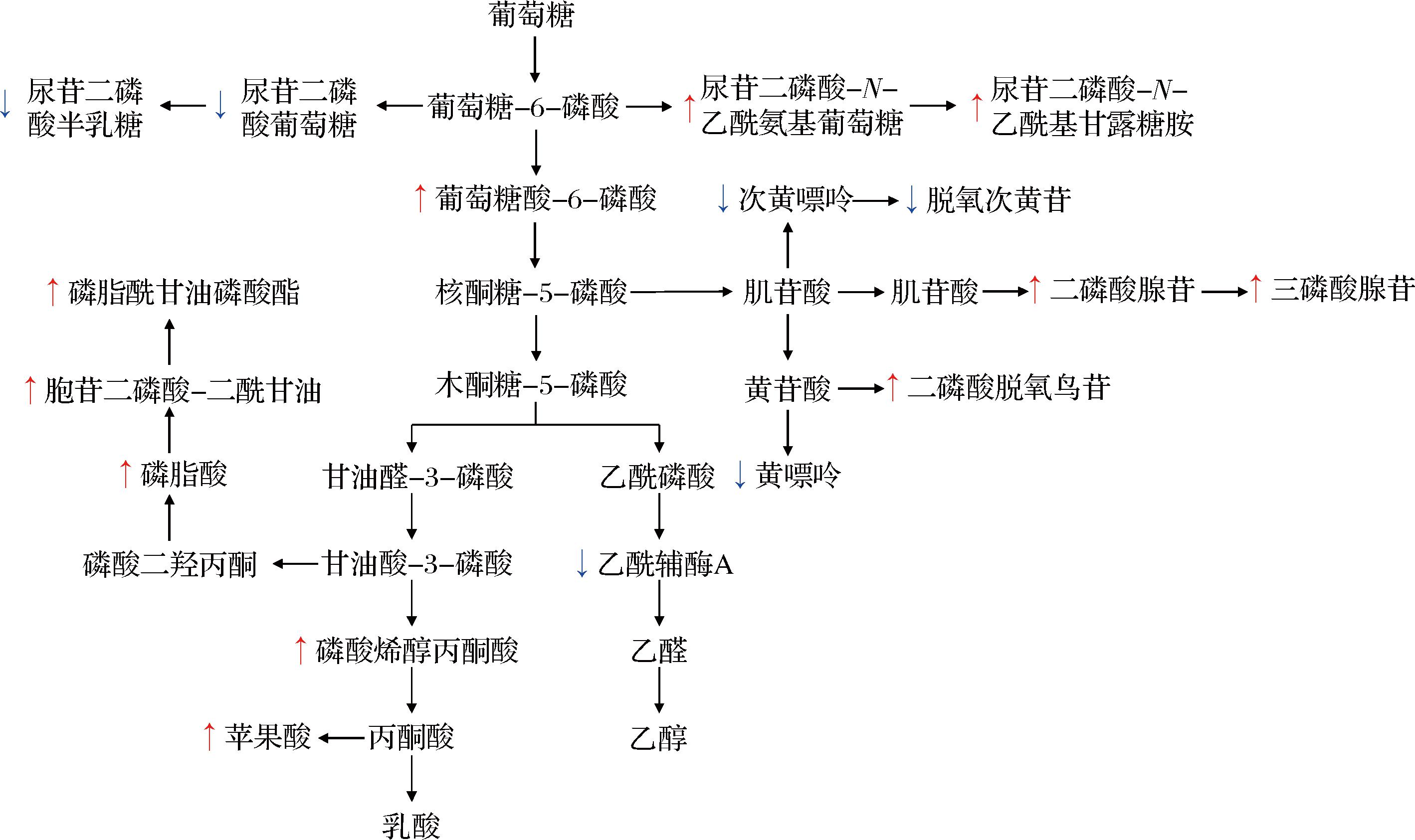
图6 盐胁迫下融合魏斯氏菌JQ3的代谢响应变化
Fig.6 Metabolic response changes of W.confusa JQ3 under salt stress
注:代谢途径是基于KEGG数据库构建;图中红色箭头↑表示盐胁迫下代谢物相对丰度增加,蓝色箭头↓表示盐胁迫下代谢物相对丰度减少。
脂类物质是微生物细胞膜的结构基础、能量贮存与信号转导介质,决定细胞完整性并调节环境适应性[28-29]。融合魏斯氏菌JQ3在180 g/L NaCl胁迫条件下,甘油磷脂代谢途径显著富集,其中磷脂酸、胞苷二磷酸-二酰甘油和磷脂酰甘油磷酸酯上调(表1和图6)。甘油磷脂是细胞膜的主要成分,维持膜的流动性和稳定性[28]。细胞膜作为盐胁迫的核心靶点,其结构完整性直接决定细胞存活[29]。推测菌株JQ3通过上调甘油磷脂代谢关键中间体,增强细胞膜在高盐环境下的稳定性与完整性,减少盐胁迫引起的细胞结构损伤,保障细胞在高盐环境中存活。
核苷酸是DNA和RNA的基本组成单位,核苷酸代谢在微生物的生存、适应和功能发挥中具有核心作用[30]。融合魏斯氏菌JQ3在180 g/L NaCl胁迫条件下,嘌呤代谢途径显著富集,其中二磷酸脱氧鸟苷、二磷酸腺苷(adenosine 5′-diphosphate,ADP)和三磷酸腺苷(adenosine 5′-triphosphate,ATP)上调,黄嘌呤、次黄嘌呤和脱氧次黄苷下调(表1和图6)。脱氧鸟苷二磷酸参与DNA合成,其上调表明可能与细胞的DNA修复有关。ADP和ATP是细胞能量代谢的核心,为微生物的生存、适应环境和生理功能提供能量动力和调控信号[30-31]。其上调表明菌株JQ3的能量代谢被激活,为细胞应对高盐胁迫的代谢活动、合成反应提供能量,增强微生物的存活能力。黄嘌呤和次黄嘌呤作为嘌呤分解代谢途径的中间体,其下调表明细胞减弱了嘌呤的分解过程,将代谢流集中用于生产ADP和ATP,保障胁迫条件下细胞的能量供应和生存的必需活动。
综上所述,融合魏斯氏菌JQ3在180 g/L NaCl胁迫下,通过调节多条关键代谢途径有效应对盐胁迫,确保细胞的生存和适应能力。在碳水化合物代谢方面,菌株强化磷酸己糖途径与异型发酵乳酸分支,提升NADPH供给与能量利用效率,同时抑制乙醇分支以减少ATP消耗。在细胞结构方面,通过上调氨基糖和核苷酸糖代谢促进细胞壁肽聚糖合成,并增强甘油磷脂代谢以维持细胞膜完整性,共同强化细胞结构的稳定性。在能量与遗传物质调控方面,通过优化嘌呤代谢抑制核苷酸分解、增加ADP和ATP储备,为DNA修复与胁迫响应提供能量基础。这些代谢调控策略共同提升了菌株在高盐环境中的生存适应能力。
3 结论
本研究比较了融合魏斯氏菌JQ3在0、180 g/L NaCl条件下的生长特性和细胞代谢差异。结果显示,盐胁迫抑制菌株生长,引起细胞形态改变、胞外蛋白质含量上升及胞内代谢物显著变化。代谢组学分析发现无盐和有盐条件下有545种差异代谢物,主要涉及碳水化合物、脂质和核苷酸。KEGG通路富集分析显示,差异代谢物显著富集于14条通路,其中碳水化合物代谢通路占比最高。进一步分析表明,菌株通过增强异型乳酸发酵、氨基糖和核苷酸糖代谢以提高还原力水平和细胞结构稳定性;通过调节甘油磷脂代谢维持细胞膜完整性;并通过优化嘌呤代谢以增强能量供应并减少分解消耗。在高盐胁迫下,菌株JQ3虽然生长受到抑制,但通过系统性地调控碳水化合物代谢、脂质代谢和核苷酸代谢等关键通路,进行资源重分配、细胞结构强化和能量优化实现在高盐环境中存活。本文通过比较代谢组学,解析了融合魏斯氏菌JQ3在酱油发酵典型盐浓度(180 g/L NaCl)胁迫下的代谢响应,明确了菌株适应盐环境的代谢调控途径,后续研究可联合其他组学分析验证关键差异代谢物的功能,为阐明菌株的耐盐分子机制提供理论依据,促进盐发酵体系中微生物资源的高效利用。
[1] FUSCO V, CHIEFFI D, FANELLI F, et al.The Weissella and Periweissella genera:Up-to-date taxonomy, ecology, safety, biotechnological, and probiotic potential[J].Frontiers in Microbiology, 2023, 14:1289937.
[2] FESSARD A, REMIZE F.Why are Weissella spp.not used as commercial starter cultures for food fermentation [J].Fermentation, 2017, 3(3):38.
[3] DEVANTHI P V P, GKATZIONIS K.Soy sauce fermentation:Microorganisms, aroma formation, and process modification[J].Food Research International, 2019, 120:364-374.
[4] 李巧玉. 魏斯氏菌在酱油发酵过程的含量变化及特性研究[D].无锡:江南大学, 2018.LI Q Y.Detection of characteristics of Weissella strains and their contents in soy sauce moromi mash during soy sauce fermentation[D].Wuxi:Jiangnan University, 2018.
[5] 孙莉, 胡文康, 黄瑶, 等.非耐盐乳酸菌与米曲霉共生酿造酱油的研究[J].中国调味品, 2020, 45(5):13-18.SUN L, HU W K, HUANG Y, et al.Study on symbiotic brewing of soy sauce with non-salt-tolerant lactic acid bacteria and Aspergillus oryzae[J].China Condiment, 2020, 45(5):13-18.
[6] HE X N, CUI Y, JIA Q Y, et al.Response mechanisms of lactic acid bacteria under environmental stress and their application in the food industry[J].Food Bioscience, 2025, 64:105938.
[7] 王阿利, 王子谦, 魏梓晴, 等.酱油酿造中微生物群落演替及其空间异质性研究[J].中国食品学报, 2022, 22(12):257-266.WANG A L, WANG Z Q, WEI Z Q, et al.Studies on succession and spatial heterogeneity of microbial community during the soy sauce fermentation process[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(12):257-266.
[8] WANG H B, WEI Q Z, GUI S Q, et al.Metagenomic profiling of the bacterial community changes from koji to mash stage in the brewing of soy sauce[J].Polish Journal of Microbiology, 2017, 66(4):537-541.
[9] CHEN W, LU W W.Environmental stress responses of lactic acid bacteria[M].Lactic Acid Bacteria in Foodborne Hazards Reduction.Singapore:Springer Singapore, 2018:115-140.
[10] PARLINDUNGAN E, JONES O A H.Using metabolomics to understand stress responses in lactic acid bacteria and their applications in the food industry[J].Metabolomics, 2023, 19(12):99.
[11] HE G Q, WU C D, HUANG J, et al.Metabolic response of Tetragenococcus halophilus under salt stress[J].Biotechnology and Bioprocess Engineering, 2017, 22(4):366-375.
[12] FENG Y, MING T H, ZHOU J, et al.The response and survival mechanisms of Staphylococcus aureus under high salinity stress in salted foods[J].Foods, 2022, 11(10):1503.
[13] SÉVIN D C, ST HLIN J N, POLLAK G R, et al.Global metabolic responses to salt stress in fifteen species[J].PLoS One, 2016, 11(2):e0148888.
HLIN J N, POLLAK G R, et al.Global metabolic responses to salt stress in fifteen species[J].PLoS One, 2016, 11(2):e0148888.
[14] 钟先锋, 晏雅馨, 黄桂东, 等.一株能降解亚硝酸盐的耐高盐酱曲源融合魏斯氏菌JQ3及其应用:CN115404190B[P].2023-03-24.ZHONG X F, YAN Y X, HUANG G D, et al.A strain of high salt-tolerant sauce koji source Weissella confusa JQ3 capable of degrading nitrite and its application:China, CN115404190B [P].2023-03-24.
[15] WANG A L, DU Q Q, LI X M, et al.Intracellular and extracellular metabolic response of the lactic acid bacterium Weissella confusa under salt stress[J].Metabolites, 2024, 14(12):695.
[16] 杜钦钦, 崔艺敏, 彭冲, 等.氨基酸对盐胁迫下融合魏斯氏菌生长的影响[J].食品与发酵工业, 2025, 51(8):45-52.DU Q Q, CUI Y M, PENG C, et al.Effect of amino acids on growth of Weissella confusa under salt stress[J].Food and Fermentation Industries, 2025, 51(8):45-52.
[17] CAI X H, SUN H J, YAN B, et al.Salt stress perception and metabolic regulation network analysis of a marine probiotic Meyerozyma guilliermondii GXDK6[J].Frontiers in Microbiology, 2023, 14:1193352.
[18] HU S Y, LI Y W, WANG B R, et al.Effects of NaCl concentration on the behavior of Vibrio brasiliensis and transcriptome analysis[J].Foods, 2022, 11(6):840.
[19] NGUYEN P T, NGUYEN-THI T U, NGUYEN H T, et al.Halophilic lactic acid bacteria:Play a vital role in the fermented food industry[J].Folia Microbiologica, 2024, 69(2):305-321.
[20] STINCONE A, PRIGIONE A, CRAMER T, et al.The return of metabolism:Biochemistry and physiology of the pentose phosphate pathway[J].Biological Reviews, 2015, 90(3):927-963.
[21] YU J X, ZHANG Y, LIU H, et al.Temporal dynamics of stress response in Halomonas elongata to NaCl shock:Physiological, metabolomic, and transcriptomic insights[J].Microbial Cell Factories, 2024, 23(1):88.
[22] MACLEAN A, LEGENDRE F, APPANNA V D.The tricarboxylic acid (TCA) cycle:A malleable metabolic network to counter cellular stress[J].Critical Reviews in Biochemistry and Molecular Biology, 2023, 58(1):81-97.
[23] ALABD A, CHENG H Y, AHMAD M, et al.Abre-binding factor3-wrky DNA-binding protein44 module promotes salinity-induced malate accumulation in pear[J].Plant Physiology, 2023, 192(3):1982-1996.
[24] SKARBEK K, MILEWSKA M J.Biosynthetic and synthetic access to amino sugars[J].Carbohydrate Research, 2016, 434:44-71.
[25] 楼洁, 胡晓, 梁延群, 等.肽聚糖的生物合成及其调控机制研究进展[J].微生物学报, 2023, 63(1):106-123.LOU J, HU X, LIANG Y Q, et al.Peptidoglycan biosynthesis and the regulatory mechanism[J].Acta Microbiologica Sinica, 2023, 63(1):106-123.
[26] 郑佳佳, 薛松, 杨晴晴, 等.细菌半乳糖代谢通路及对细菌毒力的影响研究进展[J].微生物学报, 2025, 65(1):17-28.ZHENG J J, XUE S, YANG Q Q, et al.Research progress in bacterial galactose metabolic pathway and its impacts on bacterial virulence[J].Acta Microbiologica Sinica, 2025, 65(1):17-28.
[27] 陈归航, 李春, 冯旭东.UDP-糖生物合成的研究进展[J].生物学杂志, 2023, 40(2):95-100.CHEN G H, LI C, FENG X D.Research progress of UDP-sugar biosynthesis[J].Journal of Biology, 2023, 40(2):95-100.
[28] SOHLENKAMP C, GEIGER O.Bacterial membrane lipids:Diversity in structures and pathways[J].FEMS Microbiology Reviews, 2016, 40(1):133-159.
[29] MYKYTCZUK N C S, TREVORS J T, LEDUC L G, et al.Fluorescence polarization in studies of bacterial cytoplasmic membrane fluidity under environmental stress[J].Progress in Biophysics and Molecular Biology, 2007, 95(1-3):60-82.
[30] KILSTRUP M, HAMMER K, RUHDAL JENSEN P, et al.Nucleotide metabolism and its control in lactic acid bacteria[J].FEMS Microbiology Reviews, 2005, 29(3):555-590.
[31] MAN Z W, GUO J, ZHANG Y Y, et al.Regulation of intracellular ATP supply and its application in industrial biotechnology[J].Critical Reviews in Biotechnology, 2020, 40(8):1151-1162.