在肉制品的加工过程中常常添加一些盐类,如食盐,镁盐与钙盐等,通过影响肌肉蛋白质的构象来改变肌肉蛋白质的功能特性,最终改善肉制品的品质[1]。蛋白质的构象变化研究是理解蛋白质功能变化不可或缺的重要环节,因为蛋白质特定的生理活性和功能在很大程度上由其构象决定。在肉制品加工及品质控制基础理论研究中,对肌肉蛋白质的二级结构等变化情况进行测定,再结合肌肉蛋白质凝胶品质的相关变化规律,可构建肌肉蛋白质二级结构等构象变化和凝胶品质间的关系,进而快速预测肌肉蛋白质凝胶的品质[2]。因此研究斩拌过程中不同盐处理对肉糜凝胶蛋白质的构象变化和水合特性的影响具有一定的指导意义。
作为一种快速、无损的检测方法,低场核磁已在食品工业的多方面用于样品水分相关性质的检测包括煮制对产品的影响,不同的冷冻、贮藏条件对于各种肉制品相关品质的影响。此外,低场核磁还可用于快速评价猪肉的质量等[3-4]。低场核磁可测定高水分含量样品的水分状态,明确水分在不同样品中的分布情况,进而反映肉中水分-蛋白质之间的相互作用[5]。通过运用该方法,明确水分分布与水分迁移转变规律,可有助于理解不同盐处理对产品主要品质特性的影响[6-7]。
蛋白质二级结构主要是指蛋白质分子局部区域内,多肽链沿一定的方向盘绕和折叠的方式:主要是分子内氢键维系的局部空间排列,包括α-螺旋和β-折叠、β-转角、无规卷曲等[8]。傅里叶红外吸收光谱(Fourier transform infrared spectroscopy, FT-IR)属于分子振动吸收光谱,可以根据蛋白质等生物大分子对应的红外光谱特征吸收峰的谱型、强度、频率等谱学参数变化,来分析不同状态、不同浓度及不同环境中的蛋白质和多肽的二级结构,而且为蛋白质的变性过程以及蛋白质分子间相互作用研究提供便利的手段[9-11]。同时蛋白质和多肽在红外光谱图上会显示出不同振动频率的酰胺带,位于1 700~1 600 cm-1的峰为酰胺I带(amide I),位于1 600~1 500 cm-1处的峰为酰胺Ⅱ带(amide Ⅱ)[1]。其中,酰胺I带对于蛋白质二级结构的研究最有价值,主要通过对羰基伸缩振动和氢键结构的反映提供关于蛋白质骨架的详细信息,常用于研究蛋白质的折叠,解折叠以及聚合情况[2]。另外,1 330~1 220 cm-1的酰胺Ⅲ带也被用于归属蛋白质的二级结构并探讨其内部氢键结合情况[12]。
该研究按照以肉糜乳化凝胶为对象,利用低场核磁共振技术对不同盐处理肉糜乳化凝胶的H1质子的迁移规律进行分析,进而分析蛋白质的水合特性;对肉糜进行红外吸收光谱测试,检测水合阶段蛋白质空间构象包括蛋白质二级结构以及微环境的变化规律,确定水合状态对猪肉糜蛋白质分子构象变化的影响。在肉制品加工及品质控制的基础理论研究中,跟踪斩拌过程中氢质子迁移变化规律,建立水合特征与分子构象变化关系,揭示水分子在溶解和溶胀过程对蛋白分子构象变化和分子间交联的影响,尤其是蛋白-蛋白分子间交联与蛋白-水分子间交联,再结合肌肉蛋白质凝胶品质的相关变化规律,可明确斩拌过程中盐类、水分与蛋白质作用的相关性,为健康的乳化性肉制品开发和品质控制奠定基础,促进肉类加工的发展。
1 材料与方法
1.1 材料与试剂
新鲜猪背最长肌,购于当地大润发超市;食盐(NaCl)、复合磷酸盐(三聚磷酸钠、焦磷酸钠、六偏磷酸钠,质量比1∶1∶1),均为分析纯。
1.2 仪器与设备
TJ12-H绞肉机,广东恒联食品机械制有限公司;Stephan-M5低温真空斩拌机,德国Stephan机械有限公司;SY-1230恒温水浴槽,上海沪粤明科学仪器有限公司;BCD-215KALM海尔立式冷藏柜,青岛海尔股份有限公司;低场核磁共振分析仪,上海纽迈电子科技有限公司;Allegra 64R低温高速离心机,美国贝克曼库尔特有限公司。
1.3 方法
1.3.1 凝胶样品制备
制备程序参照YOUSSEF的方法[13],稍加改动。对经过前处理的猪背最长肌,首先用孔径为6 mm的绞肉机绞碎得到碎肉;再将绞碎的猪背最长肌(1 000 g)与食盐(50 g)、磷酸盐(6.25 g)一起放入乳化斩拌机中高速(3 000 r/min)斩拌1 min,静止2 min以提取盐溶性肌原纤维蛋白;向乳化机中加入冰水(500 g)继续斩拌2 min,获得肉糜。
在斩拌阶段按照4种方式:不加食盐与磷酸盐、只加食盐、只加磷酸盐、加食盐+磷酸盐,分别加入预先绞碎的猪背最长肌高速真空斩拌1 min后,停留2 min,加冰水(1∶1,500 g)后继续真空斩拌2 min后取样,即得到不同盐处理方式的肉糜。
对得到的不同盐处理方式的肉糜(空白组、食盐组、磷酸盐组、食盐+磷酸盐组),分别从斩拌好的相应肉馅中称取质量约35 g的肉糜,置于50 mL带螺旋盖的离心管中,低速(1 800 r/min)4 ℃离心5 min,以驱除肉糜中的气泡,然后加盖密封。75 ℃恒温水浴30 min,取出离心管。静置1 h冷却后取样。
1.3.2 低场核磁共振分析
使用低场核磁共振分析仪对蛋白质的水合特性进行分析,研究蛋白质和水分中的1H质子相互交换和迁移的规律,用以表征蛋白质的水合特征。方法依据BERTRAM等[14],稍作变动。
测试样品为:不同盐处理的加热肉糜。测试条件:质子共振频率为22 MHz,测量温度为32 ℃。首先确定测试参数为:重复扫描32次,重复间隔时间TR为3 000 ms,采样间隔150 μs,回波个数2 500。每个样品平行测定5次,实验重复3次。
样品的测试步骤如下:取2 g肉糜,直接放入15 mm直径的核磁管,然后插入分析仪进行分析。
自旋-自旋弛豫时间T2采用CPMG序列进行测量。CPMG得到的指数衰减曲线用仪器自带的MultiExplnv Analysis软件进行T2反演,得到T2值。反演结果为生成的弛豫图和各个弛豫过程的弛豫幅值、其对应时间常数(峰值)及其所占面积分数、每个峰的起始时间和结束时间。为了分析方便,弛豫图中每个组分的峰值对应时间作为T2。每个组分峰值对应的曲线面积,通过累积积分后作为每个组分对应的峰面积,每个组分峰面积所占总峰面积的峰比例P2可表征对应水分的相对含量。
1.3.3 傅里叶红外吸收光谱测试
将制得的不同盐处理加热后的样品,经冷冻干燥72 h后研磨成粉,采用傅里叶变换红外光谱仪测定试样的FT-IR谱图,KBr压片测定。光谱范围为4 000~400 cm-1,分辨率4 cm-1,信号扫描累加次数32次。
1.4 数据分析
对反演过的T2和P2数据,采用SPSS 19.0进行统计分析,方差分析采用单因素ANOVA分析,数据进行正态分布检验,符合正态分布的多重比较采用LSD法,不符合正态分布的用Tamhane,s-T2(M)检验,差异显著性为p<0.05。
对得到的FT-IR谱图,谱峰拟合采用Peakfit V 4.12拟合软件。作图采用Sigmaplot 12.0软件。
2 结果与分析
2.1 不同盐处理肉糜加热后的水合特性分析
本实验中,新鲜的猪背最长肌经历不同盐处理斩拌加热后,T2弛豫时间变化不一。按照弛豫时间T2由低到高看,分别对应与大分子紧密结合水(T2b<10 ms),处在肌原纤维网状结构粗丝与细丝之间的不易流动水(T21, 10~100 ms)以及肌原纤维网状结构外的游离水(T22>100 ms)。弛豫时间越短,表明该部分水分的流动性越差,而弛豫时间越长则对应流动性越好的那部分水分,弛豫时间越长,代表该种水分被蛋白质束缚越不紧密[15-17]。
由图1可以看出,与空白组相比,食盐与食盐+磷酸盐处理组的T21与T22均显著(p<0.05)增加,即该两种相态水分的流动性显著高于未加任何盐处理的空白组,而该两种相态水分在磷酸盐单独添加的肉糜组与空白组中差异不显著(p>0.05)。
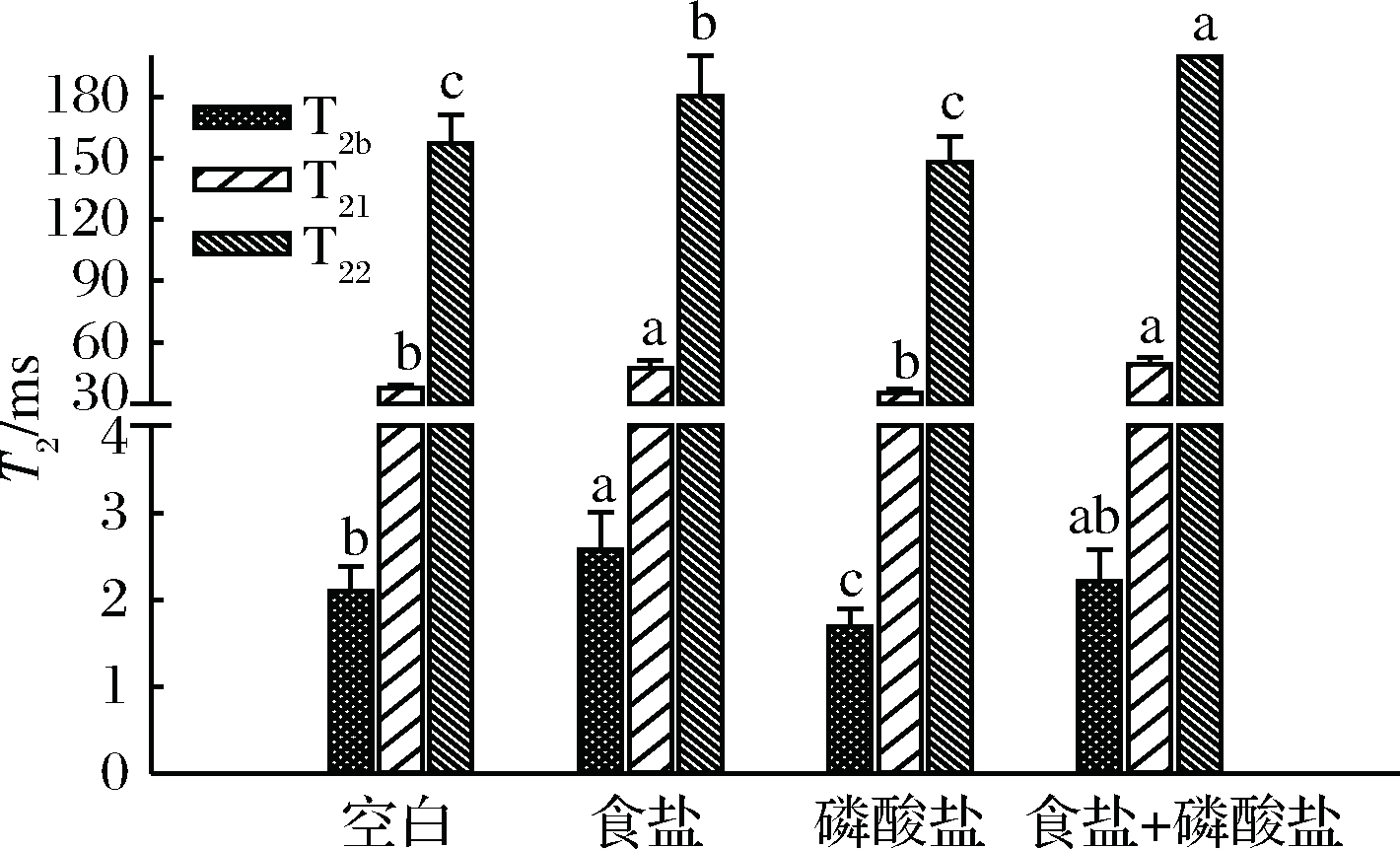
图1 不同盐处理对肉糜加热后T2弛豫时间的影响
Fig.1 Effect of different salt treatments on the heated meat batters relaxation time T2
注:标注有不同字母表示差异显著(p<0.05)。
图2为不同盐处理肉糜的弛豫组分峰面积比例的变化情况。依据弛豫组分峰面积百分比,可以估算氢质子的相对含量,从而反映不同状态水分群的相对含量,然后根据不同状态水分群含量的变化情况,可以进一步评估各种状态水分群的迁移情况[18]。
肉糜加热后,由图2可以看出,食盐+磷酸盐处理组的加热凝胶结合水相对含量显著低于其他处理组,不易流动水含量与食盐组差异不显著(p>0.05)但均显著高于另外两组处理结果,自由水含量则显著低于空白处理。
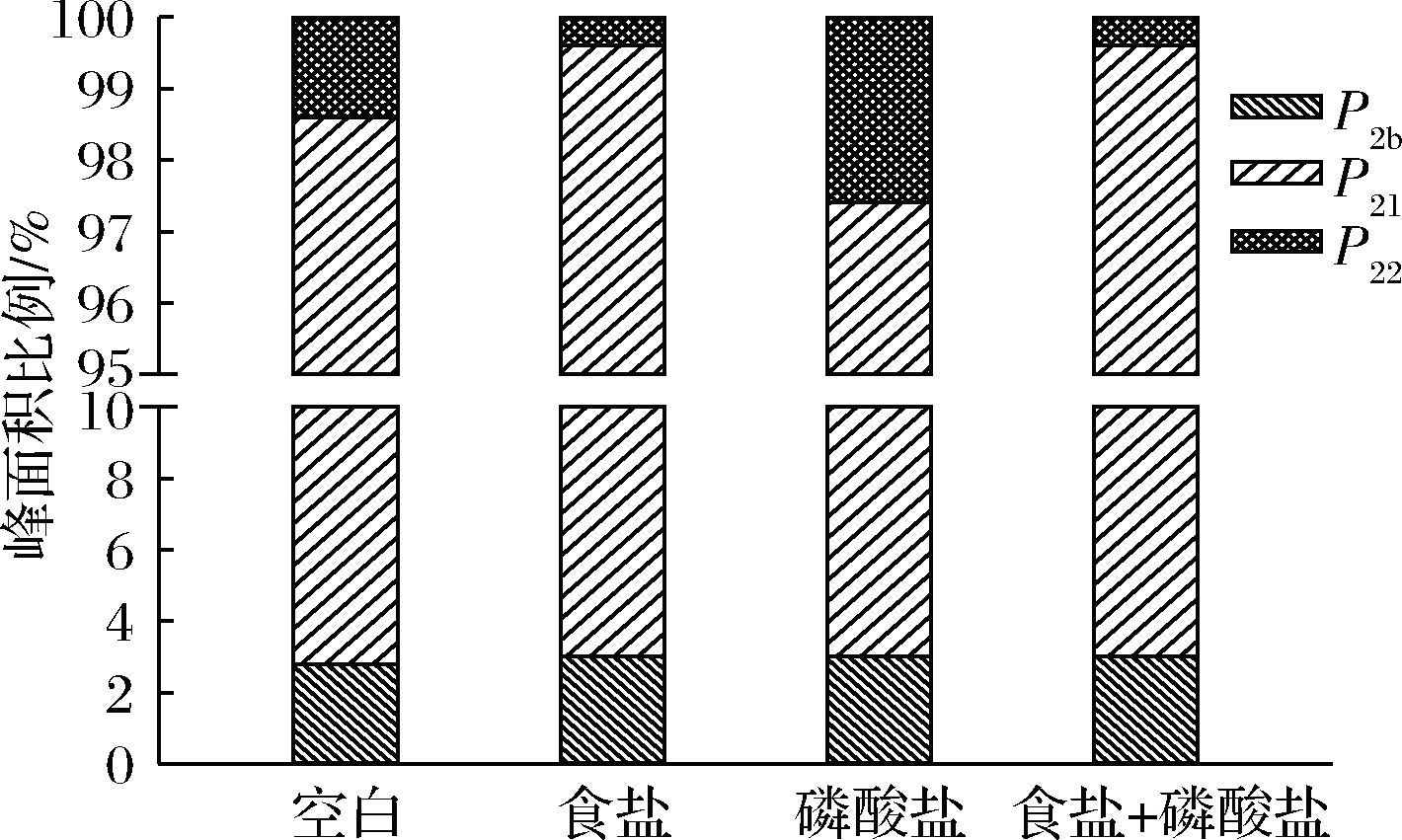
图2 不同盐处理对肉糜加热后弛豫峰比例P2的影响
Fig.2 Effect of different salt treatments on the heated meat batters peak area proportion P2
斩拌过程中添加盐类对于盐溶性蛋白质的提取至关重要,溶解性和蛋白质结构的变化有很大的关系[19],盐溶蛋白的提取程度势必影响蛋白质的溶胀情况及随后的乳化过程,最终对产品的品质比如多汁性、嫩度等造成影响[1]。研究表明:盐离子可选择性地与暴露在蛋白表面的相反电荷结合,破坏肌球蛋白分子之间的离子键,使得蛋白分子与水分子的亲和力增加,蛋白质溶解[20]。另一方面,添加的盐类使得肌原纤维蛋白膨胀,增加了肌丝纤维之间的空隙,肌丝纤维对水分的截留能力减弱,促进了盐溶性蛋白的溶解形成溶胶,因此造成弛豫时间的增加,表现为水分的流动性得到增强[21]。本实验结果也表明盐类的加入使得主要水分流动性增强,与蛋白质的作用几率增大,可能使得水合作用更加充分以形成产品较好的质地。
不易流动水,作为水分在肌肉中的主要(80%)存在形式,是肌肉的主要水分,这部分水分取决于肌原纤维蛋白质凝胶的网状结构变化,是反映肌肉系水力及其变化的主要指标[8]。与空白对照比较,食盐单独使用后蛋白质对不易流动水的束缚强度显著(p<0.05)下降,不易流动水的流动性显著增强;而单独加入磷酸盐的处理,肌肉蛋白质对不易流动水的束缚能力显著增强,不易流动水的流动性显著下降。表明食盐与磷酸盐在蛋白质的水合方面发挥相反的作用,食盐添加后主要水分的流动性增加,可能水分分布相对均匀;反之,主要水分流动性下降,其活动将可能限定在一定的小范围内。
对于不同盐处理的肉糜进行加热后,只有食盐与磷酸盐复合添加处理的自由水含量显著低于空白处理。在肉糜的斩拌后期加入了一定量的水,而且肉糜加热之后,4组处理之间自由水含量的差异仍然存在,说明盐类影响蛋白质的水合溶胀作用,引起水分分布与流动性的差异。蛋白质与许多化学物质之间均存在相互作用,尤其是水、一些盐类离子和有机溶剂常常很容易引起蛋白质结构的变化,甚至是变性最终影响蛋白质的功能特性[12]。因此,有必要在进行水合特性分析的基础上继续对蛋白质结构变化进行下一步的分析。
2.2 不同盐处理加热肉糜傅里叶红外吸收
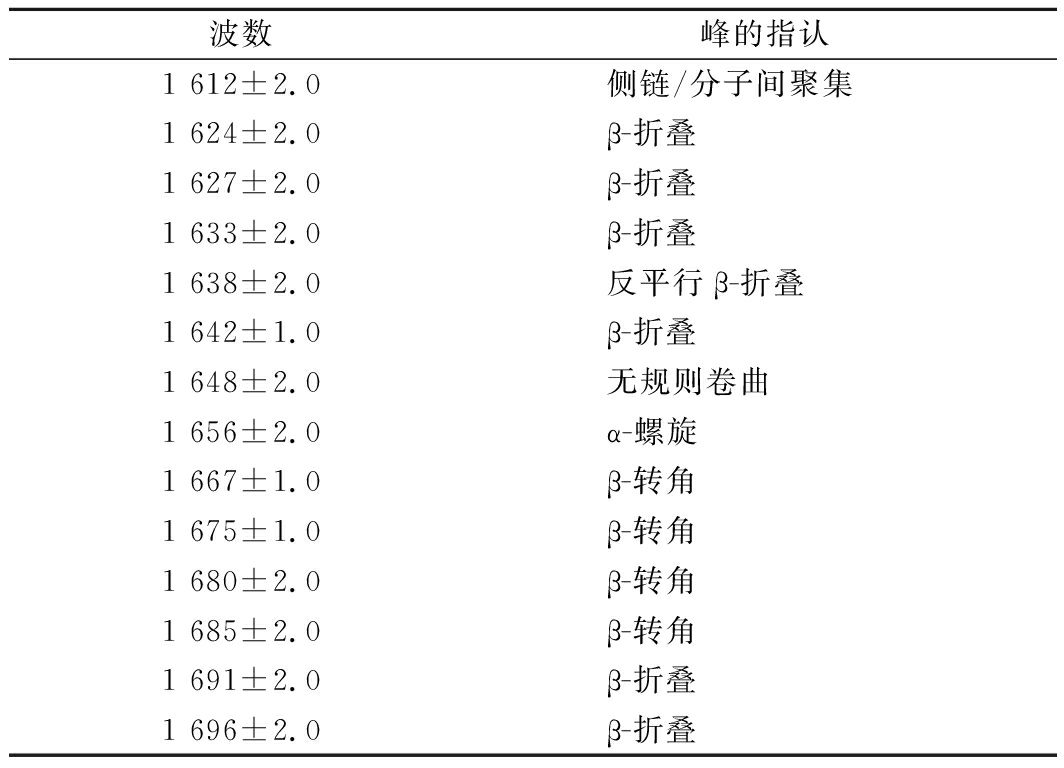
如图3所示,各组加热后的肉糜红外光谱形状与强度没有明显差异。由图4可知,4组处理的二级结构含量变化情况,对于β-折叠结构,食盐+磷酸盐组显著低于其他3个处理,而磷酸盐组则显著高于空白与食盐组,对于α-螺旋结构,磷酸盐组与空白组差异不大,而食盐+磷酸盐组高于食盐组高于另外2组处理。对于无规则卷曲食盐组和磷酸盐组相比空白组显著降低,而β-转角4组之间变化不大。
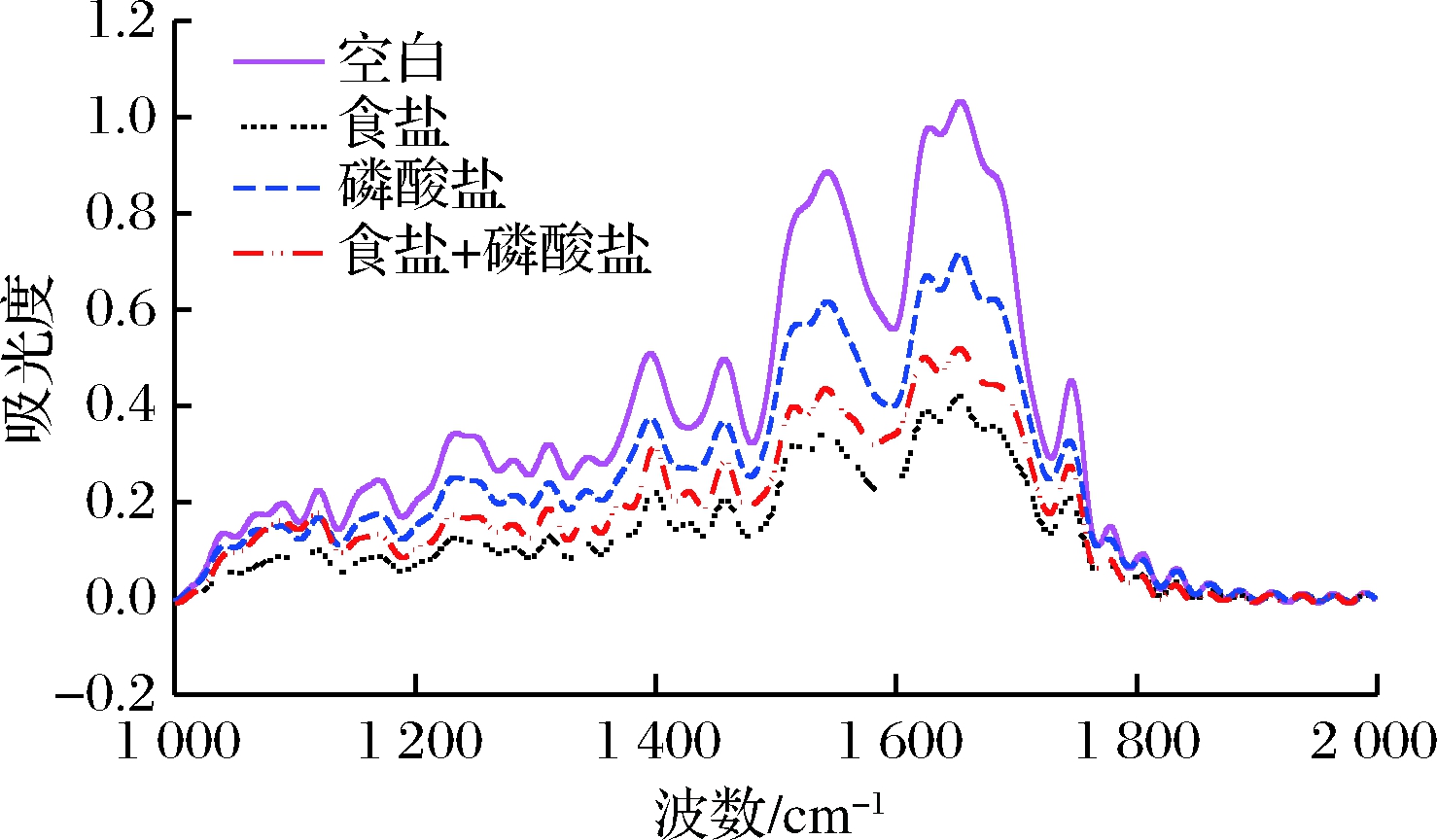
图3 不同盐处理肉糜的红外吸收光谱
Fig.3 FT-IR on the meat batters with different salt treatments
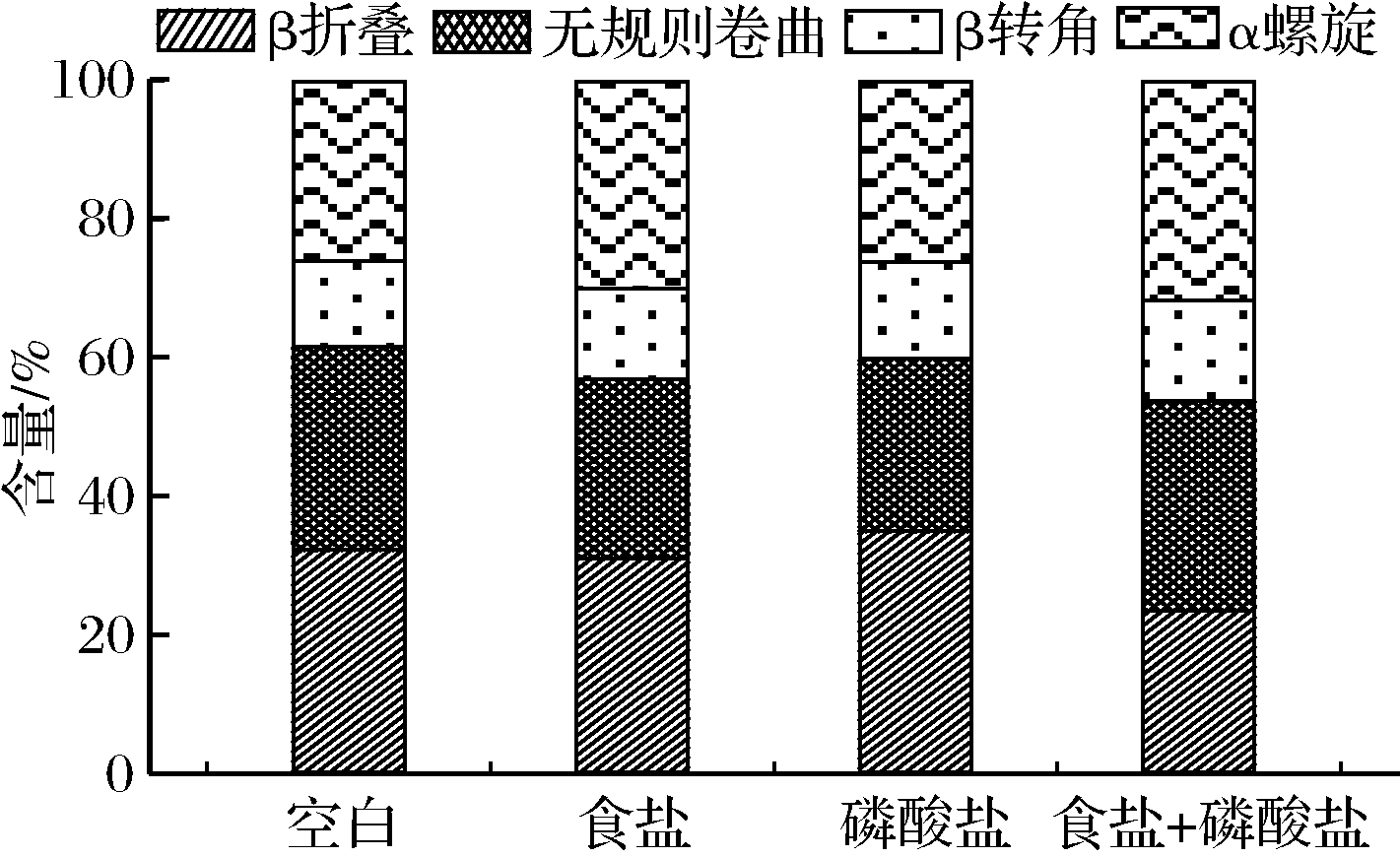
图4 不同盐处理肉糜加热后的蛋白质二级结构
Fig.4 Protein secondary structure of different salt trea- tments on the heated meat batters
维持蛋白质二级结构的作用力有多种,α-螺旋与β-折叠主要是依靠氢键维持,且不同二级结构的氢键强度不同,氢键在凝胶形成后维持网络结构的稳定中起到重要作用。水、盐类离子、有机溶剂或温度作用于蛋白质,导致蛋白质二级结构变化甚至是变性,都是由于它们改变了蛋白质内部的氢键作用[11]。KANG等[22]报道了提高猪肉糜中食盐添加量,β-折叠含量有升高的趋势。β-折叠结构是蛋白质集聚和形成凝胶的基础物质,增加肉制品体系中β-折叠的含量,能够形成良好的凝胶结构,提高肉制品的硬度和保水性[23-24]。董昳廷等[25]也发现凝胶的质构、保水性与其蛋白质二级结构含量密切相关。本实验肉糜在由绞碎到加盐斩拌再到加水发生水合,无规则卷曲含量呈下降趋势。而张极震等[26]报道了类似的结果,利用FT-IR研究了水对肌红蛋白和聚赖氨酸溴化氢结合物二级结构的影响,认为提高水合度,就减少了蛋白质无序结构含量,增加了有序二级结构含量。
表1 外光谱酰Ⅰ带对蛋白质二级结构的波数[1,27-28]
Table 1 Deconvoluted amide I band frequencies andassignments to secondary structure for protein
2.3 相关性分析
加热肉糜蛋白质的二级结构与水合特性的相关性分析结果如表2所示。
表2 加热肉糜蛋白质的二级结构与水合特性的相关性分析
Table 2 Correlation analysis of heated meat batter proteinsecond structure and hydration states

注:*表示在 0.05 水平(双侧)上显著相关, **表示在 0.01 水平(双侧)上显著相关。
对于不同盐处理加热后的肉糜,其β-折叠含量与加热后肉糜的不易流动水T21、自由水弛豫时间T22呈显著负相关(R=-0.970,p<0.05;R=-0.960,p<0.05);α-螺旋含量与加热后肉糜的结合水比例呈显著负相关(R=-0.971,p<0.05),与不易流动水比例呈显著正相关(R=0.980,p<0.05)。即熟肉糜中不易流动水与自由水的流动性越强,加热后得到的肉糜中的β-折叠含量越低;熟肉糜中结合水比例越高而不易流动水比例越低,则加热后得到的肉糜中的α-螺旋含量越低。
3 结论
在不同盐处理的加热肉糜中,与空白组相比较,食盐组与食盐+磷酸盐组的弛豫时间T2增加,即结合水、不易流动水和自由水的流动性均增加,说明乳化凝胶对3种相态水分的束缚能力减弱,而磷酸盐组与之相反;3个处理组(食盐组、磷酸盐组、食盐+磷酸盐组)均表现出P2b、P22降低而P21增加,即结合水与自由水的含量降低,部分转化为不易流动水导致其含量升高。在蛋白质二级结构变化中,食盐单独加入使得部分无规则卷曲向α-螺旋转变,而磷酸盐的单独添加使得部分无规则卷曲向β-折叠转变;此外,乳化凝胶中不易流动水与自由水的流动性越强,β-折叠含量越低;乳化凝胶中结合水比例越高而不易流动水比例越低,则乳化凝胶中的α-螺旋含量越低。因此,不同盐处理方式对肉糜凝胶的水合特性产生变化,进而影响肉糜凝胶的蛋白质构象。实际生产过程中,为获得更优质的产品,应考虑不同方式的盐处理。
参考文献
[1] KONG J, YU S. Fourier transform infrared spectroscopic analysis of protein secondary structures[J]. Acta Biochimica Et Biophysica Sinica, 2007, 39(8): 549-559.
[2] 张秋会,黄现青,李苗云,等. 傅里叶红外光谱法研究肌肉蛋白质的二级结构[J]. 食品与发酵工业, 2015, 41(10): 247-251.
[3] LI T, RUI X, LI W, et al. Water distribution in tofu and application of T2 relaxation measurements in determination of tofu’s water-holding capacity[J]. Journal of Agricultural and Food Chemistry, 2014, 62(34): 8 594-8 601.
[4] S NCHEZ-ALONSO I, MORENO P, CARECHE M. Low field nuclear magnetic resonance (LF-NMR) relaxometry in hake (Merluccius merluccius L.) muscle after different freezing and storage conditions[J]. Food Chemistry, 2014, 153: 250-257.
NCHEZ-ALONSO I, MORENO P, CARECHE M. Low field nuclear magnetic resonance (LF-NMR) relaxometry in hake (Merluccius merluccius L.) muscle after different freezing and storage conditions[J]. Food Chemistry, 2014, 153: 250-257.
[5] HINRICHS R, GÖTZ J, NOLL M, et al. Characterisation of the water-holding capacity of fresh cheese samples by means of low resolution nuclear magnetic resonance[J]. Food Research International, 2004, 37(7): 667-676.
[6] ANDERSEN R H, ANDERSEN H J, BERTRAM H C. Curing-induced water mobility and distribution within intra-and extra-myofibrillar spaces of three pork qualities[J]. International Journal of Food Science & Technology, 2007, 42(9): 1 059-1 066.
[7] CARNEIRO C, M RSICO E T, RIBEIRO R, et al. Studies of the effect of sodium tripolyphosphate on frozen shrimp by physicochemical analytical methods and Low Field Nuclear Magnetic Resonance (LF 1H NMR)[J]. LWT-Food Science and Technology, 2013, 50(2): 401-407.
RSICO E T, RIBEIRO R, et al. Studies of the effect of sodium tripolyphosphate on frozen shrimp by physicochemical analytical methods and Low Field Nuclear Magnetic Resonance (LF 1H NMR)[J]. LWT-Food Science and Technology, 2013, 50(2): 401-407.
[8] 何建川,邵阳,张波. 蛋白质和变性蛋白质二级结构的FTIR分析进展[J]. 化学研究与应用, 2012, 24(8): 1 176-1 180.
[9] SAGUER E, ALVAREZ P, ISMAIL A A. Heat-induced denaturation/aggregation of porcine plasma and its fractions studied by FTIR spectroscopy[J]. Food Hydrocolloids, 2012, 27(1): 208-219.
[10] ULRICHS T, DROTLEFF A M, TERNES W. Determination of heat-induced changes in the protein secondary structure of reconstituted livetins (water-soluble proteins from hen’s egg yolk) by FTIR[J]. Food Chemistry, 2015, 172: 909-920.
[11] 卢雁,张玮玮,王公轲. FTIR用于变性蛋白质二级结构的研究进展[J]. 光谱学与光谱分析, 2008(1): 88-93.
[12] 谢孟峡,刘媛. 红外光谱酰胺Ⅲ带用于蛋白质二级结构的测定研究[J]. 高等学校化学学报, 2003(2): 226-231.
[13] YOUSSEF M K, BARBUT S. Physicochemical effects of the lipid phase and protein level on meat emulsion stability, texture, and microstructure [J]. Journal of Food Science, 2010, 75(2): S108-S114.
[14] BERTRAM H C, ANDERSEN R H, ANDERSEN H J. Development in myofibrillar water distribution of two pork qualities during 10-month freezer storage[J]. Meat Science, 2007, 75(1): 128-133.
[15] SHAO J H, DENG Y M, SONG L, et al. Investigation the effects of protein hydration states on the mobility water and fat in meat batters by LF-NMR technique[J]. LWT-Food Science and Technology, 2016,66: 1-6.
[16] LI C B, LIU D Y, ZHOU G H, et al. Meat quality and cooking attributes of thawed pork with different low field NMR T21[J]. Meat Science, 2012, 92(2): 79-83.
[17] MCDONNELL C K, ALLEN P, DUGGAN E, et al. The effect of salt and fibre direction on water dynamics, distribution and mobility in pork muscle: A low field NMR study[J]. Meat Science, 2013, 95(1): 51-58.
[18] PEARCE K L, ROSENVOLD K, ANDERSEN H J, et al. Water distribution and mobility in meat during the conversion of muscle to meat and ageing and the impacts on fresh meat quality attributes—A review[J]. Meat Science, 2011, 89(2): 111-124.
[19] 孔保华. 肉品科学与技术[M]. 北京:中国轻工业出版社, 2007: 125-134.
[20] 王冰冰,张丽君,万雪,等. 盐处理对冷冻扇贝肉糜制品性质的影响[J]. 食品与生物技术学报, 2012(9): 1 002-1 007.
[21] DHALL A, HALDER A, DATTA A K. Multiphase and multicomponent transport with phase change during meat cooking[J]. Journal of Food Engineering, 2012, 113(2): 299-309.
[22] KANG Z L, ZOU Y F, XU X L, et al. Effect of a beating process, as a means of reducing salt content in Chinese-style meatballs (kung-wan): A physico-chemical and textural study[J]. Meat Science, 2014, 96: 147-152.
[23] LIU R, ZHAO S M, LIU Y M, et al. Effect of pH on the gel properties and secondary structure offish myosin[J]. Food Chemistry, 2010, 121: 196-202.
[24] HERRERO A M. Raman spectroscopy a promising technique for quality assessment of meat and fish: A review[J]. Food Chemistry, 2008, 107: 1 642-1 651.
[25] 董昳廷. 蛋清和大豆分离蛋白复合凝胶特性的研究[D]. 无锡:江南大学, 2014: 28-30.
[26] 张极震,梁圻. 水在稳定肌红蛋白天然结构中的作用[J]. 生物物理学报, 1995, 11(1): 5-10.
[27] DONG A, HUANG P, CAUGHEY W S. Redox-dependent changes in beta-extended chain and turn structures of cytochrome c in water solution determined by second derivative amide I infrared spectra[J]. Biochemistry, 1992, 31(1): 182-189.
[28] DONG A, CAUGHEY B, CAUGHEY W S, et al. Secondary structure of the pentraxin female protein in water determined by infrared spectroscopy: Effects of calcium and phosphorylcholine[J]. Biochemistry, 1992, 31(39): 9 364-9 370.