山葡萄(Vitis amurensis Rupr)也称东北山葡萄,原产中国东北、华北及朝鲜、日本、俄罗斯远东地区,是葡萄科葡萄属落叶藤本植物。我国东北山葡萄资源主要分布于辽宁、吉林、黑龙江三省的长白山和兴安岭山脉中,其中通化地区是东北葡萄产区的主要栽培以及酒的生产地[1]。目前,通化集安地区主要栽培‘双红’‘双优’‘公酿1号’和‘北冰红’等品种。其中,‘双优’山葡萄是1963年吉林农业大学从‘双庆’营养系中选育而成,在通化集安地区栽培历史有20年以上,葡萄的栽培和管理技术较为成熟。其浆果着生紧、粒小、圆形、紫黑色、皮薄、味酸甜和果香味浓郁。含糖量为110~130 g/L,含酸量为20~23 g/L,出汁率65%[2]。由于‘双优’山葡萄低糖、高酸,使其酒口感不佳,香气浓郁性和复杂性降低。俗话说“葡萄酒的质量先天在于葡萄,后天在于工艺”,所以可以通过后天的工艺技术改善山葡萄酒品质不足,同时强化它的特色。然而,多数研究主要针对山葡萄或山葡萄酒的有机酸、花色苷或香气成分检测等方面[3-4],提高‘双优’山葡萄酒品质技术的研究较少。
香气成分是葡萄酒品质的主要因素,构成葡萄酒香气的化合物复杂多样,有几百乃至上千种,主要有醇、酯、内酯、缩醛、脂肪酸、单萜醇氧化物等1 300多种,这些气味各异的物质之间通过累加、协同、分离以及抑制等相互作用,使葡萄酒香气千变万化,多种多样[5-6]。山葡萄香气种类也比较丰富,涂正顺等[7]对‘双优’等品种的香气成分进行分析,‘双优’果实中有45种香味物质,其主要含有乙酸乙酯、己酸乙酯、橙花醇乙酸酯等表现为果香的成分。研究发现,葡萄酒香气成分中糖苷香气物质则部分代表了葡萄品种的潜在香气,在β-葡萄糖苷酶作用下,水解酯、醇、萜烯类、C13-去甲类异戊二烯和苯衍生物等糖苷类前体物质释放出相应的糖苷配基和糖类,赋予葡萄酒香气[8-9]。WANG等[10]研究3种不同β-葡萄糖苷酶对蛇龙珠葡萄酒香气和花色苷的影响,研究发现β-葡萄糖苷酶水解糖苷类物质前体和花色苷,酶处理后香气成分显著增加而花色苷含量略有降低,低pH值对β-葡萄糖苷酶活性具有明显抑制作用。RODRIGUEZ等[11]研究发现葡萄果实内和酵母菌株产β-葡萄糖苷酶具有水解β-葡萄糖苷酶水解糖苷类物质前体释放香气成分的作用,但水解作用受葡萄酒中高的糖、酒精度和酚类物质以及低pH值等发酵条件影响。
因此,本文以‘双优’山葡萄为原料发酵葡萄酒,研究β-葡萄糖苷酶对其品质的影响。测定在发酵过程中β-葡萄糖苷酶活力变化以及发酵结束时葡萄酒基本理化指标和香气成分,初步分析山葡萄酒对β-葡萄糖苷酶活力的影响,进一步探讨β-葡萄糖苷酶对‘双优’山葡萄酒增香作用。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
供试葡萄品种为‘双优’山葡萄品种。本实验摘取吉林省通化市集安地区葡萄园(东经125°34E,北纬40°52N)中成熟山葡萄,采摘时间为2015年9月25日。‘双优’山葡萄理化指标为:单果重1.35 g,果实比重1.07 g/cm3,出汁率45.49%,白利度16 °Bx,总糖60.54 g/L,总酸14.67 g/L,总花色苷0.207 g/L。
1.1.2 试剂
葡萄糖、NaCl、酵母浸粉、胰蛋白胨、葡萄糖、琼脂、亚硫酸、柠檬酸、Na2CO3等为国产分析纯;4-甲基-2-戊醇为色谱纯,购于上海一基实业有限公司;p-硝基苯基-β-D-葡萄糖苷(pNPG)购于生工生物工程(上海)股份有限公司。葡萄酒专用酵母菌(RV171菌株)购于安琪酵母有限公司;β-葡萄糖苷酶为本实验室用黑曲霉菌株发酵获得酶提取物(酶活力为10 U/g,最适温度为50 ℃,最适pH值为5.0)。
1.2 仪器与设备
ME204E型分析天平,梅特勒 托利多国际股份有限公司;UV-2600型紫外可见分光光度计,日本岛津公司;TRACE1300/ISQ-LT型气相色谱-质谱联用仪,美国赛默飞世尔科技公司;PC-420D型固相微萃取(SPME),美国色谱科公司。
1.3 方法
1.3.1 葡萄酒酿制工艺
(1)挑选、清洗、破碎和除梗:选取‘双优’,完全成熟的、新鲜的、无机械损伤的、无病虫害的山葡萄;采用破碎-除梗机去除果梗并机械破碎,将破碎山葡萄汁装入发酵罐内,装入量为发酵罐体积的70%~80%,发酵罐体积为5 L;同时,将体积分数为5%亚硫酸加入到山葡萄汁中,使其含量达0.05 g/L SO2。(2)接种:将0.1%葡萄酒专用干酿酒酵母活化,接种到山葡萄汁中,接种量为1.0×106CFU/mL,充分搅拌。(3)加酶增香:将β-葡萄糖苷酶以100 U/L(以山葡萄汁体积计)加入至山葡萄汁中,充分搅拌,以未加入β-葡萄糖苷酶的山葡萄酒为对照。(4)发酵:封闭发酵,每天早晚2次开封充分搅拌,搅拌时使上浮葡萄皮下沉,充分浸渍;浸渍时间7 d后,将山葡萄皮、籽与山葡萄汁分离。(5)澄清:分离山葡萄酒再用0.4 g/L膨润土处理,澄清并稳定山葡萄酒,每3 d处理1次,共处理2次,获得澄清山葡萄酒。(6)陈酿:发酵罐密封陈酿增香5 d,陈酿温度为(18±2) ℃。(7)中止发酵:补加0.05 g/L SO2停止发酵。(8)取样:每个处理分别用3个平行发酵罐进行发酵,每2 d取1次样品,每次分别从3个平行发酵罐中取样进行检测。
1.3.2 β-葡萄糖苷酶酶活力测定
β-葡萄糖苷酶酶活力测定采用pNPG法检测,测定‘双优’山葡萄酒发酵过程中每1天酶活。将1 mL样品与1.25 mL 1 mmol/L的pNPG和3.75 mL柠檬酸-磷酸缓冲液(pH值5.0)混合液反应30 min,然后加入5 mL 1 mol/L Na2CO3终止反应。反应后样品在400 nm下测定吸光度,即为产物对硝基苯酚(pNP)浓度。β-葡萄糖苷酶酶活力单位(U)定义为:40 ℃条件下1 min内催化生成1 μmol pNPG所需要的酶量。
1.3.3 葡萄酒理化指标的测定
分别测定‘双优’山葡萄汁、中止发酵后对照和酶处理山葡萄酒样品的理化指标,测定方法:(1)可滴定酸采用电位滴定法,用酒石酸(g/L)计。(2)总糖采用斐林试剂热滴定法测定,以葡萄糖(g/L)计。(3)总花色苷采用pH示差法,以花色苷(g/L)计。(4)色度采用色度分析,依据1976年CIE L*、a*、b*色度标准,测定450、520、630 nm波长处的吸光度,依据4个吸光度计算L*、a*、b*数值。
1.3.4 顶空固相微萃取(solid-phase microextraction,SPME)提取香气成分
分别取8 mL‘双优’山葡萄汁、中止发酵后对照和酶处理的山葡萄酒样品加入到15 mL萃取瓶中,加入0.8 g NaCl稳定样品,再加入30 μL质量浓度为3.2 g/L 4-甲基-2-戊醇为内标物,在45 ℃下预处理10 min,再用萃取头(50/30 μm DVB/CAR/PDMS)在45 ℃下萃取30 min。
1.3.5 气相色谱-质谱联用仪(gas chromatography-mass spectrometer,GC-MS)测定香气成分
(1)色谱条件:色谱柱为30 m×0.25 mm×0.25 μm毛细管色谱柱(赛默飞公司,HP-5,弱极性柱子);进样口温度为250 ℃,热解析时间为8 min;载气流速为1 mL/min;不分流进样;柱室程序升温为初始柱温32℃、保持3 min,以2 ℃/min速率升至50 ℃、保持2 min,再以4 ℃/min升至230 ℃、保持8 min。
(2)质谱条件:MSD检测器;电子轰击(EI)离子源;质量扫描范围:m/z (30~450);离子源温度230 ℃;传输线温度280 ℃。
(3)GC-MS分析:样品的香气成分经气相色谱-质谱联用仪测得各物质的色谱峰后,将上述的各色谱峰所对应化合物的名称、分子式、结构式与2014年NIST谱图进行检索和比对,再结合文献进行人工谱图解析,鉴定和分析。采用内标半定量法计算香气成分含量,按公式(1)计算。
![]()
(1)
式中:ai为待测物的峰面积;as为内标物的峰面积;Xi为待测物的含量,mg/L;Xs为内标物的含量,mg/L。
1.3.6 香气活性值(odour activity values,OAVs)
OAVs是衡量葡萄酒典型香气重要指标,它是根据文献查找每个香气物质在9.5%~14%乙醇溶液中的阈值(mg/L),再根据香气物质的阈值和样品中含量计算每个物质的OAVs,以此表征某种香气化合物对香气贡献的大小。一般认为香气物质OAVs>1时,对葡萄酒典型香气具有显著的贡献,而在1以下说明嗅觉器官对这种物质的气味无感觉,某香气物质的OAVs越大,说明对葡萄酒整体香气的贡献度也越大[12-13]。
1.3.7 数据统计
采用SPSS Statistics 19对数据进行单因素方差分析(ANOVA)检验其差异显著性,每个处理测定3次,结果用![]() 表示。
表示。
2 结果与分析
2.1 β-葡萄糖苷酶活力变化
‘双优’山葡萄酒发酵过程中,对照和添加β-葡萄糖苷酶山葡萄酒中β-葡萄糖苷酶活力变化见图1。由图1可知,‘双优’山葡萄汁中β-葡萄糖苷酶活力
为2.21 U/L,说明‘双优’山葡萄汁中含有少量的β-葡萄糖苷酶[14]。添加100 U/L(以山葡萄汁体积计)β-葡萄糖苷酶的山葡萄汁酶活力仅为46.45 U/L,说明‘双优’山葡萄汁环境降低β-葡萄糖苷酶活力,一些研究也证明部分菌株所产β-葡萄糖苷酶在葡萄酒中活力会大大降低[15]。随着发酵时间延长,对照组山葡萄酒中β-葡萄糖苷酶活力先增加后减少;在发酵4~10 d酶活力变化较稳定,在发酵第6天达到最大值12.46 U/L,随后平缓降低;说明山葡萄酒中存在产β-葡萄糖苷酶的菌株,使β-葡萄糖苷酶活力增加。在酶处理山葡萄酒中,随着发酵时间延长酶活力迅速增加,在发酵第7天酶活力达到最大值为72.42 U/L,一方面,微生物代谢产生β-葡萄糖苷酶使其活力增加。另一方面,可能是由于β-葡萄糖苷酶逐渐适应山葡萄酒发酵环境,对山葡萄酒低酸环境有了一定耐受性,恢复部分酶活力。随后酶处理山葡萄酒的酶活力迅速降低,到第14天后酶活力降低趋于平缓,因为β-葡萄糖苷酶水解山葡萄酒中糖苷类香气前体物质产生游离香气物质而被消耗,同时也可能是产物对酶活性具有抑制作用,使酶活力降低。
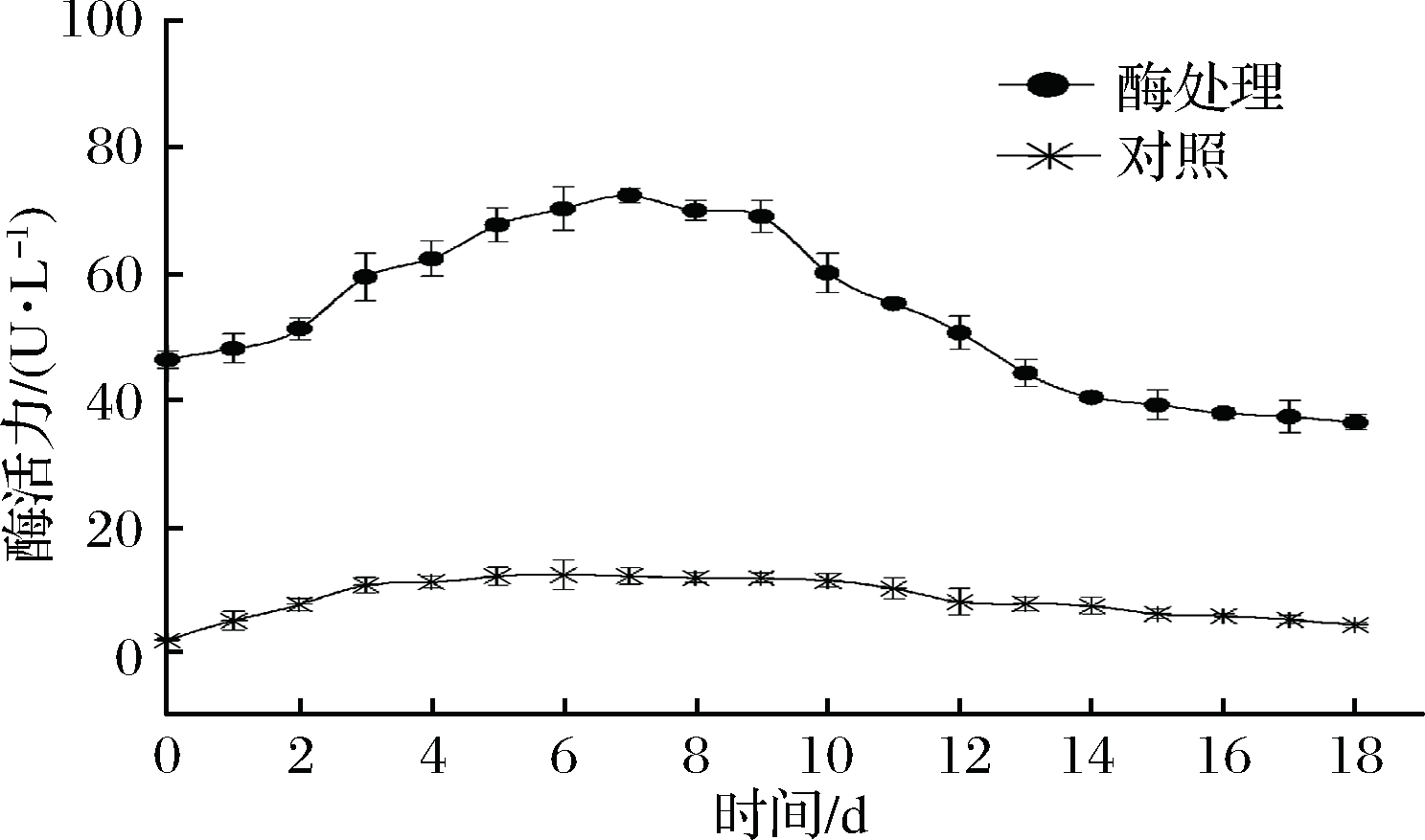
图1 在葡萄酒中β-葡萄糖苷酶活力的变化
Fig.1 Changes of β-glycosidase activities in wines
2.2 山葡萄酒理化特性
‘双优’山葡萄汁以及发酵结束时对照组和添加β-葡萄糖苷酶山葡萄酒处理组理化指标见表1。
表1 理化指标结果
Table 1 The results of physicochemical indexes

注:同一行不同字母表示显著性差异(p<0.05,n=3);“NA”表示未检测出成分。
由表1可知,‘双优’山葡萄汁总糖和总花色苷含量显著高于山葡萄酒,而山葡萄酒酒精度显著增加;可滴定酸降低不明显。‘双优’山葡萄汁L*值和a*值低于山葡萄酒,说明山葡萄汁经菌株发酵后成分和颜色发生了显著变化。比较对照和酶处理‘双优’山葡萄酒理化特性可知,对照组总糖含量和酒精度显著低于酶处理(p<0.05),可能是β-葡萄糖苷酶水解山葡萄酒中糖苷类香气前体物质产生游离香气物质,同时释放出糖类,糖类进一步代谢生成醇。对照组总花色苷含量显著高于酶处理组(p<0.05),β-葡萄糖苷酶对总花色苷具有水解作用[10]。对照和酶处理组的可滴定酸和颜色无明显差异(p>0.05)。
2.3 山葡萄酒香气成分分析
对‘双优’山葡萄汁、加入β-葡萄糖苷酶和对照的‘双优’山葡萄酒香气进行定性和半定时分析,结果见表2。由表2可知,共检测和鉴定出54种香气物质,包括酯类28种、醇类8种、酸类4种、酮类3种、醛类5种、挥发性酚类1种、单萜烯类2种、C13-去甲类异戊二烯类1种和苯衍生物类2种,山葡萄汁、对照和酶处理组种类分别为24、50和54种;酶处理组香气物质总量显著高于对照和山葡萄汁处理组(p<0.05),山葡萄汁、对照和酶处理组的香气物质总量分别为76.18、124.28和184.99 mg/L。由图2可知,酯类含量最高,其他类别依次为醇类、苯衍生物类、酮类、酸类、醛类、C13-去甲类异戊二烯类、挥发性酚类和单萜烯类。每类香气物质酶处理组含量显著高于对照组(p<0.05),对照与酶处理组之间大部分香气物质含量差异显著,说明β-葡萄糖苷酶对葡萄酒的香气产生了影响。
2.3.1 酯类香气物质
酯类是影响葡萄酒香气的重要挥发性化合物,由脂肪酸和醇在酯酶催化作用下可形成酯,它们能赋予葡萄酒果香和花香[16-17]。从图2和表2可以看出,山葡萄汁、对照与酶处理组的酯类总量之间差异显著,分别为55.35、66.62和89.34 mg/L;山葡萄汁中己酸乙酯(香蕉、青苹果)、乙酸己酯(水果、花香)、辛酸乙酯(花香、香蕉、梨)、癸酸乙酯(花香、肥皂味)含量显著高于山葡萄酒(p<0.05),其他检测到的酯类含量均低于山葡萄酒,山葡萄汁检测到酯类种类数量为13种远远小于山葡萄酒的28种,说明山葡萄汁以果香和花香等品种的酯香为主,经过发酵后山葡萄酒产生了大量发酵酯香,丰富‘双优’山葡萄酒的香气风味。比较对照和酶处理‘双优’山葡萄酒酯类成分可知,己酸甲酯只在酶处理组检测到。酯类含量较高的前4种依次为乙酸乙酯>己酸乙酯>辛酸乙酯>乙酸异戊酯,它们经酶处理后含量分别较对照提高了11.76%、37.25%、101.81%、51.35%。在酯类物质中有20种酯类物质酶含量处理组显著高于对照组(p<0.05)。其中,羟基酯类检测到2-羟基-4-甲基戊酸乙酯,它的配基与糖类形成糖苷类香气前体物质,经β-葡萄糖苷酶水解后释放出来,其酶处理组含量显著高于对照组(p<0.05),并较对照组提高了150%。说明β-葡萄糖苷酶可以水解‘双优’山葡萄酒酯类、糖苷类香气前体物质,促进酒中的酯类香气物质形成。
2.3.2 醇类香气物质
醇类物质是发酵过程中产生的一类重要挥发性化合物,主要由酵母代谢、酯类的水解作用、糖苷酶水解糖苷类香气前体物质产生的[18]。由表2和图2可知,山葡萄汁、对照与酶处理组的醇类总量之间差异显著(p<0.05),分别为16.81、42.94和68.53 mg/L;山葡萄汁中醇类种类(4种)远远低于山葡萄酒(8种),说明醇类香气成分主要是山葡萄酒经酵母菌发酵所产生的。比较对照和酶处理组‘双优’山葡萄酒醇类香气物质可知,酶处理组均显著高于对照(p<0.05);醇类含量较高的前2种依次为异戊醇(醇香、涩味)>正己醇(草本植物、青草),它们经酶处理后含量分别较对照提高了41.77%和419.54%。其中,正己醇是C6化合物糖苷类香气物质,它的配基与糖类形成糖苷,经β-葡萄糖苷酶水解后释放出来,所以酶处理‘双优’山葡萄酒的正己醇含量显著增加,促进酒中的C6化合物类糖苷香气物质的形成。
醇类物质根据C的数量可以分为低级醇(≤C6)和高级醇(>C6)。低级醇具有刺激、辛辣和涩味,是葡萄酒中醇香的来源。高级醇又被称为杂醇,其含量低于300 mg/L时会提高葡萄酒复杂性,而含量高于400 mg/L则会给葡萄酒带来负面影响[19-20]。从表2可知,在‘双优’山葡萄酒检测2种低级醇分别是异戊醇(C5H12O)和正己醇(C6H14O),它们含量远远高于其他醇类物质,并且酶处理组含量显著高于对照组;而检测到的高级醇种类有6种,含量均低于300 mg/L,酶处理组含量高于对照组。
说明β-葡萄糖苷酶促进葡萄酒中产生醇类物质,增加葡萄酒的醇香、草香和花香,使葡萄酒产生令人愉悦的复杂、浓郁的香气。
表2 香气成分分析结果 单位:mg/L
Table 2 The results of aroma compounds analysis

续表2
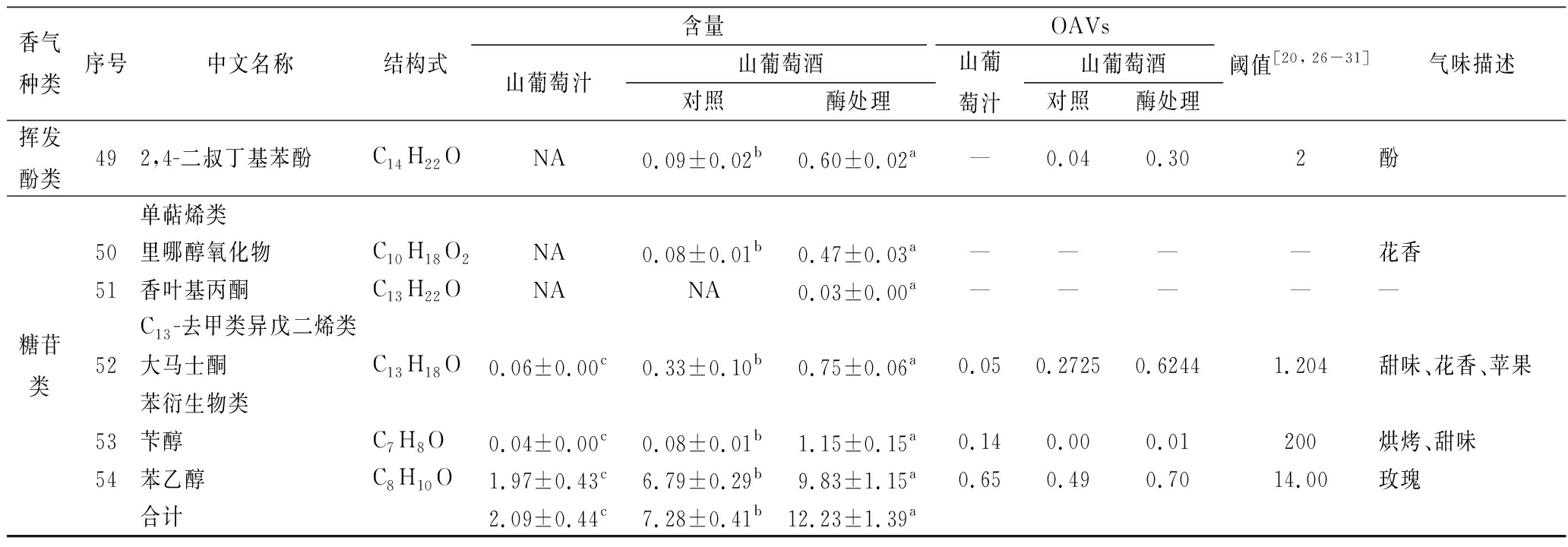
注:同一行不同字母表示显著性差异(p<0.05,n=3);“NA”表示未检测出成分;“—”表示未查到相关资料或计算出OAVs。
2.3.3 酸类香气物质
葡萄酒中酸类挥发性化合物主要来源于乳酸菌等细菌代谢,具有油脂、酸腐以及奶酪的气味[21]。从表2和图2可知,酶处理与山葡萄汁和对照组的酸类总量之间差异显著(p<0.05),其总量分别为3.59、1.87和1.00 mg/L;山葡萄汁酸类种类(2种)小于山葡萄酒(4种)。比较对照和酶处理‘双优’山葡萄酒处理组酸类香气物质可知,在检测出4种酸类物质中,2-甲基-2-己醇醋酸只在酶处理组检测到。而含量较高的前2种依次为辛酸(奶油、杏仁)>正癸酸(腐臭、脂肪),酶处理组显著高于对照组(p<0.05),它们经酶处理后含量分别较对照提高了306.94%和117.65%。研究认为辛酸在低浓度时会有奶酪和奶油的香味,而当浓度过高时则会出现腐败和刺激味等异味[22],而正癸酸也呈现腐臭味道。因此考虑β-葡萄糖苷酶处理使葡萄酒产生一定的负面影响。
2.3.4 酮、醛和挥发性酚类香气物质
醛和酮主要是由酸的脱羧和醇的氧化形成[23]。从表2和图2可知,酮、醛和酚类3大类香气物质中,山葡萄汁只检测到癸醛(橘子)和苯乙醛(花香、蜂蜜)2种醛类成分。在检测出的3种酮类物质中,甲壬酮只在酶处理组检测到,酶处理组与对照组酮类总量差异显著(p<0.05),分别为9.63和5.77 mg/L。在醛类物质中,山葡萄汁、对照与酶处理组的醛类总量之间差异显著(p<0.05),分别为0.06、0.61和1.09 mg/L。挥发酚类物质中只检测到2,4-二叔丁基苯酚1种,酶处理与对照组挥发性酚类差异显著(p<0.05),分别为0.60和0.09 mg/L。在酮、醛和挥发性酚类香气物质中,含量较高前3种依次为二异丁基酮>2,4-二叔丁基苯酚>安息香醛,它们经酶处理后含量分别较对照提高了62.32%、566.66%、86.96%。
2.3.5 糖苷类香气物质
香气糖苷除去酯类中羟基酯类物质和醇类中C6化合物类,含量最丰富糖苷类物质为萜烯类、C13-去甲类异戊二烯类和苯衍生物类。它们的配基与糖类物质通过糖苷键结合形成香气的前体物质,在酸或酶的水解作用下,其配基可以释放出来形成游离香气物质[24-25]。从表2和图2可知,检测到单萜烯类有2种、C13-去甲类异戊二烯类1种和苯衍生物类2种,山葡萄汁、对照与酶处理组的糖苷类香气物质总量之间差异显著(p<0.05),其含量分别为2.09、7.28和12.23 mg/L。在5种糖苷类香气物质中,香叶基丙酮只在酶处理组中检测到。苯衍生物类糖苷总含量最高,其次是C13-去甲类异戊二烯类,单萜烯类总含量最少。比较对照和酶处理‘双优’山葡萄酒糖苷类香气物质可知,经酶处理组后其总含量较对照组提高了11.23%,说明β-葡萄糖苷酶可以水解‘双优’山葡萄酒糖苷类香气前体物质,促进酒中的香气物质形成。

图2 不同种类香气物质总含量
Fig.2 Total content of different classes of aroma compounds
2.4 山葡萄酒OAVs分析
OAVs是用于评价各风味化合物对酒香气贡献的指标。OAVs>1的成分为样品的主体呈香物质,OAVs越大,对香气的贡献也越大[32-33]。对‘双优’山葡萄酒检测和鉴定的挥发性化合物进行OAVs的计算,将OAVs>1的物质进行了归纳和总结,如表3所示。从表3可知,OAVs>1的香气成分共19种,根据香气感官特征和风味轮盘划分[22-33],‘双优’山葡萄酒的香气成分分为9个系列,包括化学味、脂肪味、刺鼻味、土壤味、坚果味、焦糖味、花香味、植物味、果香味,计算各系列对照与酶处理组葡萄酒香气强度对比如图3所示。从图3可知,各系列香气对葡萄酒贡献程度依次为果香>花香>焦糖味>植物味>脂肪味>土壤味>坚果味>刺鼻味>化学味,酶处理组对葡萄酒贡献程度高于对照。山葡萄汁果香与山葡萄酒无明显差异,其他香气远低于酶处理山葡萄酒。其中,山葡萄汁中己酸乙酯(香蕉、青苹果)、辛酸乙酯(花香、香蕉、梨)、癸酸乙酯(花香、肥皂味)对葡萄酒贡献程度高于山葡萄酒。
比较对照和酶处理‘双优’山葡萄酒OAVs可知,‘双优’山葡萄酒中酯类成分对葡萄酒香气贡献程度最大,主要呈果香和花香。醇类贡献次之,主要呈植物香和土壤味。果香成分中己酸乙酯(香蕉,青苹果)、乙酸异戊酯(香蕉)、丁酸乙酯(草莓)的OAVs均大于30,酶处理OAVs较对照组分别提高了37.17%、51.42%、46.18%,在酯类成分中贡献较大。花香成分中辛酸乙酯(甜味、花香、香蕉、梨)和癸酸乙酯(花香、肥皂味)的OAVs均小于16,酶处理组OAVs较对照组分别提高了101.7%和72.4%。植物香成分中正己醇(草本植物、青草味)和蘑菇醇(蘑菇味)OAVs均小于10,在醇类成分中贡献较大,酶处理组OAVs分别较对照组提高了420.25%和95.70%。脂肪香成分主要来自天竺葵醛(脂肪、柑橘、植物)、天竺葵醇(脂肪、花香)和辛酸(奶油、杏仁),酶处理OAVs分别较对照提高了66.58%、283.66%、307.64%,其中天竺葵醛的OAVs值高于其他2种脂肪香成分。焦糖味源自苯乙醛(花香、蜂蜜),其酶处理OAVs值高达71.72,较对照提高了53.82%。
表3 香气成分OAVs结果
Table 3 The OAVs results of aroma compounds OAVs
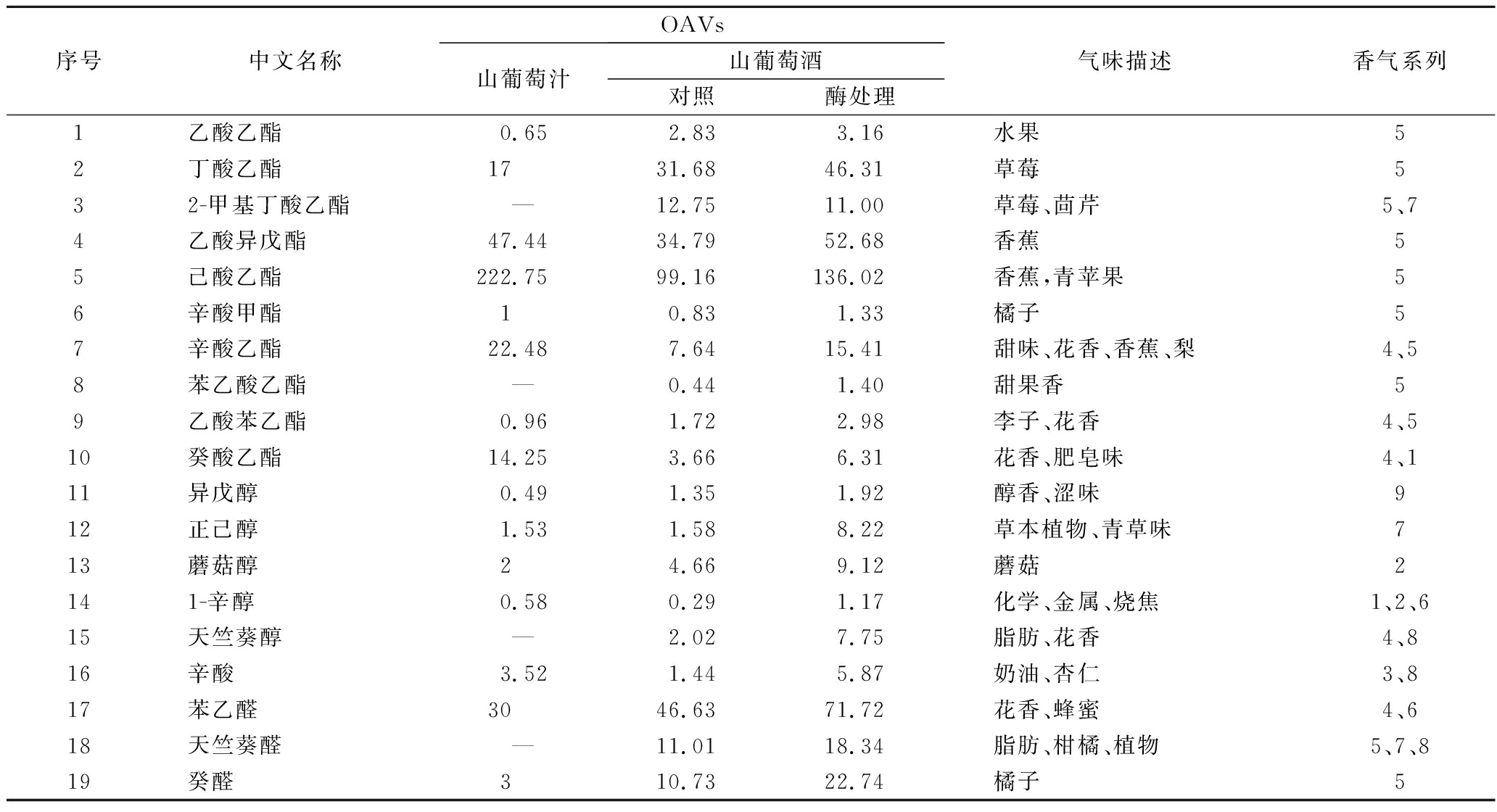
注:1-化学味;2-土壤味;3-坚果味;4-花香味;5-果香味;6-焦糖味;7-植物味;8-脂肪味;9-刺鼻味

图3 对照与酶处理葡萄酒各系列香气强度对比
Fig.3 Comparison of wine aroma intensity in control and enzyme treatment
3 结论
本文以‘双优’山葡萄为原料发酵葡萄酒,研究β-葡萄糖苷酶在酒发酵过程中活力变化以及对酒品质和香气的影响。研究表明,随着发酵时间延长,β-葡萄糖苷酶活力先增加后减小,对照组和酶处理组活力最大值分别为12.46和72.42 U/L,说明‘双优’山葡萄酒发酵产生少量β-葡萄糖苷酶,而添加β-葡萄糖苷酶在‘双优’山葡萄酒发酵环境中活力受到抑制。比较对照和酶处理组‘双优’山葡萄酒理化特性可知,对照组总糖含量和酒精度低于酶处理组,对照组总花色苷含量高于酶处理组。酶处理组香气成分含量显著高于山葡萄汁和对照山葡萄酒处理组,山葡萄汁、对照和酶处理组香气物质总量分别为76.18、124.28和184.99 mg/L,种类分别为24、50和54种;检测出香气成分共分为9大类,其含量大小依次为酯类、醇类、苯衍生物类、酮类、酸类、醛类、C13-去甲类异戊二烯类、挥发性酚类和单萜烯类;其中,检测出2-羟基-4-甲基戊酸乙酯、正己醇、里哪醇氧化物、香叶基丙酮、大马士酮、苄醇、苯乙醇7种糖苷类香气物质,经酶处理山葡萄酒中7种糖苷类香气物质含量分别显著高于对照组。检测出19种OAVs大于1的香气成分分为化学味、花香味和果香味等9个系列,其中果香味对山葡萄酒风味贡献最大,并且酶处理对葡萄酒贡献程度高于对照组。因此,β-葡萄糖苷酶对‘双优’山葡萄酒香气成分具有显著的影响。
参考文献
[1] 王银龙,钟大辉. 吉林省葡萄酒产业存在问题及发展对策研究[J]. 北方园艺,2016(1):173-176.
[2] 皇甫淳,修荆昌,国贤贵,等. “双优”两性花山葡萄研究初报[J]. 吉林农业大学学报, 1988(4):9-12.
[3] 丁梅,辛若竹,卜丽伟,等. 有机酸鉴定山葡萄酒及山葡萄露酒真伪的方法研究[J]. 中国食品与营养, 2013, 19(8): 23-28.
[4] 赵权,王军,杨成君. 不同品种山葡萄果皮和酒中非花色苷酚的成分分析[J].东北林业大学学报, 2012, 40(3): 72-77,102.
[5] 张振华,葛毅强,倪元颖,等.葡萄芳香物质研究进展[J].食品科学, 2004, 25(4): 181-184.
[6] LUKIC I, RADEKA S, GROZAI N, et al. Changes in physico-chemical and volatile aroma compound composition of Gewürztraminer wine as a result of late and ice harvest[J]. Food Chemistry, 2016, 196(2):1 048-1 057.
[7] 涂正顺,薛洁,常伟,等. 吉林地区山葡萄果实香气成分的GC/MS分析[J]. 西北农林科技大学学报, 2013, 35(10): 195-201.
[8] ZHU F M, DU B, LI J. Aroma enhancement and enzymolysis regulation of grape wine using β-glycosidase[J]. Food Science and Nutrition, 2014, 2(2): 139-145.
[9] PALMERI R, SPAGNA G. β-Glucosidase in cellular and acellular form for winemaking application [J]. Enzyme and Microbial Technology, 2007, 40(3): 382-389.
[10] WANG Yu-xia, ZHANG Chao, LI Ji-ming, et al. Different influences of β-glucosidases on volatile compounds and anthocyanins of Cabernet Gernischt and possible reason [J]. Food Chemistry, 2013, 140(1/2): 245-254.
[11] RODRIGUEZ M E, LOPES C, VALLES S, et al. Selection and preliminary characterization of β-glycosidases producer Patagonian wild yeasts [J]. Enzyme and Microbial Technology, 2007,41(6/7): 812-820.
[12] 谢克林,冯涛,庄海宁,等. 外源可发酵糖对葡萄酒挥发性化合物的影响[J].食品科学, 2016, 37(18): 113-119.
[13] 岳泰新,迟明,李梅花,等. 2种产量赤霞珠葡萄酒香气和花色苷的比较[J].食品科学, 2014, 35(24): 194-200.
[14] DIGNUM M J W, KERLER J, VERPOORTE R. β-Glucosidase and peroxidase stability in crude enzyme extracts from green beans of Vanilla planifolia Andrews[J]. Phytochemical Analysis, 2001, 12(3): 174-179.
[15] UGLIANO M, BARTOWSKY E J, MCCARTHY J, et al. Hydrolysis and transformation of grape glycosidically bound volatile compounds during fermentation with three saccharomyces yeast strains[J].Journal of Agricultural and Food Chemistry, 2006,54(17): 6 322-6 331.
[16] SUMBY K M, GRBIN P R, JIRANEK V. Microbial modulation of aromatic esters in wine: Current knowledge and future prospects[J]. Food Chemistry, 2010, 121(1): 1-16.
[17] WELKE J E, ZANUS M, LAZAROTTO M, et al. Quantitative analysis of headspace volatile compounds using comprehensive two-dimensional gas chromatography and their contribution to the aroma of Chardonnay wine[J]. Food Research International, 2014, 59(4):85-99.
[18] GONZALEA-ROMPINELLI E M, RODRIGUEZ-BENCOMO J J, GARCIA-RUIZ A, et al. A winery-scale trial of the use of antimicrobial plant phenolic extracts as preservatives during wine ageing in barrels[J]. Food Control, 2013, 3(2):440-447.
[19] SWIEGERS J H, PRETORIUS I S. Yeast modulation of wine flavor[J]. Advances in Applied Microbiology, 2005, 57(57): 131-175.
[20] CAMPO E, FERREIRA V, LOPEZ R, et al. Identification of three novel compounds in wine by means of a laboratory-constructed multidimensional gas chromatographic system [J]. Journal of Chromatography A, 2006, 1122(1/2): 202-208.
[21] 蔡建,朱保庆,段长青,等. 蛇龙珠与卡曼娜葡萄酒主要呈香物质鉴定[J]. 中国酿造, 2014, 33(5): 90-96.
[22] 陈霞,李敏,张波,等. 扩展青霉对‘蛇龙珠’葡萄酒棒曲霉素及风味品质的影响[J]. 食品科学, 2016, 37(20):126-133.
[23] XIAO Zuo-bing, YU Dan, NIU Yun-wei, et al. Characterization of aroma compounds of Chinese famous liquors by gas chromatography-mass spectrometry and flash GC electronic-nose.[J]. Journal of Chromatography B Analytical Technologies in the Biomedical and Life Sciences, 2014, 945-946(2):92-100.
[24] RODRIGUEZ-BENCOMO J J, SELLI S, MUNOZ-GONZALEZ C. Application of glycosidic aroma precursors to enhance the aroma and sensory profile of dealcoholised wines[J]. Food Research International, 2013. 51(2): 450-457.
[25] VILANOVA M, GENISHEVA Z, BESCANSA L. Changes in free and bound fractions of aroma compounds of four Vitis vinifera at the last ripening stages[J]. Phytochemistry, 2012, 74(1): 196-205.
[26] GUTH H. Quantitation and sensory studies of character impact odorants of different white wine varieties[J]. Journal of Agricultural and Food Chemistry, 1997,45(8): 3 027-3 032.
[27] PEINADO R A, MORENO J, BUENO J E, et al. Comparative study of aromatic compounds in two young white wines subjected to pre-fermentative cryomaceration[J]. Food Chemistry, 2004, 84(4): 585-590.
[28] WANG J, CAPONE D L, WILKINSON K L, et al. Chemical and sensory profiles of rosé wines from Australia[J]. Food Chemistry, 2016(196): 682-693.
[29] CAI Jian, ZHU Bao-qing, WANG Yun-he, et al. Influence of pre-fermentation cold maceration treatment on aroma compounds of Cabernet Sauvignon wines fermented in different industrial scale fermenters[J]. Food Chemistry, 2014, 154(2): 217-219.
[30] PINEAU B, BARBE J C, VAN LEEUWEN C,et al. Which impact for β-damascenone on red wines aroma?[J]. Journal of Agricultural and Food Chemistry, 2007, 55(10): 4 103-4 108.
[31] PENG Chuan-tao, WEN Yan, TAO Yong-sheng, et al. Modulating the formation of Meili wine aroma by prefermentative freezing process[J]. Agricultural and Food Chemistry, 2013, 61(7): 1 542-1 553.
[32] ALLEN M S, LACEY M J, BOYD S. Determination of methoxypyrazines in red wines by stable isotope dilution gas chromatography-mass spectrometry[J].Journal of Agricultural and Food Chemistry, 1994, 42(8):1 734-1 738.
[33] CAPONE S, TUFARIELLO M, SICILIANO P. Analytical characterisation of Negroamaro red wines by “Aroma Wheels”[J]. Food Chemistry, 2013, 141(3): 2 906-2 915.