单宁酶,即单宁酰基水解酶(EC 3.1.1.20),可专一性水解没食子酰单宁及复合单宁等水解型单宁的酯键和缩酚羧键,生成葡萄糖、没食子酸、六羟基联苯二甲酸及醇类等物质[1-2]。它是一种由单宁酸、五倍子等诱导产生的诱导酶,也是一种细胞膜结合酶,可分泌至胞外[3]。单宁酶因其对单宁类物质的高效水解作用而应用于食品、饮料、酿酒、医药及化工等多个领域,其中以饮料和医药行业中的应用最为广泛[2]。随着单宁酶在茶饮料和没食子酸生产中的应用不断深入,加速了单宁酶的开发和工业化生产。然而,单宁酶的大规模生产受到了许多因素的限制,包括酶学性质研究的缺乏和较高的生产成本等[1, 4]。
除了存在于富含单宁的植物中,单宁酶还广泛存在于微生物中,包括细菌、酵母和真菌等。目前产单宁酶的微生物主要是细菌以及真菌类的曲霉属、青霉属和根霉属,尤其是曲霉属中的黑曲霉和米曲霉[4-5]。单宁酶的生产可采用固态发酵和液态发酵2种方式。目前,单宁酶的生产主要是通过液体深层发酵获得,其酶活较低,且酶液中成分复杂,难以纯化,限制了单宁酶的应用[6]。近年来,分子克隆技术的快速发展,为微生物单宁酶酶学性质的研究和大规模生产提供了有效的途径。
迄今为止,黑曲霉单宁酶已被克隆、表达或进行了酶学性质研究的有以下5种:单宁酶Tan7[1, 7]、A. niger GH1单宁酶[8-9]、A. niger N5-5单宁酶[10-11]、A. niger PTCC 5012单宁酶[12]以及具有β-葡萄糖苷酶活性的单宁酶[13]。本课题组前期通过对黑曲霉基因组中的单宁酶基因进行分析,发现了一个新的编码基因tahA。为此,本研究拟采用分子克隆的手段将其在毕赤酵母中进行克隆表达,对其进行初步纯化后,全面解析该酶的生化特征,以期大规模生产及在茶饮料行业的应用提供物质材料和理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒及培养条件
黑曲霉(Aspergillus niger)CICIM F0510[14]和大肠杆菌(Escherichia coli)JM109由本实验室保藏。表达宿主Pichia pastoris GS115以及表达质粒pPIC9K购于Invitrogen公司。重组质粒pPIC-tahA、重组毕赤酵母工程菌GS115 (pPIC-tahA)由本研究中构建、筛选并保藏。霉菌和大肠杆菌分别采用PDA培养基和LB培养基进行培养;酵母培养基YPD、MD、G418-YPD、BMGY和BMMY等配制方法参考Invitrogen公司的Pichia Expression Kit。
1.1.2 试剂
限制性内切酶(Avr Ⅱ、SnaB I、Xba I、Nco I、Sac I)、LA Taq DNA Polymerase以及T4 DNA连接酶等购自宝生物工程(大连)有限公司;RNA抽提试剂盒(High Pure RNA Isolation Kit)和cDNA合成试剂盒(Transcriptor High Fidelity cDNA Synthesis Kit)为Roche公司产品;蛋白分子量标准、质粒小量提取试剂盒、小量DNA产物纯化回收试剂盒和1st Strand cDNA Synthesis Kit由Thermo Scientific公司提供;无氨基酵母氮源、胰蛋白胨和酵母抽提物购于英国OXOID公司;底物没食子酸甲酯购自国药化学试剂有限公司;遗传霉素(G418)、表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)、没食子儿茶素没食子酸酯(gallocatechingallate, GCG)、表儿茶素没食子酸酯(epicatechingallate, ECG)、表没食子儿茶素(epigallocatechin, EGC)、没食子儿茶素(gallocatechin, GC)、表儿茶素(epicatechin, EC)和没食子酸(gallic acid, GA)等均由北京索莱宝科技有限公司提供;罗丹宁为Sigma-Aldrich公司产品;其他生化试剂均为国产分析纯。
1.2 方法
1.2.1 毕赤酵母工程菌的构建
黑曲霉总RNA的提取、cDNA的制备、质粒的提取与纯化、PCR及其产物的纯化、酶切、连接、转化以及转化子的筛选等均采用实验室常规方法[15],使用试剂盒时按照试剂盒说明书进行。其中,在PCR过程中采用的寡核苷酸引物![]() 下划线部分为人工设计的Xba I位点)由生工生物工程(上海)股份有限公司合成。
下划线部分为人工设计的Xba I位点)由生工生物工程(上海)股份有限公司合成。
1.2.2 重组单宁酶的分泌表达和初步纯化
将毕赤酵母重组菌GS115(pPIC-tahA)在YPD平板上进行纯化,挑选单菌落接种到25 mL YPD液体培养基中,于30 ℃、200 r/min培养至对数生长期(OD600=2.0~6.0,约18~20 h)。按1%(V/V)接种量接入50 mL BMGY培养基中,30 ℃、200 r/min培养至对数生长期。然后离心(4 ℃、6 000 r/min)5 min收集菌体,将酵母细胞重悬于适当体积的BMMY培养基中,使其OD600值为1.0,并于30 ℃、200 r/min继续培养。每隔24 h补加无水甲醇至终浓度为0.5%(V/V)以维持诱导,并同时取样测定酶活,直至酶活不再升高。
发酵结束后,离心(4 ℃、8 000 r/min、10 min)收集粗酶液。采用盐析、脱盐(PD-10脱盐柱)和Sephadex G-75凝胶层析法对重组酶进行纯化,并通过酶活测定和SDS-PAGE分析蛋白的纯化情况。其中,SDS-PAGE参照文献[16]进行,采用5%的浓缩胶和12%的分离胶。
1.3 重组单宁酶的酶学特征分析
1.3.1 酶活测定方法
采用分光光度法[17]测定单宁酶的酶活。其一般步骤如下:将250 μL经适当稀释的酶液与250 μL 0.01 mol/L没食子酸甲酯溶液混匀后,在pH值4.5和30 ℃反应20 min。煮沸5 min后,冷却至30 ℃,并加入6.67 g/L罗丹宁(溶于无水甲醇中)溶液。混匀后,于30 ℃温浴5 min。再加入200 μL温浴的0.5 mol/L KOH溶液,于30 ℃孵育5 min。加入4 mL去离子水,混匀,于30 ℃继续温浴10 min。最后,在520 nm下测定吸光度,并计算相对酶活。
酶活定义:在反应条件下,1 min内水解没食子酸甲酯产生1 μmol没食子酸所需的酶量为1个酶活力单位,以U/mL表示。
蛋白质含量的测定参照BRADFORD法[18],以牛血清白蛋白V部分为标准参照品。
1.3.2 重组酶的最适作用温度和热稳定性分析
在不同温度(20~60 ℃)和pH值4.5条件下测定重组酶TahA的酶活,以酶活最高者为100%,计算相对酶活,从而确定该酶的最适作用温度。
将重组酶在不同温度(20~70 ℃)下孵育1 h,每隔15 min取样,按照1.3.1的方法测定剩余的单宁酶酶活。以未进行热处理的酶液的酶活力为100%,计算相对酶活,确定单宁酶的热稳定性。
1.3.3 重组酶的最适作用pH值和pH稳定性分析
在不同反应pH值下(pH 3.0~8.0),以溶于相应pH值缓冲液的没食子酸甲酯为底物进行反应,然后按照1.3.1的方法测定酶活。以酶活最高者为100%,计算相对酶活,从而确定单宁酶的最适作用pH值。所用缓冲液为50 mmol/L磷酸氢二钠-柠檬酸钠缓冲液。
将重组酶在不同pH值(pH 3.0~8.0)的缓冲液中孵育2 h,每隔30 min取样,并以溶于相应pH值缓冲液的没食子酸甲酯为底物,按照1.3.1的方法测定酶活。以酶活最高者为100%,计算残余酶活,从而确定单宁酶的pH值稳定性。
1.3.4 金属离子和相关化学试剂对重组单宁酶酶活的影响
在单宁酶与其底物进行反应的体系中,加入不同的金属离子或化合物,使其终浓度为2 mmol/L,然后按照1.3.1的方法进行酶活测定。以不加金属离子的反应体系的酶活为100%,计算不同金属离子或化合物下的相对酶活。
1.3.5 重组单宁酶动力学参数的测定
以不同浓度(0.1~10.0 mmol/L)的没食子酸甲酯为底物,在重组单宁酶的最适反应pH值和温度下测定其酶活。以米氏方程作为模型,采用双倒数法作图,即可得到单宁酶的动力学参数Km和Vmax。
1.4 重组单宁酶对酯型儿茶素的水解产物分析
取500 μL适当稀释的酶液,分别与500 μL 1 mg/mL EGCG、ECG和GCG溶液混匀,在单宁酶的最适作用温度和pH值下反应20 min后,沸水浴10 min灭酶。用0.22 μm膜过滤反应液后,采用液相色谱检测过滤液中的产物组成[19]。液相分析条件如下:色谱柱:C18柱(5 μm,250 mm×4.6 mm);检测器:RID紫外吸收检测器;柱温:35 ℃;流速:1 mL/min;进样体积:10 μL;流动相:A液(乙腈∶乙酸∶水=9∶2∶89),B液(乙腈∶乙酸∶水=80∶2∶18);梯度洗脱条件:100%A(0 min)-100%A(10 min)-68%A和32%B(25 min)-68%A和32%B(35 min)-100%A(45 min)。
2 结果与分析
2.1 黑曲霉单宁酶的克隆表达和分离纯化
提取黑曲霉CICICM F0510的总RNA,并反转录成cDNA。以此cDNA为模板,采用引物TahA1和TahA2对单宁酶基因tahA进行PCR扩增。PCR产物经Xba I酶切后,克隆入pPIC9K的SnaB I和Avr II位点。将重组质粒用Nco I进行酶切验证,获得了重组表达质粒pPIC-tahA。进一步经DNA测序,确认了所克隆的tahA基因具有完整的开放阅读框,且其序列与A. niger CBS 513.88基因组公布的序列(Gene ID:4990346)完全一致。其大小为1 689 bp,编码562个氨基酸残基。将重组质粒pPIC-tahA用Sac I线性化后,通过电转化将目的基因整合到毕赤酵母GS115染色体DNA上,获得重组毕赤酵母GS115 (pPIC-tahA)。在250 mL三角瓶培养条件下,发酵进行到120 h时,重组菌的产酶水平达到最高,为1.04 U/mL。
进一步通过盐析、脱盐和凝胶过滤层析法将重组酶TahA进行纯化,其得率、纯化倍数和比酶活分别为21.4%、13.9倍和11.5 U/mg。蛋白电泳的结果表明:与目前已报道的大多数单宁酶一样[2, 4, 20],粗酶液和纯化后的TahA均含有2个亚基(图1),它们的大小分别为48和42 ku。而未经β-巯基乙醇和热处理的天然TahA的分子量为90 ku左右,远高于其理论分子量(61.4 ku),这可能是因为该酶已经被糖基化修饰了[21]。
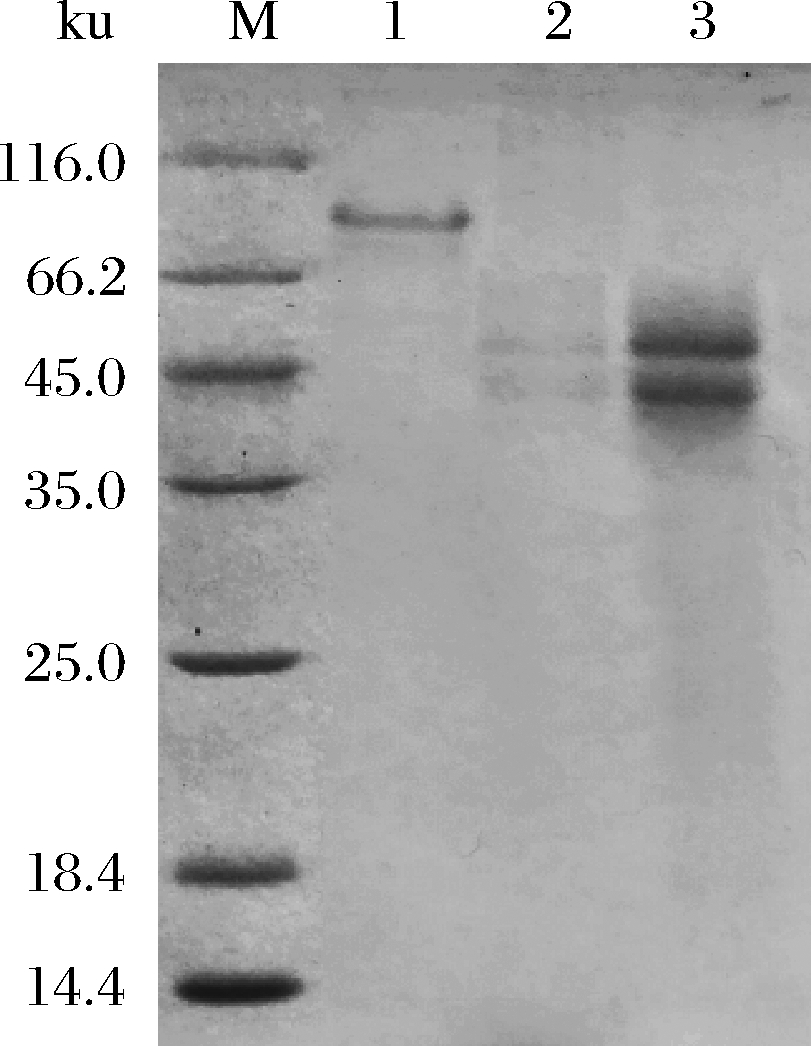
M-蛋白分子量标准;1-纯化后未经β-巯基乙醇和
热处理的TahA;2-变性后的TahA粗酶液;3-纯化后变性的TahA
图1 SDS-PAGE分析TahA的纯化情况
Fig.1 SDS-PAGE analysis of the purification of TahA
2.2 重组单宁酶的酶学特性解析
2.2.1 最适反应温度和热稳定性
分别在不同温度(10、20、25、30、35、40、45、50、55和60 ℃)和pH值4.5条件下测定TahA的酶活,结果如图2-a所示。重组单宁酶的最适作用温度为30 ℃,当温度低于或高于30 ℃时,酶促反应速率会逐渐下降。反应温度在30~35 ℃之间时,重组单宁酶有较高的活性(相对酶活>80%);而当温度高于55 ℃时,其相对酶活小于40%。
将酶液分别在不同温度(20、30、40、50、60和70 ℃)下孵育15、30、45和60 min后,取样测定TahA的残余酶活,结果汇总于图2-b。重组单宁酶在20~50 ℃保温1 h后,其相对酶活力仍保持60%以上,其中重组酶在20和30 ℃孵育1 h后的相对酶活保持在80%以上;在60 ℃保温15 min和1 h后,其相对酶活分别保持在70%和20%以上;而当该酶在70 ℃下保温15 min时,其相对酶活急剧下降至40%左右;孵育1 h后,单宁酶则几乎完全失活。
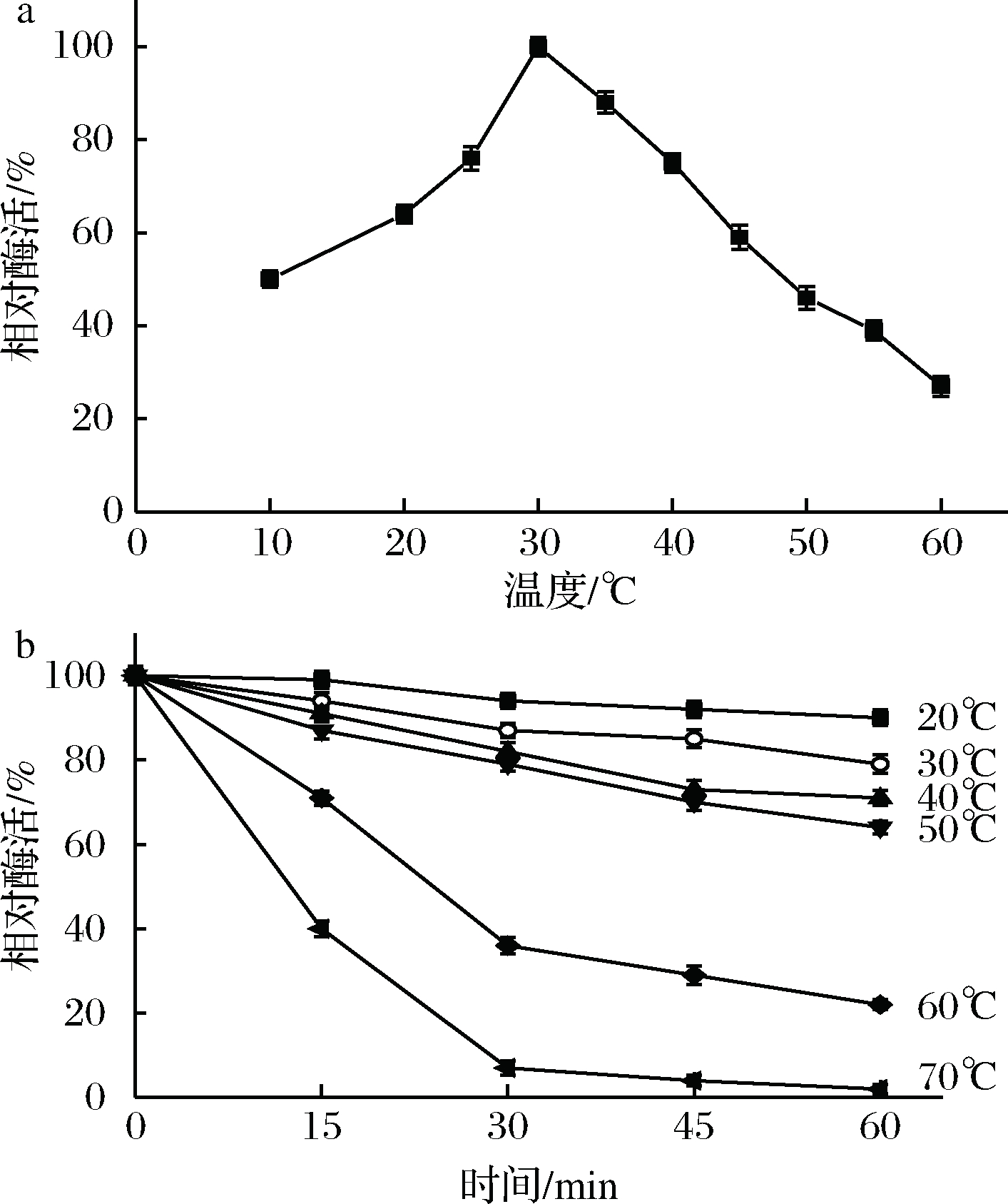
图2 温度对TahA的酶活(a)和稳定性(b)的影响
Fig.2 Effects of temperature on the activity (a) and
stability (b) of TahA
2.2.2 最适反应pH值和pH值稳定性
在30 ℃条件下,分别在不同pH值条件(pH值3.0、3.5、4.0、4.5、5.0、5.5、6.0、7.0和8.0)下测定重组单宁酶TahA的酶活,结果如图3-a所示。单宁酶TahA的最适作用pH值为4.0~4.5。在该范围内,TahA的相对酶活维持在100%左右。而当pH值小于3.0或大于6.0时,其相对酶活均小于40%。
将单宁酶TahA在不同pH值(pH 3.0、3.5、4.0、4.5、5.0、6.0和7.0)缓冲液中孵育0.5、1.0、1.5和2.0 h后,取样测定其残余酶活,结果如图3-b所示。除了在pH值3.5和5.0孵育2 h后的残留酶活在70%和60%左右,该酶在pH 3.5~5.0的缓冲液中残留酶活均维持在80%以上;分别在pH值3.0和6.0的缓冲液中保温2 h后,该酶仍能保持50%和30%以上的相对酶活;而当缓冲液的pH值为7.0时,TahA的相对酶活迅速下降,1 h后残余酶活力不足10%。

图3 pH对TahA的酶活(a)和稳定性(b)的影响
Fig.3 Effects of pH on the activity (a) and stability (b)
of TahA
2.2.3 金属离子和化学试剂对TahA酶活的影响
在单宁酶与其底物进行反应的体系中,加入不同的金属离子或化合物,使其终浓度为2 mmol/L,研究它们对单宁酶酶活的影响,结果如图4所示。Cu2+、Mn2+和K+对重组酶的活性有明显的促进作用。Co2+、Fe3+、Mg2+、Zn2+和EDTA对TahA的活性有轻微的抑制作用;Ca2+和Sn2+对重组酶的活性有强烈的抑制作用;而SDS则几乎完全抑制重组酶单宁酶的活性。
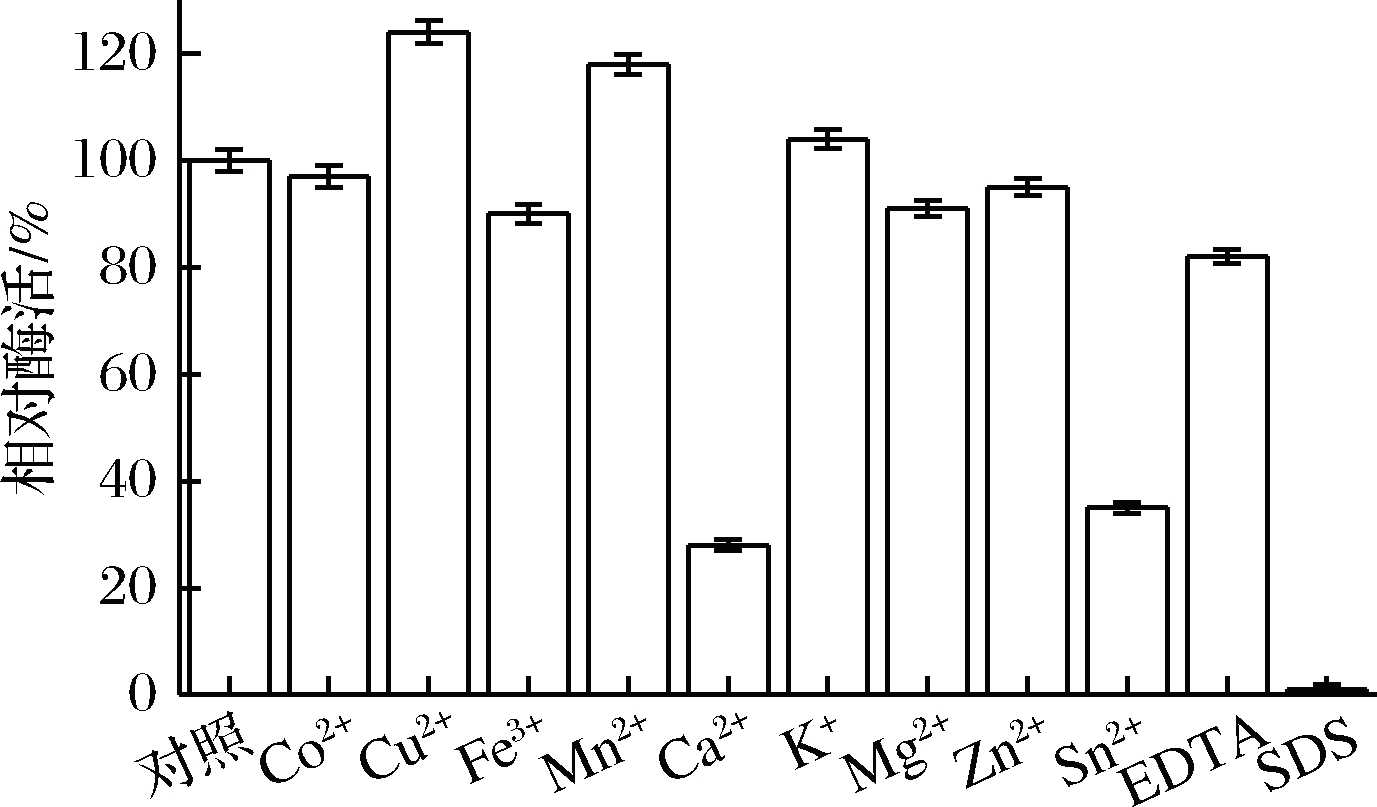
图4 金属离子和化学螯合剂对TahA酶活的影响
Fig.4 Effects of metal ions and chemicals on the activity
of TahA
2.2.4 动力学参数的测定
以不同浓度(0.1~10.0 mmol/L)的没食子酸甲酯为底物,在重组单宁酶的最适反应pH和温度下测定其酶活。然后采用Lineweaver-Burk双倒数作图法,以酶促反应初速率倒数1/[V]对底物浓度倒数1/[S]作图。由测定结果可知,单宁酶对没食子酸甲酯的水解作用符合米氏方程,其线性回归方程为y=11.807x+2.295 6(R2=0.997 3)。此外,TahA的Vmax和Km值分别为0.436 μmol/(mL·min)和5.143 mmol/L。
2.3 重组单宁酶对酯型儿茶素的水解作用
为了进一步确定重组单宁酶对酯型儿茶素的水解作用,分别以1 mg/mL EGCG、ECG和GCG为底物,在单宁酶的最适作用温度和pH条件下进行水解,并通过HPLC分析酶解产物。从液相图谱(图5)可以看出,单宁酶可以水解酯型儿茶素的酯键,分别将EGCG、ECG和GCG水解为非酯型儿茶素(EGC、EC和GC)和没食子酸。且在此条件下,单宁酶TahA水解EGCG、ECG和GCG产生的没食子酸的浓度分别为33.98 μg/mL、87.00 μg/mL和22.58 μg/mL。可见,重组单宁酶TahA对3种底物的水解能力为ECG>EGCG>GCG,水解能力的不同可能跟底物的结构特异性有关。
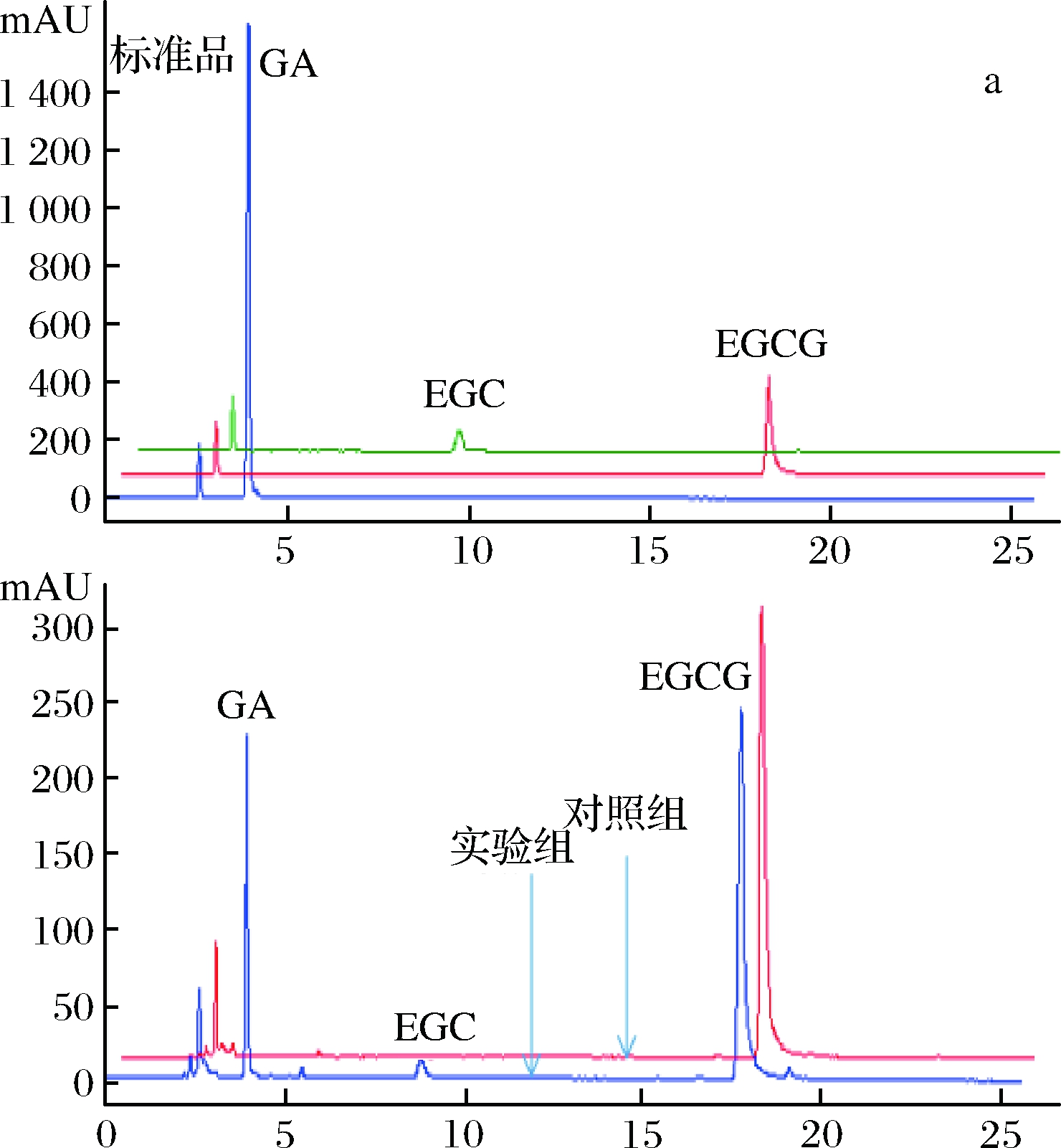
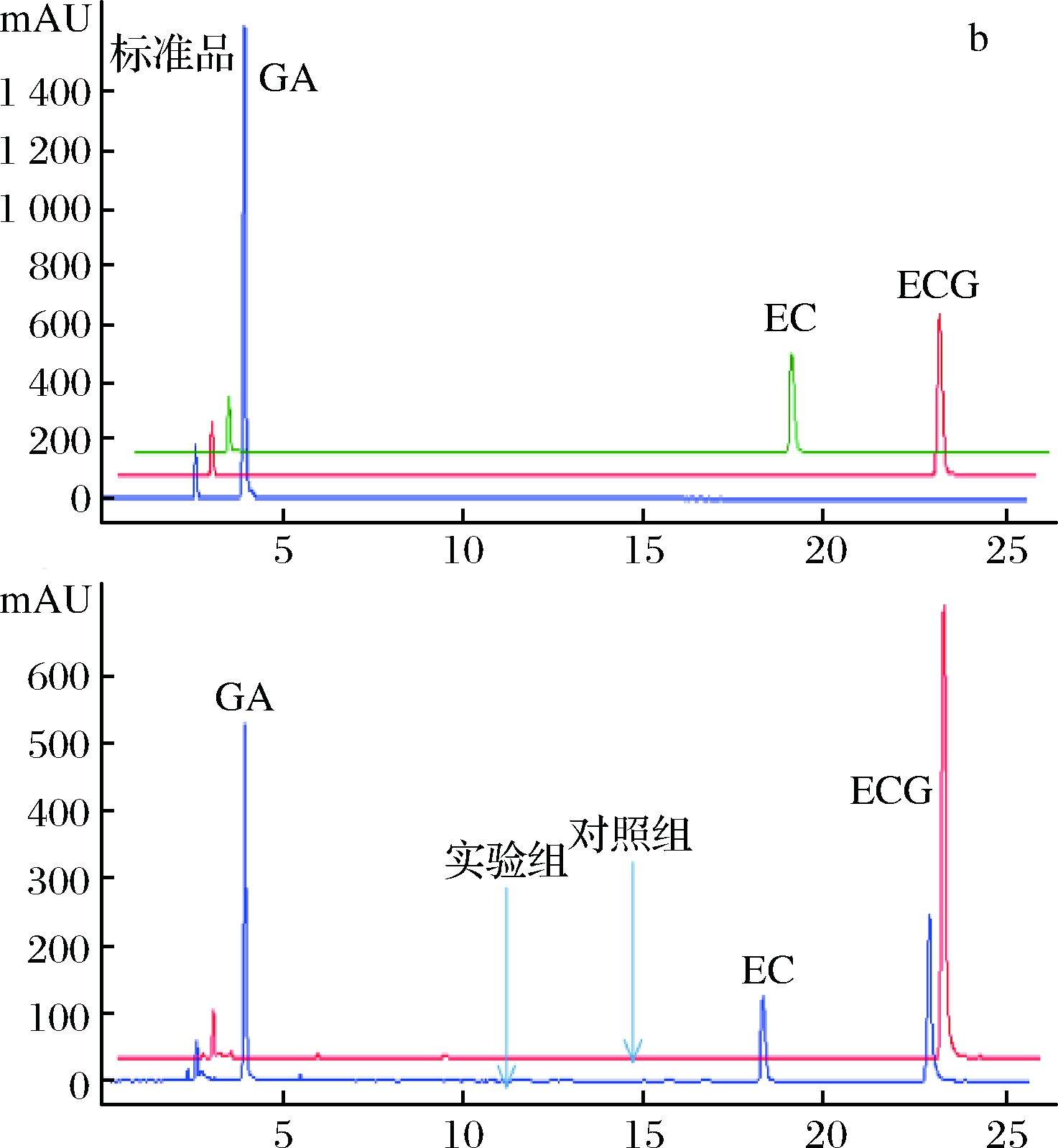
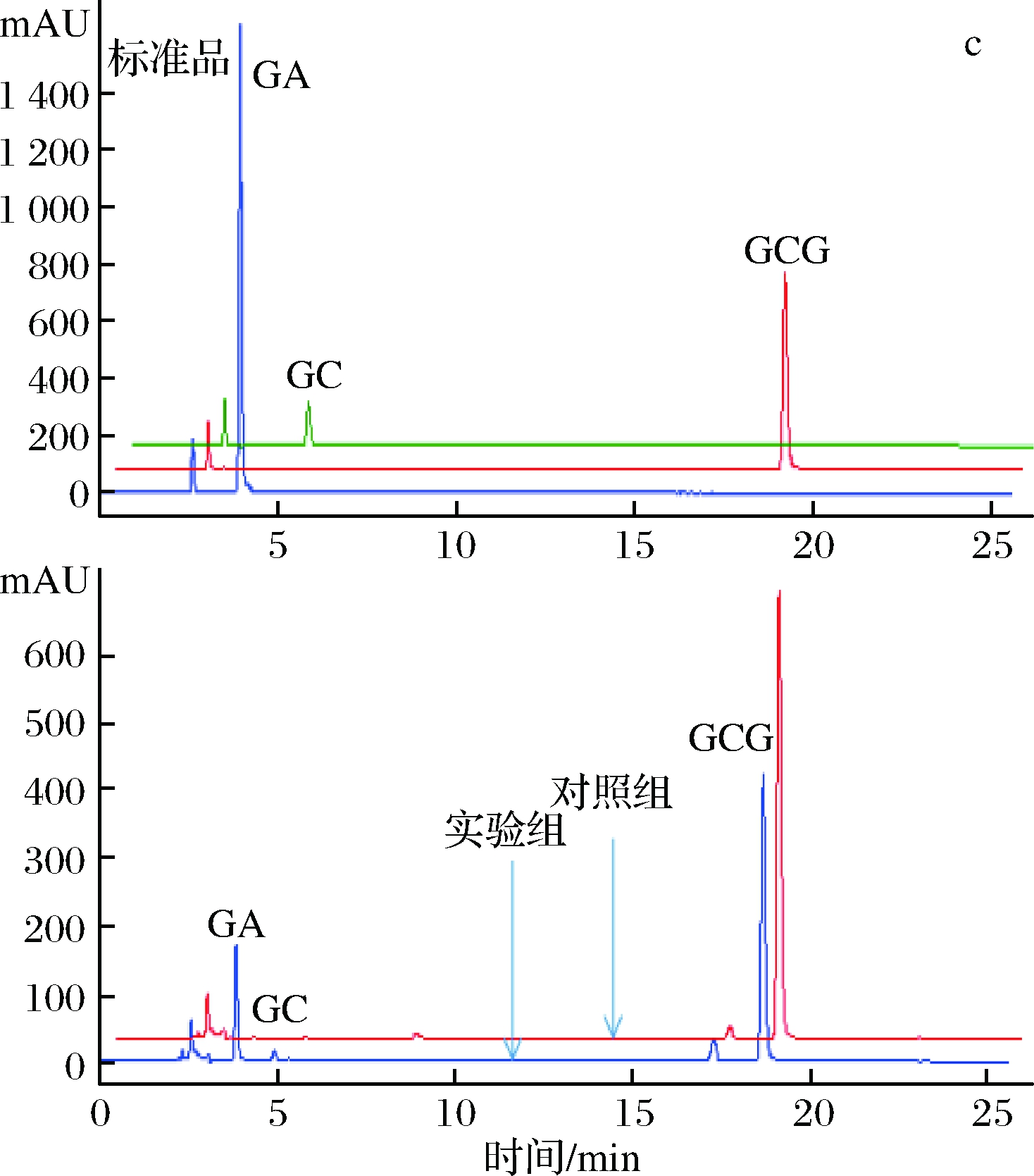
a、b和c分别为EGCG、ECG和GCG的水解产物分析
图5 重组单宁酶TahA水解酯型儿茶素的产物分析
Fig.5 HPLC profiles of ester catechins hydrolyzed by
recombinant tannase TahA
3 讨论
在茶饮料的生产和冷藏过程中,茶叶提取液冷却到4 ℃以下时会变浑浊(“冷后浑”现象),并产生絮状沉淀,影响了茶饮料的品质[5],这一直是茶饮料行业需要解决的关键问题。单宁酶专一性水解没食子酸单宁中酯键和缩酚酸键的特点,使其成为茶饮料生产中使用的主要酶制剂[22]。在茶饮料中应用单宁酶,可转溶茶沉淀,增加茶汤澄清度,对茶饮料的品质改良产生积极作用[5]。但单宁酶在茶饮料行业的应用缺乏酶学性质研究和受到生产成本较高等因素的限制。
该研究通过DNA重组技术将黑曲霉CICIM F0510单宁酶基因tahA在毕赤酵母GS115中进行了克隆表达。在摇瓶中发酵120 h后,重组菌的产酶水平达到1.04 U/mL,高于Bacillus licheniformis、Serratia ficaria和黑曲霉GH1等来源的单宁酶的酶活(分别为0.356、0.56和0.344 U/mL)[8, 23-24],但却低于单宁酶Tan7和A. niger N5-5的酶活(分别为111.5和471.35 U/mL)[1, 11]。后续将通过发酵条件优化,进一步提高重组酶TahA的表达量。此外,重组毕赤酵母GS115 (pPIC-tahA)发酵液中的杂蛋白较少(图1),有利于单宁酶的分离纯化。
酶学性质的研究表明,与大多数单宁酶的最适反应温度(30~60 ℃)和温度稳定范围(≦60 ℃)[3]相似,重组酶TahA的最适作用温度为30 ℃,且在20~50 ℃范围内都具有较好的稳定性(图2)。重组单宁酶的最适作用pH值为4.5,在pH 3.0~6.0范围内稳定性良好(图3),也与真菌单宁酶的最适pH值(4.0~6.0)和pH耐受性范围(3.0~7.0)相符[3, 5]。而茶叶浸提物的pH值通常在5.0~6.0之间,其中红茶和绿茶茶汤的pH值分别为5.0和5.7。单宁酶TahA的最适pH值和pH稳定范围偏酸性的特点为其在茶饮料生产中的应用提供了可能。然而,由于重组单宁酶TahA经过了糖基化修饰,其酶学性质可能会跟野生型单宁酶存在一些差异。后续将利用内切糖苷酶等将其去糖基化后,再确认其酶学性质。
茶叶提取液的“冷后浑”问题主要是由多酚类物质与咖啡碱等相互作用,形成不溶性的络合沉淀造成的,而多酚类物质中儿茶素的含量约为80%[25]。重组单宁酶TahA可以水解具有苦涩味的酯型儿茶素(EGCG、ECG和GCG),生成非酯型儿茶素(EGC、EC和GC)和没食子酸(图5)。后者可以与茶红素、茶黄素等竞争茶饮料中的咖啡碱,形成分子量较小的水溶物,从而提高茶饮料的澄清度和稳定性,并降低其苦味[5, 26]。此外,EGCG是儿茶素的主要成分,约占绿茶中总多酚含量的40%,而且EGC的抗氧化活性大于EGCG[27]。因此,将EGCG水解为EGC还有利于提高茶饮料的抗氧化性[28]。
综上所述,本研究通过分子克隆与遗传重组技术成功将黑曲霉单宁酶基因tahA在毕赤酵母中进行了分泌表达与酶学特性研究。重组酶单宁酶良好的理化性质以及对酯型儿茶素的水解作用,为其在茶饮料生产中的应用奠定了坚实的基础。
参考文献
[1] LIU Feng-ling, WANG Bin, YE Yan-rui, et al. High level expression and characterization of tannase tan7 using Aspergillus niger SH-2 with low-background endogenous secretory proteins as the host[J]. Protein Expression and Purification, 2018, 144: 71-75.
[2] CHAVEZ-GONZALEZ M, RODRIGUEZ-DURAN L V, BALAGURUSAMY N, et al. Biotechnological advances and challenges of tannase: An overview[J]. Food and Bioprocess Technology, 2012, 5(2): 445-459.
[3] 王挥. 黑曲霉产单宁酶与固定化酶制备没食子酸及其丙酯的研究[D]. 长沙:中南林业科技大学, 2012.
[4] YAO J, GUO G S, REN G H, et al. Production, characterization and applications of tannase[J]. Journal of Molecular Catalysis B-Enzymatic, 2014, 101: 137-147.
[5] 邓军,马少敏,王荣辉. 单宁酶及其在茶饮料中的应用[J]. 广西轻工业, 2009, 25(3): 6-7+17.
[6] 保玉心,邱树毅,李秧针,等. 固态发酵黑曲霉产单宁酶发酵条件研究[J]. 食品与发酵工业, 2008, 34(6): 54-56+61.
[7] 岳苗苗. 单宁酶基因在黑曲霉中的同源表达研究[D]. 哈尔滨:东北农业大学, 2014.
[8] VEANA F, DURON-VAZQUEZ R, GUERRERO-OLAZARAN M, et al. Tannase production by the xerophilic Aspergillus niger GH1 strain and partial isolation of the tannase gene[J]. Revista Mexicana De Ingenieria Quimica, 2016, 15(1): 51-56.
[9] FUENTES-GARIBAY J A, AGUILAR C N, RODRIGUEZ-HERRERA R, et al. Tannase sequence from a xerophilic Aspergillus niger Strain and production of the enzyme in Pichia pastoris[J]. Molecular Biotechnology, 2015, 57(5): 439-447.
[10] ZHANG Shuai, CUI Feng-chao, CAO Yong, et al. Sequence identification, structure prediction and validation of tannase from Aspergillus niger N5-5[J]. Chinese Chemical Letters, 2016, 27(7): 1 087-1 090.
[11] 张帅,曹庸,梁晓莹,等. 黑曲霉N5-5单宁酶的纯化及酶学性质测定[J]. 食品科学, 2017, 38(06): 142-146.
[12] KAZEMI A, ZADE M A, JAFARI A. Identification, isolation, cloning and sequencing of tannase gene from Aspergillus niger[J]. Jundishapur Journal of Microbiology, 2011, 4: S27-S34.
[13] RAMIREZ-CORONEL M A, VINIEGRA-GONZALEZ G, DARVILL A, et al. A novel tannase from Aspergillus niger with beta-glucosidase activity[J].Microbiology, 2003, 149(Pt 10): 2 941-2 946.
[14] 董自星,肖华,王静培,等. 黑曲霉果糖基水解酶的重组表达及酶学特征分析[J]. 食品工业科技, 2017, 38(10): 178-184.
[15] 诸葛健,王正祥. 工业微生物实验技术手册[M]. 北京:中国轻工业出版社, 1994: 413-450.
[16] 奥斯伯F,金斯顿R,塞德曼J,等. 精编分子生物学实验指南[M]. 北京:科学出版社, 2008: 42-50.
[17] SHARMA S, BHAT T K, DAWRA R K. A spectrophotometric method for assay of tannase using rhodanine[J]. Analytical Biochemistry, 2000, 279(1): 85-89.
[18] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254.
[19] 蔡明瑛,倪辉,李利君,等. 液相色谱检测乌龙茶水浸提物及其单宁酶水解产物中的儿茶素[J]. 中国食品学报, 2013, 13(5): 211-219.
[20] RIUL A J, GONCALVES H B, JORGE J A, et al. Characterization of a glucose- and solvent-tolerant extracellular tannase from Aspergillus phoenicis[J]. Journal of Molecular Catalysis B-Enzymatic, 2013, 85-86: 126-133.
[21] 朱继新,杨民和. 微生物单宁酶研究现状[J]. 微生物学杂志, 2013, 33(1): 75-81.
[22] SELWAL M K, YADAV A, SELWAL K K, et al. Tannase production by Penicillium Atramentosum Km under SSF and its applications in wine clarification and tea cream solubilization[J]. Brazilian Journal of Microbiology, 2011, 42(1): 374-387.
[23] BELUR P D, MUGERAYA G, KUPPALU N R. Temperature and pH stability of a novel cell-associated tannase of Serratia ficaria DTC[J]. International Journal of Biotechnology & Biochemistry, 2010, 6(5): 667-674.
[24] DAS MOHAPATRA P K, MAITY C, RAO R S, et al. Tannase production by Bacillus licheniformis KBR6: Optimization of submerged culture conditions by Taguchi DOE methodology[J]. Food Research International, 2009, 42(4): 430-435.
[25] 王赞苗,李永刚. 单宁酶对酯型儿茶素作用研究[J]. 中国食品添加剂, 2005(1): 42-44+37.
[26] ZHANG Ying-na, YIN Jun-feng, CHEN Jian-xin, et al. Improving the sweet aftertaste of green tea infusion with tannase[J]. Food Chemistry, 2016, 192: 470-476.
[27] LU M J, CHEN C. Enzymatic modification by tannase increases the antioxidant activity of green tea[J]. Food Research International, 2008, 41(2): 130-137.
[28] ONG C B, ANNUAR M S M. Polyphenolic composition and invitro antioxidant activities of native- and tannase-treated green tea extracts[J]. International Journal of Food Science & Technology, 2017, 52(3): 1-9.