环磷酸腺苷(cyclic adenosine monophosphate, cAMP)是人体内广泛存在的一种生理活性物质,作为细胞内的第二信使,对糖代谢、脂肪代谢以及核酸和蛋白质合成等具有重要的调节作用[1]。该物质作为药物和饲料添加剂广泛应用于心血管类疾病的治疗和畜禽产品的生产中,具有十分重要的应用价值[2]。
微生物发酵生产cAMP的方法具有反应条件温和、成本低、环境友好等优点,具有良好的工业化生产前景,受到越来越多的关注[3]。然而,微生物合成cAMP的过程存在两个主要问题,制约着其发酵性能的提高。一方面,cAMP是由ATP在腺苷酸环化酶的催化下直接环化形成的,ATP不仅是合成产物的原料,还要为细胞生长以及蛋白质、核酸、脂肪等的合成提供能量[4],cAMP合成也常常受到能量供应制约。另一方面,由从头合成途径合成嘌呤环的过程要经过10步反应,消耗5分子的ATP,代谢过程复杂而且加剧了ATP供应不足的问题。
柠檬酸盐是一种常见的化学试剂,价格低廉,在微生物代谢中具有重要的调节作用。该物质可以抑制磷酸果糖激酶和丙酮酸激酶的活性,减少有机酸的合成,调节糖酵解途径与磷酸戊糖途径的代谢流,促进肌苷、尿苷酸等物质的合成[5-6]。更重要的是,柠檬酸盐作为辅助能量物质可以刺激以NAD+为辅酶的代谢反应,加快NAD+合成NADH的过程,再通过电子呼吸链大量合成ATP[7-8]。另外,微生物的补救途径[9]可以直接利用现成的嘌呤类物质与PRPP一步反应即可合成肌苷酸,进而合成cAMP,相比于从头合成途径代谢效率得以提高,同时降低了ATP的消耗,这种合成方法具有明显的优势[10]。
该研究针对cAMP发酵过程中能量供应不足的问题,试图将柠檬酸盐的作用与补救途径的优势相结合促进cAMP的合成,提出了柠檬酸盐与次黄嘌呤偶联添加发酵工艺,提高发酵性能。
1 材料与方法
1.1 菌种
本实验室筛选并保藏的节杆菌(Arthrobacter sp. A. sp01)。该菌株已保藏于中国典型培养物保藏中心,保藏号为CCTCC NO. M2013431。
1.2 培养基及配制方法
斜面培养基(g/L):葡萄糖10,蛋白胨10,牛肉膏10,NaCl 3,尿素4,琼脂20,调pH值至7.2,121 ℃高压蒸汽灭菌20 min。
种子培养基(g/L):葡萄糖10,蛋白胨10,牛肉膏10,NaCl 3,尿素4,酵母膏10,调pH值至7.2,121 ℃、高压蒸汽灭菌20 min。
发酵培养基(g/L):葡萄糖50,K2HPO4 10,KH2PO4 10,尿素10,生物素0.005,CoCl2 0.01,蛋白胨5,次黄嘌呤2,调pH值至7.2,121 ℃高压蒸汽灭菌20 min。
1.3 培养方法
摇瓶培养:30 mL发酵培养基装入250 mL锥形瓶,121 ℃高压蒸汽灭菌20 min。接入培养24 h种子液,接种量为10%体积百分浓度。接种后放入摇床培养72 h,培养温度30 ℃、转速220 r/min。
发酵罐培养:7 L机械搅拌式发酵罐(上海保兴生物设备有限公司BIOTECH-7BG)配备pH和DO电极各一支(瑞士METTLER TOLEDO公司),装载发酵培养基5 L(初始葡萄糖浓度为80 g/L)。121 ℃高压蒸汽灭菌20 min,接种量10%,发酵温度30 ℃,pH值控制在6.8,搅拌转速初始400 r/min,视溶氧变化情况逐渐增加至600 r/min,通风量从起始的0.1 vvm提升至0.6 vvm。
次黄嘌呤添加方法:分批发酵进行至27 h和40 h,分别脉冲式添加次黄嘌呤,每次添加量1 g/L-broth(发酵液中次黄嘌呤浓度提高1 g/L)。
柠檬酸钠添加方法:
(a)发酵罐实验,发酵进行至24 h一次性添加3 g/L-broth的柠檬酸钠。
(b)摇瓶实验,设置1、2、3、4和5 g/L-broth 5个不同的浓度梯度和0、18、30和42 h 4个不同的添加时间,共计20个不同组合,每个组合做3个平行试验。
1.4 分析方法
菌体浓度测定:采用光密度法测定。发酵液稀释20倍,用600 nm波长下的OD值表示菌体浓度。
菌体干重测定:参见文献[11],最终得到菌体干重与OD600的关系为:DCW/(g·L-1)=0.46×OD600
葡萄糖浓度测定:采用DNS法进行测定。
cAMP与次黄嘌呤测定:使用高效液相色谱(安捷伦1026)进行测定[12]。
ATP与ADP测定方法:取5 mL发酵液,4 ℃、9 000 r/min冷冻离心10 min获得菌体,液氮中处理1 min,使胞内代谢瞬间停止。将菌体用PBS缓冲液洗涤2次,重新悬浮在5 mL的PBS缓冲液中,冰浴条件下超声波破碎10 min,超声3 s,静置5 s,经4 ℃、10 000 r/min离心后,上清液用0.22 μm膜过滤后使用液相色谱分析。色谱条件:Lichrospher C18柱(4.6 mm×250 mm,5 μm);柱温30 ℃;水相(6.8 g KH2PO4和3.2 g四丁基溴化铵溶解于水并定容至1 L,用H3PO4调pH至4.3),水相∶乙腈为85∶15(体积比),流量0.8 mL/min;检测波长258 nm。
2 结果与讨论
2.1 柠檬酸钠最佳添加时间与添加量的确定
研究表明,柠檬酸盐能改变糖酵解与磷酸戊糖途径的碳流量分配比例并可以作为辅助能源使用提高细胞产能水平,有利于核苷类物质的合成[5-6]。在250 mL锥形瓶中进行了添加柠檬酸钠的cAMP发酵试验,共设置5个浓度梯度和4个不同添加时间,以cAMP产量为主要指标确定最佳添加时间和添加量。如表1所示,30 h添加3 g/L-broth柠檬酸钠时产物浓度达到最高的2.67 g/L,比对照提高了54.3%。
表1 柠檬酸钠添加时间和添加量对cAMP发酵产物的影响
Table 1 The effects of citrate sodium on cAMP production
with different addition time and amounts
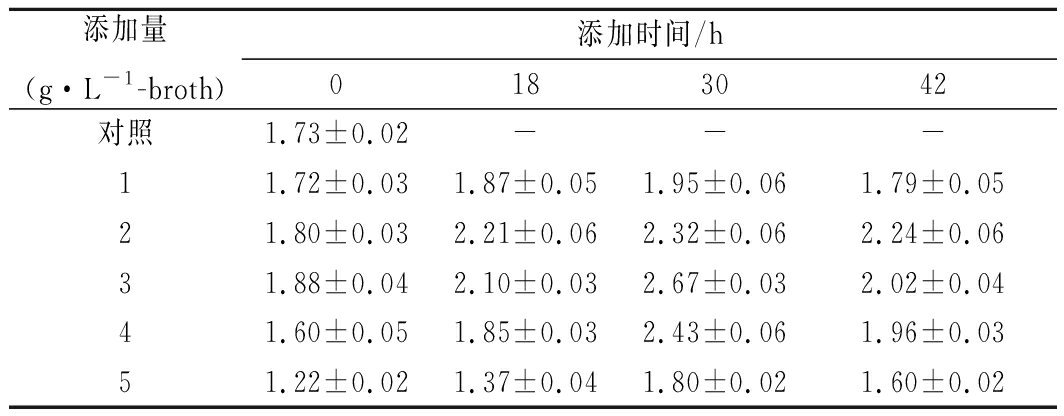
注:表中数据单位为g/L。
2.2 添加柠檬酸钠提高cAMP发酵的整体性能
根据摇瓶实验结果并充分考虑发酵罐培养溶氧效果好、菌体生长快的特点,在7 L发酵罐上进行了添加柠檬酸钠的发酵实验,柠檬酸钠的添加时间为24 h,添加量为3 g/L-broth。图1将对照批次与添加柠檬酸的批次的主要参数进行了比较。如图1(A, B)所示,添加柠檬酸钠批次的cAMP浓度在发酵50 h时达到最大值3.68 g/L,而对照批次发酵72 h时cAMP浓度为3.32 g/L;产量仅提高了11.2%,然而由于发酵时间缩短了22 h,生产效率提高了60.2%。此外,柠檬酸钠添加提高了菌体浓度、葡萄糖消耗以及cAMP合成速率,如图1-A、图1-C和图1-D所示。值得注意的是,次黄嘌呤在发酵前期快速消耗,至发酵27 h时降至0.4 g/L以下,不再变化(图1-B)。
这表明发酵进行至27 h后,cAMP是由从头合成途径合成并积累的,柠檬酸钠添加显著提高了从头合成途径的代谢通量,促进了产物的快速合成。
2.3 柠檬酸钠添加促进ATP合成提高ATP/ADP比
研究表明柠檬酸盐可以促进能量代谢,是一种有效的辅助能量物质[7]。对上述2个发酵批次不同时期的胞内ATP和ADP含量进行了测定,结果见图2。
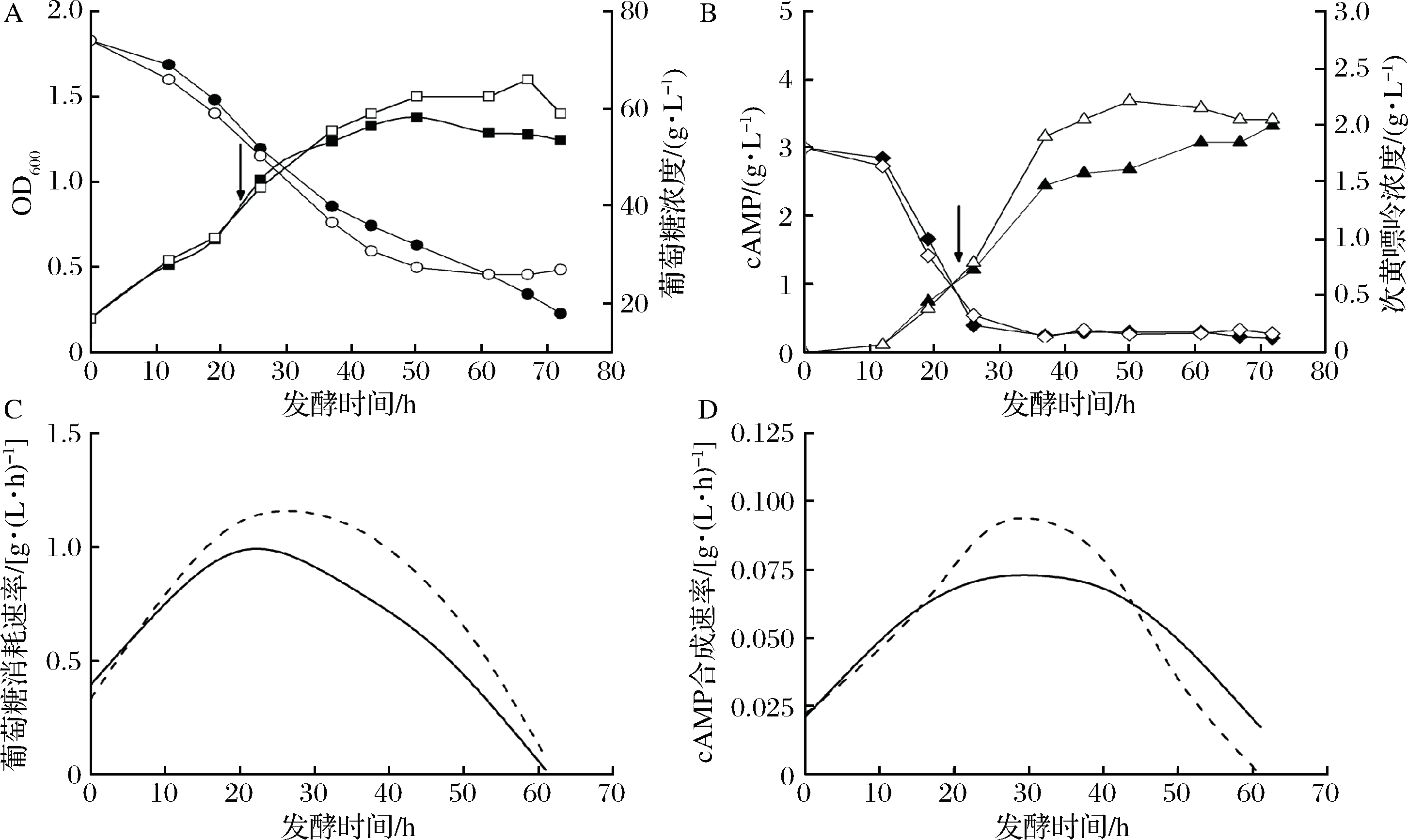
A:■/□菌体浓度,●/○葡萄糖浓度;B:▲/△ cAMP浓度,◆/◇次黄嘌呤浓度;黑色符号:对照批次;
白色符号:24 h添加3 g/L-broth柠檬酸钠;C、D:——对照批次;---24 h添加3 g/L-broth柠檬酸钠;↓表示柠檬酸添加时间
图1 柠檬酸钠添加对菌体生长、残糖、产物合成及前体利用的影响
Fig.1 The effects of citrate sodium on cAMP fermentation performance
添加柠檬酸钠批次的胞内ATP含量得到显著提高,ATP/ADP比率也大幅提高;尤其在24 h后,ATP含量和ATP/ADP比率迅速上升,至40 h左右达到最高点,此时正是cAMP快速合成、葡萄糖快速消耗的时期。这表明柠檬酸钠促进了ATP的合成,为cAMP的合成提供了充足的原料。
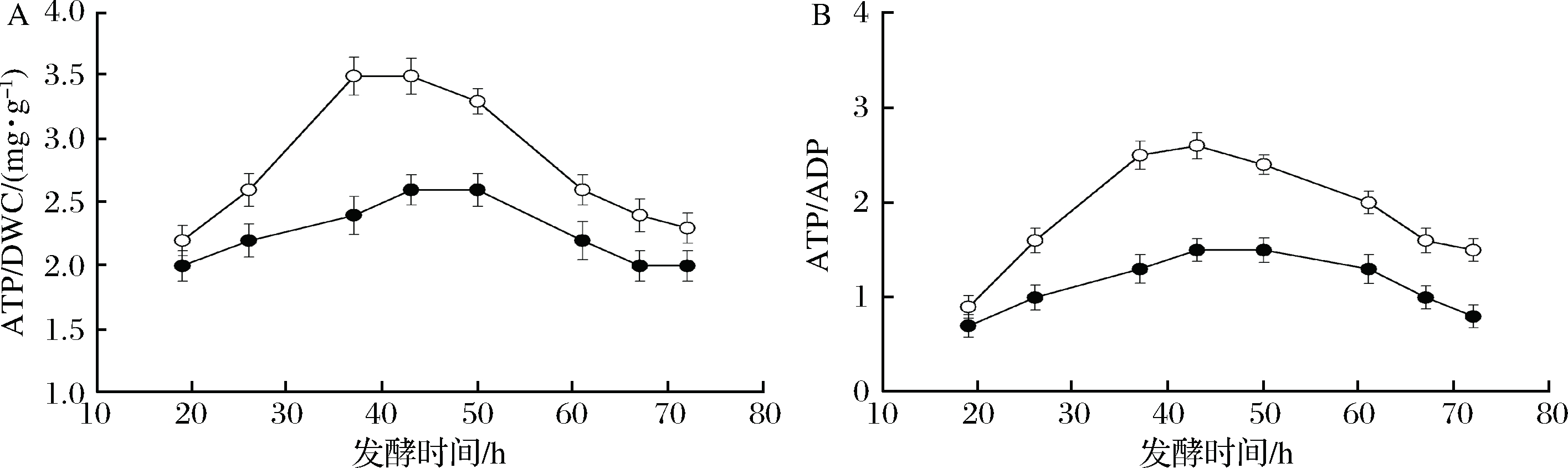
●-对照;○-24 h添加3 g/L-broth柠檬酸钠
图2 柠檬酸钠添加对ATP合成及ATP/ADP比的影响
Fig.2 The effects of citrate sodium on ATP synthesis and ATP/ADP ratio
2.4 脉冲式补充次黄嘌呤偶合柠檬酸钠添加的cAMP发酵工艺的整体性能
除从头合成途径外,微生物还可以直接利用环境中现有的嘌呤类物质合成肌苷酸(补救途径),进而合成cAMP。补救途径通过一步反应即可完成从头合成途径的10步反应,节省了5分子ATP,代谢过程效率更高。希望将补救途径的优势与柠檬酸钠的作用相结合,进一步提高cAMP的生产效率。因此,进行了脉冲式补充次黄嘌呤偶合柠檬酸钠添加的cAMP发酵试验。如图3所示,偶合添加柠檬酸钠批次的菌体浓度和cAMP产量均明显提高,cAMP浓度在50 h达到最大的4.42 g/L,生产效率达到0.088 g/(L·h),与单独添加次黄嘌呤批次相比分别提高了38.1%和40.2%,大大提高了补救途径的运行效率。
另外,由图3B中次黄嘌呤浓度的变化情况也表明添加柠檬酸钠确实促进了次黄嘌呤的吸收,提高了次黄嘌呤的利用效率。
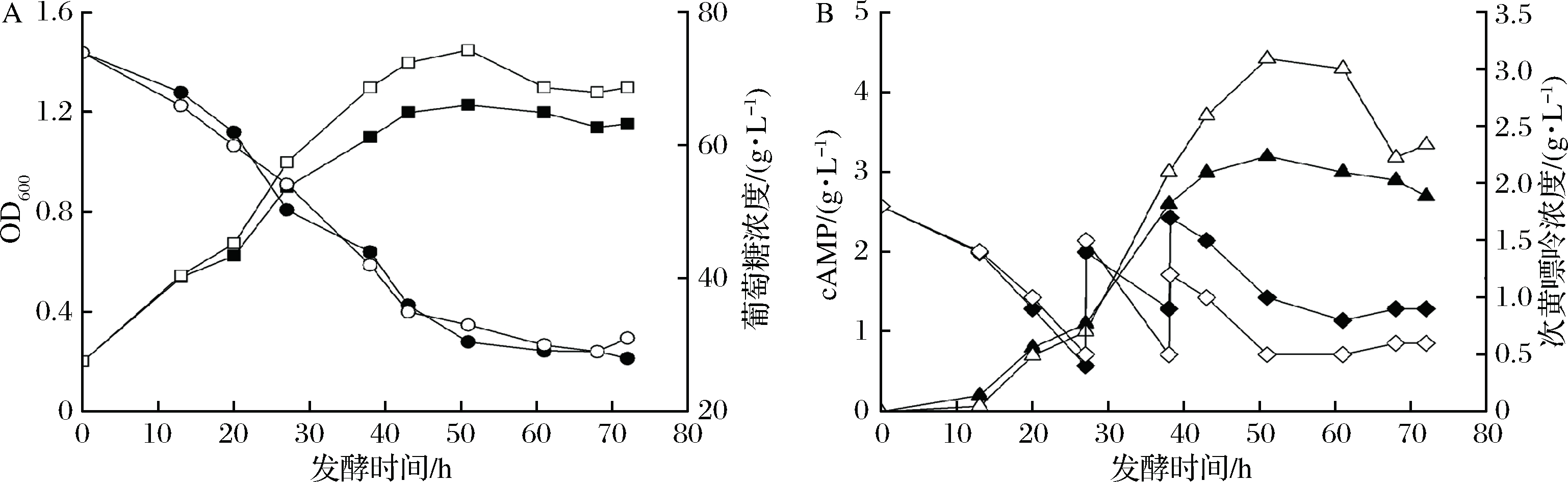
■/□:菌体浓度;●/○:葡萄糖浓度;▲/△:cAMP浓度;◆/◇:次黄嘌呤浓度;黑色符号:27、38 h各补充g/L-broth次黄嘌呤;
白色符号:24 h添加3 g/L-broth柠檬酸钠,27、38 h各补充1 g/L-broth次黄嘌呤
图3 柠檬酸钠与次黄嘌呤偶联添加工艺中菌体、残糖、产物及前体浓度的变化情况
Fig.3 The fermentation performance for cAMP production with citrate sodium and hypoxanthine addition
2.5 不同发酵模式下主要发酵参数比较
表2对不同工艺条件下各发酵批次的主要参数进行了比较。如表2所示,添加柠檬酸钠或次黄嘌呤批次的发酵周期均不同程度的缩短,cAMP产量和发酵强度均不同程度的提高;24 h加柠檬酸钠并脉冲补充次黄嘌呤批次的cAMP产量为4.42 g/L,发酵强度达到0.088 g/(L·h),比对照分别提高了33.1%和91.3%。所有添加柠檬酸批次的cAMP产量、发酵强度均有一定程度的提高,特别是同时补充次黄嘌呤的批次提高幅度更大,使柠檬酸钠的作用与补救途径优势同时得到发挥。
表2 不同发酵批次的性能参数比较
Table 2 Performance comparison for different fermentation modes

注:HX代表添加次黄嘌呤,C代表添加柠檬酸钠;24 h表示添加柠檬酸钠的时间;次黄嘌呤添加方式:27、38 h各补充1 g/L-broth次黄嘌呤
3 结论
添加柠檬酸钠有利于提高cAMP发酵的整体性能,24 h一次性添加3 g/L-broth的柠檬酸钠,cAMP浓度和生产效率分别比对照提高了11.2%和60.2%;对胞内能量物质含量进行分析,结果表明添加柠檬酸钠显著提高了ATP含量和ATP/ADP比率,为cAMP合成提供了能量和物质保障。提出了添加柠檬酸钠偶合脉冲补充次黄嘌呤(前体)的发酵工艺,将能量供给与补救途径的优势相结合,cAMP产量和发酵强度分别比对照提高了33.1%和91.3%。
参考文献
[1] MCPHEE I, GIBSON L, KEWNEY J, et al. Cyclic nucleotide signalling: A molecular approach to drug discovery for Alzheimer’s disease[J]. Biochemical Society Transactions, 2005, 33(6): 1 330-1 332.
[2] DING Hong, PENG Rui-xin. Role of the cAMP in immunological liver injury in mice: comparing LPS-induced model with LPS+BCG-induced model[J]. Chinese Pharmacology Bulletin, 2003, 19: 940-943.
[3] CHEN Xiao-chun, BAI Jian-xin, CAO Jia-ming, et al. Medium optimization for the production of cyclic adenosine 3’, 5’-monophosphate by Microbacterium sp. no.205 using response surface methodology[J]. Bioresource Technology, 2009, 100(2): 919-924.
[4] 陈晓春. 环磷酸腺苷高产菌的选育及其代谢调控[D]. 南京:南京工业大学, 2010.
[5] CHEN Shuang-xi, CHU Ju, ZHUANG Ying-ping, et al. Enhancement of inosine production by Bacillus subtilis through suppression of carbon overflow by sodium citrate[J]. Biotechnology Letters, 2005, 27(10): 689-692.
[6] CHEN Yong, LI Shu-ya, XIONG Jian, et al. The mechanisms of citrate on regulating the distribution of carbon flux in the biosynthesis of uridine 5’-monophosphate by Saccharomyces cerevisiae[J]. Applied Microbiology and Biotechnology, 2010, 86(1): 75-81.
[7] ZHOU Jing-wen, LIU Long, CHEN Jian. Improved ATP supply enhances acid tolerance of Candida glabrata during pyruvic acid production[J]. Journal of Applied Microbiology, 2011, 110(1): 44-53.
[8] WANG Yu-lei, WANG Da-hui, Wei Gong-yuan, et al. Improved co-production of S-adenosylmethionine and glutathione using citrate as an auxiliary energy substrate[J]. Bioresource Technology, 2012, 131: 28-32.
[9] 徐海,钱卫,季明杰,等. 核苷酸补救途径在肌苷代谢中应用的研究[J]. 山东大学学报, 2000, 35(4): 453-457.
[10] CHEN Xiao-chun, SONG He, FANG Ting, et al. Enhanced cyclic adenosine monophosphate production by Arthrobacter A302 through rational redistribution of metabolic flux[J]. Bioresource Technology, 2010, 101(9): 3 159-3 163.
[11] 曹艳. 利用代谢酶学和模型技术改善谷氨酸发酵的稳定性和糖酸转化率[D]. 无锡:江南大学, 2014.
[12] LI Lei, CHEN Xiao-chun, CHENG Jian, et al. Bi-stage control of dissolved oxygen to enhance cyclic adenosine monophosphate production by Arthrobacter A302[J]. Bioprocess and Biosystems Engineering, 2012, 35(8): 1 281-1 286.