膳食纤维是人类“第七大营养素”,在预防和治疗肥胖、糖尿病和肠道疾病等方面具有特殊功效,有调节血糖、降低胆固醇,延缓小肠对葡萄糖的吸收,增强肠道蠕动,防止结肠癌和预防便秘等功能,但不同膳食纤维功能特性和感官特性不同,可溶性膳食纤维(soluble dietary fiber,SDF)比不溶性膳食纤维(insoluble dietary fiber,IDF)有更强的功能性[1-3],IDF口感粗糙,而SDF口感细腻。因此,提升食物源膳食纤维中SDF含量,可提升膳食纤维功能作用和增进人们接受能力,所以提高SDF含量的膳食纤维改性研究是近几年的研究热点[4]。
作为大豆加工的副产品,膳食纤维占豆渣干基重的60%~70%,是一种廉价而又极好的天然膳食纤维源[5]。豆渣膳食纤维和大多数植物性食物纤维一样,主要是IDF和SDF含量较低,只有大约6%,既降低了豆渣的可接受性,营养价值也受影响。由于豆渣口感粗糙及含水量高,不宜贮存和直接食用。因此,豆渣一般作为动物饲料贱卖或直接丢弃,造成了资源的极大浪费及在一定程度上的环境污染[6]。但是豆渣作为一种低脂低糖低能量髙膳食纤维食物资源,符合人们追求“三低一高”的完美食物的要求,有重要的开发利用价值[7]。目前报道的对豆渣膳食纤维进行改性的方法主要有高温、高压、发酵、酶解、均质、离子液体处理或这几种方法联合处理等[8-10]。其中,发酵法不仅可提高SDF含量,还可去除部分抗营养因子,产生一些对人体有益的小分子物质,已成为目前膳食纤维改性的有效方法之一。
一方面,膳食纤维改性通过提升SDF含量占比改进其功能特性;另一方面,备受关注的是通过改性,有效改善膳食纤维的理化性质,如持水力和膨胀力等[11-12],以提升膳食纤维的加工特性和可接受性,以更好地应用于食品加工。为此,本研究采用真菌单独发酵及真菌结合乳酸菌联合发酵制备改性豆渣膳食纤维,并分析其食品化学特性及微观结构变化,为发酵豆渣膳食纤维应用于食品加工提供有关食品化学的基础研究数据。
1 材料与方法
1.1 实验材料
豆渣:购于重庆北碚天生农贸市场豆腐坊。
米曲霉(Aspergillus oryzae 3.951),黑曲霉(Aspergillus niger),毛霉(Mucor sp.)和乳酸菌(嗜热链球菌(Streptococcus thermophilus CH-1),保加利亚乳杆菌(Lactobacillus bulgaricus Lb0925B),均由西南大学食品科学学院食品发酵研究室提供。
1.2 主要试剂
KH2PO4、K2HPO4、H2SO4、HCl、NaOH、30~60 ℃沸程石油醚、丙酮:为分析纯,成都市科龙化工试剂厂。
耐高温α-淀粉酶(250 NFU/mg),胰蛋白酶(300 NFU/mg),胃蛋白酶(250 NFU/mg)北京奥博星生物技术有限责任公司。马铃薯葡萄糖琼脂(PDA)培养基,MRS培养基。
1.3 主要仪器设备
电子天平(FA2004A型),上海精天电子仪器有限公司;电热恒温鼓风干燥箱(DHG 9140A型),上海齐欣科学仪器有限公司;台式高速离心机(5810型),德国Eppendorf公司;冷冻干燥机,上海东星建材试验设备有限公司;全自动凯氏定氮仪(Kjel Flex K-360型),瑞士Buchi公司;马尔文激光粒度仪(ZEN3690),英国马尔文仪器公司;马弗炉(4-10型),北京市永光明仪器厂;循环水式多用真空泵(SHZ-Ⅲ),上海亚荣生化仪器厂;万用电炉(DL 1),北京中兴伟业仪器有限公司;原子吸收分光光度计(Z-5000),日本日立有限公司;恒温振荡器(2D-85),金坛市富华仪器有限公司等。
1.4 实验方法
1.4.1 孢子悬浮液制备
1.4.1.1 米曲霉、黑曲霉和毛霉孢子悬浮液制备[13]
将米曲霉、黑曲霉和毛霉分别在马铃薯葡萄糖琼脂(PDA)斜面培养基上活化,分别挑取活化好的菌丝接种到装有麸皮的培养基[14](m麸皮∶m水=1∶1.2)的三角瓶上进行扩培。活化和扩培条件均为:温度28 ℃、时间3 d。最后向三角瓶加入适量质量分数为0.9%的生理盐水,振荡,无菌纱布过滤,将滤液收集到三角瓶中并用质量分数为0.9%的生理盐水稀释,制成2×107~5×107个/mL孢子悬浮液以备发酵豆渣使用。
1.4.1.2 乳酸菌孢子悬浮液制备[15]
在无菌条件下称取2.5 g乳酸菌发酵剂,与22.5 mL质量浓度为8.5 g/L NaCl溶液充分混匀;吸取上述溶液1 mL与9 mL灭菌的质量浓度为8.5 g/L NaCl溶液充分混匀,依次稀释到浓度为10-7,选取2~3个适宜稀释浓度,取0.1 mL加入到MRS培养基中,用涂布棒进行涂布,在37 ℃厌氧培养2 d,观察菌落生长状况。
取固体培养基中的乳酸菌菌种于液体培养基中,37 ℃静置培养18 h得到乳酸菌发酵种子液。
1.4.2 发酵豆渣的制备
1.4.2.1 真菌发酵豆渣的制备[16-18]
称取150 g适当水分含量的新鲜豆渣于500 mL三角瓶中,6层纱布封口,在121 ℃高压灭菌锅内蒸煮20 min,冷却至室温后,分别加入黑曲霉、米曲霉和毛霉孢子悬浮液,以加入质量分数为1%无菌水的豆渣为对照,混匀后置恒温恒湿培养箱培养,分析不同发酵时间对豆渣IDF的影响,确定最佳发酵时间为3 d,并分别得到黑曲霉发酵豆渣(H)、米曲霉发酵豆渣(M’)、毛霉发酵豆渣(M)3个样品。每个处理重复3次,合并、冻干、备用。以未发酵处理豆渣为对照(CK)。
黑曲霉发酵:温度28 ℃、相对湿度90%,接种量2%,孢子数107个/mL;米曲霉发酵:温度28 ℃、相对湿度75%,接种量6%,孢子数107个/mL;毛霉发酵:温度28 ℃、相对湿度70%,接种量2%,孢子数107个/mL。
1.4.2.2 霉菌结合乳酸菌联合发酵豆渣制备
分别称取50 g冻干的霉菌发酵样品H、M’和M,分别加入水使含水量达到40%,置磨砂广口瓶中,6层纱布封口,121 ℃高压灭菌锅内蒸煮20 min,冷却至室温,加入质量分数为1%的乳酸菌发酵液,混匀后用灭菌的棕榈叶子封口倒扣在无菌生理盐水中于37 ℃恒温培养箱中培养7 d,分别得黑曲霉+乳酸菌、米曲霉+乳酸菌和毛霉+乳酸菌3种联合乳酸菌发酵后的样品HR、M’R和MR,每个处理重复3次,合并,冻干,粉碎备用[19]。以未发酵处理豆渣为对照组(CK)。
1.4.3 主要测定指标
1.4.3.1 基础成分分析
水分:GB 5009.3—2016《食品中水分的测定》;脂肪:GB 5009.6—2016《食品中脂肪的测定》;蛋白质:GB 5009.5—2016《食品中蛋白质的测定》;灰分:GB 5009.4—2016《食品中灰分的测定》;膳食纤维:GB/T 5009.88—2014《食品中膳食纤维的测定》
碳水化合物含量/%=[1-(含水量+脂质+蛋白质+灰分)]×100[20]
1.4.3.2 发酵豆渣粒径和显微观察
发酵豆渣粒径:样品均匀分散于超纯水中,超声波清洗机超声10 min,待均匀后进行梯度稀释,重复上述步骤,稀释到适宜浓度,上机测定,每个样品重复3次并读数。
发酵豆渣显微观察:取0.1 g过80目筛的豆渣粉于小烧杯中,加入10 mL蒸馏水,充分振荡搅拌均匀,用微量移液枪吸取少量样品于载玻片上,盖上盖玻片,置于载物台上,用荧光显微镜观察,由于放大倍数较高,所以要在油镜下观察并拍摄豆渣的内部结构,放大倍数为100倍。
1.4.3.3 豆渣水合性质[21]
豆渣水溶指数:精确称取适量豆渣样品放入200 mL烧杯中,向烧杯中加入50 mL蒸馏水,搅拌均匀。放入90 ℃恒温水浴中持续搅拌振荡30 min,4 500 r/min离心15 min,取上清液放入烘箱,103 ℃烘干至质量恒定,称量残留物质量,根据式(1)计算豆渣水溶指数:
![]()
(1)
式中:WS,豆渣的水溶性,%;m1,豆渣样品的质量,g;m2,残留物质量,g。
豆渣膨胀力:准确称取豆渣样品放入25 mL量筒,加入15 mL蒸馏水,振荡使其充分溶解,25 ℃下放置24 h。读取样品在量筒中自由膨胀后的体积,据式(2)计算膨胀力。
![]() %
%
(2)
式中:E,豆渣膨胀力,mL/g;m,豆渣样品的质量,g;v,豆渣在量筒中膨胀后的体积,mL。
豆渣持水力:称取豆渣样品置于恒重离心管中,加入30 mL蒸馏水,振荡均匀,室温下放置24 h,4500 r/min离心20 min,除去上清液,用滤纸吸干离心管上的液体,称量离心管和残渣总质量,根据式(3)计算持水力。
![]()
(3)
式中:WHC,豆渣的持水力,g/g;m,豆渣样品的质量,g;m1,离心管恒重后的质量,g;m2,经处理恒重后的离心管和残渣的总质量,g。
1.4.3.4 发酵豆渣吸附特性
吸附不饱和脂肪能力[22]:取豆渣样品置于恒重离心管中,加入5 mL食用大豆油混合均匀,放置30 min,每5 min振荡1次。4 500 r/min下离心25 min,除去上层游离脂肪,称量离心管和残渣总质量。以1 g豆渣样品所结合脂肪质量为豆渣持油力,按式(4)计算:
![]()
(4)
式中:OHC,豆渣持油力,g/g;m,豆渣样品的质量,g;m1,离心管恒重后的质量,g;m2,经处理恒重后的离心管和残渣的总质量,g。
吸附饱和脂肪能力[22]:取50 mL恒重离心管,质量记做W1;准确称取适量样品于恒重离心管中,豆渣质量记作W2。加入猪油24 g,于37 ℃恒温水溶锅静置1 h,4 000 r/min离心20 min,将上层油倒掉,用滤纸吸干残渣的游离猪油,称重得W3。根据式(5)计算吸附饱和脂肪能力。
吸油量![]()
(5)
吸附胆固醇能力[23]:取鲜鸡蛋蛋黄并进行准确称重,用9倍质量蒸馏水充分搅打至呈乳液状。精确称取适量豆渣样品于200 mL三角瓶中,加入50 g稀释蛋黄液,搅拌均匀,分别调节体系pH值为1.5 (模拟人体胃液环境)和7.6 (模拟人体小肠环境),置37 ℃恒温摇床中振荡2 h,于4 000 r/min下离心20 min,取上清液,采用邻苯二甲醛作显色剂,在550 nm下比色。通过标准曲线法计算蛋黄液中胆固醇含量和吸附后上清液中胆固醇含量,根据式(6)计算胆固醇吸附量。
胆固醇吸附量/(mg·g-1)=
(6)
吸附亚硝酸盐能力:精确称取样品1 g于100 mL干燥锥形瓶中,加入50 mL 100 μmol/L的亚硝酸钠溶液,调节体系pH值为1.5 (模拟人体胃液环境)和7.6 (模拟人体小肠环境),置于37 ℃恒温摇床中振荡2 h,于4 000 r/min下离心20 min,取上清液,通过盐酸萘乙二胺比色法测定亚硝酸根含量。通过标准曲线换算蛋黄液中亚硝酸根含量和吸附后上清液中亚硝酸根含量,根据式(7)计算亚硝酸根吸附量[24]。
亚硝酸根吸附量/(mg·g-1)=
(7)
1.4.3.5 发酵豆渣抗氧化能力
准确称取豆渣样品10 mg于10 mL恒重离心管中,加入2.5 mL 0.2 mol/L(pH值6.6)的PBS缓冲液、2.5 mL 10 g/L的K3 [Fe(CN) 6]溶液后混匀,50 ℃水浴20 min,冷却后再加入100 g/L的TCA溶液2.5 mL,混匀静置10 min,以3 000 r/min离心10 min,取2.5 mL上清液通过铁氰化钾比色法测定,通过标准曲线换算得到Vc当量浓度[25]。
1.5 数据分析
每个样品重复测定3次。数据分析应用SPSS软件单因素方差分析和显著性检验(p<0.05),结果用平均值±标准差(SD)来表示。
2 结果与分析
2.1 发酵豆渣基础成分分析
2.1.1 发酵豆渣宏量营养素及灰分含量分析
真菌及真菌联合乳酸菌发酵豆渣宏量营养素及灰分含量分析如表1所示。水分和灰分含量分别在5.36%~6.26%和3.24%~3.79%,表明发酵对豆渣灰分含量影响较小(p> 0.05)。蛋白质含量在发酵中显著下降(p<0.05),经真菌发酵后含量为CK组的71.31%~82.0%,继续采用乳酸菌发酵,蛋白质含量继续下降,为CK的61.81%~70.20%,M’及M’R组蛋白质降低最多。豆渣发酵后多数处理脂肪含量下降,经真菌发酵及真菌结合乳酸菌发酵后脂肪含量分别为CK组的91.68%~105.19%和72.92%~77.34%,表明豆渣脂肪含量下降主要受乳酸菌发酵影响。这些变化可能与微生物胞外酶及微生物本身代谢繁殖消耗有关。真菌发酵与真菌+乳酸菌发酵处理组蛋白质和脂肪含量的下降导致发酵豆渣碳水化合物相对含量不同程度增加(p<0.05)。
表1 发酵豆渣宏量营养素及灰分含量分析 单位:%
Table 1 Changes of macronutrients and ash in fermented soybean dregs
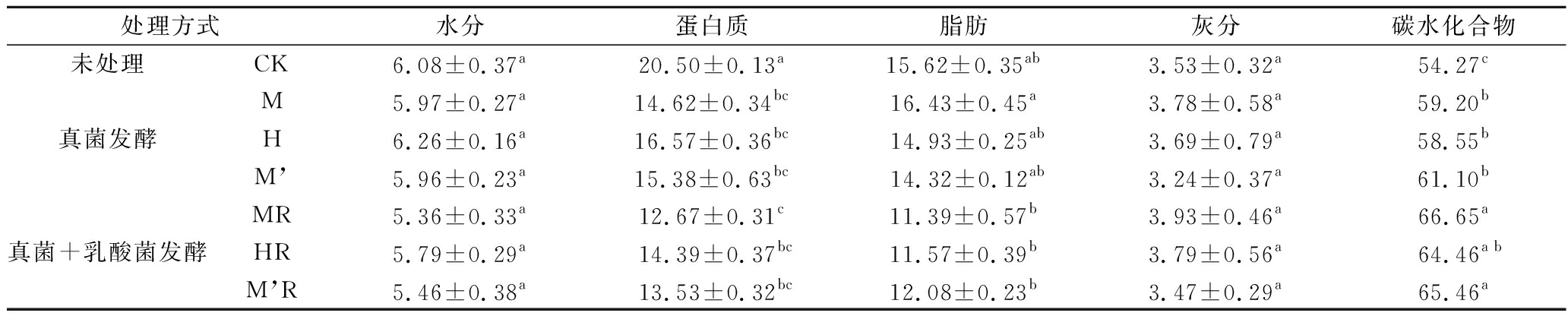
注:数值表示为平均值±标准偏差(SD)。同一列内不同小写字母代表差异显著(p<0.05)。字母相同则代表差异不显著(p>0.05)。下表同。
2.1.2 发酵豆渣膳食纤维含量分析
如表2所示,发酵豆渣总膳食纤维含量在64.17%~65.35%,略高于CK组,表明发酵对豆渣总膳食纤维含量几乎没有影响;但从SDF和IDF分布可看出,发酵可显著提升SDF含量和降低IDF含量(p<0.05),原因可能是IDF大部分是大分子物质,经过发酵分解之后就会降解,暴露极性基团,使可溶性提高,SDF含量升高,所以总膳食纤维的含量保持稳定。
表2 发酵豆渣膳食纤维含量分析单位:g/100g干基
Table 2 Changes of dietary fiber in fermentedsoybean dregs
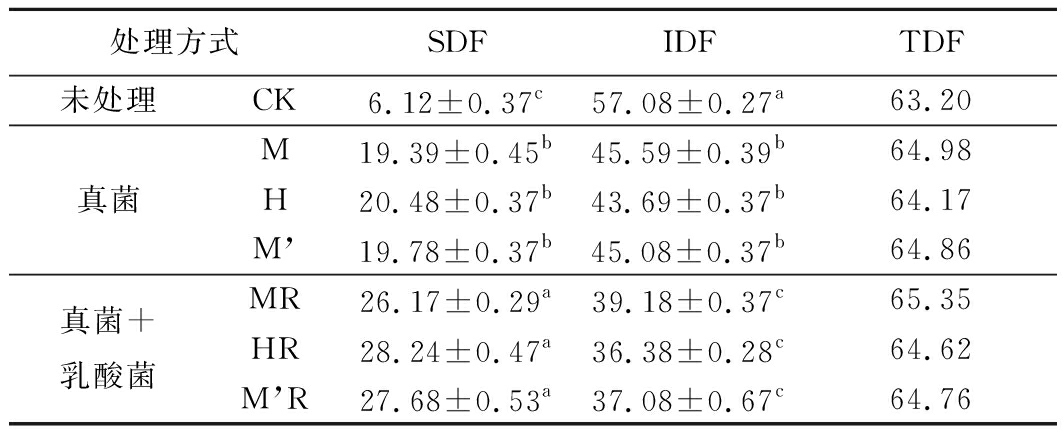
注:TDF总膳食纤维Total dietary fiber。
经真菌发酵和真菌结合乳酸菌发酵后豆渣SDF含量分别为CK的3.17~3.35倍和4.28~4.61倍,IDF分别为CK的76.54%~79.87%和63.74%~68.64%;3种真菌发酵样品之间没有显著差异(p>0.05),3种真菌结合乳酸菌发酵样品之间也没有显著差异(p>0.05),但黑曲霉发酵及黑曲霉结合乳酸发酵样品SDF含量均最高。从SDF角度考虑,黑曲霉及黑曲霉结合乳酸发酵效果较好。
2.2 发酵豆渣粒径和显微结构
2.2.1 发酵豆渣粒径分析
发酵显著降低了豆渣粒径,真菌发酵豆渣和真菌结合乳酸菌发酵豆渣粒径分别为CK组的45.01%~49.06%和31.21%~33.65%(图1)。
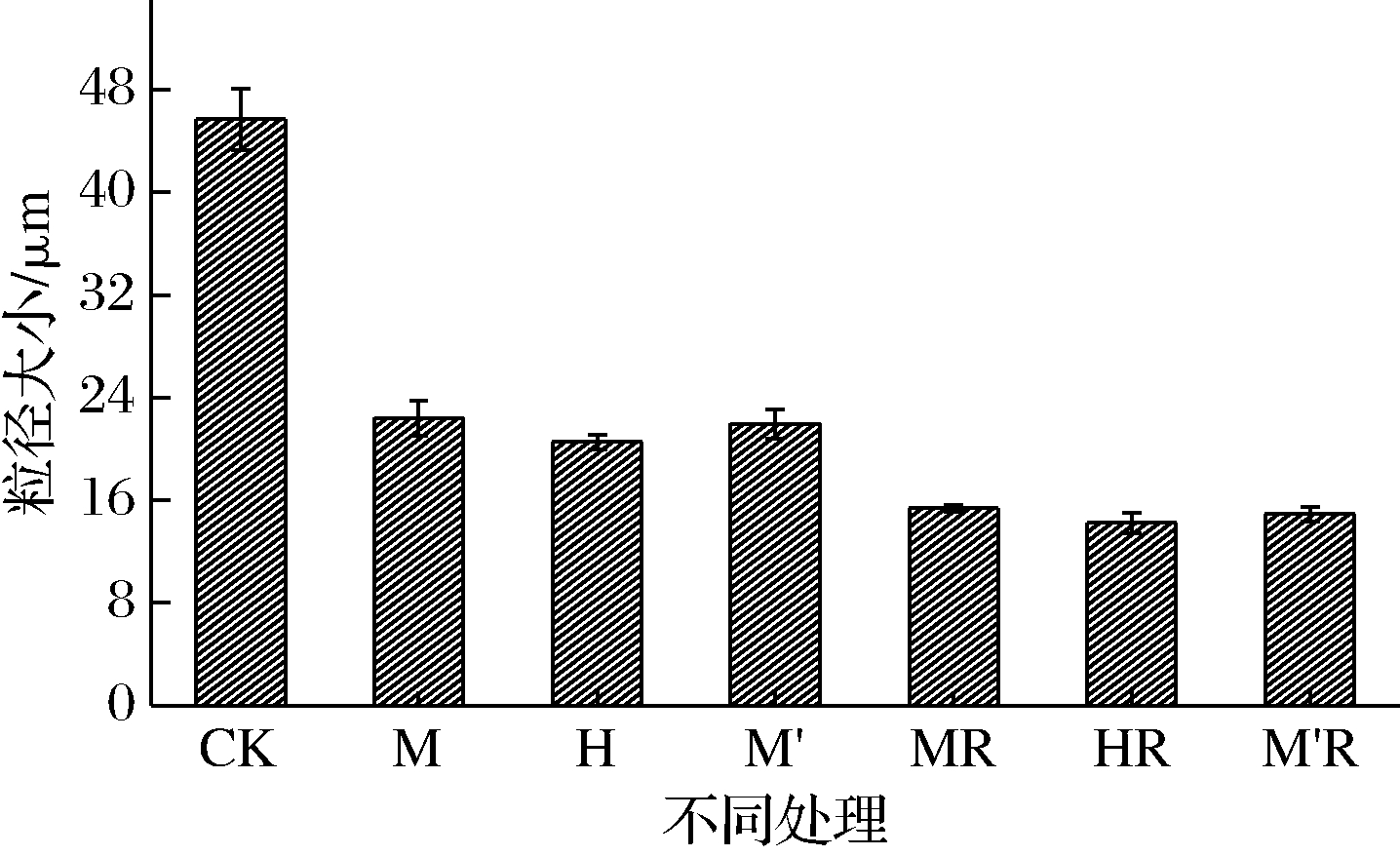
图1 发酵豆渣粒径分析
Fig.1 Particle size analysis of fermented soybean residue
分别以黑曲霉和黑曲霉结合乳酸菌发酵的豆渣粒径最低。膳食纤维粒径越小,比表面积越大,持水、持油能力就越强,口感越细腻。所以发酵可提升豆渣感官品质。发酵豆渣粒径减小的原因可能是微生物生长及微生物胞外酶代谢产生小分子物质,特别是与黑曲霉产生的胞外酶活性较高有关。文献[13]报道黑曲霉产生纤维素酶和半纤维素酶活力更高,这2种酶在促进不溶性膳食纤维的降解方面起了重要作用,促进了不溶性膳食纤维大分子的降解,产生的豆渣粒径相对较小[13]。加上乳酸菌发酵产酸促使纤维素大分子进一步分解,引发粒径减小,进一步增强了纤维结构的蓬松度[26]。
2.2.2 发酵豆渣显微观察
图2所示,未发酵豆渣(CK)组为致密网状结构,没有明显的断层和破碎等。真菌发酵(M、H、M’)豆渣表面多呈蜂窝状,同时可观察到部分较小的碎片,豆渣内部原本致密的结构变得蓬松易碎。3种真菌结合乳酸菌发酵豆渣MR、HR和M’R破碎为小块结构,可以观察到比较多的碎片。说明真菌结合乳酸菌发酵可有效改变豆渣结构而影响其食品化学特性。

图2 发酵豆渣的显微观察
Fig.2 Microscopic observation of fermented soybean residue
2.3 发酵豆渣水合性质分析
如表3所示,真菌发酵豆渣水溶指数、膨胀力和持水力均不同程度地提高,分别为CK的1.76~2.40倍、1.54~1.95倍和1.40~1.82倍。真菌发酵组中黑曲霉发酵豆渣水溶指数、膨胀力和持水力均最高;真菌结合乳酸菌发酵豆渣水溶指数、持水力和膨胀力继续增加,分别为CK组的3.35~4.04倍、1.87~2.43倍和1.77~2.08倍,黑曲霉结合乳酸菌发酵豆渣水溶指数、膨胀力和持水力最高。
发酵豆渣水合性质的改善与微生物代谢导致大分子物质分解有关。这些大分子物质的分解使豆渣细胞壁破裂,颗粒变小,增加了其与水接触的表面积;此外,豆渣的水溶性还与纤维素结构的稳定性相关。而发酵可使纤维素有序结构变得无序,使纤维素分子长链断裂,微晶结构破坏。
表3 发酵豆渣水合性质
Table 3 Changes of hydration properties of fermentedsoybean dregs
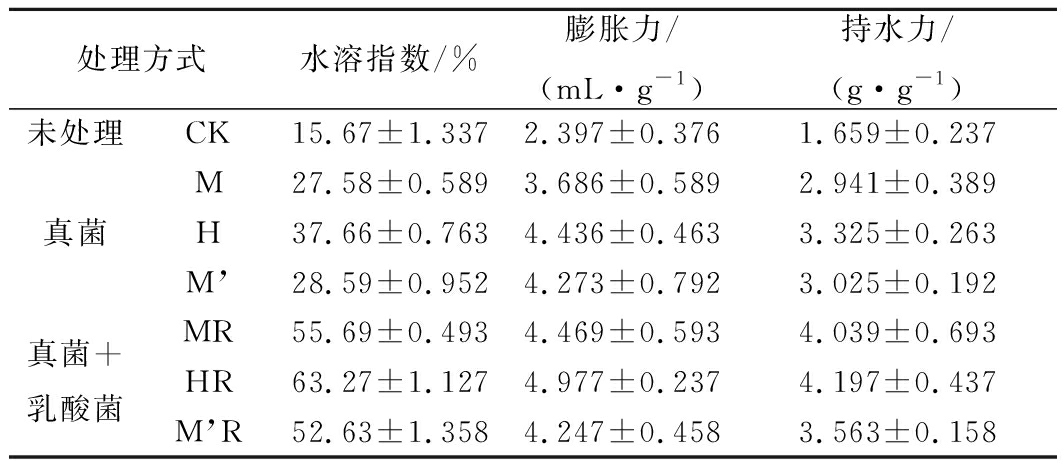
显微观察也显示发酵豆渣表面多呈蜂窝状,表面的孔洞数量和体积均有不同程度的提高,使结构变得蓬松,水分子更易进到内部,提高豆渣持水力和膨胀力。真菌结合乳酸菌发酵豆渣水合性质的改善,与乳酸菌发酵产酸及胞外酶作用有关,通过利用豆渣中的蛋白质、淀粉等产酸,使部分IDF降解;同时,酸是质子的良好供体,能使纤维素糖苷键断裂,产生新的还原端,使IDF转化为SDF。所以提升了豆渣的水合性质,改善了豆渣膳食纤维的功能性[27-28]。
2.4 发酵豆渣吸附特性分析
2.4.1 发酵豆渣吸附脂质的能力
如图3所示,真菌和真菌联合乳酸菌发酵豆渣不同程度地提升了脂质吸附能力。真菌发酵豆渣吸附胆固醇、不饱和脂肪和饱和脂肪的能力分别为CK组的1.63~1.70倍、1.16~1.28倍和1.16~1.25倍;真菌结合乳酸菌发酵吸附脂质能力更高,分别为CK组的1.94~2.01倍、1.77~1.82倍和1.20~1.31倍。表明发酵豆渣可很好提升吸附胆固醇的能力。

图3 发酵豆渣吸附脂质能力
Fig.3 The ability of fermented soybean residue to adsorb lipid
黑曲霉和黑曲霉结合乳酸菌发酵豆渣均有较强的吸附胆固醇的能力及吸附饱和脂肪的能力。因此,发酵豆渣可用于降血脂和体重控制。吸附脂质能力的增加主要与颗粒的表面性质有关,也可能与总电荷密度、组成成分的亲水性能等有关[29]。发酵会使纤维素大分子的致密结构被破坏,表面积增加,组织更加疏松,能更好地吸附和结合脂类物质。发酵豆渣SDF含量增加可能也是吸附脂质能力提高的原因[30]。
2.4.2 发酵豆渣吸附亚硝酸盐的能力
如图4所示,真菌发酵豆渣以及真菌结合乳酸菌发酵豆渣吸附亚硝酸盐的能力均不同程度地提升,分别为CK的1.27~1.40倍和1.43~1.51倍,黑曲霉以及黑曲霉结合乳酸菌发酵豆渣吸附力最高。膳食纤维对![]() 的吸附除了物理吸附之外,还有其中酚类物质也可与
的吸附除了物理吸附之外,还有其中酚类物质也可与![]() 结合有关,其中主要是阿魏酸的作用,吸附
结合有关,其中主要是阿魏酸的作用,吸附![]() 能力的提升可能与该类物质在微生物作用下得到了充分释放有关。
能力的提升可能与该类物质在微生物作用下得到了充分释放有关。
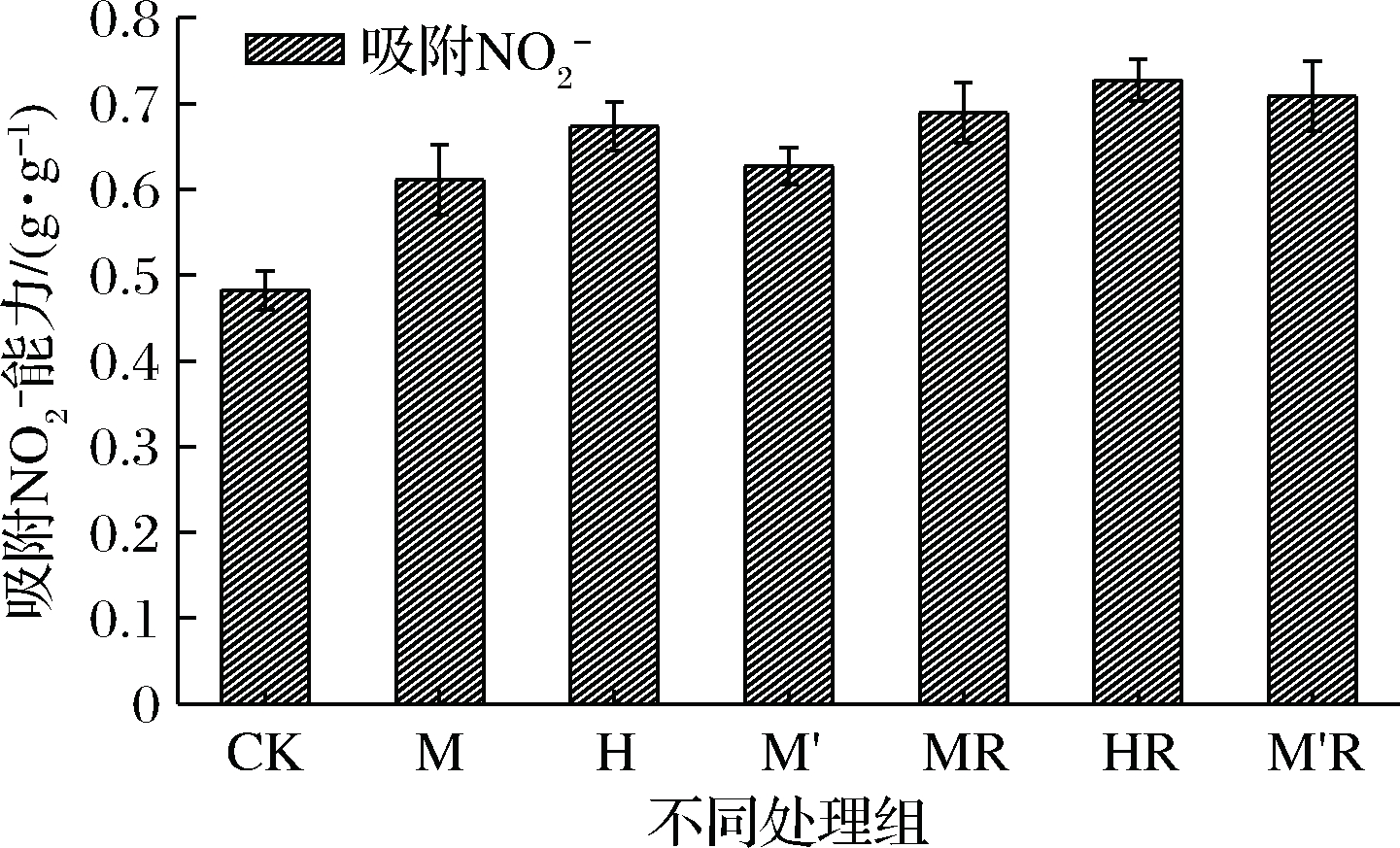
图4 发酵豆渣吸附亚硝酸盐能力
Fig.4 The ability of fermented soybean residue to adsorb nitrite
2.5 发酵豆渣抗氧化性分析
如图5所示,真菌发酵豆渣以及真菌结合乳酸菌发酵豆渣总还原力均不同程度地提升,分别为CK的1.37~1.51倍和1.67~1.87倍,黑曲霉以及黑曲霉结合乳酸菌发酵豆渣总还原力最高。YANG等[31]认为在发酵过程中会产生一些酮类物质,这类还原性物质可通过提供电子使自由基变为稳定的物质,从而中断自由基链式反应,导致发酵后的样品具有较强的还原能力。除此之外,由于乳酸菌及真菌代谢产生胞外酶及产酸等,降解蛋白质等大分子物质产生较小的肽类物质和氨基酸等,这些氨基酸中有一些具有还原性,如色氨酸、亮氨酸和酪氨酸等使豆渣具有较强的还原力[32-33]。在发酵的过程中,微生物所分泌的各种酶类物质,如纤维素酶、蛋白酶、糖化酶的产生,降解大分子物质产生更多的肽、有机酸、还原糖、氨基酸及释放结合型酚类物质,使发酵豆渣抗氧化活性提升。
真菌在发酵过程中产酶种类及活性有差异,导致真菌发酵豆渣的抗氧化能力具有一定差异。黑曲霉发酵以及黑曲霉结合乳酸菌发酵改善效果最好。这与黑曲霉发酵后对豆渣中膳食纤维含量、粒径、水合性质以及吸附能力等有关[34]。
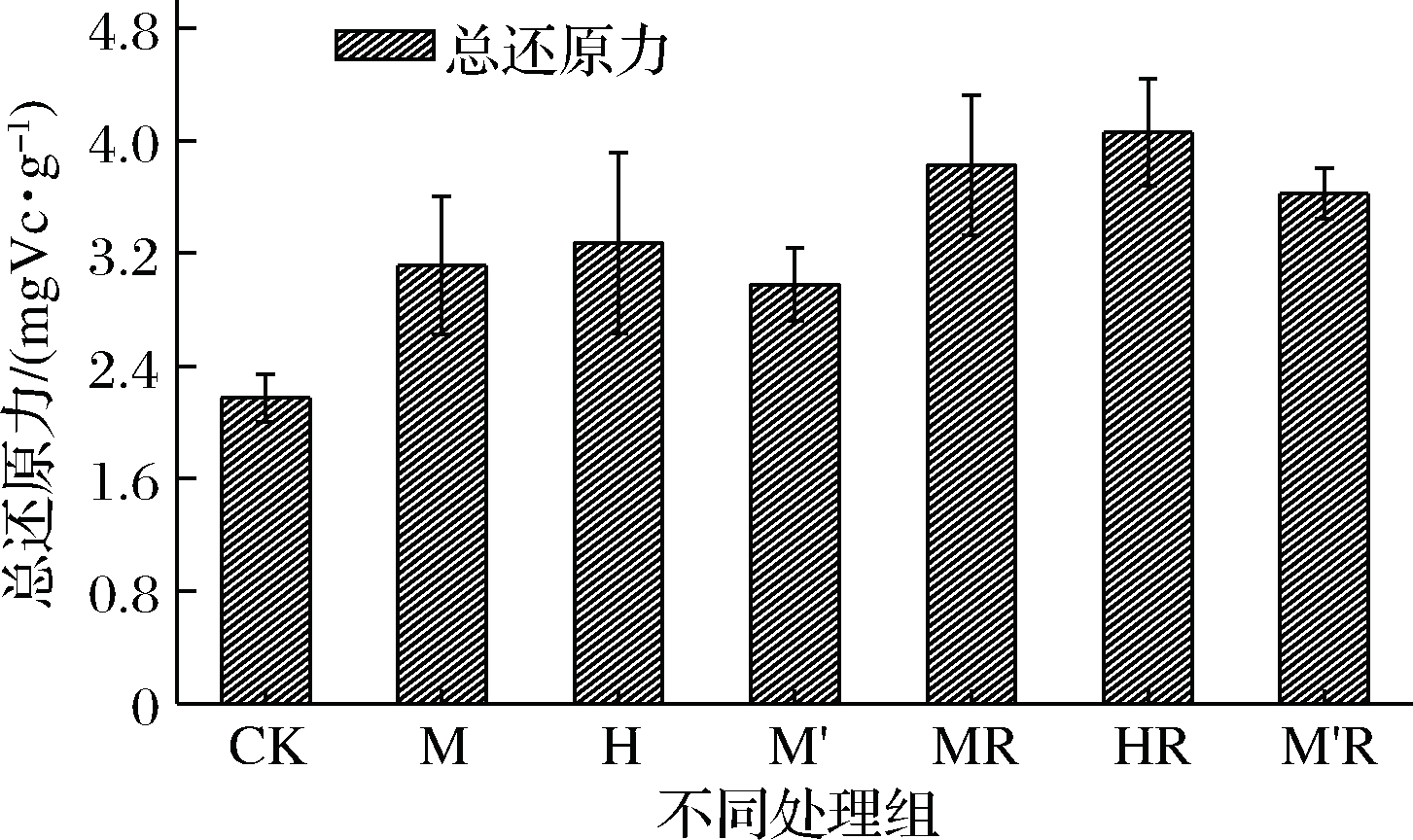
图5 发酵豆渣总还原力分析
Fig.5 Analysis of total reduction force of fermented soybean residue
3 结论
豆渣作为一种廉价的豆类加工副产品,富含膳食纤维,但主要是IDF,口感粗糙。通过不同加工技术改进豆渣膳食纤维理化特性,改进豆渣膳食纤维营养及感官品质,可提升豆渣的再加工利用价值。本研究以不同真菌接种发酵豆渣及真菌结合乳酸菌发酵豆渣发现,根据3种真菌产酶特性及联合乳酸菌接种发酵产酸特性,真菌及结合乳酸菌发酵可引起豆渣大分子的降解,使某些特征基团暴露,引发功能性改善。通过发酵,豆渣中所含有的蛋白质、脂肪和IDF等大分子降解,SDF升高。这种变化可破坏豆渣颗粒结构,同时增强豆渣的感官品质。粒径分析和显微观察也显示发酵降低了豆渣膳食纤维粒径使比表面积增加,结构变得蓬松易碎,发酵豆渣结合水分和吸附脂类物质的能力更强,特别是结合水分的能力和吸附胆固醇的能力。豆渣发酵既可改善豆渣感官品质粗糙的问题,又能提高豆渣的功能特性。
本研究结果显示,真菌结合乳酸菌发酵豆渣各项特性优于真菌发酵豆渣,黑曲霉以及黑曲霉结合乳酸菌发酵豆渣效果最好。
参考文献
[1] ELLEUCH M,BEDIGIAN D,ROISEUX O,et al.Dietary fibre and fibre-rich by-products of food processing:Characterisation,technological functionality and commerecial applications:A review[J],Food Chemistry,2011,124(2):411-421.
[2] KACZMARCZYK M M,MILLER M J,FREUND G G. The health benefits of dietary fiber:beyond the usual suspects of type 2 diabetes mellitus,cardiovascular disease and colon cancer[J]. Metabolism,2012,61(8):1 058-1 066.
[3] ZHONG Xiao,FANG Yu-jing, PAN Zhi-zong, et al. Dietary fiber and fiber fraction intakes and colorectal cancer risk in Chinese adults[J]. Nutrition and Cancer,2014,66(3):351-361.
[4] 裘纪莹,陈蕾蕾,王未名,等.发酵法制备高品质膳食纤维的研究进展[J].中国食物与营养,2010,6(7):24-27.
[5] 毕韬韬,吴广辉,高愿军.豆渣深加工研究进展[J].食品研究与开发,2011,32(6):149-152.
[6] 吴占威,胡志和.大豆豆渣的生理功能及其在食品中的应用[J].食品科学,2012(33):358-362.
[7] 贾丽,黎乃维,金海珠,等.豆腐渣高膳食纤维饼干的研制[J].农产品加工(学刊),2013(2): 43-45.
[8] 赵丽,李倩,朱丹实,等.膳食纤维的研究现状及展望[J].食品与发酵科技,2014,50(5):76-86.
[9] 涂宗财,陈丽莉,王辉,等.发酵与动态高压微射流对豆渣膳食纤维理化特性的影响[J].高压物理学报,2014,28(1):113-119.
[10] 戚勃,李来好.膳食纤维的功能特性及在食品工业中的应用现状[J].现代食品科技,2006,22(3):272-275.
[11] REDGWELL R J,FISCHER M.Dietary fiber as a versatile food component: an industrial perspective[J].Molecular Nutrition & Food Research, 2005,49(6):521-535.
[12] 申瑞玲,王英.膳食纤维的改性及其对功能特性的影响[J].农产品加工(学刊),2009(3):17-20.
[13] 李艳芳,郝建雄,程永强,等.黑曲霉和米曲霉发酵改善豆渣口感[J].农业工程学报,2012,28(7):248-253.
[14] 谢婧.毛霉发酵豆渣过程中主要营养成分变化的研究[J].保鲜与加工,2010,10(1):35-39.
[15] 胡耀辉,徐媛,刘俊梅,等.米曲霉发酵对豆渣成分影响研究[J].大豆科技,2013(4):63.
[16] 谢欢,涂宗财,张露,等.黑曲霉发酵制备高可溶性膳食纤维豆渣工艺优化及其水合性质研究[J].中国粮油学报,2017,32(4):116-121.
[17] 于寒松,徐媛,王玉华,等.响应面法优化混合菌发酵豆渣提高水溶性蛋白含量[J].食品安全质量检测学报,2015,6(4):1 401-1 408.
[18] 陶瑞霄,贾冬英,姚开,等.豆渣毛霉发酵条件的研究[J].中国调味品,2013,38(4):57-60.
[19] 孙进,乐国伟,侯丽霞,等.一株植物乳杆菌内化于小鼠回肠派伊尔结及其免疫调节作用的研究[J].免疫学杂志,2008(1):49-52.
[20] 杨月欣,王光亚,潘兴昌.中国食物成分表2002[M].北京:北京大学医学出版社,2002.
[21] 张洪微,杨铭铎,樊祥富,等.3种改性方法对小麦麸皮膳食纤维结构与性质的影响[J].中国粮油学报,2016,31(12):12-17.
[22] SANGNARK A,NOOMHOM A. Effect of particle sizes on functional properties of dietary fibre prepared from sugarcane bagasse[J]. Food Chemistry,2003,80(2):221-229.
[23] 朱丽云,吴俊清,吴丽樱,等.碱提香菇柄膳食纤维的功能性分析[J].中国食品学报,2013,13(4):219-224.
[24] 欧仕益,郑妍,刘子立,等.酵解和酶解麦麸吸附脂肪和胆固醇的研究[J].食品科技,2005(1):91-93.
[25] 陶姝颖,郭晓晖,令博,等.改性葡萄皮渣膳食纤维的理化特性和结构[J].食品科学,2012,33(15):171-177.
[26] 王慧,刘莹,胡博涵,等.豆渣不同菌种发酵后成分变化的研究[J].现代食品科技,2013,29(6):1 277-1 280.
[27] 管瑛,汪瑨芃,李文,等.豆渣固态发酵过程中主要营养成分及抗氧化特性变化[J].食品科学,2016,37(21):189-194.
[28] 王佳,张颜笑,郑炯.酶解处理对竹笋膳食纤维理化特性的影响[J].食品与发酵工业,2016,42(9):104-108.
[29] 涂宗财,陈媛,刘成梅,等.动态超高压微射流均质对半纤维素B理化性质的影响[J].食品工业科技,2009,30(3):74-75.
[30] 郑刚,何李,赵国华.高压蒸煮对苹果膳食纤维理化特性及发酵性能的影响[J].食品与发酵工业,2009,35(5):90-93.
[31] LEE I H,HUNG Y H,CHOU C C.Soild-state fermentation with fungi to enhance the antioxidative activity,total phenolic and anthoccyanin contents of black bean[J].International Journal of Food Microbiology,2008,121(2):150-156.
[32] AJIBOLA C F,FASHAKIN J B,FAGBEMI T N,et al.Effect of peptide size on antioxidant propeties of African yam bean seed(Sphenostylis stenocarpa)protein hydrolysate fractions[J]. International Journal of Food Microbiology,2011,12(10):6 685-6 702.
[33] YANG J H,MAU J L,KO P T,et al.Antioxdant properties of femented soybean borth[J].Food Chemistry,2000,71(2):249-254.
[34] 王秀丽,李海云,李子院.桂圆壳水不溶性膳食纤维吸附![]() 胆酸钠的研究[J].食品研究与开发,2007.28(10):48-51.
胆酸钠的研究[J].食品研究与开发,2007.28(10):48-51.