红茶菌(Kombucha)是一种以糖茶水为原料,经醋酸菌、酵母菌和乳酸菌等多种微生物共同发酵而成的一种有悠久历史的民间传统酸性饮料[1-2]。长期饮用红茶菌有益于身体健康[3],因此它是民众喜爱的一种功能茶饮料[4]。近年来研究者在红茶菌的发酵工艺、营养成分与保健功效、功能微生物等方面已展开了多项研究[5-8]。红茶菌菌群中细菌的优势菌为醋酸菌,这使得红茶菌发酵茶饮料酸感强烈且较为刺激,口感比较单一[9-10]。由于红茶菌发酵体系是半开放性发酵体系[11],发酵产品的品质受微生物组成、培养条件与环境因素影响较大,存在不稳定性。因此,通过添加乳酸菌强化红茶菌发酵,对改善红茶菌的风味与保健功效,提高产品品质具有重要意义。
乳酸菌是发酵食品和发酵饮品生产中重要的微生物,也是益生菌的主要来源,它们在改变食品组织结构、强化食品风味和功能等方面发挥着重要作用[12]。已有研究证实,在泡菜发酵过程中添加乳酸菌(Lactobacillus pentosus、Leuconostoc mesenteroides)能够减少亚硝酸盐的生成[13],嗜热链球菌和双歧杆菌发酵豆乳的甲醇提取物有抗炎作用[14],植物乳杆菌的存在可使酸面团的品质更佳[15]。红茶菌在防止心血管疾病发生、促进消化功能、提高免疫、减少炎症等方面有一定的保健功效[16]。通过在红茶菌发酵过程中强化有益乳酸菌,不仅有助于抑制发酵体系中杂菌和致病菌的生长,还可改善红茶菌的风味与口感,赋予红茶菌更多益生特性。本研究拟通过优化培养基组成和发酵条件,实现在红茶菌发酵过程中强化乳酸菌。通过强化乳酸菌,获得风味独特且功效改善的红茶菌产品,为其的推广应用及提升产品附加值提供理论基础。
1 材料与方法
1.1 材料与试剂
菌株:短乳杆菌(Lactobacillus brevis)Y52 (CCTCC M 2012162)和棒状乳杆菌(Lactobacillus coryniformis)H3 (CCTCC M 2012130)为本研究保藏菌株,嗜酸乳酸足球菌(Pediococcus acidilactici)B1355购自中国高校工业微生物资源和信息中心。红茶菌菌种购自黑龙江美斯优唐食品,滇红红茶和白砂糖购自超市。
MRS培养基(g/L):蛋白胨10.0,牛肉膏5.0,酵母粉4.0,葡萄糖20.0,吐温80 1.0,K2HPO4 2.0,乙酸钠5.0,柠檬酸三铵2.0,MgSO4 0.2,MnSO4 0.05,L-半胱氨酸0.5。
1,1-二苯基-2-三硝基苯肼(DPPH),有机酸标准溶液购自Sigma公司。
1.2 仪器与设备
SCIONSQ-456-GC气相色谱-质谱联用仪,色谱柱:DB-WAX,30 m × 0.25 mm,0.25 μm;Agilent 1260 液相仪,色谱柱:Bio-Rad Aminex HPX-87H(300 mm×7.8 mm,9 μm);BioTek多功能酶标仪。
1.3 方法
1.3.1 红茶菌的制备
将茶叶(10 g/L)和白砂糖(70 g/L)与饮用水混合,煮沸5 min后滤去茶叶,分装于250 mL烧杯中,盖上4层纱布,冷却后接种红茶菌种子液,于28 ℃恒温培养箱中发酵8 d [17-18]。嗜酸乳酸足球菌B1355,短乳杆菌Y52和棒状乳杆菌H3用MRS培养基在37 ℃培养24 h [19],离心收集菌体,分别在红茶菌发酵第0, 2, 4, 6天按相同菌浓添加,并根据研究需要调节红茶菌液的初始pH值[20]。
1.3.2 有机酸含量测定
取1 mL红茶菌液离心取上清液后用超纯水稀释10倍,再用孔径为0.22 μm的水系滤膜过滤后待测。液相系统:Agilent 1260;色谱柱:Bio-Rad Aminex HPX-87H(300 mm×7.8 mm,9 μm);流动相:5 mmol/L稀硫酸;进样体积:10 μL;洗脱速度:0.5 mL/min ;分离时间:30 min;柱温:40 ℃;检测器:UV210 nm。测定用的有机酸标准溶液购自Sigma公司的混合标准品。包含抗坏血酸、柠檬酸、苹果酸、琥珀酸、酒石酸、甲酸、乙酸、丙酸、乳酸等9种常见有机酸,且浓度均为0.10 g/L。通过与有机酸标准溶液的保留时间比对来定性。定量采用外标法,将有机酸混合标准品在同样的色谱条件下进样,绘制各种有机酸的浓度对峰面积的标准曲线[21]。
1.3.3 DPPH自由基清除能力的测定
使用1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力表征红茶菌液的抗氧化性。在2 mL样品中加入2×10-4 mol/L DPPH乙醇溶液2 mL,混匀,37 ℃暗处静置30 min后,在517 nm处测定吸光值Am。同时,将2 mL样品溶液与2 mL乙醇溶液混匀,37 ℃暗处静置30 min后,在517 nm处测定吸光值An,将2 mL DPPH溶液与2 mL乙醇溶液混匀,37 ℃暗处静置30 min后,在517 nm处测定吸光值![]() 随后计算红茶菌的DPPH自由基清除效果:
随后计算红茶菌的DPPH自由基清除效果:
DPPH自由基清除率![]()
(1)
1.3.4 感官评定
感官评定采用双盲评定方法,从色泽、气味、滋味3个方面对红茶菌液进行评定[24-27]。每项评定内容满分为10分,以总分最高,单项内容无缺陷为最好。
1.3.5 发酵条件优化
根据发酵条件对红茶菌成分和功效的影响[24, 28],本研究以产乳酸量、DPPH自由基清除能力为指标,选取不同的初始pH值(5、6、7、8),乳酸菌接种量(3%、5%、7%、9%),氮源添加量(3、4、5、6、7 g/L),有机氮源(蛋白胨)与无机氮源(硫酸铵)添加比例(2∶1,1∶1,1∶2)4个因素进行单因素试验。
在单因素试验的基础上,选择初始pH值,氮源添加量,有机氮源与无机氮源添加比例,乳酸菌接种量作为考察因素,以产乳酸量、自由基清除能力以及感官评分为指标,设计L9(34)的正交试验以确定最优发酵条件,因素和水平如表1所示。根据正交试验结果,确定乳酸菌复配红茶菌发酵的最优条件,并进行实验验证。
表1 正交试验因素与水平
Table 1 Factors and levels used in the orthogonal design
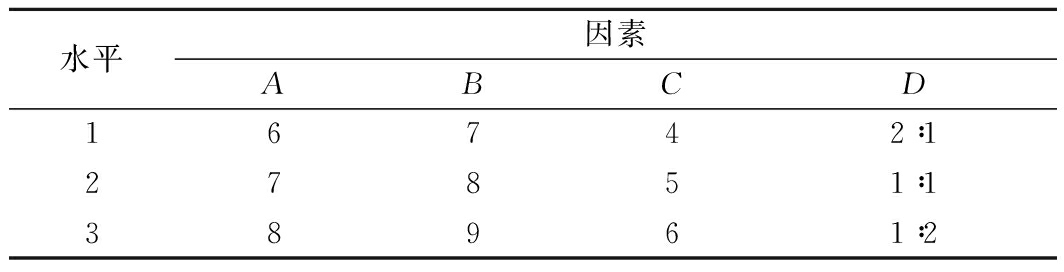
注:A-培养体系初始pH值;B-短乳杆菌接种量(%);C-氮源添加量(g/L);D-有机与无机氮源添加质量比
1.3.6 挥发性物质含量检测
采用GC-MS法测定挥发性物质的相对含量的方法[24]。挥发性物质的定性与定量分析利用谱库和文献描述对得到的质谱图进行串联检索,确定化合物的组成,通过面积归一化法计算各组分的相对峰面积并换算为百分比进行相对定量。
将5.0 mL样品置于20 mL顶空瓶中,将老化后的75 μm CAR/PDMS萃取头插入样品瓶顶空部分,于50 ℃吸附30 min,吸附后的萃取头取出后插入气相色谱进样口,于250 ℃解吸3 min。
GC条件:采用WB-WAX毛细管柱(30 m×0.25 mm,0.25 μm),载气为He,流速0.8 mL/min。色谱柱升温程序为:起始柱温40 ℃,保持3 min,以5 ℃/min升到90 ℃,随后以10 ℃/min升到230 ℃,保持7 min。进样口温度250 ℃,无分流进样。
MS条件:电离方式为EI源,电子能量70 eV,发射电流80 μA;离子源温度200 ℃,接口温度250 ℃;检测电压1.0 kV,扫描模式为全扫描,质量范围20~450 u。
2 结果与讨论
2.1 用于红茶菌复配的乳酸菌菌株的确定
乳酸菌可以发酵糖类物质产生乳酸等多种有机酸,并且具有促进营养物质吸收、增加人体有益菌群、抗氧化等多种益生功能[29-31]。由于红茶菌液的pH值在发酵第1~2天迅速下降[32],体系中氮源匮乏,不利于乳酸菌的生长和代谢。因此选择最优的乳酸菌菌株以及适宜的培养条件尤为重要。本研究首先调节红茶菌液初始pH值至7.0,发酵起始接种体积分数为7%的乳酸菌,在补充少量氮源的条件下,考查添加不同乳酸菌对红茶菌中有机酸种类、含量以及其对自由基清除能力的影响。由图1可知,能使红茶菌液中乙酸含量减少且其他有机酸含量增加效果最好的乳酸菌是短乳杆菌Y52。强化短乳杆菌Y52后,红茶菌液中乳酸含量增加至1.82 g/L,酒石酸和柠檬酸含量显著增加,乙酸含量显著减少,由11.63 g/L降至8.63 g/L,减少了25.8%。强化棒状乳杆菌H3的红茶菌液中乳酸含量增加至1.12 g/L,酒石酸含量增加了70%,乙酸含量略有增加。强化乳酸足球菌B1355的红茶菌液中乳酸含量增加至1.10 g/L,有少量苹果酸生成,酒石酸和乙酸含量有所减少。
自由基对细胞成分进行有害进攻会造成细胞衰老,而维持体内适当水平的自由基清除能力可以延长寿命和延缓衰老[33]。通过在红茶菌发酵过程中强化短乳杆菌Y52,红茶菌液的自由基清除能力由42.6%上升至63.7%,相对提高了49.5%;强化棒状乳杆菌H3的红茶菌液自由基清除能力提高了15.5%;强化乳酸足球菌B1355的红茶菌自由基清除能力基本没有变化。
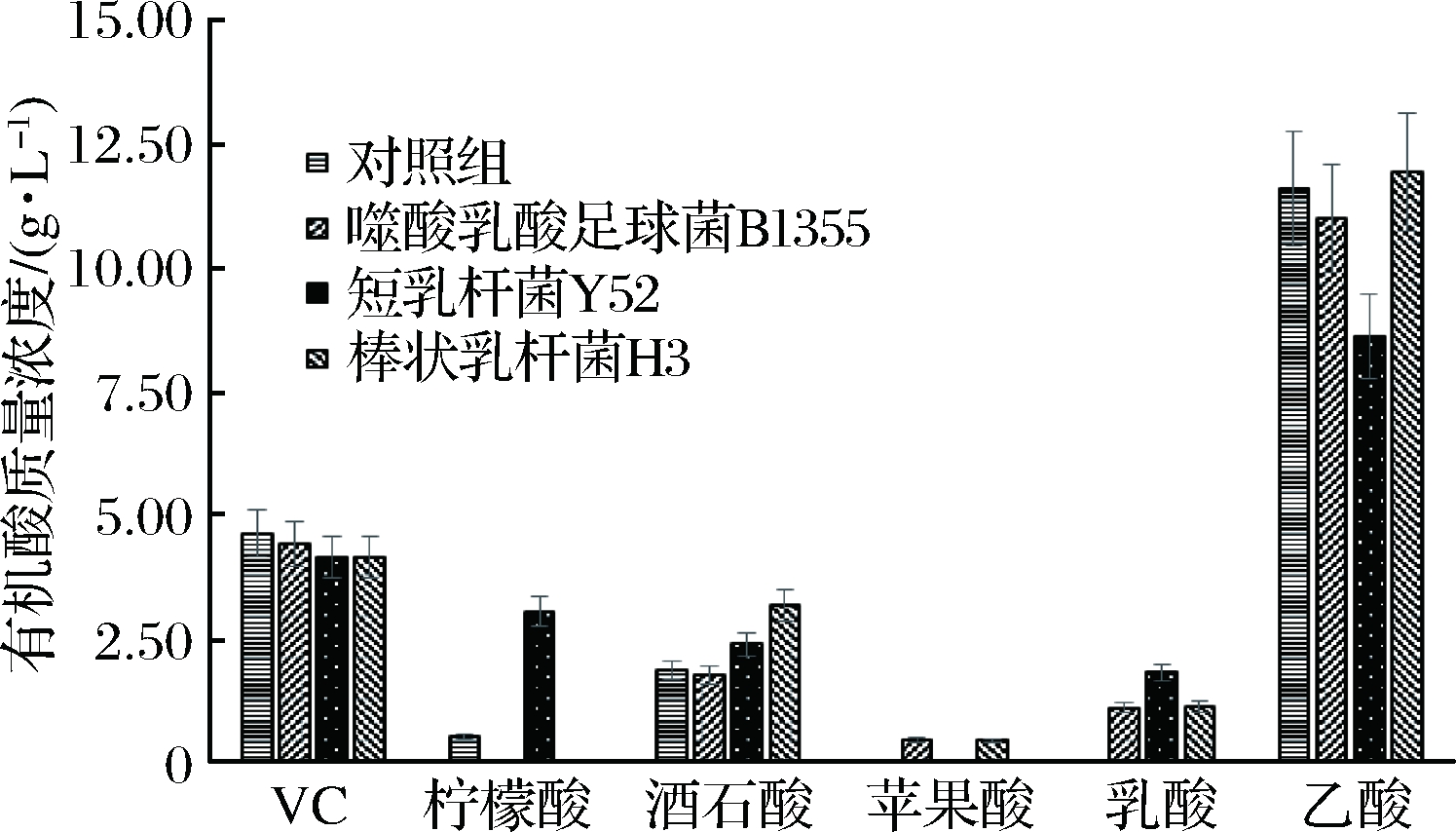
图1 强化乳酸菌对红茶菌液中有机酸合成的影响
Fig.1 Effect of enhancing lactic acid bacteria during Kombucha fermentation on organic acids production
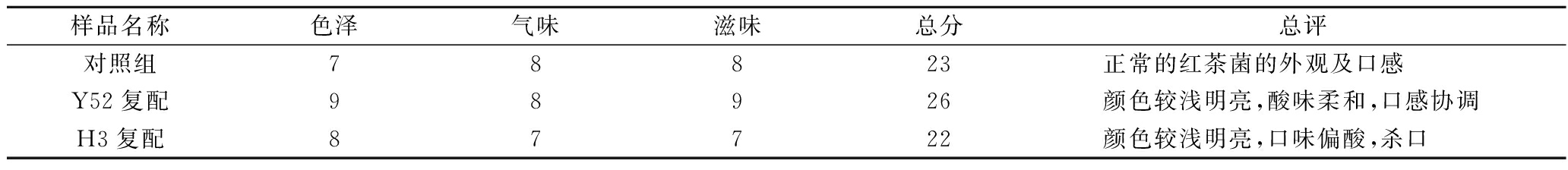
由于添加乳酸足球菌B1355对红茶菌有机酸组成和自由基清除能力方面的改善均不突出,因此仅对强化短乳杆菌Y52或棒状乳杆菌H3的红茶菌进行了感官评定。由表2可知,强化短乳杆菌Y52的红茶菌在色泽和口感等方面均明显优于对照,而强化棒状乳杆菌H3对红茶菌的口感并无改善。综合以上结果,短乳杆菌Y52在改善红茶菌的口感和提高红茶菌功效方面效果显著,适合用于复配红茶菌并进行后续发酵工艺优化。
表2 红茶菌的感官评定
Table 2 Sensory evaluation of Komucha
通过对强化短乳杆菌Y52发酵条件的优化,初步确定乳酸菌强化红茶菌发酵的工艺条件:将接种红茶菌后的红茶液初始pH值调至7.0,发酵起始接种体积分数为7%的乳酸菌,补充少量氮源(蛋白胨2.5 g/L,硫酸铵2.5 g/L) (表3)。
表3 培养条件对添加短乳杆菌Y52发酵红茶菌的影响
Table 3 Effect of cultivation conditions on Kombucha fermentation with the addition of L. brevis Y52

2.2 强化乳酸菌的红茶菌发酵条件单因素实验
根据发酵条件对红茶菌成分和功效的影响,以产乳酸量、DPPH自由基清除能力为指标,选取初始pH值、乳酸菌接种量、氮源添加量、有机氮源与无机氮源添加比例这4个因素进行单因素试验。由图2-A可以看出,初始pH值对强化短乳杆菌Y52发酵的红茶菌自由基清除能力影响不明显,但是对乳酸水平有显著影响。初始pH值为5~7时红茶菌中乳酸含量由0.98 g/L增至1.80 g/L。综合考虑初始pH值对乳酸菌复配红茶菌自由基清除能力以及乳酸含量的影响,将初始pH值为6、7、8作为后续考察的3个水平。短乳杆菌Y52的接种量对红茶菌自由基清除能力几乎没有影响,但对乳酸含量影响显著。当Y52接种量为3%和5%时,红茶菌中不含乳酸;当接种量大于5%时,乳酸含量随接种量的增加而增加(图2-B)。因此,确定要考察的Y52接种量为7%、8%、9%。当向红茶菌中补充3 g/L氮源时,红茶菌的自由基清除能力最低,为47.5%;当氮源含量大于3 g/L时,红茶菌的自由基清除能力有所提高,其中添加4 g/L氮源时,强化短乳杆菌Y52发酵红茶菌的自由基清除能力最高60%。此外,红茶菌中氮源含量增加也会使发酵结束时发酵液中乳酸增加(图2-C)。综合考虑,取氮源含量4、5、6 g/L作为后续考察的3个水平。当有机、无机氮源添加比例不同时,对乳酸菌复配红茶菌的自由基清除能力几乎没有影响。但随着有机氮源补充比例的降低,红茶菌中乳酸含量逐渐降低(图2-D)。如果有机氮源比例较高,不仅对红茶液的滋味和气味有不良影响,而且还会增加生产成本。综合考虑,取有机氮源与无机氮源比例为2∶1,1∶1,1∶2作为后续考察的3个水平。
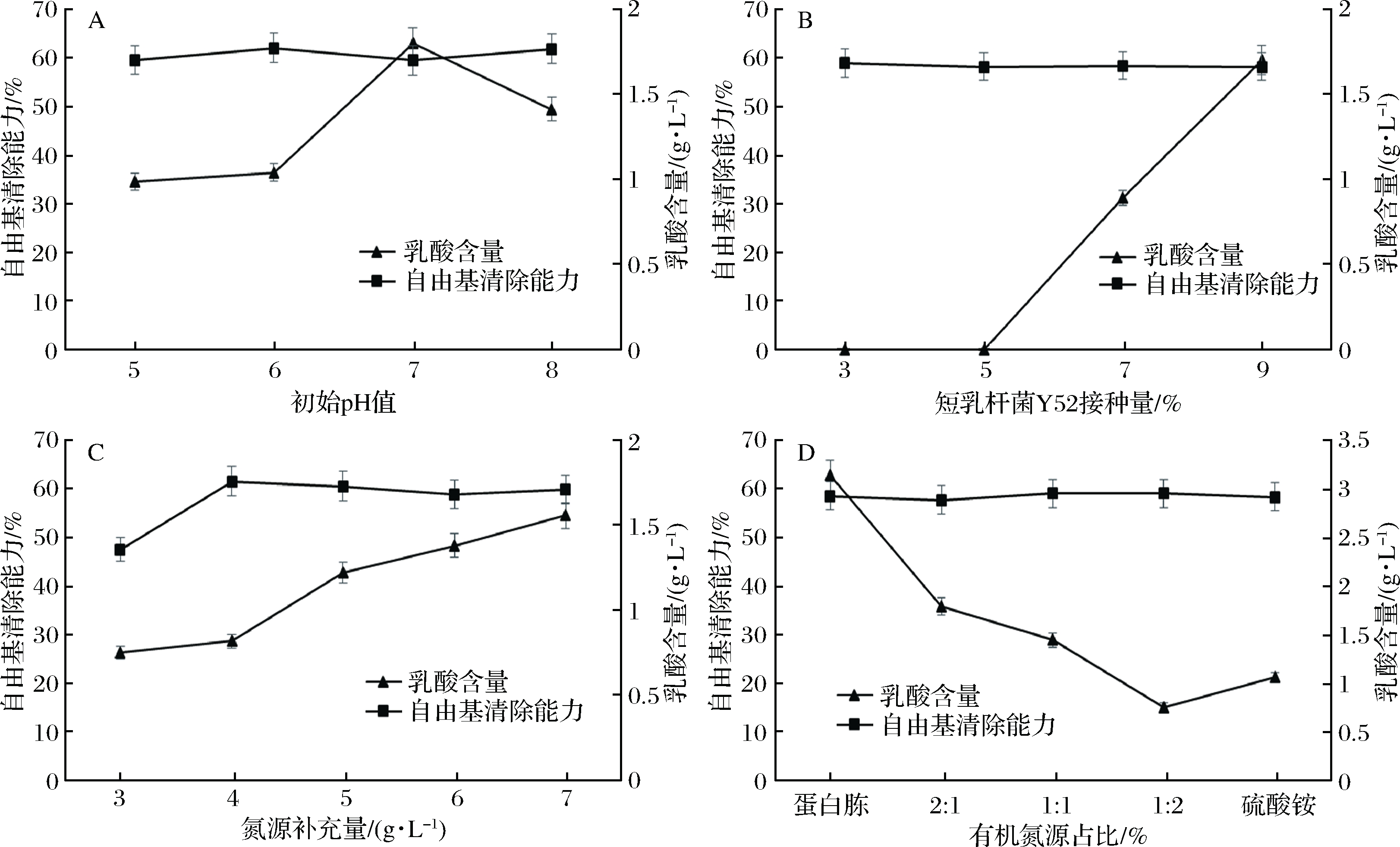
图2 工艺条件对红茶菌发酵的影响
Fig.2 Effect of fermentation conditions on Kombucha fermentation
2.3 强化乳酸菌的红茶菌发酵条件优化
为了获得最优的强化乳酸菌发酵红茶菌的条件,在单因素实验的基础上通过正交实验设计,分别考察了(A)初始pH值,(B)乳酸菌接种量,(C)氮源补充量,(D)有机、无机氮源补充比例4个因素对强化乳酸菌进行红茶菌发酵的影响。由表4可知,4个因素对复配红茶菌感官品质的影响程度由大到小依次为D>A=B>C,即有机、无机氮源补充比例>初始pH值=乳酸菌接种量>氮源补充量,最优水平为A2B1C1(C3)D3;4个因素对复配红茶菌乳酸含量的影响程度由大到小依次为C>B>D>A,即氮源补充量>乳酸菌接种量>有机、无机氮源补充比例>初始pH,最优水平为A3B2C2D2;4个因素对复配红茶菌的DPPH自由基清除能力的影响程度由大到小依次为A>B>C>D,即初始pH值>乳酸菌接种量>氮源补充量>有机、无机氮源补充比例,最优水平为A3B2C3D1。
表4 正交试验设计与结果分析
Table 4 Design of orthogonal test for Kombucha fermentation and corresponding results
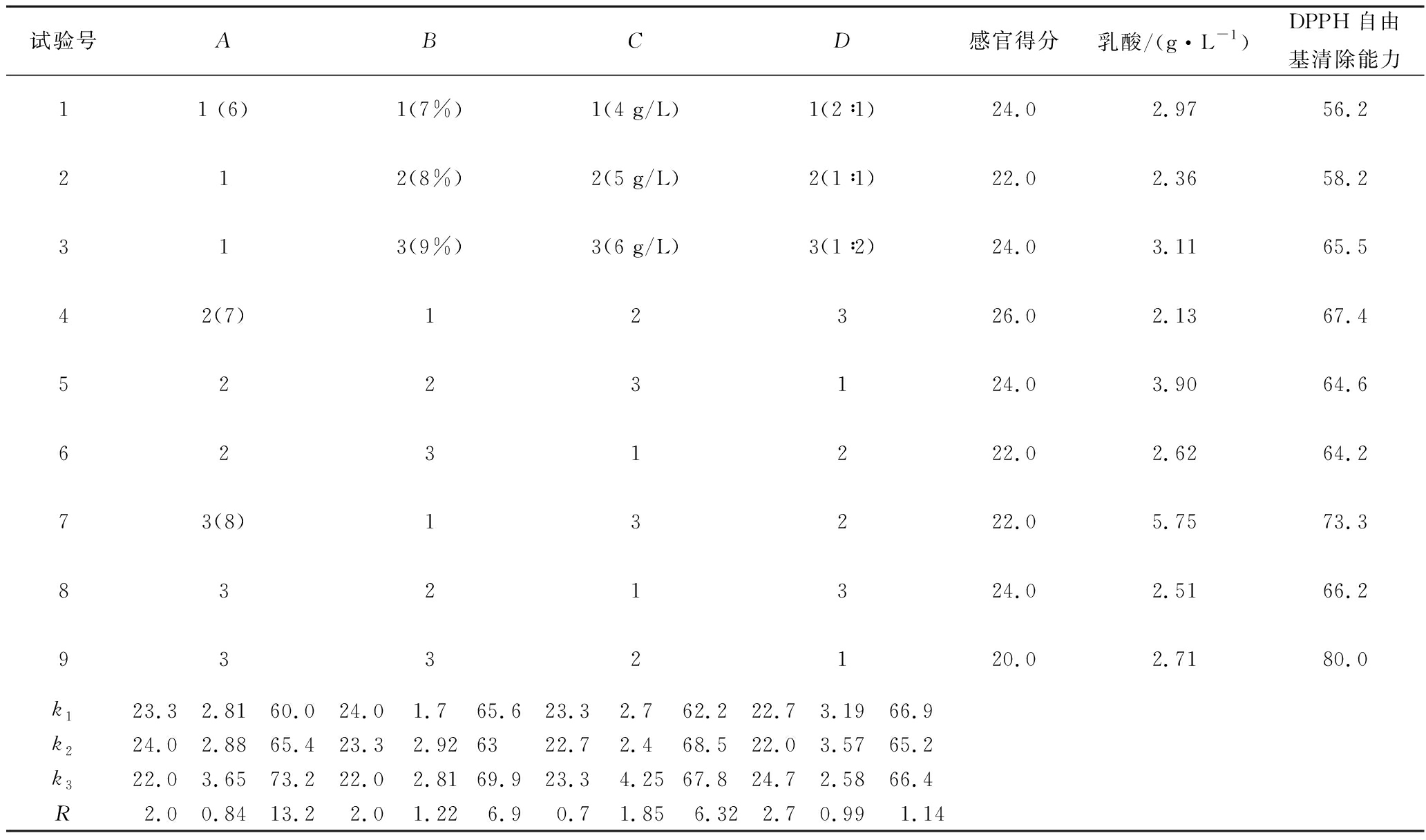
注:A-红茶菌初始pH值;B-短乳杆菌Y52接种量;C-氮源;D-有机与无机氮源质量比。
本研究希望获得感官评价较好,乳酸含量较高以及DPPH自由基清除能力强的红茶菌发酵工艺条件。所以在选择最优发酵条件时,首要考虑满足感官指标。有机与无机氮源添加比例在感官质量、乳酸含量、DPPH自由基清除能力3个考察指标中的重要性排序分别为1、3、4,说明有机、无机氮源添加比例的不同对感官质量的影响更大,因此选择D3即蛋白胨与硫酸铵的比例为1∶2为最佳条件之一。其次,初始pH值在感官质量、乳酸含量、DPPH自由基清除能力3个考察指标中的重要性排序分别为2、4、1,则主要评价初始pH值对感官质量以及DPPH自由基清除能力的影响。感官指标的优水平是A2,而DPPH自由基清除能力指标的优水平是A3,两者结果不一致,又因为A3在感官指标中排末位,而A2在DPPH自由基清除能力指标中排位居中,所以选择整体表现较好的A2即pH=7作为最佳条件之一。由于乳酸菌的接种量在感官质量、乳酸含量、DPPH自由基清除能力3个考察指标中的重要性排序分别为3、1、3,表明乳酸菌接种量的多少对乳酸生成量的影响最大,且乳酸含量与DPPH自由基清除能力的优水平均为B2,因此选择B2即乳酸菌接种量为8%作为最佳条件之一。氮源含量对3个考察指标的优水平的影响差异略大,在感官质量、乳酸含量、DPPH自由基清除能力3个考察指标中的重要性排序分别为4、1、3,优水平分别为C1(C3)、C3、C2。其中C3在DPPH自由基清除能力指标中排位居中,而C1与C2在其他指标中均有排在末位的情况,不符合筛选原则,因此选择C3,即氮源添加量为6 g/L作为最佳条件之一。因此,通过正交实验设计确定的乳酸菌复配红茶菌的最优发酵条件为A2B2C3D3,即初始pH值为7,接种体积分数为8%的乳酸菌,氮源添加6 g/L,有机氮源与无机氮源质量比为1∶2。
2.4 最优发酵条件验证
通过优化添加短乳杆菌Y52的红茶菌发酵工艺,红茶菌液中苹果酸和乳酸占总酸含量有所增加,其中乳酸含量增加到3.08 g/L;抗坏血酸、酒石酸、琥珀酸和乙酸含量略微减少,其中乙酸含量比对照减少19.8%(图3)。因此通过发酵优化,红茶菌中有机酸组成更加协调,有助于风味的改善。工艺优化后茶菌液的自由基清除能力与优化前相同,比对照提高37.8%。强化短乳杆菌Y52发酵红茶菌制得的红茶菌液颜色变浅且更为透亮。

对照A-不添加乳杆菌;实验1-添加短乳杆菌Y52;实验2-添加短乳杆菌Y5并优化发酵工艺
图3 红茶菌中有机酸种类与含量的分析和比较
Fig.3 Quantification of organic acids in Kombucha
采用优化条件制备的红茶菌酸味柔和、口感协调,评价最优(表5)。
为进一步分析强化短乳杆菌改善红茶菌风味的原因,采用SPME-GC-MS对红茶菌中的挥发性物质进行了分析和比较。由表6可知,红茶菌中既含有芳樟醇这类具有高锐显著花香的茶叶特征香气物质[34],也有像壬醛、辛酸这样具有果香味的物质[35],构成了红茶菌特有的风味物质。与不添加乳酸菌的红茶菌相比,强化短乳杆菌Y52的红茶菌中风味物质的总量和种类均有提高:风味物质相对含量总量从63.78%增加到65.19%,种类增加了7种(表6)。
表5 红茶菌的感官评定
Table 5 Sensory evaluation of Kombucha
表6 红茶菌中风味物质的相对含量
Table 6 The relative content of volatile compounds in Kombucha

强化短乳杆菌Y52的红茶菌中新增风味物质种类17种,包括醇类5种、醛类1种、酯类2种、酸类2种、酮类3种、酚类2种、其他2种。新增酮类物质中3-羟基-2-丁酮、2-甲基四氢噻吩-3-酮是赋予食品奶油香和栗子香味的风味物质,甲基庚烯酮是具有青草柑橘味的物质[35]。强化乳酸菌红茶菌桃醛(γ-十一内酯)、橙花醇、4-乙基愈创木酚等香味物质新增或含量成倍增加。由于强化短乳杆菌的红茶菌中醇类、酯类、醛类化合物种类较对照组更为丰富,可使醇类与酯类、醛类相互作用,融合出的味道协调细腻,给人柔和、优雅、愉悦的感觉[36]。此外,强化乳酸菌的红茶菌中功能性有益的物质如短链脂肪酸、抗氧化的黄酮类物质(柠檬烯)含量也有所增加,将有助于提高红茶菌的功能性。
3 结论
通过在红茶菌发酵过程中强化短乳杆菌Y52,红茶菌中有机酸组成更为合理,有效降低了不适酸感,自由基清除能力也得到了显著提高。此外,红茶菌在外观、口感和风味等方面均有提高和改善。本研究通过在红茶菌发酵过程中添加益生菌短乳杆菌Y52,显著改善了红茶菌的风味和口感,大幅提升了其抗氧化功效。
参考文献
[1] 段葆兰. 健康之友:红茶菌[M]. 北京:科学普及出版社, 1982.
[2] DIPTI P, YOGESH B, KAIN A K, et al. Lead induced oxidative stress: beneficial effects of Kombucha tea[J]. Biomedical and Environmental Sciences, 2003, 16(3):276-282.
[3] 中国科学技术情报研究所重庆分所. 红茶菌的培养和饮效[M]. 北京:科学技术文献出版社,1981.
[4] 食品科技杂志社. 红茶菌与健康长寿[M]. 北京:工商出版社, 1981.
[5] 陈秀清,杨润贤. 功能性饮料红茶菌研究进展[J]. 福建茶叶, 2009, 31(2):12-13.
[6] 宋清鹏,胡卓炎,刘丹. 红茶菌饮料的研究进展[J]. 包装与食品机械, 2013(3):44-48.
[7] 吴薇,盖宝川,籍保平. 红茶菌菌种主要代谢产物的试验研究[J]. 食品科学, 2004, 25(12):50-50.
[8] 谢俊杰,佘世望,许杨,等. 红茶菌抗菌蛋白产生方式的初步研究[J]. 微生物学通报, 2000, 27(6):424-427.
[9] 蒋立文. 红茶菌优势微生物的分离、鉴定及抗菌机理的研究[D]. 长沙:湖南农业大学, 2007.
[10] 林娟,叶秀云,曹泽丽,等. “红茶菌”中微生物的分离及纯菌混合发酵生产[J]. 中国食品学报, 2015, 15(2):39-48.
[11] MARSH A J, O′SULLIVAN O, HILL C, et al. Sequence-based analysis of the bacterial and fungal compositions of multiple kombucha (tea fungus) samples[J]. Food Microbiology, 2014, 38(2):171.
[12] KHOI N N, DONG N T N, THUY N H, et al. Lactic acid bacteria: promising supplements for enhancing the biological activities of kombucha[J]. Springerplus, 2015, 4(1):91.
[13] YAN P M, XUE W T, TAN S S, et al. Effect of inoculating lactic acid bacteria starter cultures on the nitrite concentration of fermenting Chinese paocai[J]. Food Control, 2008, 19(1):50-55.
[14] LIAO C L, HUANG H Y, LEEYAN S, et al. Anti-inflammatory activity of soymilk and fermented soymilk prepared with lactic acid bacterium and Bifidobacterium.[J]. Journal of Food and Drug Analysis, 2010, 18(3):202-210.
[15] VENTIMIGLIA G, ALFONZO A, GALLUZZO P, et al. Codominance of Lactobacillus plantarum and obligate heterofermentative lactic acid bacteria during sourdough fermentation[J]. Food Microbiology, 2015, 51:57-68.
[16] DUFRESNE C, FARNWORTH E. Tea, Kombucha, and health: A review[J]. Food Research International, 2000, 33(6):409-421.
[17] 过慈妹,方世辉. 不同茶类茶汤对红茶菌生长及品质的影响[J]. 茶业通报, 2007, 29(3):129-131.
[18] 万春美,才瑛琦,王晓婷,等. 发酵条件对红茶菌生长及菌液酸度影响的研究[J]. 食品科学, 2010, 31(1):206-210.
[19] 武运,黄彭,李远.等. 新疆哈萨克族发酵酸驼乳中乳酸菌的分子生物学鉴定[J]. 食品科学, 2011, 32(1):173-176.
[20] 赵振军,周黎,刘勤晋. 红茶菌发酵普洱茶茶汤过程中主要成分变化[J]. 食品科学, 2010, 31(1):79-83.
[21] 马瑞,欧阳嘉,李鑫,等. 高效液相色谱法同时测定生物质乳酸发酵液中有机酸及糖类化合物[J]. 色谱, 2012, 30(1):62-66.
[22] 李旭,刘停. 杜仲叶总黄酮微波辅助提取工艺的优化及其抗氧化活性研究[J]. 食品工业科技, 2013(4):243-248.
[23] 刘世凯,李楠,匙丹丹. 籽粒苋籽多酚的提取及其抗氧化性的研究[J]. 中国酿造, 2010, 29(9):80-82.
[24] 袁磊,张国华, FAIZAN A S,等. 发酵条件对红茶菌发酵品质及风味的影响[J]. 食品科学, 2017, 38(2):92-97.
[25] 孙玉坤,李亚霖,赵亮,等.红茶菌A4发酵功能饮料的研制[J].食品与发酵工业,2017,43(2):147-153.
[26] 任二芳,牛德宝,郭海蓉,等. 固定化共生发酵红茶菌饮料工艺的研究[J]. 食品工业科技, 2015, 36(12):193-196.
[27] 张继冉. 酱油中氨基甲酸乙酯的产生机制和消除策略研究[D].无锡:江南大学, 2016.
[28] 孙协军,宋立. 红茶菌发酵工艺优化及菌液主要成分变化分析[J]. 食品与发酵科技, 2013(5):87-90.
[29] 任大勇,李昌,秦艳青,等. 乳酸菌益生功能及作用机制研究进展[J]. 中国兽药杂志, 2011, 45(2):47-50.
[30] MASOOD M I, QADIR M I, SHIRAZI J H, et al. Beneficial effects of lactic acid bacteria on human beings[J]. Critical Reviews in Microbiology, 2011, 37(1):91.
[31] LIN M Y, YEN C L. Antioxidative ability of lactic acid bacteria[J]. Journal of Agricultural & Food Chemistry, 1999, 47(4):1 460-1 466.
[32] 蒋立文,刘德华,唐道方,等. 不同条件对红茶菌发酵酸度和成膜影响的初步研究[J]. 食品科学, 2006, 27(9):96-99.
[33] 赵保路. 自由基、营养、天然抗氧化剂与衰老[J]. 生物物理学报, 2010, 26(1):26-36.
[34] 姚逸. 工夫红茶的香气及色泽的特征值研究[D]. 重庆:西南大学, 2013.
[35] 彭邦远,罗昱,张洪礼,等. β-葡萄糖苷酶对刺梨汁香气物质的影响[J]. 中国酿造, 2017, 36(7):172-177.
[36] 罗涛,范文来,郭翔,等. 顶空固相微萃取(HS-SPME)和气相色谱-质谱(GC-MS)联用分析黄酒中挥发性和半挥发性微量成分[J]. 酿酒科技, 2007, 2007(6):121-124.