喹乙醇和卡巴氧是化学合成的广谱类抗菌类药物,都属于喹噁琳类药物(图1)。该类药物具有显著的促进生长和治疗、预防动物疾病等作用,常用作饲料添加剂[1-3]。喹乙醇和卡巴氧在动物体内可分别快速代谢成3-甲基-喹噁啉-2-羧酸(3-methyl-quinoxaline-2-carboxylic acid, MQCA)和喹噁啉-2-羧酸(quinoxaline-2-carboxylic acid, QCA)[4],MQCA和QCA是喹乙醇和卡巴氧残留检测的标志物。研究报道显示,MQCA和QCA对人体具有致癌,致突变和致畸等潜在危害,尤其对人体长寿细胞具有较大的危害作用[5]。因此,喹乙醇已经被美国和欧美禁用[6]。同时,在1998年欧盟禁止卡巴氧在动物饲料中添加。在中国,喹乙醇药物在动物使用中规定了最高残留限量,喹乙醇药物仅允许在体重少于35 kg的猪的饲料中使用。对于猪组织和猪肝中的MQCA的最大残留限量分别为4和50 μg/kg。2003年,粮农和世界卫生组织专家委员会要求相关部门需要规定出食品MQCA药物的最高残留限量和喹乙醇药物每天最大摄入量[7]。因此,需要灵敏、快速和高通量的检测技术。
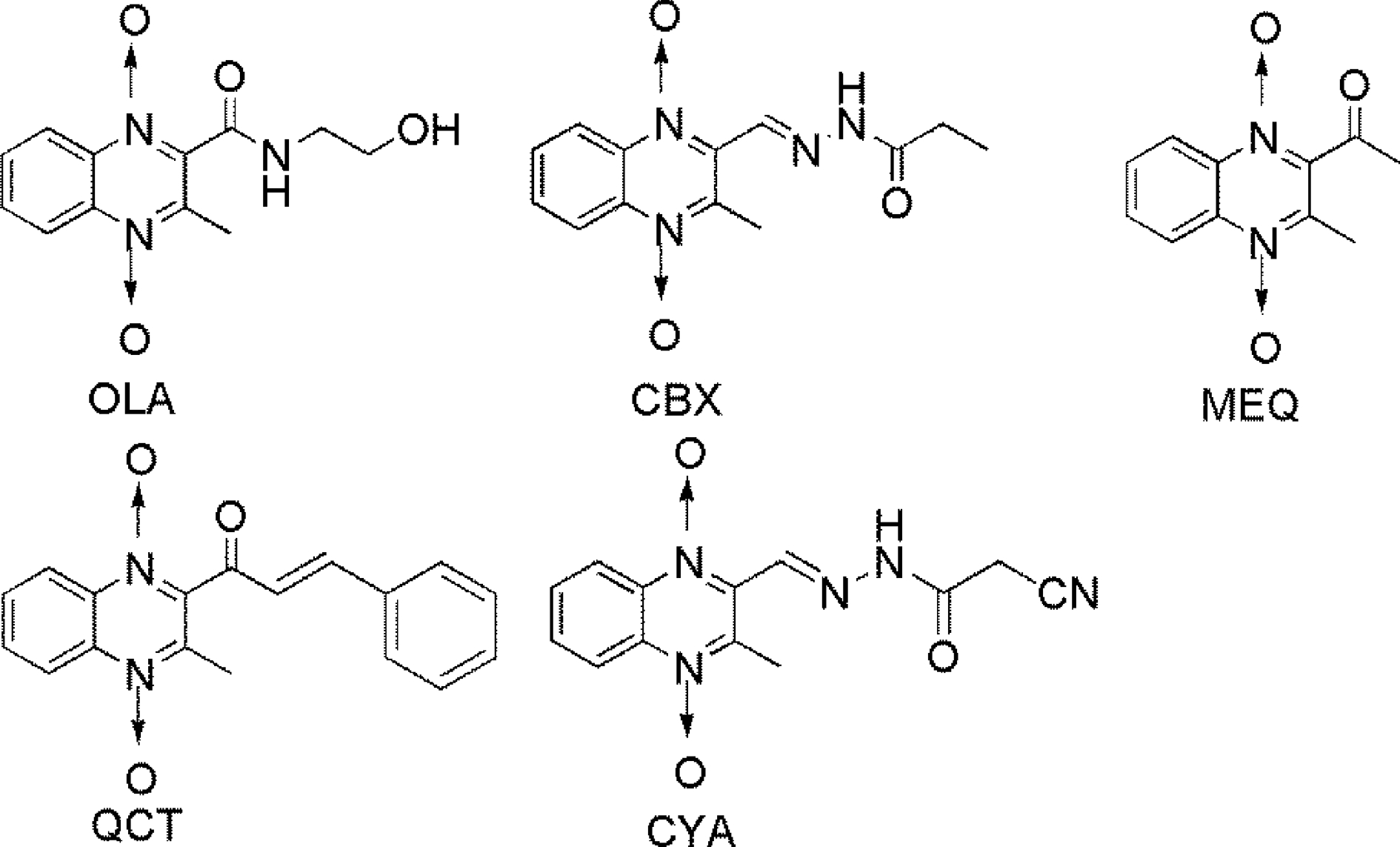
图1 喹噁琳类药物化学结构式
Fig.1 Chemical structures of quinoxaline antibiotics
到目前为止,已经有较多的方法检测在动物组织中MQCA和QCA的残留,包括液相色谱-质谱联用技术[7-9],高效液相色谱-质谱联用技术[10],高效液相色谱[11-12]。仪器检测方法是公认的最可靠的检测方法,但是繁琐的样本前处理,昂贵的设备,专业的操作知识限制了该方法的广泛应用,检测规模也不适用于高通量的快速检测要求。
基于抗原抗体特异性结合的免疫检测方法越来越多,针对喹乙醇,卡巴氧及其代谢物免疫检测方法主要包括时间分辨荧光免疫分析(time-resolved fluoroimmunoassay,TR-FIA),酶联免疫检测(enzyme-linked immunosorbent assay,ELISA)和胶体金免疫层析方法(colloidal gold immunochromatographic assay,CGICA)等[1, 3, 13-15]。在这些方法中,TR-FIA方法,灵敏性较高,需要特殊读数仪器,不适合现场快速检测,限制该方法的使用。ELISA方法,可以较准确定量检测,但是包括复杂的试验步骤,主要包括孵育、洗涤、反应等,都需要较长的时间,对基质干扰和反应条件比较敏感,同时需要特殊设备(酶标读数仪),这类检测方法不适合现场检测和快速定性检测。CGICA主要受限于灵敏度低,不能满足低检测限检测要求[16]。除此之外,组织中MQCA和QCA的检测,样本前处理方法大多是氮吹法[1, 17-19],有机试剂的使用,不利于环境友好型要求,同时需要特殊设备(氮吹仪)等,限制了这类方法的广泛应用,尤其是现场检测方面。在不断探索样本前处理方面,免疫磁珠的出现提供了新的途径,该方法可实现高特异性目标药物的提取、快速分离、高倍数富集,结合简单的检测方法(如CGICA),可同时解决灵敏度低和检测程序繁琐等问题。
本文建立一种基于免疫磁珠提取、净化和富集猪肉中MQCA和QCA灵敏的快速胶体金免疫层析定性和定量检测方法(图2)。免疫磁珠分离技术将分离与富集结为一体,具有高效、快速和操作简便等优点。目前国内外尚未见免疫磁珠富集净化结合胶体金免疫层析法同时检测猪肉中MQCA和QCA的报道。本实验拟建立以免疫磁珠富集净化结合胶体金免疫层析法同时检测猪肉中的MQCA和QCA残留的方法,以期为猪肉中MQCA和QCA的检测提供一种新的有效的检测手段。

图2 基于免疫磁珠处理的胶体金免疫层析检测猪肉中MQCA和QCA流程图
Fig.2 The scheme of CGICA with immunomagnetic beads for the determination of MQCA and QCA in pork
1 材料与方法
1.1 材料与试剂
MQCA、QCA标准品购自Dr. Ehrenstorfer GmbH公司;牛血清白蛋白(bovine serum albumin, BSA),卵血清蛋白(ovalbumin, OVA),N-二甲基甲酰胺(N-dimethylformamide, DMF),乙基二甲氨基碳化二亚胺盐酸盐(EDC HCl),生物素化酯(biotinamidohexanoic acid 3-sulfo-N-hydroxysuccinimide ester, BAC-SufoNHS),N-羟基琥拍酰亚胺(NHS)等购自Sigma-Aldrich公司;羊抗鼠二抗购自美国Jackson ImmunoResearch公司;KH2PO4,NaH2PO4,NaCl,NaBH4购自北京化学试剂公司;链霉亲和素磁珠购自于赛默飞世尔科技公司(挪威);磷酸缓冲液(Phosphate buffer, PB.包括NaH2PO4和Na2HPO4);磷酸盐缓冲盐水(phosphate-buffered saline, PBS.包括Na2HPO4, KH2PO4, NaCl和KCl)。
1.2 设备耗材
液相色谱串联质谱仪(LC-MS/MS),Waters公司;硝酸纤维素膜(nitrocellulose membrane, NC膜),Millipore公司;卡壳,上海金标生物科技有限公司;PVC背板,上海良信科技有限公司;划膜仪,美国BioDot公司;喷金仪,日本Hitachi公司;切条机,上海金标生物科技有限公司;胶体金免疫层析定量分析仪,北京维德维康生物技术有限公司。
1.3 方法
1.3.1 免疫原和包被原的制备
半抗原合成方法根据报道[14, 20]改进得到。戊二醛法合成免疫原和包被原。0.1 mmol MQCA-NH2溶于1 mL DMF溶剂中。BSA或OVA溶于5 mL PBS(0.01 mol/L, pH为7.4),然后逐滴加入到MQCA-NH2溶液中,伴随搅拌。2 h后逐滴加入甲醛(0.05 mmol),搅拌过夜。将NaBH4(0.3 mmol)溶于5 mL PBS溶液中,混匀后逐滴加入到过夜后的反应体系中。室温下搅拌2 h。0.01 moL/L PBS透析8次,于-20℃储存备用。
1.3.2 单克隆抗体制备
单克隆抗体用BALB/c小鼠制备。第1次免疫剂量为100 μg/小鼠,将MQCA-NH2-BSA与弗氏完全佐剂和不完全佐剂乳化后注入小鼠体内,两周后加强免疫,免疫的剂量与第1次使用量相同。经过6次免疫后,选出抗体效价最高的小鼠,取出脾脏细胞与SP2/0骨髓瘤细胞融合。经过一段时间培养,通过直接ELISA检测细胞上清液,筛选出能生产优质性能抗体的杂交瘤细胞,优质性能主要包括抗体效价高和特异性高。将筛选的杂交瘤细胞注入小鼠腹腔,经过2周培养,从小鼠腹腔取出腹水,经过免疫亲和柱的纯化,纯化后的抗体放在-20 ℃下备用。
1.3.3 胶体金免疫层析检测卡的制备
胶体金免疫层析检测卡的制备包括胶体金制备,胶体金与抗体偶联(胶体金探针),NC膜上T线和C线的包被及检测卡整体组装,组装后如图2中检测卡所示。胶体金的制备,本文制备直径为40 nm胶体金颗粒。36 mL 20 g/L的HAuCl4 3H2O加入到900 mL蒸馏水中加热至充分沸腾。在搅拌下加入79.5 mL(1%)柠檬酸三钠溶液,当溶液颜色由香蕉黄变成酒红色,继续保持溶液沸腾状态10 min,冷却至室温,用紫外-可见分光光度计观察胶体金颗粒的分散均匀程度和计算金颗粒直径大小[3]。胶体金探针的制备,取1g胶体金溶液于1.5 mL离心管中,分别加入10、15、20、25、30、35、40 μL 0.1 moL/L K2CO3调节溶液pH,室温下于3D旋转仪混合反应10 min。分别加入0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5和6 μg的MQCA单克隆抗体,快速混匀,室温下于3D旋转仪混合反应10 min,加入20 μL 20% BSA溶液进行封闭,室温下于3D旋转仪混合反应10 min,12 000 r/min 离心30 min,移去上清液,用移液器将上清液吸取干净,加入200 μL复溶液,超声混匀1 min,4 ℃储存备用。将胶体金探针用喷金仪喷在金标垫上,37 ℃过夜烘干,根据调试的优化条件等比例放大标记。
样本垫处理方法[21],将玻纤膜用0.1 moL/L PBS(包含有1%BSA,0.5%Tween-20,0.05%叠氮化钠,pH=7.4)浸泡,然后在60 ℃下烘干2 h。结合垫用6%蔗糖溶液浸泡,然后于60 ℃下烘干2 h。将胶体金探针用喷金仪均匀喷在结合垫上(1.2 μL/cm),37 ℃下烘干过夜。MQCA-NH2-BSA(14.4 mg/mL),羊抗鼠二抗(12 mg/mL)通过划膜仪包被在NC膜上分别作为T线和C线,T线和C线的稀释倍数分别为2、4、8、12、16、20、24、28倍,划膜液包被量分别为0.6、0.7、0.8、0.9 μL/cm,最终搭配胶体金探针通过棋盘法筛选出最佳的T线和C线包被浓度,主要依据T线和C线的良好的形态(线不能太细或者太宽,是很均一的线条)和良好的药物抑制效果(灵敏度较高)。PVC底板,样品垫样品垫样品垫,结合垫,NC膜和吸收垫的组装如图2所示。
1.4 样本前处理
本实验采用免疫磁珠提取、分离和富集样本中MQCA和QCA药物。主要包括抗体生物素化,免疫磁珠的构建,MQCA和QCA的提取,分离,洗脱富集。
1.4.1 抗体生物素化
将纯化后的MQCA单克隆抗体(19.84 mg/mL)用0.05 mol/L PBS调整浓度至2~3 mg/mL,加入相应量的生物素化酯(BAC-SufoNHS),抗体和生物素化酯的摩尔比例为1/5,25 ℃下旋转混合反应2 h,用0.01 mol/L PBS透析8次,获得生物素化的抗体。
1.4.2 免疫磁珠的制备
移液枪吸取链霉亲和素磁珠1 mg(100 μL 10 mg/mL磁珠混合液),加入到2 mL离心管中,将离心管放入磁力架磁吸30 s,移除液体,将离心管从磁力架中取下,放入离心管架,加入1 mL缓冲液(0.01 mol/L PBS,pH 7.4),加入一定量生物素化抗体,轻轻混匀。室温下,放入摇床上慢慢摇晃30 min,让生物素化后的抗体与亲和素修饰的磁珠通过生物亲和素作用偶联在一起,从而构建成免疫磁珠。反应30 min后,将带有混合磁珠液的离心管放入磁力架磁吸30 s,移液枪移除液体,取下离心管放入离心管架,加入1 mL封闭缓冲液(0.01 mol/L PBS中含有0.01% BSA),轻轻混合10 S,放入磁架磁吸30 s,移除液体,依次重复4次,然后加入1 mL 0.01mol/L PBS重悬备用(1mg/mL),4 ℃下保存。
1.4.3 免疫磁珠处理实际样本
从本地(重庆超市)购买猪肉样本,经过液相色谱-质谱/质谱串联技术(liquid chromatography-tandem mass spectrometry, LC-MS/MS)方法[22]挑选出不含MQCA和QCA的阴性样本,作为空白基质。
1.4.3.1 定性检测
称5 g匀浆,分别添加一定量MQCA和QCA标准品,使样本中分别含有0、0.05、0.1、0.25、0.5、1、2、4 μg/kg MQCA药物和0、0.13、0.25、0.63、1.25、2.5、5和10 μg/kg QCA药物。加入10 mL 0.01 mol/L PBS,涡动3 min。4 000 r/min离心5 min,取一定量上清液于新离心管中,分别加入一定量(50、100、150、200、250 μL)的免疫磁珠液,室温下反应8 min。将离心管放入磁力架,磁吸30 s,移去上清液,将离心管从磁力架取下,加入0.01 mol/L PBS到离心管中,混合10 s,离心管放入磁力架,磁吸30 s,如此循环3次。将洗涤后的带有磁珠的离心管取下,加入0.02 mol/L PB液复溶,放入金属浴中加热,将吸附在磁珠上的MQCA和QCA药物洗脱到复溶液中,复溶液作为模拟样本液并用ELISA试剂盒计算MQCA(QCA)的回收率。检测液滴加到检测卡上层析5 min,用肉眼观察T线和C线的相对深浅判断样本中MQCA(QCA)的含量,C和T线颜色一样深或者T线比C线深时阴性,C线颜色深,T线颜色比C线颜色浅,或者T线无色时是阳性,C线不显色表示无效。
1.4.3.2 定量检测
定量检测主要包括标准曲线的建立和方法检出限和回收率测定。
标准曲线的建立,用免疫磁珠洗脱复溶液(0.02 mol/L PB)配制MQCA标准曲线(0、0.05、0.1、0.25、0.5、1、2、4 μg/kg),用CGICA检测,每个样本重复3次。5 min后用胶体金免疫层析定量分析仪记录T/C比值。设定MQCA为0 μg/kg时,T/C比值为B0,其他浓度时T/C比值为B。以B/B0为纵坐标,添加的MQCA浓度的对数为横坐标,绘制出竞争抑制曲线,计算检测卡半数抑制浓度和定量范围。
方法检出限和回收率测定,随机选取经LC-MS/MS检测为MQCA阴性的猪肉20份,经过免疫磁珠处理(同定性检测免疫磁珠处理方法)后CGICA检测,每个样品测试3次,以20个阴性空白样品的平均值加上3倍的标准差作为CGICA检测限(limit of detection, LOD)。在阴性猪肉中分别添加MQCA和QCA,MQCA的添加浓度 0.1、0.5和2 μg/kg,QCA添加浓度为0.25、1.25和5 μg/kg。根据建立的标准曲线计算出检测浓度,实际检测浓度与理论浓度的比值百分率即为回收率,重复检测 5次。
2 结果与分析
2.1 抗原合成
半抗原的设计与合成是制备高灵敏性和高效价抗体的最重要的步骤。本研究最终形成的半抗原MQCA-NH2结构如图3所示。合成的半抗原通过LC-MS/MS方法鉴定,结果显示半抗原合成成功(图4)。
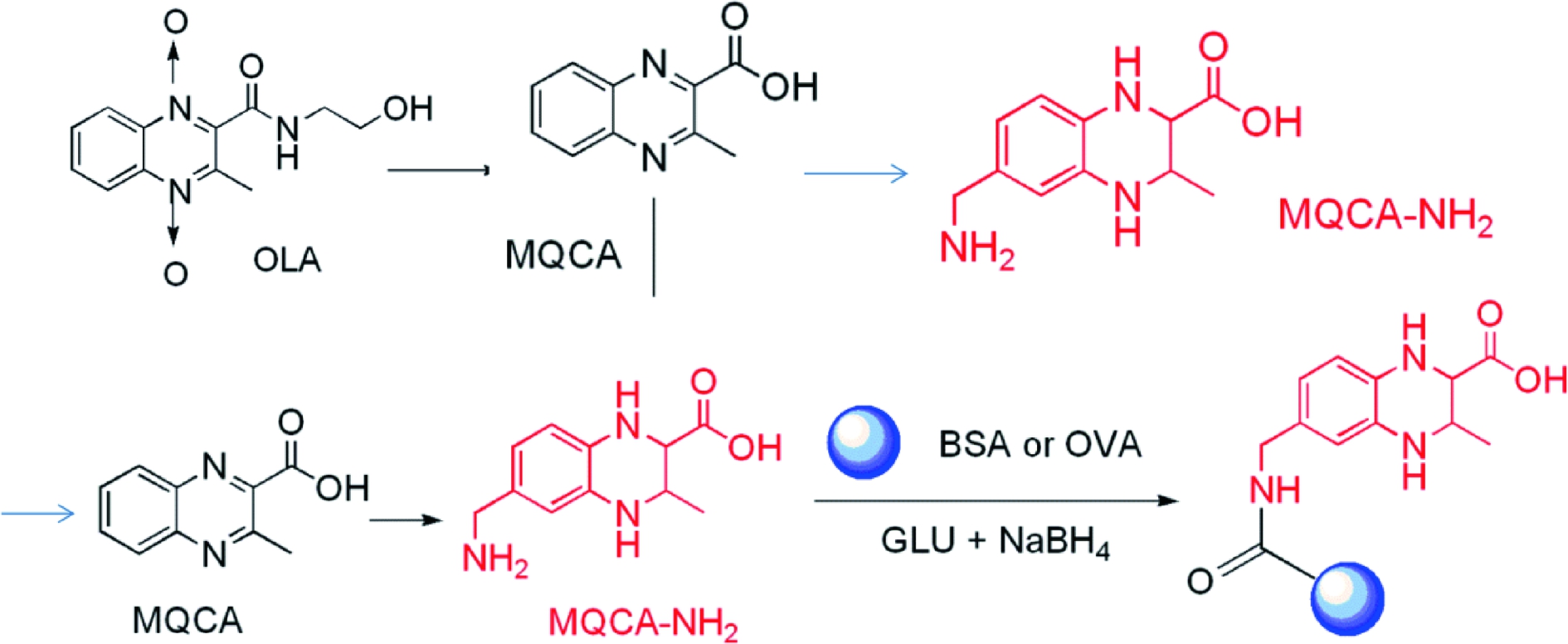
图3 半抗原的合成以及包被原和免疫原合成路线图
Fig.3 Synthesis scheme for the novel haptens and hapten-protein conjugates
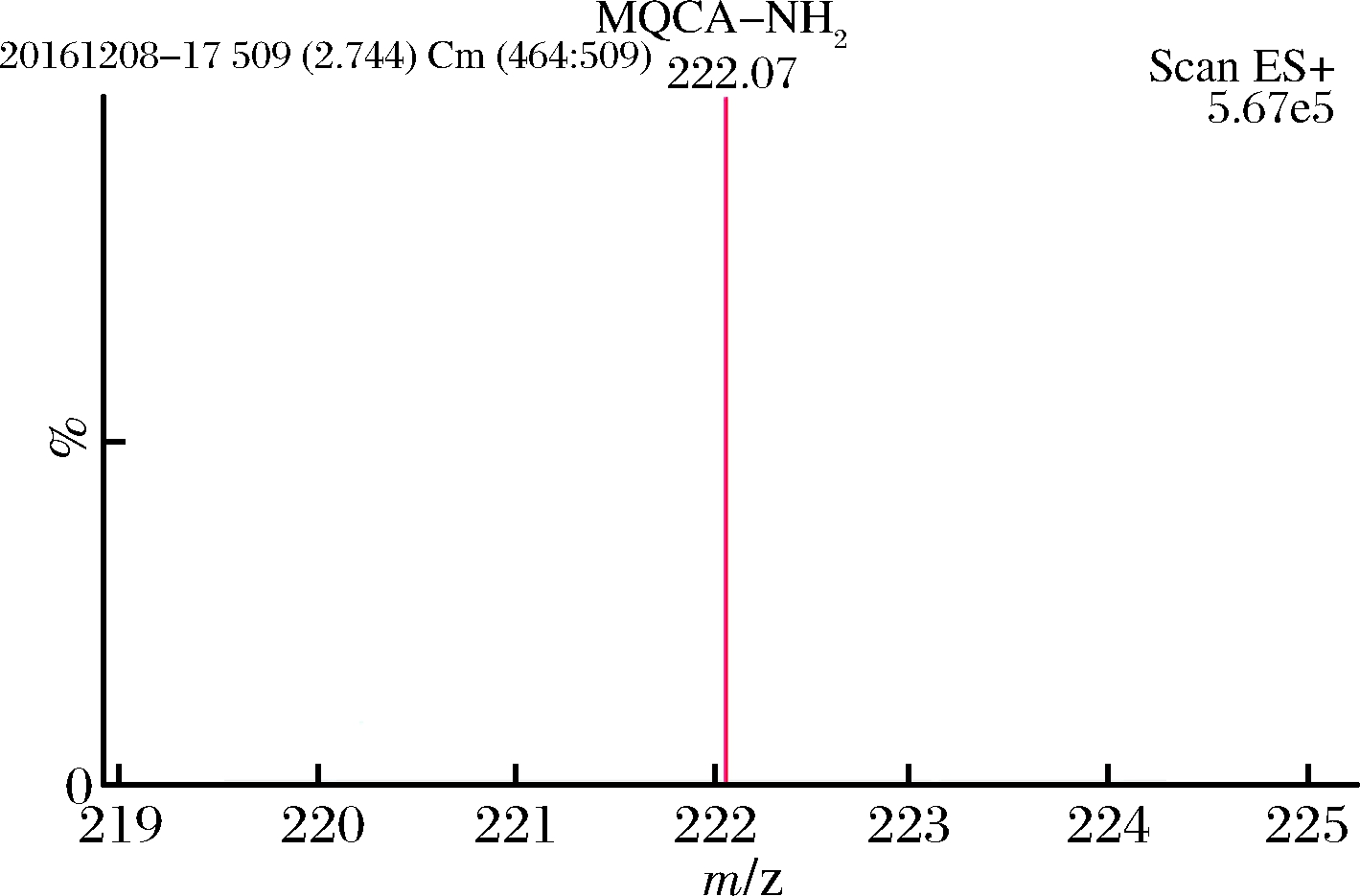
图4 MQCA-NH2半抗原LC-MS/MS鉴定图
Fig.4 The result of synthetic haptens (MQCA-NH2) by LC-MS/MS
MQCA半抗原是小分子物质,缺乏免疫原性,需要偶联一个大分子蛋白获得免疫原性。本文分别将半抗原MQCA-NH2与BSA和OVA偶联,形成免疫原和包被原,合成过程如图3所示,蛋白分子与MQCA-NH2偶联时,形成一定的特殊结构,蛋白分子和半抗原之间具有一个连接臂,突出抗原特异性,有利于制备出特异性高的抗体[2, 20]。
2.2 抗体的特性
制备的抗体(19.84 mg/mL)的特性主要包括抗体的效价和交叉反应率。制备出的抗体使用间接ELISA方法[18]验证制备抗体的特性。发现抗体效价为1/32 000,抗体的IC50(half maximal inhibitory concentration,IC50)和交叉反应率如表1所示。
表1 间接ELISA方法中MQCA抗体的IC50和交叉反应率
Table 1 The IC50 and cross reactivity of MQCA-mAb inindirect ELISA

其中,制备出的抗体仅与QCA有40%的交叉反应率,与其余的具有相似结构的药物基本无交叉,证明该抗体特异性较好。
2.3 胶体金的紫外扫描图谱
通过肉眼识别,可以看到胶体金溶液呈现均一的酒红色。将胶体金溶液在350~600 nm紫外扫描,结果如图5所示。
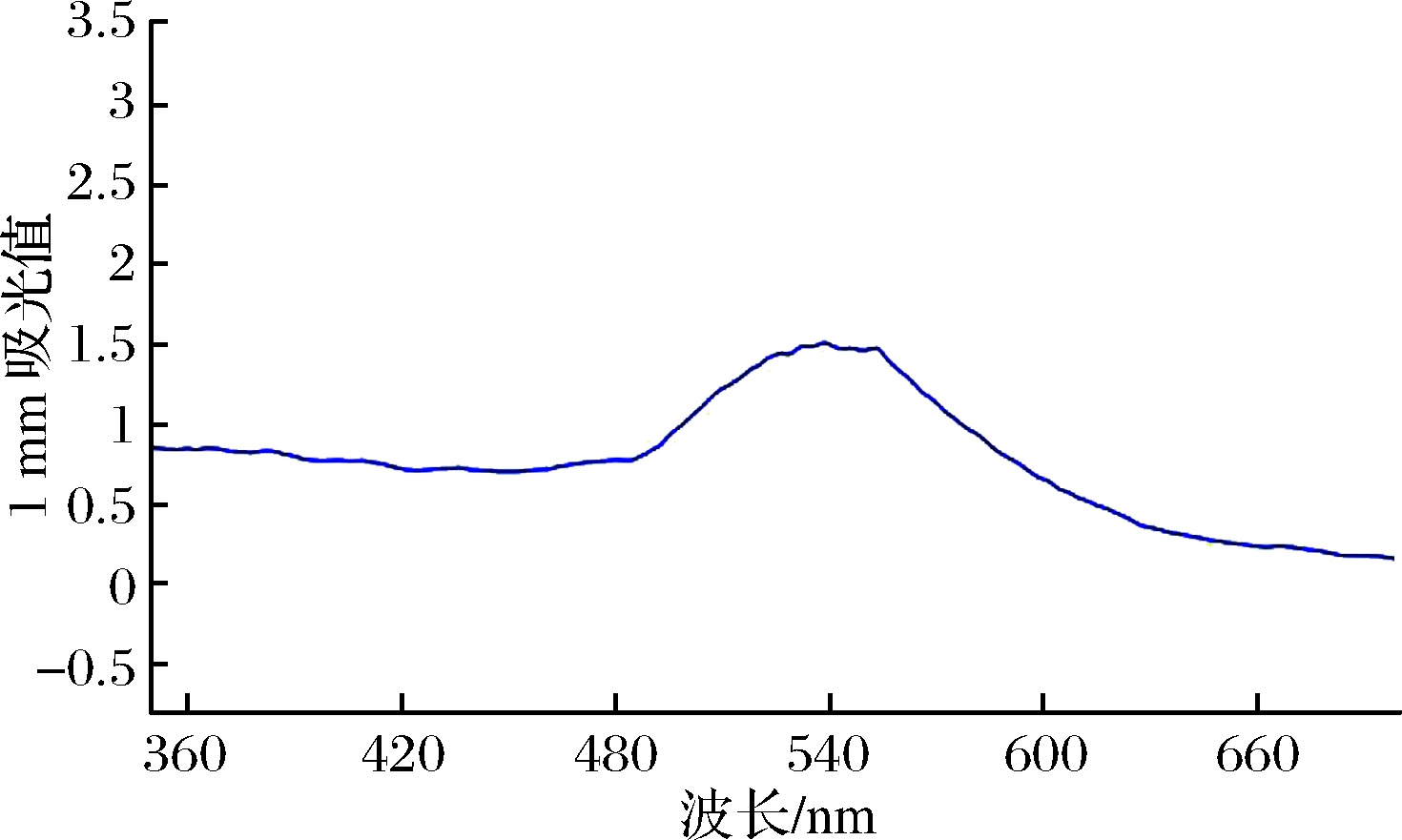
图5 胶体金紫外光扫描图谱
Fig.5 Determination of colloidal gold by spectrophotometry
通过图5可以看出制备的胶体金溶液在539.0 nm左右处具有最大的单一吸收峰。在紫外扫描图谱中,胶体金颗粒直径和最大吸收峰之间的关系Dnm=(λmax-505.53)/0.786[23],计算出胶体金颗粒的直径为42 nm。在波长为539 nm附近,扫描曲线的峰宽较小,说明胶体金颗粒整体上比较均一。采用柠檬酸三钠还原氯金酸法制备胶体金时,柠檬酸三钠加入量会影响金颗粒的大小和数目,在氯金酸总量一定情况下,金颗粒数目越多,生成金颗粒越小。烧制胶体金的时间和搅拌速度都会影响胶体金颗粒的形成,反应时间短,氯金酸没有被充分还原,生成的胶体金颗粒不均一,但烧制时间过长则容易发生聚沉,搅拌太慢反应不充分,太快则可能导致溶液飞溅而损失胶体金颗粒。
2.4 胶体金探针制备与T线和C线的划膜浓度的参数优化
根据胶体金探针最终形成的颜色,是否聚沉和实际灵敏性等参数,1 g胶体金用于调节pH的0.1 mol/L K2CO3的加入量为20 μL,偶联的抗体量为2.5 μg。抗体与胶体金连接的作用力主要有静电引力,疏水作用和配位键的相互作用。调节体系的pH可以将抗体包含在内部的疏水性氨基酸残基暴露。当pH高于抗体等电点,抗体整体呈负电性,只是其碱基氨基酸为正电性,在合适的pH条件下,抗体与胶体金连接的主要作用力为疏水作用力。高pH时,抗体表面带正电性增加,导致抗体与胶体金之间斥力增强,抗体与胶体金结合数目下降,导致胶体金探针与抗原结合数目减少,T线显色变浅。低pH时,抗体与胶体金颗粒之间的疏水作用力很弱,容易出现胶体金聚沉,形成一定的大颗粒,导致胶体金溶液的颜色变化(由酒红色变为褐蓝色)。根据不同划膜液稀释倍数与胶体金探针的棋盘法实验,得到的优化条件为:抗原划膜(T线)浓度为1.2 mg/mL,划膜喷量为0.7 μL/cm;羊抗鼠二抗(C线)划膜浓度为1.0 mg/mL,划膜喷量为0.7 μL/cm,在该条件下T线与C线显色均匀,抑制效果较好。
2.5 磁珠前处理的优化
经过试验,优化参数如下,1 mg链霉亲和素磁珠需要偶联MQCA抗体的量为40 μg;800 μL样本提取液加入0.1 mg(100 μL)免疫磁珠提取效果最佳;最佳的洗脱温度和时间分别为85 ℃和3 min。当1 mg链霉亲和素磁珠偶联抗体的量少于40 μg时,磁珠周围可能还有剩余的抗体偶联位点,增加抗体用量时MQCA(QCA)提取的效率提高。当加入的抗体量高于40 μg时,多余的抗体可能会影响后续药物的洗脱效率(影响加热效率)导致药物回收率下降。800 μL样本提取液需要的免疫磁珠用量少于0.1 mg时,免疫磁珠的吸附的MQCA总量太少,很难达到检测卡的检测限要求(灵敏度低),当免疫磁珠加入量高于0.1 mg,造成磁珠浪费。洗脱温度和时间是影响最终提取MQCA药物洗脱效率的重要因素。最终结果表明,85 ℃和3 min是优化的洗脱时间和温度。洗脱温度较小时(<85 ℃),洗脱效果较差,可能由于低热量不足以使抗原抗体结合键断裂,过度的延长洗脱时间则不符合快速检测的理念。
免疫磁珠的净化富集主要包括吸附和洗脱两个过程,吸附是免疫磁珠和样品中的MQCA或者QCA之间的特异性结合,从而可以实现高特异性提取,通过磁场分离待检测药物与杂质,净化效果显著,大大简化后续检测方法的研究,为检测新方法的建立奠定了基础,同时去除基质干扰效果较好,可以显著性提高检测方法的灵敏性[24]。根据猪肉样本的传统前处理方法(氮吹法)[1, 13-14],处理时间为50 min左右,浓缩倍数为1~2倍,同时需要使用有毒有害的一些化学试剂(乙腈或者乙酸乙酯,正己烷等),免疫磁珠的处理时间更短(30min),浓缩倍数更高(至少4倍以上),加热的洗脱方式,减少有机试剂的掺入,减少后续检测试验的干扰因素,提高方法的稳定性。
2.6 胶体金免疫层析的定性检测
不同浓度MQCA(QCA)药物添加到阴性样本中,经过免疫磁珠处理后,处理液滴加到制备的胶体金免疫层析检测卡上反应5 min后,定性检测结果如表2所示。
表2 胶体金免疫层析法定性检测结果
Table 2 Determination result of the colloidal gold immuno-chromatographic assay in qualitatively detection
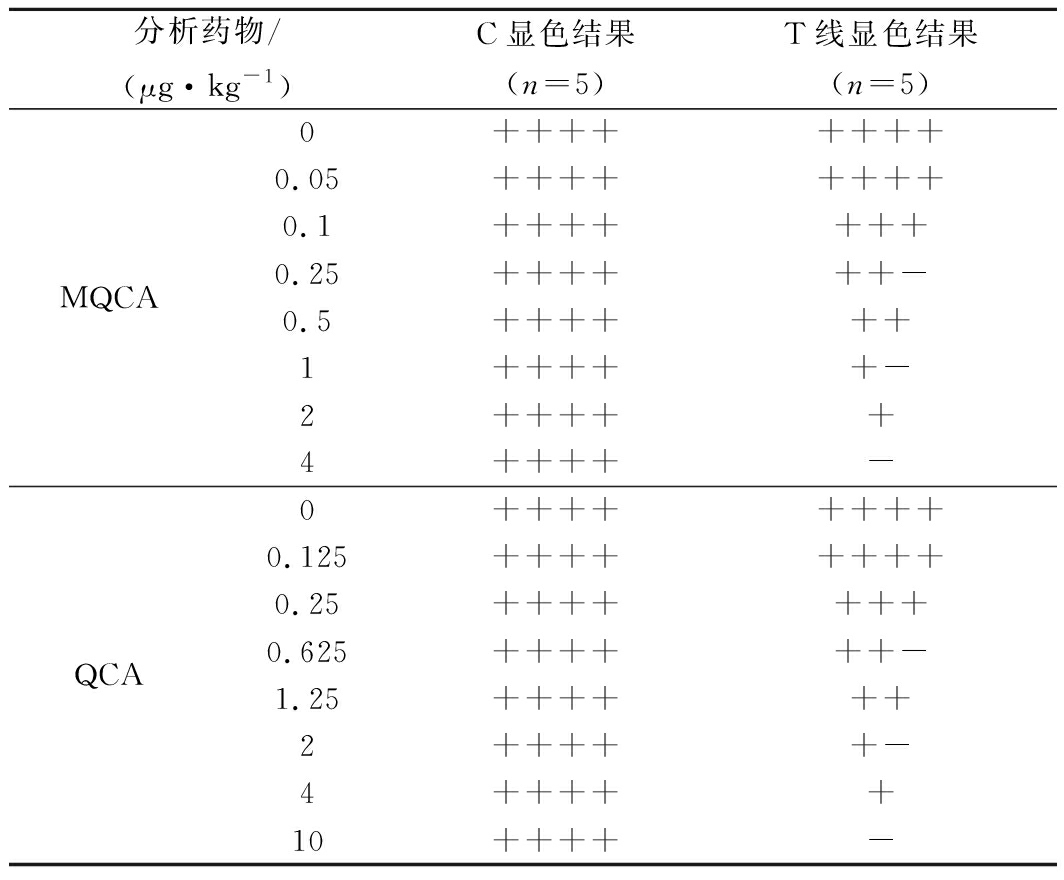
注:根据显色结果判断:“++++”:显色深“+++”:显色较深“++”显色明显“+”:显色较浅“-”:没有显色,或者肉眼无法辨别。
阴性样本,T线颜色微深于C线,当加入0.05 μg/kg的MQCA药物时,T线颜色和C线基本一样;当加入0.1 μg/kg的MQCA药物时,T线颜色明显比C线浅,定性检测卡的LOD为0.1 μg/kg。分别添加0.25、0.5、1、2和4 μg/kg MQCA时,T线颜色越来越浅,直至消失。同理可知QCA的定性检测限为0.25 μg/kg。ELISA试剂盒检测磁珠处理液,平均回收率为92.3%,磁珠处理样本前处理满足检测需求。定性检测能够根据需要进行快速检测,尤其适用于现场快速检测方面。
2.7 胶体金免疫层析的定量检测
在0.02 mol/L PB中分别加入0、0.05、0.1、0.25、0.5、1、2、4 μg/kg MQCA药物,建立的标准曲线如图6所示。

图6 定性和定量胶体金免疫层析法结果及定量检测标准曲线的建立
Fig.6 The result of qualitative and quantitative CGICA and the normalized standard curve of CGICA for MQCA in quantitative method
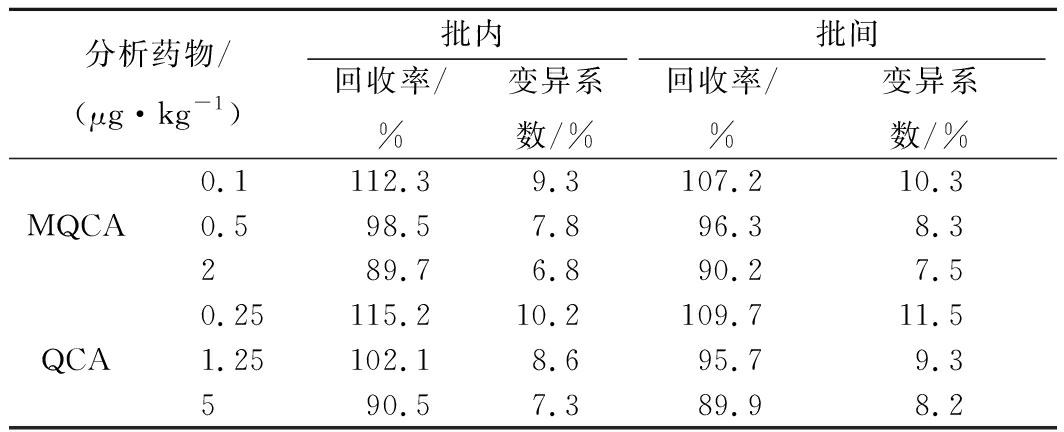
曲线方程为y=1.179 2+(4.362 3)/(1+(x/x0)1.145 5),IC50为0.139 0 μg/kg,定量范围为0.1~4 μg/kg。该曲线方程可以用二维码带入,胶体金免疫层析定量分析仪可直接显示出检测样本的药物含量,直接出结果,免去换算的步骤。根据检测限计算方法的定量检测方法的检测限为0.1 μg/kg。猪肉样本的添加回收结果表3所示,回收率为89.9%~115.2%,变异系数为6.8%~11.5%。证明该方法(免疫磁珠结合胶体金免疫层析检测)可以用于实际猪肉样本的快速定量检测。
表3 胶体金免疫层析法定量检测回收结果(n=5)
Table 3 Recovery result of the colloidal gold immunoch-romatographic assay in quantitatively detection (n=5)
本文建立的定性和定量胶体金免疫层析方法灵敏度较高(LOD=0.1 μg/L),是已经报道的TR-FIA方法的1.6倍(LOD=0.16 μg/L),是传统ELISA方法的2.8倍和19倍[1, 14](LOD=0.28和1.9 μg/L),是已经报道的胶体金方法的4.9和68倍(LOD=0.49和6.83 μg/L)[3, 16]。同时结合免疫磁珠的快速、高特异性和高倍数富集作用,可作为猪肉中MQCA或者QCA的残留检测技术。
2.8 胶体金免疫层析方法(定量)与LC-MS/MS测定结果比较
根据随机选取的20份市售猪肉,采用胶体金免疫层析方法和LC-MS/MS[22]同时定量检测。检测结果如表4所示,其中13份阴性样本,7份阳性样本。其中,CGICA的检测结果为MQCA+QCA的总量,该方法以MQCA为标准品建立的检测方法,检测的结果直观以MQCA含量表示。
表4 CGICA和LC-MS/MS对20份猪肉样本的检测结果 单位:μg/kg
Table 4 The results of determination of 20 pork with
CGICA and LC-MS/MS
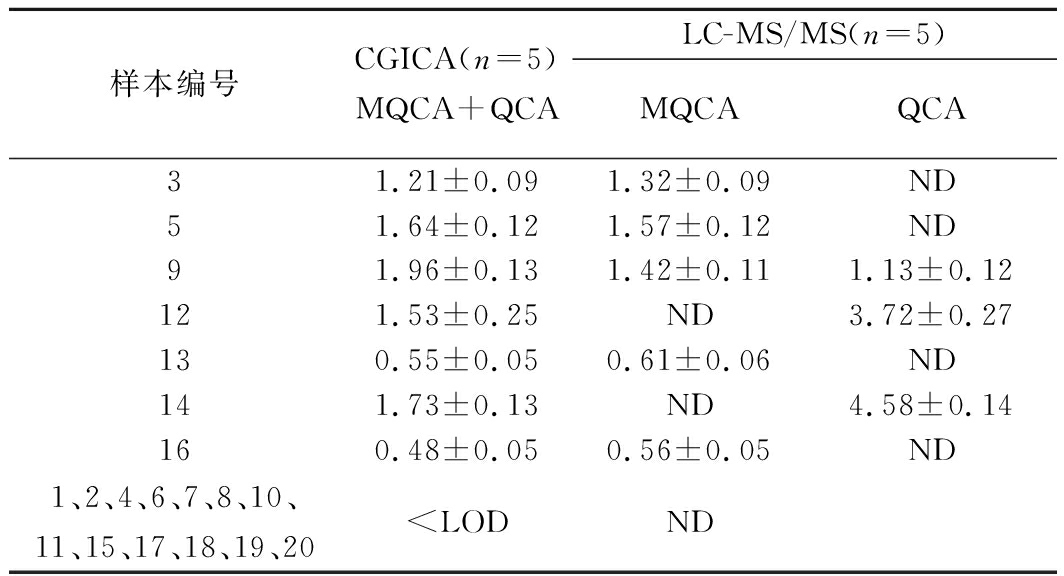
注:ND表示未检出。
LC-MS/MS能分别直观显示MQCA和QCA的含量。另外,文中MQCA+QCA的值与LC-MS/MS的值有差异,原因是MQCA的交叉反应率为100%,QCA交叉反应率为40%。根据交叉反应率计算知,LC-MS/MS和CGICA检测结果一致性较好,证明建立的CGICA方法准确,可靠。
3 结论
本文建立一种方便、快速和灵敏的用于猪肉中MQCA和QCA的定性和定量的胶体金免疫层析方法,定性和定量检测限为0.1 μg/L。免疫磁珠简化样本前处理,可高特异性提取猪肉中的MCA和QCA药物。可在30 min内完成样本的前处理,5 min完成定性定量检测,肉眼视觉直接判断阴阳性(定性),通过仪器识别内置二维码直接显示检测的MQCA和QCA含量,可以根据需要灵活地选择检测方式,快速方便。本文建立的CGICA与LC-MS/MS的测量结果一致性很好,证明该方法准确、可靠,可用于猪肉样本中MQCA和QCA药物的非法残留,可为我国的食品安全检测提供一种有效的检测手段。
参考文献
[1] JIANG Wen-xiao, BEIER R C, WANG Zhan-hui, et al. Simultaneous screening analysis of 3-methyl-quinoxaline-2-carboxylic acid and quinoxaline-2-carboxylic acid residues in edible animal tissues by a competitive indirect immunoassay[J]. Journal of Agricultural and Food Chemistry, 2013, 61(42): 10 018-10 025.
[2] LIU Li-qiang, PENG Juan, XIE Zheng-jun, et al. Development of an icELISA and immunochromatographic assay for methyl-3-quinoxaline-2-carboxylic acid residues in fish[J]. Food Analytical Methods, 2017, 10(9): 3 128-3 136.
[3] PEI Xing-yao, WANG Qi, LI Xiang-mei, et al. Provision of ultrasensitive quantitative gold immunochromatography for rapid monitoring of olaquindox in animal feed and water samples[J]. Food Analytical Methods, 2016, 9(7): 1 919-1 927.
[4] LIU Zhao-ying, WANG Qi, LI Xiang-mei, et al. The metabolism and N-oxide reduction of olaquindox in liver preparations of rats, pigs and chicken[J]. Toxicology Letters, 2010, 195(1): 51-59.
[5] ZHANG Ke-yu, BAN Man-man, ZHAO Zhan-zhong, et al. Cytotoxicity and genotoxicity of 1,4-bisdesoxyquinocetone, 3-methylquinoxaline-2-carboxylic acid (MQCA) in human hepatocytes[J]. Research in Veterinary Science, 2012, 93(3): 1 393-1 401.
[6] SITU C, ELLIOTT C T. Simultaneous and rapid detection of five banned antibiotic growth promoters by immunoassay[J]. Analytica Chimica Acta, 2005, 529(1/2): 89-96.
[7] SNIEGOCKI T, GBYLIK-SIKORSKA M, POSYNIAK A, et al. Determination of carbadox and olaquindox metabolites in swine muscle by liquid chromatography/mass spectrometry[J]. Journal of Chromatography B, 2014, 944: 25-29.
[8] BOISON J O, LEE S C, GEDIR R G. A determinative and confirmatory method for residues of the metabolites of carbadox and olaquindox in porcine tissues[J]. Analytica Chimica Acta, 2009, 637(1/2): 128-134.
[9] PENG Da-peng, ZHANG Xi-ya, WANG Yu-lian, et al. An immunoaffinity column for the selective purification of 3-methyl-quinoxaline-2-carboxylic acid from swine tissues and its determination by high-performance liquid chromatography with ultraviolet detection and a colloidal gold-based immunochromatographic assay[J]. Food Chemistry, 2017, 237: 290-296.
[10] WAGNER L S D, JUAREZ F A F, FABIANO A S O, et al. HPLC-MS/MS method validation for the detection of carbadox and olaquindox in poultry and swine feedingstuffs[J]. Talanta, 2015, 144: 740-744.
[11] WU Yu-jie, YU Huan, WANG Yu-lian, et al. Development of a high-performance liquid chromatography method for the simultaneous quantification of quinoxaline-2-carboxylic acid and methyl-3-quinoxaline-2-carboxylic acid in animal tissues[J]. Journal of Chromatography A, 2007, 1 146(1): 1-7.
[12] DUAN Zhen-juan, YI Jiang-hua, FANG Guo-zhen, et al. A sensitive and selective imprinted solid phase extraction coupled to HPLC for simultaneous detection of trace quinoxaline-2-carboxylic acid and methyl-3-quinoxaline-2-carboxylic acid in animal muscles[J]. Food Chemistry, 2013, 139(1/4): 274-280.
[13] LE T, WEI Shu, NIU Xiao-dong, et al. Development of a time-resolved fluoroimmunoassay for the rapid detection of methyl-3-quinoxaline-2-carboxylic acid in porcine tissues[J]. Analytical Letters, 2014, 47(4):606-615.
[14] LI Guo-peng, ZHAO Liang, ZHOU Feng, et al. Monoclonal antibody production and indirect competitive enzyme-linked immunosorbent assay development of 3-methyl-quinoxaline-2-carboxylic acid based on novel haptens[J]. Food Chemistry, 2016, 209: 279-285.
[15] LE T, XU J, JIA Y Y, et al. Development and validation of an immunochromatographic assay for the rapid detection of quinoxaline-2-carboxylic acid, the major metabolite of carbadox in the edible tissues of pigs. Food Additives & Contaminants: Part A, 2012, 29(6): 925-934.
[16] 霍如林,朱爱荣,张林, 等. 胶体金免疫层析法快速定量检测猪肝中喹乙醇残留[J]. 食品工业科技, 2014, 35(9): 299-302.
[17] LE T, YU Huan, NIU Xiao-dong. Detecting quinoxaline-2-carboxylic acid in animal tissues by using sensitive rapid enzyme-linked immunosorbent assay and time-resolved fluoroimmunoassay[J]. Food Chemistry, 2015, 175: 85-91.
[18] PENG Juan, KONG De-zhao, LIU Li-qiang, et al. Determination of quinoxaline antibiotics in fish feed by enzyme-linked immunosorbent assay using a monoclonal antibody[J]. Analytical Methods, 2015, 7(12): 524-529.
[19] CHENG Lin-li, SHEN Jian-zhong, WANG Zhan-hui, et al. A sensitive and specific ELISA for determining a residue marker of three quinoxaline antibiotics in swine liver[J]. Analytical and Bioanalytical Chemistry, 2013, 405(8): 2 653-2 659.
[20] ZHANG Xi-ya, PENG Da-peng, PAN Yuan-hu, et al. A novel hapten and monoclonal-based enzyme-linked immunosorbent assay for 3-methyl-quinoxaline-2-carboxylic acid in edible animal tissues[J]. Analytical Methods, 2015, 7(16): 6 588-6 594.
[21] LI Chao-hui, WEI Luo, XU Heng-yi, et al. Development of an immunochromatographic assay for rapid and quantitative detection of clenbuterol in swine urine[J]. Food Control, 2013, 34(2): 725-732.
[22] MEROU A, KAKLAMANOS G, THEODORIDIS G. Determination of carbadox and metabolites of carbadox and olaquindox in muscle tissue using high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography B, 2012, 881-882: 90-95.
[23] JIANG Tao, LIANG Zhong, REN Wei-wei, et al. A simple and rapid colloidal gold-based immunochromatogarpic strip test for detection of FMDV serotype A[J]. Virologica Sinica, 2011, 26(1): 30-39.
[24] TIAN Wen-hao, ZHANG Xiao-xiao, SONG Mei-rong, et al. An enzyme-linked immunosorbent assay to detect salinomycin residues based on immunomagnetic bead clean-up[J]. Food Analytical Methods, 2017, 10:3 042-3 051.