大曲高温放线菌是芽胞杆菌目(Bacillales),高温放线菌科(Thermoactinomycetaceae),高温放线菌属(Thermoactinomyces)的典型种,由姚粟等人于2014年在芝麻香型白酒高温大曲中首次发现[1],是芝麻香型白酒高温大曲中的优势菌种,对高温大曲发酵及芝麻香型白酒特殊风味形成具有不可忽视的作用[2]。高温大曲发酵最高品温达60 ℃以上,大曲高温放线菌的高温耐受特征是其在高温大曲发酵过程中生长代谢的基础,深入认识大曲高温放线菌的耐热机制不仅有助于掌握其生存特点和规律,而且有助于解析其在芝麻香型白酒酿造过程中的功能作用,从而有效指导生产实践。
脂肪酸是细胞膜的重要组成成分,是影响细胞膜热稳定性的一个重要因素。研究表明,微生物通过增加磷脂酰烷基链的长度,增加脂肪酸异构化支链的比例或增加脂肪酸的饱和度都可提高细胞膜的相变温度,以维持高温条件下细胞膜的液晶态[3-5]。因此,脂肪酸的代谢是影响微生物适应外界高温环境的一个重要机制。
本文以大曲高温放线菌模式菌株CICC 10681为研究对象,利用RNA-seq技术结合气相色谱研究了大曲高温放线菌CICC 10681在不同温度下参与脂肪酸代谢相关基因的表达情况及脂肪酸含量变化,旨在从分子层面及表型层面解析脂肪酸代谢对大曲高温放线菌CICC 10681耐热性能的影响,为大曲高温放线菌在芝麻香型白酒酿造过程中的产业化应用提供理论基础。
1 材料和方法
1.1 菌株及培养基
大曲高温放线菌CICC 10681分离自高温大曲,保藏于中国工业微生物菌种保藏管理中心(CICC)。R2A液体生长培养基(g/L):胰蛋白胨1.5,酸水解酪蛋白3,酵母浸粉3,可溶性淀粉3,K2HPO4 1.8,MgSO4 0.6,丙酮酸钠1.8,蛋白胨1.5,葡萄糖10,pH 7,115 ℃高压灭菌20 min。
1.2 主要试剂及设备
TRizol试剂:Invitrongen公司;PrimerScriptRT reagent Kit with gDNA Eraser试剂盒和SYBRPremix Ex TaqII试剂盒:TaKaRa宝生物工程(大连)有限公司;NaOH、NaCl、甲酸和浓HCl(分析纯):北京化工厂;正己烷(色谱纯):西陇化工股份有限公司;甲基叔丁醚(色谱纯):天津市光复精细化工研究所。
恒温振荡器,上海一恒科学仪器有限公司;低温离心机,德国Eppendorf公司;HP6890气相色谱仪,安捷伦科技有限公司,配备分流/不分流进样口,氢火焰离子化检测器(FID)及HP气相层析化学工作站,层析柱为Ultra-2柱,长25 m,内径0.2 mm,液膜厚度0.33 μm。
1.3 方法
1.3.1 菌体收集
从甘油管转接大曲高温放线菌CICC 10681菌体于R2A液体生长培养基中,55 ℃条件下180 r/min培养过夜,制备成种子液。将种子液在OD620下的吸光值调至0.5,按2%接种量接种至新的R2A液体生长培养基中。在pH 7.0条件下,分别于45、55和60 ℃下,180 r/min振荡培养,取对数生长期菌悬液(OD620为0.5),12 000 r/min离心1 min收集菌体。不同温度下收集的菌体分别记为S45、S55和S60,-20 ℃保存供后续分析使用。
1.3.2 RNA测序确定脂肪酸代谢基因差异表达
参照TRizol试剂使用说明书提取总RNA,采用Agilent 2100 Bioanalyzer和Nanodrop 2000超微量分光光度计对总RNA的纯度、浓度及完整性进行质控,需保证RNA的OD260/280在1.8~2.2之间,RNA完整性(RIN值)在8以上,质控合格后利用BGISEQ-500测序仪测序。
对高通量测序产生的原始数据(raw reads)进行质控,去除接头污染序列、无意义序列(N的含量大于10%)及低质量序列(Q值≤5的碱基数占序列总长度的50%以上),得到有效数据(clean reads)[6]。使用Biwtie2软件将有效数据比对到大曲高温放线菌CICC 10681参考基因组序列中[7-8]。基因表达定量使用RSEM工具完成,定量结果以FPKM(Reads Per Kilobases per Million reads)表示[9]。根据基因表达量(FPKM值),计算各基因在不同样本间的差异表达倍数。通过控制错误发现率(false discovery rate, FDR)对P-value值进行校正,定义FDR≤0.001且差异倍数大于2倍为差异表达基因。
1.3.3 实时荧光定量PCR
参照PrimerScript RT reagent Kit with gDNA Eraser试剂盒说明书操作步骤,去除RNA样品中DNA污染并逆转录合成cDNA,作为实时荧光定量PCR反应(quantitative Real-Time PCR,qRT-PCR)的模板。利用Applied Biosystems 7500 Real Time PCR System,参照SYBRPremix Ex TaqII试剂盒说明书配制PCR反应液体系,使用两步法扩增程序(预变性95 ℃ 30 s;PCR反应95 ℃ 5 s,60 ℃ 34 s,40个循环)进行反应。采用primer 5.0软件设计反应引物,以16S rRNA作为内参基因,目标验证基因的引物如表1所示,使用2-ΔΔCt法计算目的基因的相对表达差异倍数[10]。
表1 实时荧光定量PCR验证大曲高温放线菌CICC 10681脂肪酸代谢相关基因及引物
Table 1 The genes and primers of fatty acid metabolism in Thermoactinomyces daqus CICC 10681 used for RT-qPCR

1.3.4 脂肪酸组分测定
脂肪酸提取参考《放线菌系统学—原理、方法及实践》中描述方法,大致分为皂化、甲基化、提取、碱洗4个步骤[11]。脂肪酸测定采用气相色谱法结合美国MIDI公司Sherolock全自动细菌鉴定系统的标准化分析结果,气相色谱条件为:炉温为二阶程序升温,起始温度170 ℃,以5 ℃/min的上升速度升至260 ℃,随后以40 ℃/min升至310 ℃,维持1.5 min;进样口温度250 ℃,载气为H2,流速0.5 mL/min,分流进样模式,分流比100∶1,进样量2 μL;检测器温度300 ℃,H2流速30 mL/min,空气流速216 mL/min,补充气(N2)流速30 mL/min。
2 结果与分析
2.1 不同温度大曲高温放线菌脂肪酸代谢相关基因差异表达情况
大曲高温放线菌CICC 10681与脂肪酸代谢相关基因组成及在不同温度下的差异表达如表2所示。与45 ℃相比,大曲高温放线菌CICC 10681在55和60 ℃时生物素羧基载体蛋白编码基因accB分别上调表达8.6和11.3倍,生物素羧化酶编码基因accC分别上调表达4.6和5.3倍,丙二酰辅酶A: ACP转移酶编码基因fabD分别上调表达8.6和8.9倍,β-酮脂酰-ACP合成酶III编码基因fabH分别上调表达6.5和7.1倍,β-酮脂酰-ACP合成酶II编码基因fabF分别上调表达6.5和9.2倍,β-酮脂酰-ACP还原酶编码基因fabG分别上调表达8.6和9.2倍,β-羟脂酰-ACP脱水酶编码基因fabZ分别上调表达8.6和9.2倍,烯脂酰-ACP还原酶编码基因fabV分别上调表达6.5和7.0倍。大曲高温放线菌CICC 10681中与脂肪酸合成相关的11个基因中,8个基因在不同温度下发生了差异表达,与45 ℃相比,在55和60 ℃时平均上调表达7.3和8.4倍。说明随着温度升高,大曲高温放线菌CICC 10681增强了脂肪酸合成途径。
表2 不同温度下大曲高温放线菌CICC 10681脂肪酸代谢相关基因表达情况
Table 2 The differentially expressed genes related fatty acid metabolism inThermoactinomyces daqus CICC 10681 at different temperatures

注:“/”表示未发生差异表达
与45 ℃相比,大曲高温放线菌CICC 10681在55和60 ℃时脂酰辅酶A合酶编码基因fadD分别下调表达7.5和7.8倍,脂酰辅酶A脱氢酶编码基因acdA分别下调表达8.0和8.0倍,烯脂酰辅酶A水合酶编码基因echA分别下调表达7.5和7.6倍,脂酰辅酶A转酰酶编码基因fadA分别下调表达6.1和6.9倍。大曲高温放线菌CICC 10681中与脂肪酸分解相关的4个基因全部发生了差异表达,与45 ℃相比,在55和60 ℃时分别平均下调表达7.3和7.6倍。说明随着温度升高,大曲高温放线菌CICC 10681减弱了脂肪酸分解途径。
乙酰-CoA是直链脂肪酸从头合成的原材料,其主要通过丙酮酸经丙酮酸脱氢酶复合体代谢产生[12]。与45 ℃相比,大曲高温放线菌CICC 10681在55和60 ℃时丙酮酸脱氢酶复合体编码基因pdhA、pdhB、pdhC和pdhD分别平均上调表达2.7和3.1倍。与直链脂肪酸不同,在支链脂肪酸的合成时乙酰辅酶A被分别由亮氨酸、缬氨酸和异亮氨酸经支链酮酸脱水酶复合体代谢产生的异戊酰CoA(Isovaleryl-CoA)、异丁酰CoA(Isobutyryl-CoA)和2-甲基丁酰CoA(2-methylbutyryl-CoA)代替[13]。与45 ℃相比,大曲高温放线菌CICC 10681在55和60 ℃时支链酮酸脱水酶复合体编码基因ilvE、ilvB和ilvD分别平均下调表达5.3和6.0倍(表3)。
表3 不同温度下大曲高温放线菌CICC 10681缬氨酸、亮氨酸和异亮氨酸分解相关基因表达情况
Table 3 The differentially expressed genes related valine,leucine and isoleucine synthesis inThermoactinomyces daqus CICC 10681 at different temperatures
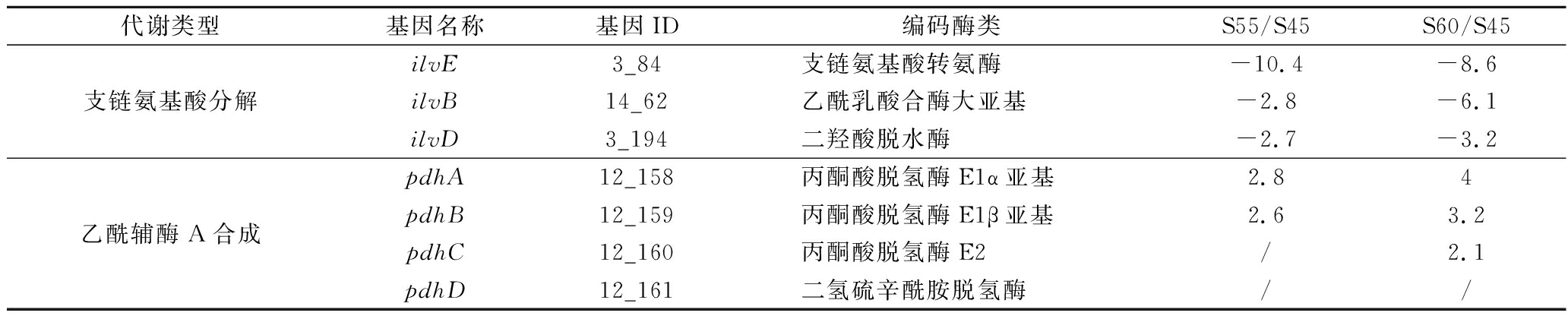
注:“/”表示未发生差异表达。
综上,随着温度升高,大曲高温放线菌CICC 10681中直链脂肪酸合成通路呈上调趋势。同时,在大曲高温放线菌CICC 10681中未发现与不饱和脂肪酸合成相关的β-羟脂酰-ACP脱水酶FabA和β-酮脂酰-ACP缩合酶FabB。说明在高温条件下大曲高温放线菌CICC 10681增强了直链饱和脂肪酸的合成。
2.2 实时荧光定量PCR验证分析
实时荧光定量PCR结果表明(图1),与45 ℃相比,大曲高温放线菌CICC 10681在55、60 ℃时乙酰辅酶A羧化酶编码基因accB分别上调表达8.4和10.3倍,丙二酰辅酶A: ACP转移酶编码基因fabD分别上调表达7.9和9.4倍,β-酮脂酰-ACP合成酶II编码基因fabF分别上调表达6.5和8.3倍。脂酰辅酶A脱氢酶编码基因acdA分别下调表达7.1和7.7倍,脂酰辅酶A转酰酶编码基因fadA分别下调表达7.9和7.5倍。实时荧光定量PCR验证结果与RNA-seq分析结果基本保持一致。
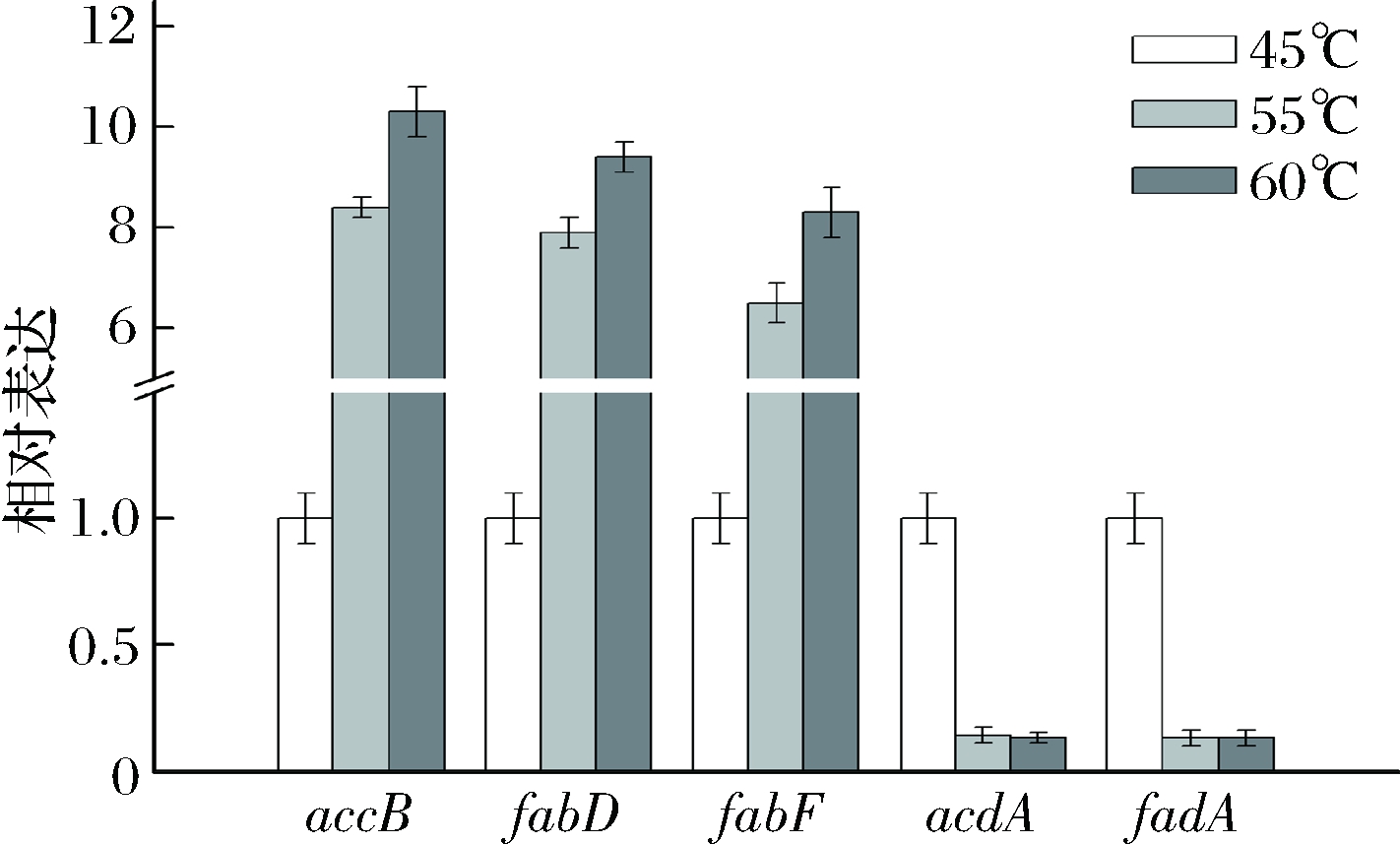
图1 不同温度大曲高温放线菌CICC 10681脂肪酸代谢
相关基因的实时荧光定量PCR验证结果
Fig.1 RT-qPCR verification results for genes related fatty
acid metabolism in Thermoactinomyces daqus CICC 10681 at different temperatures
2.3 温度变化对大曲高温放线菌脂肪酸组成及含量的影响
大曲高温放线菌CICC 10681在不同温度下脂肪酸组成及含量测定结果表明(表4),大曲高温放线菌CICC 10681的脂肪酸主要以直链饱和脂肪酸(C16∶0、C18∶0)和单甲基支链饱和脂肪酸(iso-C15∶0、anteiso-C15∶0、iso -C16∶0、iso-C17∶0、anteiso-C17∶0)为主,且相同碳链长度脂肪酸(C15∶0 和C17∶0)中,iso式脂肪酸含量高于anteiso式脂肪酸含量。随着温度升高,支链饱和脂肪酸含量均呈下降趋势,直链饱和脂肪酸含量呈上升趋势,与45 ℃相比,大曲高温放线菌CICC 10681在60 ℃培养时,C16∶0的含量由8.99%上升到14.45%,升高了1.6倍,C18∶0的含量由1.38 %上升到12.73 %,升高了近10倍。
表4 不同温度大曲高温放线菌CICC 10681的脂肪酸组成
Table 4 Fatty acid composition of Thermoactinomycesdaqus CICC 10681 at different temperatures
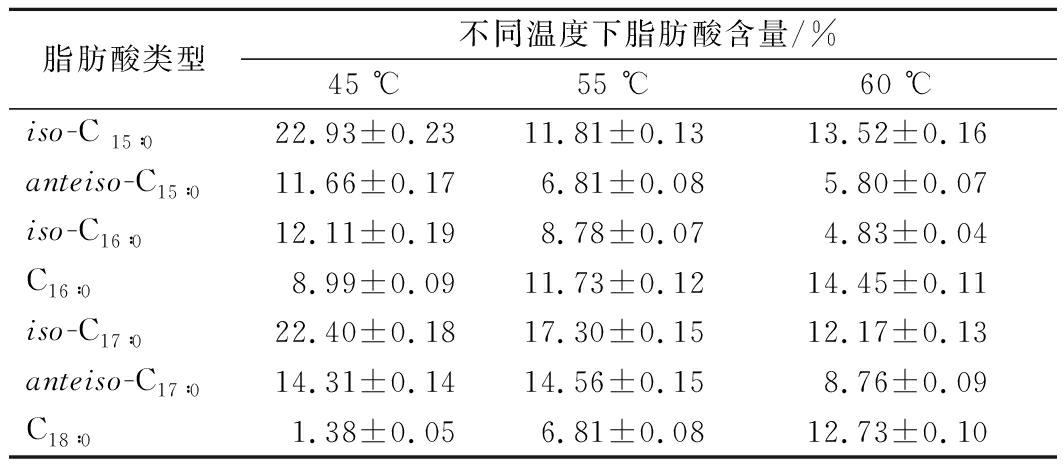
注:表中数据为平均值±标准偏差
3 讨论
液晶态是细胞膜发挥保护作用、选择性吸收、信息传递、能量转换等功能的物化性质基础。所谓液晶态是指某些有机化合物在发生固相到液相转变时的过渡状态,既具有液态的流动性、黏度、变形等特性,同时也具有固态晶体的有序性。能形成液晶态的有机化合物一般为长棒状或平板状,具有一定的刚性,还有极强的偶极矩和容易极化的基团[14-15]。而构成生物膜的各种磷脂分子也都具有上述特点。因此,微生物通过调节磷脂分子的相变温度来维持不同温度下细胞膜的液晶态是其适应外界环境温度变化的一个重要机制[17]。
通常磷脂分子的相变温度与结合在该磷脂上的脂肪酸熔点相同[18]。不同种类的脂肪酸具有不同的熔点,总体趋势为碳氢链越短,越不饱和,则熔点越低,相同碳链的支链脂肪中,iso式脂肪酸的熔点要明显高于anteiso式脂肪酸[19]。大曲高温放线菌CICC 10681的脂肪酸主要以饱和脂肪酸为主,而无不饱和脂肪酸,这可能与大曲高温放线菌不含有与不饱和脂肪酸合成相关的FabA和FabB 2个酶相关。而且相同碳链长度脂肪酸(C15∶0和C17∶0)中,iso式脂肪酸含量高于anteiso式脂肪酸含量,说明大曲高温放线菌CICC 10681的脂肪酸相对主要以高熔点脂肪酸为主,高熔点的脂肪酸使其细胞膜具有较高的相变温度,这在一定程度上与大曲高温放线菌CICC 10681的嗜高温特性是吻合的。
需要强调的是,相同碳原子的直链脂肪酸与iso式脂肪酸的熔点大致相同,但直链脂肪酸构成的磷脂分子的相变温度要明显高于iso式脂肪酸构成的磷脂分子的相变温度。这种差异与不同脂肪酸在磷脂分子的结合位点不同相关。如在枯草芽胞杆菌(Bacillus subtilis)中,n-C15脂肪酸主要结合在磷脂分子的1号位置,anteiso-C15脂肪酸主要结合在磷脂分子的2号位置,Iso-C15脂肪酸则主要结合在磷脂分子的1号和2号位置之间[20]。可以看出,温度升高条件下大曲高温放线菌CICC 10681增强了直链饱和脂肪酸的含量,降低了支链饱和脂肪酸的含量。这2种脂肪酸含量的变化可能都是大曲高温放线菌CICC 10681在高温条件下提高其细胞膜相变温度以维持细胞膜流动性的有效调控方式。
4 结论
本研究利用RNA-seq技术结合实时荧光定量PCR技术在分子水平研究了不同温度下大曲高温放线菌CICC 10681脂肪酸代谢相关基因的差异表达,并通过气相色谱结合Sherolock全自动细菌鉴定系统在表型水平研究了不同温度下大曲高温放线菌CICC 10681脂肪酸的组成及变化。结果表明,温度升高条件下,大曲高温放线菌CICC 10681增强了直链饱和脂肪酸的合成,减弱了支链饱和脂肪酸的合成,脂肪酸种类及含量变化呈现出提高细胞膜相变温度的变化趋势,这种变化趋势保证了大曲高温放线菌CICC 10681在高温条件下细胞膜功能的正常发挥,是其适应高温环境的一个重要机制。
参考文献
[1] YAO S, LIU Y, ZHANG M J, et al. Thermoactinomyces daqus sp. nov. a thermophilic bacterium isolated from high temperature Daqu[J].International Journal of Systematic & Evolutionary Microbiology,2014,64(1):206-210.
[2] 姚粟,葛媛媛,李辉,等.利用非培养技术研究芝麻香型白酒高温大曲的细菌群落多样性[J].食品与发酵工业, 2012, 38(6):1-6.
[3] 马挺,刘如林.嗜热菌耐热机理的研究进展[J].微生物学通报, 2002, 29(2):86-89.
[4] 徐国恒.细胞膜的双层磷脂结构与功能[J].生物学通报, 2006, 41(9):11-14.
[5] 李颖.微生物生理学[M].北京:科学出版社, 2013.
[6] BLANKENBERG D, GORDON A, KUSTER G V, et al. Manipulation of FASTQ data with galaxy [J].Bioinformatics, 2010, 26(14):1 783-1 785.
[7] LANGMEAD B. Ultrafast and memory-efficient alignment of short DNA sequences to the human genome[M]. Genome Biology,2009, 10(3):25-34.
[8] YAO S, XU Y, XIN C, et al. Genome Sequence of Thermoactinomyces daqus H-18,a novel thermophilic species isolated from high-temperature Daqu[J].Genome Announcements,2014,3(1):e01394-14.
[9] LI B, DEWEY C N. RSEM: accurate transcript quantification from RNA-Seq data with or without a reference genome[J].Bmc Bioinformatics, 2011, 12(1):323-325.
[10] LU G, LI Z, ZHANG X, et al. Expression analysis of lignin-associated genes in hard end pear (Pyrus pyrifolia, Whangkeumbae) and its response to calcium chloride treatment conditions[J].Journal of Plant Growth Regulation, 2015,34(2):251-262.
[11] 徐丽华.放线菌系统学[M].北京:科学出版社,2007.
[12] PATEL M S, ROCHE T E. Molecular biology and biochemistry of pyruvate dehydrogenase complexes[J]. Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology, 1990, 4(14):3 224-3 233.
[13] 罗琦霞. Shewanella oneidensis脂肪酸生物合成及其调控的研究[D]. 杭州:浙江大学, 2015.
[14] KOGA Y. Thermal adaptation of the archaeal and bacterial lipid membranes.[J].Archaea-an International Microbiological Journal,2012, 2012(1):789-652.
[15] 蔡浩然.液晶态生物膜[J].科学通报,1978,23(4):209-216.
[16] 刘玮.液晶态生物膜结构及其相变同功能的关系[J].生物化学与生物物理进展,1985(1):18-24.
[17] HAZEL J R. Thermal adaptation in biological membranes: is homeoviscous adaptation the explanation?[J].Annual Review of Physiology,1995,57(1):19-42.
[18] AGUILAR P S, JR C J, De M D. A Bacillus subtilis gene induced by cold shock encodes a membrane phospholipid desaturase[J]. Journal of Bacteriology, 1998, 180(8):2 194-2 200.
[19] KANEDA T. Iso- and anteiso-fatty acids in bacteria: biosynthesis, function, and taxonomic significance[J]. Microbiological Reviews, 1991, 55(2):288-302.
[20] KANEDA T. Positional preference of fatty acids in phospholipids of Bacillus cereus and its relation to growth temperature[J]. Biochim Biophys Acta,1972,280(2):297-305.