白酒是中国传统发酵食品之一,主要是由谷物类原料在微生物的作用下形成的具有水果香、花香等丰富的风味物质的蒸馏酒[1]。白酒发酵过程中复杂的微生物种群是决定白酒风味特征的重要因素。微生物种类及数量的差异会直接影响白酒的产量和质量。
鉴于微生物在白酒酿造中的重要作用,近几十年来国内开展了大量的针对酿酒微生物的研究工作。主要包括培养法和免培养法,其中免培养法仅能通过分子手段观察白酒酿造相关微生物的组成、结构等信息,如ZHANG等[2-3]通过变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)技术分析浓香型白酒发酵过程中的细菌及真菌种群。而基于培养法的研究对生产实践有更直接的帮助,如吴衍庸等[4]从浓香型白酒生产窖泥中筛选到窖泥甲烷菌和己酸菌,对提高浓香型白酒主体香己酸乙酯有重要意义。同时,由于白酒发酵过程中涉及到非常复杂的微生物相互作用及代谢,通过常规的单菌培养方式并不能呈现出白酒生产实际中真实的微生物代谢情况。因此,组合发酵方式成为了研究白酒酿造微生物功能的有力工具。如WU等[5-6]分析酿酒酵母、异常毕赤酵母和东方伊萨酵母组合发酵方式,最终可以生产出具有汾酒特征的产品。张艳等[7]通过组合发酵方式证明了酱香型白酒发酵过程中部分乳酸菌可以促进酵母的生长代谢,乳酸菌和酵母菌的相互作用可以影响酒中酸、醇、酯类物质的生成。然而目前组合发酵研究基本上是通过筛选酒醅中丰度较高的菌群进行组合,对不同菌株的酶活、代谢风味特性缺乏深入的考虑与理性的设计。
针对以上问题,基于本研究室以往筛选到的白酒功能菌株,根据不同菌株的酶活、风味特征进行组合发酵,建立了理性设计组合发酵的方法。
1 材料与方法
1.1 实验材料
1.1.1 菌种
酵母菌包括酿酒酵母(Saccharomyces cerevisiae)、粟酒裂殖酵母(Schizosaccharomyces pombe)、异常毕赤酵母(Pichia anomala)、东方伊萨酵母(Issatchenkia orientalis)、扣囊复膜酵母(Saccharomycopsis fibuligera)等共24株、细菌包括芽孢杆菌(Bacillus sp.)等共16株、霉菌包括曲霉属(Aspergillus sp.)、青霉属(Penicillium sp.)、根霉属(Rhizopus sp.)等共16株。菌株来源为本实验室已有的保藏菌株。
1.1.2 试剂及药品
蛋白胨、琼脂粉、酵母粉为Oxoid原装进口,其他试剂购于国药集团。
1.1.3 培养基
菌株的活化分别使用NB培养基(细菌)、YPD培养基(酵母)、PDA培养基(霉菌);测量糖化力使用2%淀粉察氏培养基;测量蛋白水解力使用酪蛋白培养基,发酵培养基为高粱汁培养基。
NB培养基(g/L):牛肉膏5,蛋白胨10,NaCl 5;
YPD培养基(g/L):胰蛋白胨20,葡萄糖20,琼脂粉20;
PDA培养基(g/L):PDA试剂粉46.1;
2%淀粉察氏培养基(g/L):淀粉20,NaNO33,KCl 0.5,K3PO4 1,FeSO4 0.01,MgSO4 5,琼脂粉5;
酪蛋白培养基(g/L):酪蛋白10,蛋白胨5,酵母膏2.5,KH2PO4 0.3,MgSO4 7H2O 0.5,NaCl 1,琼脂粉20。
1.2 实验方法
1.2.1 菌株糖化力指标的测定
将菌种活化后在淀粉平板背面划分区域。霉菌较大,一般分为2格;细菌和酵母较小,可分为4格。记录好要接种的菌,用移液管枪头蘸取少量菌,接种于相应的格内。每种菌株至少做2组。细菌于37 ℃恒温箱中培养1~2 d,酵母菌和霉菌于30 ℃恒温箱中培养2~3 d。
用移液枪吸取适量卢戈氏碘液滴加到淀粉培养基内,分别观察菌落大小及透明圈大小,并分别测量其直径,得到菌落直径与淀粉透明圈直径比值,即可得到菌株糖化力大小。
1.2.2 菌株蛋白水解力指标的测定[8]
将活化后的菌种以同样的方法接种于酪蛋白平板上,培养条件及时间与上述相同。可以直接观察并测量菌落直径与淀粉透明圈直径,得到其比值,即可得到菌株蛋白水解力大小。
1.2.3 酵母菌发酵风味评定
发酵液中风味物质的分析:运用顶空固相微萃取技术(HS-SPME)和气相色谱-质谱(GC-MS)方法分析。样品处理方法及GC-MS分析条件见文献[9]。
将酵母菌菌种活化。吸取5 mL高粱汁于试管中,用接种环钩取1环菌,接种于高粱汁中,每个菌株接种2管。放于30 ℃恒温箱中培养1周。1周后,取出发酵液,通过感官评定筛选出发酵液具有优良风味的菌株。
1.2.4 菌株组合固态发酵
白酒生产中微生物的相互作用对微生物群落的有效应用具有重要的作用。例如,霉菌与酵母的相互作用影响着糖化与产酒的速度;产酒酵母与产香酵母的相互作用影响着白酒的品质与产量;产香细菌与产酒酵母的相互作用也能影响着白酒的品质与产量[10]。
根据前期所得菌种水解力及风味分析,结合菌种特性[11],做出4个组合方案。将4个组合中的菌株活化,制成菌悬液。用70 ℃的去离子水浸泡20 kg高粱颗粒18 h,将水沥干后于蒸锅中蒸2 h,等量分装到4个发酵罐中。取1 mL上述菌株的菌悬液分别加入到4个发酵罐中,于室温下密封培养2个月。将培养物取出蒸馏,白酒中的风味活性化合物应用液液萃取后再GC-O结合GC-MS技术检测[9]。
2 结果与分析
已有研究发现,酵母菌在发酵过程中主要起到产酒精、产香的作用[12],而细菌和霉菌的糖化力和蛋白水解力较高,主要起到分解大分子,为风味物质的产生提供前体物质,辅助酵母的生长和产香的作用[13]。不同菌株之间的相互作用可以提高酵母的发酵能力。吴群等[14]在对芝麻香型白酒酿造功能霉菌及其与酵母的相互作用的研究中证实了此观点。研究表明随着霉菌麸曲的用量增加,霉菌酵母的生物量都会比较大。同时淀粉的糖化速度也会加快,还原糖的充足供应加快了酿酒酵母的增殖速度,使发酵温度升高并产有机酸等从而影响整个白酒发酵体系的微生物群落结构,而微生物群落结构的变化会影响最终白酒的风味变化[14]。
2.1 菌株糖化力和蛋白水解力比较
白酒主要原料是高粱等淀粉质原料,使用传统的大曲作为糖化发酵剂,经发酵和蒸馏而制成的一种饮料酒[15]。在白酒发酵过程中,糖化剂以及菌株蛋白水解力的性能是决定白酒品质重要因素。因此优势的组合菌株需要有良好的糖化力和蛋白水解力。
图1显示了部分菌株的糖化力和蛋白水解力。糖化力总体比较高的菌株有:拜尔接合酵母BJY-6(Zygosaccharomyces bailii BJY-6)、异常毕赤酵母HX-2(Pichia anomala HX-2)、枯草芽孢杆菌80(Bacillus subtilis 80)等。由图1-a可以分析得到,拜尔接合酵母BJY-6(Zygosaccharomyces bailii BJY-6)和异常毕赤酵母HX-2(Pichia anomala HX-2)的糖化力在酵母中比较有优势。总体糖化力的比较中,细菌糖化力较高,其次是霉菌,而酵母总体糖化力水平略低(图1-a)。
蛋白水解力总体比较高的菌株有:死谷芽孢杆菌HX-30(Bacillus vallismortis HX-30)、紫红红曲5024(Monascus purpureus 5024)、地衣芽孢杆菌HX-50(Bacillus licheniformis HX-50)。芽孢杆菌的蛋白水解力都较强,其次是霉菌,酵母的蛋白水解能力较其他菌株较弱(图1-b)。
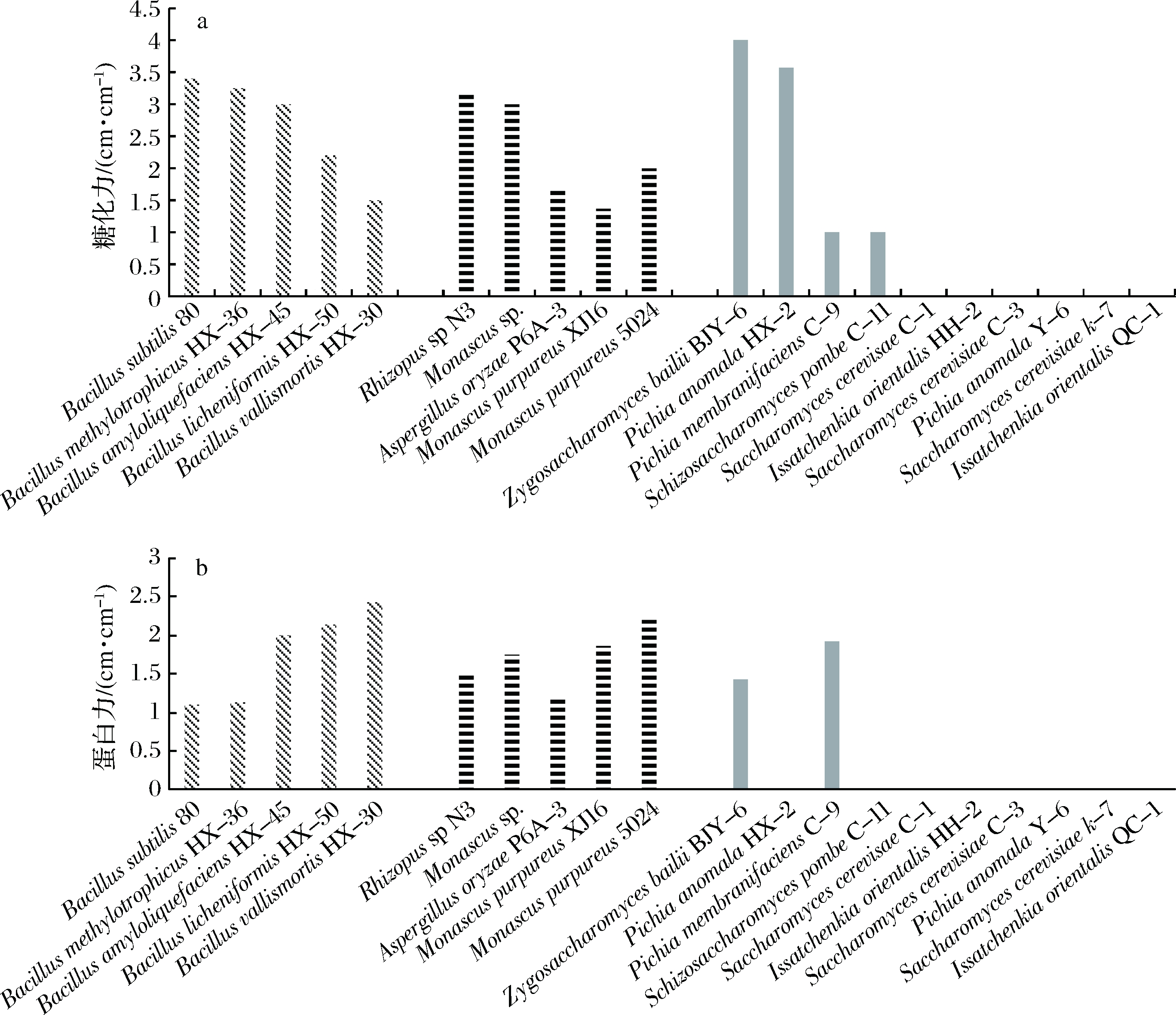
图1 部分菌株糖化力(a)和蛋白水解力比较图(b)
Fig.1 Comparison of saccharifying activity (a) and proteolytic activity of selected strains (b)
2.2 选取优势酵母测定发酵风味
2.2.1 感官评定酵母发酵液
在传统酿造白酒的过程中,微生物对白酒的产量、口感、香味等起到非常重要的作用。其中酵母菌在原料淀粉的糖化、酒精的生成、香气风味物质的形成、酒醅的发酵质量及其产品品质的优劣等方面都起着举足轻重的作用[16]。邵明凯等人在酱香型白酒风味研究中发现,酵母菌是白酒酿造中的重要的微生物群落,它对乙醇和对白酒风味贡献最大的酯类物质的产生有重要作用。其研究中还表明,酱香型白酒发酵过程中酵母群落多样性丰富,其差异是造成好和差轮次白酒风味和品质上不同的重要原因[17]。许焰等[18]通过研究酱香型白酒中的拜耳接合酵母发现其能够产生更多的的酸类,酯类和醛类物质,并可生产19种特有的风味化合物,包括2-庚醇、2-壬醇、己醇、香叶醇、2-庚酮和丁酸等,其中一些风味物质对酱香型白酒中风味形成有重要影响。以上研究都表明了酵母在白酒酿造过程中对白酒风味物质产生的重要性。因此选取优质酵母是酿造好白酒的重要一步,所以感官评价了部分优势酵母高粱发酵风味,为选取白酒微生物的组合发酵提供参考(表1)。
表1 酵母发酵液风味
Table 1 The flavor of yeast fermentation

注:这里只列出优势酵母的高粱发酵风味。
YU等[19]对毕赤酵母属和酿酒酵母属的8种单菌株分别进行了液态和固态接种发酵,结果显示苯乙醇、异丁醇等醇类,醋酸、己酸、辛酸、十二烷酸等酸类,乙酸乙酯、己酸乙酯、壬酸乙酯、十六酸乙酯等酯类在固态和液态发酵中都可以产生。王丹丹[20]将酿酒酵母和产酯酵母在水解液中液态发酵产生的微量成分与固态酒醅发酵28 d时的微量成分进行对比。发现液态发酵和固态发酵都可以产生醇、酸、酯等主要的风味物质,醇类主要有正丙醇、异丁醇、异戊醇;酸类主要有乙酸;酯类主要有乙酸乙酯、乳酸乙酯。因此,通过酵母液态发酵来评估酵母的风味特征,在一定程度上,能够与其固态发酵的风味特征一致。
2.2.2 酵母高粱汁发酵液风味物质含量的测定
目前根据酵母的作用可以将酵母大致分成两大类。一类是Saccharomyces cerevisiae,主要完成酒精发酵,用于产酒精[21]。另一类是non-Saccharomyces,其发酵能力可能略有欠缺,但能够合成多种酶,将原料中的前体物质转换成风味物质如酯、酸、高级醇和醛等产物,可以赋予发酵食品优良的风味、质地、色泽等品质[22]。
由图2分析,酵母产酸能力虽然较低,但其产醇类物质以及酯类物质能力较强。其中Issatchenkia orientalis HH-2 (东方伊萨酵母)产酸能力最强;产醇能力较强的为Saccharomyces cerexisiae K-7(酿酒酵母)、Issatchenkia orientalis HX-11(东方伊萨酵母)和Issatchenkia orientalis QC-1(东方伊萨酵母);Pichia anomala L3(异常毕赤酵母)的产酯能力最高,远远高于其他酵母,Pichia anomala HX-2(异常毕赤酵母)的产酯能力约为Issatchenkia orientalis QC-1(东方伊萨酵母)的一半,Issatchenkia orientalis C-16(东方伊萨酵母)和Pichia anomala Y6(异常毕赤酵母)的产酯能力相近。定量测定酵母高粱汁发酵液风味物质含量对于选取组合酵母具有参考意义。
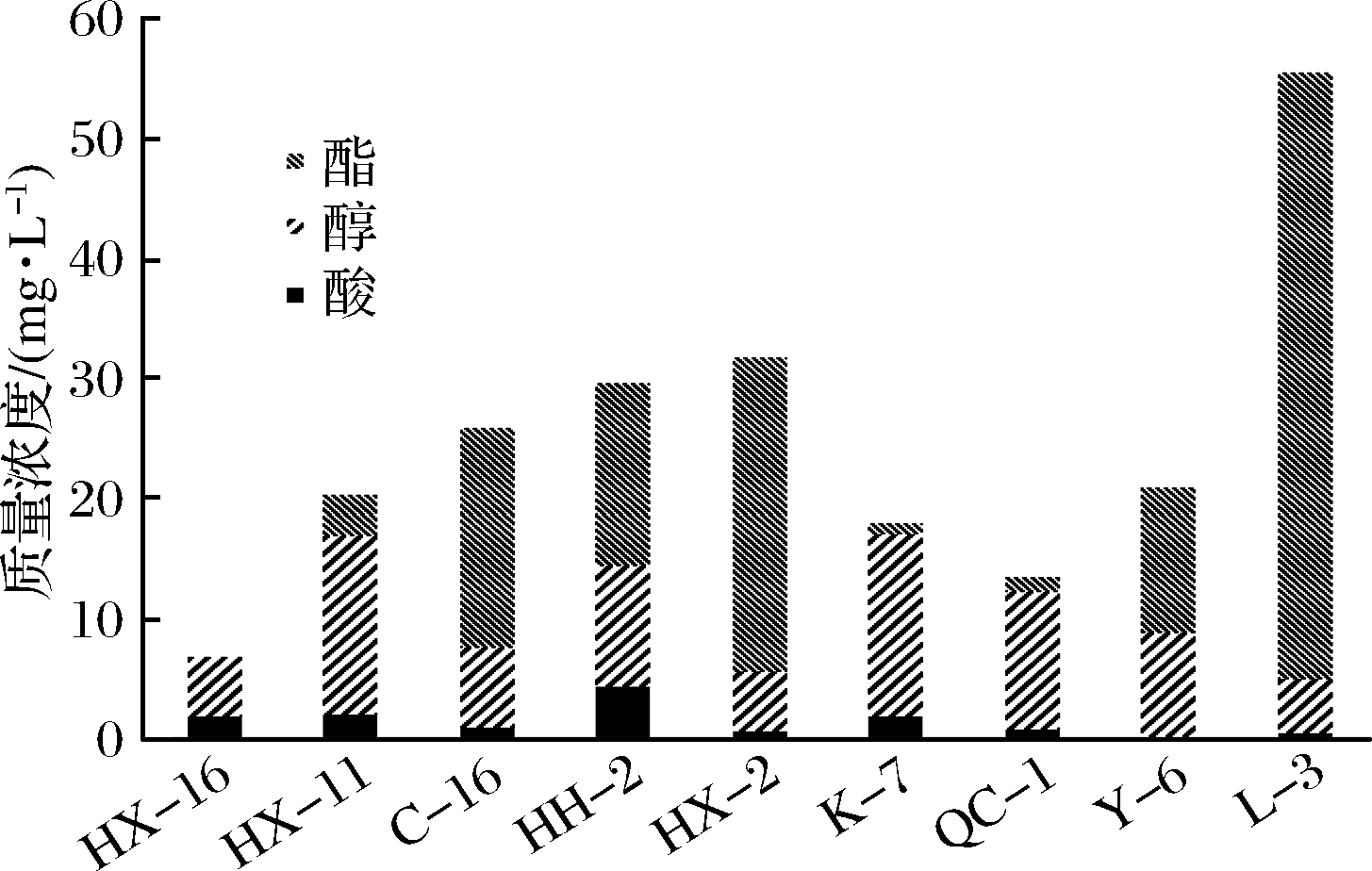
图2 优势酵母高粱汁发酵液中酸、醇、酯含量比较图
Fig 2 Comparison of acid, alcohol and ester content in fermented sorghum juice by yeast
2.3 微生物组合发酵的白酒风味
2.3.1 设计组合方案
综合前述对于细菌、霉菌、酵母糖化力及蛋白水解力的比较以及主要优势酵母风味评定分析,做出了如下4种组合方案并用于实验室小型白酒固态发酵实验。其中每种组合中都优先选择优良酵母参与组合发酵。目前已有相关实验分析,与单独培养发酵相比,酵母的混菌发酵,能够在白酒酿造中表现出更好的酿造水平。它们或者代谢产生、增强一些有益的风味化合物如苯乙醇、乙酸苯乙酯等,或者降解某些异味物质如乙酸、乙醛等,或者促进酵母的代谢性能,从而最终改变发酵产物的风味特征[23]。所以将酵母和其他菌株共同作为发酵起始菌种,为丰富发酵产物的风味复杂性和增强风格的独特性提供了一条有效的途径[23]。
组合1:选择Saccharomyces cerevisiae C-1、Issatchenkia orientalis HH-2、Aspergillus oryzae P6A-3为一组。C1虽然糖化力没有其他酵母优良但其为酿酒酵母,具有良好的发酵能力,同时在培养过程中显示了良好的生存能力。HH-2为东方伊萨酵母,感官评定为水果味,能够产生令人愉悦的风味物质。曲霉的选择为米曲霉P6A-3。由数据分析可知,3株红曲霉:中红10号,紫红红曲 5024,紫红红曲XJ16糖化力和蛋白水解力都显示出更高的水平,但是红曲霉在培养过程中可能产生有毒物质,对于食品安全有威胁[24],因此本研究选择了更为安全的P6A-3作为培养菌株且其单菌培养过程中易于培养,综合糖化力和蛋白水解力也较优。
组合2:选择Saccharomyces cerevisiae C-3、Pichia anomala Y-6、Bacillus licheniformis HX-50为一组。C-3为酿酒酵母,也用于产酒精。Y-6为异常毕赤酵母,感官评定时为焦糖味。HX-50为地衣芽胞杆菌,细菌蛋白水解力较强。目前白酒酿造研究的热点之一就是酿酒酵母与非酿酒酵母组合发酵中酵母之间的相互影响和代谢产物的差异分析[23]。选取酿酒酵母C-3、产酯酵母Y-6和蛋白水解力较强的芽孢杆菌为组合发酵实验提供实验新路线。
组合3:选择Schizosaccharomyces pombe C-11、Pichia anomala HX-2、Bacillus subtilis 80为一组。C-11为粟酒裂殖酵母,其具有一定的糖化力,且可用于产酒精。HX-2为异常毕赤酵母,感官评定风味为果醋味,并且在酵母中具有较高的糖化力。80为枯草芽孢杆菌,细菌糖化力较为突出。
组合4:选择Saccharomyces cerevisiae K-7、Issatchenkia orientalis QC-1、Bacillus amyloliquefaciens HX-45为一组。K-7为酿酒酵母,在高粱汁发酵中产醇能力较好,并且感官评定为蜂蜜味。QC-1为东方伊萨酵母,感官评定为水果味。HX-45为解淀粉芽孢杆菌,糖化力和蛋白水解力都名列前茅。
2.3.2 四种组合方案主要风味物质解析
图3为4种组合方案中主要风味物质解析图,结果分析可得组合1含量较高的物质半定量峰面积为:乙酸异戊酯21454,乙酸乙酯13263,丙酸乙酯760,丙酸异戊酯199,2-甲基丁酸乙酯135。组合2含量较高的物质半定量峰面积为:己酸乙酯1126,丁酸丁酯299,丙酸丁酯89,戊酸乙酯44,乙酸异戊酯20。组合3含量较高的物质半定量峰面积为:甲酸异戊酯11,乙酸乙酯6.36,乙酸异戊酯5.20,庚酸2.38,正己酸乙酯1.76。组合4含量较高的物质半定量峰面积为:3-辛醇3.95,丁酸1.77,1-辛烯-3-醇1.32,1-辛醇0.82,己酸0.81。相较于其他组合,组合1产酯能力较强,且发酵后蒸馏的白酒风味更宜人。
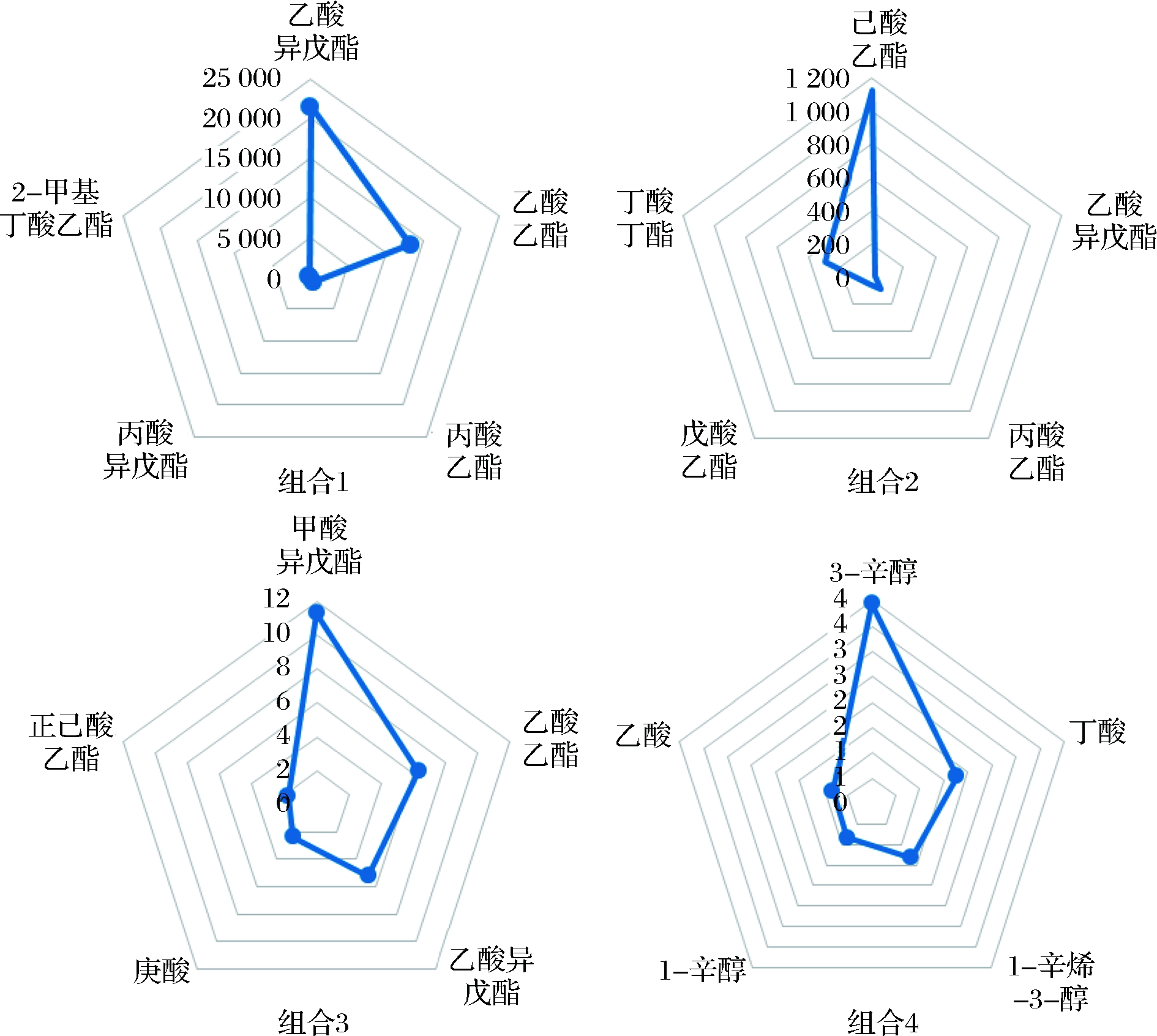
图3 四种组合方案主要风味物质GC-MS半定量峰
面积对比图
Fig.3 Comparison of GC-MS semi-quantitative peak areas of major flavor compounds in four combinations
图4比较了4个组合主要风味物质的含量,包括三大醇(乙醇、异戊醇、异丁醇)、两大酯(己酸乙酯、乙酸乙酯)以及丁酸。醇类对形成酒的风味和促使酒体丰满、浓厚起着重要的作用;也是酯类的前驱物质。酯类是具有芳香的化合物,在各种香型白酒中起着重要作用,是形成酒体香气浓郁的主要因素。酸类影响白酒的口感和后味,酸不足是造成后味寡淡的主要原因。
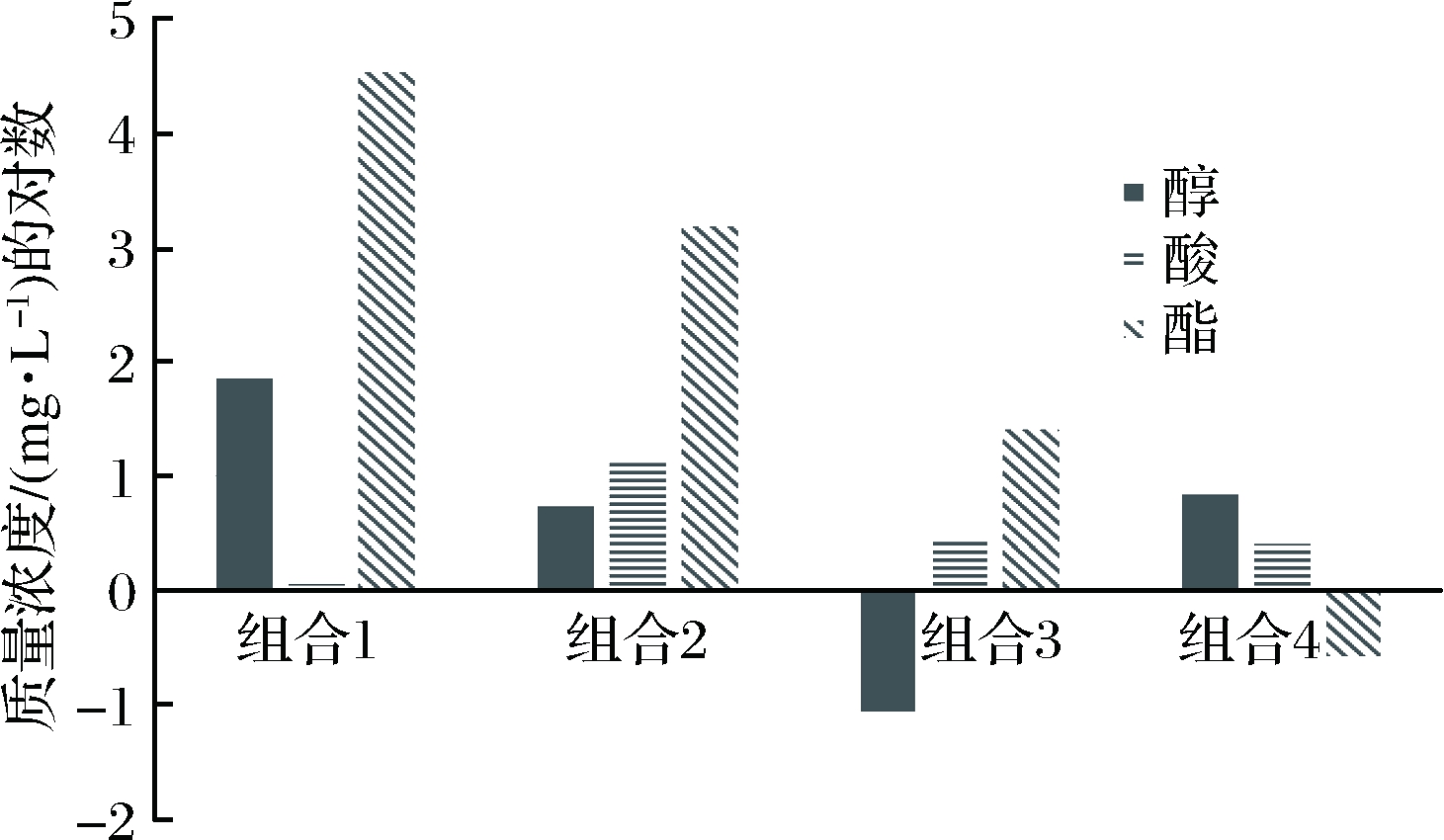
图4 重要风味物质含量对比
Fig.4 Comparison of the content of important flavor substances
结合感官评定,得到4个组合中风味最好的是组合1,它的醇和酯的总含量最高,主要体现水果味。近年来,白酒质量与安全已经成为消费者关注的重点。目前消费者关注的酒类中高级醇含量较高而由此带来的健康问题值得注意。虽然高级醇的微弱毒性不足以为其做限量标准,但在越来越注重健康的今天,白酒的适口性及饮用后的体验也更多地被关注[25]。为了进一步分析组合1的发酵产物是否具有食品安全可靠性,本文对比相关数据得出如下结论:组合1醇类物质含量较高,其总醇含量为74.24 mg/L。通过相关仪器测定组合1蒸馏的高粱酒中异丁醇的含量为0.28 mg/L,异戊醇的含量为3.85 mg/L。纯净的杂醇油具有刺鼻的气味和辛辣味,含量如果超过100 mg/L时,饮用后易“上头”,对人体有较大的伤害,且以异丁醇和异戊醇的毒性为主。以上对比分析组合1中高级醇的含量低于相关卫生指标。且白酒中都含有一定量的高级醇类,高级醇类是白酒中重要的风味物质,适量的高级醇类能赋予白酒浓郁、芬芳、醇甜等特殊感官特征。所以作为饮料酒,在蒸馏时因酿酒师掌握温度的技艺不同,会使酒中杂醇油的含量不同。高质量的白酒,杂醇油含量一般可控制在50 mg/L左右,既保证了酒的风格,适量饮用后又不会对人体产生有害作用[26]。
3 结论与讨论
为了验证微生物发酵高粱可以产生果酒的香气,将组合1与实验室已有的桑葚酒和橘子酒风味物质进行对比。组合1经发酵蒸馏后的高粱酒中含量较高的几种物质分别是乙酸异戊酯,乙酸乙酯,2-甲基丁酸乙酯,乙醇,异戊醇。高粱酒与桑椹酒、橘子酒2个果酒中含量较高的醇、酸、酯类物质的浓度对数的对比发现,水果酒中的重要风味物质,在高粱酒中也有体现。
同时查阅相关文献对比了该组合发酵所得白酒与自然混菌发酵白酒的风味差别[27]。其中组合1中乙酸乙酯浓度为3 099.78 mg/L,辛酸乙酯为5.17 mg/L。自然混菌发酵白酒乙酸乙酯约为950.01 mg/L,辛酸乙酯为2.72 mg/L。研究表明当白酒中乙酸乙酯浓时呈苹果香、香蕉香,稀薄时呈梨香。组合1中乙酸乙酯浓度较高,也含有少量辛酸乙酯,十六酸乙酯等。其量虽少但阈值低,对口感影响较大。除含有酯类等香味物质外,组合1中还含有酸类物质如乙酸、丙酸、异丁酸、丁酸、戊酸、异戊酸,己酸等。存在一定的酸类物质,可使得酒体饱满,易于老熟,经过一定时间的储存可有陈香味。组合1蒸馏所得白酒虽然与其他自然混菌发酵白酒相比还存在一定差距,但在中国白酒品类日新月异的发展中,可以为酿造优质多元化白酒提供组合微生物的新思路。
目前组合发酵酿造白酒已有许多成功案例[28-31]。有针对性地培养筛选优良的功能微生物,分析各功能菌株及其代谢产物的生态关系和作用机理,使混菌发酵以最高效稳定的方式酿造白酒,将有效解决传统经验式操作,减少酿造微观环境的不确定因素引起微生态的改变对白酒酿造的不良影响,对白酒的风味控制和产量有着非常重要的意义。但是对于白酒发酵过程中优势菌株互作及其应用还需进一步完善:
(1)白酒的生产过程具有粗放性,它是一个多菌多酶混合发酵的过程。目前本研究仅选择组合了4种微生物,而其他种类繁多的微生物也参与了白酒发酵过程中代谢调控,其中包括可分离培养的及众多的暂未能够分离出来的菌种,而揭开白酒酿造神秘的面纱离不开对环境中所有微生物的认识,离不开对所有微生物间相互作用的研究。
(2)同时本次研究并未深入研究酿造菌株之间的相互作用,对是否只是单纯的菌株强强加和效果,还是存在菌株互配、竞争抑制及更深层次的原因还有待研究。
(3)后续的研究重点可以放在组合功能微生物之间互作代谢研究及发酵工艺条件,从而在酿造过程中产生具有特殊风味及香型的白酒,以提高白酒的口感与品质。
参考文献
[1] 任聪,杜海,徐岩.中国传统发酵食品微生物组研究进展[J].微生物学报,2017,57(6):885-898.
[2] ZHANG W X,QIAO Z W,SHIGEMATSU T,et al.Analysis of the bacterial community in zaopei during production of Chinese Luzhou‐flavor liquor[J].J I Brewing,2005,111(2):215-222.
[3] ZHANG W X,QIAO Z W, TANG Y Q,et al.Analysis of the fungal community in zaopei during the production of Chinese Luzhou‐flavour liquor[J].J I Brewing,2007,113(1):21-27.
[4] 吴衍庸,薛堂荣,陈昭蓉,等.五粮液老窖厌氧菌群的分布及其作用的研究[J].微生物学报,1991(4):299-307.
[5] WU Q, ZHU W, WANG W,et al.Effect of yeast species on the terpenoids profile of Chinese light-style liquor[J].Food Chemistry,2015,168:390-395.
[6] WU Q, KONG Y, XU Y.Flavor profile of Chinese liquor is altered by interactions of intrinsic and extrinsic microbes[J].Appl Environ Microbiol,2016,82(2):422-430.
[7] 张艳,杜海,吴群,等.酱香型白酒发酵中两株主要乳酸菌对酿造微生物群体的影响[J].微生物学通报,2015,42(11):2 087-2 097.
[8] 汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2000:48-49.
[9] MO X L,FAN W L,XU Y.Changes in volatile compounds of Chinese rice wine wheat Qu during fermentation and storage[J].Journal of the Institute of Brewing,2009,115(4):300-307.
[10] 徐岩.基于风味导向技术的中国白酒微生物及其代谢调控研究[J].酿酒科技,2015,2:1-16.
[11] 徐岩,范文来,吴群,等.风味技术导向白酒酿造基础研究的进展[J].酿酒科技,2012,1:17-22.
[12] 胡帮超,刘国英,董琪.白酒酿造中功能性酵母菌的研究及应用[J].酿酒,2017,44(2):13-18.
[13] 黄永光.香型白酒酿造中Aspergillus hennebergii及其分泌酸性蛋白酶的研究[D].无锡:江南大学,2014.
[14] 吴群,陈笔,李勇,等.芝麻香型白酒酿造功能霉菌及其与酵母的相互作用[J].酿酒科技,2015,1:7-11.
[15] 刘宇驰,蒋英丽,邓皖玉,等.引入“酱香功能菌”概念探索酱香型白酒风味成因[J].酿酒科技,2009(12):47-41.
[16] 王世伟,王卿惠,芦利军,等.白酒酿造微生物多样性、酶系与风味物质形成的研究进展[J].农业生物技术学报,2017,25(12):2 038-2 051.
[17] 邵明凯,王海燕,徐岩,等.酱香型白酒发酵中酵母群落结构及其对风味组分的影响[J].微生物学通报,2014,41(12):2 466-2 473.
[18] 许焰.酱香型白酒酿造拜耳接合酵母风味代谢特征及机制分析[D].无锡:江南大学,2017.
[19] KONG Yu,WU Q,ZHANG Y, et al.In Situ analysis of metabolic characteristics reveals the key yeast in the spontaneous and solid-state fermentation process of Chinese light-style liquor[J].Appl Environ Microbiol,2014,80(12):3 667-3 676.
[20] 王丹丹.白酒发酵过程中酶系与物系的相关性研究[D].北京:北京理工大学,2015.
[21] 杨洁,丁明珠,李炳志,等.乙醇发酵过程中酿酒酵母的磷脂组变化[J].化工学报,2012,63(6):1 830-1 835.
[22] CIANI M,COMITINI F.Non-Saccharomyces wine yeasts have a promising role in biotechnological approaches to winemaking[J].Annals of Microbiology,2011,61(1):25-32.
[23] 唐洁,王海燕,徐岩.酿酒酵母和异常毕赤酵母混菌发酵对白酒液态发酵效率和风味物质的影响[J].微生物学通报,2012,39(7):921-930.
[24] 许赣荣,李凤琴,陈蕴,等.红曲霉桔霉素的检测方法及红曲霉产桔霉素的判别方法[J]. 微生物学通报,2004,31(3):16-20.
[25] 郑淼,岳红卫,钟其顶.白酒质量安全风险及其控制[J].食品科学技术报,2016,34(2):18-23.
[26] 张敏,杨玉珍,李擎,等.白酒中主要醇类和醛类代谢途径与饮用健康的分析研究[J].酿酒科技,2017,1:121-128.
[27] 张红.白云边小曲酒工艺和风味特征[J].酿酒,2013,40(4):46-49.
[28] VIANA F,GIL J V,VALLÉS S,et al.Increasing the levels of 2-phenylethyl acetate in wine through the use of a mixed culture of Hanseniaspora osmophila and Saccharomyces cerevisiae[J].International Journal of Food Microbiology,2009,135(1):68-74.
[29] S EZ J S,LOPES C A,KIRS V C,et al.Enhanced volatile phenols in wine fermented with Saccharomyces cerevisiae and spoiled with Pichia guilliermondii and Dekkera bruxellensis[J].Letters in Applied Microbiology,2010,51(2):170-176.
EZ J S,LOPES C A,KIRS V C,et al.Enhanced volatile phenols in wine fermented with Saccharomyces cerevisiae and spoiled with Pichia guilliermondii and Dekkera bruxellensis[J].Letters in Applied Microbiology,2010,51(2):170-176.
[30] BADER J,MAST-GERLACH E,POPOVIC M K,et al.Relevance of microbial coculture fermentations in biotechnology[J].Journal of Applied Microbiology,2010,109(2):371-387.
[31] CIANI M,COMITINI F,MANNAZZU I,et al.Controlled mixed culture fermentation: a new perspective on the use of non-Saccharomyces yeasts in winemaking[J].Fems Yeast Research,2010,10(2):123-133.