酸肉是流行于贵州、重庆、湖南、广西及江西等一带少数民族地区的一种特色发酵肉制品,具有酸香浓郁、易于消化等特点[1]。其多为家庭手工作坊生产,以持续发酵作为保藏方式,食用周期多达半年以上。由于长时间处于一定微生物和酸的条件下,使酸肉成为一个动态体系,酸肉的风味、营养及安全都会发生相关变化。
近年来,对肉制品品质的研究不再局限于通过物理品质、感官品质或微生物安全的评价,许多研究者开始从蛋白质和脂肪的理化性质和结构特性的变化角度出发,更深层次地研究原料肉在加工过程中品质的形成和劣变相关机理。蛋白质作为肉类的重要组成成分,其在加工贮藏过程中发生的氧化、降解及结构改变等理化变化对肉制品品质起着关键性作用。其中,蛋白质的降解最重要且对最终产品感官特性影响显著[2]。一方面,蛋白质在组织蛋白酶和微生物胞外蛋白酶作用下发生降解,生成小肽、游离氨基酸,甚至酮酸、胺和醛等风味物质或风味前体物[3-4],在一定程度上有利于风味的发展和促进产品的消化吸收[5]。另一方面,蛋白质的持续降解可能会导致产品产生金属味、苦涩味、酸涩味,加速产品腐败。此外,加工过程中蛋白质也容易发生氧化修饰,适当的氧化有利于风味的形成和蛋白消化率的提高,而严重的蛋白氧化引起的疏水性变化、羰基化及交联聚集则可能会导致消化率下降[6]。对发酵食品而言,发酵既是一种加工方法也是一种食物保藏方法,不但延长了产品的货架期,还促进风味和营养价值的提升[7]。而肉类在发酵过程中牵涉了许多复杂的物理、生物化学和微生物的变化,主要包括:pH值降低、微生物区系的改变、亚硝酸盐还原及亚硝基血红蛋白生成、肌浆蛋白和肌原纤维蛋白溶解度的改变、蛋白组成的变化、酸化及蛋白凝胶化等[7-8]。这些变化与发酵时间、发酵剂、温度及辅料(如盐)添加量等密切相关。然而,目前关于酸肉发酵过程中蛋白质的变化这方面的报道相对较少且不够深入[9]。
该文从蛋白质降解和聚集角度考察酸肉在长时间发酵过程中蛋白质的基本变化规律,旨在为酸肉在长时间发酵过程中有关蛋白质的变化及对酸肉蛋白质营养价值的影响提供依据,为合理控制发酵时间,以及何时食用提供有关蛋白质变化的支持。
1 材料与方法
1.1 实验材料
新鲜猪里脊(背最长肌)、湖北大米及加碘食用盐,重庆北碚天生路永辉超市。大米炒至微黄后,粉碎机粉碎后过20目筛,备用。
1.2 主要试剂
尿素、NaOH、十二烷基硫酸钠(SDS)、NaCl、三氯乙酸、KCl、乙二胺四乙酸二钠(EDTA)、NaH2PO4、KH2PO4、β-巯基乙醇、茚三酮、考马斯亮蓝R-250等化学试剂,均为分析纯;SDS-PAGE凝胶配制试剂盒,碧云天生物技术有限公司。
1.3 主要仪器与设备
UV-2450紫外分光光度计,日本岛津公司;ZEN3690马尔文激光粒度仪,英国马尔文仪器公司;Bio-Rad电泳仪,伯乐生命医学产品(上海)有限公司;JSM-6510LV钨灯丝扫描电子显微镜,日本电子株式会社(JEOL)。
1.4 实验方法
1.4.1 酸肉制备及处理
新鲜猪肉,洗净沥干,切成约3 cm×5 cm×0.5 cm薄片,按m(原料肉)∶m(米粉)∶m(食盐)=85∶10∶5加入配料,揉制数分钟装坛,并用新鲜粽叶压紧塞住发酵坛口,倒置,水密封,后于20~25 ℃发酵。分别于发酵第0,20,50,80,110,140,180天取样分析。
1.4.2 非蛋白氮的测定
参照廖定容[10]的方法,刷掉附在酸肉表面的米粉并剔除可见脂肪和筋膜,称取绞碎的肉样10 g于锥形瓶中,加入90 mL蒸馏水,室温振摇40 min,过滤后取25 mL滤液,加入25 mL质量分数为10%的TCA溶液。再次过滤后取10 mL滤液消化,采用凯氏定氮法测定非蛋白氮含量。
1.4.3 蛋白质组成分析
(1)蛋白质组成:参照SUN等[11]的方法。称取绞碎肉样4 g,加入10倍提取液A(15.6 mmol/L Na2HPO4,3.5 mmol/L KH2PO4),冰浴中以10 000 r/min高速匀浆1 min,接着将匀浆液冷冻离心(7 500×g,15 min),该步骤重复2次,收集上清液和沉淀。①上清液部分:加入50%TCA使上清液TCA终浓度为10%,以7 500×g冷冻离心15 min,所得沉淀为肌浆蛋白。②沉淀部分:加入10倍提取液B(0.45 mmol/L KCl,15.6 mmol/L Na2HPO4,3.5 mmol/L KH2PO4),以10 000 r/min匀浆1 min,将匀浆液离心(7 500×g,15 min),此提取步骤重复1次,合并上清液,即得肌原纤维蛋白。此次得到的沉淀作如下处理:用10倍体积的0.1 mol/L NaOH振荡提取4 h,离心,上清液为碱溶蛋白,沉淀为肌基质蛋白。碱溶蛋白和肌原纤维蛋白含量采用双缩脲法测定,肌浆蛋白和肌基质蛋白经冻干后采用凯氏定氮法测定。
(2)蛋白质SDS-PAGE:按SDS-PAGE凝胶配制试剂盒说明配制10%的分离胶,5%的浓缩胶。电泳测试条件:刚开始采用15 mA恒流,至分离胶时换成25 mA恒流,当溴酚蓝指示条带靠近分离胶底部时立刻终止操作。取下电泳胶块,放入染色液[0.25%考马斯亮蓝,V(甲醇)∶V(冰醋酸)∶V(蒸馏水)=45∶10∶45]中染色1 h,随后转入脱色液[V(甲醇)∶V(冰醋酸)∶V(蒸馏水)=25∶10∶65]中摇床脱色至凝胶底色脱尽。
1.4.4 蛋白质聚集分析
(1)蛋白质浊度:肌浆蛋白浊度测定参照吴满刚[12]的方法,肌原纤维蛋白质浊度参照许艳顺[13]的方法。先将蛋白用1.4.2对应的提取液稀释至1 mg/mL,肌浆蛋白做如下处理:在25 ℃放置20 min后,340 nm处测定吸光度。肌原纤维蛋白处理如下:取1 mL肌原纤维蛋白溶液(1 mg/mL)加入4 mL内含不同浓度尿素(0、1.875、10 mol/L) 的0.6 mol/L NaCl溶液,调整其最终浓度为0.2 mg/mL,尿素浓度分别为0、1.5、8 mol/L。涡旋混合均匀后,室温静置15 min,分别于350 nm处测定吸光值(OD350)。
(2)蛋白质粒径:参考李学鹏等[14]的方法。采用马尔文激光粒度仪测定肌浆蛋白、肌原纤维蛋白和碱溶蛋白的粒径。提取的各种蛋白溶液磁力搅拌30 min后用4层纱布过滤除去不溶性物质,将蛋白质浓度调整至5 mg/L。参数设定:扫描角度90 ℃,温度25 ℃。
1.4.5 肌肉微观结构观察
参考WATTANACHANT等[15]的方法制样并略作修改。将肉样切成0.5 cm×0.5 cm×0.5 cm的规格,在含有质量分数为2.5%戊二醛的磷酸盐缓冲液(0.1 mol/L,pH=7.2)中4 ℃固定24 h,再将样品切成2 mm×2 mm×2 mm的规格,接着用磷酸盐缓冲液(0.1 mol/L,pH=7.2)清洗,再接着用30%,50%,70%,80%,95%,100%乙醇逐级脱水(每级1 h)。经液氮冷冻后放入冷冻干燥机中干燥,将干燥样品喷金,扫描电镜下观察结果。
1.4.6 蛋白质体外消化率
参照LI等[16]的方法并略微修改,用消化后的蛋白质含量占消化前蛋白质含量的百分比表示。胃蛋白酶消化率处理如下:准确称取肉样(2.0 g),加入8 mL PBS(10 mmol/L NaH2PO4-Na2HPO4,pH 7.0)并在4 ℃下均质(2×30 s,9 500×g;2×30 s,13 500×g),用1 mol/L HCl将匀浆液pH值调至2.0,并以1∶31.25的质量比(以肉样为质量基位)添加胃蛋白酶,混合反应液于37 ℃恒温水浴2 h(每隔10 min摇匀1次),然后用1 mol/L NaOH将pH值调至7.5以灭酶结束反应。胃蛋白酶+胰蛋白酶体外消化率处理如下:在前述胃蛋白酶消化基础上,接着再以1∶50的质量比(以肉样为质量基位)添加胰蛋白酶,继续将混合物于37 ℃水浴反应2 h,接着用95 ℃水浴加热5 min灭酶终止反应。加入3倍体积的乙醇以沉淀反应体系中未被消化的蛋白质,4 ℃放置12 h后于4 ℃条件下以10 000×g离心20 min,弃上清,将沉淀中的乙醇挥发完全,采用凯氏定氮法测定沉淀的蛋白含量。按下列公式计算蛋白消化率:
消化率![]()
式中:W0为未消化的蛋白质含量;W1为经酶消化后的蛋白质含量。
1.5 数据处理
结果以平均值±标准差表示,采用Origin 8.6作图,SPSS 22.0进行单因素方差分析和相关性分析。p<0.01表示极显著,p<0.05表示显著。
2 结果与分析
2.1 发酵过程中非蛋白氮(NPN)含量的变化
如图1所示,发酵0~80 d期间NPN含量不断增长(p<0.05),由13.96 mg/g上升至23.25 mg/g,随着发酵的继续NPN含量则继续缓慢增加,说明发酵过程中蛋白质一直处于被水解状态。该变化趋势与马艳梅等[17]对火腿的研究、HU等[18]对鱼糜、香肠的研究结果相似。有研究报道,NPN的含量发生变化可能是由一些微生物或内源性蛋白酶将蛋白氮转变为NPN造成的,也可能是环境中较低的pH值诱导蛋白结构改变,进而促进NPN含量升高[19]。
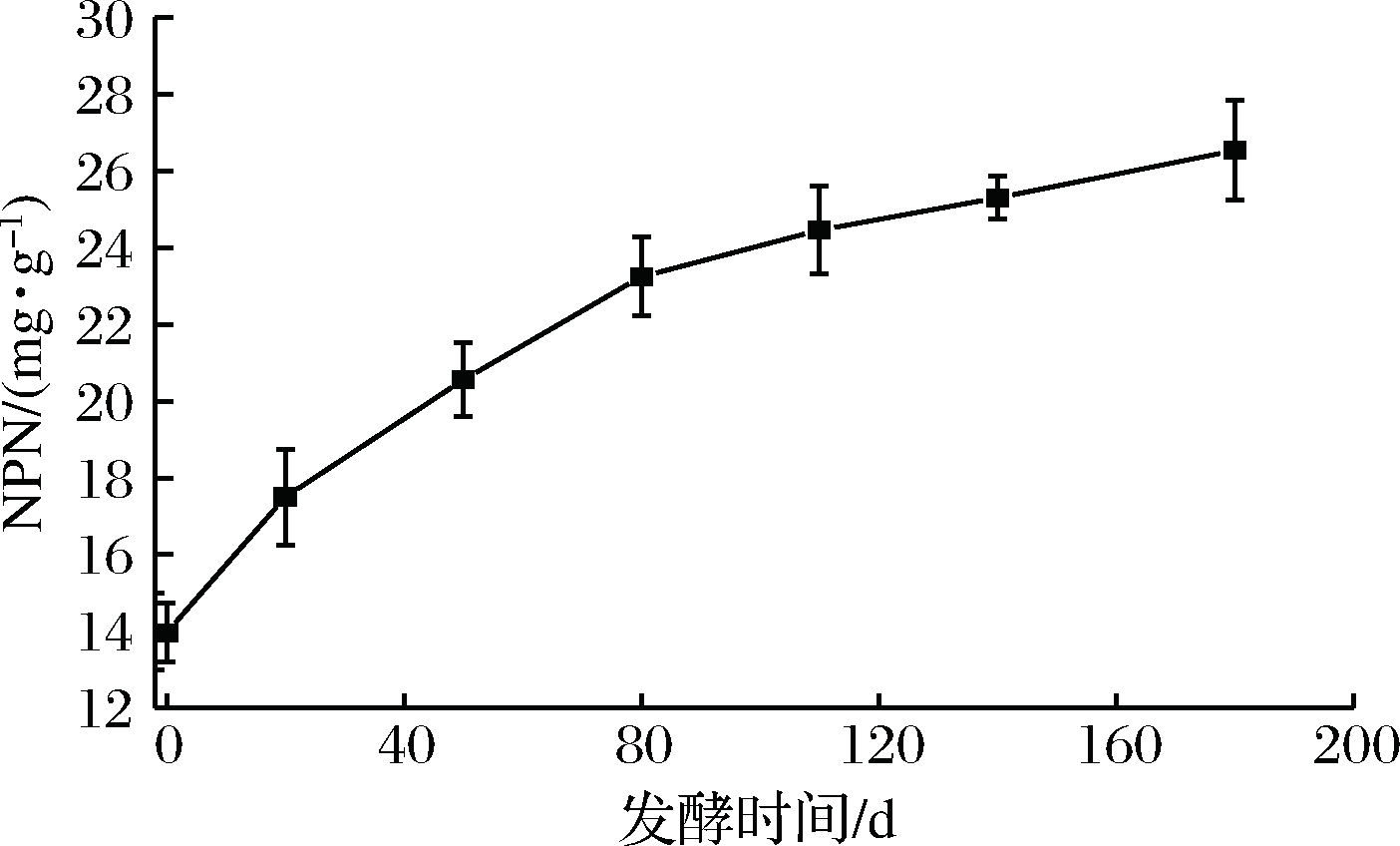
图1 发酵过程中非蛋白氮含量的变化
Fig.1 Changes in non-protein nitrogen content during fermentation
2.2 酸肉发酵过程中蛋白质的变化
2.2.1 酸肉发酵过程中蛋白质组成变化
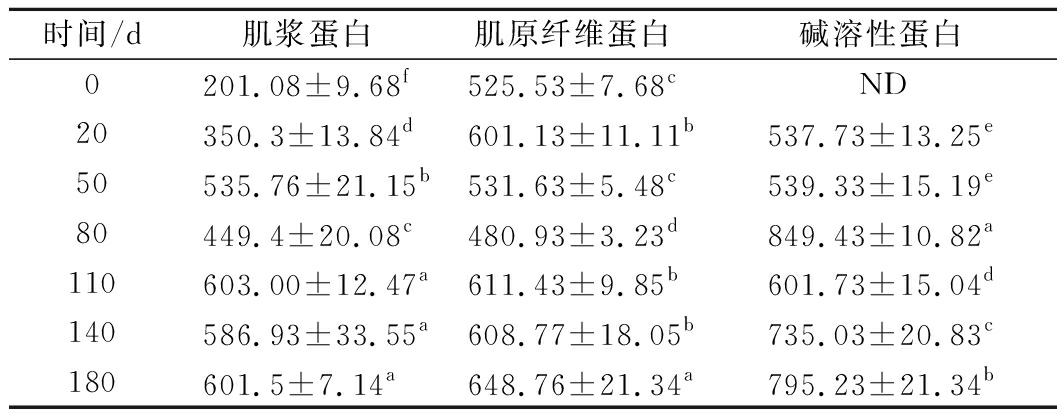
不同发酵时段酸肉的蛋白组成变化如图2,发酵0 d时肌原纤维蛋白含量最高,约占总蛋白的60.45%,其次是肌浆蛋白约占35.68%,而碱溶蛋白和肌基质蛋白含量相对较少,分别约占总蛋白的4.8%和2.3%。随着发酵时间的延长,肌浆蛋白和肌原纤维蛋白含量显著降低,而碱溶蛋白显著增加(p<0.05),特别是发酵前期20 d的含量变化最为明显,肌浆蛋白和肌原纤维蛋白分别降至发酵0 d时的59.28%和58.20%,碱溶蛋白增至发酵0 d的6.92倍;发酵180 d时,肌浆蛋白和肌原纤维蛋白分别为发酵0 d时的27.21%和21.19%,碱溶蛋白为发酵0 d时的8.76倍,而肌基质蛋白含量在整个发酵过程中变化不大。肌浆蛋白和肌原纤维蛋白含量的减少可能与发酵过程中pH值降低(产酸)导致其发生变性聚集[20-21],使其盐溶性下降而变成了可溶于碱性溶液的蛋白有关。其次,在肌肉内源酶和微生物胞外酶共同作用下发生降解,生成了肽和游离氨基酸等物质。该变化趋势与孙为正[22]、VISESSANGUAN等[23]、许艳顺等[13]对相关发酵肉制品的研究报道相似。

图2 酸肉蛋白质组成在发酵中的变化
Fig.2 Changes in protein composition of sour meat during fermentation
2.2.2 不同发酵时段酸肉蛋白SDS-PAGE电泳分析
SDS-PAGE结果如图3。从肌浆蛋白电泳图谱(A)可知,发酵0 d肌浆蛋白分子量主要分布在14~180 kDa之间。具体来说,20 d时约100、63 kDa蛋白条带消失;发酵20、50和80 d时,48、45和30 kDa的蛋白条带无明显变化,但相对0 d均变得很浅,而在110 d后,这些蛋白条带几乎完全消失;14.4~25 kDa蛋白条带均在发酵80 d后消失;约66.2 kDa和60 kDa附近的蛋白条带无明显变化。值得注意的是,在发酵0 d时约30~35 kDa有4条蛋白条细带,发酵20 d变为2条宽带,110 d后只剩下一条颜色较深的宽带,推测可能由于发酵产酸导致该区间的蛋白质变性聚集或是发生持续降解所致。总之,随着发酵时间的延长,肌浆蛋白电泳图出现蛋白条带逐渐变浅或消失,说明了肌浆蛋白发生了降解或变性聚集,也说明了其含量不断降低。

图3 酸肉各蛋白组分电泳图
Fig.3 SDS-PAGE electrophoretograms of sarcoplacmic
proteins(A), myofibrillar proteins(B), alkali-soluble proteins(C)
肌原纤维蛋白的特征条带可归属为肌球蛋白重链(MHC,200 kDa)、α-辅助激动蛋白(94 kDa),原肌球蛋白(80 kDa)、肌钙蛋白(75 kDa),肌动蛋白(45 kDa)、肌球轻链(20 kDa)。由肌原纤维蛋白电泳图(图3-B)看出,与0 d相比,发酵20 d时MHC和肌动蛋白条带明显变细且颜色变浅,50 d时基本消失,说明MHC和肌动蛋白在发酵过程中其含量在不断减少;约66.2~180 kDa区域的蛋白条带在20~80 d时有的颜色变浅,有的发生消失并在附近生成了新的条带,而在110 d后则变成色深、带宽而清晰的3条蛋白条带(116、75和66.2 kDa)。63 kDa处的条带颜色先加深,110 d时再次加深,说明其是肌原纤维蛋白中大分子蛋白的主要降解产物之一。约35 kDa处蛋白条带在发酵20 d后颜色加深,50 d后变成了带宽而色深的蛋白条带,并发现其在整个发酵阶段的变化趋势与肌动蛋白相反,因此推断肌动蛋白可能降解成了约35 kDa的蛋白质分子。其他一些发酵肉制品的肌原纤维电泳图谱均显示MHC和肌动蛋白条带逐渐变浅至消失的现象[22]。对酸肉而言,最有可能是乳酸菌产酸和添加的质量分数为5%食盐的渗透直接或间接影响蛋白质降解或变性所致,如张平等[24]研究发现,食盐能促进大分子蛋白(>180kDa)降解,且在贮藏后期也发现许多蛋白条带的消失现象。此外,从整体看,各发酵时段蛋白条带变化明显,其中50、80 d的条带较相似,110、140、180 d图谱基本一致,尤其发酵110 d后出现许多蛋白条带的消失并生成宽而深的条带,可能由于肌原纤维蛋白进一步降解,同时部分小分子蛋白重新聚合而成大分子蛋白引起的。此外,也可能由于此时蛋白严重变性引起溶解度改变,导致某些分子量蛋白不易被提取出来。
碱溶性蛋白电泳图(图3-C)显示其最初主要是由200 kDa和45 kDa构成。发酵20 d后,这2种蛋白条带颜色明显减弱直至消失,说明此时碱溶性蛋白发生了一定程度的降解。与此同时,约135、35、30 kDa有新条带产生。同样,14.4 kDa处有新条带生成,说明碱溶性蛋白中的大分子降解产生了一些小分子蛋白片段。此外,高于245 kDa区域内的蛋白片段在发酵80 d时明显增多,可能由于部分蛋白通过自由基键合作用,相互连接生成了大分子蛋白聚集体而堆积在分离胶顶部[25]。此外,碱溶性蛋白的部分条带如200、45kDa处的条带与肌原纤维蛋白的变化有一定相似性,说明肌原纤维蛋白变性是引起碱溶性蛋白含量上升的原因之一。
2.3 酸肉发酵过程中的蛋白质聚集情况分析
2.3.1 蛋白质浊度的变化
蛋白质浊度在一定程度上可以反映蛋白质的聚集情况,其值越大,说明聚集程度越大。由图4可知,肌浆蛋白吸光值在发酵过程中呈现波动上升的趋势,可能的原因是肌浆蛋白在发酵过程中存在不断聚合以及聚合蛋白体又被解离降解有关。而其他发酵阶段的肌浆蛋白的浊度值均高于0 d时,说明其结构发生了改变,这可能与疏水基团过度暴露,蛋白发生疏水聚集有关[12]。
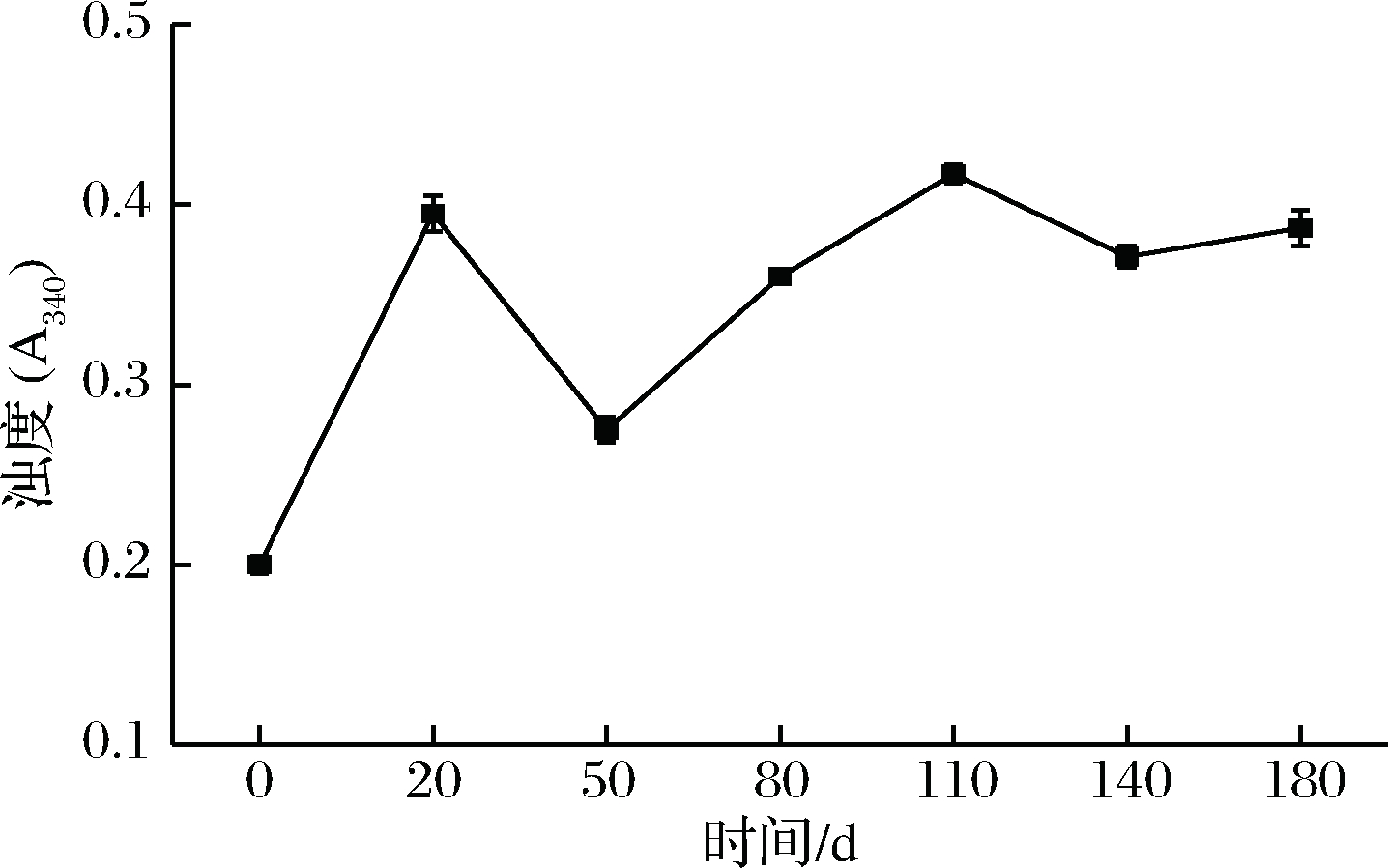
图4 发酵过程中肌浆蛋白浊度的变化
Fig.4 Changes in turbidity of sarcoplasmic protein during fermentation
1.5 mol/L的尿素(urea)能够打破分子间或分子内的氢键,8 mol/L的尿素则能够打破氢键及破坏疏水作用。肌原纤维蛋白在含有不同浓度尿素的0.6 mol/L NaCl溶液中的浊度变化如图5。在不含尿素的0.6 mol/L NaCl溶液中,肌原纤维蛋白浊度呈快速上升后保持稳定略升的趋势,在发酵110 d达峰值;在1.5 mol/L尿素溶液中呈逐渐增加后保持稳定略降的趋势,在发酵80 d时达峰值,但是其浊度值均低于在0.6 mol/L NaCl的浊度值;在浓度为8 mol/L尿素溶液中时,浊度值呈略降后缓慢上升趋势,且各发酵阶段的浊度值均低于低浓度尿素处理时的浊度,说明肌原纤维蛋白在NaCl溶液中浊度的增加与氢键和疏水作用有关,也说明发酵可使酸肉蛋白之间的疏水相互作用增强从而引起蛋白发生疏水聚集。该结果与许艳顺[13]报道类似。

图5 发酵过程中肌原纤维蛋白浊度的变化
Fig.5 Changes in turbidity of myofibrillar proteins during fermentation
2.3.2 蛋白质粒径的变化
各发酵时段蛋白组分平均粒径变化如表1。与发酵0 d相比,肌浆蛋白平均粒径显著增加(p<0.05),发酵180 d时粒径为发酵0 d的2.99倍,峰值粒径出现在发酵110 d。肌原纤维蛋白在发酵中粒径呈波动变化,峰值粒径出现在发酵180 d,为发酵0 d的1.24倍。碱溶性蛋白平均粒径呈先快速增加后波动变化。这说明发酵后酸肉蛋白发生变性导致蛋白聚集体形成,也印证了浊度增加的原因。而各种波动性的变化主要与蛋白质降解、蛋白聚集体的不断形成和解离有关。这些变化最终都会导致酸肉微观结构和蛋白质营养特性发生改变。
表1 发酵过程中酸肉蛋白平均粒径的变化单位:nm
Table 1 Changes in average size of sour meat proteinduring fermentation
注:结果以均值±标准差表示,n=3,同一行数据不同字母表示显著性差异(p<0.05);ND表示未检出。
2.4 发酵酸肉微观结构变化
观察酸肉SEM结果可知(图6),发酵0 d时肌纤维束结构完整、排列紧密、肌束间界限分明且空隙较小、纹理清晰。

A-G依次代表发酵0,20,50,80,110,140,180 d样品图;
箭头a-肌纤维束;箭头b-肌束间隙
图6 不同发酵时段酸肉的横截面微观结构图
(×250倍)
Fig.6 SEM of sour meat during different fermentation time
发酵20 d时,酸肉组织结构完整性遭到轻度破坏、肌纤维明显收缩、结构开始变得疏松、肌内膜开始破裂、肌束间隙略微增大。发酵20~80 d,肌纤维排列更加混乱、肌束间隙更加明显、肌纤维边界更加模糊并伴有明显的断裂等。发酵80 d之后,可能由于蛋白的进一步降解及凝胶化加剧,导致肌束膜被严重破坏,进而导致部分肌纤维束发生崩塌使它们相互黏成一块,肌肉横截面纹理也变得很不规则。其中,肌内膜有保持肌肉的完整性、阻止肌纤维遭到损伤的作用,其破裂可导致致密的结构破损和营养成分的流失。樊明明[26]报道发酵后的肉脯肌原纤维结构遭到严重破坏,认为是发酵剂分泌的蛋白酶促进了肌纤维间连接蛋白和小蛋白水解所致,并推测如果发酵继续,肉脯蛋白会进一步水解,纤维间的间隙和空洞会变得更大。
2.5 发酵时长对酸肉蛋白质体外消化率的影响
不同发酵时段酸肉蛋白质的体外消化率如图7。无论是单独使用胃蛋白酶还是胃蛋白结合胰蛋白酶处理,消化率均高于发酵0 d,说明发酵能够在一定程度上促进蛋白质消化性提高。单独使用胃蛋白酶时,发酵前50 d蛋白消化率显著升高(p<0.05)并于50 d达到峰值,但随着发酵时间延长,消化率逐渐下降,其中发酵50~110 d消化率无显著性差异(p>0.05)。采用胃蛋白酶+胰蛋白酶消化时,各阶段消化率差异显著(p<0.05),在发酵前80 d蛋白质消化率显著升高,随着发酵的继续,消化率略微下降。这些结果表明,发酵明显影响了肌肉蛋白对消化酶的水解敏感性,发酵过程中蛋白质适度变性使其暴露出更多消化酶作用位点,从而促进消化率提高。长时间发酵可能由于蛋白质较高水平的氧化和聚集,消化酶作用位点被掩埋导致消化率降低[27]。此外,胃蛋白酶和胰蛋白酶都有固定的作用位点,当作用位点的氨基酸被氧化后,消化率下降[6]。
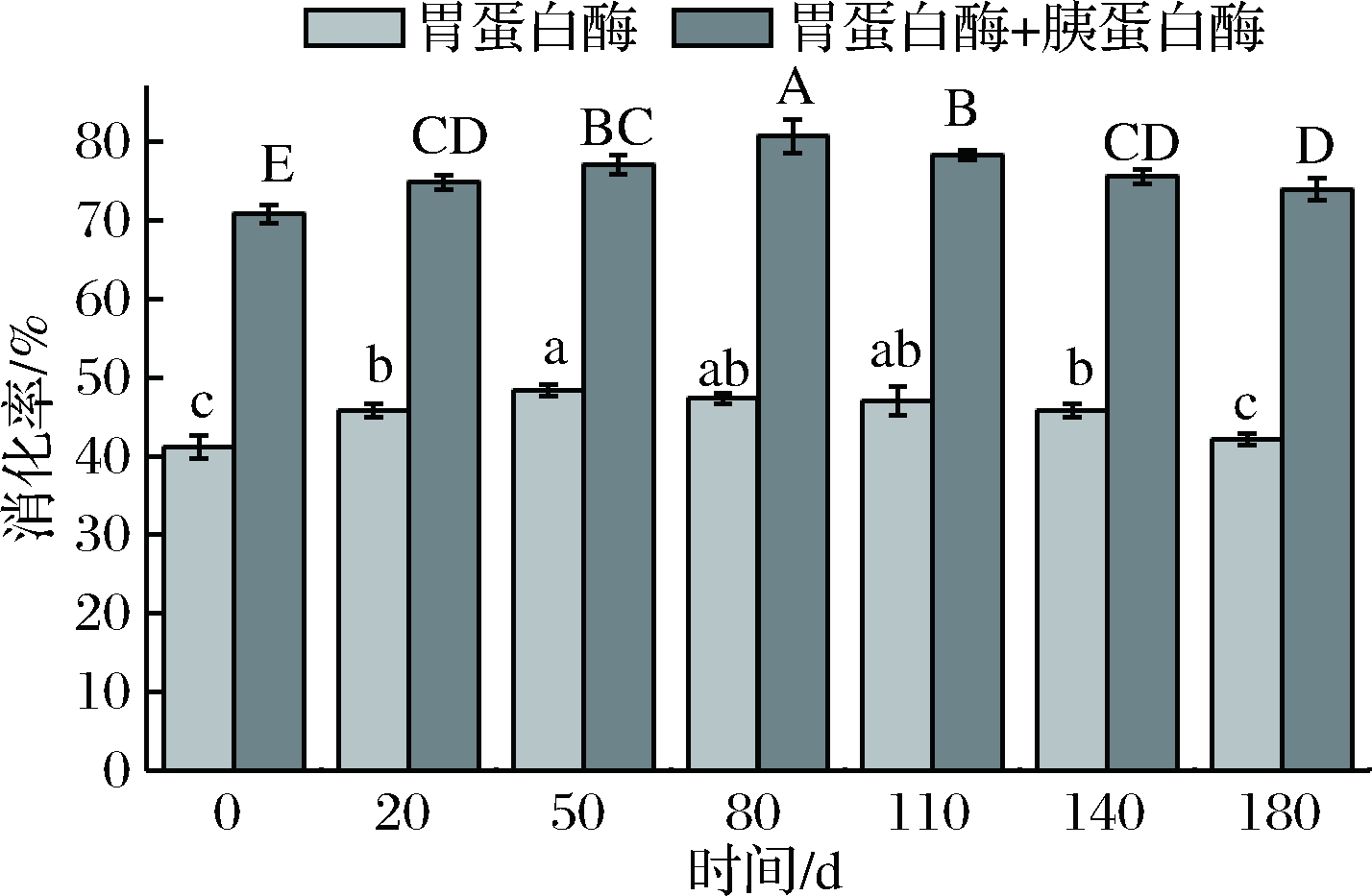
图7 不同发酵保藏时段酸肉蛋白质的消化率变化
Fig.7 Changes in vitro digestibility of sour meat protein during fermentation
注:不同小写字母表示胃蛋白酶体外消化率差异显著;不同大写字母表示胃蛋白酶+胰蛋白酶体外消化率差异显著(p<0.05)。
2.6 蛋白质变化及与体外消化率的相关性分析
由表2可知,蛋白组分间均呈较好的相关性(p<0.01)。其中肌浆蛋白、肌原纤维蛋白与碱溶性蛋白呈极显著负相关(p<0.01),表明发酵后酸肉中肌浆蛋白和肌原纤维蛋白部分发生变性,进而生成碱溶性蛋白。由体外消化率与蛋白组分相关性分析可知,胃蛋白酶体外消化率与碱溶性蛋白存在极显著正相关(p<0.01),而胃蛋白酶+胰蛋白酶体外消化率与肌浆蛋白、肌原纤维蛋白、碱溶性蛋白极显著相关(p<0.01)。通常认为蛋白质适度变性和降解可在一定程度上促进产品消化率和较好滋味的形成,但过度氧化聚集或降解则会对消化率或滋味等品质产生消极影响,如大量小肽的累积反而会导致产品滋味变差[28]。
表2 发酵过程中蛋白质的变化及与消化性的相关性分析
Table 2 Correlation analysis between changes of proteinand digestion during fermentation
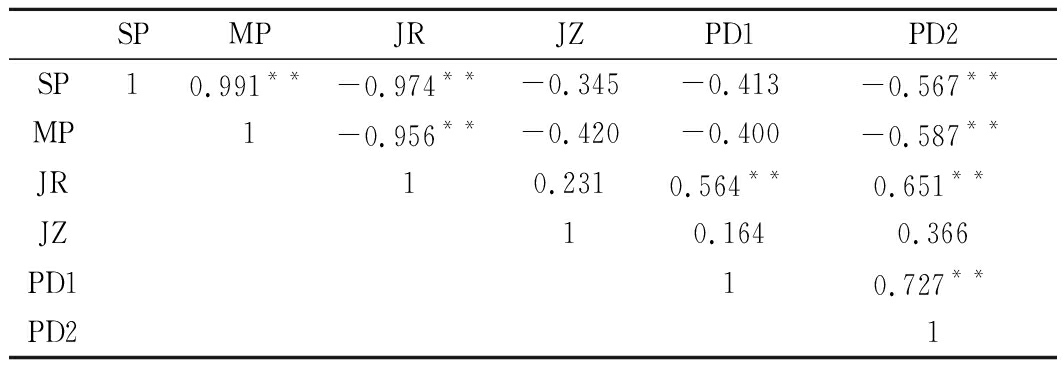
注:*表示相关性在 0.05 水平上显著(双侧);**表示相关性在 0.01 水平上显著(双侧)。SP:肌浆蛋白;MP:肌原纤维蛋白;JR:碱溶蛋白;JZ:肌基质蛋白;PD1:胃蛋白酶消化率;PD2:胃蛋白酶+胰蛋白酶消化率。
3 结论
本文研究了酸猪肉在长时间发酵中蛋白质降解及聚集变化,以及肌肉微观结构和蛋白质体外消化情况,发现长时间发酵使蛋白组分显著变化,其中肌浆蛋白和肌原纤维蛋白含量均随发酵时间延长不断减少,碱溶性蛋白则不断增加并在发酵20 d时成为酸肉中主要的蛋白组成分,同时非蛋白氮含量呈不断增长趋势。SDS-PAGE图谱显示,随着发酵进行,肌浆蛋白和肌原纤维蛋白的蛋白条带数不断减少或直至消失,尤其发酵110 d后条带数最少,但有宽而深的条带产生,说明发酵过程中蛋白不断发生降解并可能有蛋白聚集体形成。碱溶蛋白某些蛋白条带变化趋势与肌原纤维蛋白相似,说明肌原纤维蛋白变性是导致碱溶性蛋白含量增加的主要原因。发酵20 d后肌浆蛋白和肌原纤维蛋白浊度增加,两者及碱溶蛋白平均粒径也有所增加并在发酵过程中呈波动变化,说明蛋白在发酵过程中发生了聚集,但聚集体又不断被分解。这些结果表明,发酵过程中蛋白的变性聚集并未阻止蛋白的持续降解。肌肉微观结构显示,肌原纤维结构完整性明显受到破坏,尤其到中期后可能由于蛋白的进一步降解及凝胶化加剧,导致肌束膜被严重破坏。此外,体外消化实验显示发酵在一定程度上促进蛋白质消化率,但在发酵后期,可能由于大量蛋白聚集体的形成淹没了蛋白酶作用位点,导致体外消化率降低,表明长时间发酵保藏酸肉可影响蛋白质消化率。从本研究结果观察酸肉以发酵50~80 d为宜。
参考文献
[1] 叶春,马顺强,张倩,等. 酸肉肽抗氧化活性的研究[J]. 食品科学, 2010,31(7):94-97.
[2] GARRIDO R, DOM NGUEZ R, LORENZO J M, et al. Effect of the length of salting time on the proteolytic changes in dry-cured lacón during ripening and on the sensory characteristics of the final product[J]. Food Control, 2012,25(2):789-796.
NGUEZ R, LORENZO J M, et al. Effect of the length of salting time on the proteolytic changes in dry-cured lacón during ripening and on the sensory characteristics of the final product[J]. Food Control, 2012,25(2):789-796.
![]() P,
P, ![]() T,
T, ![]() L, et al. Proteolysis and biogenic amines formation during the ripening of Petrovská klobása, traditional dry-fermented sausage from Northern Serbia[J]. Food Control, 2013,30(1):69-75.
L, et al. Proteolysis and biogenic amines formation during the ripening of Petrovská klobása, traditional dry-fermented sausage from Northern Serbia[J]. Food Control, 2013,30(1):69-75.
[4] 耿翠竹,王海滨,崔莹莹,等. 蛋白质降解对猪肉制品品质影响的研究进展[J]. 肉类研究, 2016,30(2):35-39.
[5] 陈好春,周兴虎,康大成,等. 风味蛋白酶对腌腊鸡腿蛋白质降解、抗氧化能力和感官品质的影响[J]. 食品与发酵工业, 2016,42(7):128-134.
[6] SANTELHOUTELLIER V, LAURENT AUBRY A, GATELLIER P. Effect of oxidation on in vitro digestibility of skeletal muscle myofibrillar proteins[J]. Journal of Agricultural & Food Chemistry, 2007,55(13):5 343.
[7] KUMAR P, CHATLI M K, VERMA A K, et al. Quality, functionality, and shelf life of fermented meat and meat products: A review[J]. Critical Reviews in Food Science and Nutrition, 2017,57(13):2 844-2 856.
[8] CASABURI A, DIMONACO R, CAVELLA S, et al. Proteolytic and lipolytic starter cultures and their effect on traditional fermented sausages ripening and sensory traits[J]. Food Microbiology, 2008,25(2):335-347.
[9] 李成龙,袁军,刘淑贞,等. 米粉及食盐添加量对发酵酸肉蛋白质降解及γ-氨基丁酸形成的影响[J]. 食品科学, 2015,36(13):202-206.
[10] 廖定容,姚伟伟,帅谨,等. 雅安罐罐肉加工与贮藏过程中肌肉蛋白质的变化[J]. 食品与发酵工业, 2013,39(5):207-212.
[11] SUN W, CUI C, ZHAO M, et al. Effects of composition and oxidation of proteins on their solubility, aggregation and proteolytic susceptibility during processing of Cantonese sausage[J]. Food Chemistry, 2011,124(1):336-341.
[12] 吴满刚,吴雪燕,于海,等. 中式香肠风干过程中蛋白氧化对蛋白聚集、水解性及溶解性的影响[J]. 食品与发酵工业, 2014,40(7):193-198.
[13] 许艳顺. 发酵鲢鱼鱼糜凝胶形成及其机理研究[D]. 无锡:江南大学, 2010.
[14] 李学鹏,周凯,周明言,等. 自由基氧化对大黄鱼肌原纤维蛋白交联和聚集的影响[J]. 中国食品学报, 2015,15(4):13-21.
[15] WATTANACHANT S, BENJAKUL S, LEDWARD D A. Effect of heat treatment on changes in texture, structure and properties of Thai indigenous chicken muscle[J]. Food Chemistry, 2005,93(2):337-348.
[16] LI L, LIU Y, ZOU X Y, et al. In vitro protein digestibility of pork products is affected by the method of processing[J]. Food Research International, 2017,92:88-94.
[17] 马艳梅,卢士玲,李开雄,等. 羊肉火腿加工过程中蛋白质的降解[J]. 食品与发酵工业, 2014,40(4):238-242.
[18] HU Y, XIA W S, GE C R. Characterization of fermented silver carp sausages inoculated with mixed starter culture[J]. LWT-Food Science and Technology, 2008,41(4):730-738.
[19] KLEMENT J T, CASSENS R G, FENNEMA O R. The association of protein solubility with physical properties in a fermented sausage[J]. Journal of Food Science, 1973,38(7):1 128-1 131.
[20] VENUGOPAL V, DOKE S N, NAIR P M. Gelation of shark myofibrillar proteins by weak organic acids[J]. Food Chemistry, 1994,50(2):185-190.
[21] CHAWLA S P, VENUGOPAL V, NAIR P M. Gelation of proteins from washed muscle to threadfin bream (Nemipterus japonicus) under mild acidic conditions.[J]. Journal of Food Science, 2010,61(2):362-367.
[22] 孙为正. 广式腊肠加工过程中脂质水解、蛋白质降解及风味成分变化研究[D]. 广州:华南理工大学, 2011.
[23] VISESSANGUAN W, BENJAKUL S, RIEBROY S, et al. Changes in composition and functional properties of proteins and their contributions to Nham characteristics[J]. Meat Science, 2004,66(3):579-588.
[24] 张平,杨勇,曹春廷,等. 食盐用量对四川腊肉加工及贮藏过程中肌肉蛋白质降解的影响[J]. 食品科学, 2014,35(23):67-72.
[25] 李学鹏,王祺,周凯,等. 丙烯醛氧化对大黄鱼肌肉组织和肌原纤维蛋白结构性质的影响[J]. 现代食品科技, 2014,30(10):1-7.
[26] 樊明明. 发酵工艺对猪肉脯食用品质影响研究[D]. 江南大学, 2015.
[27] BAX M L, AUBRY L, FERREIRA C, et al. Cooking temperature is a key determinant of in vitro meat protein digestion rate: investigation of underlying mechanisms[J]. Journal of Agricultural and Food Chemistry, 2012,60(10):2 569-2 576.
[28] 曾雪峰. 淡水鱼发酵对酸鱼品质影响的研究[D]. 无锡:江南大学, 2013.