木质纤维素乙醇生产的关键技术之一是开发能有效代谢其水解液中的多种糖(主要是葡萄糖和木糖)为乙醇的菌种[1]。但是,到目前为止,还没有任何一种天然的微生物能够将木质纤维素所有组成糖类转化为乙醇[2-3]。过去几十年,研究者们致力于开发能够利用葡萄糖和木糖进行乙醇发酵的单一菌株,在乙醇发酵性能优越的菌种(Saccharomyces cereviseae, Zymomonas mobilis)中引入木糖代谢途径,拓宽其底物利用范围;或者在能天然利用多种糖类的菌株中引入乙醇合成途径,已经开发的产乙醇重组菌主要包括重组Saccharomyces sp., Zymomonas sp.,Klebsiella sp.和E. coli[4-8]。但是由于葡萄糖阻遏效应,木糖的利用滞后于葡萄糖,单一菌株乙醇发酵过程中木糖和葡萄糖的同步利用问题没有得到很好解决[9-12]。此外,研究人员将利用不同糖类的不同微生物接种于同一体系进行共发酵,如S. cerevisiae和Pichia stipitis或Candida shehatae共发酵,Z. mobilis和Pachysolen tannophilus或P. stipitis共发酵,以同步利用葡萄糖和木糖合成乙醇[13-14]。但不同微生物共发酵工艺与操作较为复杂,难以实现其工业应用价值,因此基于同一亲本菌株的底物选择性菌株共发酵策略被成功用于乳酸、琥珀酸或乙醇发酵菌种改造[15-17]。
为此,本研究利用同一个E. coli亲本菌株构建了葡萄糖或木糖选择性代谢大肠杆菌,然后将携带Z. mobilis乙醇合成途径关键酶基因pdc和adhB的质粒pEtac-PA[18]转入2种底物选择性菌株,获得乙醇合成能力。通过发酵试验,研究2种产乙醇重组菌共发酵时同步利用木糖和葡萄糖合成乙醇的发酵性能。
1 材料与方法
1.1 菌株和质粒
本研究所用的菌株和质粒见表1。E. coli B0013-1031 (pta-ackA, ldhA, pflB, frdA, xylH)为亲本菌株,其中pta-ackA, ldhA, pflB和frdA基因在本研究室前期的研究中被删除[19-20],以阻断乙酸、乳酸、甲酸和琥珀酸的形成;该菌株中木糖主要运输载体XylFGH跨膜蛋白编码基因xylH天然缺失[21]。其他菌株为本研究构建。pMD18T-simple载体购自宝生物工程(大连)有限公司。携带Z. mobilis乙醇合成途径关键酶基因pdc和adhB的质粒pEtac-PA为作者前期构建并保藏[18]。pSK-EcdifGm[22]由本研究室前期构建并保存。pTH18Ks1-K12xylH′为作者前期构建并保藏[21],用于B0013-1031中天然缺失xylH的回复突变。
表1 本研究所用的菌株和质粒
Table 1 Strains and plasmids used in this study

注:xylH* 代表自然突变的xylH经同源重组回复突变为正常序列[21]。
1.2 培养基
LB培养基(5 g/L酵母粉, 10 g/L蛋白胨, 5 g/L NaCl)[24]作为菌株活化和培养的常规培养基。固体培养基添加15 g/L琼脂。必要时培养基中添加100 μg/mL氨苄青霉素(Amp)、30 μg/mL庆大霉素(Gm)或50 μg/mL卡那霉素(Km)。改良M9培养基[20-21]添加5 g/L葡萄糖或木糖,作为种子培养基;或用于底物选择性菌株选择培养;以及摇瓶发酵试验中细胞生长培养基;细胞生长结束,补加葡萄糖和木糖至各自终浓度为25 g/L,用于乙醇发酵。LB培养基和M9培养基均在121℃高压蒸汽灭菌15 min备用。500 g/L葡萄糖或木糖贮备液在115 ℃高压蒸汽灭菌20 min备用。
1.3 基因操作
除非特别说明,常见的各种分子操作按照标准操作方案进行[24]。xylH回复突变通过同源重组结合菌株筛选进行[21];根据前期本实验室建立的方法[20, 25],利用Red重组系统和Xer重组系统,对木糖异构酶编码基因xylA、IICBGlc编码基因ptsG、甘露糖PTS透过酶结构域IIDMan编码基因manZ和葡萄糖激酶编码基因glk进行删除,本研究所用的引物及其用途见表2。
表2 本研究所用的引物
Table 2 Primers used in this study

续表2

基本步骤为(1)目的基因删除突变盒的制备:以染色体DNA为模板,扩增出要删除的基因,PCR产物纯化后克隆入载体pMD18 T-simple中,获得重组质粒;以此为模板,反向PCR扩增含有目标基因上下游同源臂和载体的片段,并与dif-Gm-dif(1 kb)连接,获得重组质粒,以此制备突变盒xylA::dif-Gm、manZ::dif-Gm和glk::dif-Gm备用;突变盒ptsG::dif-Gm是实验室前期研究中按照类似方法构建完成[19];(2)遗传转化与突变株的筛选:将突变盒片段电转化入含有pKD46的目标菌株中,通过菌落PCR确认突变菌株,进一步通过传代消除Gm抗性基因和温度敏感型质粒pKD46。
1.4 培养试验和发酵试验
培养试验和发酵试验在500 mL三角瓶中进行,所有试验平行测定3次,结果取平均值。
从LB平板接种新鲜的单菌落至50 mL LB培养基,37 ℃、200 r/min振荡培养过夜。离心(4300 g, 10 min)收集细胞,用M9培养基洗涤、重悬,接种50 mL种子培养基,接种后的初始细胞密度为0.1(OD600),37 ℃、200 r/min振荡培养至细胞密度为2.0~2.5(OD600),离心收集细胞,用M9培养基重悬,接种含有5 g/L葡萄糖或木糖的细胞生长培养基或发酵培养基至最终体积为100 mL,初始细胞密度为0.1 (OD600)。单一菌株发酵试验及双菌株共发酵试验时,2种菌株的种子液均分别制备。除非特别说明,保持每个菌株接种的初始细胞密度为0.1 (OD600)。
发酵过程分为2个阶段,第一阶段为好氧细胞生长阶段,于37 ℃、200 r/min振荡培养12 h。第二阶段为厌氧发酵阶段,培养物于37 ℃静置发酵。转移间歇,补加葡萄糖和木糖至各自终浓度为25 g/L。发酵过程中定时取样分析细胞密度、底物葡萄糖/木糖浓度和产物乙醇浓度。
1.5 分析方法
采用UNICO UV2000分光光度计(尤尼柯(上海)仪器有限公司)测定600 nm的吸光度值(OD600, 1 cm光程)来监控培养过程的细胞密度。葡萄糖、木糖和乙醇含量采用HPLC方法测定[19, 21],色谱条件为: Shodex SH-1011色谱柱(Shodex SH-1011 H610009; Showa Denko K.K., Kawasaki, Japan)、示差检测器,柱温60 ℃,洗脱液为0.01 mol/L H2SO4,流速1.0 mL/min。
2 结果与讨论
2.1 葡萄糖/木糖选择性代谢大肠杆菌的构建
E. coli中木糖主要是通过高亲和力载体XylFGH运输进入细胞,然后通过磷酸戊糖途径进行分解代谢。木糖首先由木糖异构酶XylA催化,异构化形成木酮糖,然后由木酮糖激酶XylB催化形成木酮糖-5-磷酸[26-27]。删除B0013-1031中木糖异构酶编码基因xylA,获得了木糖不利用突变菌株E. coli B0013-2010。该菌株在以葡萄糖为唯一碳源的M9培养基上生长良好,而在以木糖为唯一碳源的M9培养基上不能生长。说明菌株B0013-2010中木糖利用途径被成功阻断。
通过同源重组方法,对B0013-1031中xylH的无义突变进行修复[21],获得回复突变株B0013-1031H。删除B0013-1031H中与葡萄糖摄取代谢相关的3个基因ptsG, manZ和glk[28-31],获得了木糖选择性利用菌株B0013-2011H。该菌株在以木糖为唯一碳源的M9培养基上正常生长,在以葡萄糖为唯一碳源的M9培养基上不能生长。可见删除ptsG、glk和manZ,B0013-2011H中葡萄糖利用途径被成功阻断。
2.2 葡萄糖/木糖选择性代谢大肠杆菌的生长特性
通过摇瓶培养试验,验证2种底物选择性菌株的生长特性。在以葡萄糖或木糖为唯一碳源的M9培养基中,接种后于37 ℃、200 r/min振荡培养12 h,B0013-2010利用葡萄糖生长,细胞密度达到5.08 (OD600);在木糖M9培养基中细胞密度维持初始值0.1 (OD600),基本不变(图1)。而B0013-2011H利用木糖生长至OD600为4.24,在葡萄糖M9培养基中细胞密度基本维持在初始值不变(图1)。
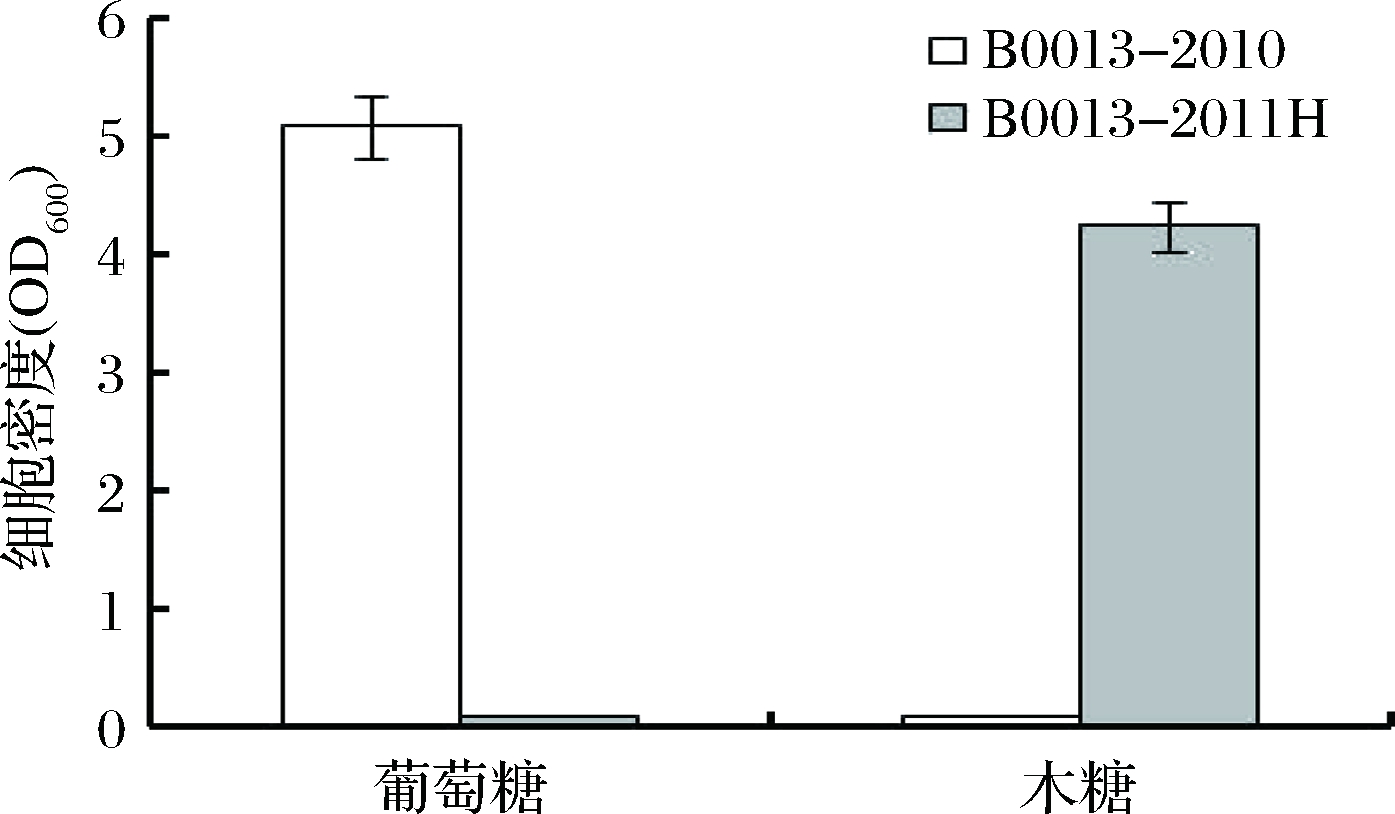
图1 葡萄糖/木糖选择性菌株E. coli B0013-2010和 B0013-2011H的生长量
Fig.1 Biomass of E. coli B0013-2010 and B0013- 2011H on glucose or xylose
在其他条件相同时,B0013-2011H利用木糖生长的细胞密度略低于B0013-2010利用葡萄糖生长的细胞密度,这种差异可能会影响双菌株共发酵过程葡萄糖和木糖的同步利用。要调节2种菌株的菌体密度尽可能相同,以实现2种糖的同步利用,可以从以下几个方面进行尝试:在不同时间点接种;采用不同的接种量;或针对影响生长的因素进行遗传修饰[16]。研究2种底物选择性菌株的接种方法,便于调节两者生长尽可能一致。
在含有5 g/L葡萄糖和5 g/L木糖的培养基中,将B0013-2010PA和B0013-2011HPA分别单独培养,以及按不同比例接种混合培养,37 ℃、200 r/min培养12 h,测定细胞密度,结果见表3。加大菌株B0013-2011HPA的接种比例,可以适当提高混合培养物的细胞密度,但是仍低于单菌株培养细胞密度之和。将B0013-2011HPA分别提前2 h或1 h接种,然后再接种B0013-2010PA,继续培养12 h,则混合培养物的细胞密度分别达到9.48、9.16 OD600(表4)。
表3 B0013-2010PA和B0013-2011HPA分别培养及 不同比例接种培养的生长量
Table 3 Biomass of B0013-2010PA and B0013-2011HPA cultivated separately, and cooperatively at different inoculation ratio
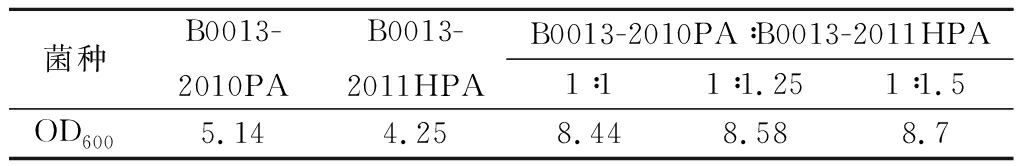
表4 B0013-2010PA和B0013-2011HPA分别培养及 错开接种时间接种混合培养的生长量
Table 4 Biomass of B0013-2010PA and B0013-2011HPA cultivated separately, and cooperatively at different inoculation time

可见,将B0013-2011HPA提早2 h接种,可获得较高的细胞密度,是本研究双菌株共发酵过程比较好的接种方法。
2.3 重组大肠杆菌利用葡萄糖、木糖或混合糖乙醇发酵
将携带Z. mobilis乙醇合成途径关键酶基因pdc和adhB的质粒pEtac-PA转化2种底物选择性菌株B0013-2010和B0013-2011H,得到产乙醇重组菌B0013-2010PA和B0013-2011HPA。利用单一菌株B0013-2010PA或B0013-2011HPA进行乙醇发酵。发酵过程分2个阶段,首先在37 ℃、200 r/min振荡培养12 h,然后将培养物转移至培养箱中37 ℃静置发酵,结果见图2和表5。
发酵10 h,B0013-2010PA消耗25 g/L葡萄糖,产生12.1 g/L乙醇(图2-A),乙醇合成速率为1.21 g/(L·h),葡萄糖消耗速率为2.5 g/(L·h)(表5),木糖质量浓度基本保持不变。同样条件下,发酵12 h,B0013-2011HPA消耗25 g/L木糖,合成11.85 g/L乙醇(图2-B),乙醇合成速率为0.99 g/(L·h),木糖消耗速率为2.08 g/(L·h)(表5),葡萄糖质量浓度基本保持不变。
按照B0013-2011HPA提前2 h接种的方法,将2种底物选择性重组菌B0013-2010PA和B0013-2011HPA接种至含有葡萄糖和木糖的发酵培养基中进行共发酵。37 ℃、200 r/min培养12 h,转移至培养箱静置发酵,培养物细胞密度为9.06 (OD600)。发酵24 h,消耗25 g/L葡萄糖和25 g/L木糖,合成24.22 g/L乙醇(图2-C),乙醇合成速率为1.01 g/(L·h),葡萄糖和木糖消耗速率分别为2.02 g/(L·h)和1.05 g/(L·h)(表5)。同样条件下,对照菌株B0013-1031HPA的木糖消耗明显滞后于葡萄糖(图2-D,表5)。可见,B0013-2010PA和B0013-2011HPA双菌株发酵过程葡萄糖和木糖的同步利用问题得到明显改善。

(A) B0013-2010PA; (B) B0013-2011HPA; (C) B0013-2010PA和B0013-2011HPA; (D) B0013-1031HPA(对照) ●-葡萄糖;◆-木糖;△-乙醇
图2 B0013-2010PA和B0013-2011HPA单一菌株及双菌株利用葡萄糖和木糖的乙醇发酵性能
Fig.2 Ethanol fermentation performance of B0013-2010PA, B0013-2011HPA ,and B0013-2010PA and B0013-2011HPA on mixed glucose and xylose
表5 发酵阶段B0013-2010PA、B0013-2011HPA和 B0013-1031HPA的耗糖速率和乙醇合成速率
Table 5 Consumption rates of sugars and production rate of ethanol by B0013-2010PA, B0013-2011HPA and B0013-1031HPA
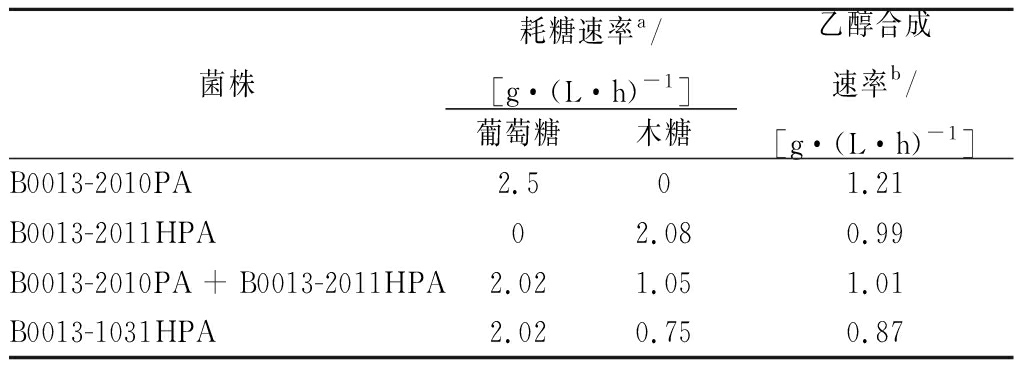
注:a,耗糖速率是指发酵阶段单位时间单位体积内消耗的糖;b,乙醇产率是指发酵阶段单位时间单位体积内合成的乙醇。
利用木质纤维素水解物发酵生产乙醇,需要高效利用其中各种组成单糖,尤其是葡萄糖和木糖,木糖和葡萄糖同步消耗有利于提高乙醇生产效率。但是由于葡萄糖阻遏效应,菌株总是优先利用葡萄糖,对木糖的利用则相对滞后。将E. coli中葡萄糖磷酸转移酶体系的ptsG基因突变,构建的分解代谢物突变株虽然能够同步利用葡萄糖、阿拉伯糖和木糖产生乙醇,但是由于葡萄糖主动运输系统失活,突变株利用葡萄糖的生长变得缓慢,并且对水解产生的抑制物更为敏感[9]。
3 结论
本研究构建的木糖选择性利用菌株,由于阻断了葡萄糖代谢途径,在有葡萄糖存在的情况下可以不受葡萄糖阻遏效应的影响,而优先利用木糖。该菌株和葡萄糖选择性菌株共发酵时,各自分别消耗葡萄糖和木糖,因此实现葡萄糖和木糖的同步利用。虽然在上述实验条件下木糖和葡萄糖的消耗速率略低于单一选择性菌株发酵过程,并且木糖消耗略有滞后。但与出发菌株相比,葡萄糖/木糖选择性代谢菌株共发酵,显著改善了混合糖乙醇发酵中葡萄糖和木糖的同步利用。为了更有效转化木质纤维素水解物中的组成糖类为发酵产品,双菌株共发酵过程还有待于进一步优化。
参考文献
[1] BANERJEE S, MUDLIAR S, SEN R, et al. Commercializing lignocellulosic bioethanol: technology bottlenecks and possible remedies [J]. Biofuels Bioprod Bioref, 2010, 4(1): 77-93.
[2] SANCHEZ R G, KARHUMAA K, FONSECA C, et al. Improved xylose and arabinose utilization by an industrial recombinant Saccharomyces cerevisiae strain using evolutionary engineering [J]. Biotechnol Biofuels, 2010, 3(1):13.
[3] JEFFRIES T W. Engineering yeasts for xylose metabolism[J]. Curr Opin Biotechnol, 2006, 17(3): 320-326.
[4] HO N WY, CHEN Z, BRAINARD A P. Genetically engineered Saccharomyces yeast capable of effective cofermentation of glucose and xylose[J]. Appl Environ Microbio, 1998, 64(5): 1 852-1 859.
[5] MARIS AJ AV, WINKLER A A, KUYPER M, et al. Development of efficient xylose fermentation in Saccharomyces cerevisiae: xylose isomerase as a key component [J]. Adv Biochem Engin Biotechnol, 2007, 108: 179-204.
[6] ZHANG M, EDDY C, DEANDA K, et al. Metabolic engineering of a pentose metabolism pathway in ethanologenic Zymomonas mobilis [J]. Science, 1995, 267(5 195): 240-244.
[7] OHTA K, BEALL D S, MEJIA J P, et al. Metabolic engineering of Klebsiella oxytoca M5A1 for ethanol production from xylose and glucose [J]. Appl Environ Microbiol, 1991, 57(10):2 810-2 815.
[8] INGRAM L O, CONWAY T, CLARK D P, et al. Genetic engineering of ethanol production in Escherichia coli [J]. Appl Environ Microbiol, 1987, 53(10): 2 420-2 425.
[9] NICHOLS N N, DIEN B S, BOTHAST R J. Use of catabolite repression mutants for fermentation of sugar mixtures to ethanol[J]. Appl Microbiol Biotechnol, 2001, 56(1-2):120-125.
[10] YOMANO L P, YORK S W, SHANMUGAM K T, et al. Deletion of methylglyoxal synthase gene (mgsA) increased sugar co-metabolism in ethanol-producing Escherichia coli [J]. Biotechnol Lett, 2009, 31(9):1 389-1 398.
[11] HERNáNDEZ-MONTALVO V, VALLE F, BOLIVAR F, et al. Characterization of sugar mixtures utilization by an Escherichia coli mutant devoid of the phosphotransferase system[J]. Appl Microbiol Biotechnol, 2001, 57(1-2):186-191.
[12] KARIMOVA G, LADANT D, ULLMANN A. Relief of catabolite repression in a cAMP-independent catabolite gene activator mutant of Escherichia coli [J]. Res Microbiol, 2004, 155(2):76-79.
[13] FU N, PEIRIS P. Co-fermentation of a mixture of glucose and xylose to ethanol by Zymomonas mobilis and Pachysolen tannophilus [J]. World J Microbiol Biotechnol, 2008, 24(7): 1 091-1 097.
[14] FU N, PEIRIS P, MARKHAM J, et al. A novel co-culture process with Zymomonas mobilis and Pichia stipitis for efficient ethanol production on glucose/xylose mixtures [J]. Enzyme Microb Technol, 2009, 45(3): 210-217.
[15] EITEMAN M A, LEE S A, ALTMAN E. A co-fermentation strategy to consume sugar mixtures effectively [J]. J Biol Eng, 2008, 2(1):1-8.
[16] EITEMAN M A, LEE S A, ALTMAN R, et al. A Substrate-selective co-fermentation strategy with Escherichia coli produces lactate by simultaneously consuming xylose and glucose [J]. Biotechnol Bioeng, 2009, 102(3): 822-827.
[17] TIAN X,ALTMAN E,EITEMAN M A. Succinate production from xylose-glucose mixtures using a consortium of engineered Escherichia coli [J]. Eng Life Sci, 2015, 15(1): 65-72.
[18] 孙金凤,徐敏,张峰,等. 利用木糖和葡萄糖合成乙醇的新型重组大肠杆菌的研究[J]. 微生物学报, 2004, 31(5):600-604.
[19] 曹剑磊,周丽,张梁,等. 产琥珀酸重组大肠杆菌的构建和发酵性能[J]. 应用与环境生物学报, 2010,16 (6):851-857.
[20] ZHOU L, ZUO Z R, CHEN X Z, et al. Evaluation of genetic manipulation strategies on D-lactate production by Escherichia coli[J]. Curr Microbiol, 2011, 62(3):981-989.
[21] 孙金凤,田康明,沈微,等. 大肠杆菌不同菌株木糖代谢差异性的遗传本质[J].食品与发酵工业,2017, 43(10): 68-73.
[22] 周丽,牛丹丹,李宁,等. 基于Red重组系统和Xer重组系统的大肠杆菌多基因删除方法[J]. 微生物学通报, 2010, 37(6):23-28.
[23] DATSENKO K A, WANNER B L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products [J]. Proc Natl Acad Sci USA, 2000, 97(12):6 640-6 645.
[24] JOSEPH S, RUSSELL D W. Molecular cloning: A laboratory manual [M].2nd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 2001.
[25] ZHOU L, NIU D D, TIAN K M, et al. Genetically switched D-lactate production in Escherichia coli[J]. Metab Eng, 2012, 14(5):560-568.
[26] KHANKAL R, CHIN J W, CIRINO P C. Role of xylose transporters in xylitol production from engineered Escherichia coli [J]. J Biotechnol, 2008, 134(3): 246-252.
[27] SONG S, PARK C. Organization and regulation of the D-xylose operons in Escherichia coli K-12: XylR acts as a transcriptional activator [J]. J Bacteriol, 1997, 179(22):7 025-7 032.
[28] GOSSET G. Improvement of Escherichia coli production strains by modification of the phosphoenolpyruvate:sugar phosphotransferase system[J]. Microb Cell Fact, 2005, 4(1):14.
[29] CURTIS S J, EPSTEIN W. Phosphorylation of D-glucose in Escherichia coli mutants defective in glucosephosphotransferase, mannosephosphotransferase, and glucokinase [J]. J Bacteriol, 1975, 122(3): 1 189-1 199.
[30] DEUTSCHER J, FRANCKE C, POSTMA P W. How phosphotransferase system-related protein phosphorylation regulates carbohydrate metabolism in bacteria [J]. Microbiol Mol Biol Rev, 2006, 70(4): 939-1 031.
[31] HUBER F, ERNI B. Membrane topology of the mannose transporter of Escherichia coli K12 [J]. Eur J Biochem, 1996, 239(3):810-817.