DNA不仅是生物个体的遗传物质,而且还是其遗传信息的运载体。获取高质量的DNA是进行PCR扩增、电泳检测、遗传多样性分析以及基因图谱构建等下游分子生物学研究试验的基础[1]。植物的基因组DNA提取首先裂解细胞壁、细胞膜,除去多糖和多酚等次生物质;然后使用酚和氯仿变性分离蛋白质;最后富集核酸、去除RNA和浓缩DNA等几个步骤。且DNA的提取效率尤其是纯度会严重影响到实验的结果,对于同种植物采用不同方法或者不同植物采用相同的方法其纯度和提取率都有所不同[2]。对于葡萄而言,其多糖、多酚、单宁等大分子物质含量较高,这些物质易与核酸结合形成复合物。多酚类物质能使DNA氧化成棕褐色凝胶状物,多糖类物质能与DNA结合成黏稠的胶状物,这些胶状物溶解度较低,严重影响DNA的浓度和纯度[3-4]。因此需要根据葡萄特性,找到适合葡萄DNA的提取方法,从而提高DNA的质量。
本研究选取新疆天山北麓葡萄酒产区4个优良红白酿酒葡萄品种为试材,采用改良的十六烷基三甲基溴化铵法(hexadecyl trimethyl ammonium bromide, CTAB)和商业试剂盒法提取酿酒葡萄基因组DNA,通过比较,得出最适合提取酿酒葡萄DNA的方法。使用琼脂糖凝胶电泳检测DNA的片段大小及质量,同时在核酸蛋白仪上测定样品DNA的浓度,最后通过PCR扩增验证DNA质量。
1 材料与方法
1.1 实验材料
选取新疆天山北麓葡萄酒产区的4个优良酿酒葡萄品种果实,具体见表1,置于-80 ℃冰箱贮藏备用。
表1 四个酿酒葡萄品种及其分子身份证编码
Table 1 Four wine grape varieties and their molecular ID

1.2 仪器与设备
BG-sub MIDI多用途水平电泳仪、BG-Power600 通用电泳仪电源,北京百晶生物技术有限公司;Tanon 1600凝胶成像系统,上海天能科技有限公司;BioSpec-nano核酸蛋白检测仪、微量移液器,德国Eppendorf公司;立式电热压力蒸汽灭菌锅,上海申安医疗器械厂。
1.3 方法
1.3.1 提取试剂
0.5 mol/L EDTA-Na2溶液(pH值为8.0),1 mol/L Tris-HCl溶液(pH值为8.0),预提取缓冲液,1×TE缓冲液(pH值为8.0),Tirs饱和酚/氯仿(1∶1,体积比),氯仿/异戊醇溶液(24∶1,体积比)。
1.3.2 酿酒葡萄品种基因组DNA提取方法
将新鲜酿酒葡萄放置-80 ℃冷冻,待果实冻硬后去梗,使用洁净刀片切块,然后放入冷冻干燥仪中1~2 d,至果实完全冻干后,最后使用液氮迅速研磨成粉,同时,放入-20 ℃保藏备用。分别采用改良的CTAB法和2种商业试剂盒提取基因组DNA。每个试验重复3次。
1.3.2.1 改良的CTAB法
(1)将配制好的质量分数为2%CTAB裂解缓冲液,放入60 ℃水浴锅中,恒温水浴15 min;
(2)称取适量研磨好的样品放入5 mL离心管中,加入600 μL预提取缓冲液,冰上研磨成匀浆;
(3)加入1 200 μL预热的2%CTAB裂解缓冲液,同时,加入β-巯基乙醇,使其最终浓度达到20 μL/mL,混匀;
(4)60 ℃恒温水浴90 min,期间每隔10 min轻微振荡离心管;
(5)恒温水浴结束后立即放入冰盒,冷却至室温。加入与步骤(2)等体积Tirs饱和酚/氯仿=1∶1,振荡混匀,放置室温静置,待溶液中出现白色絮状沉淀时,12 000 r/min离心 15 min,最大程度移取上清液;
(6)加入2/3倍体积的氯仿/异戊醇=24∶1,振荡混匀,放置室温静置,待溶液中出现白色絮状沉淀时,12 000 r/min离心 10 min,最大程度移取上清液;
(7)加入 4~7 μL RNase A,轻微振荡混匀,37 ℃恒温水浴30 min;
(8) 恒温水浴结束后立即放入冰盒,冷却至室温。加入步骤(7)所获体积的0.8/10倍5 mol/L NaCl与2/3倍的异丙醇,混匀,-20 ℃静置 30 min;
(9)12 000 r/min离心 15 min,弃上清液;
(10)加入600 μL 70 %乙醇,使之与沉淀充分接触后,8 000 r/min,离心 2 min,弃上清液,这一步骤重复2遍;
(11)将离心管放置室温,待沉淀干燥后,加入80 μL 1×TE缓冲液(pH值为8.0),混匀,-20 ℃保存备用。
1.3.2.2 试剂盒法
选用的试剂盒分别是QIAGEN公司DNeasy Plant Mini Kit(50)试剂盒和天根生化科技(北京)有限公司高效植物基因组试剂盒进行植物基因组DNA提取,操作步骤严格按照使用手册进行。本试验中使用2个公司的试剂盒用A和B表示,顺序与文中出现的顺序没有对应关系。
1.3.3 DNA质量检测
1.3.3.1 琼脂糖凝胶电泳检测
使用质量分数为0.8%琼脂糖凝胶对3种不同方法提取得到的样品进行电泳检测,5 μL DNA样品与1 μL 6×loading buffer混匀后进样,80 V,30 min,恒压对DNA样品进行电泳,并在凝胶成像系统下观察,并照相分析。
1.3.3.2 核酸蛋白检测仪检测
使用BioSpec-nano核酸蛋白检测仪对3种不同方法提取得到的样品,进行浓度和纯度检测,通过对DNA浓度、 OD260/OD280和OD260/OD230 3个方面进行结果分析,比较3种提取方法的优缺点,最终确定最优的酿酒葡萄基因组DNA提取的方法。
1.3.3.3 PCR扩增及琼脂糖凝胶电泳检测
根据1.3.3.1和1.3.3.2的试验结果比对,选择浓度和纯度结果均较高的DNA样品,进行PCR扩增检测。选用植物内源基因18S rDNA基因,对酿酒葡萄基因组DNA进行PCR扩增。上游引物(F):5′-TCTGCCCTATCAACTTTCGATGGTA-3′;下游引物(R):5′-AATTTGCGCGCCTGCTGCCTTCCTT-3′[5]。
本试验采用25 μL反应体系进行PCR扩增,参照10×PCR Buffer说明书,建立25 μL反应体系为:15 mmol/L Mg2+ 2.50 μL,2.5 mmol/L dNTPs 2.00 μL,5.0 U/μL Taq酶 0.20 μL,10 μmol/L引物1.00 μL,DNA模板1.00 μL,剩余用超纯水补足。
PCR反应程序:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸45 s,共35个循环,最后72 ℃延伸7 min。
PCR扩增产物使用2.0%琼脂糖凝胶电泳检测,110 V,20 min,恒压对PCR扩增产物进行电泳,并在凝胶成像系统下观察,并照相分析。
2 结果与分析
2.1 琼脂糖凝胶电泳检测结果与分析
通过3种不同方法提取酿酒葡萄基因组DNA,琼脂糖凝胶电泳结果显示,不同方法均有条带,但是差异较大。通过比较3种方法的电泳图谱,可以得出,图1条带清晰,无拖尾现象,说明改良的CTAB法提取DNA完整性较好。图2条带较清晰,有拖尾现象,并且进样口处有光斑,说明存在蛋白和其他大分子杂质污染现象。图3条带模糊,有拖尾现象,说明DNA纯度不高,并且存在杂质污染。3种方法提取的DNA浓度需要使用核酸蛋白检测仪进行检测。

M-D 15000 DNA marker;1-赤霞珠;2-霞多丽; 3-美乐;4-玫瑰香
图1 酿酒葡萄基因组DNA的CTAB法琼脂糖 凝胶电泳结果
Fig.1 CTAB agarose gel electrophoresis of genomic DNA from wine grape

M-D 15000 DNA marker;1-赤霞珠;2-霞多丽; 3-美乐;4-玫瑰香
图2 酿酒葡萄基因组DNA的A试剂盒琼脂糖凝胶 电泳结果
Fig.2 Kit A agarose gel electrophoresis of genomic DNA from wine grape
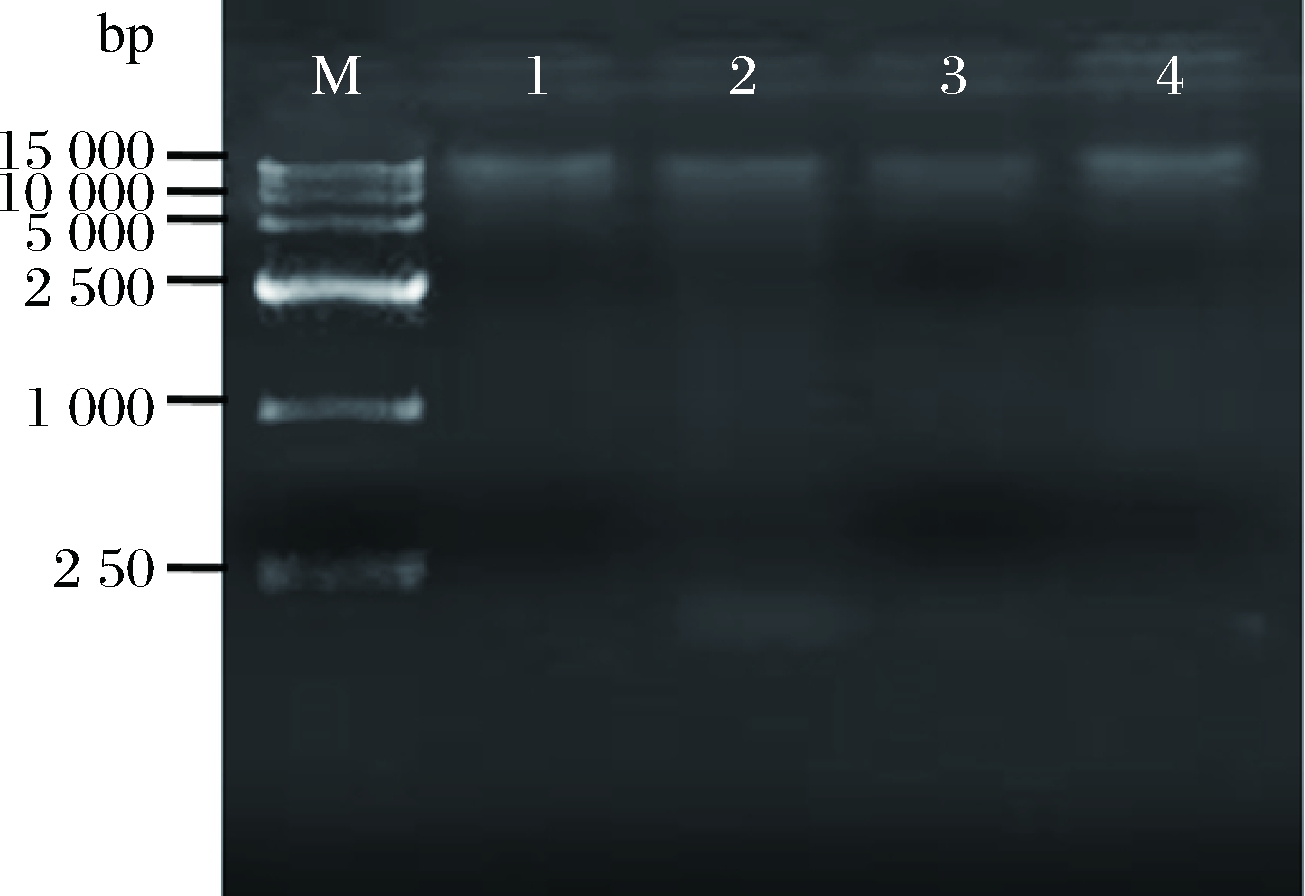
M-D 15000 DNA marker;1-赤霞珠;2-霞多丽; 3-美乐;4-玫瑰香
图3 酿酒葡萄基因组DNA的B试剂盒琼脂糖凝胶 电泳结果
Fig.3 Kit B agarose gel electrophoresis of genomic DNA from wine grape
2.2 核酸蛋白检测仪检测结果与分析
对酿酒葡萄基因组DNA的提取,选用3种不同提取方法均可获得DNA,但不同方法所获得的DNA质量差异较大,具体结果见表2。当OD260/OD280在1.8~2.0之间,说明DNA相对完整,浓度较高。当OD260/OD280<1.8时,提取的基因组DNA样品中可能存在蛋白质污染;当OD260/OD280>2.0时,提取的基因组DNA中含有一定量的RNA;当OD260/OD230<2.0时,基因组DNA样品中可能在提取过程中有残存的盐等含量较少的杂质。改良的CTAB法提取的基因组DNA样品的OD260/OD280比值均在1.8左右,说明所有样品的总DNA含量较高,相对完整。使用A试剂盒提取的DNA样品的OD260/OD280比值<1.8,说明DNA样品中存在蛋白等杂质污染,与图2的结果分析相一致。使用B试剂盒提取的DNA样品的OD260/OD230<2.0,说明DNA样品中含有少量小分子杂质污染,与图3的结果分析相一致。
表2 不同方法提取的酿酒葡萄基因组DNA的 质量检测结果
Table 2 Quality result of different wine-grape DNA extracted by diferent methods
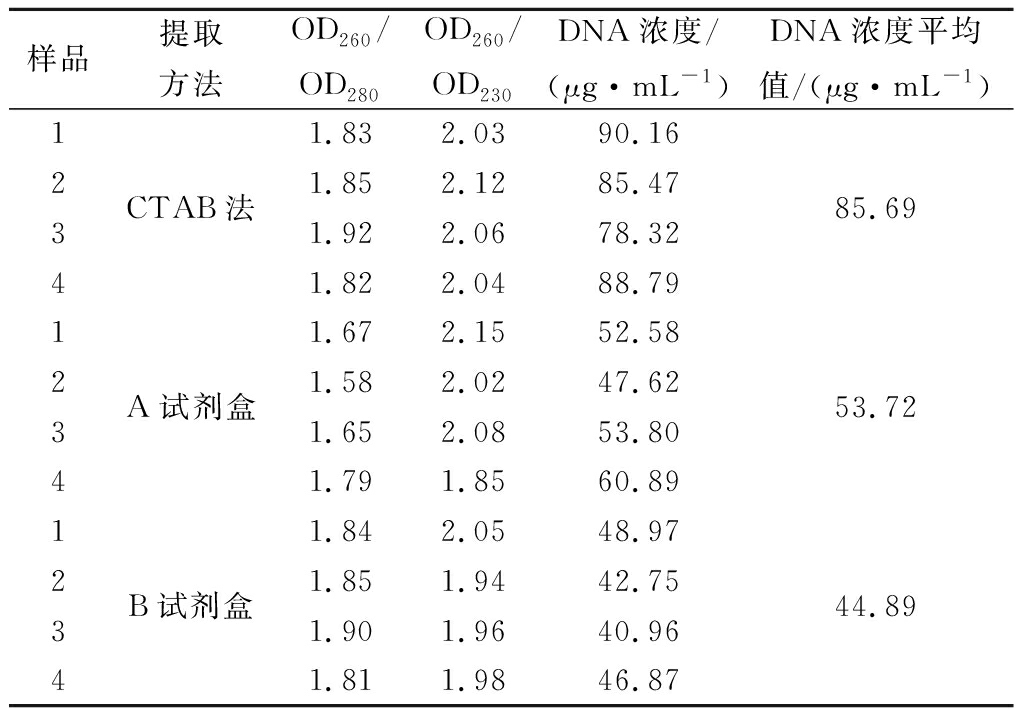
注:1-赤霞珠;2-霞多丽;3-美乐;4-玫瑰香。
2.3 PCR扩增及琼脂糖凝胶电泳检测结果与分析
选用改良的CTAB法提取的基因组DNA进行PCR扩增植物内源基因18S rDNA基因,琼脂糖凝胶电泳检测见图4。所有样品均能扩增出PCR条带,条带清晰,无拖尾现象。说明改良的CTAB法提取的酿酒葡萄基因组DNA浓度和纯度均较高,可以进行PCR扩增、电泳检测、遗传多样性分析以及基因图谱构建等下游分子生物学研究试验。

M-D 2000 DNA marker;1-赤霞珠;2-霞多丽; 3-美乐;4-玫瑰香
图4 PCR扩增及琼脂糖凝胶电泳检测结果
Fig.4 Results of PCR amplification and agarose gel electrophoresis
3 讨论
不同植物因个体差异,植物内部组织含有的物质种类和含量差异较大,对于最适的基因组DNA的提取条件也有所不同。目前,基因组DNA的提取方法基本成熟,常用的提取植物基因组DNA方法有CTAB法、十二烷基硫酸钠(sodium dodecyl sulfate, SDS)法、离心柱法、磁珠法和商业DNA提取试剂盒[6]。提取过程包括破碎细胞壁、裂解细胞膜、去除多糖,多酚等次生物质、变性分离蛋白质、沉淀核酸、去除RNA和浓缩DNA等几个步骤[7]。针对酿酒葡萄富含多糖、多酚、色素和细胞壁较厚等问题,寻求最适的提取方法,对后续生物学检测非常重要。因此,本研究选用改良的CTAB法和2种不同的商业试剂盒进行提取方法比对,最终得出1种适合酿酒葡萄品种基因组DNA的提取方法。
葡萄中的多糖,多酚等物质容易与DNA形成复合物,较难溶解。因此根据葡萄特性改进传统CTAB的提取条件,从而获得高质量的葡萄基因组DNA是后续分子生物学研究的基础[8]。目前,改良的传统提取方法受到国内外许多研究者的认可。首先,葡萄果实汁多肉少,富含多糖等次生代谢产物,针对这一特点,本研究将果实进行冷冻干燥,不仅能去除组织中大量的水分,还能去除一部分糖物质。段婧婧[9]等以木瓜为试验材料,对传统CTAB法进行改良,最终确定先将试材前处理冷冻干燥后液氮研磨成粉,确定了最适的材料粉末添加量和PVP添加量,能有效提高木瓜基因组DNA浓度。本研究使用预提取缓冲液进行组织破碎,最大程度保护DNA完整性。裂解缓冲液中添加了30 g/L PVP-40和20 μL/mL β-巯基乙醇,最大程度阻止了多酚物质氧化,降低了多酚氧化物与DNA形成复合物的几率,从而提高葡萄DNA的纯度,保证了PCR扩增的产量。刘锴栋等[10]采用传统CTAB法和改良CTAB法,分别对野生荔枝的总DNA进行提取,结果表明改良的方法提取的DNA比传统方法提取的DNA质量和纯度都要高。本研究在蛋白变性去除后,添加RNase A,37 ℃恒温水浴30 min,有效分解了溶液中的RNA,然后添加异丙醇,醇类物质与DNA分子团中的水分子结合,DNA因失水而发生聚合,低温沉降DNA,从而提高DNA的浓度。高媛等[11]以苹果种子和果肉为试材,采用改良CTAB法、SDS法与高盐低pH SDS法进行基因组DNA的提取,结果显示,CTAB提取液中加入质量分数为1% 的PVP和质量分数为1% 的β-巯基乙醇,能够有效降低酚化合物的离子化并且防止酚类物质的氧化,得到的DNA产量最高。徐美隆等[12]以葡萄嫩叶为研究材料,选用改良CTAB法和试剂盒法分别提取DNA,结果显示,改良CTAB法提取的总DNA进行PCR扩增验证,电泳条带清晰明亮,说明总DNA质量较高。齐玲倩等[13]以水果果肉为试材,采用改良CTAB法、商业试剂盒和行业标准法3种方法对提取效果进行对比,结果说明,改良CTAB法提取的水果果肉DNA浓度和纯度均比其他2种方法高。
综上所述,针对葡萄果实特性对其基因组DNA提取方法进行了改良,在前处理过程中进行真空冷冻干燥以去除葡萄中可溶性多糖与水分,并加入600 μL预提取缓冲液以去除多糖,防止多酚氧化,并洗涤DNA,提高DNA提取效率;在提取过程中加入1 200 μL裂解缓冲液,可进一步增大DNA提取效率;为聚合DNA而加入异丙醇,时间越长可使DNA聚合效率增高,从而增加DNA的浓度。本文使用3种提取方法提取葡萄中的DNA并对比琼脂糖凝胶电泳基因组DNA条带,检测基因组DNA的质量并通过PCR扩增验证,最终确定改良的CTAB法提取的葡萄基因DNA样品质量最高,能够满足后续的研究要求。
参考文献
[1] LI H, LI J, CONG X H, et al. A high-throughput, high-quality plant genomic DNA extraction protocol[J]. Genetics & Molecular Research, 2013, 12(4):4 526-4 539.
[2] 刘塔斯,林丽美,龚力民,等.分子标记中植物DNA提取方法的研究进展[J].中南药学,2005, 3(6):370-373.
[3] 高苏娟,李志勇,高东微,等.葡萄酒中葡萄的DNA提取和分子鉴定研究进展[J].食品科学, 2015, 36(15):282-287.
[4] 张璐璐,樊晨,樊哲,等. 改良CTAB法提取草莓基因组DNA[J]. 现代园艺, 2014(11):5-7.
[5] 中华人民共和国国家质量监督检验总局.SN/T 3729—2013出口食品及饮料中常见水果品种的鉴定方法第2部分:杏成分检测实时荧光PCR法[S].北京:中国标准出版社,2013.
[6] 李金璐,王硕,于婧,等.一种改良的植物DNA提取方法[J].植物学报, 2013, 48(1):72-78.
[7] 赵志常,陈业渊,高爱平,等.改良CTAB法提取番石榴总DNA的初步研究[J].北方园艺,2013(9):123-125.
[8] 陈林杨,宋敏舒,查红光,等.一种改良的植物基因组DNA通用提取方法[J].植物分类与资源学报, 2014,36(3):375-380.
[9] 段婧婧,肖琳,陈军.用于转基因检测的水果果肉总DNA提取法[J].食品科学,2009,30(3):230-233.
[10] 刘锴栋,袁长春,陈燕,等.不同方法提取野生荔枝基因组DNA效果的比较[J].北方园艺,2012(23):105-109.
[11] 高媛,杜国强,师校欣.适于转基因苹果种子和果肉总DNA提取的方法[J].中国农学通报, 2010, 26(16):238-241.
[12] 徐美隆,章雨,倪细炉.一种高质量葡萄基因组DNA提取方法[J].北方园艺, 2011(15):172-174.
[13] 齐玲倩,刘秀,丁梦璇,等.水果果肉中总DNA提取方法的比较研究[J].食品研究与开发,2016, 37(5):55-58.