蕨根为凤尾蕨科植物蕨的根茎,又叫乌角、小角,广泛分布于热带、亚热带和温带地区[1]。蕨根富含淀粉、蛋白质、维生素及微量元素等营养成分,同时还含有黄酮类化合物等生物活性物质[2-3],具有清热解毒、健肾补脾的功效,还对防治中暑、鼻出血、牙痛和痢疾有特效[4-5]。蕨根是一种优良的药食同源野生植物资源,目前对蕨根的研究主要集中在加工蕨根淀粉[6],提取蕨根黄酮[3]等方面,鲜有将蕨根用于蕨根酒酿造的报道。在蕨根淀粉加工过程中,因黄酮类成分不易溶于水,现有蕨根淀粉的提取方法易造成蕨根黄酮的大量流失。
米酒是以糯米为主要原料,经糖化发酵而成[7],米酒历史悠久,口感良好,具有多种氨基酸、维生素等营养成分[8-9]。为了充分利用野生资源,提升米酒产品的营养价值,将蕨根与糯米混合发酵,酿造的蕨根米酒不仅可以有效利用蕨根淀粉的黄酮类物质,同时可解决单一蕨根酒口感欠协调的问题。
本研究在单因素试验的基础上对蕨根米酒发酵工艺参数进行响应面分析,同时对发酵成品进行体外抗氧化性研究,旨在提高蕨根资源的开发与附加值,为蕨根米酒的生产控制提供理论依据与基础数据。
1 材料与方法
1.1 材料与仪器
蕨根(60 ℃烘干,粉碎过40目筛),宜宾志君蕨粉科技有限责任公司;糯米市售;安琪甜酒曲,安琪酵母股份有限公司;芦丁标准品,上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) 、2,2-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS),上海阿拉丁生化科技股份有限公司;甲醇、乙醇、磷酸、过硫酸钾、铁氰化钾、三氯乙酸、三氯化铁、水杨酸钠、硫酸亚铁、过氧化氢、维生素C(VC)等,分析纯。
T6紫外可见分光光度计,北京普析通用仪器有限责任公司;HH-W21-600S数显电热恒温水温箱,上海跃进医疗器械有限公司;GHP-9160隔水式恒温培养箱,上海齐欣科学仪器有限公司;ME204电子天平,梅特勒-托利多(上海)有限公司;SW-CJ-2FD洁净工作台,苏州安泰空气技术有限公司;酒精计,河北武强同辉仪器厂;GTR21-1高速离心机,北京时代北利离心机有限公司;CNT95数显糖度计,杭州陆恒生物科技有限公司。
1.2 实验方法
1.2.1 工艺流程
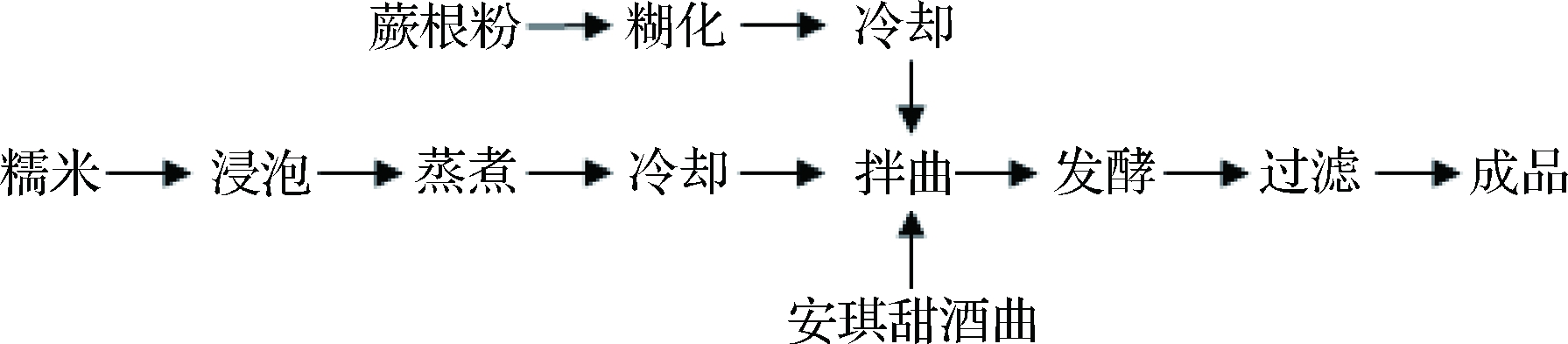
工艺要点:将糯米洗净,浸泡24 h使其充分吸水,手捏无硬心;蒸煮好的糯米内无白心,熟而不烂;蕨根蒸煮30 min,让蕨根淀粉糊化完全,将熟糯米和熟蕨根粉摊凉降至室温混匀,加入甜酒曲搅拌均匀,在设定的温度下进行糖化发酵;发酵结束后过滤得到蕨根米酒成品。
1.2.2 指标测定
总黄酮(以芦丁计)测定:比色法[10];残糖(以葡萄糖计)测定:斐林试剂法[11];酒精度测定:酒精计法[11];总酸度测定:酸碱滴定法[11];可溶性固形物含量测定:手持糖度计;菌落总数、大肠菌群、致病菌的检测:采用《GB/T 4789.3—2016食品安全国家标准 食品微生物学检验 大肠菌群计数》。
1.2.3 感官评定
选择10名(男女各5名)经过感官评定培训的食品专业学生组成评价小组,按照表1的感官评价标准对各样品进行感官评分。
表1 蕨根米酒感官评价标准
Table 1 Standards for sensory evaluation of ferm rice wine

1.2.4 发酵工艺条件优化和确定[7,12]
单因素试验:选择蕨根添加量(蕨根和糯米总量的百分比)20%、发酵温度28 ℃、发酵时间5 d,考察不同安琪甜酒曲添加量(0.5%、1.0%、1.5%、2.0%、2.5%)对蕨根米酒的影响;选择酒曲添加量1.5%、发酵温度28 ℃、发酵时间5 d,考察不同蕨根的添加量(10%、20%、30%、40%、50%)对蕨根米酒的影响;选择蕨根添加量20%、安琪甜酒曲添加量1.5%、发酵时间5 d,考察不同发酵温度(22、25、28、31、34 ℃)对蕨根米酒的影响;选择蕨根添加量20%、安琪甜酒曲添加量1.5%、发酵温度28 ℃,考察不同发酵时间(3、4、5、6、7 d)对蕨根米酒的影响。按照上述条件发酵完成后,以总黄酮含量和感官评分为评价指标对蕨根米酒的品质进行分析,确定单因素最佳条件。
在单因素试验的基础上,根据Box-Behnken试验设计原理,选择安琪甜酒曲添加量(X1)、发酵温度(X2)、发酵时间(X3)为响应变量,以总黄酮含量和感官评分为响应值进行3因素3水平响应面优化试验,因素水平如表2所示。
表2 响应面试验因素水平设计
Table 2 Factors and levels used in Box-Behnken design

1.2.5 体外抗氧化能力评价
1.2.5.1 DPPH自由基清除能力
参照XIAO[13]等的方法,将0.1、0.2、0.3、0.4、0.5、1.0、1.5 mL的样品分别加入4 mL DPPH甲醇溶液(0.1 mmol/L),在室温条件下黑暗反应30 min。以甲醇溶液为参比溶液,以VC为阳性对照,以去离子水代替样品同体积反应混合液为空白对照,在517 nm下测定吸光度。DPPH自由基清除率按下式计算。
DPPH清除率![]()
(1)
式中,A0为加同样品等体积水后测定的吸光值;A1为加样品后测定的吸光值。
1.2.5.2 ABTS自由基清除能力
参照YE[14]的方法,将ABTS溶液(7 mmol/L)与等体积的过硫酸钾溶液(2.5 mmol/L)混合,在室温下将混合物在黑暗中放置16 h产生ABTS自由基阳离子(ABTS+),用乙醇将ABTS+溶液稀释成在734 nm处的吸光度为(0.7±0.01)的溶液。随后将0.01、0.02、0.05、0.1、0.2、0.3、0.4 mL样品分别加入到5 mL上述稀释液中,在室温下反应5 min。以去离子水为参比溶液,以Vc为阳性对照,以去离子水代替样品同体积反应混合液为空白对照,在734 nm处测定吸光度。ABTS自由基清除率按下式计算。
ABTS自由基清除率![]()
(2)
式中,A0为加同样品等体积水后测定的吸光值;A1为加样品后测定的吸光值。
1.2.5.3 还原力的测定
参考LIN[15]的方法测定还原力,将0.1、0.25、0.5、0.75、1、1.25、1.5 mL的样品分别加入到2.5 mL PBS(0.2 mol/L,pH值为 6.6)和2.5 mL铁氰化钾(10 g/L)的混合液中,50 ℃反应20 min,然后加入2.5 mL三氯乙酸(100 g/L),3 000 r/min离心10 min,取上清液2.5 mL,加入2 mL去离子水和0.5 mL三氯化铁(10 g/L),在室温条件下反应10 min。以去离子水为参比溶液,以VC为阳性对照,在700 nm处测定吸光度。
1.2.5.4 羟基自由基清除能力
参考蒋增良[16]的方法,将0.1、0.2、0.4、0.6、0.8、1.0、1.2 mL的样品分别加入到4 mL混合体系中(1.4 mL 6 mmol/L H2O2、0.6 mL 20 mmol/L水杨酸钠和2 mL 1.5 mmol/L硫酸亚铁),在37 ℃的条件下反应20 min。以去离子水为参比溶液,以VC为阳性对照,以去离子水代替样品同体积反应混合液为空白对照,在562 nm处测定吸光度。羟基自由基清除率按下式计算。
羟基自由基清除率![]()
(3)
式中,A0为加同样品等体积水后测定的吸光值;A1为加样品后测定的吸光值
1.3 数据处理
采用Design-Expert 6.0.5软件进行响应面试验设计与结果分析,通过Excel 2003软件进行数据处理。
2 结果与分析
2.1 蕨根米酒发酵工艺条件单因素试验
2.1.1 蕨根添加量的确定
蕨根添加量主要影响蕨根米酒的总黄酮含量和成品的口感。由图1可知,蕨根添加量较低时,蕨根米酒中总黄酮含量偏低且蕨根香气偏淡,随着蕨根添加量的增加,蕨根米酒的总黄酮含量呈递增趋势;当蕨根粉添加量达 50%时,蕨根米酒中虽然总黄酮含量最高,但所得的蕨根米酒蕨根味过浓、酒体稍浑、整体风味欠协调,导致感官评分较低。综合考虑米酒感官效果和黄酮含量2个因素,确定蕨根添加量为 20%。
2.1.2 酒曲添加量的确定
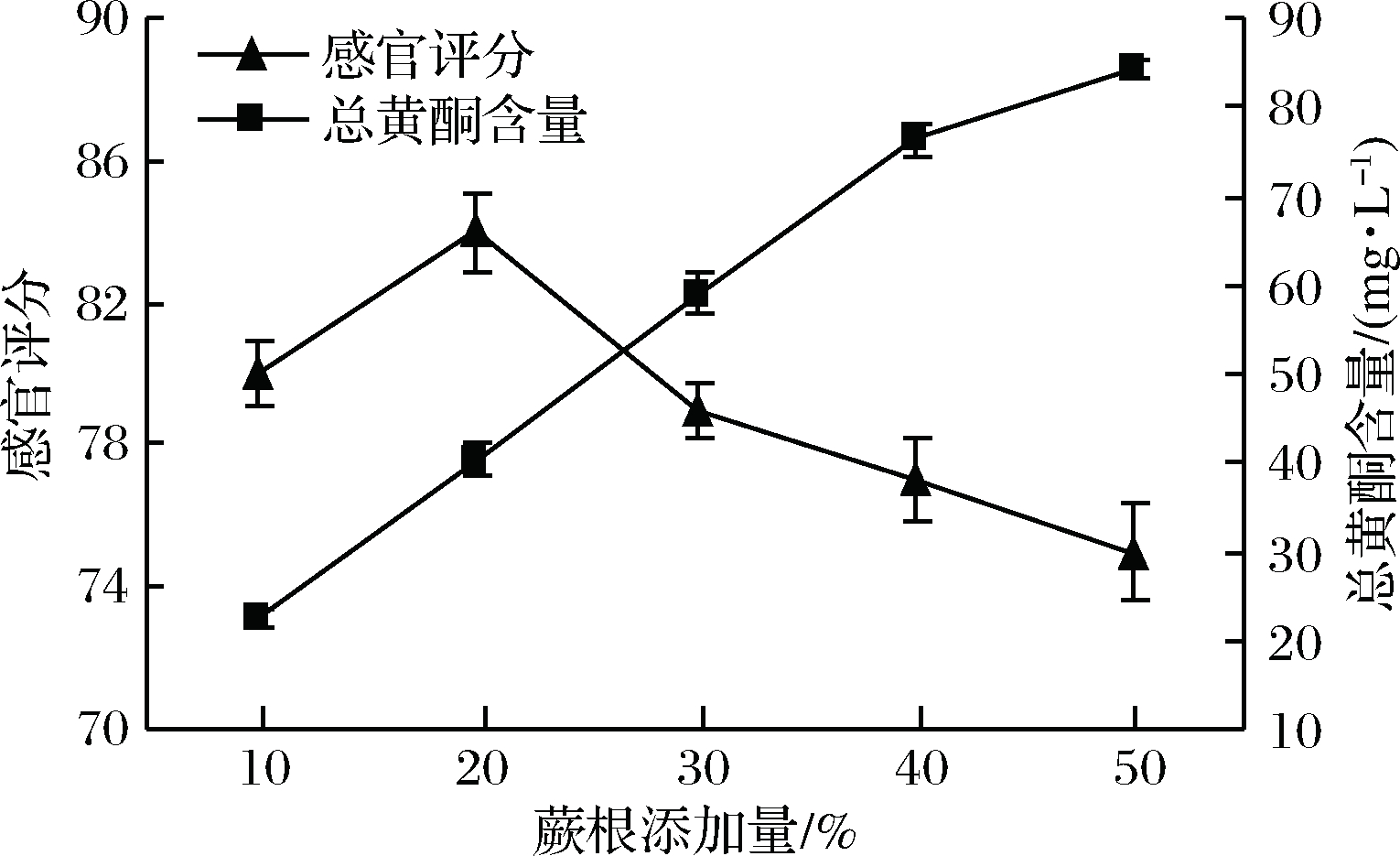
图1 蕨根添加量对蕨根米酒总黄酮含量和感官评分 的影响
Fig.1 Influence of adding fern on total flavonoids and sensory evaluation of fern rice wine
酒曲是米酒发酵的动力,其添加量对米酒的品质有着较大的影响。酒曲添加量太低,淀粉的糖化效率降低,发酵进程减慢,导致米酒酒精度较低且风味寡淡有异味;酒曲添加量过高,米酒发酵速度过快,不利于风味的形成[17]。由图2可知,随着酒曲添加量的增加,蕨根米酒中总黄酮含量逐渐升高,当酒曲添加量大于1.5%时,米酒中总黄酮含量升高缓慢,可能是由于霉菌产生的一些酶破坏了蕨根细胞结构使黄酮含量有所升高。随酒曲添加量的增加蕨根米酒发酵加快、风味得到改善,且在酒曲添加量为1.5%时蕨根米酒风味最佳、感官评分最高;当酒曲添加量大于1.5%时,蕨根米酒中酸味和涩味较明显,风味较差,感官评分降低。综合考虑,选择酒曲添加量为1.5%较为适宜。
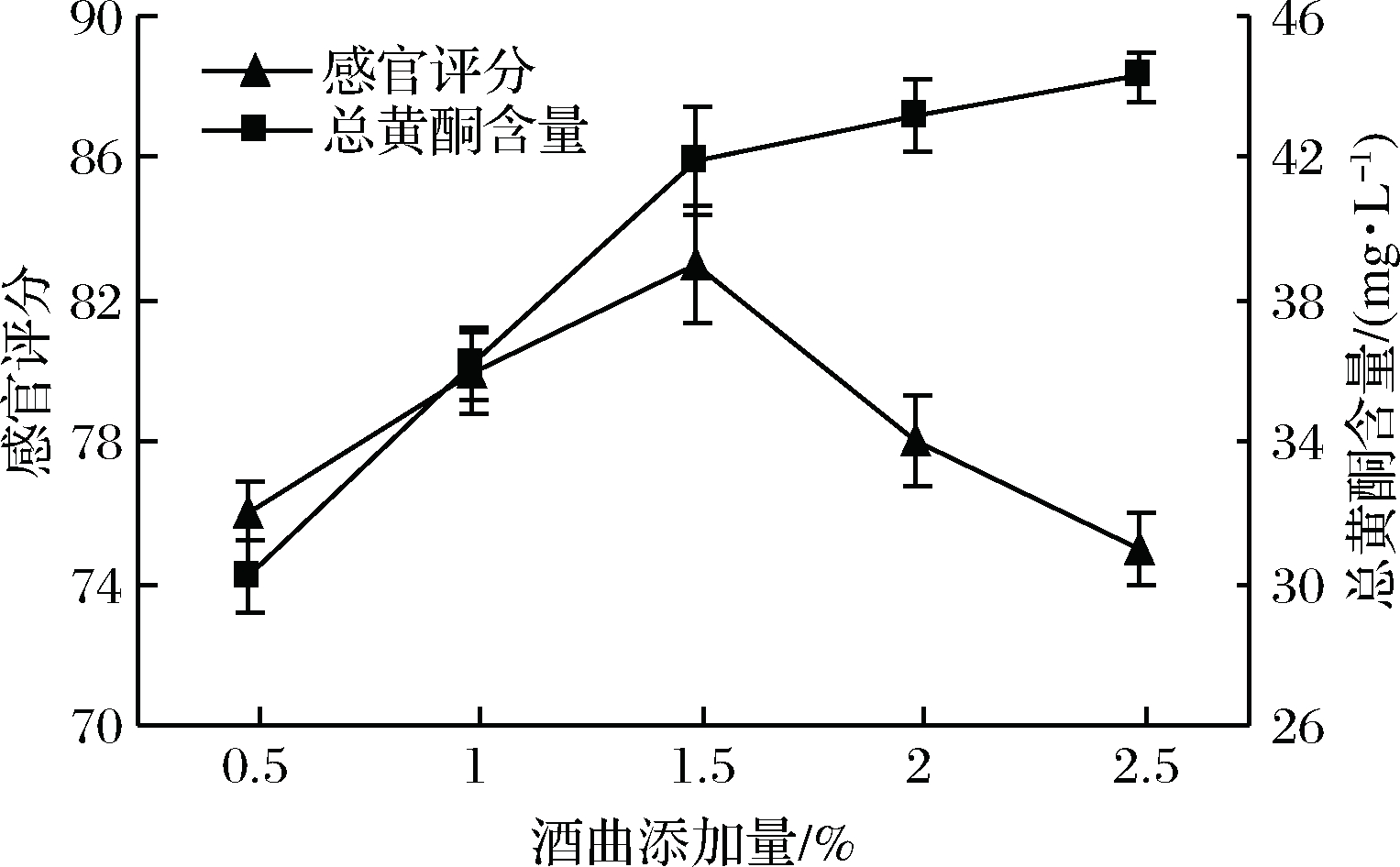
图2 酒曲添加量对蕨根米酒总黄酮含量和感官评分 的影响
Fig.2 Influence of adding Jiuqu on total flavonoids and sensory evaluation of fern rice wine
2.1.3 发酵温度的确定
温度对微生物的生长和蕨根米酒品质有着较大的影响。温度较低时,酒曲中的霉菌生长较慢,延长发酵前糖化阶段,容易引起杂菌污染;此外酵母菌代谢活动较弱,发酵速率较低,不利于优势菌群的形成;发酵温度过高时,霉菌快速生长,淀粉糖化加快,导致蕨根米酒糖浓度较高影响酵母发酵;此外发酵温度过高,酵母生长加快,生成较多的代谢产物,导致蕨根米酒口感欠佳。由图3可知,随着发酵温度的升高,蕨根米酒总黄酮含量和感官评分先增加后降低,当发酵温度为31 ℃时,蕨根米酒的总黄酮含量和感官评分均达到最高值,因此发酵温度选择31 ℃为宜。
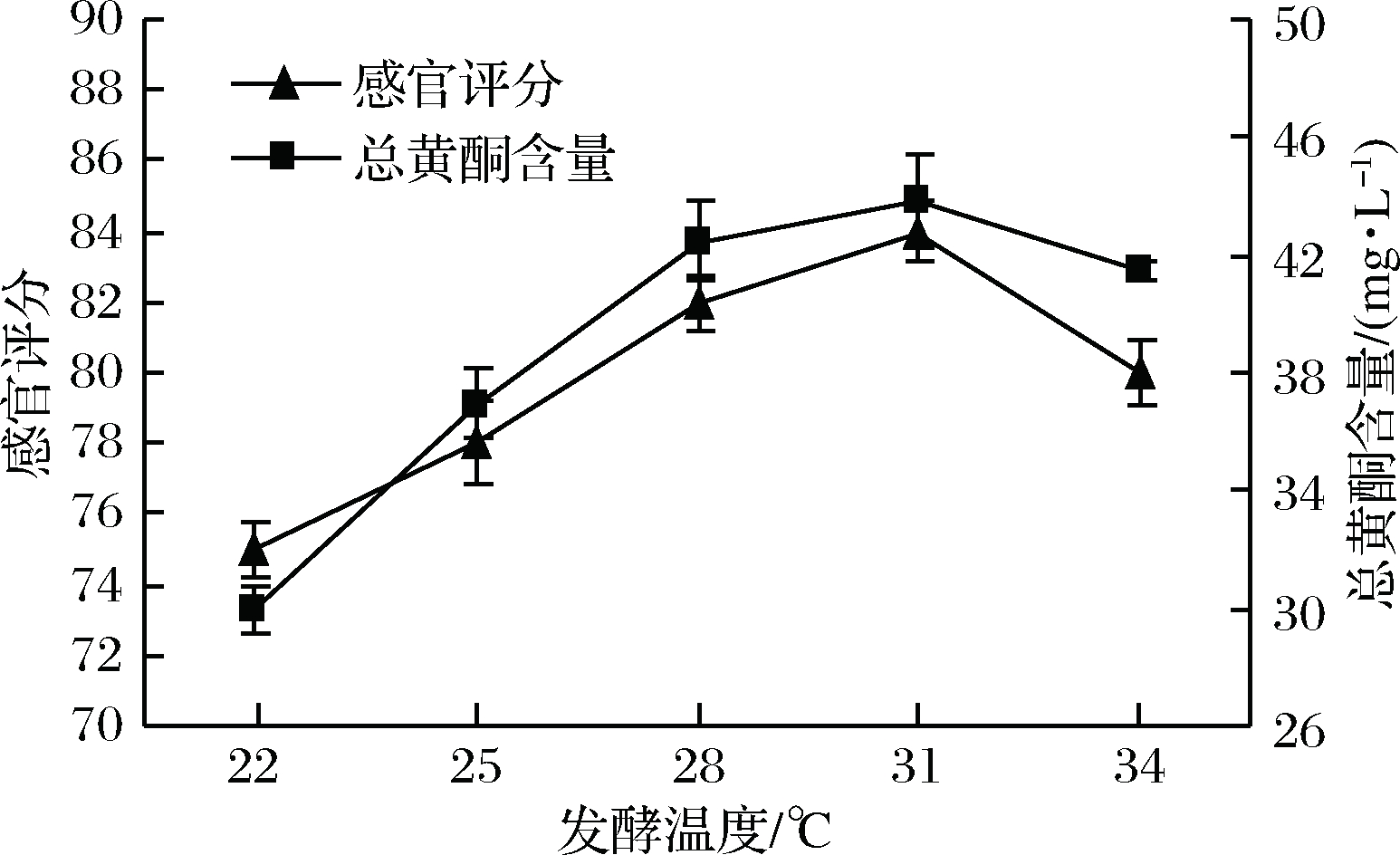
图3 发酵温度对蕨根米酒总黄酮含量和感官评分 的影响
Fig.3 Influence of fermentation temperature on total flavonoids and sensory evaluation of fern rice wine
2.1.4 发酵时间的确定
发酵时间过短,米酒中糖度较高,并且岀汁量少,酒香味不明显。由图4可知,延长发酵时间可以增加蕨根米酒中总黄酮的含量,可能是由于发酵时间的延长增加了蕨根米酒中的酒精度,从而增加蕨根黄酮的溶解。在发酵时间为5 d时,蕨根米酒的风味最佳,感官评分最高;虽然延长发酵时间可以增加蕨根米酒中总黄酮含量,但会导致蕨根米酒酒精味突出,影响其整体风味,故选择最佳发酵时间为5 d。
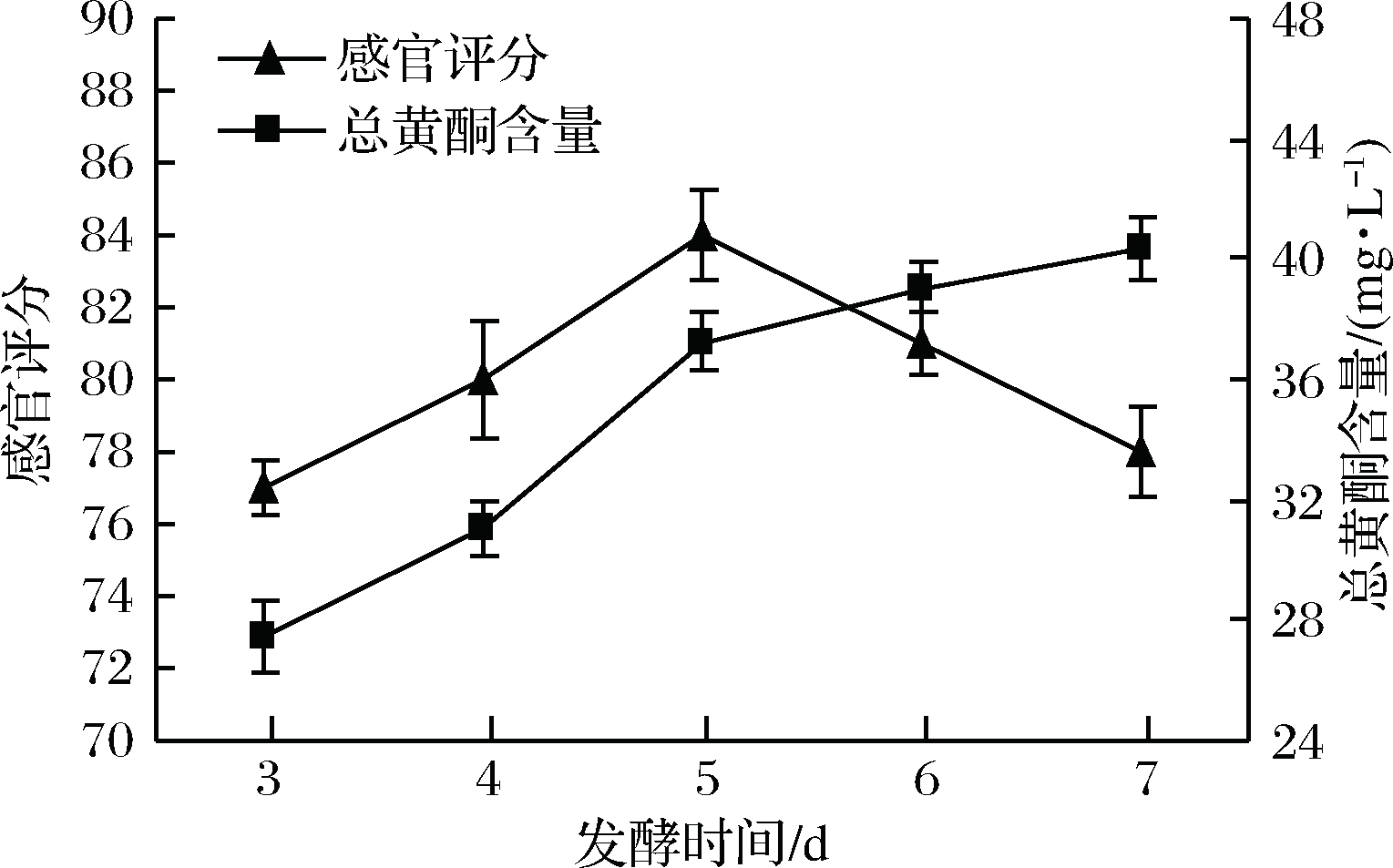
图4 发酵时间对蕨根米酒总黄酮含量和感官评分 的影响
Fig.4 Influence of fermentation time on total flavonoids and sensory evaluation of fern rice wine
2.2 响应面法对蕨根米酒工艺优化
2.2.1 模型的建立及其显著性验证
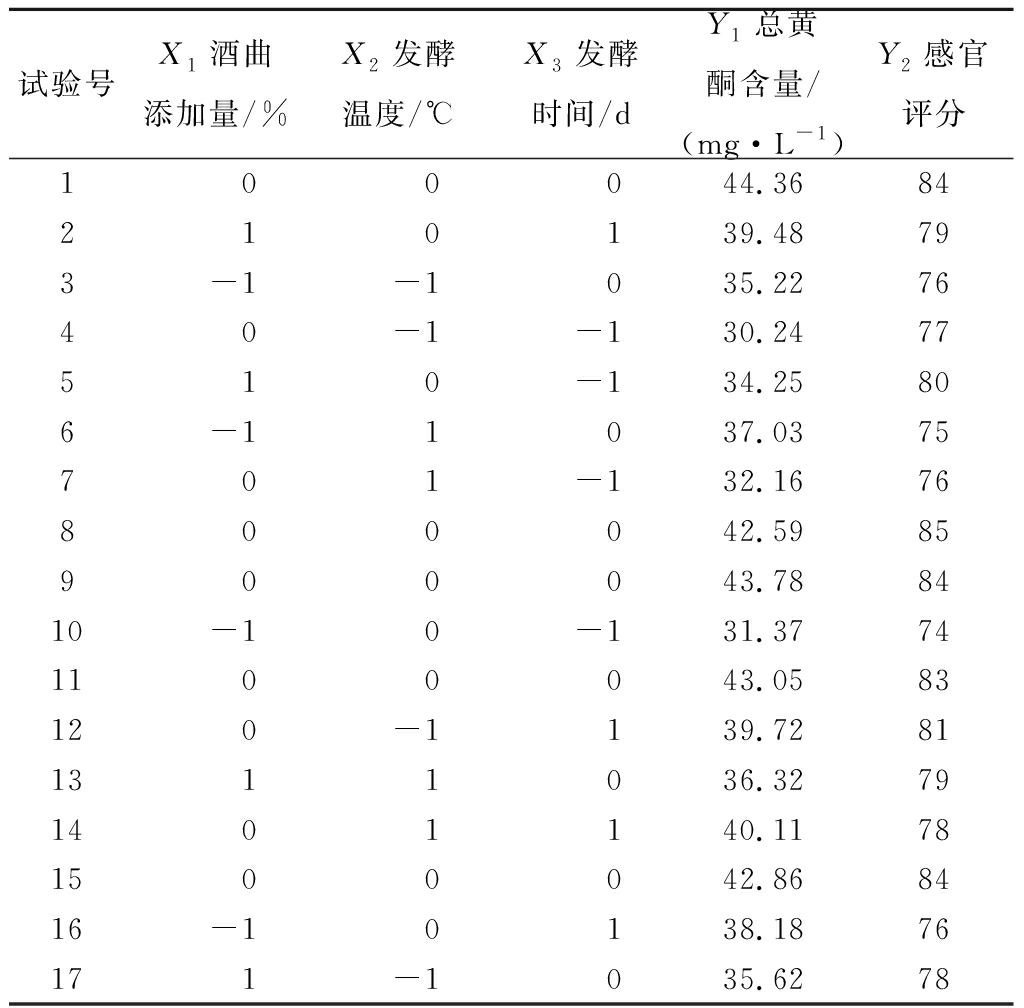
根据单因素试验的结果,确定蕨根添加量为20%,利用Design-Expert 6.0.5软件,通过box-behnken试验设计原理进行三因素三水平试验,以总黄酮含量和感官评分为响应值进行响应面试验,其因素水平设计与响应值结果如表3所示。
以蕨根米酒总黄酮含量(Y1)和感官评分(Y2)为响应值,建立蕨根米酒发酵工艺参数回归模型。得到模型的回归方程为:
表3 响应面试验设计方案及结果
Table 3 Results of Box-Behnken design
Y1=43.33+0.48X1+0.6X2+3.68X3-0.28X1X2-0.4X1X2-0.38X2X3-3.51 ![]()
![]()
对模型进行方差分析,结果如表4所示,建立的模型方程Y1和Y2极显著(p<0.000 1和p=0.000 4);失拟项在0.05水平上均不显著(p>0.05和p>0.05),表明试验结果和数学模型拟合良好,模型可用;拟合模型的相关系数R2分别为0.974 4和0.959 5,表明模型方程的拟合程度较好;本试验2个模型CV(变异系数)分别为2.86和1.37,在可接受的范围内,说明试验结果可靠。
从方差分析的结果可以看出,模型Y1一次项X3,二次项![]() 表现为极显著;一次项X1、X2,交互项X1X2、X1X3、X2X3均不显著。从F值可以看出各因素对总黄酮含量影响顺序为:发酵时间>发酵温度>酒曲添加量。模型Y2一次项X1,二次项
表现为极显著;一次项X1、X2,交互项X1X2、X1X3、X2X3均不显著。从F值可以看出各因素对总黄酮含量影响顺序为:发酵时间>发酵温度>酒曲添加量。模型Y2一次项X1,二次项![]() 表现为极显著;一次项X2、X3,交互项X1X2、X1X3、X2X3均不显著。从F值可以看出各因素对感官评分影响强弱顺序为:酒曲添加量>发酵时间>发酵温度。
表现为极显著;一次项X2、X3,交互项X1X2、X1X3、X2X3均不显著。从F值可以看出各因素对感官评分影响强弱顺序为:酒曲添加量>发酵时间>发酵温度。
2.2.2 验证试验结果
经软件Design-Expert 6.0.5分析得到:以总黄酮含量为响应值的最佳发酵参数为酒曲添加量1.52%、发酵温度28.17 ℃、发酵时间5.46 d,此时蕨根米酒总黄酮含量预测值为44.19 mg/L。根据实际情况选择酒曲添加量为1.5%、发酵温度为28 ℃、发酵时间为5.5 d的条件,在该条件下进行3次平行试验,得到蕨根米酒总黄酮含量为43.32 mg/L,与预测值的相对误差为1.97%,进一步验证模型方程Y1的实用性。
以感官评分为响应值的最佳发酵参数为酒曲添加量1.61%、发酵温度30.78 ℃、发酵时间5.13 d,此时蕨根米酒感官评分预测值为84.29。根据实际情况选择酒曲添加量为1.6%、发酵温度为31 ℃、发酵时间为5 d的条件,在该条件下进行3次平行试验,得到感官评分为83,与预测值的相对误差为1.53%,表明预测值与实际值相差不大,说明模型方程Y2能较好地反映各因素与感官评分的关系。
综上不同发酵工艺参数对蕨根米酒总黄酮含量和感官评分的影响,经软件对发酵参数进行分析后得到最佳工艺条件。酒曲添加量为1.57%、发酵温度为27.94 ℃、发酵时间为5.30 d,此时蕨根米酒总黄酮含量和感官评分预测值分别为44.03和84.18 mg/L。根据实际情况选择酒曲添加量为1.6%、发酵温度为28 ℃、发酵时间为5.5 d的条件,在此条件下进行3次平行实验后得到总黄酮含量为43.88 mg/L,感官评分为85,与预测值吻合,因此响应面优化蕨根米酒发酵工艺参数准确可靠。
表4 总黄酮含量和感官评分回归模型方差分析
Table 4 Analysis of variance in the regression model for sensory score and total flavonoids

2.3 产品质量指标
由表5可知,蕨根米酒的酒精度为12.65%,残糖含量为25.03 g/L,总酸含量为3.61 g/L,符合传统型半干黄酒理化要求。菌落总数小于34 CFU/mL,大肠杆菌和致病菌均未检出,符合国家标准。
表5 蕨根米酒产品质量分析
Table 5 Analysis of product quality of fern rice wine

2.4 蕨根米酒抗氧体外化活性评估
不同的抗氧化性能评估其反应物之间的机制存在着差异,因此单一的抗氧化性能的测定难以反映抗氧化能力。本研究通过4种方法对蕨根米酒体外抗氧化能力进行评估,结果如图5所示。
清除DPPH自由基是常见的抗氧化评价方法[18]。由如图5-a所示,蕨根米酒的DPPH自由基清除能力高于米酒,且随着样品体积的增加,其DPPH自由基清除率逐渐增加,表现出一定的剂量依赖性。在试验的体积范围内,蕨根米酒的DPPH自由基清除率从12.12%增加到62.18%,米酒的DPPH自由基清除率从10.62%增至50.31%。通过计算得到,蕨根米酒的IC50为0.038 mgVC/mL,米酒的IC50为0.022 mgVC/mL,两者的差异显著(p<0.05)。可能是因为蕨根中含有酚类物质和黄酮类化合物,在发酵过程进入到米酒中,表现出一定的抗氧化活性。SINGH[19]等研究表明酚类和黄酮类化合物参与自由基链的终止反应,从而表现出自由基清除能力。
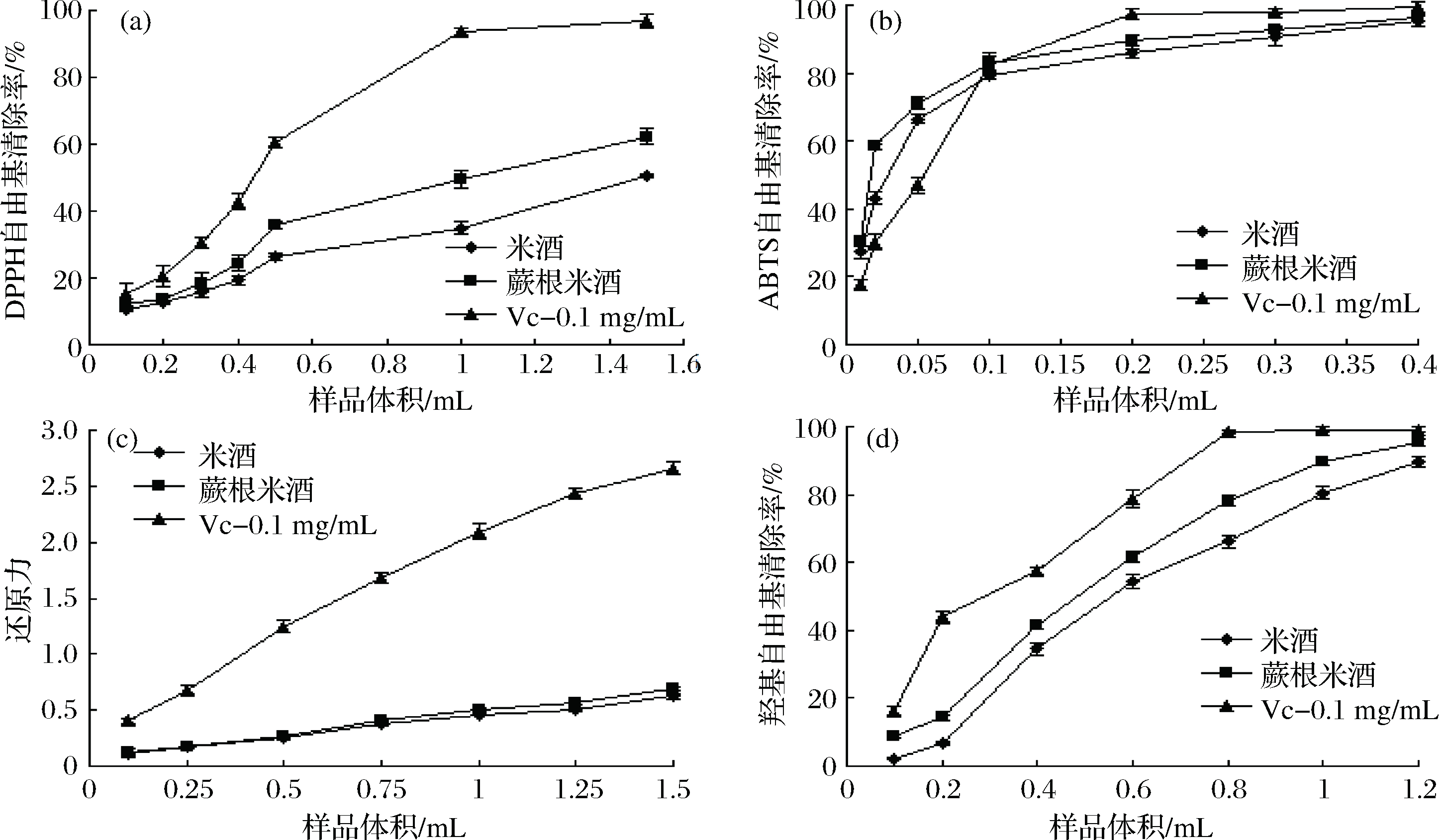
a-DPPH自由基清除能力;b-ABTS自由基清除能力;c-还原力;d-羟基自由基清除能力
图5 蕨根米酒抗氧化活性
Fig.5 Antioxidant activity of fern rice wine
图5-b显示的是蕨根米酒对ABTS自由基清除能力的影响。在试验浓度范围内,蕨根米酒ABTS自由基清除能力略大于米酒;当样品加入量在0.01~0.1mL时,蕨根米酒ABTS自由基清除能力大于Vc试验组;当样品加入量大于0.2 mL后,蕨根米酒、米酒和Vc对照组的ABTS自由基清除能力均逐渐趋于稳定且蕨根米酒、米酒ABTS自由基清除能力低于VC试验组;当样品加入量为0.4 mL时,蕨根米酒、米酒和VC对照组的ABTS自由基清除能力分别为95.41%、96.13%和99.25%;计算得知蕨根米酒和米酒的IC50分别为0.779 mgVC/mL、0.569 mgVC/mL,两者差异显著(p<0.05)。从IC50可以看出,蕨根米酒ABTS自由基清除能力大于DPPH自由基清除能力,这可能是由于抗氧化剂对不同的自由基的反应速率不一样,HUANG等[20]研究报道许多抗氧化剂与脂质过氧化反应产生的过氧自由基反应迅速,而与DPPH自由基反应较慢。
由图5-c可知,蕨根米酒还原力随样品加入量的增加而增加,也表现出剂量依赖性,蕨根米酒还原力稍高于米酒,远低于VC对照组。在实验样品加入量范围内,蕨根米酒的还原力从0.123增加到0.692,米酒的还原力从0.110增至0.623。MARAZZA[21],LEE等[22]研究表明还原力与多酚类物质抗氧化活性密切相关,还原力也与存在还原酮的供氢能力关系密切。由此可知,蕨根米酒在发酵过程中可能形成了还原剂而提高其还原力;此外,细胞内抗氧化剂,生物体的肽和它们的供氢能力也有助于还原力的增加[15,22]。
在活性氧中,羟自由基是最活泼的自由基,能够诱导生物分子氧化损伤[23]。由图5-d所示,蕨根米酒的羟基自由基清除能力随样品加入量的增加而增加,同时表现出剂量依赖性,蕨根米酒羟基自由基清除能力高于米酒,低于VC对照组。蕨根米酒和米酒的IC50分别为2.335 mgVC/mL、1.822 mgVC/mL,两者差异显著(p<0.05)。蕨根米酒表现出较强的羟基自由基清除能力,高于DPPH自由基和ABTS自由基的清除能力,这可能是由于在蕨根米酒中存在着对羟基自由基清除较强的活性物质。
3 结论
本研究以糯米和蕨根为原料制得蕨根米酒,通过单因素和Box-Behnken设计试验,采用响应面分析法优化蕨根米酒发酵工艺条件,得到优化的工艺条件为:蕨根粉添加量为20%、酒曲添加量为1.6%、发酵温度为28 ℃、发酵时间为5.5 d,在此条件下得到蕨根米酒总黄酮含量43.88 mg/L,感官评分85,酒精度为12.65%、残糖含量25.03 g/L、总酸含量3.61 g/L、可溶性固形物含量8.89%,菌落总数、大肠杆菌、致病菌总数均符合国家标准。体外抗氧化活性研究表明:蕨根米酒的DPPH自由基清除率、ABTS自由基清除率、还原力、羟基自由基清除率在实验体积的范围内均表现出剂量依赖性,而且蕨根米酒的4种抗氧化能力都高于米酒。从IC50可以看出,蕨根米酒的自由基清除能力顺序是:羟基自由基清除率(2.335 mgVC/mL)>ABTS自由基清除率(0.779 mgVC/mL)>DPPH自由基清除率(0.038 mgVC/mL)。蕨根米酒是一种富含黄酮类物质、有机酸、氨基酸等多种成分,具有一定养生功能的饮品。
参考文献
[1] 陈心启.中国植物志(三卷1分册)[M].北京:科学出版社,1990: 240-241
[2] 刘蓉燕.蕨根保健酒发酵工艺研究[J].现代食品科技, 2009,25(4):428-430.
[3] 蔡自建,陈炼红,刘鲁蜀.超声波辅助提取蕨根总黄酮的工艺研究[J].西南民族大学学报(自然科学版), 2016,42(1):47-51.
[4] 黄亮,孙昌波,李忠海,等.蕨根、葛根和马铃薯淀粉油炸膨化加工性质的比较研究[J].食品工业科技,2011,32(6):139-142.
[5] 陈恋.蕨根淀粉理化性质及抗性淀粉制备工艺的研究[D].重庆:西南大学, 2008.
[6] 曹清明,钟海雁,李忠海,等.蕨根淀粉糊的老化特性及影响因素[J].食品工业科技,2007(12):114-117.
[7] 周蒙,颜振敏,程娇娇,等.响应面优化发酵型山药米酒的工艺[J].食品研究与开发,2017,38(12):71-76.
[8] 石思文.羊肚菌营养强化米酒发酵工艺的优化//中国食品科学技术学会.中国食品科学技术学会第十一届年会论文摘要集[C].中国食品科学技术学会,2014:2.
[9] 汪建国.黄酒的营养价值及保健功能[J].中国酿造,1998(6):34-35.
[10] 肖贵平.果胶酶对莲心中黄酮类物质提取效果研究[J].中国农学通报,2012,28(3):267-271.
[11] 中国国家标准化管理委员会.GB/T 13662—2008黄酒[S].北京:中国标准出版社,2009.
[12] 陈廷廷,刘波,王秀梅,等.川西高原当归药花蜜酒发酵条件优化及其风味成分分析[J].食品工业科技, 2017,38(15):140-145,152.
[13] XIAO Y,XING G L,RUI X,et al.Enhancement of the antioxidant capacity of chickpeas by solid state fermentation with Cordyceps militaris SN-18[J].Journal of Functional Foods,2014,10:210-222.
[14] YE C L, HU W L, DAI D H.Extraction of polysaccharides and the antioxidant activity from the seeds of Plantago asiatica L[J]. International Journal of Biological Macromolecules,2011,49(4):466-470.
[15] LIN C H,WEI Y T,CHOU C C.Enhanced antioxidative activity of soybean koji prepared with various filamentous fungi[J]. Food Microbiology, 2006, 23(7):628-633.
[16] 蒋增良,刘晓庆,王珍珍,等.葡萄酵素有机酸分析及其体外抗氧化性能[J].中国食品学报,2017,17(5):255-262.
[17] 赵翾,刘功良,李红良,等.响应面法优化香梨米酒的发酵工艺研究[J].中国酿造,2017,36(10):186-189.
[18] 来吉祥.黑豆萌芽水提物抗氧化活性研究及其机理初探[D].无锡:江南大学, 2014.
[19] SINGH H B, SINGH B N, SINGH S P, et al. Solid-state cultivation of Trichoderma harzianum NBRI-1055 for modulating natural antioxidants in soybean seed matrix[J]. Bioresource Technology, 2010, 101(16):6 444-6 453.
[20] HUANG D,OU B, PRIOR R L.The chemistry behind antioxidant capacity assays[J].J Agric Food Chem,2005, 53(6):1 841-1 856.
[21] MARAZZA J A,NAZARENO M A,DEGIOR G S,et al. Enhancement of the antioxidant capacity of soymilk by fermentation with Lactobacillus rhamnosus[J]. Journal of Functional Foods, 2012, 4(3):594-601.
[22] LEE I H, HUNG Y H, CHOU C C. Solid-state fermentation with fungi to enhance the antioxidative activity, total phenolic and anthocyanin contents of black bean[J]. International Journal of Food Microbiology, 2008, 121(2):150-156.
[23] LIU J, LUO J G, YE H, et al. Production, characterization and antioxidant activities in vitro, of exopolysaccharides from endophytic bacterium Paenibacillus polymyxa EJS-3[J]. Carbohydrate Polymers, 2009, 78(2):275-281.