D-葡萄糖二酸(D-glucaric acid)作为非常重要的有机酸已被广泛研究,其在医疗和工业中有着广泛的应用,比如降胆固醇、治疗糖尿病、肿瘤治疗等等[1],或可能用作聚合物前体,包括新型尼龙和高度分支聚酯。目前已经有利用产自葡萄糖的葡萄糖二酸制备羟基化尼龙的报道,羟基化尼龙是可生物降解的纤维[2-3]。在美国太平洋西北国家实验室、国家再生能源实验室和美国能源部写的一份报告中,葡萄糖二酸被认为是“top value-added chemical from biomass”。由于该有机酸的重要性,正越来越得到学术界和工业界的重视。
目前生产葡萄糖二酸的方法主要以化学法为主,即葡萄糖的化学氧化,采用硝酸作为溶剂和氧化剂,这是一个非选择性、高成本的过程[4]。化学法的主要问题是低得率,只有不到40%;需要高温;会产生大量氧化反应副产物,不利于后续葡萄糖二酸的分离[5]。生物法合成葡萄糖二酸相较于传统的化学法,有着很多的优势,比如环境更加友好,更大地实现低成本生产的可能性。生物法产葡萄糖二酸有很多种途径[6-8]。在合适的菌种中构建高效稳定的葡萄糖二酸合成途径,应用于工业生产,取代传统的化学途径,将是非常有前景的研究领域[9-10]。
早在2009年,PRATHER领导的研究团队就在大肠杆菌中构建了葡萄糖到葡萄糖二酸的代谢途径,首次实现葡萄糖二酸在微生物中的合成[11]。通过表达不同生物来源的肌醇加氧酶(myo-inositol oxygenase,MIOX)和糖醛酸脱氢酶(uronate dehydrogenase,UDH)基因,5步反应即实现大肠杆菌中葡萄糖到葡萄糖二酸的转化。在LB培养基中,摇瓶发酵时葡萄糖二酸产量最高达到1.13 g/L,转化率最高可达17.4%。由于葡萄糖二酸发酵时的低pH值对大肠杆菌具有毒害作用,PRATHER教授的团队还将葡萄糖二酸的合成途径从大肠杆菌转移到酿酒酵母中[12]。在该研究中,表达拟南芥来源的肌醇氧化酶MIOX4和丁香假单胞菌来源的糖醛酸脱氢酶UDH,以葡萄糖为底物,葡萄糖二酸最大产量分别为:分批发酵0.56 g/L,补料分批发酵0.98 g/L,而添加60 mmol/L肌醇后补料分批发酵1.6 g/L。
本研究以酿酒酵母为宿主,构建葡萄糖二酸的合成途径,选择在酿酒酵母中稳定表达的miox4基因[13-14],构建游离型质粒表达系统,针对质粒表达的不稳定性采用整合多拷贝delta位点表达miox4和udh,最终提高葡萄糖二酸的产量,为葡萄糖二酸的实际发酵生产应用奠定坚实的基础
1 材料和方法
1.1 材料和试剂
1.1.1 主要仪器和试剂
梯度PCR仪,美国Bio-Rad公司;小型电泳槽,美国Bio-Rad公司;液相色谱仪,上海精密科学仪器有限公司分析仪器总厂;5810R型高速冷冻离心机,德国Eppendorf公司。
Prime STAR DNA Polymerase,Ex Taq DNA Polymerase,T4 DNA Ligase,限制性内切酶等均购自宝生物工程(大连)有限公司;SanPrep柱式质粒DNA小量抽提试剂盒,胶回收试剂盒等购自生工生物工程(上海)股份有限公司,其他试剂均为市售国产或进口分析纯产品,目的基因miox4和udh及引物均由苏州金唯智生物科技有限公司合成。
1.1.2 菌种和质粒(表1)
本研究所用菌株和质粒如表1所示。
表1 本研究所用菌株和质粒
Table 1 Strains and plasmids used in this study

1.1.3 培养基
YPD培养基:蛋白胨20 g/L,酵母粉10 g/L,葡萄糖20 g/L。固体培养基添加20 g/L琼脂粉。
SD-URA/SD-HIS培养基:酵母氮源1.7 g/L,葡萄糖20 g/L,硫酸铵5 g/L,补加适量的必须氨基酸。固体培养基添加20 g/L琼脂粉。
LB培养基:蛋白胨20 g/L,酵母粉10 g/L,葡萄糖20 g/L。固体培养基添加20 g/L琼脂粉。
1.2 方法
1.2.1 基因合成及PCR扩增
由美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)获得来自拟南芥的肌醇加氧酶基因miox4和丁香假单胞菌的udh,经过密码子优化,由苏州金唯智生物公司合成得到pUC57-miox4-udh。以此质粒为模板,分别扩增肌醇合成途径关键酶基因miox4、udh。本研究使用的引物见表2。
表2 本研究所用引物
Table 2 Primers used in this study

注:下划线序为融合PCR互补序列。
1.2.2 敲除OPI1基因
以pUG6质粒为模板扩增敲除框(含loxp-kan-loxp组件),敲除框带有OPI1基因上下游各50 bp碱基作为同源臂。用醋酸锂化学转化法转化酿酒酵母BY4741感受态,涂布G418抗性平板,2 d后长出单菌落。用引物OPI1kochkF和OPI1kochkR和菌落PCR验证得到正确条带,将正确菌株摇瓶培养至对数期,提取基因组验证。以此菌株做感受态,转化pSH65质粒,半乳糖诱导Cre切除抗性基因KanMX4,验证切除正确后,在YPD液体培养基中连续传代以丢失质粒pSH65,获得敲除OPI1基因的菌株BY4741opi1Δ。
1.2.3 质粒构建
选择组成型质粒pY26,在其多克隆位点BglII/NotI插入miox4片段,得到pY26-miox4质粒,利用Gibson Assembly组装构建pY26-miox4-udh;用NcoI和XhoI分别双酶切pY26质粒和PCR产物,由T4连接酶过夜连接,得到pY26-miox4-6×His。
1.2.4 Western blot
重组菌Bga-1在SD-URA培养基中培养到OD600值为0.6~0.8,按10%的接种量转接在50 mL的SD-URA培养基,以带有质粒pY26的菌株作为空白对照。培养24 h,进行Western blot验证蛋白是否表达。将pY26-miox4-6×His转化酿酒酵母BY4741opi1Δ,在YPD中培养24 h。收集菌体提取蛋白测酶活,总蛋白质浓度测定按照Bradford法,以BSA为标准。
1.2.5 整合delta位点片段的构建
以酿酒酵母基因组为模板,用genF-1/genR-1和genF-6/genR-6为引物分别扩增delta1和delta2片段,以上述质粒pY26-miox4-udh为模板,用genF-2/genR-2和genF-5/genR-5为引物分别扩增miox4和udh表达原件,以质粒pRS313为模板,用genF-3/genR-3和genF-4/genR-4为引物分别扩增组氨酸筛选标记表达元件HIS1和HIS2。将上述PCR产物胶回收,用降落PCR方法将delta1、miox4表达原件、HIS1和HIS2、udh表达原件、delta2融合成带有同源臂delta1和delta2的2个片段,如图1所示。
1.2.6 MIOX4酶活测定

图1 整合菌酵母构建示意图
Fig.1 Construction of the engineering yeast strain
离心收集菌体重悬于50 mmol/L Tris-HCl(pH 7.0)缓冲液,冰浴超声破碎20 min,4 ℃离心l0 min,Bradford法测定上清液中蛋白质浓度并测定酶活。总反应体积200 μL:50 mmol/L Tris-HCl缓冲液(pH 7.0),2.0 mmol/L L-半胱氨酸,1.0 mmol/L硫酸亚铁铵,60 mmol/L肌醇,一定量酶液。
反应体系加入肌醇后于室温反应1 h,煮沸15 min终止反应,离心取上清,用Orcinol reagent显色法测定葡萄糖醛酸的浓度。Orcinol reagent:100 mL 37% HCl,0.1 g地衣酚,0.1 g FeCl3。1体积的反应液与2体积的Orcinol reagent在沸水浴中加热30 min,冷却至室温后测定OD660值,通过比对标准曲线获得葡萄糖醛酸的含量,酶活实验以不添加肌醇的反应体系作为对照,进而测定酶活[15]。1个酶活力单位:将l min内能转化1 nmol肌醇所需的酶量定义为1个酶活单位。
1.2.7 培养方法
挑取单菌落接种到10 mL YPD液体培养基中,250 r/min,30 ℃过夜培养至OD600值约为5.0左右,按初始OD600值约为0.1转接至装有50 mL液体YPD培养基(含60 mmol/L肌醇)的250 mL锥形瓶中,在发酵进行到24 h和48 h时,分别补加5 g/L的葡萄糖[12],进行补料分批发酵240 h。
1.2.8 有机酸等代谢产物的检测
发酵液离心取上清液,用规格0.22 μm的滤膜过滤后,取滤液。即可通过液相色谱-质谱连用(LC-MS)检测,或通过高效液相色谱(HPLC)检测[12]。
2 结果和分析
2.1 敲除OPI1阻遏基因
在酿酒酵母中,从葡萄糖开始合成肌醇的生物合成与代谢途径基本明晰。在肌醇的合成过程中,肌醇-1-磷酸合成酶是关键酶,该酶的编码基因为INO1,是酵母中受控制最严格的基因之一。报道称肌醇-1-磷酸合成酶的表达受到其产物肌醇的反馈抑制,抑制过程通过阻遏因子基因OPI1来完成[16]。因此,要实现肌醇的过量积累,必须敲除OPI1这个转录负调控基因。最终成功敲除OPI1得到酿酒酵母BY4741opi1Δ菌株,如图2所示。敲除后的菌株与原始野生菌株BY4741相同条件下进行发酵,肌醇的积累量为0.69 g/L,与野生型菌株相比明显提高,如图3所示。

M-5 000 bp DNA marker;1-对照菌株1 602 bp; 2-含有OPI1敲除组件的菌株,2 025 bp;3- kan标记被消除的菌株
图2 基因OPI1的敲除和PCR验证
Fig.2 Confirmation the deletion of gene OPI1 by PCR
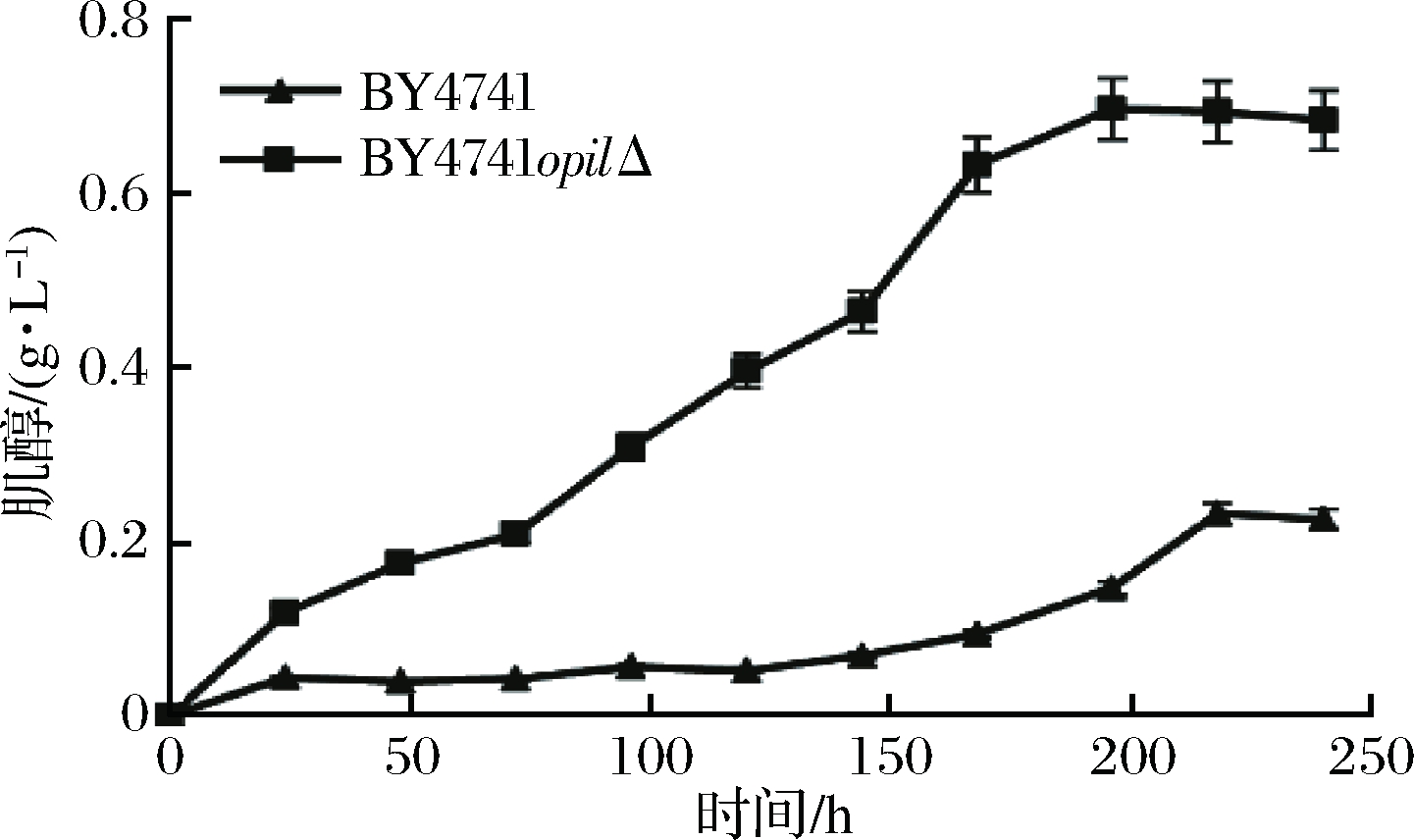
图3 OPI1基因敲除前后肌醇产量对比
Fig.3 Comparison of myo-inositol yield before and after the deletion of OPI1
2.2 葡萄糖二酸生产途径关键基因表达验证
研究发现葡萄糖二酸合成途径中肌醇氧化酶是限速步骤,来源于小鼠的肌醇氧化酶极不稳定,在培养基加60 mmol/L肌醇的培养条件下6 h达到最高酶活,之后急剧下降[11],找到更加稳定高效的肌醇氧化酶是提高葡萄糖二酸产量的关键因素之一。研究发现,在拟南芥中存在一条以肌醇为底物的合成途径,肌醇氧化酶是这个途径中的关键酶[13-14],对拟南芥中的肌醇氧化酶进行酶活性质检测,结果发现酶活较高,远高于隐球菌酵母、猪类动物[18],这为寻找更加合适的肌醇氧化酶提供了思路。
将来源于拟南芥的肌醇氧化酶基因miox4经过密码子优化并融合表达1个组氨酸标签,通过构建质粒pY26-miox4-6×His在酵母中表达,将构建好的质粒转化酿酒酵母BY4741opi1Δ得到菌株Bga-1,以酿酒酵母BY4741opi1Δ携带pY26质粒为对照,发酵24 h。将样品提取总蛋白并调节蛋白浓度一致,做Western blot验证,结果如图4所示,大小为37 kDa,与理论值相符[18],说明miox4基因成功表达。
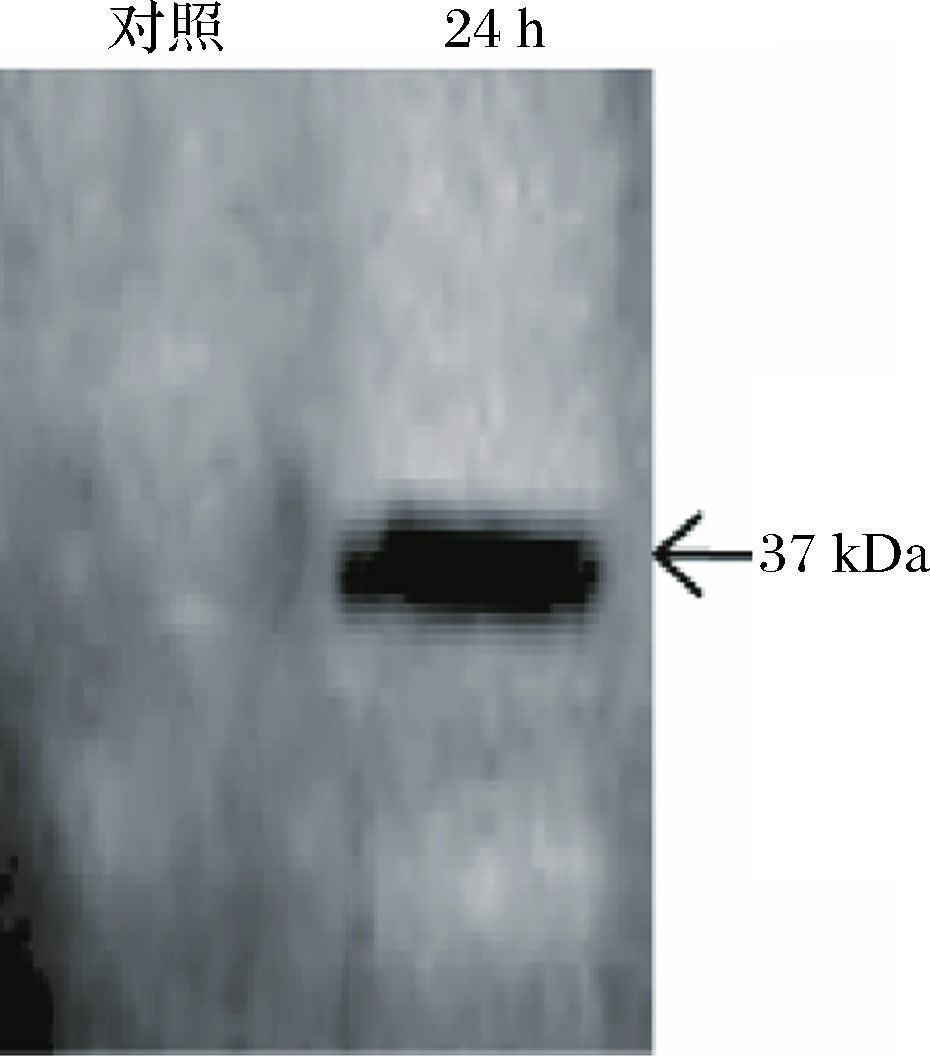
图4 MIOX4蛋白Western blot检测结果
Fig.4 Western blot analysis of MIOX4
2.3 葡萄糖二酸游离表达菌株发酵验证
以酿酒酵母BY4741opi1Δ为出发菌株,将本研究构建好的表达载体pY26-miox4-udh经LiAc高效转化法导入BY4741opi1Δ,筛选出阳性转化子,得到重组菌Bga-2。对重组菌Bga-2进行摇瓶发酵实验,以BY4741opi1Δ为对照组,发酵240 h左右,把样品处理后经LC-MS质谱检测,结果如图5所示,说明导入葡萄糖二酸合成外源基因的酿酒酵母可以实现葡萄糖二酸的生产。

图5 LC-MS检测葡萄糖二酸标准品(a)和发酵样品(b)
Fig.5 LC-MS detection of glucaric acid (a) and fermentation sample (b)
经过质谱检测之后,发酵样品经过高效液相检测,结果如图6所示,葡萄糖二酸积累量可达0.54 g/L,但是产量较低,如何提高产量是后续实验的主要目标。
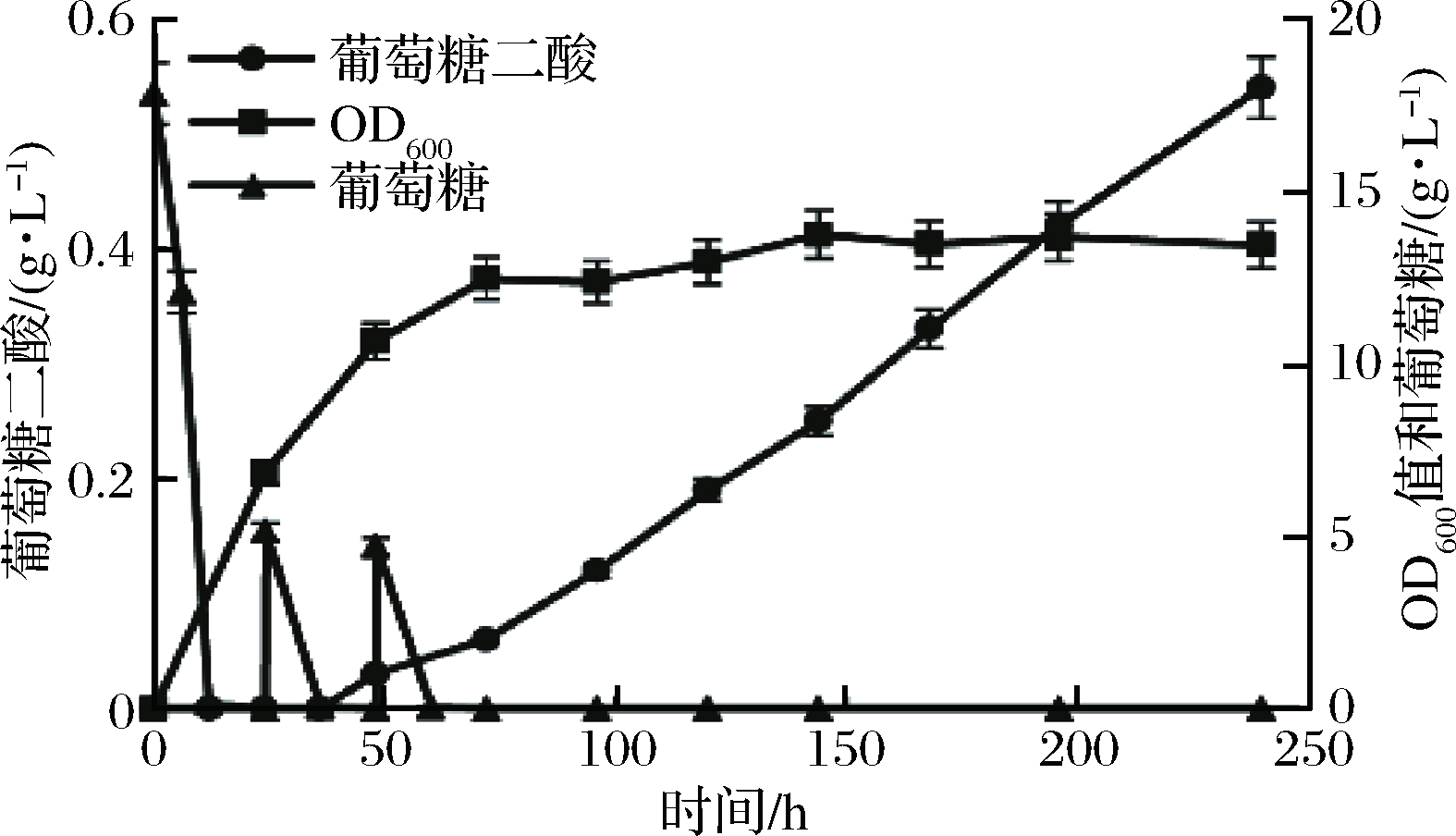
图6 Bga-2菌株在YPD培养基中发酵结果
Fig.6 Fermentation profile of Bga-2 strain in YPD medium
2.4 葡萄糖二酸合成途径delta位点整合型酵母菌株的构建
考虑到产量比较低,原因可能是游离质粒不稳定易丢失。由于酿酒酵母表达系统比较复杂,能够使用的载体类别非常有限。本实验采用的质粒pY26即为YEP型,这类质粒常用于酿酒酵母中异源蛋白的表达,但此类质粒会因酿酒酵母的有丝分裂而急剧下降导致外源基因丢失。为解决外源基因丢失,表达不稳定现象及增加目的基因整合位点拷贝数,有一些新方法,如以delta序列为整合位点的DNA重组技术[19-20]。
利用delta序列同源重组方法,将外源基因整合到酿酒酵母染色体组的效率比传统的方法高许多,且目的基因表达稳定,为人工构建酿酒酵母基因组整合表达模块提供了思路。综合以上考虑,本研究基于酿酒酵母delta序列,构建了一个以delta序列为整合位点并且包含GPD和TEF强启动子以组氨酸标签为筛选标记的2个DNA片段,将miox4和udh整合到酿酒酵母的染色体进行外源表达。将融合好的2个片段用LicA高效转化法导入酿酒酵母细胞内,由于这2个片段各自带有组氨酸筛选标记基因序列的一部分,利用同源重组原理,这2个片段整合成功的菌株可以在SD-HIS的平板上生长即为阳性克隆子。在SD-HIS平板上挑取单菌落培养提取基因组进行PCR验证,以菌株BY4741opi1Δ为对照,如图7所示,整合成功的菌株命名为Bga-3。

M-10 000 Marker;条带1-Bga-3;条带2-对照菌株
图7 delta位点整合PCR验证
Fig.7 Confirmation the correct construction of the delta site integration by PCR
将Bga-3进行补料分批发酵,取发酵后的样品通过液相色谱检测葡萄糖二酸产量,发酵结果如图8所示,葡萄糖二酸产量可达3.80 g/L,产量是Bga-2菌株的7.17倍。

图8 Bga-3菌株发酵结果
Fig.8 Fermentation profile of Bga-3 strain in YPD medium
2.5 肌醇氧化酶的酶活分析
MOON等[11]全合成老鼠来源的肌醇氧化酶基因序列,将其克隆在高效表达质粒pTrc上,并转化到E.coli BL21(DE3)进行表达,比酶活达430 U/mg。但是得出小鼠来源的肌醇氧化酶活性极不稳定,在培养基加60 mmol/L肌醇的培养条件下6 h达到最高酶活,之后急剧下降,是葡萄糖二酸代谢途径的限制因素之一。因此本研究选择酶活更加稳定高效的拟南芥来源的肌醇氧化酶MIOX4。
本研究对游离质粒表达的菌株和整合delta位点的菌株进行MIOX4的比酶活测定,培养条件相同,培养基均为YPD培养基中添加60 mmol/L肌醇。结果如图9所示。
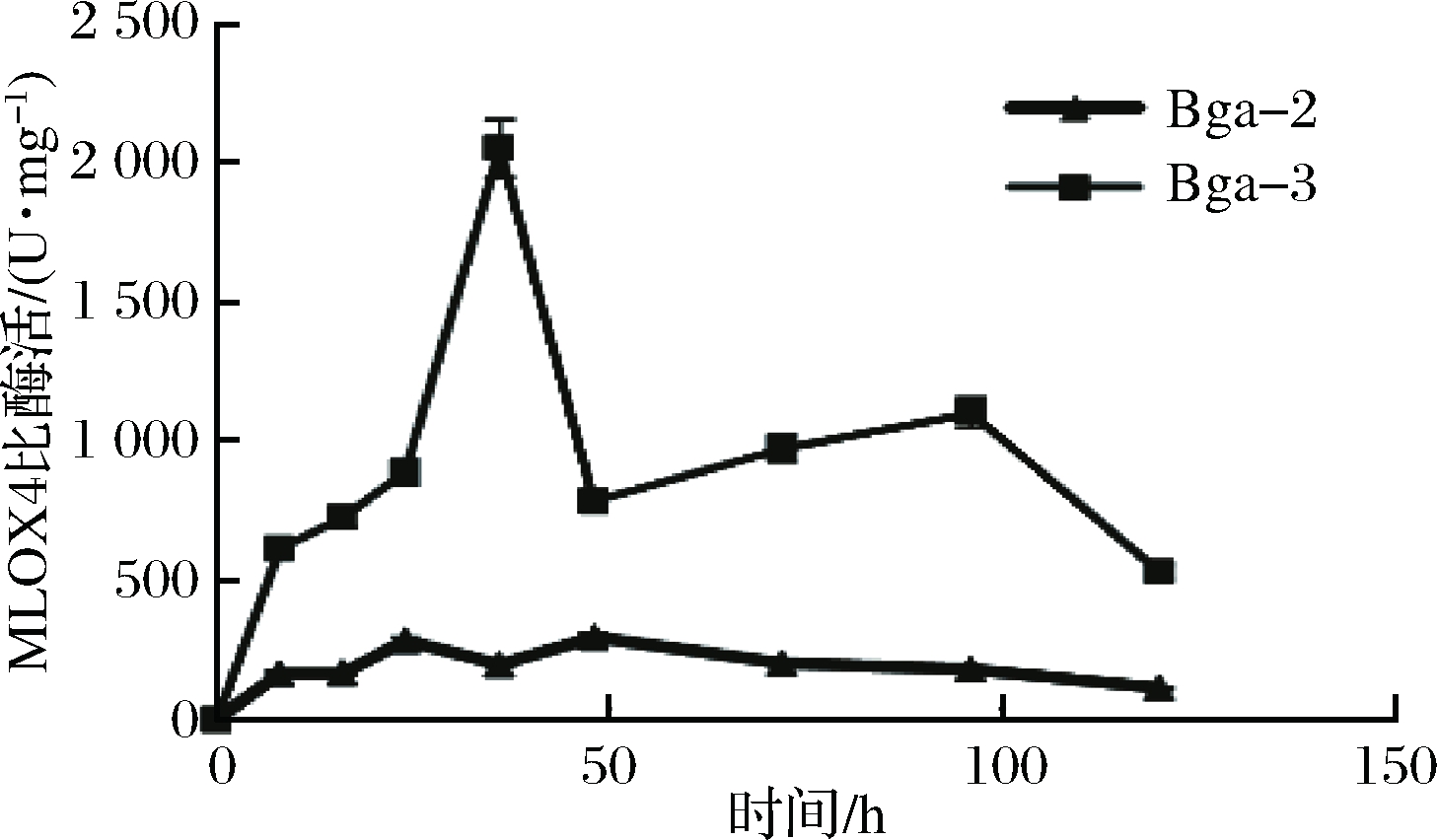
图9 Bga-2和Bga-3中MIOX4的比酶活
Fig.9 MIOX4 specific activity in Bga-2 strain and Bga-3 strain with 60 mmol/L myo-inositol
Bga-3中MIOX4比酶活在36 h达到最高为2 050 U/mg,之后比酶活逐渐降低并维持在500 U/mg之上,与游离质粒表达的最高酶活295 U/mg相比,整合表达的MIOX4更稳定,不管是质粒表达还是整合表达,在酿酒酵母中,肌醇氧化酶的活性都没有出现急剧下降至酶活很低的状况,而是酶活在逐渐下降并维持在一定活力之上。
3 结论
为了积累葡萄糖二酸的前体物质肌醇,运用loxP-kanMX4-loxP系统敲除了肌醇合成途径中阻遏基因OPI1。外源基因通过游离质粒表达,在酿酒酵母中成功构建葡萄糖二酸合成途径,获得菌株Bga-2。YPD培养基中添加60 mmol/L肌醇、在24、48 h补加5 g/L葡萄糖的培养条件下,葡萄糖二酸产量为0.54 g/L。
本研究选择酵母基因组中的delta位点作为整合位点进行外源基因的过表达,获得整合表达表达菌株Bga-3,增加外源基因的拷贝数。与游离质粒表达菌株Bga-2比较,相同培养条件下,葡萄糖二酸产量明显提高,为3.80 g/L。分别对游离质粒表达的菌株Bga-2和整合表达菌株Bga-3中MIOX4的比酶活进行测定,结果显示delta位点整合表达菌株中的MIOX4比酶活远高于游离质粒表达菌株。
参考文献
[1] WALASZEK Z. Potential use of D-glucaric acid derivatives in cancer prevention [J]. Cancer Letters, 1990, 54(1/2): 1-8.
[2] DONALD E K, CHEN L, LIN T H. Hydroxylated nylons based on unprotected esterified[J]. American Chemical Society, 1994, 116(2): 571-578.
[3] DONALD E K, CHEN L, LIN T H. Simple preparation of hydroxylated nylons—polyamides derived from aldaric acids[J]. American Chemical Society, 1994, 575(4): 149-158.
[4] LAKATOS A, BERTANI R, KISS T, et al. AlIII ion complexes of saccharic acid and mucic acid: a solution and solid-state study [J]. Chemistry- A European Journal, 2004, 10(5): 1 281-1 290.
[5] IBERT M, FUERTES P, Merbouh N, et al. Improved preparative electrochemical oxidation of D-glucose to D-glucaric acid [J]. Electrochimica Acta, 2010, 55(10): 3 589-3 594.
[6] LEE J, SAHA B, VLACHOS D G. Pt catalysts for efficient aerobic oxidation of glucose to glucaric acid in water [J]. Green Chemistry, 2016, 18(13): 3 815-3 822.
[7] SOLMI S, MORREALE C, OSPITALI F, et al. Oxidation of D-Glucose to glucaric acid using Au/C catalysts [J]. Chem Cat Chem, 2017, 9: 2 797-2 806.
[8] STEPHANOPOULOS G. Synthetic biology and metabolic engineering [J]. ACS Synthetic Biology, 2012,1(11): 514-525.
[9] NIELSEN J. Synthetic biology for engineering acetyl coenzyme a metabolism in yeast [J]. Mbio, 2014, 5(6): e02153.
[10] MOON T S, YOON S, LANZA A M. Production of glucaric acid from a synthetic pathway in recombinant Escherichia coli [J]. Applied and Environmental Microbiology, 2009, 75(3): 589-595.
[11] GUPTA A, HICKS M A, MANCHESTER S P, et al. Porting the synthetic D-glucaric acid pathway from Escherichia coli to Saccharomyces cerevisiae [J]. Biotechnology Journal, 2016, 11(9): 1 201-1 208.
[12] WHEELER G L, JONES M A, SMIRNOFF N. The biosynthetic pathway of vitamin C in higher plants [J]. Nature, 1998, 393: 365-369.
[13] SMIRNOFF N, WHEELER G L. Ascorbic acid in plants: biosynthesis and function [J]. Critical Reviews in Plant Sciences, 2000, 19(4): 267-290.
[14] REDDY C C, PIERZCHALA P A, HAMILTON G A. Myo-inositol oxygenase from hog kidney II. catalytic properties of the homogenous enzyme [J]. The Journal of Biological Chemistry, 1981, 256(16): 8 519-8 524.
[15] HENRY S A, GASPAR M L, JESCH S A. The response to inositol: Regulation of glycerolipid metabolism and stress response signaling in yeast [J]. Chemistry and Physics of Lipids, 2014, 180(5): 23-43.
[16] BOEKE J D, LACROUTE F, FINK G R. A positive selection for mutants lacking orotidine-5’-phosphate decarboxylase activity in yeast: 5-fluoro-orotic acid resistance [J]. Molecular Genetics and Genomics, 1984, 197(2): 345-346.
[17] LORENCE A, CHEVONE B I, MENDES P, et al. Myo-inositol oxygenase offers a possible entry point into plant ascorbate biosynthesis [J]. Plant Physiology, 2004, 134(3): 1 200-1 205.
[18] PAREKH R N, Shaw M R, Wittrup K D. An integrating vector for tunable, high copy, stable integration into the dispersed Ty δ Sites of Saccharomyces cerevisiae[J]. Biotechnology Progress, 1996, 12(1): 16-21.
[19] LEE F W F, SILVA N A D. Sequential δ-integration for the regulated insertion of cloned genes in Saccharomyces cerevisiae [J] Biotechnology Progess, 1997, 13(4): 368-373.
[20] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method [J]. Methods, 2001, 25(4): 402-408.