α-酮戊二酸是一种重要的短链羧酸分子,是连接细胞内碳-氮代谢的关键节点,能表征细胞中的碳-氮平衡水平,在机体内参与氨基酸、蛋白质、维生素的合成并调控多种能量代谢,比如细胞碳、氮源代谢等调节过程,是一种重要的营养物质,在各个领域都具有广泛的应用前景[1-4]。α-酮戊二酸可以减轻肾病患者的肾脏负担、促进患者手术后快速恢复和减少并发症,因此在医学领域具有重要的应用价值;α-酮戊二酸能迅速帮助人体补充能量,恢复人体机能,因此在食品领域具有广泛的应用前景;此外,α-酮戊二酸因为其特殊的化学性质还广泛应用于化学有机合成领域[5-8]。
目前,化学合成法和微生物发酵法是α-酮戊二酸生产的2种主要方法。但是由于α-酮戊二酸分子中同时存在羰基和羧基的特殊化学结构,使其化学合成工艺路线长而复杂、收率低、生产成本较高,在合成过程中涉及一系列复杂的化学反应过程,并且存在合成原料氰化物有毒以及环境污染等问题[9],因此制约了化学合成α-酮戊二酸在医药、食品等领域的应用。近年来,研究发现微生物发酵法生产α-酮戊二酸具有成本低、产量高、生产过程环保可持续等优点,并且全球非可再生资源的快速消耗和环境问题的日益突出,使得循环利用可再生资源,即利用微生物发酵法[8]生产α-酮戊二酸成为最佳选择,也成为研究热点。但发酵法生产α-酮戊二酸的难点是找到一种合适的方法来分离、提纯发酵液中的α-酮戊二酸。
双水相萃取技术近年来日益受到人们的重视,是一种引人注目、极有前途的新型分离技术,与传统的萃取分离技术相比具有界面张力低、分离迅速,含水量高、操作条件温和,易于连续操作,分离提纯效率高,成本低,过程易于放大,低毒性等特点,因此在生物工程、天然药物和生物活性物质的分离提取方面有着广泛的应用[10-14]。目前国内外鲜有对双水相萃取发酵液中α-酮戊二酸的相关研究,因此本文对双水相萃取发酵液中α-酮戊二酸进行研究,重点研究无机盐-低分子有机溶剂形成的双水相体系[12]萃取发酵液中的α-酮戊二酸。
1 材料与方法
1.1 材料与试剂
α-酮戊二酸发酵液,四川龙蟒福生科技有限责任公司。
异丙醇,重庆川东化工(集团)有限公司;K2HPO4·3H2O,成都市科龙化工试剂厂;α-酮戊二酸(含量≥99%),上海源叶生物科技有限公司;试验用试剂均为分析纯。
1.2 仪器与设备
电子分析天平Scout SE,奥豪斯仪器(常州)有限公司;循环水式真空泵SHZ-D(Ⅲ),巩义市仪器予华仪器有限责任公司;电热恒温水浴锅DK-98-Ⅱ,天津市泰斯特仪器有限公司;双光束紫外可见光分光光度计DH-2000-BAL,美国海洋光学公司;电热鼓风干燥箱DHG-9070A,常州普天仪器制造有限公司;家用冰箱BCD-215KJ,青岛海尔股份有限公司。
1.3 方法
1.3.1 双水相萃取基本原理
双水相萃取是利用物质在互不相溶的2个水相之间分配系数的差异实现分离的分离方法。由于萃取体系的性质不同,在被分离物质进入双水相体系后,由于分子间的范德华瓦尔斯力、疏水作用、分子间的氢键、分子与分子之间电荷作用的存在和环境因素的影响,使其在静置分层时被分离物质在两相中的浓度不同,然后将富集了被分离成分的相分离出来,再经过处理后就可得到被分离成分,从而达到分离的目的[15-17]。
低分子有机溶剂-无机盐双水相体系成相的基本原理是盐相与有机相争夺水分子形成缔合水合物[15-17]。溶质在双水相体系中服从Nernst分配定律,即在一定温度一定压强下,如果一个物质溶解在2个同时存在的互不相溶的液体里,达到平衡后,该物质在两相中浓度比等于常数,分离效果由分配系数来表征。它涉及表面性质(表面自由能)、电荷作用和各种力(如憎水键、氢键和离子键等)等,使其在上、下相中的浓度不同[17-18]。
相关计算公式:
![]()
(1)
![]()
(2)
![]()
(3)
式中:K为分配系数,Ct和Cb分别为α-酮戊二酸在双水相体系上、下两相中的浓度(g/L);R为相比,Vt和Vb分别为双水相体系上、下相的体积(mL);E为α-酮戊二酸的萃取效率。
1.3.2 双水相体系的相图绘制
水溶液两相的形成条件和定量关系常用相图来表示,它是一条双界线,当两相的组成位于曲线的上方时体系就会分成两相[17]。采用浊度法[19-20]绘制双水相体系的相图,确定合适的双水相体系。
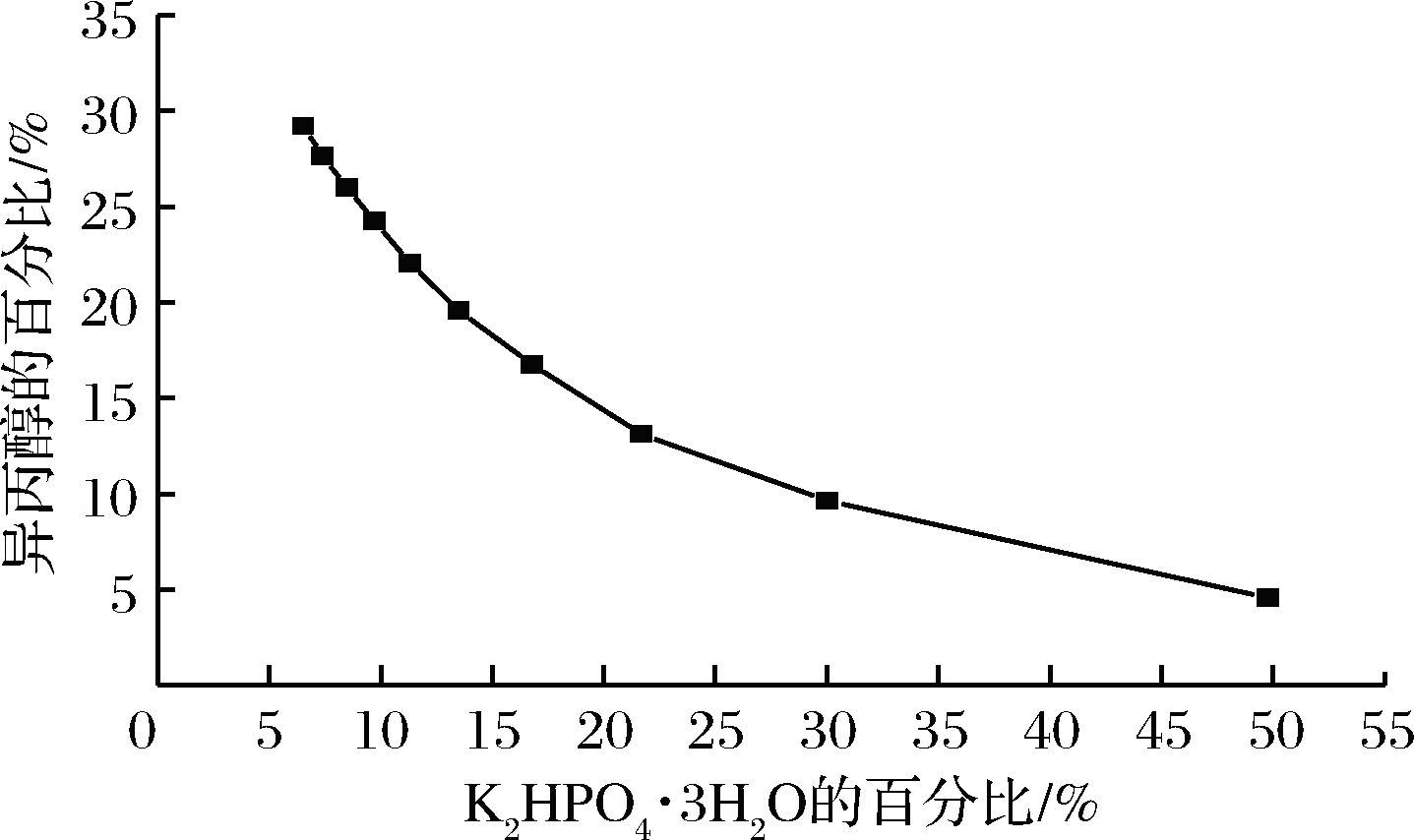
图1 异丙醇/K2HPO4·3H2O双水相体系相图
Fig.1 Isopropanol/K2HPO4·3H2O aqueous two-phase system phase diagram
由图1中可以看出,K2HPO4·3H2O与异丙醇形成稳定的双水相体系,成相范围较宽。
1.3.3 标准曲线的绘制
在一定浓度范围内,吸光度与吸光物质的浓度成正比,故以吸光度为纵坐标,浓度为横坐标作图,便可得到一条工作曲线或标准曲线。采用双光束紫外可见光分光光度计,测定α-酮戊二酸标准品的吸光值,确定最佳吸收波长为235.14 nm,并绘制标准曲线(见图2),确定标准曲线的回归方程为C=1.823 92A+0.012 75(R2=0.999 23,α-酮戊二酸溶液质量浓度为0.005~0.25(g/L)时,质量浓度与吸光度呈线性关系。

图2 α-酮戊二酸标准曲线
Fig.2 α-ketoglutarate standard curve
1.3.4 实验方法
称取10 g α-酮戊二酸发酵液,分别加入一定比例的异丙醇和K2HPO4·3H2O,搅拌均匀,溶液形成上下两相,静置10 min后分液。用移液管分别移取定量的上、下相溶液与容量瓶中,用去离子水稀释定容,用双光束紫外可见光分光光度计检测稀释一定倍数后的溶液的吸光值。将吸光值对照α-酮戊二酸溶液标准曲线,确定萃取上、下相中α-酮戊二酸的浓度,计算其相比、分配系数、萃取率[21]。采用单因素试验和正交试验方法探讨萃取过程中各因素对α-酮戊二酸萃取率的影响,并确定最佳的提取分离工艺条件[21-25]。
2 结果与分析
2.1 异丙醇用量的确定
实验结果表示如图3所示,α-酮戊二酸的分配系数随着体系中异丙醇用量的增加呈下降趋势,原因是随着异丙醇用量的增加,其竞争缔合水分子的能力增强,使得上相争夺到了更多的水分子,上相体积增加,而下相体积在小范围内浮动,整体呈下降趋势,相比上升,而水分进入上相使上相中的α-酮戊二酸被稀释,浓度降低,且随着异丙醇用量的增加,过量的异丙醇又会与部分水分子混溶进入下相,一部分α-酮戊二酸分子也会随之进入下相,使其在下相浓度增加,使得α-酮戊二酸在两相中的分配系数降低,萃取率降低;同时根据实验和相图可知,异丙醇用量不能低于6 g,否则将不能成相。因此在异丙醇用量为6 g时,α-酮戊二酸的萃取率最高,为65.66%。

图3 异丙醇用量的影响
Fig.3 Effects of isopropanol dosage
2.2 磷酸氢二钾用量的确定
实验结果表示如图4所示,α-酮戊二酸的分配系数随着体系中K2HPO4·3H2O用量的增加呈逐渐下降的抛物线趋势,原因是随着K2HPO4·3H2O用量的增加,其竞争水分子的能力增强,使得更多的水分子被吸附竞争到下相,使上相体积减小,下相体积增大,相比降低,并且水分将部分α-酮戊二酸带入下相,使下相中α-酮戊二酸的浓度升高,大量水分的流失使上相中的α-酮戊二酸被浓缩,浓度上升,但随着K2HPO4·3H2用量的增加,下相盐溶液浓度上升,逐渐达到饱和,竞争的水分子逐渐减少,使上相中的α-酮戊二酸被稀释,浓度降低,最终使得α-酮戊二酸在两相中的分配系数降低,萃取率降低,所以在K2HPO4·3H2O用量为7 g时,萃取率最高,为80.44%;同时根据实验和相图可知,K2HPO4·3H2O用量不能低于7 g,否则将不能成相。
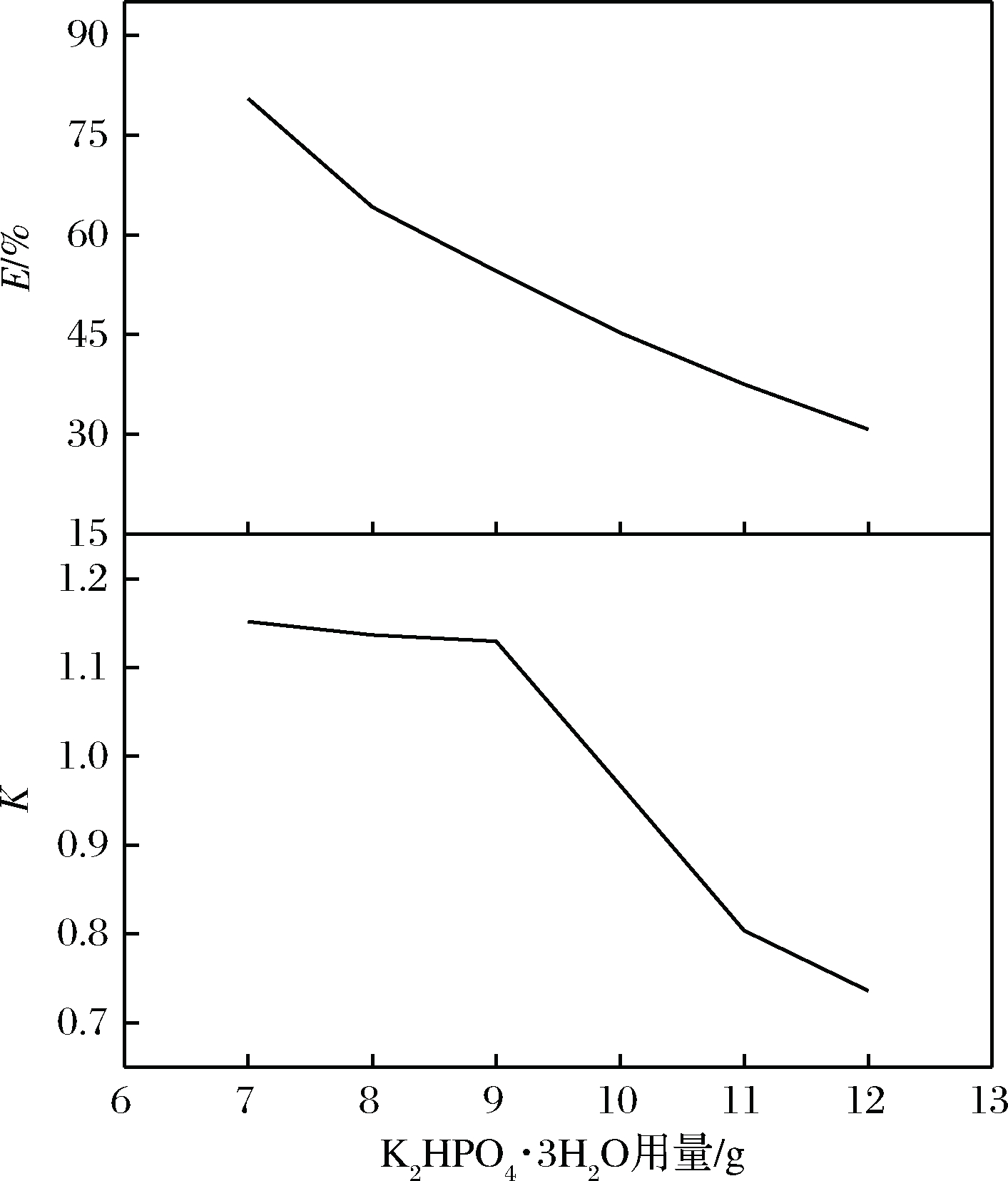
图4 K2HPO4·3H2O用量的影响
Fig.4 Effects of dipotassium hydrogen phosphate trihydrate dosage
2.3 萃取温度的确定
实验结果表示如图5所示,α-酮戊二酸的萃取率随着萃取温度的升高,呈下降趋势。
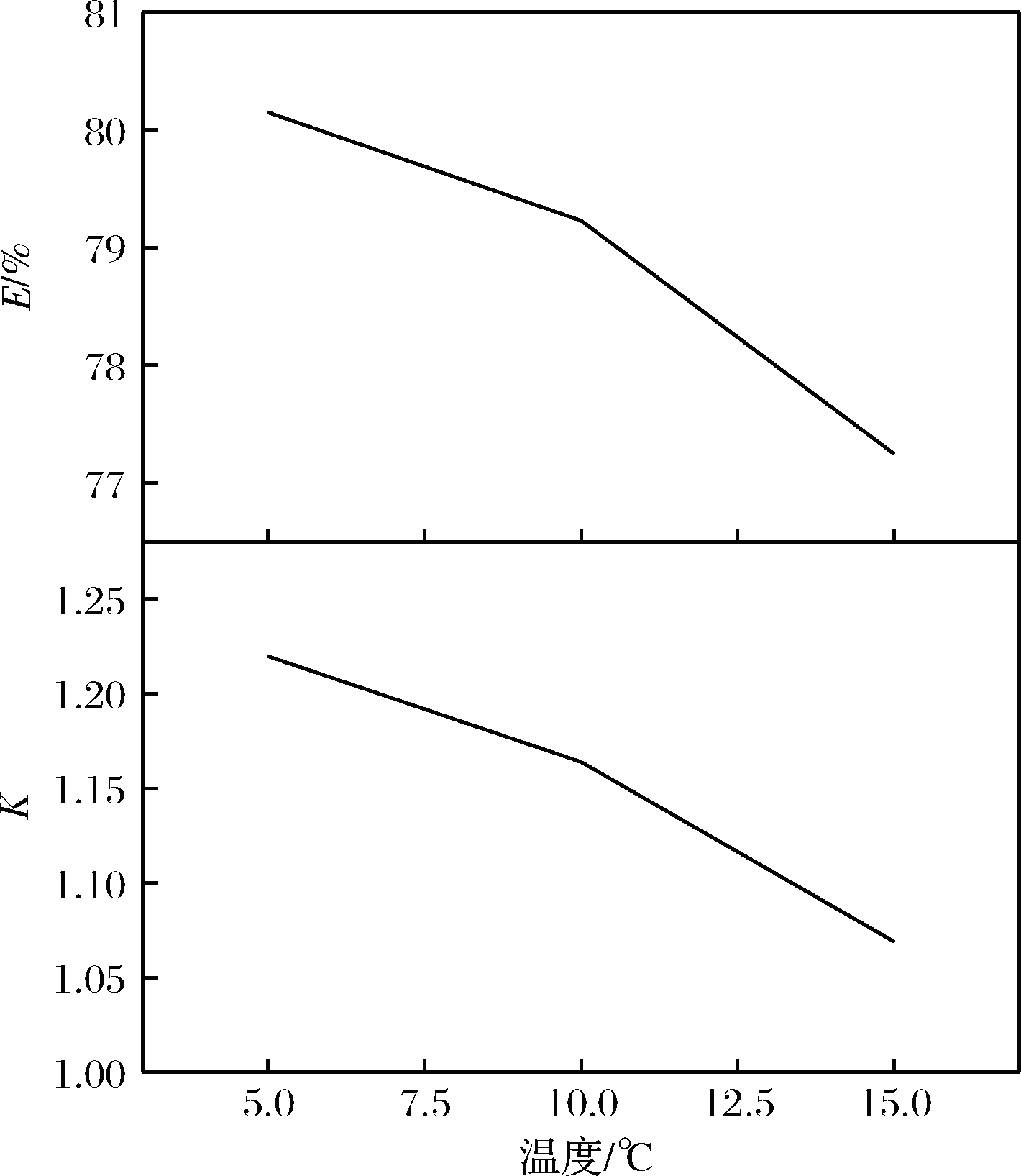
图5 萃取温度的影响
Fig.5 Effects of extraction temperature
因为当温度升高时,分子运动加剧,使得部分丙酮分子溶于下相,使上相体积减小,相比减小,同时随着温度升高,分子运动作用使部分α-酮戊二酸分子进入到下相中,使得α-酮戊二酸在上相的浓度降低,在下相的浓度增加,使得分配系数降低,最终使得α-酮戊二酸萃取率下降。并且温度升高,体系中各分子间的相互作用加强,影响相界面间的传质加剧以及体系的稳定性,不利于被分离物质的选择性分配,对萃取不利。该体系在15 ℃时成相不稳定,分相时间略长,当升温到20 ℃时已无法分相,溶液呈清澈透明状态,但温度也不宜过低,零下的温度也不适用。故选择5~10 ℃进行萃取比较适宜。
2.4 最佳双水相体系的确定及验证
以异丙醇、K2HPO4·3H2O和萃取温度为3因素进行L4(23)正交试验,因素水平见表1,试验结果及计算见表2。
表1 正交试验因素水平表
Table 1 Factors and their coded levels in orthogonal array design
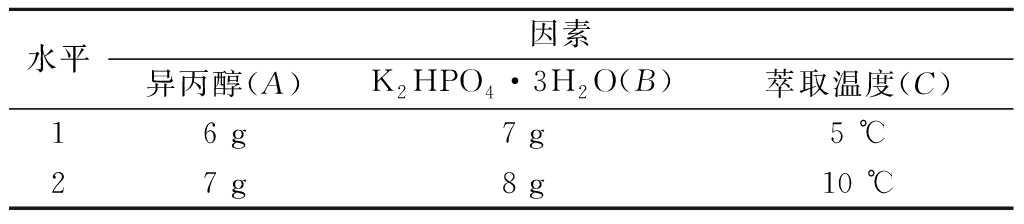
表2 正交试验设计及结果
Table 2 Orthogonal array design and corresponding experimental results
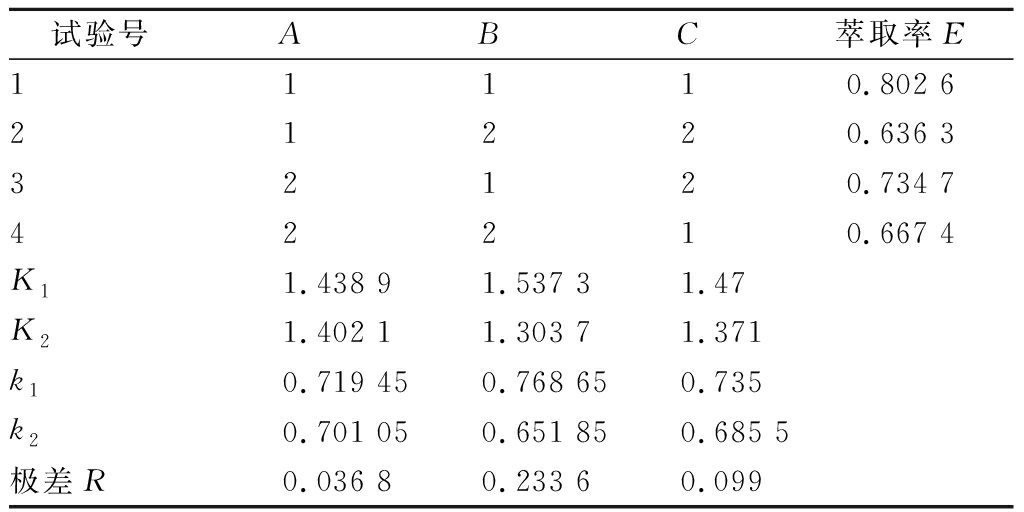
由表1、表2可知,各因素对α-酮戊二酸萃取率的影响大小为:B>C>A;最优工艺条件为A1B1C1,即异丙醇6 g,K2HPO4·3H2O 7 g,萃取温度5 ℃。
以最佳工艺条件进行三组验证实验,数据处理取均值得:相比R=1.281,分配系数K=3.215 5,萃取率E=80.45%。由此可见,在最优工艺条件下,丙酮-硫酸铵双水相体系对α-酮戊二酸具有比较稳定且较好的分离提纯效果。
3 结论
本实验通过双水相体系萃取α-酮戊二酸,主要研究了异丙醇用量、K2HPO4·3H2O用量和萃取温度对α-酮戊二酸分配系数和萃取率的影响,在此基础上进行了单因素和正交试验,确定了一种比较稳定的双水相萃取体系,即:异丙醇-K2HPO4·3H2O双水相体系提取分离α-酮戊二酸,发酵液用量为10 g,异丙醇用量6 g,K2HPO4·3H2O用量7 g,萃取温度5 ℃,相比为1.281,分配系数为3.215 5,萃取率可达到80.45%。
采用异丙醇-K2HPO4·3H2O双水相体系萃取分离α-酮戊二酸,其萃取效率较好,这种低分子有机溶剂和无机盐的新型双水相体系分离时间短、效率高等优点,且在后续工艺中两相物质易回收、资源可重复利用,很大程度上地节约了成本。这种双水相体系萃取α-酮戊二酸还鲜有报道,我们还可以进一步地深入探讨。
参考文献
[1] 占宏德, 李江华, 刘龙, 等. 离子交换法纯化α-酮戊二酸[J]. 食品与生物技术学报, 2013, 32(10): 1 043-1 048.
[2] 郭洪伟. 解脂亚洛酵母积累α-酮戊二酸关键生理调控机制解析[D]. 无锡:江南大学, 2015.
[3] SAUER M, PORRO D, MATTANOVICH D ,et al. Microbial production of organic acids:Expanding the markets [J]. Trends in Biotechnology, 2008, 26(2): 100-108.
[4] UR-REHMAN S, FOX P F. Effect of added α-ketoglutaric acid, pyruvic acid or pyridoxal phosphate on proteolyis and quality of Cheddar cheese[J]. Food Chemistrry, 2002, 76(1): 21-26.
[5] MATZI V, LINDENMANN J, MUENCH A, et al. The impact of preoperative micronutrient supplementation in lung surgery. A prospective randomized trial of oral supplementation of combined α-ketoglutaric acid and 5-hydroxymethylfurfural[J]. European Journal of Cardio-thoracic Surgery, 2007, 32(5): 776-782.
[6] STOTTMEISTER U, AURICH A, WILDE H, et al. White biotechnology for green chemistry: fermentative 2-oxocarboxylic acids as novel building blocks for subsequent chemical syntheses[J]. J Ind Microbiol Biotechnol, 2005, 32(11/12): 651-664.
[7] BARRETT D G, YOUSAF M N. Poly (triol α-ketoglutarate) as biodegradable, chemoselective, and mechanically tunable elastomers[J]. Macromolecules, 2008, 41(17): 6 347-6 352.
[8] 郭洪伟, 堵国成, 周景文, 等. 微生物发酵生产α-酮戊二酸研究进展[J]. 生物工程学报, 2013, 29(2): 141-152.
[9] ZHANG Dan-dan, LIANG Nan, SHI Zhong-ping, et al. Enhancement of α-ketoglutarate production in Torulopsis glabrata: Redistribution of carbon flux from pyruvate to α-ketoglutarate[J]. Biotechnology and Bioprocess Engineering, 2009, 14(2): 134-139.
[10] 霍清, 王强. 利用丙酮/磷酸氢二钾双水相体系分离纯化绿原酸的研究[J]. 食品科学, 2008, 29(11): 234-236.
[11] 朱红菊, 丁玉, 贾亚伟. 桔皮中橙皮苷的新型双水相萃取[J]. 食品与生物技术学报, 2013, 32(9): 995-1 001.
[12] 赵鹂, 郭圣荣. 双水相体系萃取分离-分光光度法测定益母草中水苏碱[J]. 药物分析杂志, 2010, 30(10): 1 953-1 956.
[13] XU Ying, HE Guo-qing, LI Jing-jun. Effective extraction of elastase from Bacillus sp. fermentation broth using aqueous two-phase system[J]. J Zhejiang Univ SCI, 2005, 6B(11): 1 087-1 094.
[14] LIU Qing-fen, HU Xue-sheng, WANG Yu-hong, et al. Extraction of penicillin G by aqueous two-phase system of [Bmim]BF4/NaH2PO4[J]. Chinese Science Bulletin, 2005, 50(15): 1 582-1 585.
[15] 辜鹏. 无机盐/低分子有机物双水相体系的研究及其应用[D]. 湘潭:湘潭大学, 2008.
[16] 辜鹏, 谢放华, 黄海艳, 等. 双水相萃取技术的研究现状与应用[J]. 化工技术与开发, 2007, 36(11): 29-33.
[17] 周晶, 冯椒华. 中药提取分离新技术[M]. 北京:科学出版社, 2010: 375-406.
[18] 单佳莉, 黄帮裕, 麦霖霞. 双水相萃取技术在生物技术上的应用[J]. 广东化工, 2014, 41 (16): 131-132.
[19] 李志刚. 发酵液中1,3-丙二醇和2,3-丁二醇的双水相萃取研究[D]. 大连:大连理工大学, 2011.
[20] 张鉥孟, 陈美珍. 乙醇-硫酸铵双水相体系萃取坛紫菜多糖[J]. 食品科学, 2014, 35(22): 46-49.
[21] 黄斌, 裴莹, 孙玉波, 等. 一种采用双水相萃取发酵液中酮戊二酸的方法: 中国, CN106946692A[P]. 2017-07-14.
[21] 林航, 周炳, 李映娜, 等. 正交试验优化密闭微波辅助-双水相萃取香菇多糖的研究[J]. 今日药学, 2015, 25(8): 564-568.
[22] 钟方丽, 王文姣, 王晓林, 等. 刺玫果总黄酮的双水相萃取工艺及其抗氧化能力[J]. 林产化学与工业, 2016, 36(4): 64-72.
[23] 黄少愉, 吴学昊, 黄远翔, 等. 微波辅助- 双水相萃取苦参中多糖的试验优化研究[J]. 今日药学, 2015, 25(9): 626-630.
[24] 夏昊云, 金瑜. 辣椒素的双水相萃取研究[J]. 食品工业, 2014, 35(1): 164-167.
[25] ZHAO Yan-xia, LIU Yu-bing, LIU Feng, et al. Aqueous two-phase systems with ultrasonic extraction used for extracting phenolic compounds from inonotus obliquus[J]. Chinese Herbal Medicines, 2013, 5(1): 67-72.