浓香型白酒是我国传统的酒精饮料,其产销量居各香型白酒之首,以“窖香浓郁、绵柔醇厚、口感绵甜和尾净余长”的风格著称[1-2]。有机酸是浓香型白酒中重要的呈味物质,适当比例的有机酸能使酒体更加饱满,有利于消除白酒中的苦味并促进新酒老熟[3-4]。己酸、乳酸、乙酸和丁酸占白酒中有机酸含量的90%以上,被称为白酒的“四大酸”,其含量和比例的变化对白酒风味形成具有重要作用[5]。四大酸一方面是白酒中主要酯类物质如乳酸乙酯、乙酸乙酯、己酸乙酯(浓香型白酒的主体香味物质)和丁酸乙酯合成的重要前体,其含量决定了浓香型白酒香型的形成[6-7];另一方面,白酒中四大酸含量适宜时有助于白酒风味的提升,而任一有机酸过量时则会破坏白酒风味组成平衡。例如,己酸对白酒有呈味助香的功能,其浓度过高则导致酒体浑浊。丁酸具有愉悦的水果香味,能显著增强白酒“窖香”,但过量则有不愉快的汗臭味[8]产生。乳酸能抑制有害微生物的繁殖,在稳定白酒香气,降低酒体苦涩和糙辣感方面也有重要作用,过量乳酸存在则会导致酒体酸涩,影响白酒口感[9]。乙酸能有效烘托和缓和白酒主体香味,过量乙酸则会破坏酒体风格,抑制白酒香味[10]。
目前,通过分离产酸微生物并分析菌株的生理生化特性和产酸性能等相关研究证实细菌是浓香型白酒窖内发酵过程中有机酸的主要产生者[11-12]。其中,梭状芽孢杆菌是丁酸和己酸合成的主要微生物。梭状芽孢杆菌在酒醅中的含量极少(相对丰度<0.01%),主要存在(自然存在或人工强化)于窖泥中[13]。此外,醋杆菌有较强合成乙酸的能力,而以乳杆菌属为主的乳酸菌是乳酸合成的重要微生物,乳杆菌进行异型乳酸发酵代谢时也能产生乙酸[14]。上述研究仅验证了分离出的微生物具有代谢产生有机酸的能力,并未阐明相应产酸微生物尤其是与乙酸和乳酸合成相关的微生物在白酒发酵不同阶段以及真实混菌发酵体系中对有机酸合成的影响。统计学分析手段虽已广泛应用于分析白酒微生物群落与代谢产物合成的相互关系[15-16],然而,通过分离微生物并研究其代谢能力仍是阐释白酒发酵机制和提高白酒品质的根本途径[17]。因此,在获得可培养微生物的前提下,结合分子生物学和统计学分析揭示白酒发酵过程中微生物与有机酸合成的相互关系对提升白酒风味具有重要意义。
通过分离产酸微生物并验证菌株产有机酸的能力,将产酸微生物数量动态变化与白酒窖内发酵过程酒醅中有机酸含量变化进行相关性分析,由此确定白酒发酵不同阶段对乳酸、乙酸合成有重要影响的功能微生物,为阐释白酒窖内发酵过程的微生物产酸机理和提高白酒品质提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 酒醅样品
浓香型白酒酒醅取自江苏洋河酒厂股份有限公司浓香型白酒生产窖池。采样方式:分别在窖池上、中、下3层采集样品,混匀后作为1个酒醅样品。在60 d的发酵周期内,分别取发酵0、3、6、15、20、30、45和60 d的酒醅样品,各发酵时间点样品均取自2个不同的窖池,并及时保存于-20 ℃冰箱。
1.1.2 培养基
乳酸菌筛选培养基(g/L): MRS培养基,轻质CaCO35.0(单独灭菌,倒平板前加入),钠他霉素0.05,琼脂20.0。
醋酸菌筛选培养基(g/L):葡萄糖10.0,酵母膏10.0,轻质CaCO3 5.0(单独灭菌,倒平板前加入),钠他霉素 0.05,琼脂 20.0。培养基使用前加30 g/L的无水乙醇。
其他产酸细菌筛选培养基(g/L):牛肉膏5.0、蛋白胨10.0、轻质CaCO3 5.0(单独灭菌,倒平板前加入),琼脂20.0。
粮食浸出培养基:将生产洋河浓香型白酒所用五粮(高粱、小麦、玉米、糯米、和大米)按比例混合粉碎,添加4倍体积水和高温淀粉酶(1 000 U/kg)蒸煮糊化1 h,迅速冷却至60 ℃以下后加入糖化酶(3 000 U/kg),于60 ℃下糖化2 h,纱布过滤,上清液调整糖度至13~14 ° Bx。
1.2 主要试剂和仪器
乳酸和乙酸标准品(≥99.5%),Sigma-Aldrich公司;Primer STAR® Max DNA Polymerase、SYBR® PremixEx TaqTM Ⅱ:大连宝生物工程有限公司;PowerMax® Soil DNA isolation kit试剂盒:MOBIO公司;钠他霉素:青岛宝博公司;其他试剂均购买自国药集团化学试剂有限公司。
高效液相色谱仪(安捷伦1260),美国安捷伦公司;NanoDrop 2000超微量分光光度计,美国Thermo Fisher公司;PCR仪,美国Bio-Rad公司;罗氏LightCycler® 480 Ⅱ荧光定量PCR仪,美国Molecular devices公司。
1.3 方法
1.3.1 产酸菌株的分离
称取10 g酒醅样品,与90 mL无菌生理盐水(9 g/L NaCl)混匀,梯度稀释后取10-2、10-3、10-4梯度稀释液分别涂布于乳酸菌筛选培养基、醋酸菌筛选培养基和其他产酸细菌筛选培养基。芽孢杆菌的分离采用将酒醅与生理盐水的混合物在85 °C水浴处理30 min,梯度稀释后选择10-2、10-3、10-4梯度稀释液涂布于上述筛选培养基。所有培养基平板分别以需氧(静置培养)和厌氧(厌氧箱培养)2种方式在37 ℃培养2~3 d。挑选有明显透明圈的单菌落进行分离纯化、鉴定和保藏。
1.3.2 产酸细菌属水平鉴定
利用细菌基因组提取试剂盒提取上述筛选菌株基因组,利用16S rRNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)对菌株基因组进行扩增。PCR扩增条件为:95 ℃预变性3 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸5 min。扩增产物送至上海生物工程有限公司测序,测序结果与NCBI(National Center for Biotechnology Information)数据库中序列进行Blast比对,利用MEGA 6.0软件构建进化树[18],确定菌株所属微生物属。
1.3.3 酒醅中细菌的绝对数量测定
酒醅中微生物宏基因组DNA制备采用液氮研磨结合试剂盒抽提的方法[19]。称取5 g酒醅样品至研钵中,加入液氮充分研磨使细胞破碎。使用PowerMax® Soil DNA Isolation Kit试剂盒提取微生物宏基因组DNA,提取步骤参照说明书进行。提取得到的基因组DNA用NanoDrop 2000超微量分光光度计进行基因组浓度和纯度的检测,合格样品于-20 ℃冰箱保存。
对酒醅中产酸微生物的绝对定量分析采用各菌属的16S rDNA特异性引物[20-21](表1),利用荧光定量PCR对白酒窖内发酵酒醅中Bacillus、Lactobacillus、Lactococcus、Weissella、Acetobacter和Pediococcus等菌属的微生物进行定量。将各菌属16S rDNA基因扩增产物连接至PUC57载体,构建成标准质粒,标准质粒拷贝数的计算参考文献[19]。根据扩增曲线,以阈值循环数Ct(即每个反应管内的荧光信号达到设定的阈值时所经历的循环数)作为横坐标,标准浓度的对数作为纵坐标绘制标准曲线,利用标准曲线计算各微生物的生物量。实时荧光定量PCR采用25 μL反应体系:DNA模板10 ng,上下游引物(20 μmol/L)各1 μL,SYBR®PremixEx TaqTM Ⅱ 12.5 μL,使用无菌水补足体系。定量PCR扩增程序:95 ℃预变性 30 s,95 ℃变性 5 s,58 ℃退火 30 s,65 ℃延伸10 s,共40个循环。
表1 RT-PCR引物
Table 1 Primers used for RT-PCR

1.3.4 菌株产酸能力分析
将菌株在粮食浸出培养基中37 ℃培养72 h后(醋杆菌培养添加30 g/L无水乙醇,静置培养,其余微生物厌氧培养),8 000 r/min离心20 min后取上清液,用0.22 μm水系滤膜过滤,利用高效液相色谱法测定发酵液中有机酸的含量。
依据洋河浓香型白酒窖内发酵过程温度(22~32 ℃)、酒醅中乙醇含量(小于70 g/L)和初始pH值(小于7.0)的变化特点[22-23],确定考察窖内发酵环境因素对菌株产酸能力影响的条件为:温度选择22、27、32、37 ℃;乙醇含量考察0、10、30、50、70 g/L 5个梯度;培养基初始pH值考察3.0、4.0、5.0、6.0、7.0。以5%(体积分数)的接种量将菌株接种至粮食浸出培养基,培养72 h后(醋杆菌在有氧、加入30 g/L无水乙醇条件下培养,其他微生物进行厌氧培养),检测发酵液中有机酸含量。
有机酸含量的测定:处理后的样品用高效液相色谱法进行检测。液相色谱检测器为紫外检测器,在210 nm波长处,色谱柱为HPLC organic acid analysis column(300 mm×7.8 mm),检测条件参照文献[24]。以乳酸和乙酸为标准品绘制相应标准曲线,计算有机酸含量。
1.4 数据分析
使用SPSS 19.0统计软件对产酸微生物生物量与乳酸、乙酸含量进行Pearson相关性分析,|r|>0.7且p<0.05代表高度显著性相关。
2 结果与分析
2.1 酒醅中产酸菌株的分离与鉴定
利用产酸菌株可溶解CaCO3的选择性分离培养方法从洋河浓香型白酒窖内发酵不同时期的酒醅中分离得到163株有明显透明圈的菌株。通过对分离菌株的菌落形态进行观察,依据《一般细菌常用鉴定方法》[25]对菌株进行初步鉴定,选择代表不同菌落形态的菌株用于菌种鉴定和后续研究。分离获得的细菌菌株,进一步鉴定,通过测定其16S rRNA基因序列,并将测序结果与NCBI数据库序列进行比对,当16S rRNA基因序列相似度≥99%时可认定为1个种[26]。最终从酒醅中分离得到的12株产酸菌株(16S rRNA基因序列相似度均≥99%),分别属于6个属12个种,包括戊糖足球菌(Pediococcus pentosaceus)JP1、嗜酸乳酸足球菌(Pediococcus acidilactici)JP2、植物乳杆菌(Lactobacillus plantarum)JP3、戊糖乳杆菌(Lactobacillus pentosus)JP4、阴道乳杆菌(Lactobacillus vaginalis)JP5、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)JP6、蜡样芽孢杆菌(Bacillus cereus)JP7、食窦魏斯氏菌(Weissella cibaria)JP8、格氏乳球菌(Lactococcus garvieae)JP9、巴氏醋杆菌(Acetobacter pasteurianus)JP10、东方醋杆菌(Acetobacter orientalis)JP11和苹果醋杆菌(Acetobacter malorum)JP12,如图1所示。
2.2 菌株产有机酸能力分析

图1 分离自浓香型白酒酒醅细菌的系统发育分析
Fig.1 Phylogenetic tree of bacterial strains isolated from fermented grains for producing Chinese strong-aroma spirit 注:以细菌16S rRNA基因构建进化树,分支点数值表示置信度,比例尺表示碱基替换率,0.02表示2%的序列差异;括号内序号表 示与测序结果最相近的GenBank登录号。
从酒醅中分离得到的12株细菌在粮食浸出培养基中分别进行培养和发酵(醋杆菌进行有氧培养,其他细菌进行厌氧培养)。由图2可以看出,在相应培养条件下,醋杆菌只产乙酸,乳酸菌和芽孢杆菌只产乳酸。醋杆菌中A. pasteurianus JP10可以合成4.40 g/L乙酸,其产乙酸能力分别是A. orientalis JP11及Acetobacter malorum JP12的1.79倍和2.20倍。产乳酸的菌株中L. plantarum JP3生成乳酸能力最强,达到8.59 g/L;P. acidilactici JP2、L. pentosus JP4、B. amyloliquefaciens JP6、W. cibaria JP8和Lat. garvieae JP9合成乳酸能力次之(5.22~7.31 g/L);P. pentosaceus JP1、L. vaginalis JP5和B. cereus JP7合成乳酸水平相对较低。
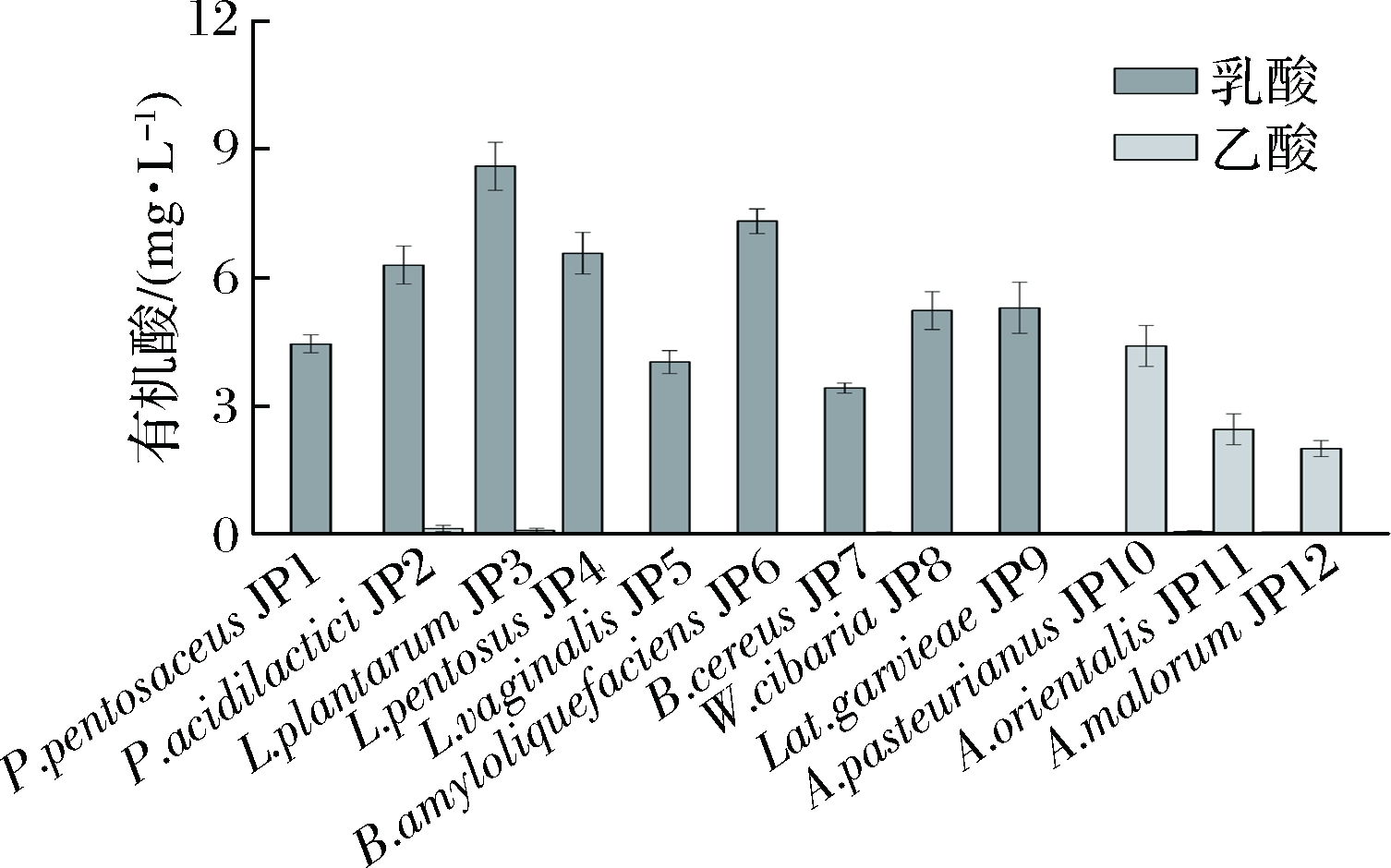
图2 分离自酒醅的菌株产有机酸能力
Fig.2 The ability of strains isolated from fermented qrains to produce organic acids
2.3 浓香型白酒窖内发酵过程酒醅中产酸微生物的定量分析
白酒窖内发酵是微生物群体参与的发酵过程,有机酸的合成和积累水平与具有该能力菌株的数量和可调控有机酸合成代谢途径的环境因素密切相关。因此,建立所分离菌株与洋河浓香型白酒中乳酸和乙酸合成之间的明确关系,需要在分析菌株合成有机酸能力的基础上,解析窖内发酵过程中产酸菌株数量变化与有机酸合成之间的相关性,并阐明白酒窖内发酵工艺条件对菌株合成有机酸水平的影响。
依据从洋河浓香型白酒窖内发酵过程酒醅中分离得到的产酸细菌菌属,通过qRT-PCR对6个菌属的绝对数量进行了分析,结果如图3所示。窖内发酵过程中Lactobacillus(106~109 copies/g)和Bacillus(106~108 copies/g)是数目最多的两类细菌。Lactobacillus数量在窖内发酵0~20 d增加了2个数量级,最高为3.9×109 copies/g,21~60 d数量逐渐减少,发酵结束时Bacillus和Lactobacillus数量与起始数量接近。Bacillus数量在0~15 d增加了1个数量级,15 d后数量逐渐减少,到发酵结束时下降了1个数量级。Weissella生物量在发酵0~3 d增加了1个数量级,3~60 d其数目减少了2个数量级。Acetobacter数量在发酵0~6 d,增加了1个数量级, 6~60 d数量减少了3个数量级。Lactococcus和Pediococcus数量在白酒窖内发酵整个阶段均无明显变化,分别在105~106 copies/g和104~105 copies/g。
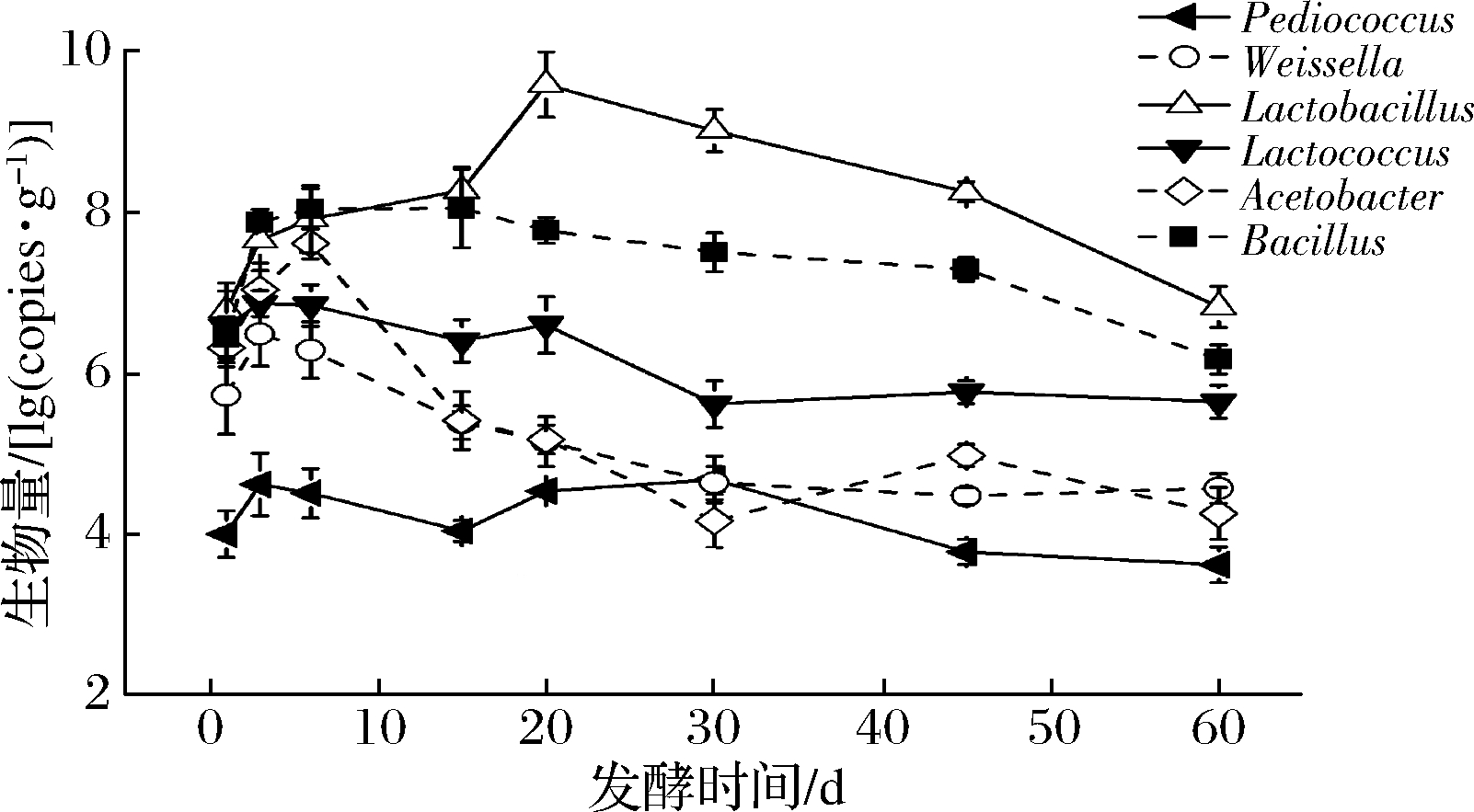
图3 浓香型白酒发酵过程酒醅中产酸细菌数量变化
Fig.3 Quantification of bacteria in fermented grains during Chinese strong-aroma spirit fermentation
2.4 白酒窖内发酵过程酒醅中产酸细菌与有机酸合成的相关性分析
在前期研究中,对洋河浓香型白酒窖内发酵过程相同酒醅中乳酸和乙酸含量变化的分析已证实:窖内发酵前期酒醅中乳酸和乙酸含量明显降低,出窖60 d时乳酸和乙酸含量分别比入窖时增加了18.8%和60.4%;同时根据酒醅属水平优势微生物组成差异,酒醅样品被明显区分为0~15 d和15~60 d两个阶段[27]。在此基础上,结合本研究结果,利用SPSS统计分析软件对酒醅产酸微生物生物量与白酒窖内发酵过程中乙酸、乳酸含量进行了相关性分析。由图4-A可知,洋河浓香型白酒窖内发酵0~15 d,乳酸合成与Weissella、Bacillus、Lactobacillus和Pediococcus4个菌属的总量呈高度显著正相关(r=0.923,p<0.05),其中Weissella(r=0.975,p<0.05)是与乳酸正相关性最好的微生物;乙酸的生成则与Acetobacter,Bacillus和Weissella 3个属的总生物量呈高度显著正相关(r=0.852,p<0.05),其中Acetobacter与乙酸的正相关性最好(r=0.976, p<0.05)。窖内发酵15~60 d,乙酸与Lactococcus、Weissella、Bacillus和Lactobacillus 4个属的总生物量呈高度显著正相关(r=0.801,p<0.05);Lactobacillus是与乳酸合成高度显著正相关(r=0.741,p<0.05)的菌属(图4-B)。上述分析表明,分离自洋河浓香型白酒酒醅的6个菌属均与白酒窖内发酵过程酒醅中乙酸和乳酸的生成呈正相关。
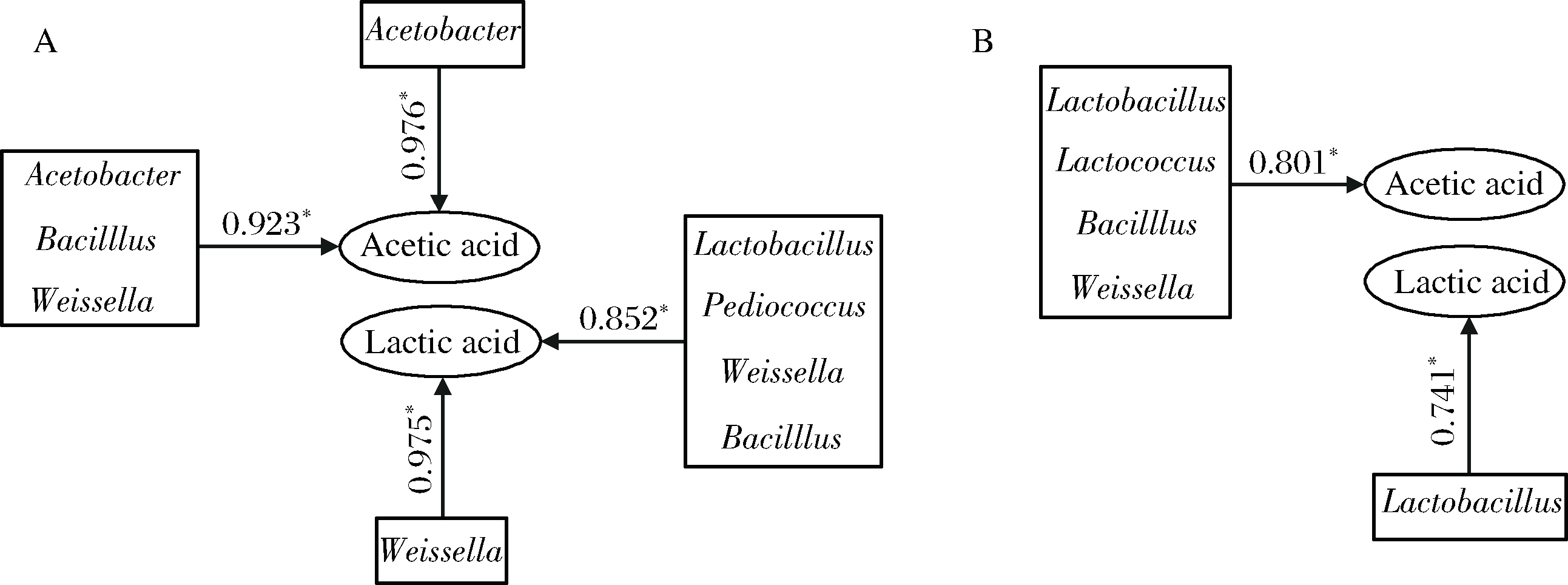
A-白酒窖内发酵0~15 d;B-白酒窖内发酵15~60 d
图4 产酸细菌与酒醅中有机酸合成的相关性分析
Fig.4 The correlation analysis between organic acids producing-bacteria in fermented grains and organic acids biosynthesis 注:箭头上方所标数值大于0.7时,表示两者具有高度正相关性,数值越接近 1.0表示两者相关性越好;*表示p <0.05。
2.5 环境因素对菌株产酸的影响
浓香型白酒生产过程中窖内环境的变化对微生物代谢合成有机酸的能力有显著影响[28]。为了分析分离菌株在白酒工艺条件改变时产酸能力变化,该研究考察了白酒发酵过程中的主要影响参数如温度、乙醇含量和培养基初始pH对菌株产酸的影响。根据菌株产单一有机酸能力强弱和微生物属种关系,选择了产乙酸能力最强的醋杆菌(A. pasteurianus JP10)以及产乳酸能力较强的乳酸菌(P. acidilactici JP2、L. plantarum JP3、W. cibaria JP8、Lat. garvieae JP9)和芽孢杆菌(B. amyloliquefaciens) JP6这6种菌株进行产酸性能的研究。
温度对乳酸菌和芽孢杆菌产乳酸能力的影响较小,对A. pasteurianus JP10产乙酸能力的影响较为显著(图5)。
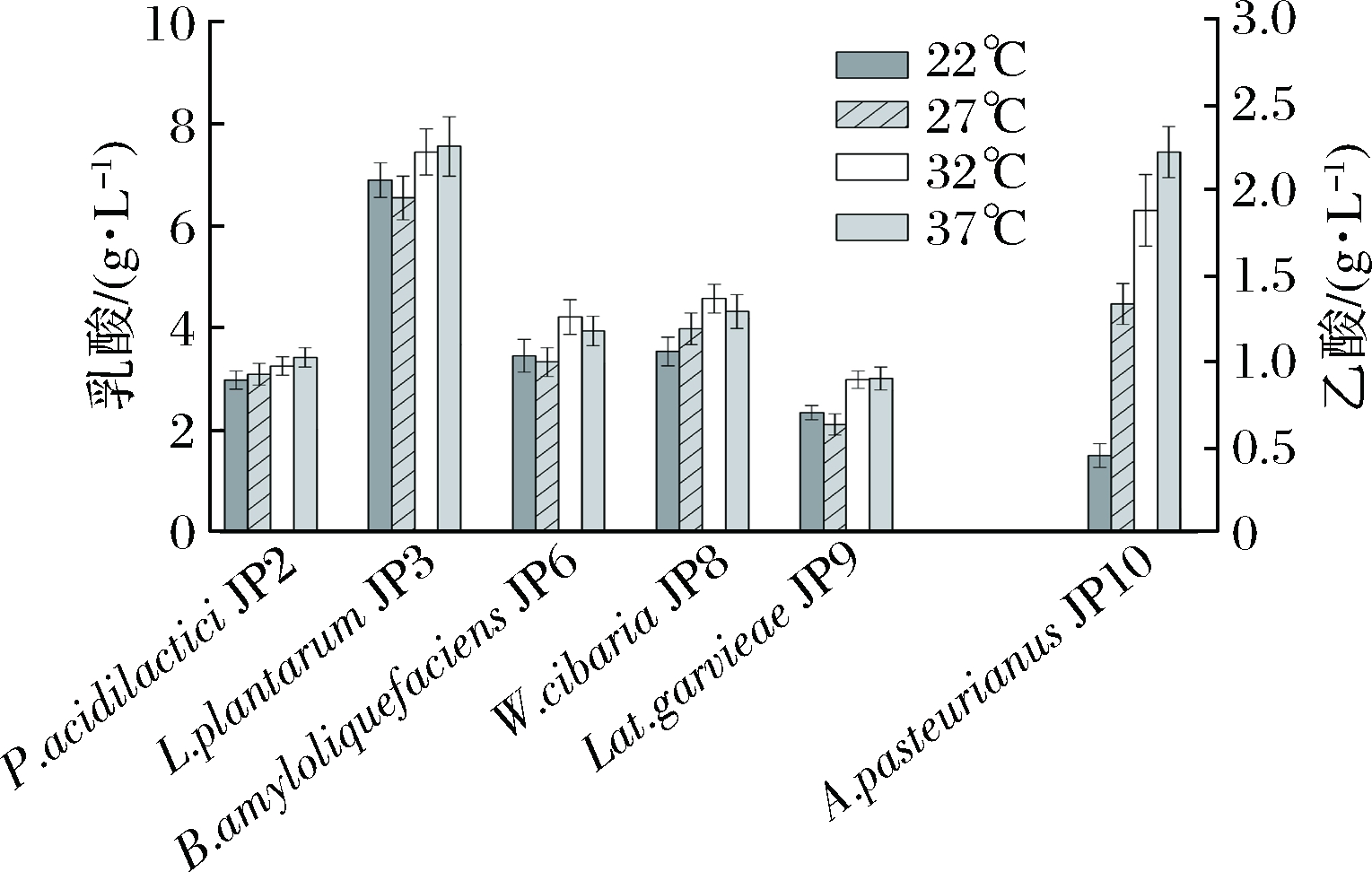
图5温度对菌株产有机酸的影响
Fig.5 Effect of temperature on producing organic acids by fermented grains isolates
在22 ℃静置培养条件下A. pasteurianus JP10产乙酸能力为0.45 g/L,37 ℃时产乙酸量最多,是22 ℃下的4.96倍。
随着白酒窖内发酵的进行,酒醅中乙醇含量逐渐增加,对微生物的生长和代谢均有不同程度的影响[29]。如图6所示,在培养基中添加0~70 g/L乙醇并在厌氧条件下培养对P. acidilactici JP2、L. plantarum JP3和B. amyloliquefaciens JP6产乳酸能力没有显著影响。0~30 g/L乙醇条件下进行厌氧培养时W. cibaria JP8产乳酸能力较强(2.79~2.96 g/L),乙醇添加量为70 g/L时产乳酸能力最弱(1.45 g/L),相比10 g/L乙醇含量时降低了51.0%。Lat. garvieae JP9产乳酸能力在10~30 g/L乙醇时较高(2.94~3.29 g/L),50 g/L乙醇时产乳酸含量迅速下降,相比30 g/L降低了54.6%。有氧条件下,醋杆菌可将乙醇氧化生成乙酸,因此适当的乙醇含量对乙酸生成有促进作用[30]。无乙醇静置培养时,A. pasteurianus JP10没有产生乙酸的能力,乙醇含量为50 g/L时乙酸含量最高(1.75 g/L),是10 g/L的1.67倍。
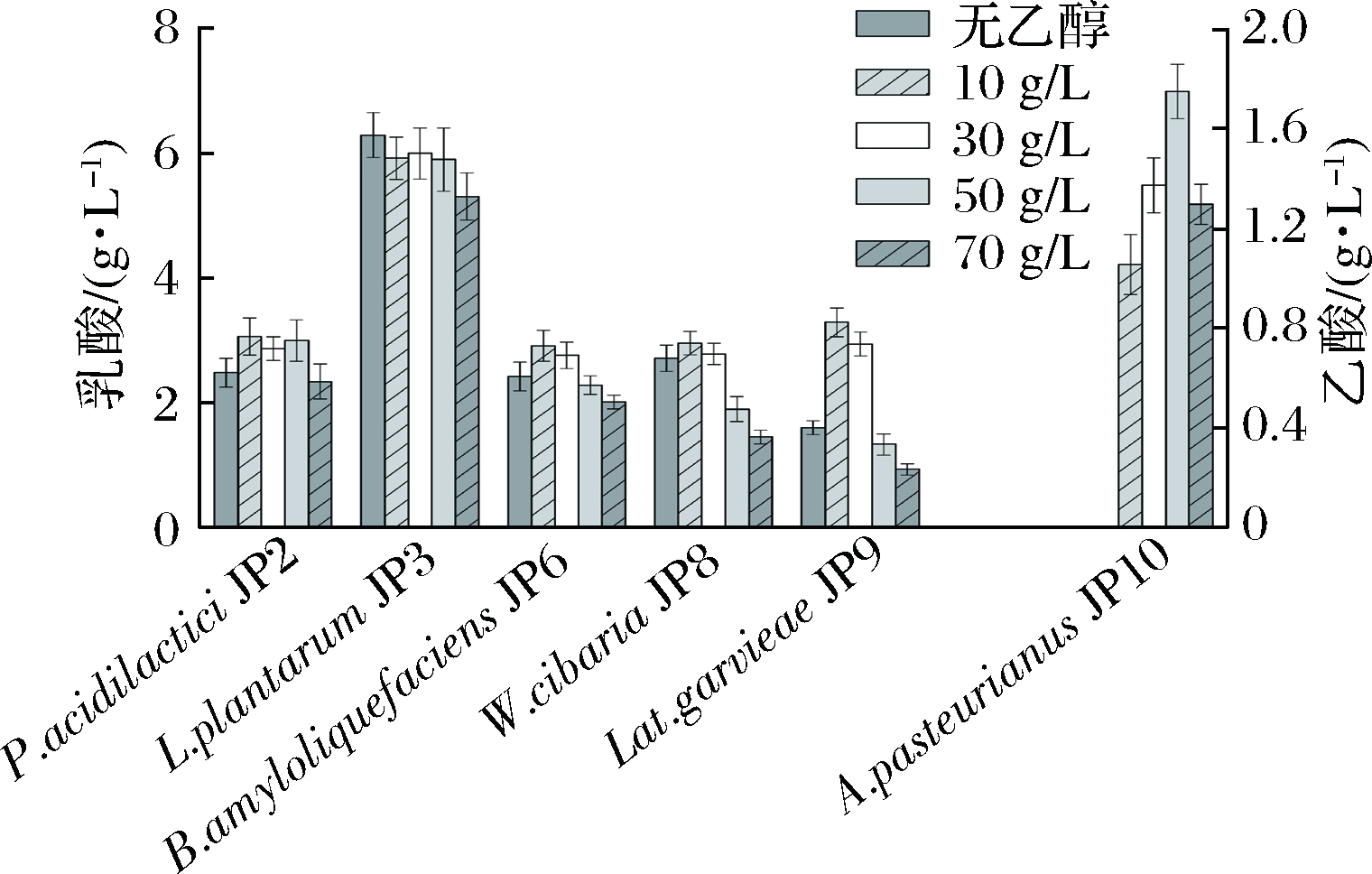
图6 乙醇对菌株产有机酸的影响
Fig.6 Effect of ethanol on producing organic acids by fermented grains isolates
从图7可知,在培养基初始pH 3.0下厌氧培养时,乳酸菌和芽孢杆菌产乳酸含量均低于1 g/L,而培养基初始pH值的提高有助于乳酸的合成。其中,L. plantarum JP3产乳酸含量在培养基初始pH为6.0时达到最高(8.60 g/L),其余菌株产乳酸能力在pH 7.0时最强。在培养基初始pH为3.0~4.0条件下进行静置培养时,A. pasteurianus JP10产乙酸能力为0.72~0.76 g/L,培养基初始pH 6.0时该菌株产乙酸含量达到最高值(1.40 g/L),是pH 3.0下乙酸产量的1.94倍。
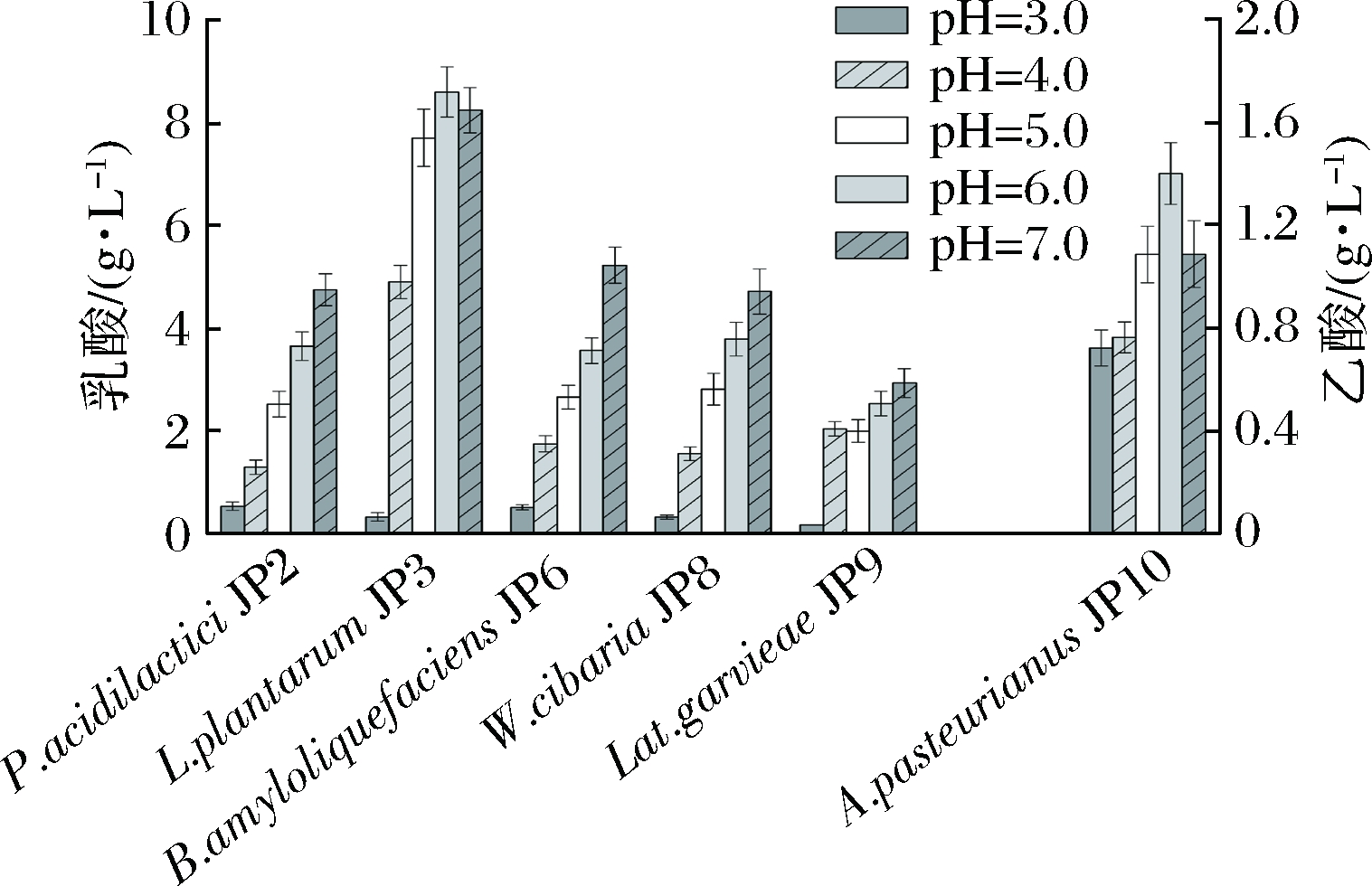
图7 培养基初始pH对菌株产酸的影响
Fig.7 Effect of initial pH of cultivation medium on producing of organic acids by fermented grains isolates
3 结论与讨论
浓香型白酒窖内发酵过程中,酒醅细菌微生物是乙酸和乳酸的主要产生者。乙酸和乳酸作为白酒中的主要有机酸,是乙酸乙酯和乳酸乙酯的重要前体,且乙酸在己酸菌和丁酸菌作用下,能与乙醇等转化生成己酸和丁酸[31-33]。因此,明确酒醅微生物与乳酸、乙酸等有机酸合成的相互关系,能有效维持白酒风味的平衡。
本研究利用3种筛选培养基从浓香型白酒酒醅中得到6个属产酸微生物,分别为Lactobacillus、Lactococcus、Weissella、Bacillus、Acetobacter和Pediococcus。这与栗连会等从浓香型白酒酒醅中分离得到Lactobacillus、Pediococcus、Bacillus等产酸微生物和孙鹏飞等从白酒酒醅中分离得到Bacillus、 Acetobacter、Weissella等产酸微生物的结论基本一致[34-35]。进一步通过高效液相色谱和qRT-PCR分别对12种菌株产有机酸能力和6个属的产酸细菌进行了绝对定量分析,并对白酒窖内发酵过程酒醅产酸微生物生物量与乳酸、乙酸含量进行了相关性分析,发现白酒发酵0~15 d时,乙酸、乳酸均与多种产酸微生物总量呈高度显著正相关,同时乙酸与Acetobacter、乳酸与Weissella均呈高度显著正相关。发酵15~60 d时,乳酸合成仅与Lactobacillus呈高度显著正相关,乙酸仅与4个属微生物总量呈高度显著正相关。说明由于浓香型白酒发酵前期细菌优势微生物种类较丰富,乙酸和乳酸的合成受多种微生物的共同影响,且Acetobacter和Weissella是该阶段影响乙酸和乳酸含量的主导微生物。同时,浓香型白酒窖内发酵中后期Lactobacillus生物量在产酸微生物中占有优势地位,乳酸合成仅与Lactobacillus呈高度显著正相关关系是导致浓香型白酒实际生产中乳酸及乳酸乙酯含量居高不下的主要原因。过量的乳酸会对窖池环境造成破坏,导致窖池板结和退化。乳酸乙酯含量过高则会导致酒体单调,影响白酒风味平衡[34,36]。通过考察白酒窖内发酵的3个重要参数(温度、乙醇含量和初始pH)与分离菌株产酸性能的关系发现,温度、乙醇含量和初始pH的变化均对醋酸菌产乙酸能力有显著影响。温度对乳酸菌和芽孢杆菌产乳酸无明显影响,乙醇含量与部分乳酸菌产乳酸能力有关,初始pH变化则对所有分离菌株产乳酸能力均有显著作用:较低初始pH抑制菌株产酸能力,初始pH 6.0~7.0时菌株产乳酸能力明显提高。因此,初始pH是影响乳酸菌和芽孢杆菌产乳酸的主要环境因素。通过调节入窖时的初始pH值,对合理调控白酒乳酸含量,实现浓香型白酒“增己降乳”具有重要意义。
综上所述,通过微生物分离技术、qRT-PCR及统计学分析手段的有机结合,可实现对可培养微生物在白酒复杂酿造环境中代谢功能的全面分析,为阐明白酒产酸机理和提升白酒品质提供借鉴。然而,白酒窖内发酵15~60 d,酒醅微生物与Lactococcus、Weissella、Bacillus和Lactobacillus的总量呈高度显著正相关,表明这4个属的部分菌株具有明显产生乙酸的能力,但由于筛选条件的局限性,在白酒酿造中后期并未成功分离到高产乙酸的菌株。今后可利用高通量筛选和宏转录组学技术,对浓香型白酒窖内发酵过程中微生物与有机酸合成的相互关系进行更加深入、系统的研究。
参考文献
[1] ZHANG W X, QIAO Z W, SHIGEMATSU T, et al. Analysis of the bacterial community in ZAOPEI during production of Chinese LUZHOU-flavor liquor[J]. Journal of the Institute of Brewing, 2005, 111(2): 215-222.
[2] HU X L, DU H, XU Y. Identification and quantification of the caproic acid-producing bacterium Clostridium kluyveri in the fermentation of pit mud used for Chinese strong-aroma type liquor production[J]. International Journal of Food Microbiology, 2015,214: 116-122.
[3] LI H, HE RY, XIONG XM, et al. Dynamic diversification of bacterial functional groups in the Baiyunbian liquor stacking fermentation process[J]. Annals of Microbiology, 2016, 66(3): 1 229-1 237.
[4] 张中义,畅晓霞. 有机酸对大曲酒品质影响分析[J]. 酿酒, 2009,36(5): 37-39.
[5] YAN SB, WANG SC, WEI GG, et al. Investigation of the main parameters during the fermentation of Chinese Luzhou-flavour liquor[J].Journal of the Institute of Brewing, 2015, 121(1): 145-154.
[6] FAN W L, QIAN M C. Identification of aroma compounds in Chinese “Yanghe Daqu” liquor by normal phase chromatography fractionation followed by gas chromatography olfactometry[J]. Flavour and Fragrance Journal, 2006, 21(2): 333-342.
[7] CHEON Y, KIM J S, PARK J B, et al. A biosynthetic pathway for hexanoic acid production in Kluyveromyces marxianus[J]. Journal of Biotechnology, 2014, 182: 30-36.
[8] 贾巧唤,任石苟. 浅述酸、酯、醇等成分对白酒的影响[J]. 食品工程, 2008(4): 12-13.
[9] 李维青. 浓香型白酒与乳酸菌、乳酸、乳酸乙酯[J]. 酿酒, 2010, 37(3): 90-93.
[10] 陶锐. 浅析白酒酒体设计中对酸的认识[J]. 酿酒, 2010, 37(5): 50-52.
[11] 侯小歌,王俊英,李学思,等. 浓香型白酒糟醅及窖泥产香功能菌的研究进展[J].微生物学通报, 2013,40 (7): 1 257-1 265.
[12] 李波,唐云容,毛晓红. 浓香型白酒产酸细菌的分离筛选[J]. 酿酒科技, 2011(9): 51-53.
[13] HU XL, DU H, REN C, et al. Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J]. Applied and Environmental Microbiology, 2016, 82(8): 2 506-2 515.
[14] 庄名扬. 中国白酒香味物质形成机理及酿酒工艺的调控 [J].酿酒, 2007,43(2): 109-113.
[15] SHAO Ming-kai, WANG Hai-yan, XU Yan, et al. Yeast community structure and its impact on flavor components during the fermentation process of Chinese Maotai-flavor liquor[J]. Microbiology China, 2014, 41(12): 2466-2473.
[16] WANG P, WU Q, JIANG X J, et al. Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of daqu starter for Chinese liquor making[J]. International Journal of Food Microbiology, 2017, 250: 59-67.
[17] 汤斌,王海涛,周庆武,等. 浓香型白酒窖泥中可培养细菌的分离鉴定及产酸研究[J]. 工业微生物, 2013,43(6): 68-73.
[18] CHIN H S, BREIDT F, FLEMING H P, et al. Identifications of predominant bacterial isolates from the fermenting kimchi using ITS-PCR and partial 16S rDNA sequence analyses[J]. Journal of Microbiology and Biotechnology, 2006, 16 (1): 68-76.
[19] 陶京兰,陆震鸣,王宗敏,等. 实时荧光定量PCR监测镇江香醋醋酸发酵过程中微生物变化[J]. 食品与发酵工业, 2013,39(2): 156-160.
[20] XU W, HUANG Z Y, ZHANG X J, et al. Monitoring the microbial community during solid-state acetic acid fermentation of Zhenjiang aromatic vinegar[J]. Food microbiology, 2011, 28(6): 1175-1181.
[21] 赵永威. 腌制冬瓜微生态解析与品质分析[D]. 宁波:宁波大学, 2013.
[22] 周新虎,陈翔,杨勇,等. 浓香型白酒窖内参数变化规律及相关性研究(Ⅰ):理化参数[J]. 酿酒科技, 2012(4): 39-43.
[23] 周新虎,陈翔,杨勇,等. 浓香型白酒窖内参数变化规律及相关性研究(Ⅱ):温度及其数学模型[J]. 酿酒科技, 2012(5):44-46.
[24] SHUI G H, LEONG L P. Separation and determination of organic acids and phenolic compounds in fruit juices and drinks by high-performance liquid chromatography[J]. Journal of Chromatography A, 2002, 977(1): 89-96.
[25] 赵佳,雷振河,吕利华,等. 汾酒产酸细菌的分离鉴定及其产酸条件研究[J]. 食品与发酵工业, 2009, 35,264(12): 43-46.
[26] DRANCOURT M, BOLLET C, CARLIOZ A, et al. 16S ribosomal DNA sequence analysis of a large collection of environmental and clinical unidentifiable bacterial isolates[J]. Journal of Clinical Microbiology, 2000, 38(10): 3 623-3 630.
[27] 刘凡,周新虎,陈翔,等. 洋河浓香型白酒发酵过程酒醅微生物群落结构解析及其与有机酸合成的相关性[J]. 微生物学报,2018. DOI: 10.13343/j.cnki.wsxb.20170616.
[28] SMID E J, LACROIX C. Microbe-microbe interactions in mixed culture food fermentations[J].Current Opinion in Biotechnology,2013, 24(2): 148-154.
[29] 张敏,毛健,黄桂东,等. 清酒酿酒酵母酒精耐受机理的研究进展[J]. 食品工业科技, 2012,33(20): 342-345,350.
[30] 李玮黎. 西凤酒酒醅中乙酸菌的分离鉴定及其生理生化特性研究[D]. 杨凌:西北农林科技大学, 2014.
[31] 信春晖,许玲,董乔娟,等. 酿酒微生物对酒体质量及风格的影响[J]. 酿酒, 2016,43(2): 38-47.
[32] 唐瑞. 己酸菌、窖泥与浓香型白酒之间的关系[J]. 酿酒, 2005,32(4): 24-27.
[33] 张方,张宿义,苏占元,等. 有机酸对浓香型白酒品质及其酿造过程影响的研究进展[J]. 酿酒科技, 2016,259 (1): 94-97;102.
[34] 栗连会. 泸型酒酒醅中乳酸菌和乳酸降解菌的多样性和代谢特性[D]. 无锡:江南大学, 2016.
[35] 孙鹏飞.衡水老白干酒中产酸微生物的分离鉴定及特性研究[D]. 石家庄:河北科技大学, 2016.
[36] 赖登燡,梁诚. 系统论对浓香型白酒生产中“增己降乳”的解析及应用[J]. 酿酒科技, 2008,170(8): 104-108;112.