动物源性食品中兽药残留对人体健康的影响已成为食品安全问题之一,兽药的残留最终会富集人体内而影响人类健康。磺胺类药物作为抗生素使用受到广泛关注,该药物具有抗菌广谱、药效稳定、价格便宜等优点,被广泛应用于饲料添加剂与动物疫病治疗[1-3]。在缺乏有效监管的情况下被过分滥用,导致许多动物源性食品中大量残留。我国农业部及欧美国家都规定了磺胺类在动物性食品中的最高残留限量0.1 mg/kg。
目前,对磺胺类药物残留检测主要通过液质联用(HPLC-MS)[4-5]、高效液相色谱法(HPLC)[6]、高效毛细管电泳法(HPCE)[7-8]与酶联免疫吸附法(ELISA)[9-10]。前三者相对专业操作强、大型仪器难以实现市场普及、快速检测难以实现等问题,而ELISA具有微量分析方法成熟、使用方便、经济易行等优点。ELISA检测方法中试剂盒法因其检测敏感性高,特异性强,检测结果重复性好,试剂稳定、易保存,操作简便,结果易判读等特点,能够很好的适合大批量快速检测[11-12]。现阶段市场检测磺胺药物试剂盒种类较多,但检测相对单一[13-15]。因此,开发一种检测多种动物性食品中磺胺类药物残留检测ELISA试剂盒具有很高的实用价值。
本研究的目的是通过优化检测板制备条件及检测方法的建立,能够实现对市场动物源性食品中残留的磺胺类药物的检测;另外,对试剂盒的稳定性验证,并与HPLC法就市场上部分动物源性食品进行抽检对比,已确定建立的试剂盒检测方法的市场应用价值。
1 材料与方法
1.1 材料与仪器
样品购自各大农贸市场及超市;抗原、单克隆抗体由北京勤邦公司提供;磺胺类标准品购自德国Dr.Ehrenstorfer公司,纯度均≥99.0%;96孔酶标板,厦门云鹏科技有限公司;ST-360型酶标仪,上海科华生物股份有限公司;化学试剂均购自国药。
1.2 方法
1.2.1 抗原的制备
磺胺类药物为小分子化合物,不具有免疫原性,将乙酰氨基苯磺酸与对氨基苯甲酸合成磺胺类半抗原,再将磺胺类药物半抗原与BSA偶联,分析计算结合比为15∶1。
1.2.2 检测参数的建立
(1)包被液的筛选。对比3种包被缓冲液:0.02 mol/L pH=7.2的PBS缓冲液,0.05 mol/L pH=9.6的碳酸盐缓冲液,0.02 mol/L pH=7.2的Tris缓冲液,筛选最佳包被缓冲溶液。
(2)抗体、酶标二抗稀释液的筛选。对比3种抗体稀释液:常规抗缓A,含0.1%明胶抗缓B,含0.1%甘油抗缓C。
(3)抗原、抗体和酶标二抗浓度的确定。采用控制变量法和参考罗贵昆等[16]的参数确定方法结合检测IC50值、鸡肉样品添加回收和吸光度值选定最佳浓度。
(4)竞争反应时间和显色时间的确定。分别设定竞争反应时间为0、15和30 min;显色时间分别设定为5、15、30和45 min。对比反应吸光度值确定最佳反应时间。
1.2.3 ELISA方法的建立
配制磺胺标准溶液,定容后逐级稀释配制以下质量浓度:1、3、9、27和81 ng/mL溶液。按照以下步骤操作:①设置0标准点与标准点,按标准品浓度梯度加入50 μL/孔,每个梯度设两孔,每孔加入50 μL SAs单克隆抗体,25 ℃孵育上述最佳竞争反应时间后,0.01% Tween-20 0.01 mol/L pH=7.2的PBS缓冲液洗板3~5次;②加入酶标二抗,25 ℃孵育后,洗板3~5次;③加入100 μL/孔TMB避光显色上述最佳显色时间后,50 μL/孔2 mol/L硫酸终止反应后,酶标仪450/630 nm测定OD值。
1.2.4 样品添加回收实验
在虾仁、猪肉、鸡肉、牛奶中添加不同浓度的磺胺药物标准品,通过设计回收方法计算添加回收率和批间、批内变异系数来确定试剂盒准确度。虾仁、猪肉、鸡肉、牛奶样品添加3组不同浓度磺胺药物,且每组设3个平行,用3个不同批次试剂盒检测。称取2.0 g均质后的虾仁、猪肉、鸡肉样本,添加磺胺类药物标准品;加入5~10 mL乙腈-乙酸乙酯溶液混匀,3 000 r/min室温离心5 min;移取上层有机相至10 mL玻璃试管,50~60 ℃水浴氮气流下吹干;加入1 mL正己烷和1 mL PBS混匀,3 000 r/min室温离心5 min,除去上层有机相,下层水相用于分析。向牛奶中添加磺胺类药物标准品,3 000 r/min室温离心15 min,除去脂肪用于检测。
1.2.5 特异性
特异性是指交叉反应率,抗体与抗原发生结合的能力强弱。通过竞争ELISA方法测定磺胺类药物IC50值,选择不同磺胺药物类似结构的药物测定IC50值,计算交叉反应率来判断试剂盒检测的特异性。
交叉反应率![]()
(1)
1.2.6 稳定性
4 ℃稳定性试验,从3批试剂盒中各抽出6组试剂盒,每组3盒试剂盒,每组均做4 ℃ 4个时间段第0、1、3、6月的保存试验。分析标准曲线的变化,检测数据变异系数。
1.2.7 试剂盒技术参数的确定
选取3批试剂盒分别检测虾仁、猪肉、鸡肉、牛奶样本,并将灵敏度、精密度和准确度与HPLC检测的灵敏度、精密度和准确度进行对比。
2 结果与分析
2.1 包被液和抗体、酶标二抗稀释液的测定
通过检测数据分析,确定优化后的包被缓冲液选择0.05 mol/L pH=9.6的碳酸盐缓冲液;抗体、酶标二抗稀释液选择常规抗缓A。
2.2 抗原、抗体和酶标二抗浓度的测定
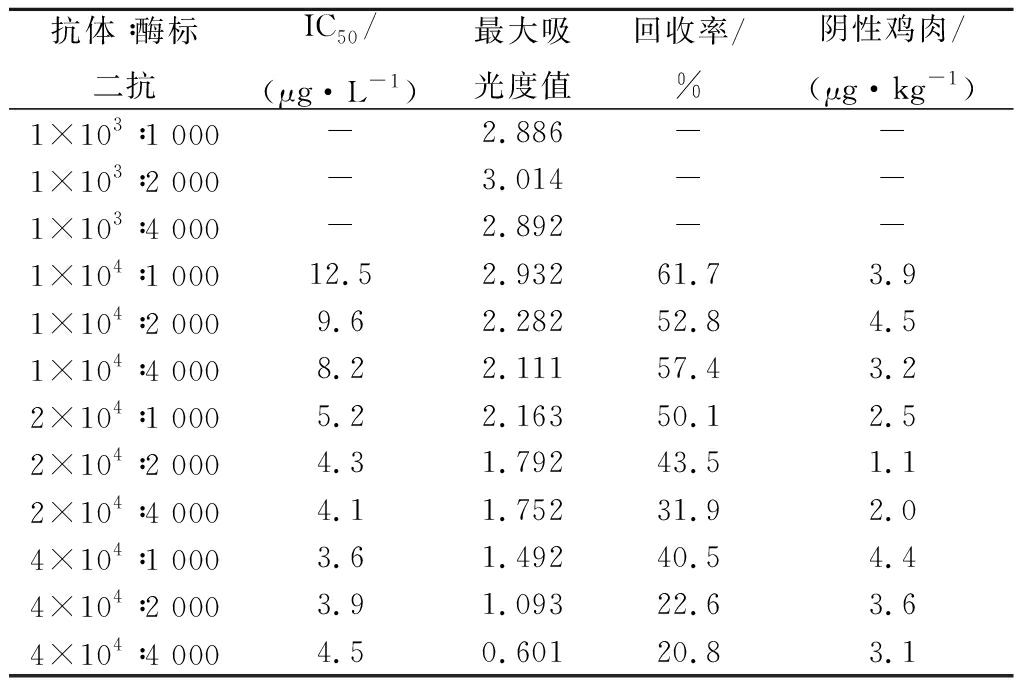
对IC50、50 μg/kg添加鸡肉回收率和最大吸光度值的比较确定抗原的包被浓度。抗体和酶标二抗的浓度分别为20 000、2 000比较结果见表1。由表1结果可知包被抗原浓度与IC50值负相关,抗原稀释2×104倍IC50与最大吸光度值均较好。表2结果表明抗体浓度在2×104倍稀释时,最大吸光度值、样品添加回收率和IC50均处于最佳状态,两者浓度比为2×104∶4 000时由于酶标二抗的浓度降低,灵敏度不高。
表1 抗原浓度的测定
Table 1 The determination of antigen concentration
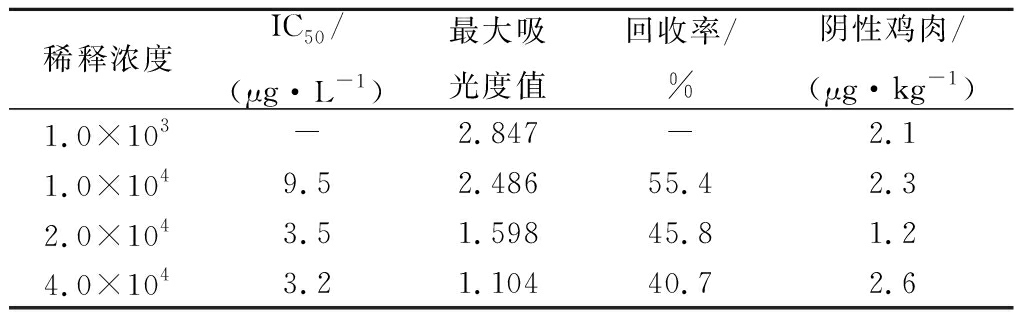
表2 抗体和酶标二抗浓度的测定
Table 2 The determination of antibody concentration and enzyme labelled antibody concentration
2.3 竞争反应时间和显色时间的测定
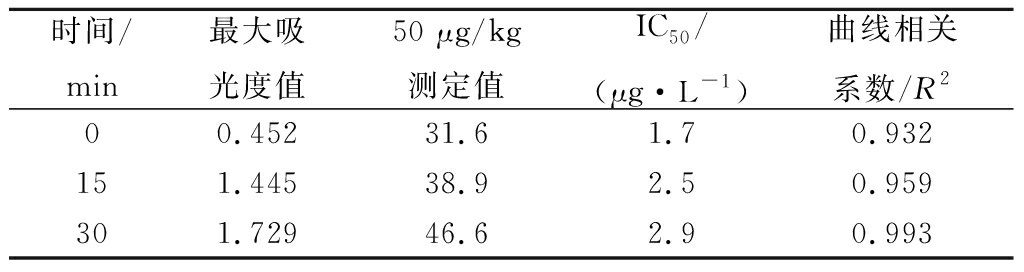
不同的孵育时间结果见表3。在25 ℃环境中,50 μL/孔样品溶液或标准品溶液,再加入50 μL/孔单抗工作液,加入酶标二抗0、15和30 min后的时间比对,结果表明加入酶标二抗的时间为30 min时,吸光度值、IC50和曲线线性均较好。
表3 竞争反应时间的测定
Table 3 The determination of competitive reaction time
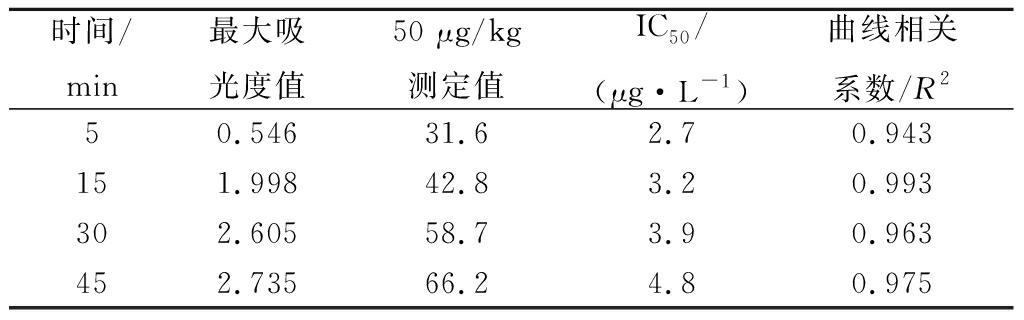
不同时间加入终止液,终止底物显色液与酶的反应,结果见表4。由表4结果可知吸光度值与时间成正相关,15 min的显色反应,其吸光度值与IC50值均较好,且曲线相关系数R2为0.993。
表4 显色时间的测定
Table 4 The determination of coloration time
2.4 ELISA标准曲线的测定
建立竞争反应曲线,以标准品百分吸光率为纵坐标,以磺胺类标准品浓度的对数为横标,绘制标准曲线如图1所示。通过计算曲线参数方程为y=-0.387 7x+0.728,相关系数R2=0.991 8,说明试剂盒线性关系良好,IC50值为3.88 ng/mL,线性检测范围1.18~41.67 ng/mL。
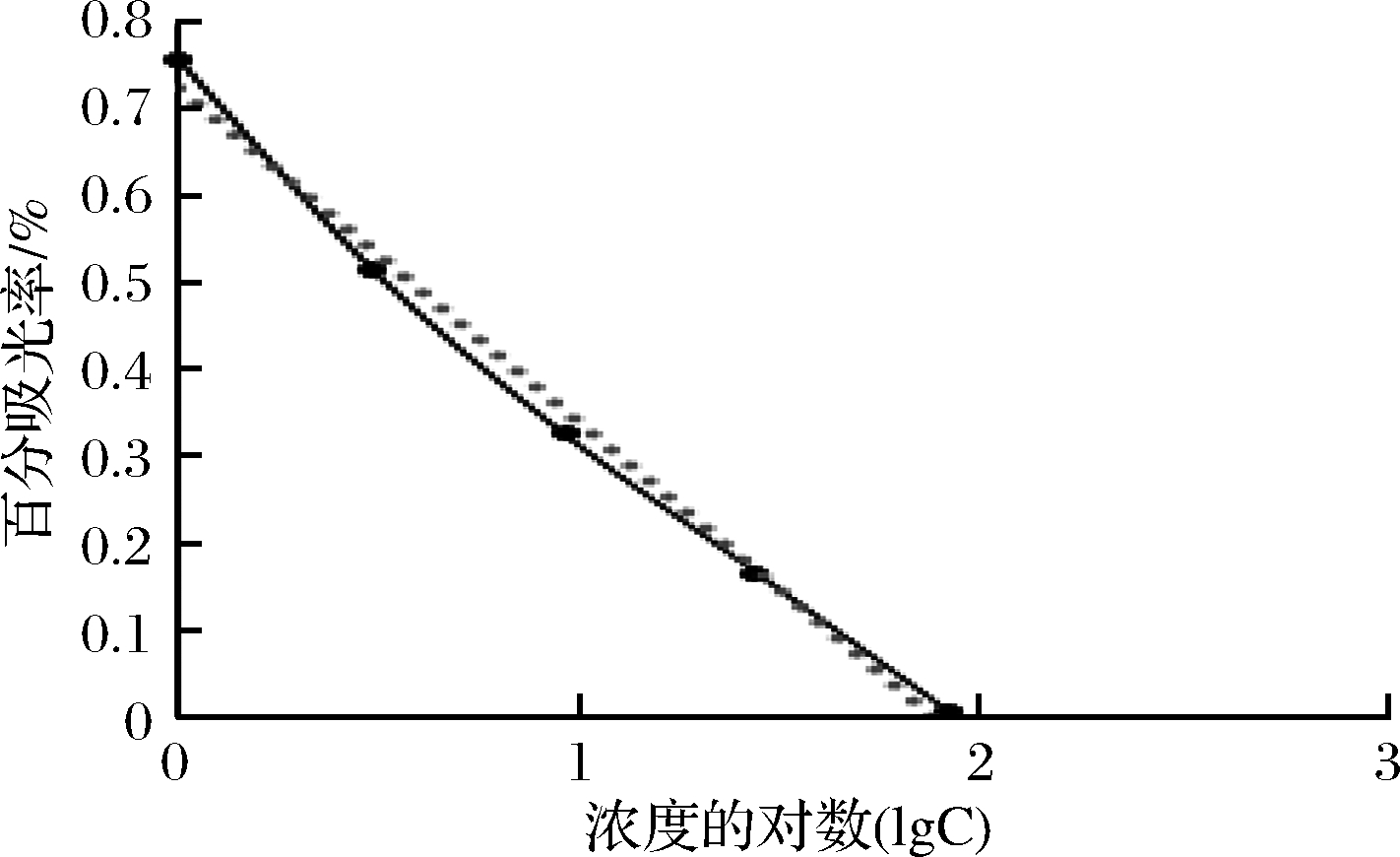
图1 标准曲线图
Fig.1 standard curve
2.5 准确度(添加回收实验)
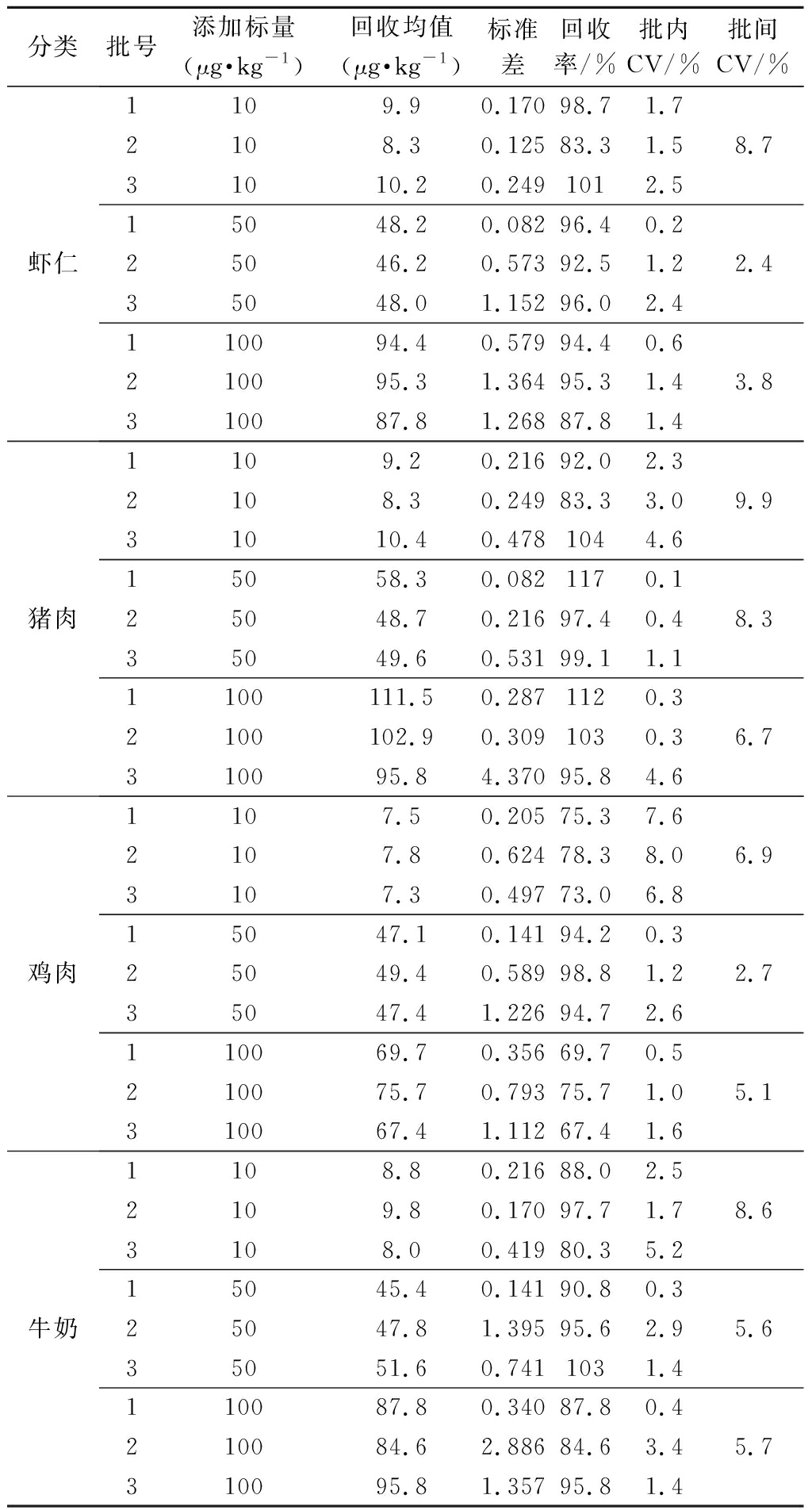
将磺胺类药物添加至终浓度为10、50、100 μg/kg,每种样品、每个浓度各5个平行,用试剂盒提供的操作方法测定。抽取3批试剂盒,每批试剂盒测定同一份样品3次,分别计算批内、批间变异系数及回收率,结果见表5。由表5可知磺胺类药物在四类动物源性样品中回收率在67.4%~117%,批间变异系数<10%,批内变异系数<10%。
表5 准确度测定结果
Table 5 Results of accuracy on chicken samples
2.6 特异性
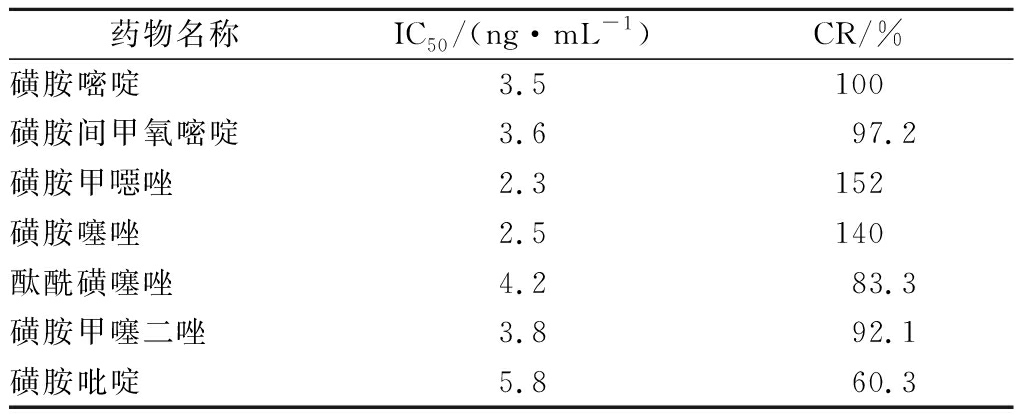
竞争法测定磺胺嘧啶、磺胺间甲氧嘧啶、磺胺甲噁唑、磺胺噻唑、酞酰磺噻唑、磺胺甲噻二唑、磺胺吡啶的IC50及交叉反应率,结果见表6。由表6可知该试剂盒对磺胺类似药物的交叉反应率均较高,对几种药物均具有较高的特异性。
表6 交叉反应率的测定
Table 6 The determination of the cross-reactivity
2.7 稳定性
选3批试剂用于确定试剂盒的稳定性,4 ℃条件保存。放置0、30、90与180 d后测定磺胺类药物的回收率和批内差异,结果见表7。由表7可知该试剂盒在4 ℃条件保存各时间段在样品中的添加回收率差异不显著,批内、批间变异系数均<10%,各项参数稳定。说明该试剂盒能够长期保存。
表7 稳定性的测定
Table 7 Determination of the stability of kit

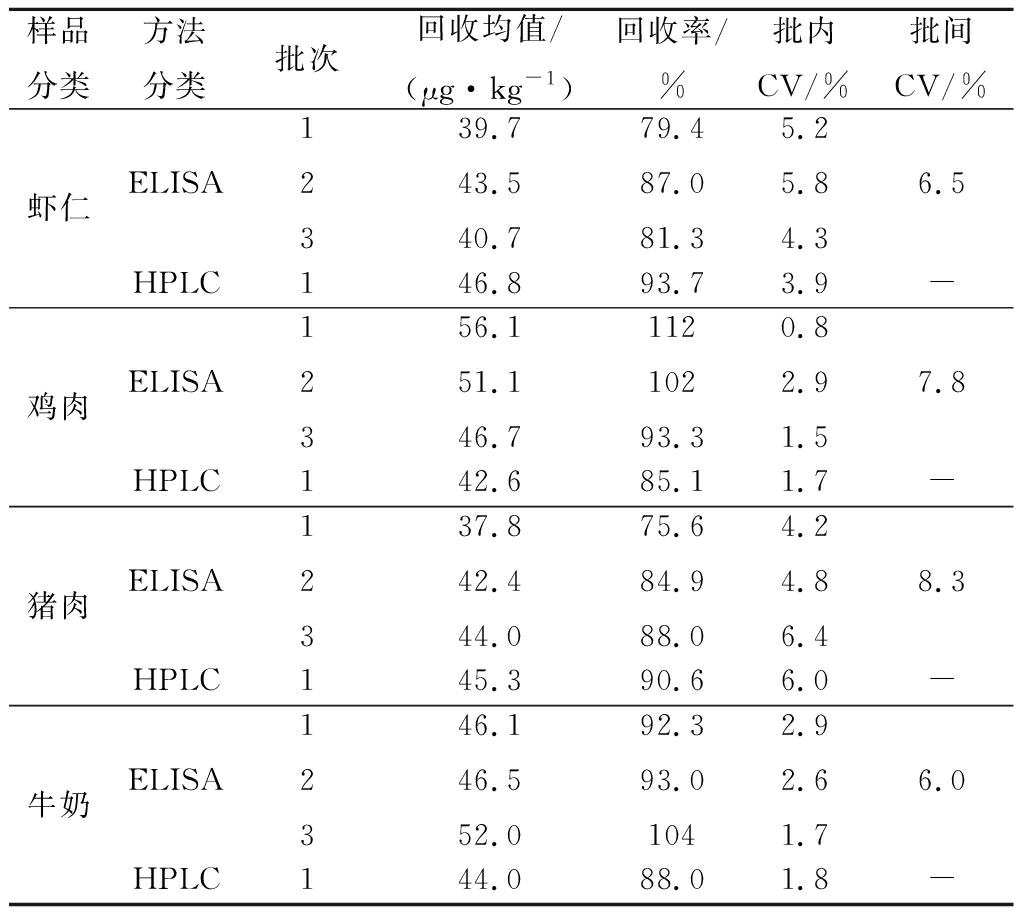
2.8 与高效液相色谱结果比较
2.8.1 灵敏度的比较
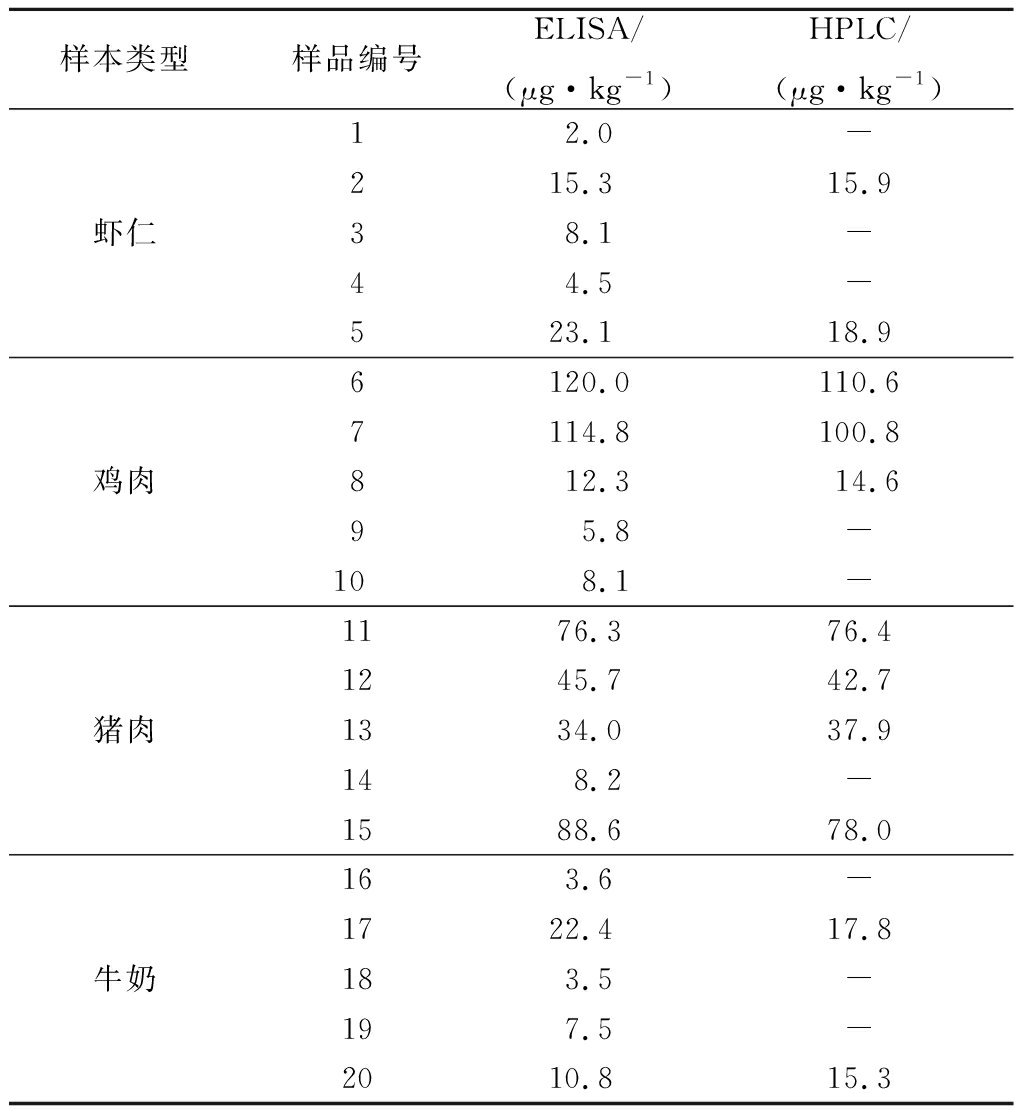
用本试剂盒建立方法和高效液相色谱法[17]分别测定市场随机抽选的虾仁、鸡肉、猪肉、牛奶样品各5分,共计20份样品,结果见表8。自制试剂盒检测方法中,取3个批次试剂盒,3个平行,求平均值;由于仪器方法的最低检测限为10 μg/kg,低于10 μg/kg的样品用“-”符号表示。由表9可知试剂盒建立方法和高效液相色谱法阴阳性结果复核率为100%,检测20个样品共有10个样品为阳性样品。
表8 灵敏度比较
Table 8 Comparison of the sensitivity of ELISA and HPLC
2.8.2 准确度和精密度的比较
用同样方法,以50 μg/kg浓度对空白虾仁、鸡肉、猪肉、牛奶样品进行磺胺类药物添加回收试验,比较仪器检测方法和自制试剂盒检测方法的平均回收率和变异系数。自制试剂盒检测方法中,取3个批次试剂盒,3个平行,计算变异系数。
由表9可知高效液相色谱检测方法以50 μg/kg浓度添加,回收率在85.0%~93.7%,变异系数在1.7%~6.0%。自制试剂盒以50 μg/kg浓度添加时,回收率在75.6%~112%,批间变异系数<10%,批内变异系数<10%,适于实际样品的检测。
表9 准确度和精密度比较结果
Table 9 Comparison of the accuracy and accuracy of ELISA and HPLC
3 讨论
不同包被缓冲液的选择及抗原、抗体和酶标二抗浓度配比对IC50、吸光度值均有较大影响。对比结果表明3种包被缓冲液中碳酸盐缓冲液优于其他2种缓冲液,更利于抗原吸附于本研究用酶标板。另外,随着包被抗原稀释浓度在一定范围增加,IC50、吸光度值均降低,最终确定最佳包被抗原稀释2×104倍;抗体∶酶标二抗的相对比对检测数据也有较大影响,分析实验数据可知抗体浓度的降低,吸光度值随之降低,酶标二抗浓度的降低,灵敏度下降。综合考虑IC50、吸光度值及添加回收率选择最佳比例2×104∶2000。
在反应时间上的确定,实验数据显示随着最佳反应时间之后继续延长反应时间,所得曲线相关系数呈下降趋势,结果与真实值相差较大。根据实验数据确定了试剂盒的检测方法:样品溶液或标准品溶液50 μL/孔,抗体工作液50 μL/孔,在25 ℃反应30 min,洗板,加入酶标二抗100 μL/孔,在25 ℃反应30 min,加入底物显色液100 μL/孔,在25 ℃反应15 min,终止,酶标仪于450/630 nm测定OD值。
对于试剂盒的稳定性验证,仅进行了4 ℃条件下保存,有一定的局限性。没有能够覆盖多个差异温度,因此在实际市场使用过程中还有待验证,但本试剂盒的实验结果仍属于较好范围内,只要进行合理的保存,仍然能够满足市场的检测需求。本研究通过对动物源性食品添加回收建立的样品分析方法与HPEC检测方法检测市场样品,检测阴阳性结果复核率为100%,准确度、精密度数据符合度均较高,表明本试剂盒能够满足HPLC样品初筛和适应现场检测。
参考文献
[1] 于淼. 养殖业中磺胺类药物残留的危害及现状[J]. 现代畜牧科技, 2015(2): 133.
[2] 赵旭壮,李明元. 动物性食品中磺胺类药物残留检测研究进展[J]. 中国食品卫生杂志, 2012(3): 292-296.
[3] WANG S,ZHANG H Y,WANG L,et al. Analysis of sulphonamide residues in edible animal products:A review[J]. Food Additives & Contaminants:Part A, 2006, 23(4): 362-384.
[4] 张晓强,张波,方萍,等. QuEChERS-超高效液相色谱-串联质谱法快速测定鱼肉中22种磺胺类药物残留[J]. 理化检验, 2015, 51(3): 369-374.
[5] YU H, TAO Y F, CHEN D M, et al. Development of a high performance liquid chromatography method and a liquid chromatography-tandem mass spectrometry method with the pressurized liquid extraction for the quantification and confirmation of sulfonamides in the foods of animal origin[J]. Journal of Chromatography B, 2011, 879(25): 2 653-2 662.
[6] 张宁. 高效液相色谱法测定鸡肉中磺胺类药物研究[J]. 天津农业学报, 2017, 24(1): 34-37.
[7] CHU Q C, ZHANG D L, WANG J Y, et al. Multiresidue analysis of sulfonamides in animal tissues by capillary zone electrophoresis with electrochemical detection[J]. Journal of the Science of Food and Agriculture, 2009, 89(14): 2 498-2 504.
[8] 代婷婷,林华萍,段婕,等. 毛细管区带电泳化学发光法测定食品中残留的磺胺类药物[J]. 分析化学, 2016(5): 747-753.
[9] ZHOU Q, PENG D, WANG Y, et al. A novel hapten and monoclonal-based enzyme-linked immunosorbent assay for sulfonamides in edible animal tissues[J]. Food Chem, 2014, 154: 52-62.
[10] PENG D, LI Z, WANG Y, et al. Enzyme-linked immunoassay based on imprinted microspheres for the detection of sulfamethazine residue[J]. J Chromatogr A, 2017, 1506: 9-17.
[11] 冯敏,李亚楠,高丽霞,等. 酶联免疫吸附法在食品安全性指标检测中的研究进展[J]. 食品安全质量检测学报, 2016(10): 3 973-3 979.
[12] 徐镇. 酶联免疫吸附技术在食品检测领域中的应用进展[J]. 食品安全导刊, 2017(27): 122.
[13] 田博,金坚,惠人杰,等. 兽药残留检测中磺胺嘧啶ELISA试剂盒的研制[J]. 生物加工过程, 2017, 15(1): 69-72.
[14] 苏明明,肖姗姗,张瑜,等. 酶联免疫试剂盒检测牛血清中磺胺类药物残留[J]. 检验检疫学刊, 2016(2): 17-19,30.
[15] 李君华,米振杰,李志平,等. 磺胺二甲嘧啶药物残留ELISA检测试剂盒的研制及初步应用[J]. 中国畜牧杂志, 2013(9): 78-81.
[16] 罗贵昆,陈旭,谢体波,等. 阿维菌素类药物酶联免疫快速检测试剂盒的制备及检测效果[J]. 中外食品工业, 2014(7): 19-22.
[17] GB 29694—2013. 动物性食品中13种磺胺类药物多残留的测定[S].