汞是一种有剧毒的重金属,其对人体的毒性大小与它的存在形态密切相关。通常而言,有机汞的毒性大于无机汞,在有机汞中,甲基汞对人体的危害最强,目前汞单质引起的食物中毒未见报道。无机汞进入人体后主要积蓄在肾脏,对肾脏造成损伤[1-2]。甲基汞由于分子质量小、脂溶性强等特点,极易通过血脑屏障,因此表现出很强的神经毒性[3]。此外,有研究报道甲基汞暴露会导致表观基因组改变如DNA甲基化等[4]。
由于汞,尤其是甲基汞对人体危害较大,世界各地对汞的污染越来越重视。世界卫生组织(World Health Organize,WHO)将汞列为最需要关注的重金属污染物。人体汞暴露主要是通过食品,因此对食品中汞含量与存在形式进行快速、准确的监控对提高食品质量、保护消费者健康具有积极意义。传统的检测技术如总汞的二硫腙比色法、冷原子吸收法、甲基汞的气相色谱法等已不能很好地满足对食品中汞的检测要求。因此,越来越多的科研工作者开始探索和寻找灵敏度、精确度更高,检测速度更快的检测方法,以满足对食品中汞监测的需求。在此背景下,本文综述了食品中汞的来源、污染现状、各国限量标准及国内外汞检测技术的现状,为汞在各类食品中限量标准的设立及检测技术的发展提供借鉴与参考。
1 食品中汞污染来源、污染现状及限量
1.1 食品中汞的来源
土壤和水体中汞的自然来源主要是岩石风化、森林火灾及大气沉降等[5-6]。人类活动如化石燃料的使用、工业生产中排放的“三废”[7],以及农药、化肥的使用都会导致汞向土壤和水体中释放[8]。
由于汞无法降解且生物富集作用强,土壤和水体中的汞经生物富集后大量进入食品原料,进而危害人类健康。此外,食品在加工、运输过程当中也有可能被金属容器溶出的汞和含汞食品添加剂污染。食物,尤其是鱼类等水产品是人体中汞的主要来源。水体和土壤中的汞经微生物的甲基化作用形成甲基汞,经食物链逐级在鱼类中富集,因此鱼类食品中的甲基汞浓度较环境中高;植物性食品通常因为磷肥和农药的滥用而被汞污染,在微生物作用下,这些汞也会被转化成甲基汞[9-12]。目前研究发现,硫酸盐还原菌、铁还原菌、产甲烷菌为主要的甲基化微生物,它们都为厌氧菌,含有将Hg2+甲基化所需的hgcA和hgcB基因,其中硫酸盐还原菌甲基化能力较强,且广泛存在于海水、河水、土壤中[13-14],因此甲基汞也可能不仅仅存在于海产品中。
1.2 食品中汞的污染现状
历史上曾发生过多次汞中毒事件,其中影响最大的是1953年发生在日本熊本县的水俣病,是一种由有机汞慢性中毒引起的神经系统障碍疾病,患者病症表现为手足不协调、运动及言语障碍,重者意识不清、神经错乱甚至死亡,该事件造成1 000多人死亡,10 000多人患病。经调查确认,该病是由甲基汞污染当地居民经常食用的水产品所致[15]。1972在伊拉克有459人由于食用被汞污染的面包而死亡[16]。汞污染食品造成中毒的事件在我国也有发生,如2004年青海省某单位饮用水被汞污染,导致78人慢性汞中毒[17];2009年11月、2010年1月,北京2市民饮用被汞污染的雪碧而中毒[18]。
尽管我国政府加强了对食品中汞的监控,由于汞污染的广泛性,不少地区抽检的食品样品中仍存在汞超标的现象。如2017年宝鸡市疾病预防控制中心从当地大型农贸市场、超市等地购买176份食品样品,用直接测汞仪进行检测,结果显示蔬菜和禽畜肉中汞超标率分别为9.4%和9.1%[19];2015年呼和浩特市疾病预防控制中心对当地食品进行抽检,结果显示乳品中汞检出率55%,合格率 75%;食用菌汞检出率96.7%,合格率 76.7%,这2种食品汞超标率较高[20]。2013年平顶山市疾病预防控制中心对当地蔬菜进行汞污染检测,结果显示当地蔬菜汞超标率为10.17%[21]。由此可见,食品中汞污染的现状不容乐观。
1.3 国内外对食品汞污染的限量标准
由于汞对人体健康的危害较大,世界各国都对食品中汞的含量进行严格限制。各国对食品中汞的残留限量值见表1。
表1 国内外食品中汞限量标准[22-23]
Table 1 Domestic and international limitation standard of mercury in food
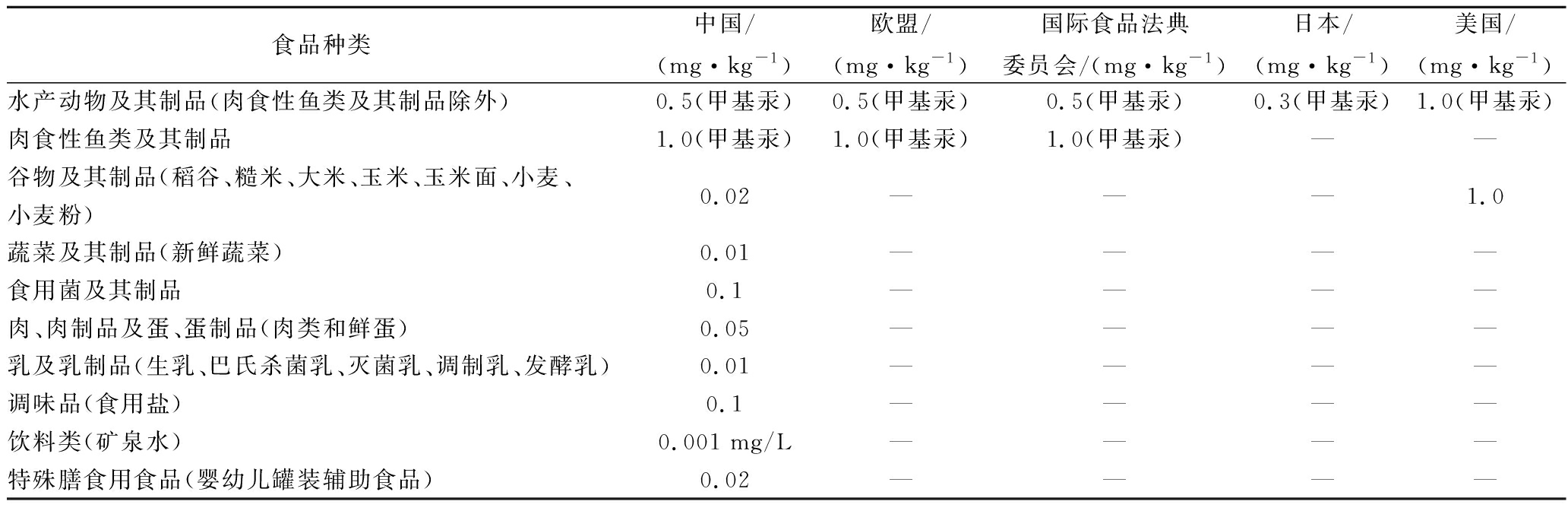
注:“-”表示没有此项标准。
如表1所示,水产动物产品中汞的限量标准以甲基汞表示,其余产品以总汞表示。我国对水产动物及肉食鱼类食品中甲基汞限量与欧盟和国际食品法典委员会(Codex Alimentarius Commission,CAC)相应的限量一致,分别不超过0.5、1.0 mg/kg;欧盟、CAC及日本仅对水产动物产品中的汞作出限量,美国仅对水产动物和小麦中的汞作出限量,说明我国对食品中汞的限量要求比国际标准更广泛。
袁晓博等[24]测定了我国9省市303份大米样品中甲基汞含量,结果显示样品中甲基汞含量在0.13~18μg/kg之间,占总汞比例的1.7%~97%。需要指出的是,大米占我国居民日常饮食大部分,食用量大、频率高,且甲基汞在人体中的积蓄性强、毒性大,其对大米的污染应当引起足够重视,相应的标准也应该被设立。
2 食品中汞的检测方法
我国国家标准GB 5009.17—2014《食品中总汞及有机汞的测定》[25]中规定了食品中总汞的测定方法,方法一为原子荧光光谱分析法(atomic fluorescence apectrometry, AFS),样品前处理采用酸加热消解;方法二为冷原子吸收光谱法(cold vapor atomic adsorption spectrometry, CV-AAS),前处理为酸消解或催化酸消解。该标准还规定了食品中甲基汞的测定方法为液相色谱-原子荧光光谱联用法(liquid chromatography-atomic fluorescence spectrometry,LC-AFS),样品前处理为超声辅助酸提取法。除了国标规定的测定方法外,不少科技人员也在探索其他的方法以达到食品中汞与甲基汞检测要求的方便、快速、准确的要求。
2.1 食品样品汞与甲基汞测定的前处理技术
要测定食品中汞与甲基汞含量,首先要对样品进行前处理。因为汞元素及形态汞不稳定[26],样品的前处理过程需要十分注意。目前常用的前处理方法有超声辅助酸处理法、超声辅助碱处理法、微波辅助处理法、酶处理法等。
王林裴等[27]用5mol/L HCl超声辅助处理水产动物样品,用AFS测定,加标回收率分别为80.1%~95.8%(Hg2+)、92.1%~105%(甲基汞)、80.3%~97.6%(乙基汞),相对标准偏差(relative standard deviation, RSD)≦5.0%,该法能够较好地防止形态汞的损失。赵凯等[28]利用超声辅助碱处理2种标准物质,用高效液相色谱-原子荧光光谱联用(high performance liquid chromatography-atomic fluorescence spectrometry, HPLC-AFS)测定甲基汞,结果显示测定值分别为给定值的(97.1±1.4)%和(99.1±1.2)%,说明该处理技术能够较好地防止甲基汞的损失。
微波辅助消解技术是近几年发展起来的一种高效、节能的样品前处理技术。微波消解技术主要分为封闭式和开放式2种。开放式微波消解系统的优点在于可以随时添加试剂以及可以排除消解过程释放的气体,缺点是易被污染。封闭式消解系统相较于开放式系统更加方便、快速,但由于不能及时排除气体,因而存在一定的安全隐患。微波辅助消解技术测定总汞时通常用酸性消解剂如硝酸、盐酸,测定甲基汞时通常选用碱性提取剂如四甲基氢氧化铵、氢氧化钾[29]。CUNHA等[30]用封闭式微波辅助浓硝酸处理样品,利用AFS测定牛奶总汞含量,用含有(9.4±1.7)ng/g总汞的标准物质验证可行性,结果显示标准物质测定值的不确定度为0.94ng/g,RSD为9.9%,表明该前处理技术对样品的消化效率较高。JIMENEZ-MORENO等[31]分别利用封闭式微波辅助硝酸和微波辅助四甲基氢氧化铵消解处理大米样品,气相色谱-原子荧光分光光度法联用(gas chromatography-atomic fluorescence spectrometry, GC-AFS)测定甲基汞,回收率分别为(99±5)%和(81±6)%,认为微波辅助硝酸处理对大米样品中甲基汞的提取率较高。CARRASCO等[32]采取传统烘箱加热消解、碱消解、微波辅助酸消解、微波辅助碱消解、酶催化消解分别处理海产品,并用GC-AFS测定其中的甲基汞,比较结果得出碱(氢氧化钾-甲醇溶液)消解(回收率97%)、微波辅助盐酸消解(回收率94%)和酶促消解(回收率99%)对甲基汞的提取效率好。REYES等[33]分别用微波辅助碱处理、微波辅助酸处理、超声辅助碱处理、超声辅助酸处理、蛋白酶处理鱼类样品,然后用高效液相色谱与电感耦合等离子体质谱联用(high performance liquid chromatography-inductively coupled plasma mass spectrometry, HPLC-ICP-MS)测定甲基汞含量,结果显示微波辅助碱处理和超声辅助碱处理使甲基汞的损失率低于6%,提取效果较好,该研究还指出微波辅助硝酸处理会导致鱼类样品中甲基汞大量损失,影响测定结果。
2.2 食品中汞的测定方法
2.2.1 色谱与光谱/质谱技术联用
近年来,对食品中汞的检测已经不局限于某单一技术的应用,而是趋向于多种技术联用。例如,为了对食品中的形态汞进行测定,GC、HPLC都是常用的分离手段,将分离得到的形态汞利用AFS、AAS、ICP-MS进行定量测定。几种常见色谱与光谱/质谱联用技术见表2。
表2 常见的色谱与光谱/质谱联用技术之间的比较
Table 2 Comparison between chromatographic and spectral/mass spectrometry techniques

2.2.2 非色谱法
尽管技术联用允许在线分析食品中汞含量,并且具有较低的检测限,但所需的仪器大多数昂贵且操作复杂,如果要测定形态汞则在色谱分离过程要消耗大量时间[39],因此不少科技人员开始研究用非色谱法来分离测定形态汞。COVACI等[40]采用非色谱法测定鱼类产品中的形态汞,利用HBr提取甲基汞,用甲苯萃取、L-半胱氨酸反萃取甲基汞后,在紫外光照射下用0.6mol/L甲酸进行衍生,用电容耦合等离子体发射光谱法(capacitively coupled plasma optical emission spectrometry, CCP-OES)测定甲基汞回收率为(100±8)%,精确度为2.4%~11.9%,检出限为2 μg/kg。
2.2.3 汞直接测定仪
汞直接测定仪也是近几年的研究热点。有研究表明,汞直接测定仪可以很好地测定诸如食品这样的成分复杂的样品中汞含量[41]。MARTINS等[42]利用汞直接测定仪对87种婴幼儿食品中总汞进行检测,结果显示检出限为0.1 μg/kg,重复性和中间精密度分别为0.7%、1.0%,不确定度为4.3%,表明汞直接测定仪具有较高的精确度和准确度。VIEIRA等[43]比较了直接汞测定仪与CV-AAS,得到的结果表明直接汞测定仪能够快速处理多个样本,检出限相比较于AAS要低,主要缺点是对样本的质量限制在100 mg以下,样本质量较大时需多次测量。
2.2.4 荧光法
荧光探针技术由于其高敏感性、高选择性以及易操作性而备受关注。近年来有研究报道利用罗丹明类衍生物作为荧光探针检测食品中的汞含量,其原理是在PVA-124表面活性剂存在的条件下,Hg2+与KI反应生成I3-,I3-与罗丹明6G形成缔合物使其荧光猝灭,荧光猝灭值在8~100 ug/L与Hg2+浓度呈良好线性关系,利用这种方法对标准样品进行测定,RSD为2.3%~3.8%,回收率97.5%~102%[44]。
LASHGARI等[45]设计了一种经靛红修饰的纳米多孔二氧化硅材料,发现该材料的荧光强度与Hg2+离子浓度之间具有良好的线性关系且对Hg2+具有显著的特异性,用其检测自来水中的Hg2+,结果显示该法检测限为3.7×10-6mol/L,回收率96.5%,可用于水中Hg2+的检测。
LI等[46]利用富含胸腺嘧啶的单链寡脱氧核糖核苷酸适配体修饰碳量子点作为荧光探针,以MnO 2纳米片作为猝灭剂,测定湖水中的Hg2+,其原理是当不存在Hg2+时,探针吸附在猝灭剂表面发生荧光猝灭,当存在Hg2+时,适配体与Hg2+形成T-Hg 2+ -T配合物,探针从猝灭剂表面分离而发出荧光。荧光强度在Hg2+浓度为2~200 nmol/L,随Hg2+浓度增加而增加,该法检测限为0.67 nmol/L,RSD<5%,回收率98.7%~103.6%,具有高灵敏度和高选择性。
纳米银具有很强的荧光特性,当Hg2+与纳米银混合后会发生氧化还原反应,纳米银紫外特征吸收峰强度随Hg2+浓度增加而降低,并在一定范围内呈良好线性关系。任艺[47]采用纳米银测定蔬菜中Hg2+含量,发现当存在Zn2+,Fe3+,Mg2+,Ca2+和Mn2+等其他8种离子时,纳米银对Hg2+表现出高度专一性,该法加标回收率为97.25%~100.63%,RSD<10%,检出限为0.7 μg/L,表明该法具有很好的准确度和精密度。
2.2.5 酶抑制法
酶抑制检测技术也被应用于汞的检测,该方法具有检测速度快、操作简便、适合现场检测等优点。张宁宁[48]探究Hg2+与脲酶活性之间的关系,发现Hg2+浓度与脲酶活性具有良好的线性负相关,与石墨炉原子吸收光谱法相比较,显示2种方法的测定结果没有显著性差异。
2.2.6 电化学法
电化学技术也因为成本低,易于检测,灵敏度高等优点应用于对汞的检测。SQUISSATO等[49]提出了一种简易的电化学方法,鱼油样品在室温下经超声辅助HCl/H2O2处理15 min后以金作为电极使用阳极溶出伏安法测定其中的汞,该法中汞信号随沉积时间增加,在5~400 μg/L具有良好线性关系,检测限为0.25 μg/L,RSD<5%,回收率为95%~105%,并且电极连续使用约100次无需更换。
电化学法通常结合纳米孔技术、适配体技术、酶抑制法使用,通过在电极上修饰不同的材料以获得更低的检测限和更高的精密度等。几种用于测定汞的修饰电极见表2。
表3 几种用于测定汞的不同修饰电极之间的比较
Table 3 Comparison between different modified electrodes for the determination of mercury
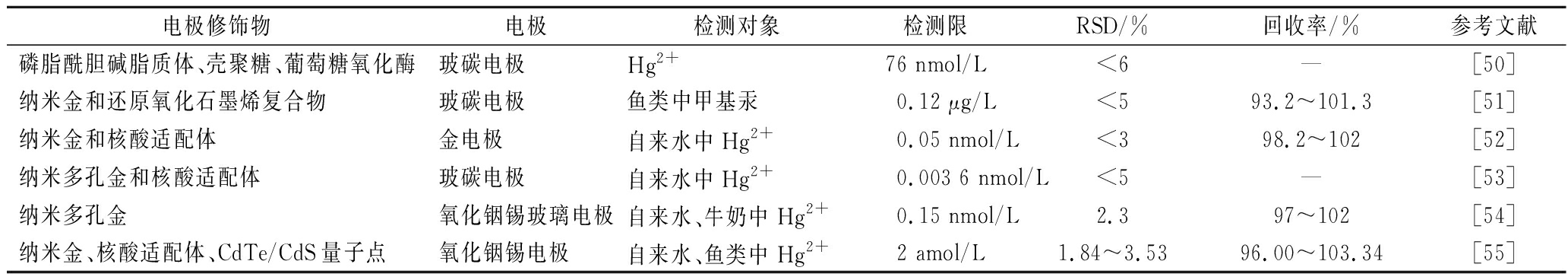
注:“-”表示文献未提及。
3 结语与展望
当前食品中汞污染现状较为严峻,食品中的汞主要来源于土壤、水体本身、大气沉降及含汞农药、化肥、添加剂的使用。在所有的形态汞当中,甲基汞对人体危害最大,会对肝脏及神经系统产生较大损伤,此外还可产生胎儿毒性和遗传毒性,而且,由于自然界中汞及能够将汞甲基化的微生物分布广泛,甲基汞广泛存在于各类食品当中,因此,健全各类食品中汞及甲基汞限量标准以及建立一种对食品中汞准确、快速测定的方法仍然是十分重要且必要的。
由于汞及其化合物的不稳定性,样品前处理必须十分谨慎选择前处理方式。目前,大部分方式都应用超声辅助或者微波辅助,这可以提高效率并降低样品中待测成分的损失。在测定总汞时,通常用硝酸或盐酸与过氧化氢作为消解剂,在测定甲基汞时则选用氢氧化钾或者四甲基氢氧化铵进行碱提取。当前对汞的测定主要采用技术联用,技术联用精确度和准确度较高,并且有着较低的检出限,但缺点也显而易见,部分设备昂贵,操作复杂,如果要分离形态汞则需要较长的时间,并且很难实现现场测定。因此,对汞的测定方法在保留较高精确度和准确度的前提下,应该向诸如电化学法、荧光法、酶抑制法及这些方法联用等方面发展,以建立更为快速、方便、经济的食品中汞的检测方法。
参考文献
[1] SU Dou-yue, YANG Xin, XIA Qing-dong, et al. Folic acid functionalized silver nanoparticles with sensitivity and selectivity colorimetric and fluorescent detection for Hg2+ and efficient catalysis[J].Nanotechnology,2014,25(35).
[2] 陈子安,聂志勇,李万华,等.汞的肾毒性及治疗研究进展[J].中国药理学与毒理学杂志,2016,30(3):286-290.
[3] 李健,刘苹.甲基汞的神经行为毒性[J].昆明医科大学学报,1999(3):83-87.
[4] GOODRICH J M, BASU N, FRANZBLAU A, et al. Mercury biomarkers and DNA methylation among Michigan dental professionals[J]. Environmental and Molecular Mutagenesis, 2013, 54(3): 195-203.
[5] 吕博,赵玲双,刘赟妮,等.汞污染的来源及修复技术[J].现代农业科技,2017(1):188.
[6] FENG X B, TANG S L, SHANG L H, et al. Total gaseous mercury in the atmosphere of Guiyang, PR China[J]. Science of the Total Environment,2003,304(1/3):61-72.
[7] WILSON S, KINDBOM K, YARAMENKA K, et al. Technical Background Report for the Global Mercury Assessment 2013[M].2013:4-68.
[8] 钱坤,齐月,何阳,等.食品中重金属汞污染状况与治理对策研究[J].黑龙江农业科学,2016(5):107-109.
[9] CLÉMENS S, MONPERRUS M, DONARD O F X, et al. Mercury speciation in seafood using isotope dilution analysis: a review[J]. Talanta,2012,89:12-20.
[10] DALAL E L H, CHRISTOPHER T S, AMANDA E P, et al. A review of mercury concentrations in freshwater fishes of Africa: Patterns and predictors[J]. Environmental Toxicology and Chemistry,2015,34(2):215-223.
[11] SHEN Tong-fei, YUE Qiao-li, JIANG Xiu-xiu, et al. A reusable and sensitive biosensor for total mercury in canned fish based on fluorescence polarization[J], Talanta,2013,117:81-86.
[12] DE JESUS R M, SILVA L O B, CASTRO J T, et al. Determination of mercury in phosphate fertilizers by cold vapor atomic absorption spectrometry[J]. Talanta,2013,106:293-297.
[13] PARKS J M, JOHS A, PODAR M, et al. The genetic basis for bacterial mercury methylation[J]. Science,2013,339(6 125):1 332-1 335.
[14] POULAIN A J, BARKAY T. Cracking the mercury methylation code[J]. Science, 2013,339(6 125):1 280-1 281.
[15] 赵静,孙海娟,冯叙桥.食品中重金属汞污染状况及其检测技术研究进展[J].食品工业科技,2014,35(7):357-363,367.
[16] BAKIR F, DAMLUJI S F, AMIN-ZAKI L, et al. Methyl mercury Poisoning in Iraq[J]. Science,1973(181):230-241.
[17] 马少元.一起饮用污染锅炉水引起慢性汞中毒事件的报道[J].环境与职业医学,2006,23(1):66.
[18] 杜吟. “雪碧汞中毒”事件有了新进展[N].中国质量报,2010-02-03(001).
[19] 赵晓亮,刘璇,许欢,等.宝鸡市市售食品中汞的污染状况及其对人群健康风险评价[J].职业与健康,2017,33(13):1 769-1 771.
[20] 宋彩军,崔建平,苏丹.2015年呼市地区抽检食品中汞污染水平分析[J].疾病监测与控制,2016,10(7):577-578.
[21] 王孝文,郭晏强,宋秋坤.蔬菜汞污染检测结果分析[J].微量元素与健康研究,2013,30(1):44-45.
[22] 中国国家标准化管理委员会.GB 2762—2017食品中污染物限量[S].北京:中国标准出版社2017.
[23] 李志勇,许业莉,刘津,等.国内外农食产品重金属限量比较分析[J].食品科技,2010,35(6):318-326.
[24] 袁晓博,冯新斌,仇广乐,等.中国大米汞含量研究[J].地球与环境,2011,3(3):318-323.
[25] 中国国家标准化管理委员会.GB5009.17—2014食品中总汞及有机汞的测定[S].北京:中国标准出版社,2014.
[26] HENRYK M, RALPHE S. Chemical vapor generation with slurry sampling: a review of applications to atomic and mass spectrometry[J]. Applied Spectroscopy Reviews,2012,47(1):41-82.
[27] 王林裴,周迎春,郑亚哲,等. 液相色谱-原子荧光光谱法分析测定水产动物及其制品中不同形态汞的含量[J]. 食品工业科技,2018,39(2):267-271,319.
[28] 赵凯,杨大进.高效液相色谱原子荧光分光光度联用法测定海产品中的甲基汞含量[J].中国食品卫生杂志,2011,23(6):534-539.
[29] FERREIRA S L C, LEMOS V A, LILVA L O B, et al. Analytical strategies of sample preparation for the determination of mercury in food matrices-A review[J]. Microchemical Journal,2015,121:227-236.
[30] CUNHA L R, COSTA T H M, CALDAS E D. Mercury concentration in breast milk and infant exposure assessment during the first 90 days of lactation in a midwestern region of Brazil[J]. Biological Trace Element Research,2013,151(1):30-37.
[31] JIMENEZ-MORENO M, LOMINCHAR M A, SIERRA M J, et al. Fast method for the simultaneous determination of monomethylmercury and inorganic mercury in rice and aquatic plants[J]. Talanta, 2018, 176: 102-107.
[32] CARRASCO L, VASSILEVA E. Determination of methylmercury in marine biota samples: method validation[J], Talanta,2014,122:106-114.
[33] REYES L H, RAHMAN G M M, FAHRENHOLZ T, et al. Comparison of methods with respect to efficiencies, recoveries, and quantitation of mercury species interconversions in food demonstrated using tuna fish[J]. Analytical and Bioanalytical Chemistry,2008,390(8):2 123-2 132.
[34] DRESSLER V L, SANTOS C M M, ANTES F G, et al. Total mercury, inorganic mercury and methyl mercury determination in red wine[J], Food Analytical Methods,2012,5(3):505-511.
[35] 樊祥,张润何,刘博,等.高效液相色谱-原子荧光光谱法测定水产品中不同形态汞含量[J].食品安全质量检测学报,2017,8(1):76-81.
[36] 李吉龙,李姗,何霜,等.测汞仪/高效液相色谱-电感耦合等离子体质谱联用法测定鱼松中总汞和甲基汞的含量[J].食品安全质量检测学报,2017,8(1):82-87.
[37] 籍术良,王芳,魏玉霞,等.液相色谱-原子荧光光谱法测定鱼肉中的甲基汞[J].中国卫生检验杂志,2018,28(2):152-154.
[38] 李清清,潘煜辰,陈贵宇,等.鱼酥制品中甲基汞和乙基汞的检测研究[J].食品工业,2017,38(6):296-299.
[39] COVACI E, SENILA M, PONTA M, et al. Methylmercury determination in seafood by photochemical vapor generation capacitively coupled plasma microtorch optical emission spectrometry[J]. Talanta,2017,170:464-472.
[40] COVACI E, SENILA M, PONTA M, et al. Mercury speciation in seafood using non-chromatographic chemical vapor generation capacitively coupled plasma microtorch optical emission spectrometry method-evaluation of methyl mercury exposure[J]. Food Control, 2017,82:266-273.
[41] DA SILVA M J, PAIM A P S, PIMENTELM F, et al. Determination of total mercury in nuts at ultratrace level[J]. Analytica Chimica Acta,2014,838:13-19.
[42] MARTINS C, VASCO E, PAIXAO E, et al. Total mercury in infant food, occurrence and exposure assessment in Portugal[J]. Food Additives & Contaminants: Part B-surveillance,2013,6(3):151-157.
[43] VIEIRA H P, NASCENTES C C, WINDMOLLER C C. Development and comparison of two analytical methods to quantify the mercury content in honey[J]. Journal of Food Composition and Analysis,2014,34(1):1-6.
[44] 张瑞华. 罗丹明6G荧光猝灭法在线测定汞离子的研究[D].石家庄:河北科技大学,2014:40-47.
[45] LASHGARI N, BADIEI A, ZIARANI G M, et al. Isatin functionalized nanoporous SBA-15 as a selective fluorescent probe for the detection of Hg(II) in water[J]. Analytical and Bioanalytical Chemistry,2017,409(12):3 175-3 185.
[46] LI Jing-shuai, DU Bin, LI Yue-wen, et al. A turn-on fluorescent sensor for highly sensitive mercury(II) detection based on a carbon dot-labeled oligo deoxyribonucleotide and MnO2 nanosheets[J]. New Journal of Chemistry,2018,42(2):1 228-1 234.
[47] 任艺.纳米银应用于蔬菜中汞含量检测的研究[D].北京:北京林业大学,2016:1-2.
[48] 张宁宁.食品中汞、镉的酶法检测技术研究[D].石家庄:河北科技大学,2014:11-19.
[49] SQUISSATO A L, ROCHA D P, Almeida E S, et al. Stripping voltammetric determination of mercury in fish oil capsules using a screen-printed gold electrode[J]. Electroanalysis, 2018, 30(1): 20-23.
[50] YU Jia, GUAN Hua-nan, CHI De-fu, et al. An amperometric glucose oxidase biosensor based on liposome microreactor-chitosan nanocomposite-modified electrode for determination of trace mercury[J]. Journal of Solid State Electrochemistry,2017,21(4):1 175-1 183.
[51] XU Yi-wei, ZHANG Wen, SHI Ji-yong, et al. Electrodeposition of gold nanoparticles and reduced graphene oxide on an electrode for fast and sensitive determination of methylmercury in fish[J]. Food Chemistry,2017,237:423-430.
[52] ZHANG Yan-yan, ZHANG Cong, MA Rui, et al. An ultra-sensitive Au nanoparticles functionalized DNA biosensor for electrochemical sensing of mercury ions[J]. Materials Science & Engineering C-materials for Biological Applications,2017,75:175-181.
[53] ZENG Guang-ming, ZHANG Chen, HUANG Dan-lian, et al. Practical and regenerable electrochemical aptasensor based on nanoporous gold and thymine-Hg2+-thymine base pairs for Hg2+ detection[J]. Biosensors & Bioelectronics,2017,90:542-548.
[54] LIN Yuan-yuan, PENG Yang, DI Jun-wei. Electrochemical detection of Hg(II) ions based on nanoporous gold nanoparticles modified indium tin oxide electrode[J]. Sensors and Actuators B-chemical, 2015,220:1 086-1 090.
[55] BABAMIRI B, SALIMI A, HALLAI R. Switchable electrochemiluminescence aptasensor coupled with resonance energy transfer for selective attomolar detection of Hg2+ via CdTe@CdS/dendrimer probe and Au nanoparticle quencher[J]. Biosensors & Bioelectronics,2018,102:328-335.