浓香型白酒是中国三大基本香型白酒(浓香型、清香型和酱香型)之一,其酿造特征被总结为“千年老窖万年糟”“以窖养糟,以糟养泥”等俗语,这些经验总结是古人酿造智慧的集中体现。生产上历来对窖泥品质给予了高度的关注,尤其重视以己酸菌(产己酸细菌的统称)为代表的挥发性风味物质产生的细菌。近年来,随着微生物生态学与微生物组学的发展,相关技术手段的发展使窖泥中蕴含的厌氧微生物科学奥秘能逐步得以剖析。研究发现,经过长期的混合循环发酵,优质老窖泥中富集了200种以上的厌氧微生物,这些微生物之间及与环境因子的相互作用,形成了复杂的窖泥微生物生态系统[1]。窖泥中的微生物多为严格厌氧和兼性厌氧的细菌和严格厌氧的古菌组成,这些微生物对浓香型白酒风味物质形成具有非常重要的贡献,并且相互作用维持着浓香型白酒酿造窖泥微生态环境的稳定[2-3]。己酸乙酯在浓香型白酒中,是除乙醇外的最高丰度的风味物质,其前体己酸由己酸菌合成。由于酿造体系中乙醇丰度较高,己酸乙酯的合成效率往往与发酵过程中己酸的累积浓度呈正相关。更为重要的是,窖泥中己酸菌的丰度及其正常代谢活动是窖泥微生物稳态的指示菌[4],故己酸菌在浓香型白酒酿造中有着独特的作用和重要的地位。
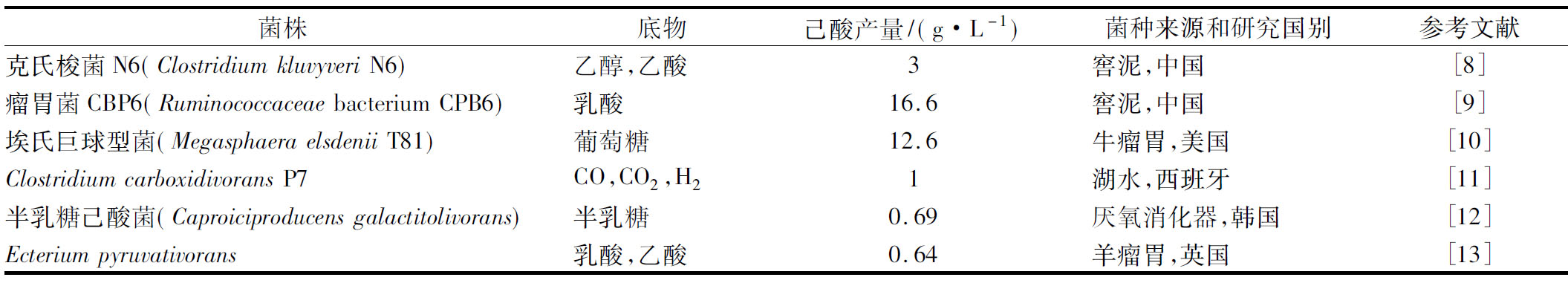
自然界能产生己酸的微生物种类并不多,目前已报道的能以较高效率合成己酸的纯培养己酸菌主要有克氏梭菌、瘤胃菌CBP6、埃氏巨球型菌、半乳糖己酸菌等6种细菌,其中克氏梭菌、瘤胃菌CBP6、埃氏巨球型菌具有较高的己酸产量和合成强度(表1)。
微生物合成己酸主要通过β-氧化循环的反转途径进行,合成己酸的胞内核心生化反应是以乙酰辅酶A为起始合成及碳链延伸单元,每次碳链延伸将脂肪链延长2个碳单元[5]。目前报道的多种己酸合成微生物除可以合成主要产物己酸外,还可以合成少量的丁酸、戊酸、庚酸、辛酸等多种类型的短中链脂肪酸,利用己酸菌合成中链脂肪酸已成为当前中链脂肪酸研究领域的热点[6-7]。
我国科研工作者对白酒酿造体系中己酸菌的分离与鉴定始于20世纪60年代,多以乙醇和乙酸盐作为碳源,进行己酸菌的富集及分离[14-15]。半个多世纪以来,酿酒科研工作者不断致力于己酸菌的分离与应用,推动了人工窖泥技术的建立与广泛应用。近年来,对窖泥己酸菌类型又有了新的认识,如新分离得到的瘤胃菌CBP6菌株,该菌株利用的主要碳源为乳酸,而非乙醇,该发现刷新了人们对窖泥己酸菌种类的认识,对窖泥中己酸菌类型进行了重要的补充[16]。然而,窖泥中的主体己酸菌为何种己酸菌,是乙醇营养型为主,还是乳酸营养型为主?至今对该问题也鲜有研究。
表1 已报道的己酸合成菌株(纯培养菌株)
Table 1 Reported caproate-producing strains (pure culture)
该文以同一厂区不同建窖时间的新窖与老窖为研究对象,比较新窖和老窖的窖泥微生物菌群结构与发酵过程中关键风味物质变化情况,以及两者的相关性,进而推断窖泥中的主体己酸菌类型。
1 材料与方法
1.1 材料
随机选取新、老窖池各6口,出池时取黄水样品,同时采用五点取样法取窖泥50 g并混合均匀。黄水与窖泥样品均冻存于-20 ℃待用。本研究中的老窖池窖龄为20年,新窖池窖龄为1年。
1.2 主要试剂
叔戊酸、叔戊醇、乙醚购买于中国医药集团上海化学试剂公司;作为标品的己酸乙酯、丁酸乙酯、己酸和丁酸购买自美国Sigma-Aldrich试剂公司;窖泥DNA提取用试剂盒(DNeasy Power Soil Kit)购买于美国Qiagen公司。
1.3 黄水样品的处理方法
黄水样品处理方法为:取1 mL黄水于12 000 r/min条件下离心2 min,之后取200 μL离心上清液,加入50 μL内标(经5%的浓盐酸酸化,浓度为12.5 g/L的叔戊酸,pH2.5),再加入250 μL乙醚进行萃取,利用振荡器涡旋振荡30 s,之后于10 000 r/min条件下离心5 min,吸取上层有机相150 μL进行气相色谱分析。
1.4 气相色谱分析
色谱柱为Agilent CP-Wax 57 CB。升温程序:60 ℃,保持0.5 min;以20 ℃ /min的速度升温至190 ℃,保持4.5 min;分流比30∶1;进样口温度220 ℃;氢火焰离子检测器(FID)温度220 ℃。
1.5 窖泥微生物DNA的提取
窖泥微生物总基因组DNA利用DNeasy PowerSoil Kit进行提取,提取方法按照试剂公司提供的实验操作指南进行。利用琼脂糖电泳对提取的窖泥微生物DNA进行质量检测,合格后进行建库、测序。
1.6 高通量测序
建库与测序在上海美吉生物技术有限公司完成。16S rDNA扩增子测序的引物为338F (5’- ACTCCTACGGGAGGCAGCAG -3’)与806R(5’- GGACTACHVGGGTWTCTAAT -3’),扩增的为16S rRNA基因的V3-V4区。测序平台为Illumina MiSeq。
2 结果与分析
2.1 新、老窖池酒醅发酵终点短中链脂肪酸的含量比较
新老窖池采用相同的酿造工艺,发酵时间均为60 d,在出窖时取黄水进行检测。气相色谱分析表明,老窖池黄水中己酸含量为2 506 mg/L,而新窖池黄水的己酸含量仅为95 mg/L,老窖池的己酸含量为新窖池的26倍,两者差异极其显著(图1)。
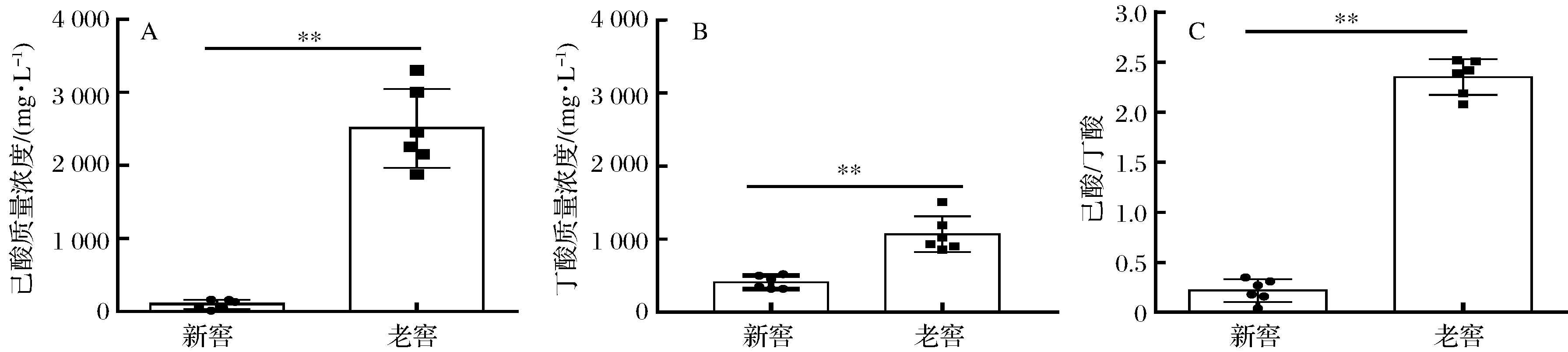
图1 新窖与老窖出池黄水中的己酸与丁酸含量
Fig.1 Concentrations of caproate and butyrate in yellow water of new and aged pit
对于黄水中的丁酸而言,老窖池平均含量为1 069 mg/L,新窖池为410 mg/L,老窖池为新窖池的2.6倍(图1)。通过检测黄水中的己酸和丁酸可以看出,对于己酸产生能力而言,老窖池远高于新窖池;而对于丁酸而言,虽然老窖池的丁酸仍然高于新窖池,但差异倍数小于己酸在新、老窖池黄水中的差异倍数。己酸/丁酸比值分析表明,老窖池的己酸/丁酸比值平均为2.4,而新窖池则低至0.2。可见,老窖池具有高产己酸的能力,新窖池的丁酸产生能力高于己酸产生能力。
2.2 新、老窖泥菌群结构分析
对老窖池与新窖池的窖泥微生物菌群结构进行分析,本研究集中于细菌菌群结构的分析。16S rRNA基因测序表明,从纲水平而言,新窖泥中细菌类型主要为芽孢杆菌纲(74%)和梭菌纲(22%),两类微生物合计96%,芽孢杆菌纲微生物丰度为梭菌纲微生物丰度的近3.3倍;而对于老窖泥而言,芽孢杆菌纲微生物丰度极低(小于0.1%),主体构成微生物为梭菌纲(80%)和拟杆菌纲(15%)(图2)。
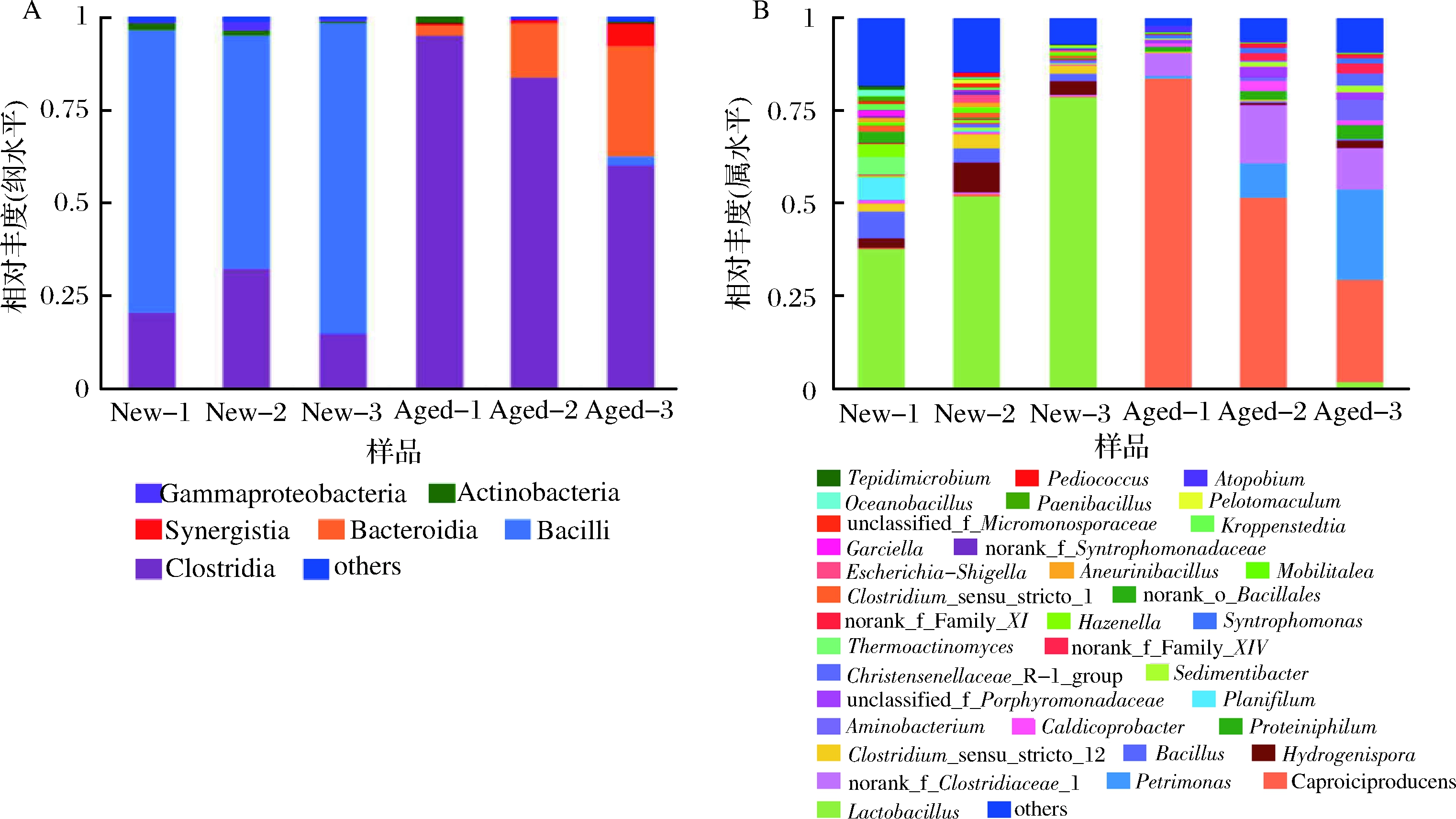
A-纲水平;B-属水平;New表示新窖泥,Aged表示老窖泥,每种窖泥做3个生物学重复,分别以-1、-2和-3表示
图2 在(A)钢水平和(B)属水平上老窖泥与新窖泥的微生物组成结构
Fig.2 The microbial community profiling in new- and aged- pit mud at class level (A) and genus level (B)
就属水平而言,新窖泥中丰度最高的属为乳杆菌属(Lactobacillus),该属在老窖泥中出现的丰度极低(低于0.1%);而老窖泥中丰度最高的属为己酸菌属(Caproicproducens)(图2,图3)。己酸菌属的代表种为韩国研究人员于2015年发表的半乳糖己酸菌(Caproiciproducens galactitolivorans),该菌在白酒酿造体系中未见。虽然己酸菌属微生物在3个典型老窖泥中丰度显示不尽相同(27%~84%),但可以确定的是,该属微生物为老窖泥中的第一高丰度属。老窖泥中丰度远高于新窖泥的其他微生物还有Petrimonas(0.7%~24%),norank_f_Clostridiaceae_1(6%~16%),Aminobacterium(0.1%~5%)和Proteiniphilum(1%~4%)4个属;而新窖泥中高于老窖泥的属为Hydrogenispora(3%~8%),Bacillus(2%~7%),Clostridium_sensu_stricto_12(0.4%~4%)和Bacillus(2%~7%)3个属(图3)。因此,从属水平分析来看,老窖泥中高丰度属排序为己酸菌属(Caproicproducens)>Petrimonas(大致与norank_f_Clostridiaceae_1相当)>Aminobacterium>Proteiniphilum。
2.3 窖泥高丰度微生物与风味物质产生的相关性分析
上述分析比较了新、老窖泥细菌在纲水平和属水平的差异,寻找出了老窖泥和新窖泥中丰度分别较高的属,那么这些属的微生物是否与发酵过程中己酸和丁酸生成相关?为从代谢产物与微生物丰度相关性探索可能产生己酸和丁酸的属,我们进行了典型相关性分析(canonical correlation analysis,CCA)。结果表明,在老窖泥中丰度较高的5个属(Caproicproducens,Petrimonas,norank_f_Clostridiaceae_1,Aminobacterium,Proteiniphilum)与己酸和丁酸生成密切相关(图4)。因此,推测主要的己酸和丁酸合成微生物可能存在于这5个属的微生物种中。

New表示新窖泥,Aged表示老窖泥,每种窖泥做3个生物学重复,分别以-1、-2和-3表示
图3 窖泥中微生物与样品对应关系
Fig.3 Correlation of microbes at genus level in pit muds and their source samples
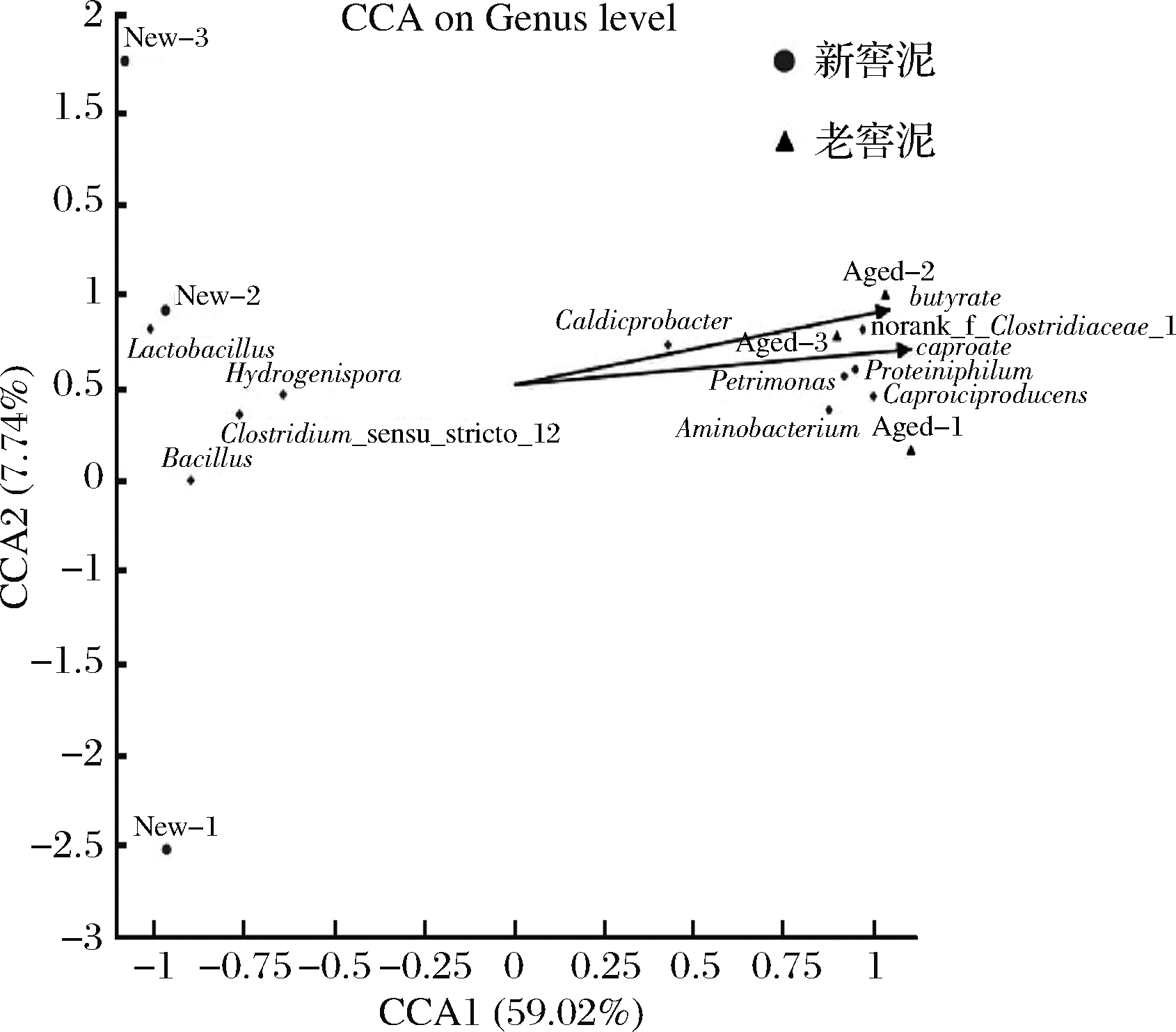
图4 窖泥微生物与发酵中风味物质(己酸和丁酸) 相关性分析
Fig.4 Correlation between microbes in pit mud and flavor components 注:本图展示了微生物种类、样本与代谢产物(己酸、丁酸) 三者的对应关系
2.4 新、老窖泥差异物种的进化分析和窖泥中主体己酸菌的判定
为进一步分析新、老窖泥差异物种与己酸及丁酸合成相关的微生物种,尤其是己酸合成微生物,我们对主要差异物种进行了进化分析。分析表明,己酸菌属中可能存在着3种己酸菌(图5,含Caproicproducens的3个分支)。我们将3种己酸菌的代表OTU(operational taxonomic units,操作分类单元,即测序中代表某种微生物的16S rRNA基因片段序列)及测出的己酸菌OTU与目前已经报道的主要己酸菌进行相似性与进化分析比较(图6),同时将各OTU的相对丰度进行了标注(图7)。结果表明,两个OTU(OTU548和OTU555)的丰度占所有己酸菌属OTU的90.7%。其中,OTU548与瘤胃菌CBP6菌株的序列同一性(identity)为99%(图6),因此,我们认为OTU548所代表的己酸菌种为与瘤胃菌CBP6同一类型的己酸菌种,该种在本研究老窖泥中的丰度为6%~75%。OTU555在老窖泥中的丰度为3%~27%,但至今尚未有OTU555代表的菌株被分离出来。OTU451代表的己酸菌属微生物种,虽然在老窖泥中丰度较低(最高为0.76%),但其代表的己酸菌属非常具有代表意义,其与已经分离得到的Ruminococcaceae bacterium CPC11菌株的16S rRNA序列同一性为99%(图6),因此我们认为OTU451代表的菌株与Ruminococcaceae bacterium CPC11为同一个种,且该菌与韩国研究人员发现并命名的半乳糖己酸菌在进化上亲缘关系最为接近(图7)。同时,我们还比较了传统己酸菌克氏梭菌在本研究样本中的丰度,其代表OTU376的丰度仅为0.12%。

图5 新老窖泥中高丰度物种在种水平的分布情况
Fig.5 The phylogenetic tree of abundant species at species level in new and old pit mud

图6 窖泥中己酸菌代表16S rRNA基因(338-806nt)OTU 与已分离典型己酸菌的序列相似性比对
Fig.6 Simility analysis for 16S rRNA gene (338-806nt) of caproate-producing bacteria OTU in pit mud and several typical caproate-producing bacteria 注:比对区域为16S rRNA基因的338~806区域; 几种已分离鉴定己酸菌16S rRNA基因在NCBI数据库中的编号分别为Ruminococcaceae Sp CBP6(KM454167),Ruminococcaceae Sp CPC11 (KM454168)和Caproiciproducens galactitolivorans(FJ805840),Clostridium kluyveri(NR_074165)和 Megasphaera elsdeni(NR_102980).
通过对己酸菌属下所有代表OTU的分析,我们得出以下结论:(1)窖泥中至少具有4种类型己酸菌,其中3种为己酸菌属微生物,在本研究中的代表OTU丰度排序为OTU548(CBP6相同种)>OTU555(未被分离鉴定)>OTU451(CPC11相同种);(2)OTU548和OTU451的代表种分别为瘤胃菌CBP6与瘤胃菌CPC11,两者均以乳酸作为主要碳源,主要代谢产物为己酸,CPC11还能合成一定量的丁酸;(3)OTU555代表的己酸菌虽然至今未能分离得到,根据进化分析,该种微生物可能仍然为产己酸微生物;(4)克氏梭菌在传统认识中虽然被认为是窖泥中的重要己酸菌,在本研究所用窖泥中也具有一定的丰度(约等于0.12%),我们推测该菌并非本研究窖泥中的主体己酸菌。本研究中的主体己酸菌是以己酸菌Caproicproducens sp.316菌株(形态见本期封面图,与文献已报道的CBP6同种)和OTU555为代表的己酸菌。
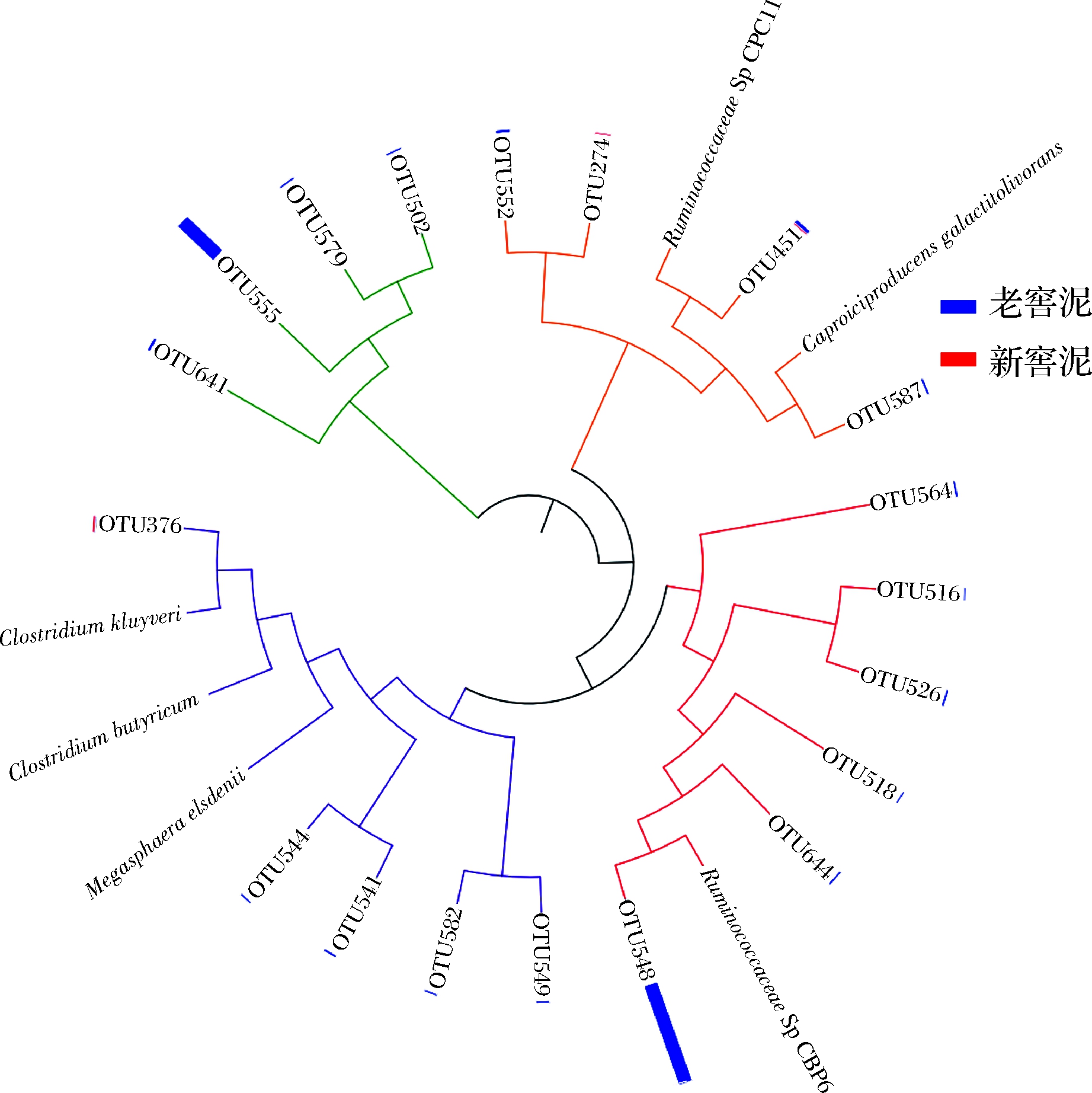
图7 新老窖泥中己酸菌OTU与已知己酸菌的 进化关系分析
Fig.7 The phylogenic tree analysis of OTU of caproate- producing bacteria in pit muds and known carpoate-producing bacteria 注:OUT旁的柱状色块表示该OTU在新、 老窖泥中的相对丰度
3 讨论与结论
人们早就认识到窖泥厌氧菌在浓香型白酒酿造中的重要作用,并试图解析窖泥微生物的结构组成,认识窖泥微生物的功能。但目前对于浓香型白酒窖泥微生物群落的研究多以差异性研究为主,如选取全国各地区酒厂、不同年份窖池以及窖池不同部位的窖泥样品,对窖泥样品中的微生物群落进行比较与分析,得到不同地区、不同窖龄、不同质量的窖泥微生物菌群结构。陶勇等通过扩增子测序分析,发现老窖泥中富含梭菌纲的微生物[9];胡晓龙等则比较了相同窖龄但窖泥质量不同的窖泥微生物菌群结构,发现梭菌纲微生物在优质窖泥中丰度更高,而在退化窖泥中丰度极低[4]。以上研究均表明梭菌纲微生物是浓香型窖泥发挥正常酿造功能所必需的微生物,也明确了己酸菌是梭菌纲下的微生物,但分析多停留在纲水平至属水平,而对于己酸菌在种水平上的区分仍然鲜有研究。本研究将新、老窖泥的微生物菌群结构组成与代谢产物(己酸、丁酸)丰度进行对比分析,认识到老窖泥中己酸菌类型的独特性与复杂性。
目前对于白酒酿造体系中的己酸菌认识逐步清晰,不同于西方蒸馏酒己酸来源于酵母的特征,我国基于泥窖发酵体系中的己酸菌主要来源于窖泥。从营养型角度而言,目前发现的己酸菌类型包括乙醇营养型,如克氏梭菌;乳酸营养型,如己酸菌属下的己酸菌菌株(已经分离鉴定的是CBP6菌株代表的种与CPC11菌株代表的种)[16]。研究表明,窖泥中的主体己酸菌为己酸菌属微生物,而非传统使用的乙醇营养型己酸菌(如克氏梭菌)。
近年来随着极端高温天气的频繁出现,乳酸菌与乙酸菌的繁殖更难以被控制,乙酸乙酯与乳酸乙酯超标已经成为困扰酿酒行业的共性问题。乳酸乙酯和乙酸乙酯在酒体中含量超标,与己酸乙酯的量比关系倒挂,导致成品酒酒体单薄、口感较涩,造成重大经济损失。从微生物学生态学角度而言,窖泥菌群结构紊乱可能是造成酯类不协调的重要原因,窖泥菌群结构紊乱将引起己酸菌丰度失调,最终引起酒体酯类比例失衡。因此,认识己酸菌的种类对于构建针对性策略,预防窖泥菌群失调,维持窖泥菌群结构稳定就有重要意义。
实验对新老窖泥中微生物组成结构,以及对应窖池的丁酸和己酸产生情况分析,初步明确了窖泥中主体的己酸菌为己酸菌属微生物,而非传统认为的克氏棱菌。根据是否使用窖泥,我国白酒可以分为两类,即有泥酿造与无泥酿造。鉴于有泥酿造工艺类型多种多样,如浓香型采用全泥窖工艺,酱香型与芝麻香型采用泥底砖壁工艺,那么不同地区、不同酿造工艺下,己酸菌种类是否相同?由于对己酸菌种类的认识与人工窖泥制作、窖泥养护、窖泥防退化息息相关,对窖泥中己酸菌种类的认识值得进行更为深入的研究。
参考文献
[1] 任聪,杜海,徐岩. 中国传统发酵食品微生物组研究进展[J]. 微生物学报, 2017,57(6): 885-898.
[2] 熊亚,陈强,唐玉明.等. 泸州老窖不同窖龄窖泥中乳酸菌多样性PCR-DGGE分析[J]. 应用与环境生物学报, 2013,19(6): 1 020-1 024.
[3] 叶光斌,罗惠波,杨晓东.等. 基于免培养法研究泸州地区浓香型白酒窖泥原核微生物群落结构[J]. 食品科学, 2013,34(17): 176-181.
[4] HU X, DU H, REN C, et al. Illuminating anaerobic microbial community and co-occurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J]. Applied and Environmental Microbiology, 2016, 82(8):2 506-2 515
[5] ANGENENT L T, RICHTER H, BUCKEL W, et al. Chain elongation with reactor microbiomes: Open-culture biotechnology to produce biochemicals[J]. Environmental Science & Technology, 2016, 50(6): 2 796-2 810.
[6] WEIMER P J, KOHN R A. Impacts of ruminal microorganisms on the production of fuels: how can we intercede from the outside?[J]. Applied Microbiology and Biotechnology, 2016, 100(8): 3 389-3 398.
[7] JEON B S, CHOI O, UM Y, et al. Production of medium-chain carboxylic acids by Megasphaera sp. MH with supplemental electron acceptors[J]. Biotechnology for Biofuels, 2016, 9(1): 129-172.
[8] HU X L, DU H, XU Y. Identification and quantification of the caproic acid-producing bacterium Clostridium kluyveri in the fermentation of pit mud used for Chinese strong-aroma type liquor production[J]. International Journal of Food Microbiology, 2015, 214(2): 116-122.
[9] TAO Y, LI J B, RUI J P, et al. Prokaryotic communities in pit mud from different-aged cellars used for the production of Chinese strong-flavor liquor[J]. Applied and Environmental Microbiology, 2014,80(7):2 254-2 260.
[10] WEIMER P J, MOEN G N. Quantitative analysis of growth and volatile fatty acid production by the anaerobic ruminal bacterium Megasphaera elsdenii T81[J]. Applied Microbiology and Biotechnology, 2013, 97(9): 4 075-4 081.
[11] RAMI -PUJOL S, GANIGUÉR, BA
-PUJOL S, GANIGUÉR, BA ERAS L, et al. Incubation at 25℃ prevents acid crash and enhances alcohol production in Clostridium carboxidivorans P7[J]. Bioresource Technology, 2015, 192: 296-303.
ERAS L, et al. Incubation at 25℃ prevents acid crash and enhances alcohol production in Clostridium carboxidivorans P7[J]. Bioresource Technology, 2015, 192: 296-303.
[12] KIM B C, JEON B S, KIM S, et al. Caproiciproducens galactitolivorans gen. nov., sp. nov., a bacterium capable of producing caproic acid from galactitol, isolated from a wastewater treatment plant[J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(12): 4 902-4 908.
[13] WALLACE R J, MCKAIN N, MCEWAN N R, et al. Eubacterium pyruvativorans sp. nov., a novel non-saccharolytic anaerobe from the rumen that ferments pyruvate and amino acids, forms caproate and utilizes acetate and propionate[J]. International Journal of Systematic and Evolutionary Microbiology, 2003, 53(4): 965-970.
[14] 薛堂荣,陈昭蓉,卢世珩.等. 己酸菌W_1的分离特性及产酸条件的研究[J]. 食品与发酵工业, 1988,14(4): 1-6.
[15] 施安辉. 己酸菌C_1的筛选及应用[J]. 上海调味品, 1982(2): 15-19.
[16] ZHU X Y, ZHOU Y, WANG Y, et al. Production of high-concentration n-caproic acid from lactate through fermentation using a newly isolated Ruminococcaceae bacterium CPB6[J]. Biotechnology for Biofuels, 2017, 10(1): 102-114.